随着我国经济发展,居民饮食结构随之改变,由高盐饮食因素引起的高血压与相关心血管疾病在我国发病率极高[1]。肠道菌群作为人体生态系统的重要组成部分,其对于维持人体生理功能方面具有非常重要的作用[2]。高盐饮食会导致体内钠潴留,显著提升高血压、心脑血管病和胃癌等疾病发病率,同时还对肠道菌群存在一定不良影响[3-4]。大量研究报道在临床与动物模型中,高盐饮食会造成机体炎症水平增加、肠道免疫屏障破坏和上调高血压特征菌群等有害菌丰度等不良影响[5-6]。
焦谷氨酸广泛存在于动植物界[7],在脑脊液、血液、组织液和多种器官中以游离形式存在,参与合成神经降压素、促甲状腺素释放激素等物质[8],对神经功能改变、肿瘤的形成和转移具有预防作用,并且是体内许多生物活性物质的结构核心[9]。研究表明膳食中摄入一定量焦谷氨酸可以显著增加乙酰胆碱受体数量、增强大脑记忆力和认知能力[10],还可以通过控制胰岛素抵抗起到抗糖尿病作用[11]。肠道菌群与人类健康关系的研究越来越深入,但目前国内外研究学者对焦谷氨酸对肠道菌群的作用仍少有探究。因此本实验通过探究焦谷氨酸对高盐饮食小鼠肠道健康和肠道微生物菌群的影响,丰富对焦谷氨酸潜在功能的了解认知,为焦谷氨酸这一原料在功能性食品领域的应用研究提供实验依据。
1 材料与方法
1.1 材料与仪器
BALB/c健康雄性SPF级小鼠45只,4周龄,体重17.4~20.8 g,北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016—0006。实验中对实验动物的处置均遵守《关于善待实验动物的指导性意见》规定。
标准饲料(D12450B),中国北京科奥协力饲料有限公司;L-焦谷氨酸、NaCl(均为分析纯),国药集团上海化学试剂有限公司;IL-1、IL-6、TNF-α、ELISA试剂盒,南京建成生物工程研究所。
BX60光学显微镜,日本奥林巴斯公司;3K15高速冷冻离心机,德国Sigma 公司;XS105电子分析天平,梅特勒-托利多仪器有限公司;Varioskan Flash全波长多功能酶标仪,美国Thermo 公司。
1.2 试验方法
1.2.1 实验小鼠分组
选择4周龄健康雄性BALB/c小鼠45只,在实验动物房环境[室内温度(22±2)℃,相对湿度(30±2)%],循环光照条件12 h光照/12 h黑暗)下适应性饲养7 d,适应性饲养期间自由进食饮水,第8天早晨停食,5 h后称体重,按体重随机分为3组,每组15只:Con组(空白对照组,正常饮食),NaCl组(高盐对照组,灌胃NaCl 100 mg/(kg BW·d),PCA-Na组(焦谷氨酸组,灌胃焦谷氨酸21 mg/(kg BW·d)[9,11],灌胃NaCl 100 mg/(kg BW·d),各组间小鼠体重无显著差异(P>0.05)。连续喂养5周,试验期间动物自由摄食、饮水。
1.2.2 样品采集
乙醚麻醉后,75%(体积分数)酒精处理小鼠身体并转移至超净工作台内解剖,酒精棉球擦净小鼠腹部消毒后打开腹腔完整分离肠道,取小鼠空肠2.5 cm置于2 mL 离心管中,保存于-80 ℃冰箱,取盲肠、直肠内容物于灭菌后的冻存管中,液氮速冻保存于-80 ℃冰箱。
1.2.3 小肠苏木素-伊红(hematoxylin-eosin staining,HE)染色
取出用10%(体积分数)中性福尔马林固定的空肠样品制成石蜡切片,随后进行HE染色,置于显微镜下进行图像采集,100倍下测量空肠绒毛高度(villus height,VH)和隐窝深度(crypt depth,CD),进行病理学分析。
1.2.4 直肠粪便中白蛋白含量
取小鼠直肠中已成型粪便,称重后加入9倍PBS溶液,3 000 r/min条件下离心20 min后分离上清液,采用小鼠白蛋白酶联免疫吸附试剂盒测定小鼠粪便中白蛋白的含量。
1.2.5 小肠细胞因子检测
取小鼠空肠组织称重后加入9倍PBS溶液,3 000 r/min条件下离心20 min后分离上清液,参考ELISA试剂盒说明书,检测小肠IL-1β、IL-6和TNF-α的含量。
1.2.6 小鼠盲肠内容物菌群16S rDNA高通量测序
小鼠盲肠内容物样品从-80 ℃冰箱取出后放入干冰内寄送到奥维森基因科技有限公司,进行如下实验过程:首先利用粪便DNA基因组提取试剂盒从小鼠盲肠内容物中提取总基因组DNA,采用琼脂糖凝胶电泳检测合格后,选择16S rDNA基因的V3~V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增产物通过琼脂糖凝胶电泳进行检测,用AxyPrep DNA凝胶回收试剂盒切胶回收目标片段扩增产物。参照琼脂糖凝胶电泳定量结果,将PCR扩增回收产物进行荧光定量,根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。构建MiSeq PE测序文库后采用Illumina MiSeq平台测序。通过QIIME软件在0.97相似度下对样本进行运算分类单元(operational taxonomic unit,OTU)聚类和物种注释。
1.3 数据统计与分析
使用SPSS 25.0统计软件中的单因素方差分析对数据进行统计分析,所有数据均以“平均值±标准差”表示,P<0.05表示各个组数据差异显著。
2 结果与分析
2.1 HE染色观察焦谷氨酸对高盐饮食小鼠小肠形态的影响
本研究中各组小鼠小肠病理学染色结果如图1所示。空白对照组小鼠小肠组织形态结构正常,未见水肿、坏死、炎性细胞浸润等病理变化,肠绒毛上皮完整,小肠腺腺体排列整齐。高盐对照组小鼠小肠组织黏膜层内部分血管扩张,肠绒毛上皮细胞少量水肿、细胞肿胀。焦谷氨酸组小鼠小肠组织形态结构基本正常,肠绒毛上皮完整,小肠腺腺体排列整齐。小肠是动物体消化、吸收营养物质的主要场所之一,绒毛上皮细胞可以将肠腔中的糖类、氨基酸、无机盐等物质吸收进入体液循环,供动物体利用[12]。各组小鼠小肠绒毛长度及隐窝深度如表1所示。高盐对照组小鼠小肠绒毛高度下降(P<0.05),表明过多的Na+摄入会在一定程度上损害小肠结构,而焦谷氨酸可以改善高钠摄入引起的肠道绒毛损伤,维持肠道结构形态。
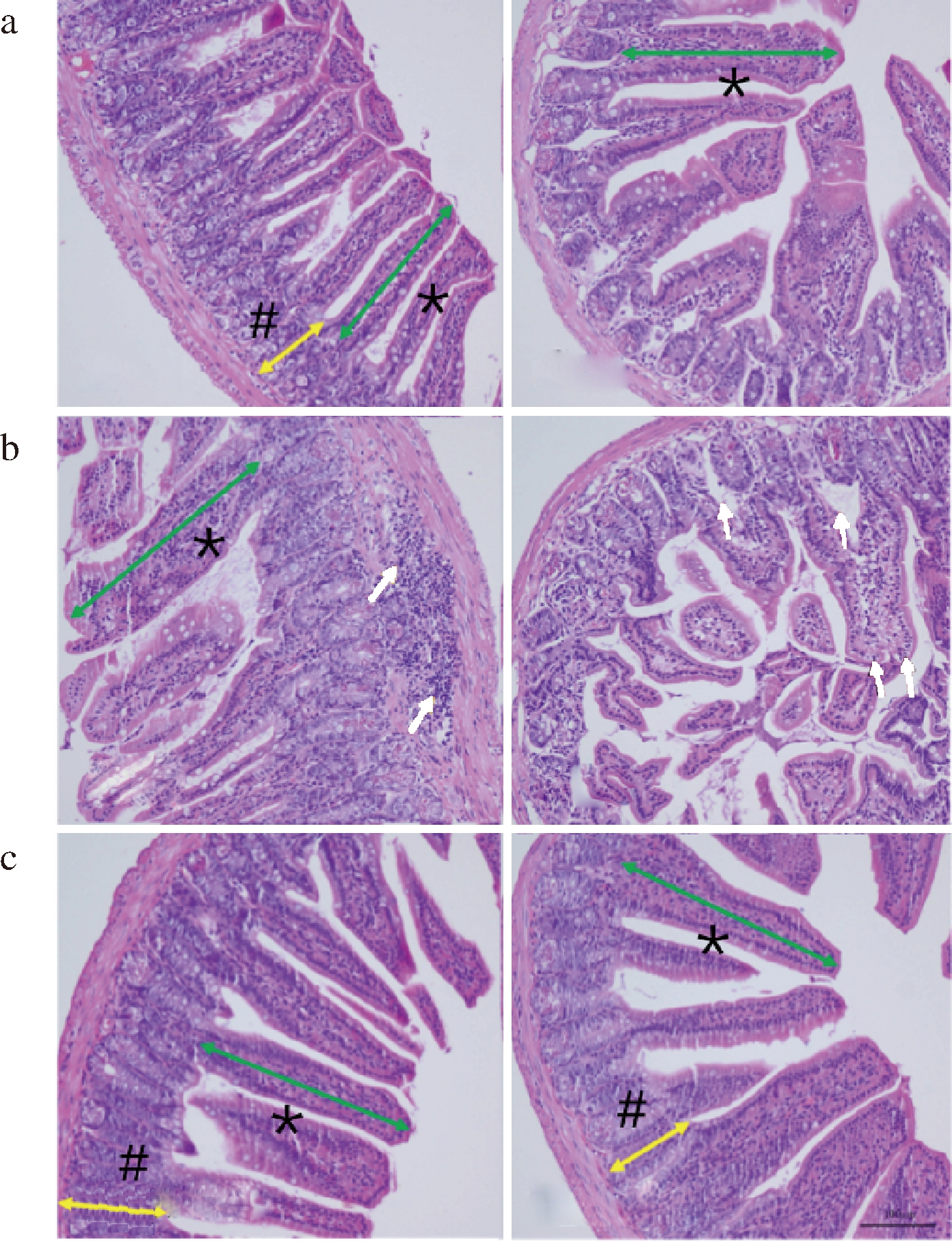
a-对照组;b-高盐对照组;c-焦谷氨酸组
图1 焦谷氨酸对高盐饮食小鼠小肠形态的影响
Fig.1 Effect of pyroglutamic acid on morphology of small intestine in mice with high salt diet
注:照片放大倍数为200倍,箭头所指为组织异常部位,*和#标记的箭头分别为典型绒毛和隐窝测量位置
表1 焦谷氨酸对高盐饮食小鼠小肠绒毛高度和隐窝深度的影响 单位:μm
Table 1 Effect of pyroglutamic acid on the height of intestinal villi and crypt depth in mice with high salt diet
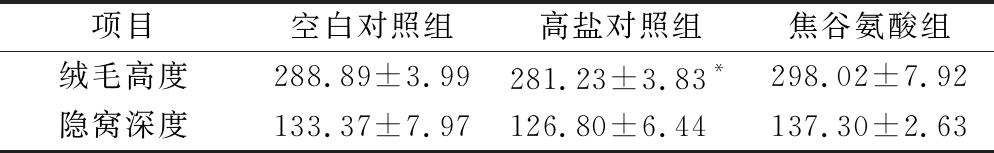
注:*表示与空白对照组相比差异显著(P<0.05)(下同)
项目空白对照组高盐对照组焦谷氨酸组绒毛高度288.89±3.99281.23±3.83*298.02±7.92隐窝深度133.37±7.97126.80±6.44137.30±2.63
2.2 高盐饮食小鼠粪便中白蛋白含量的影响
白蛋白是血浆内最主要的蛋白质,参与营养和维持机体渗透压功能。通过测定白蛋白从血液渗漏到肠黏膜上皮间质或肠腔的水平,可以从侧面评价肠黏膜通透性,肠腔中白蛋白渗漏量可以作为一种十分便捷的方法表征肠道屏障通透性功能的改变。本研究中各组小鼠小肠粪便中白蛋白的含量如图2所示。
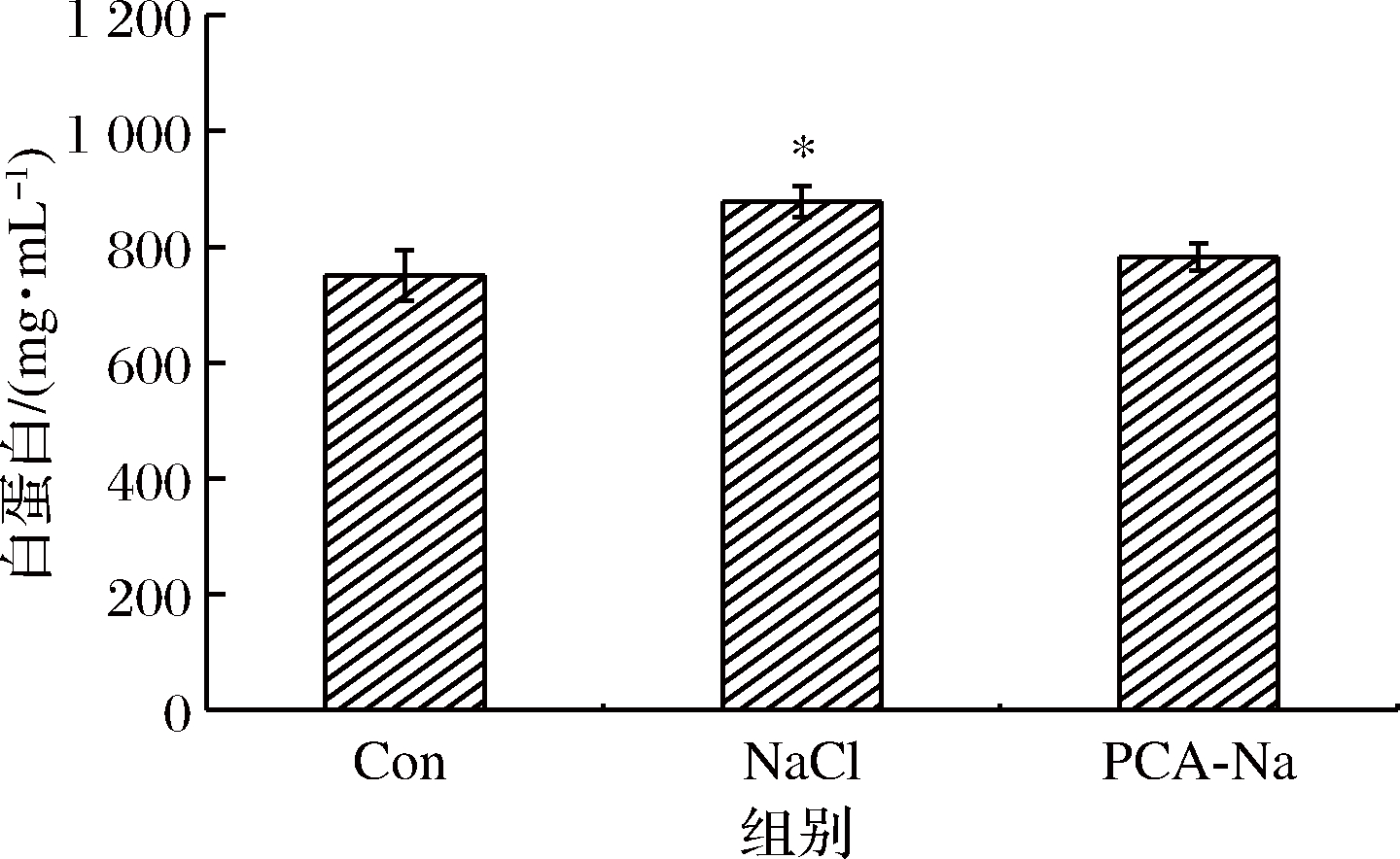
图2 高盐饮食小鼠粪便中白蛋白含量的影响
Fig.2 Effect of high-salt diet on the content of albumin in the feces of mice
注:*表示与空白对照组差异显著(P<0.05)(下同)
与空白对照组相比,高盐对照组小鼠粪便中白蛋白含量显著升高(P<0.05),焦谷氨酸组与空白对照组无显著差异(P>0.05)。肠道免疫系统的紊乱基本都伴有肠道屏障通透性功能的变化,本研究表明,高盐饮食可会引起肠道通透性功能损伤,焦谷氨酸可以抵抗大量Na+摄入引起的肠道功能性改变,维持机体健康。
2.3 焦谷氨酸对高盐饮食小鼠小肠中IL-1β、IL-6和TNF-α含量的影响
本研究中焦谷氨酸对高盐对照组小鼠小肠中IL-1β、IL-6和TNF-α含量影响测定结果如图3所示。与空白对照组相比,高盐对照组小鼠小肠组织中IL-1β、IL-6和TNF-α含量(P<0.05);焦谷氨酸组小鼠小肠组织中IL-1β、IL-6和TNF-α含量与空白对照组无显著差异(P>0.05)。
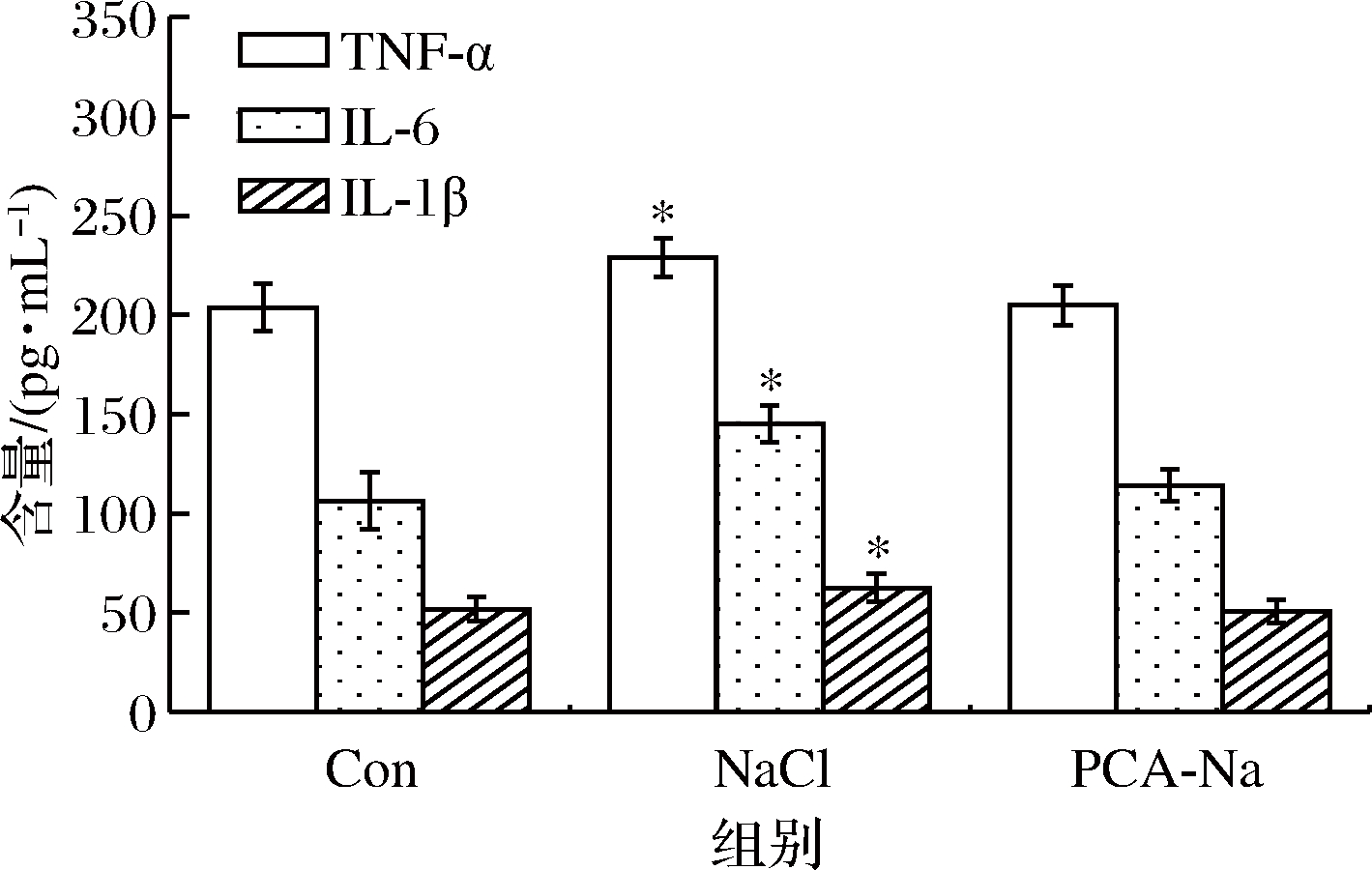
图3 焦谷氨酸对高盐饮食小鼠小肠中IL-1、IL-6和TNF-α含量的影响
Fig.3 Effects of pyroglutamic acid on the content of IL-1, IL-6 and TNF-α in the small intestine of mice with high salt diet
结果表明,单独摄入大量Na+时会损伤肠黏膜屏障功能,肠组织受病原微生物入侵,激活炎症反应,使IL-1β、IL-6及TNF-α 3种炎性细胞因子的表达增加。焦谷氨酸对肠免疫功能具有显著影响,抑制高盐饮食引起的小鼠小肠中炎症介质的表达[13],这与GANG等[9]研究结果一致,焦谷氨酸可以一定程度的抑制肠道炎症反应,改善高盐饮食小鼠肠道健康。
2.4 焦谷氨酸对高盐饮食小鼠盲肠中肠道菌群α-多样性的影响
α-多样性是指通过对单个样品的多样性分析反映微生物群落的丰富度和均匀度[14]。本研究中采用物种饱和度曲线和α-多样性指数(Observed species、Chao1、Shannon和Simpson指数)评估各样本的α-多样性。物种饱和度曲线如图4所示。

图4 物种饱和度曲线
Fig.4 Rank-Abundance plotted against the total number of OTUs
物种饱和度曲线是分析微生物多样性的一种常见方法,可以从物种丰富度和物种均匀度两方面体现α-多样性[15]。由图4可知,在水平方向上,曲线宽度正向反映物种丰富度;在曲线形状上,曲线越平滑表示物种均匀度越好,空白对照组丰富度相对较高,各样品曲线平缓,物种分布均匀。具体数值如表2所示。
表2 小鼠肠道菌群 α-多样性指数
Table 2 Mice intestinal flora α-diversity index
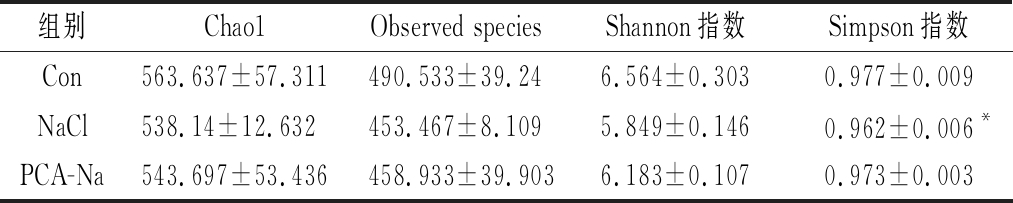
组别Chao1Observed speciesShannon指数Simpson指数Con563.637±57.311490.533±39.246.564±0.3030.977±0.009NaCl538.14±12.632453.467±8.1095.849±0.1460.962±0.006*PCA-Na543.697±53.436458.933±39.9036.183±0.1070.973±0.003
Observed species与Chao1指数衡量物种丰度,数值越大越丰富;Shannon与Simpson指数可从丰富度和均匀度两方面评价肠道菌群多样性,数值越大说明该样品中物种越丰富、分配越均匀。如表2所示,高盐饮食会使小鼠肠道菌群丰富度和均匀度略有降低,焦谷氨酸则可缓解高盐饮食对小鼠肠道菌群丰富度和均匀度的影响。
2.5 小鼠盲肠中肠道菌群β-多样性Unifrac weighted分析
Unifrac分析是利用各样品间的进化信息来比较在特定的进化谱系中是否有显著的微生物群落差异[15]。UniFrac分析中,只考虑序列是否在群落中出现,不考虑序列的丰度。Unifrac weighted分析方法,就是在UniFrac分析的基础上,将序列的丰度纳入考虑,区分物种丰度的差别,更进一步的探究样品间不同谱系上发生的变异。如图5所示,本研究各组小鼠肠道菌群物种及丰度与空白组发生差异,相同Na+浓度条件下,焦谷氨酸组的肠道菌群结构有向空白对照组小鼠肠道菌群结构模式调整的趋势。
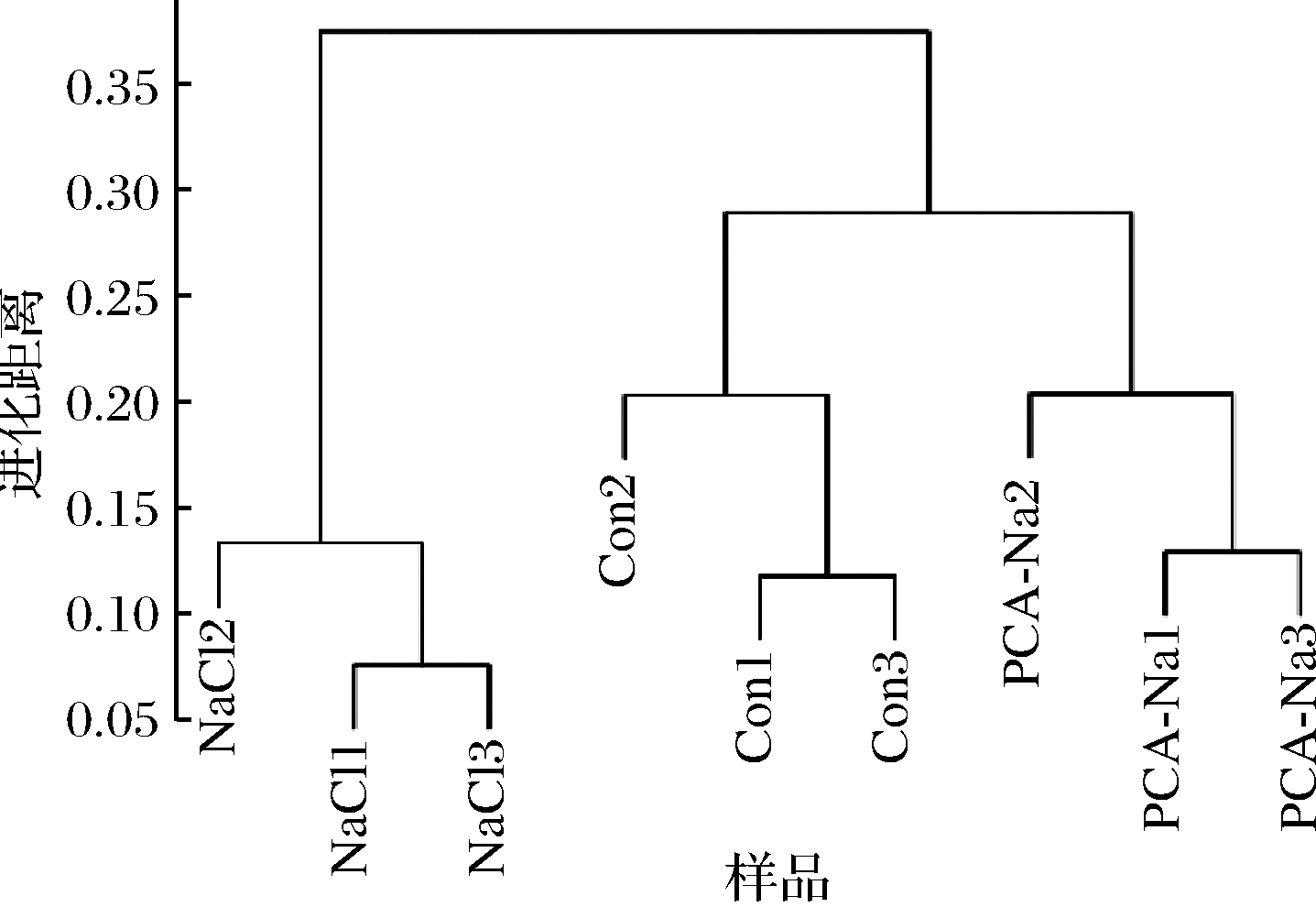
图5 聚类树状分析图
Fig.5 Unifrac weighted analysis of intestinal flora
综合α-多样性和聚类树状分析可知,本研究测序数据量足够,可反映样品中绝大多数的微生物物种信息。本试验结果说明Na+对小鼠肠道菌群物种及丰度均有一定影响,而且焦谷氨酸可以缓解Na+对肠道菌群结构的干扰,使小鼠肠道菌群趋向正常小鼠发展,焦谷氨酸对小鼠肠道菌群并无显著不良影响。
2.6 试验小鼠肠道菌群门水平组成分析
如图6所示,基于门分类水平上各组小鼠肠道菌群物种组成和差异性分析。小鼠肠道菌群于门水平主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和脱铁杆菌门(Deferribacteres)组成。与空白对照组相比,高盐对照组厚壁菌门丰度显著降低和拟杆菌门丰度显著增加(P<0.05),而焦谷氨酸组中厚壁菌门和拟杆菌门含量几乎无变化;焦谷氨酸组和高盐对照组中脱铁杆菌门丰度呈较低水平;高盐对照组放线菌门丰度降低,而焦谷氨酸组放线菌门丰度升高。3组比较,发现焦谷氨酸干预后,高盐饮食小鼠肠道菌群有向正常小鼠发展的趋势,说明焦谷氨酸对小鼠肠道菌群有良性作用。如图7所示,拟杆菌门与厚壁菌门比值(B/F)发生变化,其中高盐对照组较空白对照组B/F值显著升高(P<0.05),而焦谷氨酸组较空白对照组B/F值无明显差异。此外,各组均能保持变形菌门、软壁菌门(Tenericutes)和蓝细菌门(Cyanobacteria)的相对丰度。
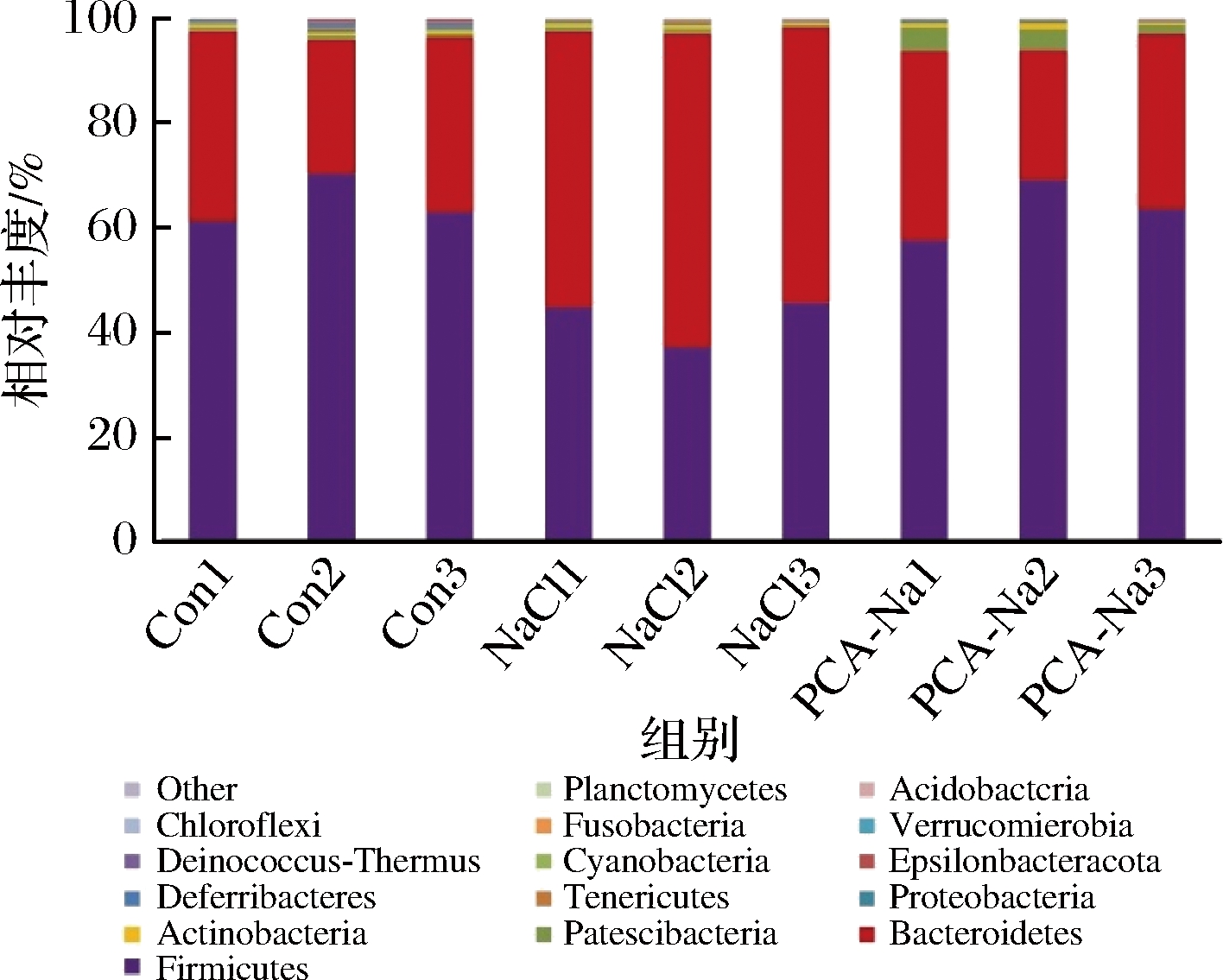
图6 小鼠肠道菌群门水平物种组成分析
Fig.6 Mice intestinal flora species composition analysis on Phylum level
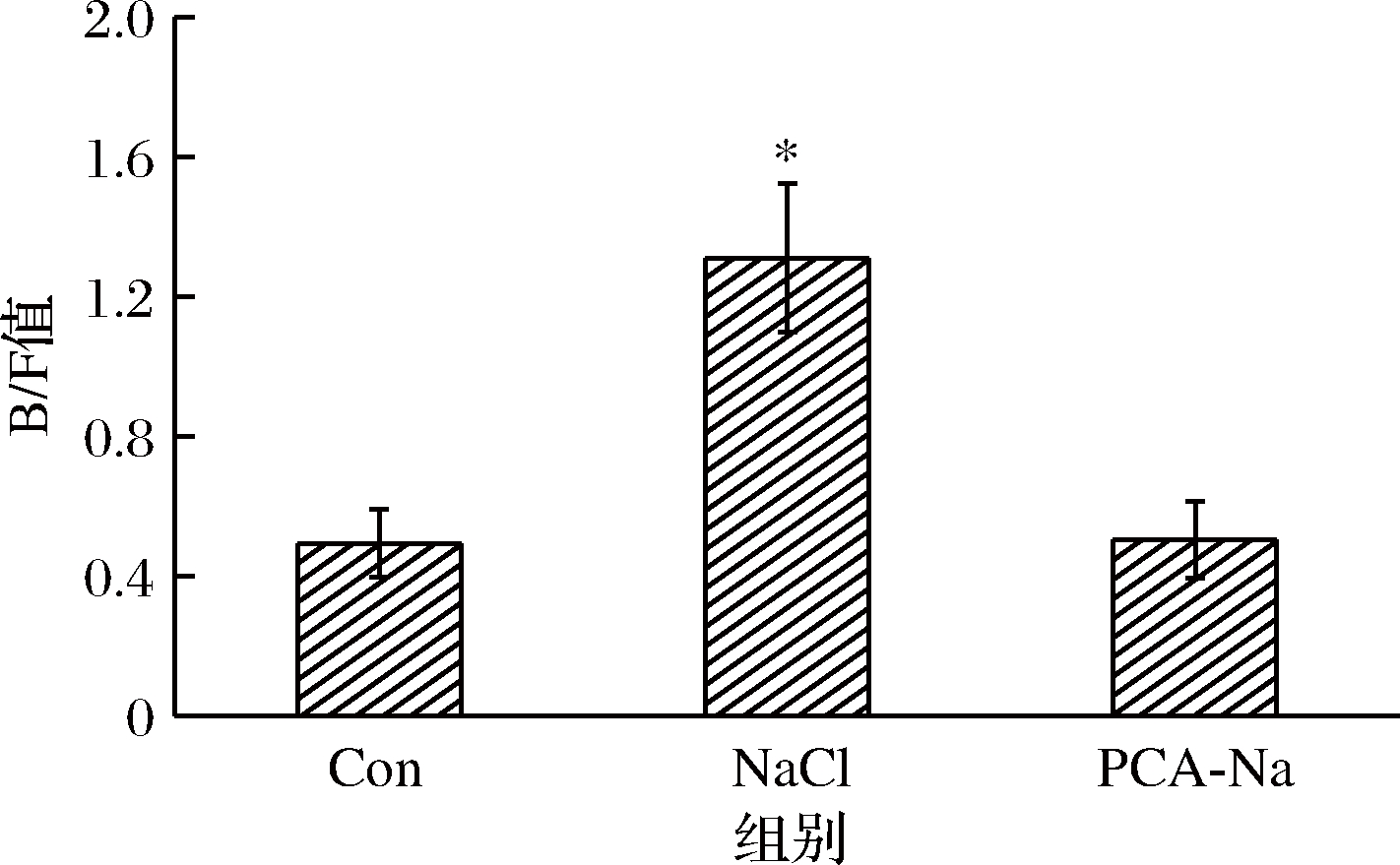
图7 拟杆菌门与厚壁菌门比值(B/F)
Fig.7 Variation of the ratio of Bacteroidetes/Firmicutes
2.7 试验小鼠肠道菌群属水平组成分析
如图8所示,在属水平上,选取前40个优势菌群构建柱形图。由聚类结果可知,与空白组比较,焦谷氨酸、NaCl组均能维持Family XIII中(AD3011 group、UCG-001、brachy group、nodatum group)成员、毛螺旋菌科中(Blautia、GCA-900066575、Lachnoclostridium、Lachnospiraceae NK4A136 group)成员的相对丰度恒定。
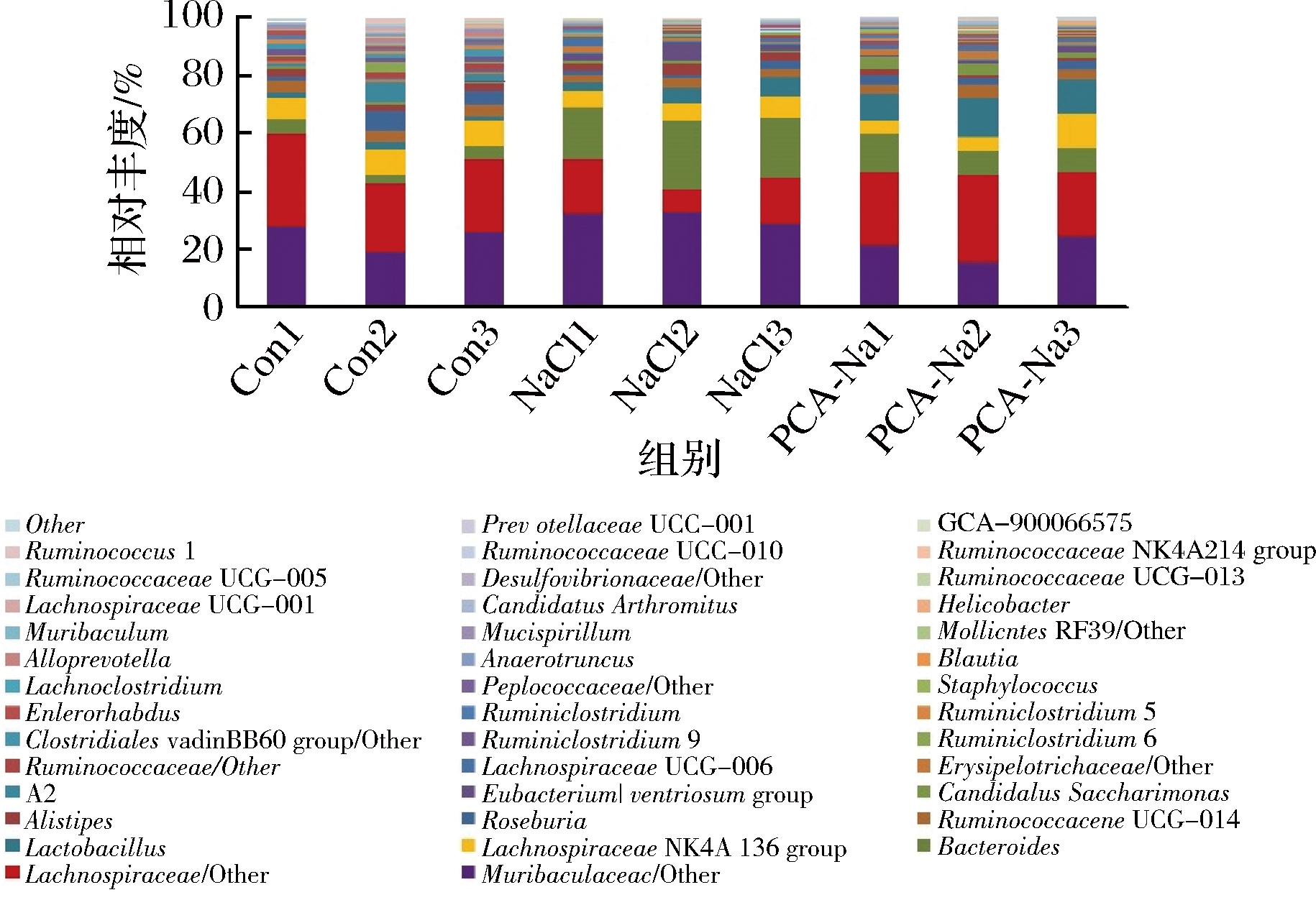
图8 小鼠肠道菌群属水平物种组成分析
Fig.8 Mice intestinal flora species composition analysis on Genus level
如表3所示,与空白组相比,高盐饮食小鼠肠道组中分节丝状菌(Candidatus Arthromitus)、毛球菌科中A2、Roseburia和瘤胃球菌科中Ruminococcaceae NK4A214 group、Anaerotruncus等相对丰度水平降低且差异显著(P<0.05),拟杆菌属(Bacteroides)、另枝菌属(Alistipes)和链球菌属(Streptococcus)等相对丰度显著提高(P<0.05);焦谷氨酸组中分节丝状菌、短杆菌属(Brevibacterium)和乳酸杆菌属(Lactobacillus)等益生菌的相对丰度显著提高(P<0.05),另枝菌属等有害菌的相对丰度降低(P<0.05)。同时焦谷氨酸组其中普雷沃氏菌科UCG-001属和链球菌属保持稳定与空白组丰度接近无显著差异(P>0.05)。
3 讨论
长期高盐饮食会引起机体肠道渗透压紊乱,同时诱导肠细胞激活p38/cFos和Erk1/2/STAT6等信号通路[16],导致巨噬细胞中促炎细胞因子升高,抗炎因子与细胞内噬相关因子降低,最终表现为肠道损伤和肠道炎症[17]。高盐饮食还会造成与消化酶及胰腺分泌相关蛋白的丰度降低,影响小鼠消化吸收功能,使小鼠生长发育迟缓[18]。焦谷氨酸已被证明可以预防神经性病变、抑制炎症反应和肿瘤的形成及转移[3]。本研究发现,焦谷氨酸干预可显著降低高盐饮食小鼠模型的肠道组织损伤和肠黏膜屏障损伤,显著提高肠道抗炎症能力。高盐饮食小鼠肠道在焦谷氨酸干预下,健康状况得到明显改善,有研究表明,焦谷氨酸可以阻断葡萄糖受体介导的细胞内离子超载及其引起的联级反应[19]。本研究结果显示焦谷氨酸对小鼠肠道具有一定保护作用,可能通过调节肠道菌群来发挥作用。
表3 小鼠肠道菌群属水平物种组成相对丰度
Table 3 Mice intestinal flora relative abundance on Genus level
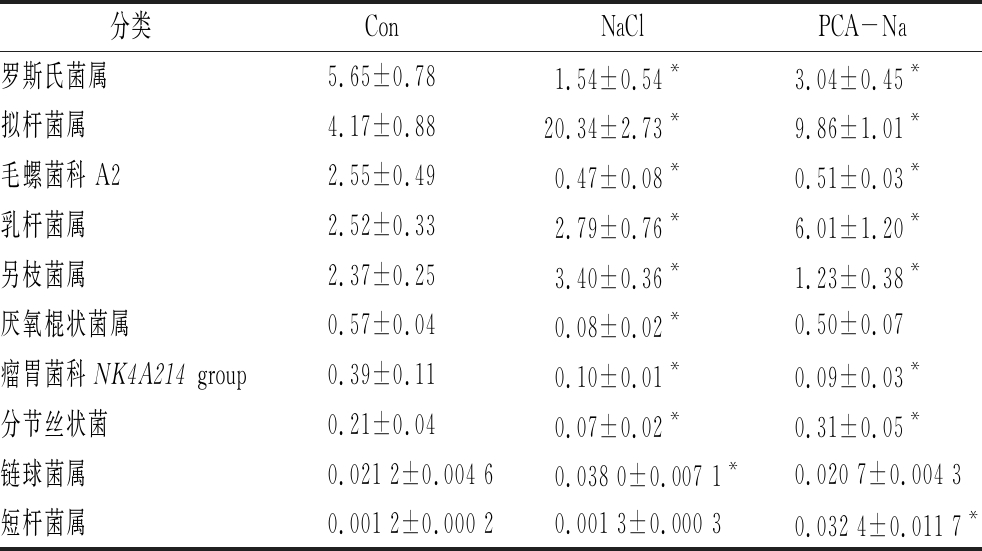
分类ConNaClPCA-Na罗斯氏菌属5.65±0.781.54±0.54*3.04±0.45*拟杆菌属4.17±0.8820.34±2.73*9.86±1.01*毛螺菌科 A22.55±0.490.47±0.08*0.51±0.03*乳杆菌属2.52±0.332.79±0.76*6.01±1.20*另枝菌属2.37±0.253.40±0.36*1.23±0.38*厌氧棍状菌属0.57±0.040.08±0.02*0.50±0.07瘤胃菌科NK4A214 group0.39±0.110.10±0.01*0.09±0.03*分节丝状菌0.21±0.040.07±0.02*0.31±0.05*链球菌属0.021 2±0.004 60.038 0±0.007 1*0.020 7±0.004 3短杆菌属0.001 2±0.000 20.001 3±0.000 30.032 4±0.011 7*
目前研究发现,肠道菌群微生态与代谢性疾病、免疫性疾病和精神性疾病等多种疾病都存在一定联系[20]。焦谷氨酸及其类似物俱被证明具有杀虫、抗菌和抑菌等作用,具有抗HIV-1、HCV活性,能抑制大肠杆菌等革兰氏阴性菌生长[21],但目前研究主要针对与焦谷氨酸生产条件优化及其复杂化合物的合成。用使小鼠肠道中拟杆菌门与厚壁菌门比值降低[22],本研究中高盐饮食小鼠肠道中拟杆菌门与厚壁菌门比值显著降低,经过焦谷氨酸干预后比值显著上升,小鼠肠道菌群结构受到一定调节作用。拟杆菌门和厚壁菌门与机体的营养代谢有着密切关系,能促进宿主体内多糖代谢,加快能量的吸收、转化和储存[23]。有研究表明,高盐饮食会使革兰氏阴性菌等致病菌相对含量增加,其代谢产生的脂多糖会堆积在肠道中,破坏肠道上皮细胞之间紧密连接蛋白,随后进入血液循环对肝脏等器官造成二次伤害[24]。本研究发现,高盐模型小鼠的肠道中拟杆菌属等革兰氏阴性菌水平显著升高,焦谷氨酸可以维持肠道中大多数革兰氏阴性菌及其他致病菌丰度与正常小鼠基本一致,一定程度缓解高盐饮食对小鼠肠道菌群结构造成的不良影响。分节丝状菌是一种革兰氏阳性菌,主要定殖在回肠末端上皮细胞表面,与肠道黏膜结构稳定性密切相关[25],在防御病原微生物感染和诱发自身免疫性疾病发生发展等方面发挥重要作用[26]。本研究结果表明,高盐饮食会降低小鼠肠道内分节丝状菌数量,而焦谷氨酸的摄入可以显著提高其丰度,降低肠道炎症反应,维持黏膜健康。此外,益生菌在肠道内具有调节机体免疫、促进肠上皮细胞的修复和再生和抗过敏等功能[27]。在本研究中,焦谷氨酸摄入后可以显著提高双歧杆菌、乳酸杆菌等益生菌相对丰度,抵抗高盐饮食导致的益生菌丰度下降,改善宿主肠道菌群结构。
总之,本研究不仅验证了高盐饮食对小鼠健康存在一定危害,同时证明了焦谷氨酸能够抵抗和缓解由摄入过量Na+对小鼠肠道健康的影响,同时对肠道菌群丰度和结构有一定调整作用,可提高有益菌相对丰度,降低高血压特征菌群及有害菌丰度等影响,促进肠道菌群良性发展。为焦谷氨酸或作为益生物质用以调控肠稳态提供了一些科学依据。
[1] XU A, MA J X, GUO X L, et al.Association of a province-wide intervention with salt intake and hypertension in Shandong province, China, 2 011-2016[J].JAMA Internal Medicine, 2020, 180(6):877-886.
[2] 陈卫, 田培郡, 张程程, 等.肠道菌群与人体健康的研究热点与进展[J].中国食品学报, 2017, 17(2):1-9.
CHEN W, TIAN P J, ZHANG C C, et al.New progress of research on gut microbiota and human health[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(2):1-9.
[3] ZHAO X, YANG X X, ZHANG X L, et al.Dietary salt intake and coronary atherosclerosis in patients with prehypertension[J].Journal of Clinical Hypertension (Greenwich), 2014, 16(8):575-580.
[4] YAN X F, JIN J J, SU X H, et al.Intestinal flora modulates blood pressure by regulating the synthesis of intestinal-derived corticosterone in high salt-induced hypertension[J].Circulation Research, 2020, 126(7):839-853.
[5] FARHANA A K, KARINA A.Maternal elevated salt consumption and the development of autism spectrum disorder in the offspring[J].Journal of Neuroinflammation, 2019, 16(1):265.
[6] BAI J, YU X J, LIU K L, et al.Tert-butylhydroquinone attenuates oxidative stress and inflammation in hypothalamic paraventricular nucleus in high salt-induced hypertension[J].Toxicolgy Letters, 2017, 281:1-9.
[7] OMBRETTA M, SIMONA F, LUIGI M.Organic acids profile in tomato juice by HPLC with uv detection[J].Journal of Food Quality, 2007, 30(2):253-266.
[8] MIROSLAVA ![]() SHERIF T S H, HAROON K, et al.A multi-biochemical and in silico study on anti-enzymatic actions of pyroglutamic acid against PDE-5, ACE, and urease using various analytical techniques:Unexplored pharmacological properties and cytotoxicity evaluation[J].Biomolecules,2019,9(9):392.
SHERIF T S H, HAROON K, et al.A multi-biochemical and in silico study on anti-enzymatic actions of pyroglutamic acid against PDE-5, ACE, and urease using various analytical techniques:Unexplored pharmacological properties and cytotoxicity evaluation[J].Biomolecules,2019,9(9):392.
[9] GANG F L, ZHU F, LI X T, et al.Synthesis and bioactivities evaluation of l-pyroglutamic acid analogues from natural product lead[J].Bioorganic & Medicinal Chemistry, 2018, 26(16):4 644-4 649.
[10] YI L Z, SHI S T, WANG Y,et al.Serum metabolic profiling reveals altered metabolic pathways in patients with post-traumatic cognitive impairments[J].Scientific Reports,2016,6:21 320.
[11] YOSHINARI O, IGARASHI K.Anti-diabetic effect of pyroglutamic acid in type 2 diabetic Goto-Kakizaki rats and KK-Ay mice[J].British Journal of Nutrition, 2011, 106(7):995-1 004.
[12] FELIX S, MOLTZAU A J, RICHA B, et al.The resilience of the intestinal microbiota influences health and disease[J].Nature Reviews Microbiology, 2017, 15(10):630-638.
[13] SPRAGUE A H, KHALIL R A.Inflammatory cytokines in vascular dysfunction and vascular disease[J].Biochemical Pharmacology, 2009, 78(6):539-552.
[14] 李梦寒, 王志勇, 盛雪, 等.基于16S rRNA技术分析α-乳白蛋白对大鼠肠道菌群的影响[J].食品科学, 2020, 41(6):155-162.
LI M H, WANG Z Y, SHENG X, et al.Effect of alpha-Lactalbumin on intestinal flora in rats analyzed by 16S rRNA high-throughput sequencing[J].Food Science, 2020, 41(6):155-162.
[15] MCDONALD D, V ZQUEZ-BAEZA Y, KOSLICKI D, et al.Striped unifrac: Enabling microbiome analysis at unprecedented scale[J].Nature Methods, 2018, 15(11):847-848.
ZQUEZ-BAEZA Y, KOSLICKI D, et al.Striped unifrac: Enabling microbiome analysis at unprecedented scale[J].Nature Methods, 2018, 15(11):847-848.
[16] XIAO Z X, HU X J, ZHANG X M, et al.High salt diet accelerates the progression of murine lupus through dendritic cells via the p38 MAPK and STAT1 signaling pathways[J].Signal transduction and targeted therapy,2020,5(1):34.
[17] WU C, YOSEF N, THALHAMER T, et al.Induction of pathogenic TH17 cells by inducible salt-sensing kinase SGK1[J].Nature, 2013, 496(7 446):513-517.
[18] 黎砚书, 董一飞, 伍锡栋, 等.高盐高蛋白饮食对Dah1/SS大鼠血压、肾脏和消化道病理变化的影响[J].实验动物科学, 2014, 31(6):11-16.
LI Y S, DONG Y F, WU X D, et al.The effect of high salt and high protein diet on blood pressure and the pathological changes of kidney and gastrointestinal in Dah1/SS rats[J].Laboratory Animal Science, 2014,31(6):11-16.
[19] 李焱,高翔,王平贵, 等.以贝壳为钙源的焦谷氨酸钙抗疲劳功效研究[J].中国海洋药物, 2020, 39(3):64-70.
LI Y, GAO X, WANG P G, et al.Study on the anti-fatigue effect of calcium L-pyroglutamate with calcium derived from shell[J].Chinese Journal of Marine Drugs, 2020,39(3):64-70.
[20] FRICK J, AUTENRIETH I B.The gut microflora and its variety of roles in health and disease[J].Curr Top Microbiol Immunol, 2013, 358:273-289.
[21] HAWKINS R A, SIMPSON I A, MOKASHI A, et al.Pyroglutamate stimulates Na+-dependent glutamate transport across the blood-brain barrier[J].FEBS Letters, 2006, 580(18):4 382-4 386.
[22] WANG C, HUANG Z X, YU K Q, et al.High-salt diet has a certain impact on protein digestion and gut microbiota:A sequencing and proteome combined study[J].Frontiers in Microbiology, 2017, 8:1 838.
[23] 訾雨歌, 徐越, 肖瀛, 等.原花青素B2对D-半乳糖模型小鼠肠道菌群的影响[J].食品科学, 2019, 40(9):146-151.
ZI Y G, XU Y, XIAO Y, et al.Effect of procyanidin B2 on intestinal microorganisms in D-galactose-induced aging mouse model[J].Food Science, 2019, 40(9):146-151.
[24] 古俊, 刘金彪, 霍文哲.BBI阻断LPS对肠道上皮细胞间紧密连接蛋白的抑制作用[J].中国感染控制杂志, 2018, 17(3):185-190.
GU J, LIU J B, HUO W Z.BBI blocks LPS-mediated inhibitory effect on tight junction protein of intestinal epithelial cells[J].Chinese Journal of Infection Control, 2018, 17(3):185-190.
[25] 王宇, 尹业师, 王欣.肠道分节丝状菌(SFB)与宿主间相互作用关系研究进展[J].微生物学免疫学进展, 2011, 39(3):78-81.
WANG Y, YIN Y S, WANG X.Research progress on the interaction between intestinal segmented filamentous bacteria (SFB) and the host [J].Progress in Microbiology and Immunology, 2011, 39(3):78-81.
[26] LIAO N G, YIN Y S, SUN G C, et al.Colonization and distribution of segmented filamentous bacteria (SBF) in chicken gastrointestinal tract and their relationship with host immunity[J].FEMS Microbiology Ecology, 2012, 81(2):395-406.
[27] SANDERS M E.Probiotics and microbiota composition[J].BMC Medicine, 2016, 14(1):82.