α-酮戊二酸(α-ketoglutaric acid,α-KG)是一种重要的二元羧酸,是三羧酸(tricarboxylic acid,TCA)循环和氨基酸代谢过程中关键的中间代谢产物,能够调节细胞对碳氮源的利用速率[1-2]。α-KG广泛应用于食品、医药、农业和化妆品等工业领域,如保健剂、抗氧化剂、营养强化剂、杂环类化合物骨架和组织工程药物载体等产品的生产[3-5]。目前,α-KG的主要生产方法包括化学合成法、酶转化法以及微生物发酵法。化学合成法主要通过琥珀酸和草酸二乙酯经多步化学反应合成,但由于产品选择性低,生产过程中有毒物质的使用和副产物的形成等缺点制约了α-KG在食品、医药等领域的广泛应用[6]。酶转化法具有清洁、低污染等优势,但由于底物成本较高等条件限制,实现工业化生产仍存在较大困难[7]。近年来,微生物发酵法生产α-KG越来越受到国内外研究者的关注[8]。
微生物发酵生产α-KG已有较长的历史,研究报道,很多微生物具有积累α-KG的能力,如石蜡节杆菌(Arthrobacter paraffineus)、巨大芽胞杆菌(Bacillus megaterium)、谷氨酸棒状杆菌(Corynebacterium glutamicum)、荧光假单胞菌(Pseudomonas fluorescens)、光滑球拟酵母(Torulopsis glabrata)和解脂亚洛酵母(Yarrowia lipolytica)等[9-10]。其中,Y.lipolytica具有大量合成α-KG的能力,且又是食品安全生产菌株,因而更受研究人员青睐[11]。研究发现,Y.lipolytica能够利用乙醇[12]、甘油[13]、菜籽油[14]和纤维素[15]等可再生资源大量积累α-KG。本研究室在前期的工作中筛选得到1株α-KG高产菌株Y.lipolytica WSH-Z06,在以甘油为唯一碳源时α-KG的产量为39.2 g/L[16]。又通过代谢工程改造和过程优化等手段强化了α-KG的积累[17-18]。但是,应用Y.lipolytica发酵法生产α-KG过程的低生产力仍是制约其工业化生产的关键因素。
在前期研究过程中,根据Y.lipolytica合成α-KG过程pH变化的特性,建立了一种α-KG高产菌株的高通量筛选方法,结合恒温常压等离子体诱变获到了1株产量提高的突变株1-C6[19]。基于此,本研究应用甲基磺酸乙酯(ethylmethylsulfone,EMS)、亚硝基胍(nitroso-guanidin,NTG)和紫外(ultraviolet,UV)等理化诱变方法对1-C6进行迭代诱变,并对最终获得的高产α-KG的Y.lipolytica突变株进行发酵优化。在发酵罐水平上考察了转速、通气量、乙酸钠(NaAc)和CaCO3添加量对α-KG积累的影响。通过探索不同的补料发酵模式,最终建立了一种恒速补料的发酵模式,强化了α-KG的生产,为实现利用发酵法工业化生产α-KG提供了参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种
解脂亚洛酵母Y.lipolytica WSH-Z06(保藏号CCTCCNO:M20714)、1-C6为本研究室在前期的工作中选育[16,19];2-G4、3-C3和4-E2由本研究获得。
1.1.2 主要试剂
溴甲酚绿、喹哪啶红,上海生工生物工程有限公司;盐酸硫胺素、α-KG、丙酮酸(pyruvic acid,PA),Sigma公司;其他试剂,上海国药集团化学试剂有限公司。
1.1.3 培养基
种子培养基(g/L):葡萄糖20,大豆蛋白10,KH2PO4 1.0,MgSO4·7 H2O 0.5,固体培养基中加入20 g/L琼脂,预筛培养基中加入0.5 g/L溴甲酚绿(过滤除菌),115 ℃灭菌15 min。
发酵培养基(g/L):甘油100,(NH4)2SO4 3,KH2PO4 3,MgSO4·7H2O 1.2,NaCl 0.5,K2HPO4 0.1,盐酸硫胺6×10-7(过滤除菌),115 ℃灭菌15 min。根据不同发酵调控策略,在摇瓶和发酵罐中加入不同浓度的CaCO3(单独灭菌)、无水NaAc和甘油等。
1.1.4 仪器与设备
QPix 420微生物筛选系统,美谷分子仪器(上海)有限公司;多孔板培养箱,德国Heidolph公司;3 L发酵罐,上海保兴生物有限公司;Agilent 1260液相色谱仪,美国Agilent公司;恒温摇床,上海知楚仪器有限公司;恒温培养箱,上海跃进医疗器械厂;台式高速离心机,德国Eppendorf公司;Cytation3全波长酶标仪,美国BioTec公司;UV-245型紫外-可见分光光度计,日本Shimadzu公司。
1.2 实验方法
1.2.1 培养方法
多孔板培养:将QPix挑选的菌落接种于250 μL/孔的96浅孔板中,装液量为160 μL,28 ℃,900 r/min培养18 h(种子培养);将多孔板培养好的种子液以10%的接种量转接至4.6 mL/孔的48深孔板中,装液量1 mL,28 ℃,900 r/min培养96 h(发酵培养)。
摇瓶培养:将活化后的种子液以10%的接种量接种至装有50 mL培养基的500 mL三角瓶中,28 ℃,200 r/min分别培养18 h(种子培养)和168 h(发酵培养)。
发酵罐培养:将活化后的种子液以10%接种量接种于装有2 L发酵培养基的 3 L发酵罐中,28 ℃培养240 h。
1.2.2 诱变方法
EMS诱变:将前期研究得到的突变株1-C6活化,取一定菌液,4 500 r/min离心10 min,生理盐水洗涤2次。稀释成菌体浓度为106~107个/mL的菌悬液,加入EMS溶液,使其终浓度为0~40 μL/mL(原液/稀释体系,每4 μL 1个梯度)。28 ℃,200 r/min振荡培养1 h后,10 000 r/min离心2 min终止反应。生理盐水洗涤3次并制成合适的稀释度涂布预筛平板,每组设置3个平行。28 ℃恒温培养24 h,统计各平板上的菌落数,采用OriginPro 2019计算各处理浓度的致死率。
NTG诱变:将经EMS诱变后获得的高产菌株活化,取一定菌液,4 500 r/min离心10 min,生理盐水洗涤2次。取一定量菌悬液,加入NTG溶液,使其终浓度为0、0.1、0.15、0.2、0.3、0.4、0.6、0.8、1.0 mg/mL,28 ℃,200 r/min振荡培养10 min后,10 000 r/min离心2 min终止反应。生理盐水洗涤3次,并制成合适的稀释度涂布预筛平板,每组设置3个平行。28 ℃恒温培养24 h,统计各平板上的菌落数,采用OriginPro 2019计算各处理浓度的致死率。
UV诱变:开启15 W紫外灯预热30 min,将经NTG诱变后获得的高产菌株活化,取一定菌液,4 500 r/min离心10 min,生理盐水洗涤2次。取5 mL菌悬液加入直径9 cm的无菌培养皿中,距离30 cm进行紫外照射,照射时间分别为0、10、20、30、40、50、60、90、120、150 s。在红灯下,取照射后的菌悬液,生理盐水洗涤3次并制成合适的稀释度涂布预筛平板,每组设置3个平行。28 ℃恒温培养24 h,统计各平板上的菌落数,采用OriginPro 2019计算各处理时间的致死率。
1.2.3 筛选方法
根据前期研究建立的高通量筛选方法进行筛选,筛选过程包括预筛、初筛和复筛[19]。
预筛:将诱变处理后的菌悬液稀释至一定浓度,涂布于含有溴甲酚绿的预筛固体平板上,28 ℃恒温培养24 h,采用QPix420微生物筛选系统挑取生长快,变色圈(由蓝变黄)与菌落直径之比较大的菌株。
初筛:将预筛过程挑选出的菌株接种至多孔板中,28 ℃恒温培养18 h,以10%的接种量将种子培养基转移至48深孔板,培养96 h。离心,取200 μL上清液于96孔板中,每孔加入喹哪啶红指示剂,反应30 min。酶标仪测定520 nm可见光下的吸光值。以当次诱变处理的出发菌株为对照,挑选高产突变菌株。
复筛:挑取初筛产量较高的菌株,扩培后转接至摇瓶发酵培养基,培养168 h,测定发酵液中的α-KG、副产物PA的含量。
1.2.4 致死率的计算
致死率的计算如公式(1)所示:
致死率![]()
(1)
式中:A,对照平板上的平均菌落数;S,诱变处理后平板上的平均菌落数。
1.2.5 细胞干重的测定
参考文献进行细胞干重(dry cell weight,DCW)的测定,准确吸取1 mL发酵液于50 mL容量瓶,加入15 mL 2 mol/L HCl与发酵液中的CaCO3充分反应,用去离子水定容后混合均匀,在570 nm处测定OD值,根据 OD570∶细胞干重(g/L)=1∶0.223计算细胞干重[16]。
1.2.6 α-KG、PA和甘油的测定
参考文献利用Agilent 1260高效液相色谱(high performance liquid chromatography,HPLC)测定,色谱条件:色谱柱Aminex HPX-87H ion exchange column,流动相 5 mmol/L H2SO4,流速 0.6 mL/min,柱温40 ℃,进样量 10 μL,紫外检测器(波长210 nm)用于检测α-KG和PA,示差折光检测器用于检测甘油[20]。
2 结果与分析
2.1 EMS、NTG和UV迭代诱变获取α-KG高产菌株
应用EMS、NTG和UV等对菌株1-C6进行迭代诱变处理,后一次诱变以前一次诱变后得到的高产菌为出发菌株。首先将1-C6进行EMS诱变,由图1可知,低浓度的EMS对菌体致死效果不明显,而当浓度增加至16 μL/mL后,致死率随着诱变剂浓度的增加不断升高(图1-A)。研究报道,应用常规理化诱变方法进行诱变处理,通常在致死率为70%~80%时正突变效果比较明显[21-22]。选择以终浓度为24 μL/mL的EMS对1-C6进行诱变处理。经预筛和初筛,获得9株α-KG产量提高的突变株,继续进行摇瓶复筛,结果如图1-D所示。EMS诱变对菌株积累α-KG能力的提高不显著,其中,2-G4相比出发菌株1-C6,α-KG的产量提高了9.7%,副产物PA的含量基本一致。
继续对菌株2-G4进行NTG处理,NTG对菌体致死效率高,NTG终质量浓度为0.1 mg/mL时,致死率达58.9%,质量浓度为0.2 mg/mL时致死率为97.3%,当质量浓度增加至0.3 mg/mL时致死率达100%(图1-B)。选取终质量浓度为0.15 mg/mL的NTG对2-G4进行诱变处理。经预筛和初筛,获得6株高产突变株,继续进行摇瓶复筛,结果如图1-E所示。NTG诱变效果明显,突变菌株产量明显增加,其中,相对出发菌株2-G4,菌株3-C3积累α-KG的量提高了33.5%,副产物PA含量基本一致。
继续对菌株3-C3进行UV处理,UV致死效果明显,处理10 s时菌株致死率达65.1%,随着处理时间的延长致死率增加,处理40 s时致死率达90.4%。继续延长处理时间,致死率呈先降低后升高的趋势,但导致这一现象的原因仍有待进一步研究(图1-C)。选用20~40 s作为UV诱变的处理时间。经预筛和初筛,获得7株高产突变菌株,继续进行摇瓶复筛,结果如图1-F所示。总体来说,UV诱变效果不显著,α-KG的产量仅有少量提高。相比出发菌株3-G3,菌株4-E2生产α-KG的量提高了10.6%,PA的含量提高了9.1%;菌株4-G12生产α-KG的量提高了10.7%,PA的量提高了5.1%。
为了验证突变菌株的遗产稳定性,对经EMS、NTG和UV迭代处理后获得的高产菌株4-E2和4-G12进行连续传代10次,选取第5代和第10代进行摇瓶(带挡板)发酵,检测突变菌株的发酵特性,以野生菌株Y.lipolytica WSH-Z06和出发菌株1-C6为对照,结果如表1所示。传代至第5代时,突变体4-E2和4-G12发酵积累α-KG的量分别为29.30、23.66 g/L。传至第10代时,4-E2生产的α-KG产量与第5代的产量相当,而4-G12的产量为22.41 g/L,仅为4-E2菌株的69.6%。最终,相比野生菌株Y.lipolytica WSH-Z06,4-E2积累α-KG的量提高了134.0%;相比出发菌株1-C6,4-E2积累的α-KG量提高了56.7%。
表1 高产突变菌株的遗产稳定性检测 单位:g/L
Table 1 Genetic stability determination of high-titer mutants
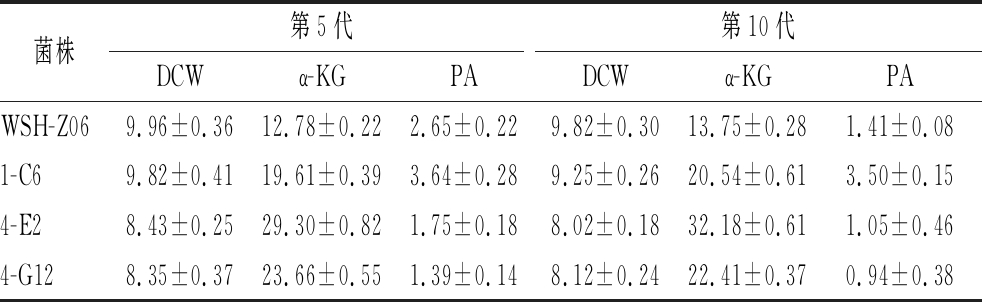
菌株第5代第10代DCWα-KGPADCWα-KGPAWSH-Z069.96±0.3612.78±0.222.65±0.229.82±0.3013.75±0.281.41±0.081-C69.82±0.4119.61±0.393.64±0.289.25±0.2620.54±0.613.50±0.154-E28.43±0.2529.30±0.821.75±0.188.02±0.1832.18±0.611.05±0.464-G128.35±0.3723.66±0.551.39±0.148.12±0.2422.41±0.370.94±0.38
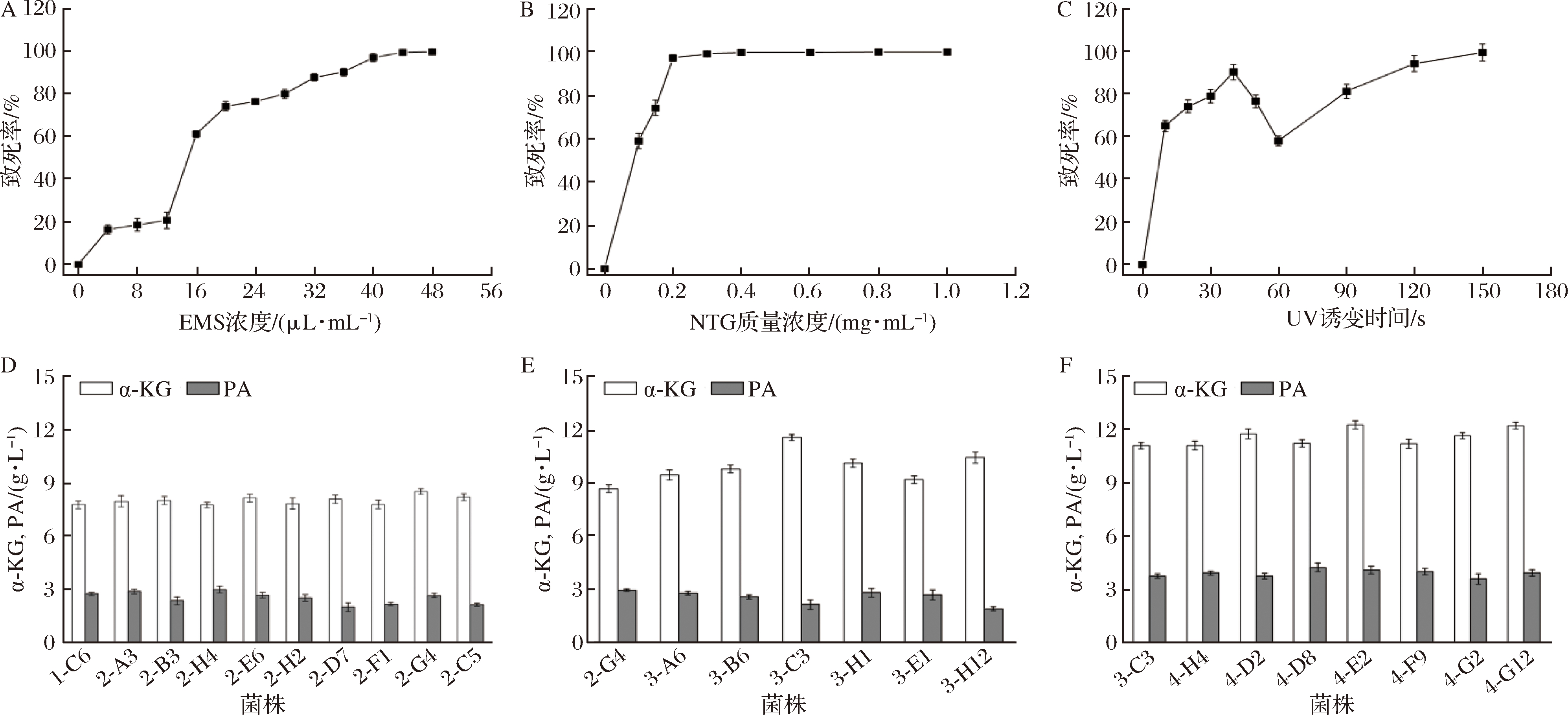
A-EMS诱变致死曲线;B-NTG诱变致死曲线;C-UV诱变致死曲线;D-EMS诱变后摇瓶复筛;E-NTG诱变后摇瓶复筛;F-UV诱变后摇瓶复筛
图1 EMS、NTG和UV诱变处理解脂亚洛酵母
Fig.1 Y.lipolytica treated with mutagenesis of NTG, EMS and UV
2.2 搅拌转速和通风比对α-KG产量的影响
溶氧水平在发酵法生产α-KG过程中是一个重要的参数,由于在实验室水平的发酵罐上准确控制溶氧水平比较困难,而搅拌转速和通风比是影响溶氧水平的2个重要参数。本研究通过控制搅拌转速和通风比,考察二者对菌株4-E2积累α-KG的影响。根据实验室前期研究结果,选取2种搅拌转速(400、600 r/min)和2种通气比(1.5、2.0 L/min)进行研究[17]。当搅拌转速为400 r/min,比较通风比分别为1.5 L/min(图2-A)和2.0 L/min(图2-B)发现,低通风比适合发酵前期菌体的生长和α-KG的积累,高通风比适合稳定期发酵生产α-KG。于是,选择采用两阶段控制通风比策略(400 r/min,初始通气量1.5 L/min,稳定期后通气量调整为2.0 L/min)进行探索。采用两段控制通风比策略,α-KG产量提高至47.02 g/L,副产物PA含量降低至11.45 g/L(图2-C)。当适当增加搅拌转速至600 r/min时,发现菌体生长速度变快,发酵后期细胞利用PA转化为α-KG的速度也有所加快,发酵168 h,α-KG的产量提高至52.53 g/L(图2-D)。
2.3 NaAc添加量对α-KG产量的影响
研究报道,在培养基中添加适量的NaAc能促进细胞内乙酰辅酶A的合成,较高浓度的乙酰辅酶A可促进细胞内TCA循环中草酰乙酸向柠檬酸的转化,从而促进α-KG的积累[23]。因此,考察了在培养基中添加不同浓度的NaAc,摇瓶实验结果如图3-A所示。当NaAc质量浓度为2 g/L时,α-KG产量与不加NaAc时相当;当质量浓度为6 g/L时,α-KG产量达到19.44 g/L,此时PA的量为3.64 g/L。随着NaAc浓度的增加,α-KG产量缓慢增加,PA的含量增加变快。综合考虑,NaAc的最佳添加量为6 g/L。在3 L发酵罐上对摇瓶发酵结果进行验证,发现α-KG的最高产量与不加NaAc时(图2-D)相当,但NaAc的加入加快了菌体对PA的利用速率(图3-B)。可见,NaAc的加入能加快后期菌体对PA的利用,缩短发酵周期,从而提高生产力。
2.4 CaCO3添加量对α-KG产量的影响
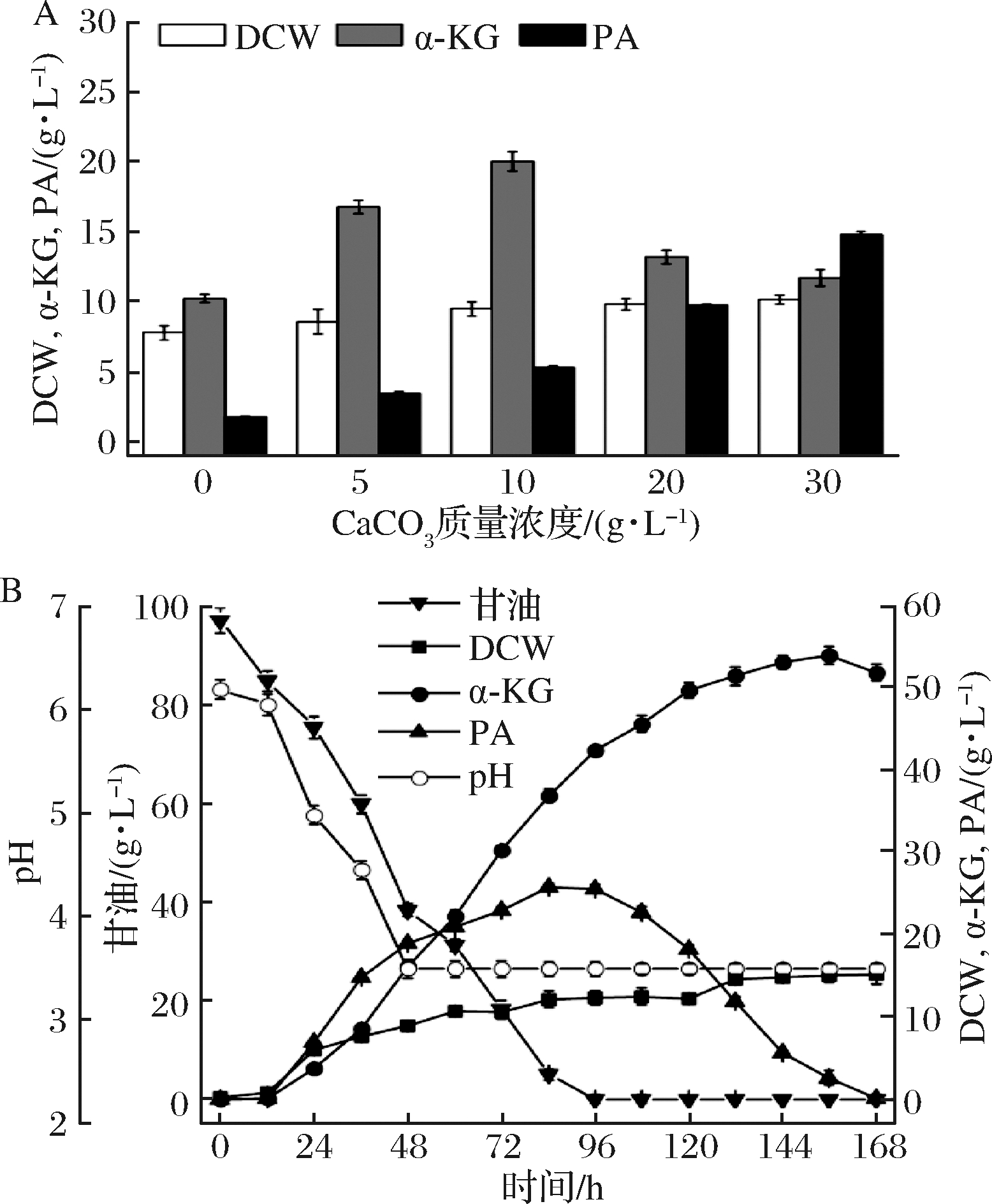
LIU等在研究光滑球拟酵母发酵生产PA时,提出Ca2+能够引导碳代谢流走向α-KG,这是由于Ca2+能提高丙酮酸羧化酶的活![]() 可以作为羧化反应的底物,强化PA羧化途径,同时能对发酵液的pH起到缓冲调节作用,更有利于发酵反应体系的稳定。在培养基中添加不同浓度的CaCO3,摇瓶发酵结果如图4-A所示。当CaCO3的添加量为10 g/L时,α-KG的产量最高,达到20.1 g/L;CaCO3添加量过少时,pH降低过早,不利于细胞积累有机酸。而随着CaCO3添加量提高至20 g/L时,α-KG产量降低,但PA含量不断积累。PA是α-KG生产过程的主要副产物,与α-KG理化性质较为相似,过多的副产物不利于后续α-KG的提取加工。综合考虑,确定CaCO3的最佳添加量为10 g/L。在3 L发酵罐上对摇瓶结果进行验证,结果如图4-B所示。α-KG的最高产量与不加CaCO3时相当,但α-KG含量达到最高值的时间提前了12 h,此时发酵液中PA含量不足2 g/L。可见,加入10 g/L的CaCO3降低了PA的积累量,使代谢偏向于积累α-KG。
可以作为羧化反应的底物,强化PA羧化途径,同时能对发酵液的pH起到缓冲调节作用,更有利于发酵反应体系的稳定。在培养基中添加不同浓度的CaCO3,摇瓶发酵结果如图4-A所示。当CaCO3的添加量为10 g/L时,α-KG的产量最高,达到20.1 g/L;CaCO3添加量过少时,pH降低过早,不利于细胞积累有机酸。而随着CaCO3添加量提高至20 g/L时,α-KG产量降低,但PA含量不断积累。PA是α-KG生产过程的主要副产物,与α-KG理化性质较为相似,过多的副产物不利于后续α-KG的提取加工。综合考虑,确定CaCO3的最佳添加量为10 g/L。在3 L发酵罐上对摇瓶结果进行验证,结果如图4-B所示。α-KG的最高产量与不加CaCO3时相当,但α-KG含量达到最高值的时间提前了12 h,此时发酵液中PA含量不足2 g/L。可见,加入10 g/L的CaCO3降低了PA的积累量,使代谢偏向于积累α-KG。
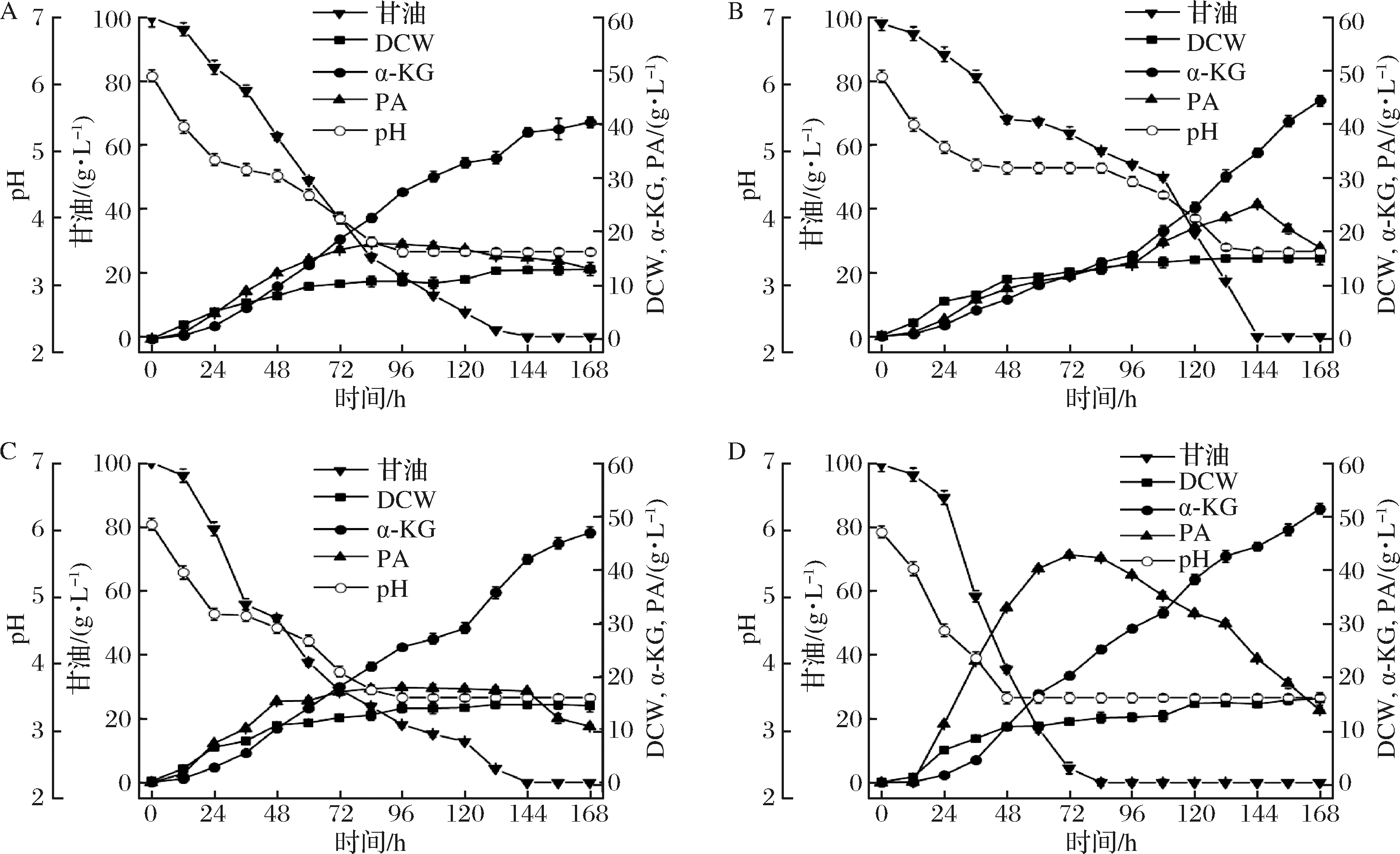
A-400 r/min,通气量1.5 L/min;B-400 r/min,通气量2.0 L/min;C-400 r/min,初始通气量1.5 L/min,稳定期后调整至2.0 L/min;D-600 r/min初始通气量1.5 L/min,稳定期后调整至2.0 L/min
图2 搅拌转速和通风比对α-KG产量的影响
Fig.2 Titer of α-KG affected by rotating speed and air flow
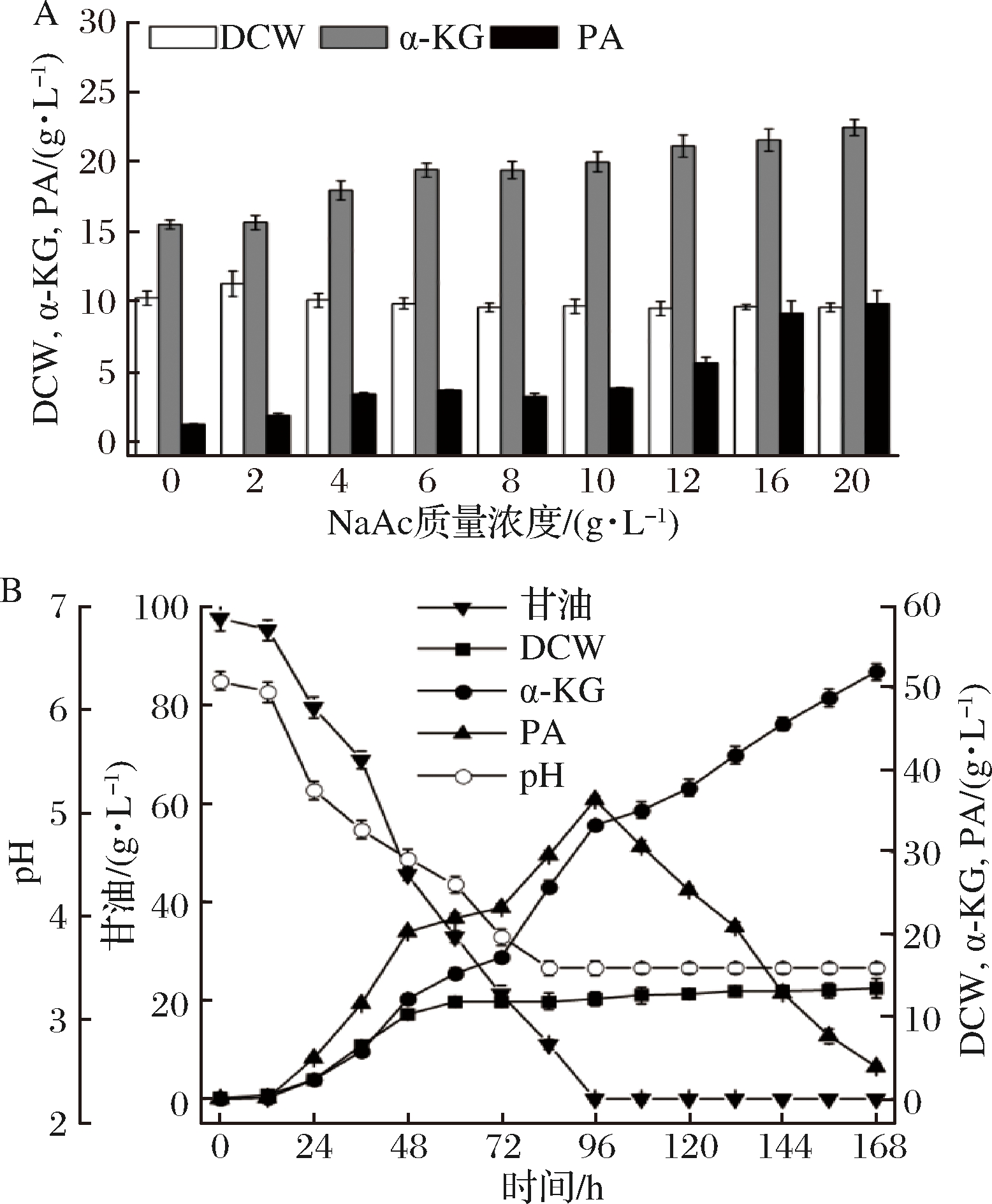
A-摇瓶上的情况;B-发酵罐上的情况
图3 NaAc对α-KG产量的影响
Fig.3 Titer of α-KG affected by NaAc
A-摇瓶上的情况;B-发酵罐上的情况
图4 CaCO3添加量对α-KG的影响
Fig.4 Titer of α-KG affected by CaCO3
2.5 补料发酵模式的探索
在搅拌转速600 r/min、两阶段控制通风比、NaAc添加量6 g/L和CaCO3添加量10 g/L的基础上,进行补料发酵的探索。研究了3种不同的补料策略:(1)一次性补料,当pH开始反弹时进行补料,84 h时一次性补入甘油100 g,即50 g/L(图5-A);(2)多节点补料,当pH开始反弹时(84 h)开始补料,补入10 g/L。96、108、120、132 h时以10 g/L各补一次,共补入甘油100 g,即50 g/L(图5-B);(3)恒速连续补料,60 h时开始补料,以10 g/L每12 h的速度补入底物甘油,120 h时停止补料,共补入甘油100 g,即50 g/L(图5-C)。由图5可知,PA的产量均在144 h达到最大值,其中,在一次性补料过程中PA的产量最高。随着发酵过程的进行,α-KG不断积累,发酵结束后,3种补料策略中α-KG的最高产量均在75 g/L左右,恒速连续补料策略中达到最高产量75.86 g/L的时间提前至204 h。但是,恒速补料发酵过程中α-KG的产量达到最大值后,菌株不再转化PA生成α-KG,α-KG和PA的含量均开始降低,这可能是由于发酵后期菌株活力不够所导致。后期可针对这一现象展开研究,进一步强化菌株积累α-KG的能力。
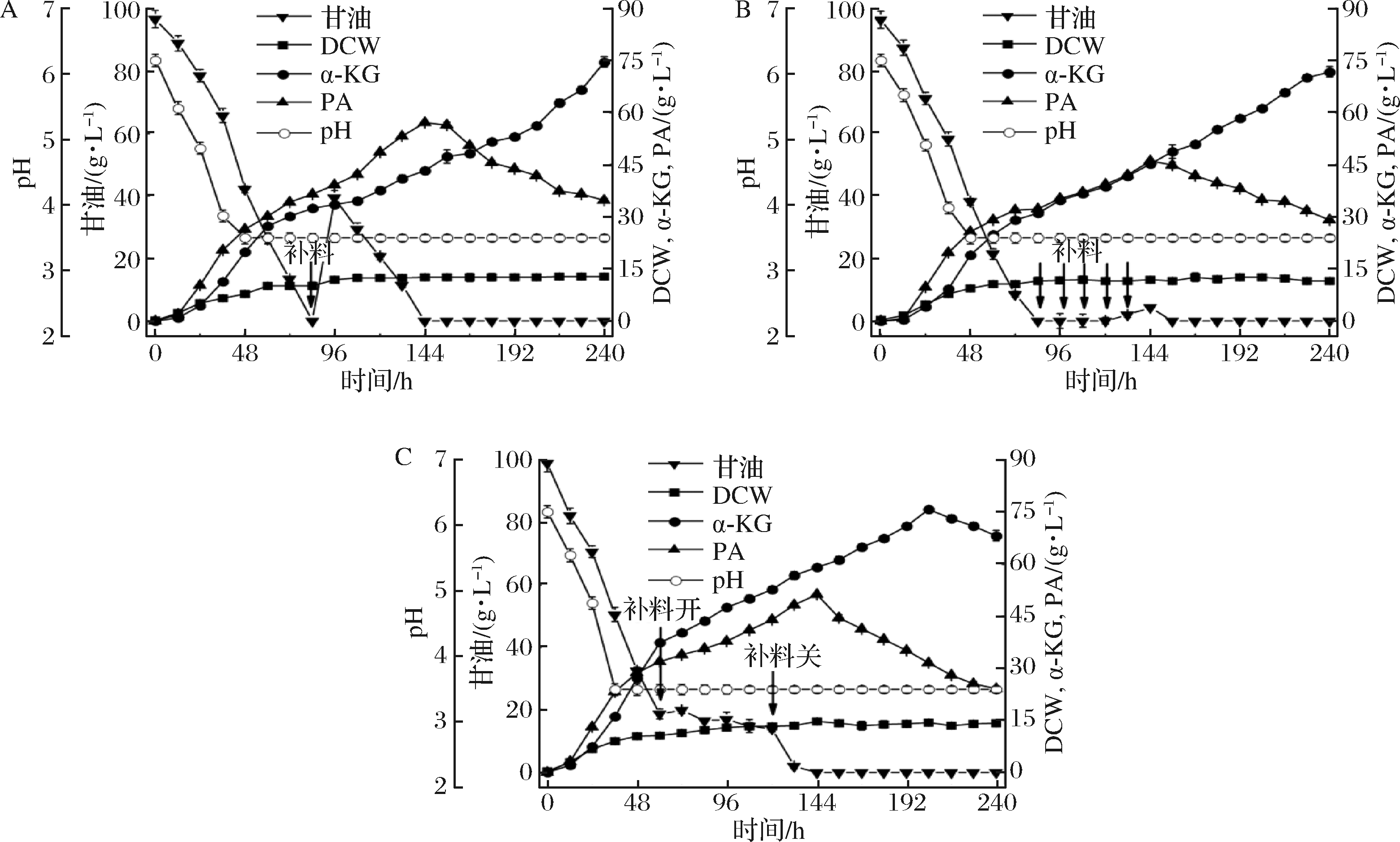
A-一次性补料;B-多节点补料;C-恒速连续补料
图5 不同补料发酵策略
Fig.5 Time course of different fed-batch fermentation in 3 L fermentor
3 讨论
α-KG是一种重要的具有多功能的有机酸,广泛应用于食品、制药、日化和农业等领域。目前,通过代谢工程改造和发酵过程优化等在一定水平上强化了α-KG的生产,但实现工业化生产仍存在一定难度。本研究基于前期建立的高通量筛选方法,应用EMS、NTG和UV等诱变方法对α-KG高产菌株1-C6进行迭代诱变,筛选获得了1株产量明显提高的突变株4-E2。在3 L发酵罐上对搅拌转速、通风比、NaAc和CaCO3添加量等条件进行了优化,并对补料发酵模式进行了探索。最终,在较高转速两阶段控制通风比(600 r/min,初始为1.5 L/min,pH值降低至3.5后调节至2.0 L/min)、NaAc添加量6 g/L和CaCO3添加量10 g/L条件下,应用恒速连续补料发酵模式,发酵204 h菌株4-E2积累α-KG的量达75.86 g/L,产物得率为0.51 g/g。相比于分批发酵,α-KG产量提高了44.4%。
本研究基于高通量筛选技术和传统诱变育种方法,并应用发酵过程优化强化了Y.lipolytica积累α-KG的能力,但与国内外研究报道的利用可再生能源积累α-KG的菌株仍然存在一些差距。KAMZOLOVA等以Y.lipolytica VKM Y—2412为出发菌株,利用乙醇为碳源可积累172 g/L的α-KG,得率为0.70 g/g[25]。HOLZ等以Y.lipolytica H222-S4 (JMP6) T5为出发菌株,应用菜籽油发酵生产获得126 g/L的α-KG,得率为1.20 g/g[26]。当以甘油为底物时,YOVKOVA等应用Y.lipolytica H355A (PYC1-IDP1)发酵获得180 g/L的α-KG,得率为0.36 g/g[27]。近年来,针对解脂亚洛酵母的基因编辑方法日趋成熟,代谢调控机制日趋清晰[28-29]。在后续研究中,通过代谢组学分析细胞内中间代谢途径的代谢通量,结合代谢工程手段定向调控胞内物质流向,以及基于理性调控的精准补料发酵策略,有望进一步提高α-KG的积累量。本研究相关诱变、过程优化和补料模式等对利用解脂亚洛酵母生产α-KG的放大实验和工业化生产具有一定的参考意义。
[1] DOUCETTE C D, SCHWAB D J, WINGREEN N S, et al.Alpha-ketoglutarate coordinates carbon and nitrogen utilization via enzyme I inhibition [J].Nature Chemical Biology, 2011, 7(12):894-901.
[2] TISCHLER J, GRUHN W H, REID J, et al.Metabolic regulation of pluripotency and germ cell fate through alpha-ketoglutarate [J].EMBO Journal, 2019, 38(1):e99 518.
[3] HE L Q, WU J, TANG W J, et al.Prevention of oxidative stress by alpha-ketoglutarate via activation of CAR signaling and modulation of the expression of key antioxidant-associated targets in vivo and in vitro [J].Journal of Agricultural and Food Chemistry, 2018, 66(43):11 273-11 283.
[4] LIU S, HE L, YAO K.The antioxidative function of alpha-ketoglutarate and its applications [J].Biomed Research International, 2018.DOI:10.1155/2018/3408467.
[5] ZHAO L, GUO H, SUN H.Effects of low-protein diet supplementation with alpha-ketoglutarate on growth performance, nitrogen metabolism and mTOR signalling pathway of skeletal muscle in piglets [J].Journal of Animal Physiology and Animal Nutrition, 2020, 104(1):300-309.
[6] STOTTMEISTER U, AURICH A, WILDE H, et al.White biotechnology for Green chemistry:Fermentative 2-oxocarboxylic acids as novel building blocks for subsequent chemical syntheses [J].Journal of Industrial Microbiology & Biotechnology, 2005, 32(11-12):651-664.
[7] ZHANG X, XU N, LI J, et al.Engineering of L-glutamate oxidase as the whole-cell biocatalyst for the improvement of alpha-ketoglutarate production [J].Enzyme and Microbial Technology, 2020, 136:109 530.
[8] 郭洪伟, 堵国成, 周景文, 等.微生物发酵生产α-KG研究进展 [J].生物工程学报, 2013, 29(2):141-152.
GUO H W, DU G C, ZHOU J W, et al.Progress in microbial production of α-ketoglutarate [J].Chinese Journal of Biotechnology, 2013, 29(2):141-152.
[9] OTTO C, YOVKOVA V, BARTH G.Overproduction and secretion of alpha-ketoglutaric acid by microorganisms [J].Applied Microbiology and Biotechnology, 2011, 92(4):689-695.
[10] SONG Y, LI J, SHIN H D, et al.Biotechnological production of alpha-keto acids:Current status and perspectives [J].Bioresource Technology, 2016, 219:716-724.
[11] MORGUNOV I G, KAMZOLOVA S V.Alpha-Ketoglutaric acid synthesis by Yarrowia lipolytica yeast and its regulation [J].Current Opinion in Biotechnology, 2013, 24(1):77-78.
[12] CHERNYAVSKAYA O G, SHISHKANOVA N V, IL′CHENKO A P, et al.Synthesis of alpha-ketoglutaric acid by Yarrowia lipolytica yeast grown on ethanol [J].Applied Microbiology and Biotechnology, 2000, 53(2):152-158.
[13] RYWINSKA A, JUSZCZYK P, WOJTATOWICZ M, et al.Glycerol as a promising substrate for Yarrowia lipolytica biotechnological applications [J].Biomass & Bioenergy, 2013, 48:148-166.
[14] MORGUNOV I G, KAMZOLOVA S V, SAMOILENKO V A.Enhanced alpha-ketoglutaric acid production and recovery in Yarrowia lipolytica yeast by effective pH controlling [J].Applied Microbiology and Biotechnology, 2013, 97(19):8 711-8 718.
[15] RYU S, LABBE N, TRINH C T.Simultaneous saccharification and fermentation of cellulose in ionic liquid for efficient production of alpha-ketoglutaric acid by Yarrowia lipolytica [J].Applied Microbiology and Biotechnology, 2015, 99(10):4 237-4 244.
[16] ZHOU J, ZHOU H, DU G, et al.Screening of a thiamine-auxotrophic yeast for alpha-ketoglutaric acid overproduction [J].Letters in Applied Microbiology, 2010, 51(3):264-271.
[17] YU Z, DU G, ZHOU J, et al.Enhanced alpha-ketoglutaric acid production in Yarrowia lipolytica WSH-Z06 by an improved integrated fed-batch strategy [J].Bioresource Technology, 2012, 114:597-602.
[18] GUO H, MADZAK C, DU G, et al.Effects of pyruvate dehydrogenase subunits overexpression on the alpha-ketoglutarate production in Yarrowia lipolytica WSH-Z06 [J].Applied Microbiology and Biotechnology, 2014, 98(16):7 003-7 012.
[19] ZENG W, DU G, CHEN J, et al.A high-throughput screening procedure for enhancing alpha-ketoglutaric acid production in Yarrowia lipolytica by random mutagenesis [J].Process Biochemistry, 2015, 50(10):1 516-1 522.
[20] YIN X, MADZAK C, DU G, et al.Enhanced alpha-ketoglutaric acid production in Yarrowia lipolytica WSH-Z06 by regulation of the pyruvate carboxylation pathway [J].Applied Microbiology and Biotechnology, 2012, 96(6):1 527-1 537.
[21] 刘春梅, 李树, 董传亮, 等.Genome shuffling技术改造epsilon-聚赖氨酸重组菌Streptomyces sp.Feel-1 [J].食品与发酵工业, 2012, 38(8):36-41.
LIU C M, LI S, DONG C L, et al.Genome shuffling enhanced epsilon-poly-L-lysine production of a recombinant Streptomyces sp. Feel-1[J].Food and Fermentation Industries, 2012, 38(8):36-41.
[22] QI Z, WANG W, YANG H, et al.Mutation of Acetobacter pasteurianus by UV irradiation under acidic stress for high-acidity vinegar fermentation [J].International Journal of Food Science & Technology, 2014, 49(2):468-476.
[23] ZHOU J, YIN X, MADZAK C, et al.Enhanced alpha-ketoglutarate production in Yarrowia lipolytica WSH-Z06 by alteration of the acetyl-CoA metabolism [J].Journal of Biotechnology, 2012, 161(3):257-264.
[24] LIU L, LI Y, ZHU Y, et al.Redistribution of carbon flux in Torulopsis glabrata by altering vitamin and calcium level [J].Metabolic Engineering, 2007, 9(1):21-29.
[25] KAMZOLOVA S V, CHIGLINTSEVA M N, LUNINA J N, et al.Alpha-ketoglutaric acid production by Yarrowia lipolytica and its regulation [J].Applied Microbiology and Biotechnology, 2012, 96(3):783-791.
[26] HOLZ M, FOERSTER A, MAUERSBERGER S, et al.Aconitase overexpression changes the product ratio of citric acid production by Yarrowia lipolytica [J].Applied Microbiology and Biotechnology, 2009, 81(6):1 087-1 096.
[27] YOVKOVA V, OTTO C, AURICH A, et al.Engineering the alpha-ketoglutarate overproduction from raw glycerol by overexpression of the genes encoding NADP(+)-dependent isitrate dehydrogenase and pyruvate carboxylase in Yarrowia lipolytica [J].Applied Microbiology and Biotechnology, 2014, 98(5):2 003-2 013.
[28] LV Y, EDWARDS H, ZHOU J, et al.Combining 26s rDNA and the Cre-IoxP system for iterative gene integration and efficient marker curation in Yarrowia lipolytica [J].ACS Synthetic Biology, 2019, 8(3):568-576.
[29] GANESAN V, SPAGNUOLO M, AGRAWAL A, et al.Advances and opportunities in gene editing and gene regulation technology for Yarrowia lipolytica [J].Microbial Cell Factories, 2019, 18(1):1 067-1 072.