藜麦,又称印第安麦、奎藜等,属苋科,种植历史悠久,是安第斯山脉土著人的传统食物[1]。藜麦与其他谷物相比,蛋白含量高达14%~22%[2]。藜麦氨基酸组成平衡,是唯一一种单体植物即可满足人类基本营养需求的食物,被联合国粮农组织推荐为最适宜人类的“全营养食品”[3]。我国于20世纪90年代引入藜麦,近年来藜麦的种植范围和产量逐年增长。藜麦引入后经多年培育,成功培育出了国内首个认定的藜麦品种—— “陇藜1号”[4]。
清蛋白是种子的贮藏蛋白之一。目前,对于芸豆、白果、花生、核桃、菜籽和荞麦[5]等清蛋白的研究报道较多。訾艳等[6]通过正交试验,对白芸豆清蛋白提取的最佳工艺参数进行了优选,并对其分子组成进行了研究。韩海涛等[7]研究发现,“清香”核桃清蛋白对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除作用与同浓度的VC相当。DENG等[8]探究了pH及NaCl浓度对白果清蛋白功能特性的影响。LI等[9]在对印加花生种子清蛋白级分的研究中发现,印加花生种子清蛋白表现出较好的免疫调节活性。赵蓓等[10]研究表明,超声处理菜籽清蛋白能够显著提升其抗氧化性。田旭静等[11]对藜麦糠清蛋白的提取工艺进行了优化并对其功能特性作了进一步研究。目前,有关“陇藜1号”藜麦清蛋白的研究尚未见报道。藜麦清蛋白作为种子清蛋白具有多种功能特性,有着广阔的应用前景。
本文以“陇藜1号”为试验对象,采用Osborne 蛋白质分类法[12]在掌握“陇藜1号”籽实中清蛋白、球蛋白、醇溶蛋白及谷蛋白含量的前提下,以含量较高的清蛋白为研究对象,采用超声波辅助提取法,在单因素试验的基础上,采用Box-Behnken试验设计,对其提取工艺条件进行优选,并对其氨基酸组成、分子质量分布以及抗氧化活性(羟自由基及DPPH自由基清除活性)进行了测定,旨在为藜麦清蛋白的提取及应用提供参考。
1 材料与方法
1.1 试验材料
“陇藜1号”藜麦(品种认定号:2015001),甘肃藜美农业科技有限公司。
1.2 试剂与仪器设备
考马斯亮蓝、牛血清白蛋白(bovine albumin,BAS),邻二氮菲、H2O2、DPPH、十二烷基硫酸钠( sodium dodecyl sulfate,SDS)、氨基酸混标、溴酚蓝、巯基乙醇、Tris-HCl缓冲液等,上海源叶生物科技有限公司。其他试剂均为分析纯。
TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;JY99-IIDN 超声细胞粉碎机,宁波新芝生物科技股份有限公司;GT10-1离心机,北京时代北利离心机有限公司;日立LA8080型氨基酸分析仪,日本株式会社日立高新技术那珂事业所;DYCZ-24KF垂直板电泳仪,赛默飞世尔科技(中国)有限公司。
1.3 试验方法
1.3.1 样品前处理
将藜麦籽粒粉碎后,过60目筛。然后用石油醚(沸程30~60 ℃)回流脱脂 8 h,过滤使藜麦粉与石油醚分离,风扫除去藜麦粉中残余的石油醚,将得到的脱脂粉放入密封袋备用。
1.3.2 藜麦蛋白提取流程
藜麦蛋白提取流程如下:
藜麦粒→粉碎→过筛→脱脂→风干→加去离子水→调pH值至7→超声处理→水浴磁力搅拌1 h→离心→收集上清液→考马斯亮蓝法测定清蛋白浓度→计算藜麦清蛋白提取率
1.3.3 藜麦蛋白分级提取
Osborne 蛋白质分类及“陇藜1号”各蛋白质组分分析参照江甜等[13]的试验方法,并加以改动。调整离心转速和磁力搅拌时间,其中将离心转速设置为5 000×g,浸提时间设置为60 min。不同溶剂依次提取得到“陇藜1号”清蛋白、球蛋白、醇溶蛋白及谷蛋白上清液。采用Bradford法测定上清液蛋白质含量。
1.3.4 清蛋白提取率的测定
采用考马斯蓝亮法。以BSA浓度为横坐标,吸光度值为纵坐标,得到标准曲线方程。根据标准曲线对收集到的上清液中的清蛋白浓度进行分析,清蛋白提取率计算如公式(1)所示:
清蛋白提取率/%
(1)
1.3.5 单因素试验
参考张舒等[14]的试验方法。清蛋白提取在超声功率320 W、料液比1∶30(g∶mL)、超声时间20 min、水浴浸提温度40 ℃的基础条件下,保持其他因素不变,只改变其中一个因素,以提取率为指标开展单因素试验。其中超声功率设置为200、260、320、380、500 W,料液比1∶15、1∶20、1∶25、1∶30、1∶35、1∶40,超声时间10、20、30、40 min,水浴温度30、35、40、45、50 ℃。每组平行试验3次,取平均值。
1.3.6 响应面试验
对单因素试验结果进行分析后,以A(超声功率)、B(料液比)、C(超声时间)、D(水浴温度)为自变量,“陇藜1号”清蛋白提取率作为响应值;设计4因素3水平响应面试验(共29组)[15],因素水平设计见表1。
表1 试验因素及水平
Table 1 Test factors and levels

水平因素超声功率(A)/W料液比(B)(g∶mL)超声时间(C)/min水浴温度(D)/℃-13201∶25203503801∶30304014401∶354045
1.3.7 清蛋白等电点的测定
参考刘静等[16]的方法。将提取的清蛋白溶液分为10份,用磷酸盐缓冲溶液依次调pH值至3、3.2、3.4、3.6、3.8、4.0、4.2、4.5、4.7、5.0。静置待蛋白沉淀,6 500×g离心10 min后收集上清液,于280 nm处测定吸光值。
1.3.8 清蛋白氨基酸组成及分子质量测定
藜麦清蛋白各氨基酸含量分析依据GB 5009.124—2016。
清蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定参照王棐等[17]的方法,略作修改。分离胶及浓缩胶质量浓度分别定为120、40 g/L;上样量10 μL。
1.3.9 清蛋白抗氧化活性的测定
1.3.9.1 DPPH自由基清除能力测定
参考TAI等[18]的方法并作调整。取2 mL样品液,加入2 mL 0.15 mmol/L的DPPH-95%(体积分数)乙醇溶液,混匀、避光反应0.5 h后5 000×g离心15 min,于517 nm处测定吸光值A1。DPPH自由基清除率按公式(2)计算:
DPPH自由基清除率![]()
(2)
式中:A2为对照组吸光度,95%乙醇溶液替代DPPH溶液;A3为空白组吸光度,95%乙醇代替样品液。
1.3.9.2 羟自由基清除能力测定
参考刘倩霞等[19]的方法。取1.0 mL样品液,依次加入0.2 mol/L磷酸盐缓冲溶液2 mL、1.0 mL 2.25 mmol/L邻二氮菲-乙醇溶液及1.0 mL 2.25 mmol/L FeSO4溶液;再加入0.03%(体积分数)H2O2 1.0 mL启动反应,混匀并在37 ℃水浴1 h,冷却后于532 nm处测吸光值A1。羟自由基清除率计算如公式(3)所示:
羟自由基清除率![]()
(3)
式中:A2为对照组吸光度,去离子水替代样品液及H2O2溶液;A3为空白组吸光度,去离子水取代样品液。
1.4 数据处理
借助SPSS 25.0及Excel,进行数据处理及显著性分析,并制作相关图表;通过Design Expert 8.0.6软件进行Box-Behnken设计及响应面分析。
2 结果与分析
2.1 标准曲线的制作
如图1所示,BSA浓度作为横坐标,吸光度值作为纵坐标,得到标准曲线方程:y=0.643 8x-0.001 5(R2=0.997 7)。该曲线线性关系良好。
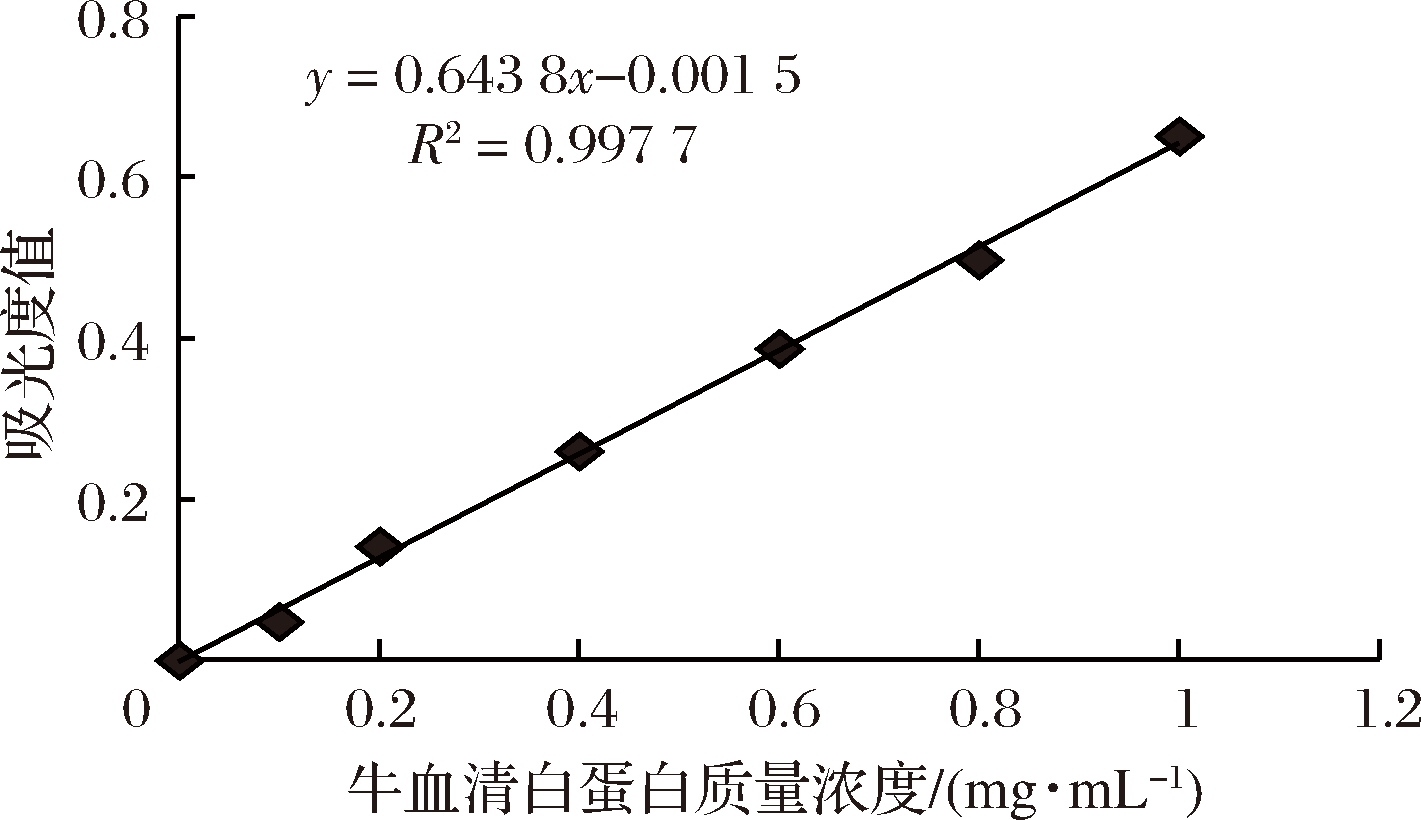
图1 标准曲线
Fig.1 The standard curve
2.2 “陇藜1号”籽实主要蛋白含量分析
由图2可知,经Osborne分级法提取后,“陇藜1号”籽实蛋白主要为清蛋白、球蛋白、谷蛋白和醇溶蛋白4种。其主要蛋白组分是水溶性的清蛋白和盐溶性的球蛋白,分别占到蛋白总量的34.96%、23.86%。而醇溶蛋白含量最少,占比为3.49%。此外,藜麦蛋白还含有9.22%的谷蛋白。

图2 “陇藜1号”籽实主要蛋白含量
Fig.2 The main protein content in seeds of "Longli 1"
2.3 单因素试验结果
2.3.1 超声功率对清蛋白提取率的影响
由图3可知,随着超声功率的升高,清蛋白提取率显著增高(P<0.05),在超声功率380 W时达到最大值;继续增加超声功率提取率反而下降。出现下降趋势的原因可能是超声功率过大破坏了蛋白质结构,使蛋白质部分分解及变性,使得清蛋白溶出量下降,导致提取率降低。根据试验结果,确定380 W为最优提取超声功率。
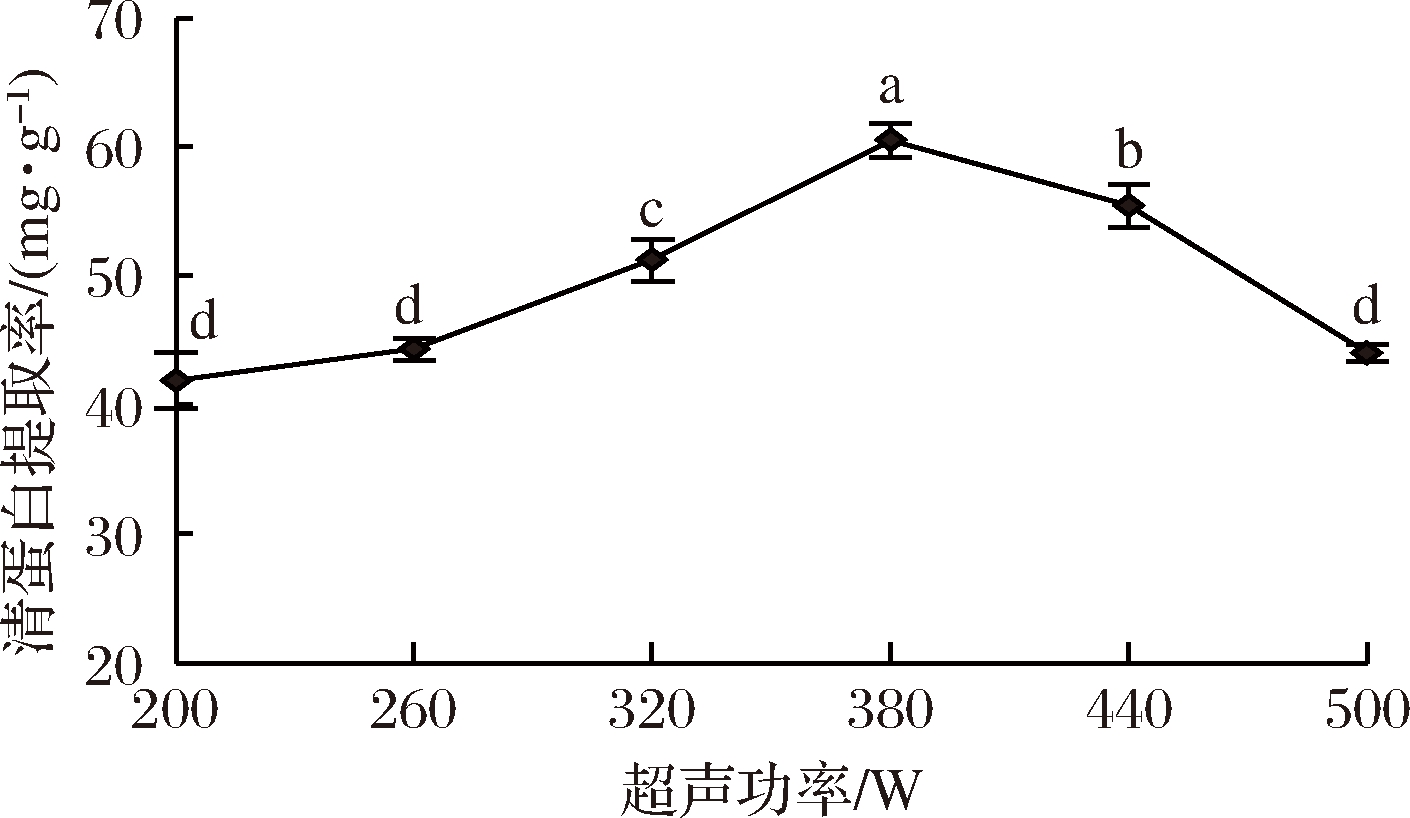
图3 超声功率对清蛋白提取率的影响
Fig.3 Effect of ultrasonic power on extraction rate of albumin
注:不同小写字母表示差异显著(P<0.05)(下同)
2.3.2 水浴温度对清蛋白提取率的影响
由图4可知,随着水浴温度的持续增加,清蛋白提取率先上升后下降。当提取温度为30~40 ℃时,清蛋白提取率显著增高(P<0.05)。40 ℃时,提取率达到峰值。提取温度在40~50 ℃时,清蛋白提取率显著降低(P<0.05)。这是因为提取温度为30~40 ℃,温度升高促进了清蛋白水和能力的增高,致使更多的蛋白质分子与水结合,提取率随之增大;而当温度>40 ℃时,温度的进一步升高将使部分蛋白分子变性、聚集。因此,提取温度应以40 ℃为宜。
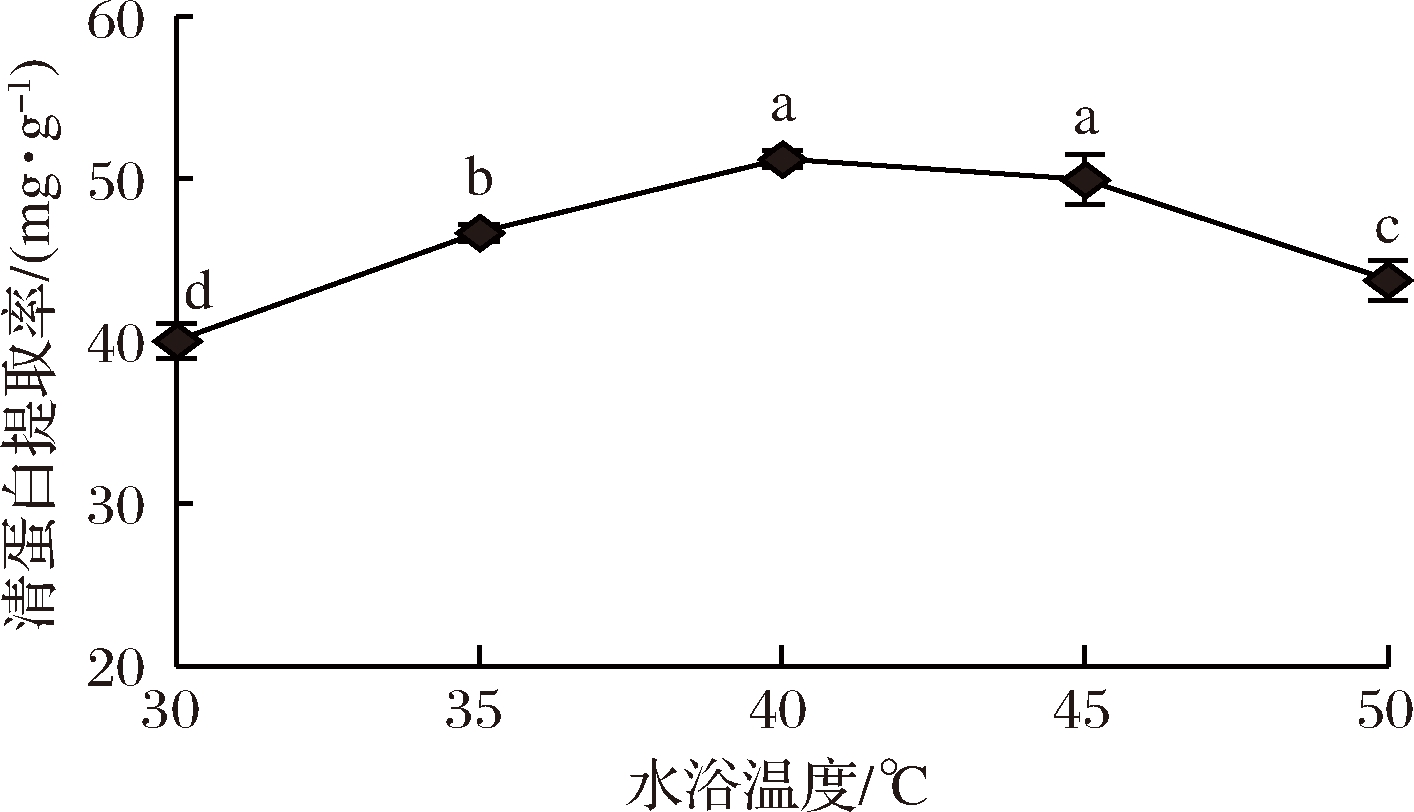
图4 水浴温度对清蛋白提取率的影响
Fig.4 Effect of water bath temperature on extraction rate of albumin
2.3.3 料液比对清蛋白提取率的影响
由图5可知,当料液比在1∶15~1∶30(g∶mL)时,随料液比增大,“陇藜1号”清蛋白提取率显著升高(P<0.05);并在料液比为1∶30时达到最高值,为58.41 mg/g,随着料液比继续增大,清蛋白提取率显著下降(P<0.05)。这可能是随提取溶剂的增加,清蛋白充分浸出,更多的蛋白分子与水结合;当达到最大值后,料液比增加,即溶剂增多,蛋白质过度膨胀,与水结合力降低的缘故。因此,宜选择1∶30为最适料液比。
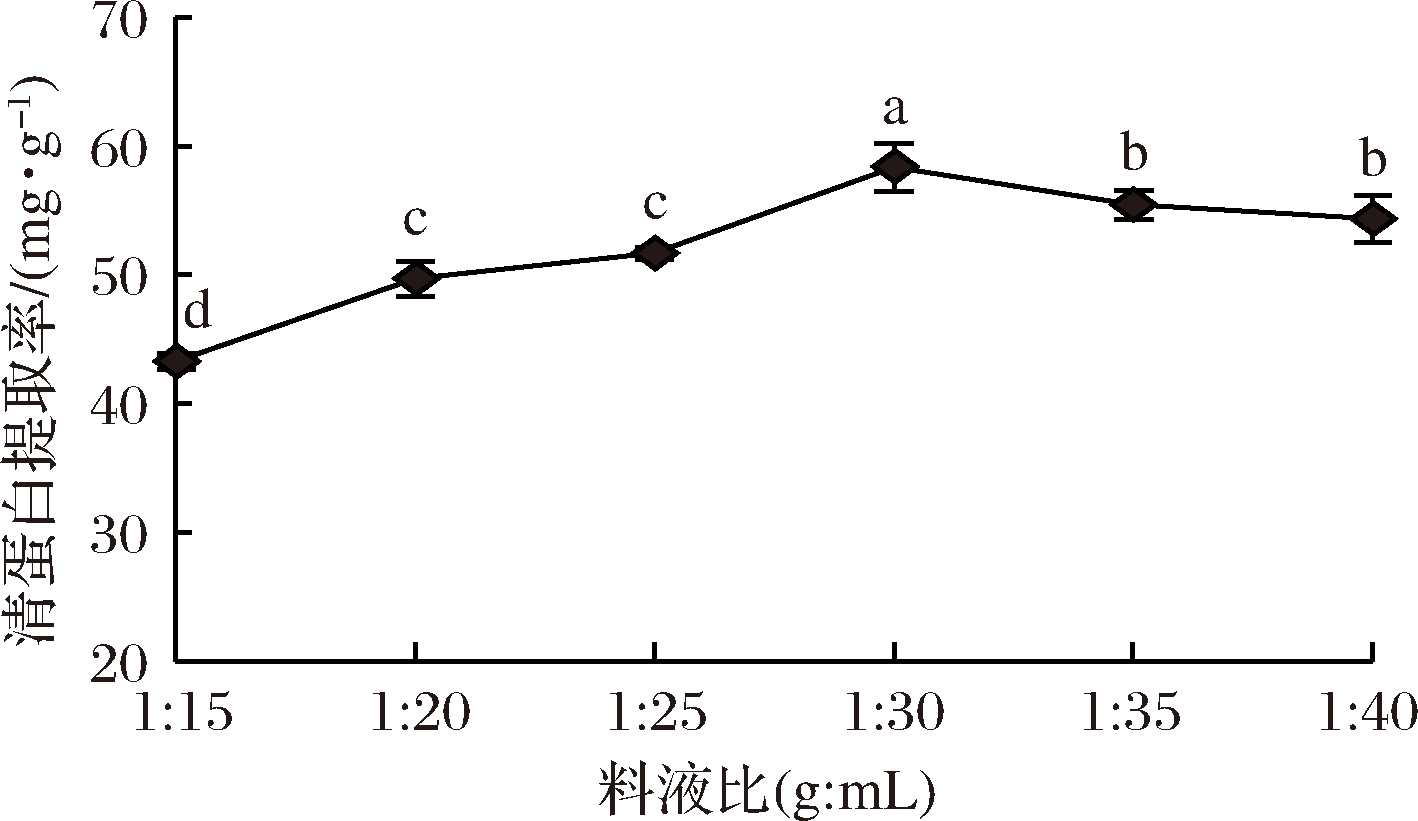
图5 料液比对清蛋白提取率的影响
Fig.5 Effect of material-liquid ratio on extraction rate of albumin
2.3.4 超声时间对清蛋白提取率的影响
由图6可知,随着超声时间的延长,藜麦清蛋白的提取率先升高后降低,在30 min时清蛋白提取率达到最高值,继续延长超声时间清蛋白提取率出现下降。原因可能是空化作用时间过长导致蛋白结构遭到破坏,蛋白分子疏水基团更多的暴露,在溶剂中的溶解度降低,得率也就变低。依据试验结果,选取超声时间30 min进行后续试验。
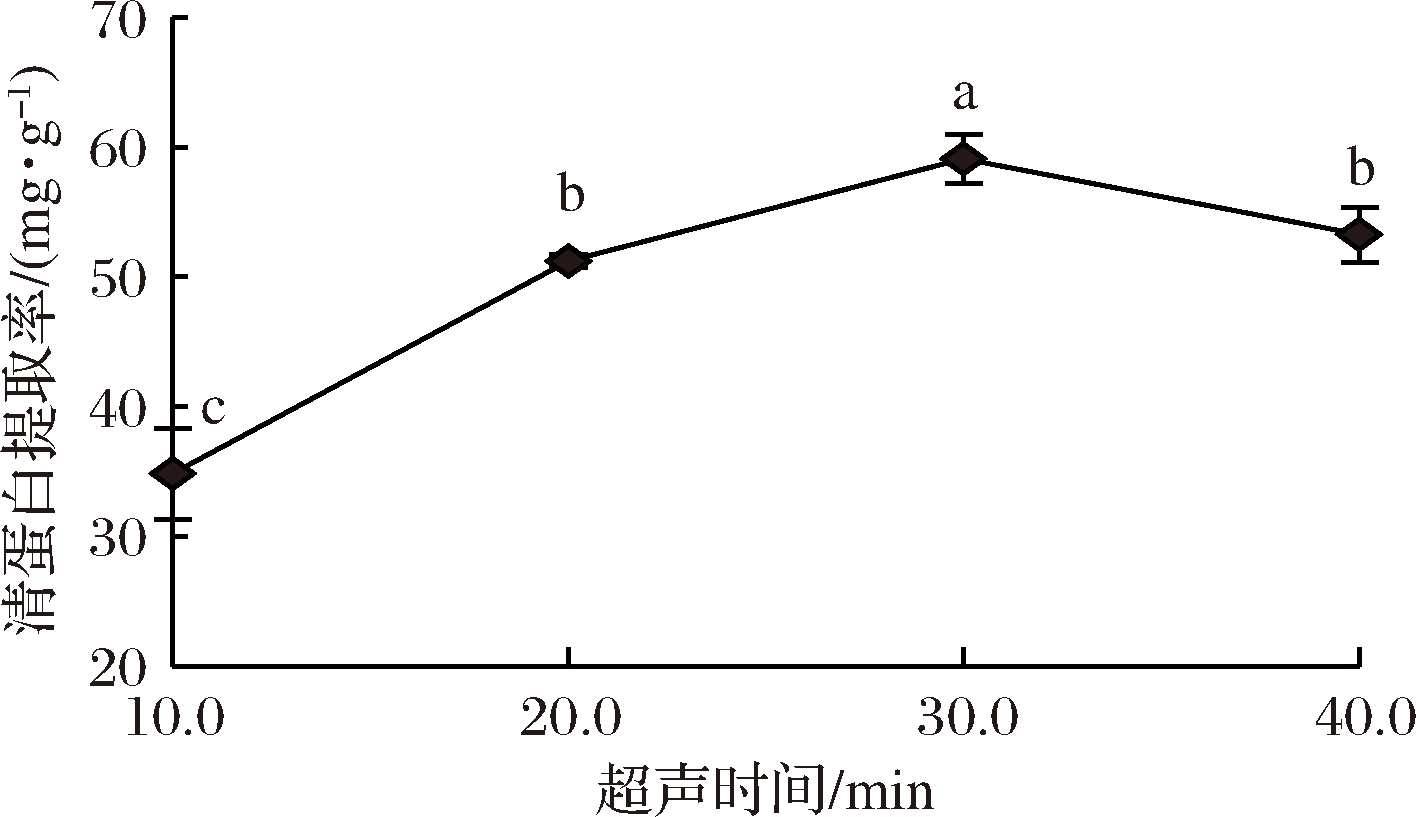
图6 超声时间对清蛋白提取率的影响
Fig.6 Effect of ultrasonic time on extraction rate of albumin
2.4 响应面试验结果
2.4.1 响应面试验设计与结果
以超声功率(A)、料液比(B)、超声时间(C)、水浴温度(D)为自变量,清蛋白提取率作为响应值,设计并实施4因素3水平试验,具体试验设计及结果如表2所示。
2.4.2 回归方程及方差分析结果
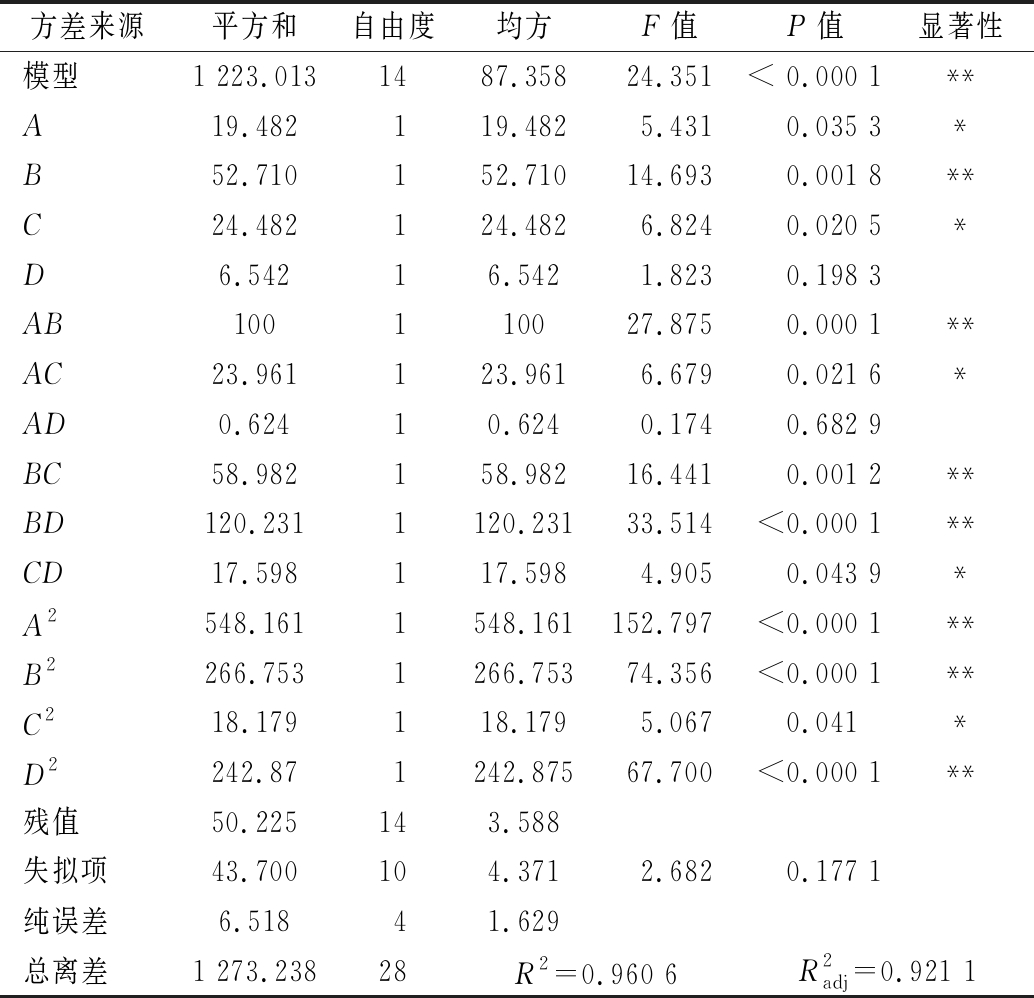
根据Design Expert 8.0.6软件对表3数据进行二次多项式回归方程分析,通过上述分析,得出回归模型, 模型中Y表示清蛋白提取率、A表示超声功率、B表示料液比、C表示超声时间、D表示水浴温度,回归方程如下:
Y=62.86-1.27A-2.10B-1.43C-0.74D+5.00AB-2.45AC-4.0AD-3.84BC+5.48BD-2.10CD-9.10A2-6.41B2-1.67C2-6.12D2。
回归模型方差分析如表3所示,模型F值为24.35,P值<0.000 1,模型差异极显著;失拟项P=0.177 1>0.05,差异不显著。模型校正相关系数![]() 表明模型与实际切合度良好,试验误差小,建立较合理,可用于“陇藜1号”清蛋白提取工艺的预测和分析。模型中B、AB、BC、BD、A2、B2、D2对清蛋白提取率影响极显著;A、C、AC、CD、C2对清蛋白得率的影响显著;而其中不显著的是D和AD。综合考量F值及P值,各因素对清蛋白提取率的影响主次顺序为:料液比>超声时间>超声功率>水浴温度。
表明模型与实际切合度良好,试验误差小,建立较合理,可用于“陇藜1号”清蛋白提取工艺的预测和分析。模型中B、AB、BC、BD、A2、B2、D2对清蛋白提取率影响极显著;A、C、AC、CD、C2对清蛋白得率的影响显著;而其中不显著的是D和AD。综合考量F值及P值,各因素对清蛋白提取率的影响主次顺序为:料液比>超声时间>超声功率>水浴温度。
表2 响应面试验设计与结果
Table 2 Response surface test design and results
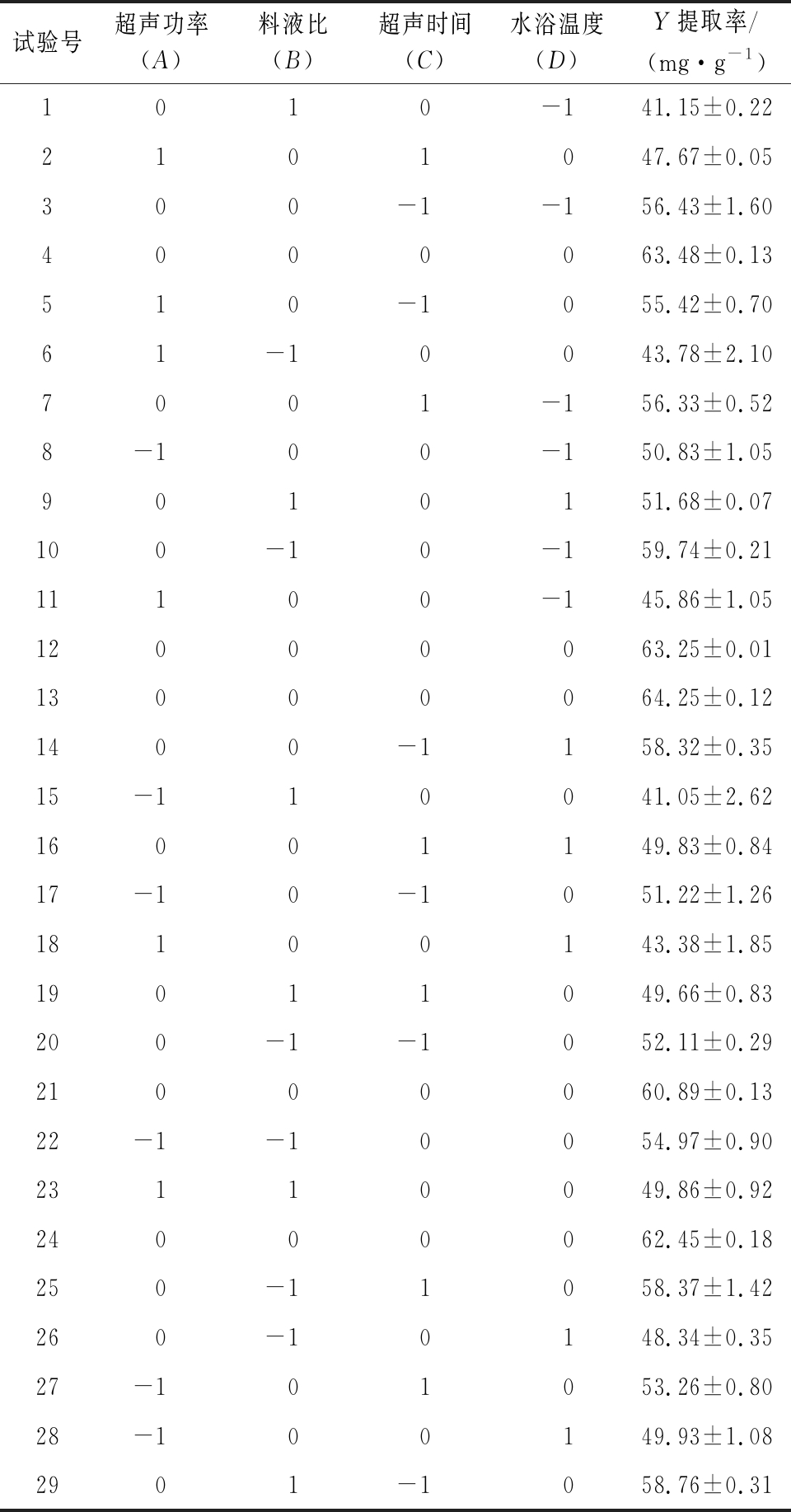
试验号超声功率(A)料液比(B)超声时间(C)水浴温度(D)Y提取率/(mg·g-1)1010-141.15±0.222101047.67±0.05300-1-156.43±1.604000063.48±0.13510-1055.42±0.7061-10043.78±2.107001-156.33±0.528-100-150.83±1.059010151.68±0.07100-10-159.74±0.2111100-145.86±1.0512000063.25±0.0113000064.25±0.121400-1158.32±0.3515-110041.05±2.6216001149.83±0.8417-10-1051.22±1.2618100143.38±1.8519011049.66±0.83200-1-1052.11±0.2921000060.89±0.1322-1-10054.97±0.9023110049.86±0.9224000062.45±0.18250-11058.37±1.42260-10148.34±0.3527-101053.26±0.8028-100149.93±1.082901-1058.76±0.31
表3 回归模型方差分析表
Table 3 Regression model variance analysis table
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
方差来源平方和自由度均方F值P值显著性模型1 223.0131487.35824.351< 0.000 1**A19.482119.4825.4310.035 3*B52.710152.71014.6930.001 8**C24.482124.4826.8240.020 5*D6.54216.5421.8230.198 3AB100110027.8750.000 1**AC23.961123.9616.6790.021 6*AD0.62410.6240.1740.682 9BC58.982158.98216.4410.001 2**BD120.2311120.23133.514<0.000 1**CD17.598117.5984.9050.043 9*A2548.1611548.161152.797<0.000 1**B2266.7531266.75374.356<0.000 1**C218.179118.1795.0670.041*D2242.871242.87567.700<0.000 1**残值50.225143.588失拟项43.700104.3712.6820.177 1纯误差6.51841.629总离差1 273.23828R2=0.960 6R2adj=0.921 1
2.4.3 各因素相互关系的响应面图分析
响应面图中各因素对清蛋白提取率的影响大小,主要通过曲面的弧度体现。曲面图倾斜程度越高,影响越显著,反之则越不显著。由图7可知,两变量交互作用BD的曲面最陡,交互作用AB的曲面陡峭程度次之,交互作用 BC的曲面陡峭程度最小。即料液比和水浴温度、超声功率和料液比、料液比和超声时间每2个因素间均具有显著交互作用。AB、BC、BD每2个因素的交互作用对藜麦清蛋白提取率的影响程度先高后低,响应值呈现出抛物线形状,故各因素相互关系对清蛋白提取率的影响存在着极大值,其与表2中的方差分析结果一致。

图7 各因素交互作用对清蛋白提取率影响的响应面图
Fig.7 Response surface of the influence of interaction of various factors on the extraction rate of albumin
2.4.4 最佳提取工艺条件的确定
运用Design Expert 8.0.6软件对模型进行分析,得到响应值(提取率)最大,即最优水平,“陇藜 1 号”籽实清蛋白提取的最佳工艺参数为:超声功率 354 W,料液比 1∶25.5(g∶mL),超声时间 40 min,水浴温度 36.9 ℃。在此条件下,经验证(平行3次试验),藜麦籽实清蛋白提取率为(63.25±0.87) mg/g;与理论预测值 64.11 mg/g基本一致,因而该试验模型能够较好地预测“陇藜 1 号”籽实清蛋白的实际提取效果。
2.5 等电点测定结果
由图8可知,在pH值为3.0~3.4,随着pH值增大吸光度降低,当pH值为3.4,吸光度最低,之后随着pH值增大吸光度升高。吸光度越低,表明蛋白沉淀越多,故“陇藜1号”清蛋白的等电点为3.4。
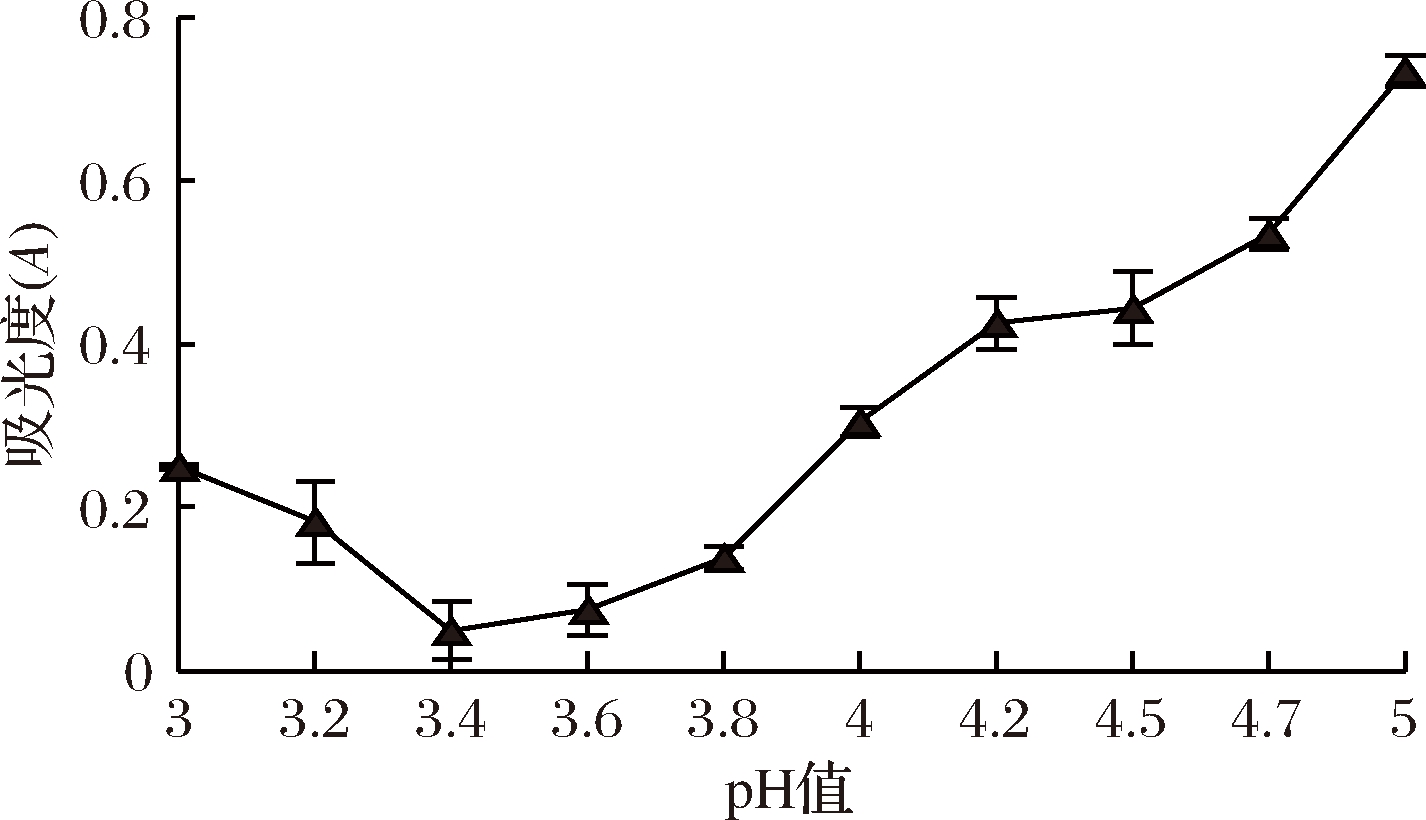
图8 藜麦清蛋白等电点
Fig.8 Quinoa albumin isoelectric point
2.6 清蛋白氨基酸组成
由表4可知,藜麦清蛋白含有17种氨基酸。因测定时采用酸水解法,色氨酸未检出。除甲硫氨酸外,其他人体必需氨基酸组成均衡。藜麦清蛋白的必需氨基酸与非必需氨基酸比值为53%,与FAO提出的参考值60%较接近。藜麦清蛋白谷氨酸、天冬氨酸及精氨酸含量相对较高,而半胱氨酸为其第一限制性氨基酸,含量仅为(0.28±0.01)%。赖氨酸和谷氨酸是TGase(转谷氨酰胺酶)作用的必需氨基酸,,藜麦清蛋白中赖氨酸和谷氨酸占16.85%。因此,藜麦清蛋白可以作为TGase的反应底物[20]。
表4 “陇藜1号”清蛋白氨基酸含量
Table 4 Amino acid content of "Longli 1" albumin

名称 含量/[g·(100g)-1]天冬氨酸(Asp) 7.27±0.33苏氨酸(Thr) 2.29±0.11丝氨酸(Ser) 3.09±0.16谷氨酸(Glu) 13.13±0.58甘氨酸(Gly) 2.62±0.12丙氨酸(Ala) 2.71±0.13半胱氨酸(Cys) 0.28±0.01缬氨酸(Val) 2.71±0.11甲硫氨酸(Met) 0.69±0.02异亮氨酸(Ile) 2.66±0.12亮氨酸(Leu) 4.67±0.21酪氨酸(Tyr) 1.99±0.09苯丙氨酸(Phe) 3.01±0.14赖氨酸(Lys) 3.72±0.17组氨酸(His) 1.50±0.07精氨酸(Arg) 4.74±0.23脯氨酸(Pro) 2.85±0.02
2.7 清蛋白分子质量测定
根据Marker的分子质量与其相对迁移率,经过拟合得到分子质量对数与相对迁移率的线性关系式:y=-1.450 2x+2.304 2;R2=0.989 0。将试验所得“陇藜1号”清蛋白的相对迁移率带入公式,即得清蛋白亚基分子质量对数,进而求出其各亚基的分子质量。
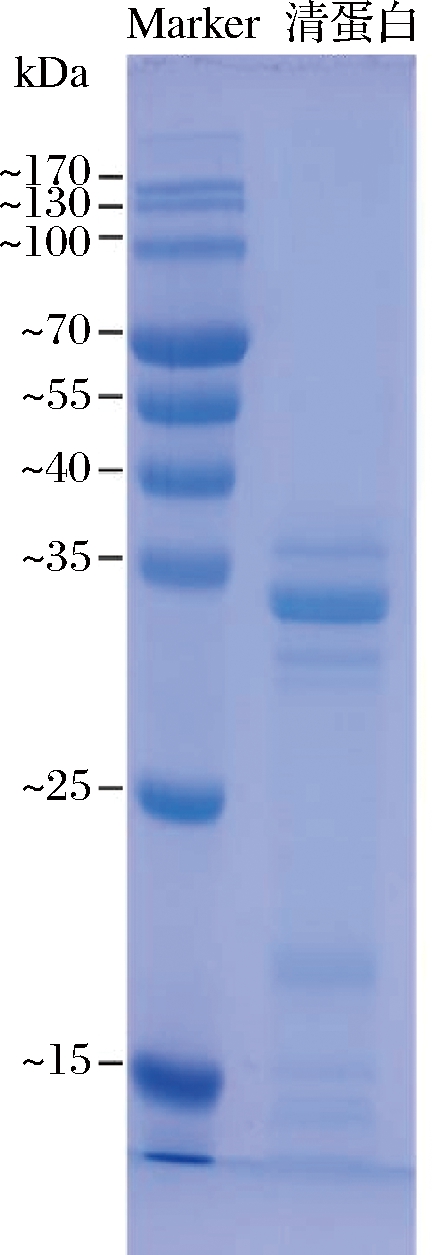
图9 “陇藜1号”清蛋白的SDS-PAGE电泳图
Fig.9 SDS-PAGE electropherogram of albumin from “Longli 1”
“陇藜1号”清蛋白由多亚基构成,各亚基分子质量如表5所示。其大致有4条谱带,主要分布在25 kDa~35 kDa,该部分条带分布较宽,颜色较深。BRINEGAR等[21]的研究报道表明,经SDS-PAGE分析,藜麦2S清蛋白的分子质量为8 kDa~9 kDa,本研究发现“陇藜1号”清蛋白存在少部分<15 kDa的亚基,该亚基可能来自于藜麦的2S清蛋白。
表5 “陇藜1号”清蛋白分子质量
Table 5 The molecular weight table of “Longli 1” albumin
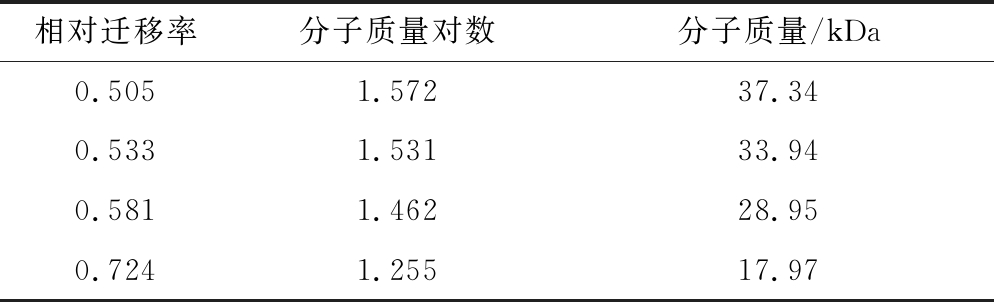
相对迁移率分子质量对数分子质量/kDa0.5051.57237.340.5331.53133.940.5811.46228.950.7241.25517.97
2.8 清蛋白抗氧化活性测定结果
2.8.1 DPPH自由基清除率
由图9可知,随浓度增大藜麦清蛋白对DPPH自由基的清除作用增强,但与VC相比均低于同浓度的VC对照组。当清蛋白质量浓度为1.2 mg/mL时,DPPH自由基清除率为67.15%。
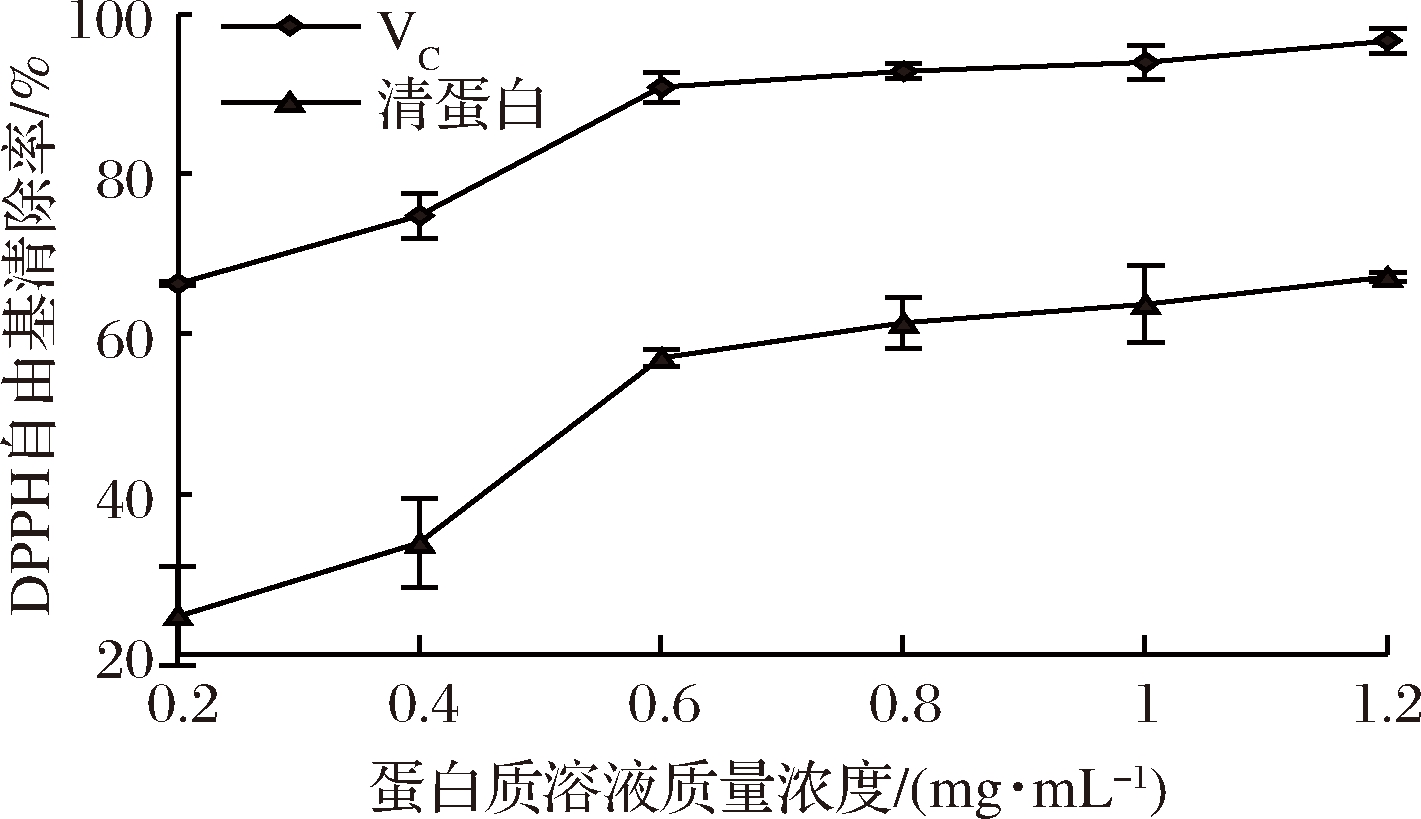
图10 藜麦清蛋白和VC的DPPH自由基清除作用
Fig.10 Scavenging effect of quinoa albumin and VC on DPPH free radical
2.8.2 羟自由基清除率
由图11可知,藜麦清蛋白羟自由基清除率随蛋白浓度增大而升高。低浓度下,清除作用上升较慢;随浓度进一步升高,表现出更好的清除效果。在蛋白质量浓度为1.2 mg/mL时,清除率为46.34%,是相同浓度VC清除率的51.46%。
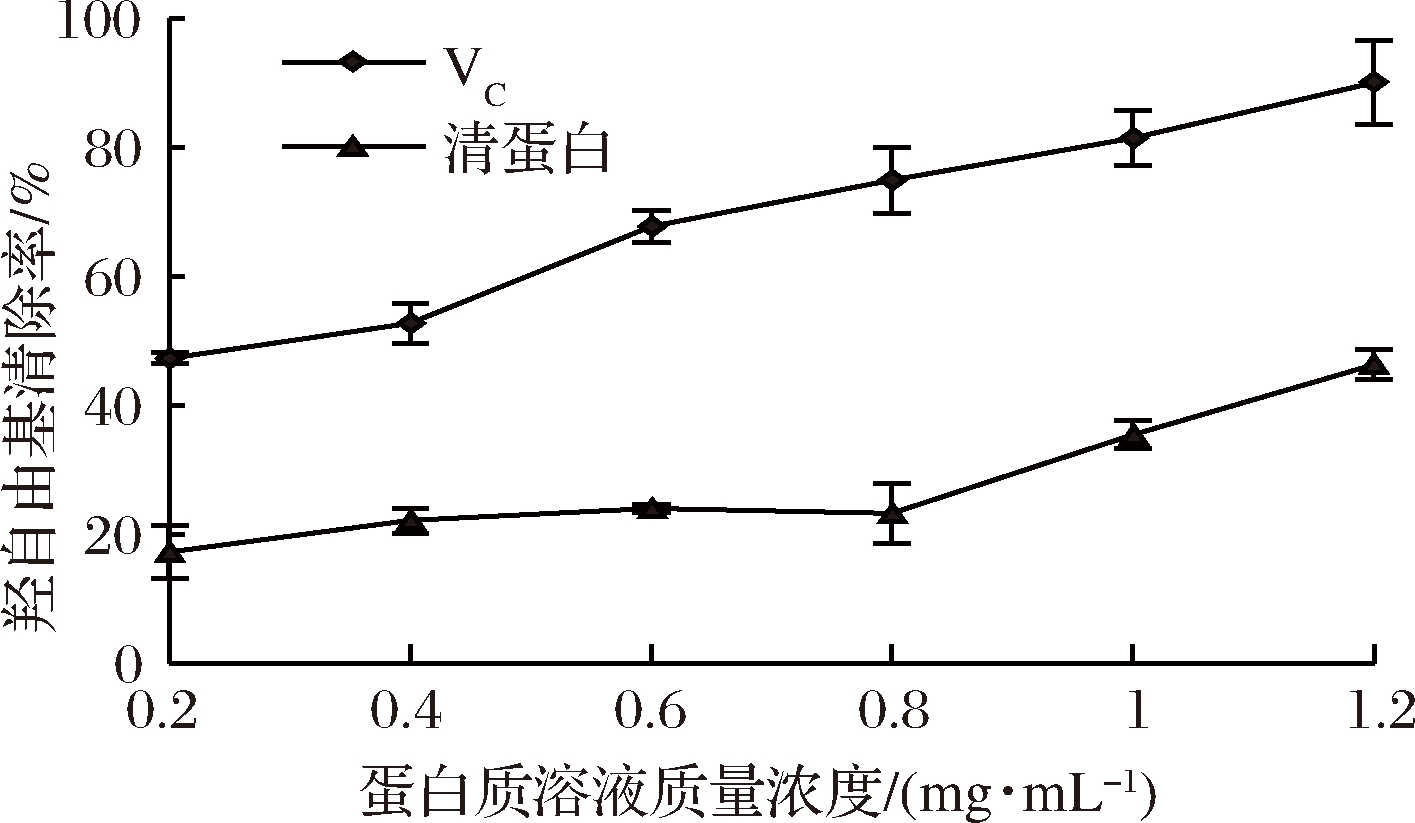
图11 藜麦清蛋白和VC的羟自由基清除作用
Fig.11 Scavenging effect of quinoa albumin and VC on hydroxyl radical
3 讨论
藜麦蛋白质的提取方法主要有酶法、碱溶酸沉法和超声波提取法等[22]。超声波提取法具有安全、节能、简单、高效等优点。超声波能够产生强烈的机械振动和空化效应,其能量可破坏植物细胞壁和细胞膜,使细胞内容物溶出,增加有效成分的提取率,广泛应用于蛋白质提取[23]。李茉等[24]采用超声辅助提取辣椒籽蛋白,超声辅助与传统提取相比蛋白提取率增加0.81 g/100g。王缈等[25]利用超声波提取玉米醇溶蛋白,使得醇溶蛋白的提取率达到了93.6%。本研究采用超声辅助提取法浸提“陇藜1号”清蛋白,研究发现,超声处理可以使藜麦清蛋白的提取率增至40.1%,表明超声处理可以有效提高藜麦清蛋白提取率,这与李茉、王缈等人的研究报道基本一致。
植物清蛋白及其酶解物具有较高的抗氧化活性已被大量的研究所证实。范三红等[26]对通过Osborne分级法提取的羊肚菌清蛋白抗氧化活性研究表明,羊肚菌清蛋白抗氧化活性虽均低于同浓度的VC对照组,但仍然对羟自由基以及DPPH自由基具有良好的清除效果。植物清蛋白属于天然活性蛋白,较化学合成物安全性更高,本研究清蛋白抗氧化活性低于同浓度的VC对照组,与范三红所报道的基本一致。卢红妍等[27]研究发现碱性蛋白酶酶解松仁清蛋白可得到具有高抗氧化活性的清蛋白肽;陈思远等[28]采用胰蛋白酶和碱性蛋白酶分步酶解麦胚清蛋白,制备得到了单一高活性抗氧化肽,未来对于藜麦清蛋白肽的研究将有着广阔的前景。
4 结论
“陇藜1号”籽实主要蛋白依次为清蛋白、球蛋白、谷蛋白和醇溶蛋白,其含量分别为34.96%、23.86%、9.22%、3.49%(质量分数)。超声波辅助提取可有效增加提取率,在超声功率 354 W、料液比 1∶25.5(g∶mL)、超声时间 40 min、水浴温度 36.9 ℃的条件下,藜麦清蛋白的提取率可达到64.11 mg/g。“陇藜1号”籽实清蛋白含有17种氨基酸,其中谷氨酸、天冬氨酸、赖氨酸及精氨酸含量相对较高,而半胱氨酸为其第一限制性氨基酸;分子质量测定结果表明,其亚基分布主要是在15 kDa~25 kDa以及25 kDa~35 kDa。当“陇藜1号”籽实清蛋白质量浓度为1.2 mg/mL时,其对羟自由基及DPPH自由基清除率分别为46.34%和67.15%。
[1] GALWEY N W.The potential of quinoa as a multi-purpose crop for agricultural diversification:A review[J].Industrial Crops and Products, 1992, 1(2-4):101-106.
[2] FILHO A M M, PIROZI M R, BORGES J T D S, et al.Quinoa:Nutritional, functional, and antinutritional aspects[J].Critical Reviews in Food Technology, 2017, 57(8):1 618-1 630.
[3] ELSOHAIMY S A, REFAAY T M, ZAYTOUN M A M.Physicochemical and functional properties of quinoa protein isolate[J].Annals of Agricultural Sciences, 2015, 60(2):297-305.
[4] 任贵兴, 杨修仕, 么杨.中国藜麦产业现状[J].作物杂志, 2015(5):1-5.
REN G X, YANG X S, YAO Y.Current situation of quinoa industry in China[J].Crops, 2015(5):1-5.
[5] 邵云, 唐传核.荞麦清蛋白水解物理化性质及抗氧化性研究[J].现代食品科技, 2013, 29(1):47-50;54.
SHAO Y, TANG C H.Physicochemical and antioxidant properties of buckwheat albumin hydrolysates[J].Modern Food Science and Technology, 2013, 29(1):47-50;54.
[6] 訾艳, 王常青, 陈晓萌, 等.白芸豆清蛋白提取工艺及分子组成研究[J].食品工业科技, 2014, 35(15):121-123;129.
ZI Y, WANG C Q, CHEN X M, et al.Study on the extraction technology and molecular composition of white kidney bean albumin[J].Science and Technology of Food Industry, 2014, 35(15):121-123;129.
[7] 韩海涛, 宴正明, 张润光, 等.核桃蛋白组分的营养价值、功能特性及抗氧化性研究[J].中国油脂, 2019, 44(4):29-34.
HAN H T, YAN Z M, ZHANG R G, et al.Nutritional value, functional characteristics and antioxidant activities of fractions in walnut protein[J].China Oils and Fats, 2019, 44(4):29-34.
[8] DENG Q C, WANG L, WEI F, et al.Functional properties of protein isolates, globulin and albumin extracted from Ginkgo biloba seeds[J].Food Chemistry, 2011, 124(4):1 458-1 465.
[9] LI P, WEN J M, MA X W, et al.Structural, functional properties and immunomodulatory activity of isolated Inca peanut (Plukenetia volubilis L.) seed albumin fraction[J].International Journal of Biological Macromolecules, 2018, 118:1 931-1 941.
[10] 赵蓓, 李欣蓉, 魏瑞芝, 等.超声辅助提取对菜籽清蛋白抗氧化活性的影响[J].食品科技,2015,40(8):235-239.
ZHAO B, LI X R, WEI R Z, et al.Effect on the antioxidant activity of rapeseed albumin of ultrasonic-assisted extraction[J].Food Science and Technology, 2015, 40(8):235-239.
[11] 田旭静, 段鹏慧,陈文超,等.Osborne分级法提取藜麦糠清蛋白及功能性质研究[J].食品工业科技, 2017, 38(12):264-269;276.
TIAN X J, DUAN P H, CHEN W C, et al.Extract of albumin from quinoa chaff by Osborne classification method and functional properties[J].Science and Technology of Food Industry, 2017, 38(12):264-269;276.
[12] 冯明珠, 何聪芬, 赵华, 等.燕麦麸蛋白质的 Osboren 分类及 SDS-PAGE 电泳分析[J].食品工业科技,2007(1):77-79.
FENG M Z, HE C F, ZHAO H, et al.Osborne classification and SDS-PAGE electrophoresis analysis of oat bran protein [J].Science and Technology of Food Industry, 2007(1):77-79.
[13] 江甜, 何毅, 祝振洲, 等.黑豆蛋白的分级提取及黑豆花色苷的成分鉴定[J].食品科学, 2017, 38(4):217-222.
JIANG T, HE Y, ZHU Z Z, et al.Fractional extraction of protein and characterization of anthocyanins from black soybean seeds[J].Food Science, 2017, 38(4):217-222.
[14] 张舒, 王长远, 谭朝印, 等.绿豆清蛋白Osborne分级提取工艺优化及亚基组成分析[J].食品与机械, 2019,35(10):174-178.
ZHANG S, WANG C Y, TAN Z Y, et al.Optimization on Osborne extracting process for mung bean albumin and its subunit strip determination[J].Food & Machinery, 2019,35(10):174-178.
[15] 刘婷婷, 刘阳, 张晶, 等.分蘖葱头蛋白提取工艺优化及其基础特性[J].食品科学, 2018, 39(2):267-272.
LIU T T, LIU Y, ZHANG J, et al.Optimization of extraction and characterization of protein from Allium cepa L.var.agrogatum Don[J].Food Science, 2018, 39(2):267-272.
[16] 刘静, 李旭, 向春蓉, 等.油茶籽粕蛋白功能特性及其酶解产物抗氧化活性研究[J].中国粮油学报, 2017, 32(1):40-46.
LIU J, LI X, XIANG C R, et al.Functional properties of camellia oleifera seed-cake protein and antioxidant activity of its enzymatic hydrolysate[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(1):40-46.
[17] 王棐, 张文斌, 杨瑞金, 等.藜麦蛋白质的提取及其功能性质研究[J].食品科技, 2018, 43(2):228-234.
WANG F, ZHANG W B, YANG R J, et al.Extraction and functional properties of quinoa protein isolates[J].Food Science and Technology, 2018, 43(2):228-234.
[18] TAI A, IOMORI A, ITO H.Structural evidence for the DPPH radical-scavenging mechanism of 2-O-α-D-glucopyranosyl-l-ascorbic acid[J].Bioorganic & Medicinal Chemistry, 2017, 25(20):5 303-5 310.
[19] 刘倩霞, 刘东, 张俊, 等.2种蛋白酶酶解曲拉干酪素条件优化及抗氧化性比较[J].食品科学, 2019, 40(8):225-234.
LIU Q X, LIU D, ZHANG J, et al.Optimization of hydrolysis conditions of Qula casein with two proteases and comparative antioxidant activity of hydrolysates[J].Food Science, 2019, 40(8):225-234.
[20] 蒋将. pH偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善[D].无锡:江南大学, 2011.
JIANG J.pH-shifting induced structural changes and functionality enhancements of soy proteins in molten globule state[D].Wuxi:Jiangnan University, 2011.
[21] BRINEGAR C, SINE B, NWOKOCHA L.High-cysteine 2S seed storage proteins from quinoa (Chenopodium quinoa)[J].Journal of Agricultural & Food Chemistry, 1996, 44(7):1 621-1 623.
[22] 王龙飞, 王新伟, 赵仁勇.藜麦蛋白的特点、性质及提取的研究进展[J].食品工业, 2017, 38(7):255-258.
WANG L F, WANG X W, ZHAO R Y.A review of characteristic, properties and extraction of quinoa protein[J].The Food Industry, 2017, 38(7):255-258.
[23] 朱新鹏. 超声波在天然产物活性成分提取中的应用[J].保鲜与加工,2012,12(2):43-45.
ZHU X P.Application of ultrasonic extraction of active ingredients in natural products[J].Storage and Process, 2012, 12(2):43-45.
[24] 李茉, 倪元颖, 彭郁,等.超声辅助提取辣椒籽蛋白工艺优化[J].农业工程学报, 2016, 32(24):309-314.
LI M, NI Y Y, PENG Y, et al.Optimization of ultrasound-assisted extraction of capsicum seed protein isolate[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(24):309-314.
[25] 王缈, 赵战利, 李宁, 等.超声提取玉米黄色素与醇溶蛋白的工艺优化[J].食品工业, 2014, 35(8):14-19.
WANG M, ZHAO Z L, LI N, et al.Optimization of ultrasonic extraction of yellow pigment and zein from Maize protein powder[J].The Food Industry, 2014, 35(8):14-19.
[26] 范三红, 田雨, 王娇娇, 等.响应面法优化羊肚菌清蛋白的提取及其抗氧化性[J].食品工业, 2019, 40(11):113-118.
FAN S H, TIAN Y, WANG J J, et al.Optimization of the extraction and antioxidant activity of Morchella esculenta albumin by response surface methodology[J].The Food Industry, 2019, 40(11):113-118.
[27] 卢红妍, 杨行, 方丽, 等.松仁清蛋白抗氧化肽的分离纯化及结构鉴定[J].食品科学, 2019, 40(24):40-45.
LU H Y, YANG H, FANG L, et al.Isolation, purification and structural identification of antioxidant peptides derived from enzymatic hydrolysis of pine nut kernel(Pinus koraiensis Sieb.et Zucc.) albumin[J].Food Science, 2019, 40(24):40-45.
[28] 陈思远, 刘永祥, 曹小舟, 等.从麦胚清蛋白分离制备高活性抗氧化肽[J].中国农业科学, 2016, 49(12):2 379-2 388.
CHEN S Y, LIU Y X, CAO X Z.The preparation process for isolation of a highly active antioxidant peptide derived from wheat germ albumin[J].Scientia Agricultura Sinica, 2016, 49(12):2 379-2 388.