熟肉制品在贮藏的过程中色泽会衰退,抑制褪色、保持色泽稳定性一直是肉制品加工与贮存中的一道难题[1]。大多数熟肉制品的色泽主要通过发色、美拉德反应等途径而形成,其中卤制、烧烤、油炸、高温杀菌等热加工中的美拉德反应对肉制品表面的色泽贡献非常大[2]。卤烤鸭软罐头是经过前处理等工序以及卤制、烘烤、真空包装和高温灭菌产品,产品表面呈黑色稍带红色,根据作者的初步研究鸭皮表面的色素物质主要为美拉德反应的产物类黑精,类黑精的变化可能是卤烤鸭以及同类产品色泽变化的主要原因。研究表明类黑精具有良好的抗氧化活性[3-5],是一种天然的抗氧化剂,可赋予食品特殊的色泽和风味,且过氧化氢和2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基的清除能力和类黑精颜色具有良好的线性关系[6]。此外,类黑精还具有抗突变、抗诱变[7]和降血压[8]、降血糖[9]等作用。
目前对类黑精的研究主要集中在果蔬和酒类中类黑精提取、抗氧化能力[10-14]和单一定量的美拉德反应模拟体系产物的结构[15-16]等方面,有关卤烤肉制品中类黑精的提取方法和性质的研究还鲜见报道。本研究目的在于探明肉制品表面主要色素物质之一类黑精的性质特点,为提高肉制品贮藏过程中色泽和风味等感官品质的稳定性提供理论依据。
1 材料与方法
1.1 材料与试剂
个体大小均匀、体态完整、经高压杀菌真空贮藏的卤烤鸭,由重庆市某食品生产企业提供;无水乙醇、铁氰化钾、抗坏血酸、H2O2、植酸、二氯甲烷(均为分析纯),重庆跃翔化工有限公司;FeCl3、FeSO4、水杨酸(均为分析纯),重庆钛新化工有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基(分析纯),上海伊卡生物技术有限公司;三氯乙酸(分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
FA2004A电子天平,上海精天电子仪器有限公司;HH-6数显恒温水浴锅,金坛市富华仪器有限公司;722-P可见分光光度计,上海现科仪器有限公司;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;Avanti J-30I贝克曼冷冻离心机,美国贝克曼库尔特公司;DW-25 W518冰箱,青岛海尔电器有限公司。
1.3 方法
1.3.1 鸭皮类黑精提取工艺的优化
1.3.1.1 鸭皮类黑精提取工艺
鸭皮类黑精提取纯化工艺如下:
卤烤鸭开袋→选取卤烤鸭胸部鸭皮25 g→料理机将鸭皮搅碎→取鸭皮5 g→乙醇溶液提取→提取液经10 000 r/min,10 min离心后取上清液(沉淀蛋白)→二氯甲烷(脱脂)→透析→冷冻干燥→类黑精提取物
参照KANG[17]的方法提纯类黑精,将所得类黑精提取液与脱脂剂二氯甲烷以体积比3∶2的比例混合脱脂2次,对脱脂的溶液进行透析,截留分子质量为12 kDa,时间24 h,15 mL提取液通过1 L蒸馏水透析,间隔4~6 h换水,透析所得产物冷冻干燥后即为高分子质量的类黑精,-18 ℃储存待用。
1.3.1.2 提取剂浓度对提取效果的影响试验
称取5.0 g搅碎的鸭皮(卤烤鸭胸部鸭皮,下同)样品7组,按料液比1∶20(g∶mL)加入100 mL体积分数为0%、10%、20%、30%、40%、60%、80%乙醇溶液,混匀后在室温(25 ℃)静置提取2 h,离心(10 000 r/min,10 min,25 ℃)(下同),取上清液测定其A420值。以AV值表示鸭皮中提取的类黑精含量(下同),计算如公式(1)所示,其中,A420值与类黑精含量呈正相关[5, 18]。
类黑精含量(AV值)=A420×V
(1)
式中:A420,420 nm处的吸光值;V,相对体积比倍数。
1.3.1.3 提取料液比对提取效果的影响试验
称取5.0 g样品6组,按照料液比1∶5、1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL)加入10%乙醇(体积分数)溶液,混匀后室温静置,提取2 h,按1.3.1.2离心后测定。
1.3.1.4 提取时间对提取效果的影响试验
称取5.0 g样品8组,按照料液比1∶20(g∶mL)加入10%(体积分数)乙醇溶液,混匀后室温静置,在提取0、0.5、1、2、3、4、6、9 h后,按1.3.1.2离心后测定。
1.3.1.5 提取温度对提取效果的影响试验
称取5.0 g样品7组,按照料液比1∶20(g∶mL)加入10%(体积分数)乙醇溶液,混匀后在20、30、40、50、60、70、80 ℃静置提取2 h,随后用纯水冷却到室温,按1.3.1.2离心后测定。
1.3.1.6 正交试验设计
为确定卤烤鸭鸭皮类黑精的最佳提取工艺,依据单因素检测结果,以类黑精含量(AV值)为检测指标,以提取剂浓度、提取料液比、提取时间、提取温度为因子,设计了L9(34)正交试验,如表1所示。
1.3.2 卤烤鸭类黑精的抗氧化能力测定
1.3.2.1 样品处理
将提取纯化的类黑精样品配制成0.2、0.4、0.6、0.8、1.0 mg/mL的溶液备用。
1.3.2.2 类黑精清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力测定方法
参照潘牧等[16]的方法有所修改,取各浓度样品2.0 mL分别加入试管中,在各试管加入2 mL 0.4 mmol/L的DPPH·无水乙醇溶液混匀后,室温暗处静置30 min后,在517 nm处测吸光值A1(样品);以pH 6.0、0.2 mol/L的磷酸盐缓冲液代替样品测吸光值为A0(对照);以2 mL无水乙醇代替DPPH自由基无水乙醇溶液测定控制组吸光值A2(控制)。DPPH自由基清除率由公式(2)得出:
DPPH自由基清除率![]()
(2)
式中:A0,空白组吸光值;A1,样品组吸光值;A2,控制组吸光值。
表1 L9(34)正交试验因素水平
Table 1 The factors and levels of L9(34) orthogonal design

水平ABCD提取剂浓度(乙醇体积分数)/%提取料液比(g∶mL)提取时间/h提取温度/℃101∶30340251∶404503101∶50560
1.3.2.3 类黑精还原力测定方法
参照王明慧[19]的方法测定有所修改,准确量取样品1.0 mL于离心管中,分别添加2.0 mL浓度为0.2 mol/L的pH 6.0磷酸缓冲液、2.0 mL浓度为10 g/L的K3Fe(CN)6溶液,混合均匀后静置,于50 ℃水浴中反应20 min,取出后及时用冷水冷却,并添加2.0 mL 100 g/L三氯乙酸溶液,充分混合均匀,离心(3 000 r/min,10 min,25 ℃)。取2.0 mL上清液,加入2.0 mL蒸馏水和1.0 mL 1.0 g/L FeCl3溶液,混合均匀后静置10 min,于700 nm处测定其吸光值A1,以pH 6.0缓冲液代替样品溶液作空白对照A0,还原力由公式(3)得出:
还原力=A1-A0
(3)
式中:A0,空白组的吸光值;A1,样品组的吸光值。
1.3.2.4 类黑精·OH清除能力的测定方法
参照DONG等[20]、WANG等[21]的方法,试管中加入1 mL 9 mmol/L FeSO4溶液和2 mL 9 mmol/L水杨酸乙醇溶液,加入2 mL样品和2 mL 8.8 mmol/L H2O2溶液,室温静置1 h后于510 nm处测定吸光值A1,以pH 6.0缓冲液代替样品作空白A0,不加显色剂H2O2为A2,·OH清除率由公式(4)得出:
·OH清除率![]()
(4)
式中:A0,空白对照吸光值;A1,加样品吸光值;A2,加样品不加H2O2吸光值。
1.3.3 类黑精稳定性的影响因素测定
1.3.3.1 样品处理
将提取纯化的类黑精配制成2 mg/mL的溶液。
1.3.3.2 光照(日光)时间对类黑精稳定性的影响试验
参考张燕等[22]的方法,并作如下修改:取5 mL 2 mg/mL类黑精样品溶液3组,采用日光照射,光照时间分别为0、6、12 h/d,在放置0、2、4、6、8、10、12 d后测定其A420值。
1.3.3.3 pH对类黑精稳定性的影响试验
配置4组5 mL 2 mg/mL的类黑精溶液,将pH分别调整为5、6、7、8,避光放置并分别在0、2、4、6、8、10、12 d后测定其A420值。
1.3.3.4 温度对类黑精稳定性的影响试验
参考张燕等[22]的方法,并作如下修改:取5 mL 2 mg/mL类黑精溶液,分别在温度4、25、40 ℃下恒温放置,避光贮藏放置,于0、2、4、6、8、10、12 d后测定其A420值。
1.3.3.5 还原剂(Na2SO3)对类黑精稳定性的影响试验
参考赵一梦等[13]的方法,并作如下修改:取2 mL 2 mg/mL类黑精样品溶液3组,分别加入等体积浓度为0%、0.05%、0.1% Na2SO3溶液,避光贮藏放置,分别反应0、2、4、6、8、10、12 d后测定其A420值。
1.3.4 数据统计与分析
本试验共重复3次,每次试验重复样设3个,取均值,通过正交设计助手V 3.1设计正交、Excel 2016处理数据、SPSS 20.0分析显著性 (P<0.05)、Origin 2018作图。
2 结果与分析
2.1 卤烤鸭类黑精提取工艺单因素及正交试验结果
2.1.1 提取剂浓度
溶剂提取法是类黑精提取的常用的方法,提取剂一般为水或不同浓度的乙醇溶液,不同溶液浓度对提取效果也有较大影响[23]。由图1可知,当提取剂为纯水时,效果最好,鸭皮类黑精提取量为13.85,乙醇体积分数为10%时提取量为13.62,两者差异不显著(P>0.05),随着乙醇体积分数的增加,卤烤鸭类黑精提取量逐渐降低(P<0.05)。王明慧[19]发现乙醇体积分数10%时,糯米藕中类黑精提取效果最好,且与纯水提取效果无明显差距(P>0.05),与本试验结果基本一致;KIM等[3]指出适当添加乙醇可以提高类黑精在水溶液中的稳定性。因此,试验以体积分数为0%~10%的乙醇溶液为提取溶剂。

图1 乙醇体积分数对鸭皮类黑精提取量的影响
Fig.1 Effect of ethanol volume fraction on the extraction amount of duck skin melanoidin
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
2.1.2 提取料液比
由图2可知,随着料液比的改变,提取出类黑精的量先增加后减少(P<0.05)。当料液比为1∶5时,卤烤鸭类黑精的提取效果最差,当料液比从1∶10增至1∶40时,提取量显著增加(P<0.05),在1∶40时提取出类黑精的量最大,当料液比为1∶50时,提取量降至12.19。原因可能是料液比的提高,使提取剂量变大,加快了溶剂扩散率和传质速率,有助于类黑精的提取,而当料液比继续升高至1∶50,溶剂量过大致使提取效率下降,提取时间会有所延长,且长时间的浸泡,鸭皮中的杂质溶解增多,会阻碍类黑精的溶解。李娜等[24]、于修烛等[25]在优化提取工艺时也有类似发现。因此,在料液比为1∶40(g∶mL)时,类黑精有最大提取量。
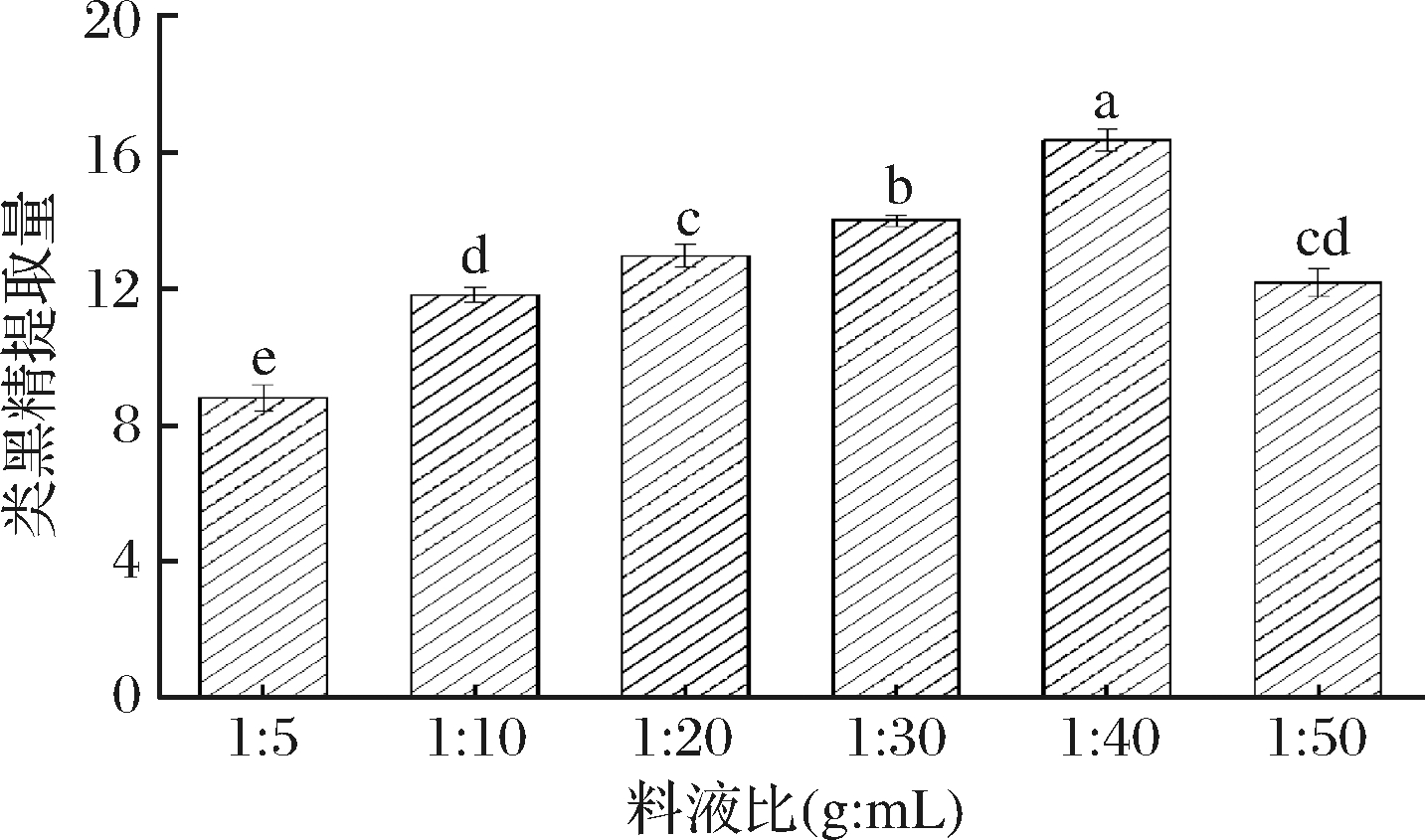
图2 料液比对鸭皮类黑精提取量的影响
Fig.2 Effect of ratio of solid to liquid on the extraction amount of duck skin melanoidin
2.1.3 提取时间
由图3可知,提取0.5、1 h类黑精的提取量分别为10.85、11.01,差异不显著(P>0.05),当时间延长至 2、3 h时,提取量上升到13.66、13.93,提取时间在4 h时,类黑精提取量有最大值16.55,提取时间为6、9 h时,提取量有所降低,为14.57、12.88。综上,随着提取时间的延长,提取量先升高后下降,有显著差异(P<0.05)。原因可能是随着提取时间的延长,提取剂溶解杂质的含量增加,使得类黑精提取出的含量降低[26],李娜等[24]认为长时间提取使乙醇溶剂挥发而造成溶剂量减少,也会使类黑精的提取率下降。因此,在提取时间为4 h时,类黑精有最大提取量。
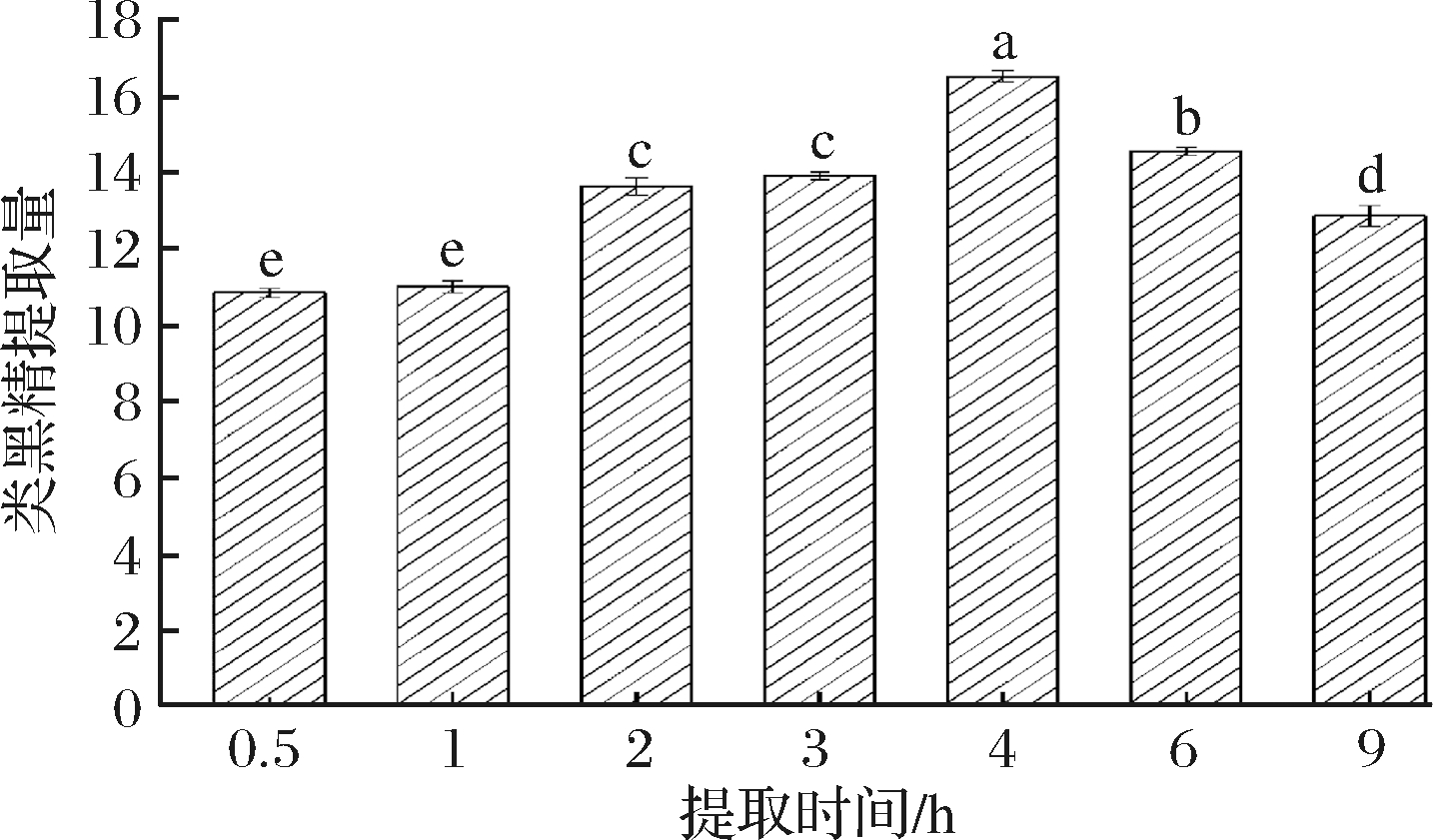
图3 提取时间对鸭皮类黑精提取量的影响
Fig.3 Effect of extraction time on the extraction amount of duck skin melanoidin
2.1.4 提取温度
如图4所示,随着提取温度的提高,鸭皮类黑精提取量先升后降(P<0.05)。在25 ℃时,类黑精提取量仅为4.96,效果最差,在40 ℃时,提取效果显著增强(P<0.05),当温度升高到50 ℃,提取量有最大值14.47(P<0.05),当温度继续提升至60、70、80 ℃时,类黑精的提取量逐渐降低(P<0.05)。原因可能是在25~50 ℃,随着温度升高,提高了产物的溶解度和扩散速度,促使提取效率提高[27],而当温度继续升高时,易造成破坏类黑精的原有结构,导致其分解、转换或挥发散失[19]。因此,类黑精提取量在提取温度为50 ℃时达到最大。

图4 提取温度对鸭皮类黑精提取量的影响
Fig.4 Effect of extraction temperature on the extraction amount of duck skin melanoidin
2.1.5 正交试验结果
基于单因素试验,进行L9(34)正交试验,试验结果如表2、3所示。在所测范围内,提取剂浓度、提取温度对提取效果影响显著(P<0.05),其影响强弱顺序为:A>D>C>B;最佳组合为:A2B2C2D3,即体积分数5%的乙醇溶液、料液比为1∶40、提取时间4 h、提取温度60 ℃,按该提取条件进行验证,测得类黑精提取量为19.13,结果高于正交表中任意组合,说明在该组合条件下提取效果最佳。
表2 正交试验结果
Table 2 The results of orthogonal experiment
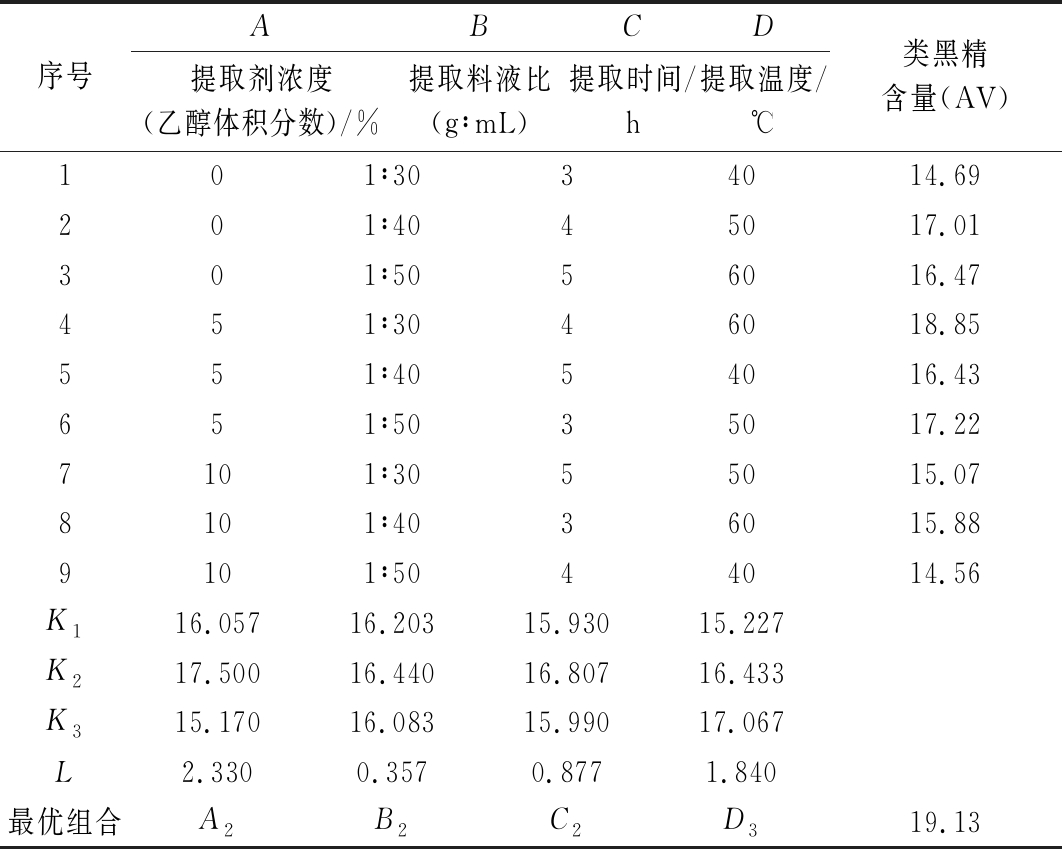
序号ABCD提取剂浓度(乙醇体积分数)/%提取料液比(g∶mL)提取时间/h提取温度/℃类黑精含量(AV)101∶3034014.69201∶4045017.01301∶5056016.47451∶3046018.85551∶4054016.43651∶5035017.227101∶3055015.078101∶4036015.889101∶5044014.56K116.05716.20315.93015.227K217.50016.44016.80716.433K315.17016.08315.99017.067L2.3300.3570.8771.840最优组合A2B2C2D319.13
表3 方差分析结果
Table 3 The result of analysis of variance
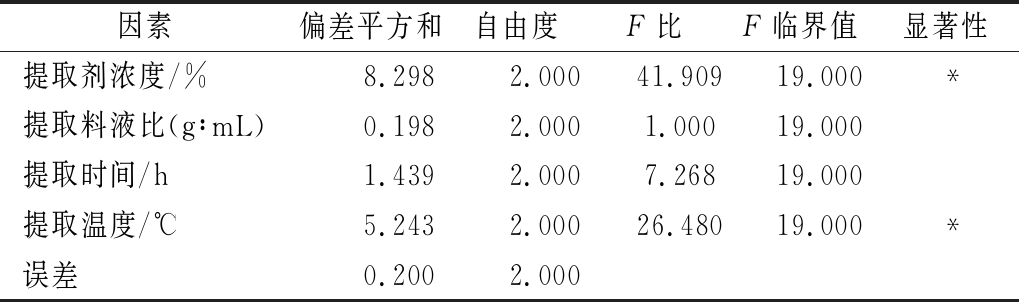
注:*表示在P=0.05 水平下显著相关
因素偏差平方和自由度F比F临界值显著性提取剂浓度/%8.2982.00041.90919.000*提取料液比(g∶mL)0.1982.0001.00019.000提取时间/h 1.4392.0007.26819.000提取温度/℃ 5.2432.00026.48019.000*误差 0.2002.000
2.2 卤烤鸭鸭皮类黑精的抗氧化能力
2.2.1 卤烤鸭鸭皮类黑精的DPPH自由基清除能力
DPPH自由基常被用来评价抗氧化剂对自由基的清除能力[28]。如图5所示,鸭皮类黑精具有一定的DPPH自由基清除能力且与浓度呈现剂量依赖关系,在0.2~1.0 mg/mL质量浓度范围内,DPPH自由基清除能力随着浓度的升高显著增强(P<0.05);当浓度为1.0 mg/mL时,DPPH自由基清除能力为55.30%。但与同浓度抗坏血酸(VC)95.81%的DPPH自由基清除能力差距较大。综上,鸭皮类黑精有一定的DPPH自由基清除能力。
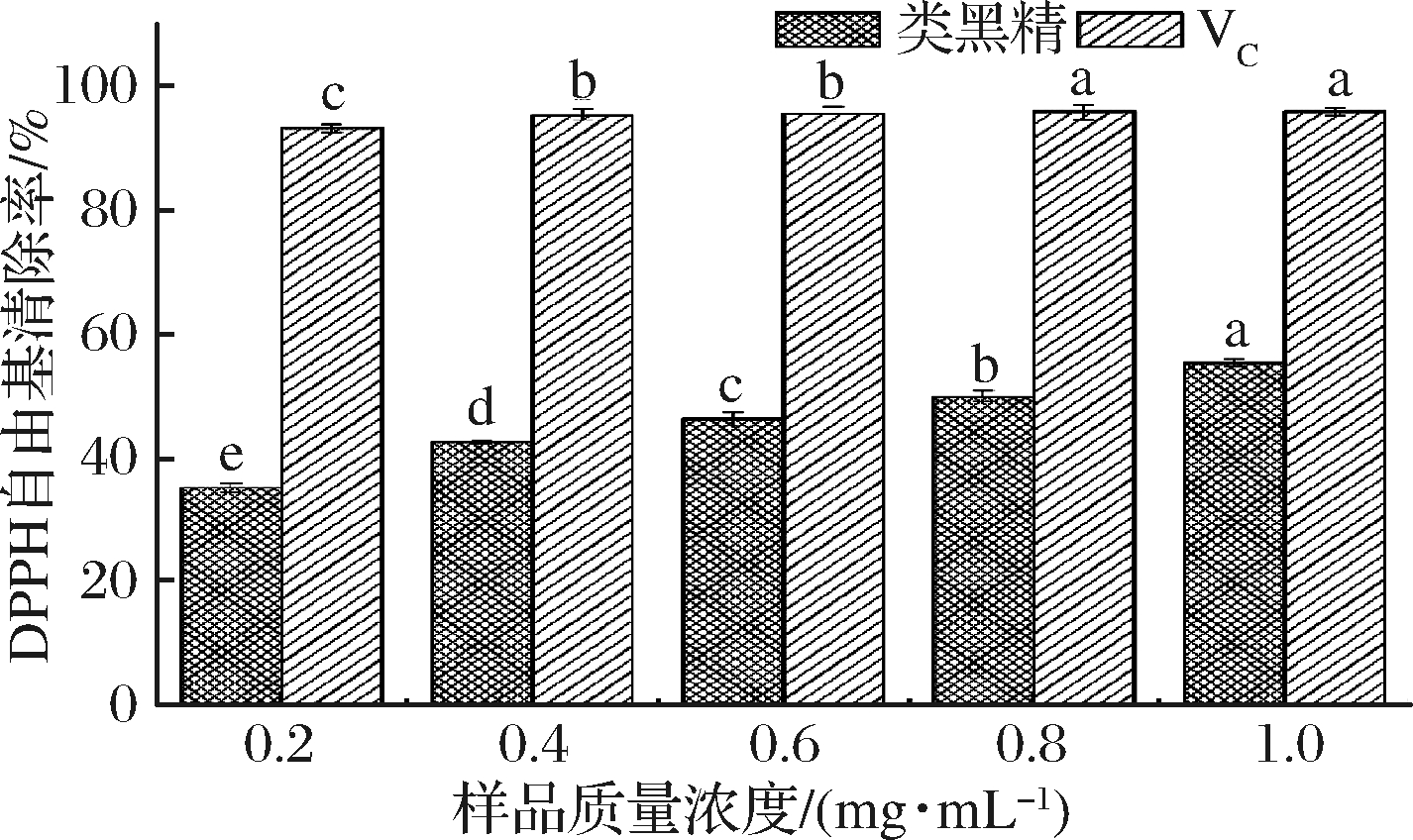
图5 不同浓度鸭皮类黑精的 DPPH·清除能力
Fig.5 DPPH· scavenging ability of melanoidin from duck skin at different concentrations
注:图中不同字母表示同一时间不同试验组差异显著(P<0.05)(下同)
2.2.2 卤烤鸭鸭皮类黑精的还原能力
总还原力是评价抗氧化活性的常用指标,有抗氧化性的物质会提供电子供体,将Fe3+还原成 Fe2+,阻止自由基链式反应[29]。由图6可知,当类黑精质量浓度为0.2 mg/mL时,还原力为0.089;当质量浓度增加至0.4、0.6、0.8 mg/mL时,还原力随之增大至0.156、0.226、0.287;当质量浓度增至1.0 mg/mL时,还原力达到最大值0.355,样品浓度不同,还原力差异显著(P<0.05)。但均显著低于同浓度抗坏血酸的还原力(P<0.05)。因此,鸭皮的类黑精有一定的还原力,并随浓度的增加显著增加(P<0.05)。

图6 不同浓度鸭皮类黑精还原能力
Fig.6 Reduction capacity of melanoidin in duck skins at different concentrations
2.2.3 卤烤鸭鸭皮类黑精的·OH清除能力
·OH清除能力也是反映抗氧化活性的重要指标,水杨酸法通过加入具有抗氧化性的样品消耗Fenton反应生成·OH,减少2,3-二羟基苯甲酸的生成。由图7可知,随着鸭皮类黑精的浓度的增加,·OH清除能力显著增强(P<0.05)。当质量浓度为0.2、0.4 mg/mL时,其·OH清除能力为3.84%、5.26%,当质量浓度增加至1.0 mg/mL,·OH清除能力显著增强(P<0.05),为22.65%。但与常见的抗氧化物质抗坏血酸的·OH清除能力差距较大(P<0.05)。综上,鸭皮类黑精具有一定的·OH清除能力,并随浓度得增大而增强。
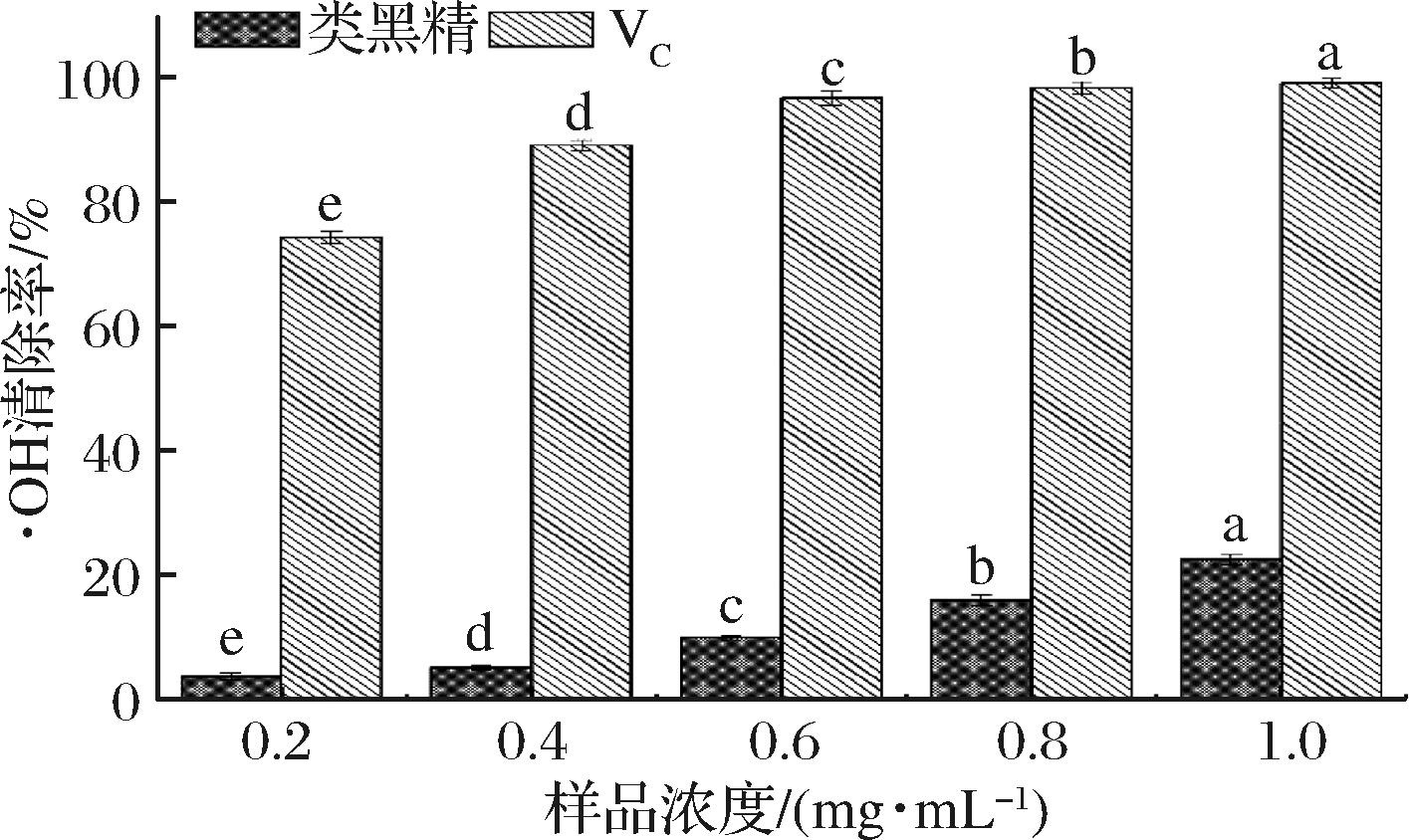
图7 不同浓度鸭皮类黑精的·OH清除能力
Fig.7 ·OH scavenging capacity of duck skin melanoidin with different concentrations
2.3 卤烤鸭类黑精在贮藏过程中的变化
类黑精是Maillard反应产生的一类深褐色高分聚合物,其含量的减少与卤烤鸭色泽衰退有关系密切。KIM等[3]、BEKEDAM[30]均表示类黑精含量与吸光度成正比,420 nm处的吸光度常用来表示类黑精含量。由图8可知,随着贮藏时间的延长,卤烤鸭鸭皮中类黑精吸光度A420先增加后减小(P<0.05)。鸭皮类黑精的A420初始值为0.440,类黑精的A420增加至0.495,这一结果与卤烤鸭贮藏0~2个月黑褐色加深的实际相符,原因可能是在贮藏过程中Maillard反应继续进行,有新的类黑精生成。贮藏2个月时,类黑精的A420减小至0.423,与初始值差异不显著(P>0.05),贮藏时间超过3个月后,类黑精的吸光度A420继续减小,贮藏时间延长至6个月时,类黑精的A420值减至最小值0.307。该试验结果与卤烤鸭的色泽贮藏初期有所加深,2~3个月后色泽明显劣变为棕黄色的实际相符。以上说明类黑精含量的降低是卤烤鸭色泽劣变存在一定相关性,提高鸭皮类黑精在贮藏过程中的稳定性有利于稳定其特有的黑褐色[31]。

图8 贮藏过程中类黑精含量的变化
Fig.8 Changes of Melanoidin content during storage
2.4 卤烤鸭类黑精的稳定性研究
2.4.1 日光光照时间
由图9可知,随着放置时间的延长, 3个组别类黑精的吸光度均逐渐较小。初始时,无光照、6 h/d光照、12 h/d光照类黑精的吸光度分别为0.408、0.405、0.405,无明显差异(P>0.05);放置2 d后无光照处理组与6 h/d光照、12 h/d光照处理组差异显著(P<0.05);放置3 d后3个试验组之间有明显差异(P<0.05),随着时间的延长,差异继续增大;放置时间延长至12 d后,无光照、6 h/d光照、12 h/d光照3个试验组类黑精的吸光度分别下降12.25%、29.24%、38.65%,下降幅度依次是12 h/d光照组>6 h/d光照组>无光照组。由此说明,日光对类黑精的稳定性有不利影响,且随着光照时间的延长,对类黑精的结构的破坏程度增强。此结果与赵一梦等[13]研究结果基本一致。因此,为延缓色泽劣变,卤烤鸭在流通、贮藏过程中应注意避光。
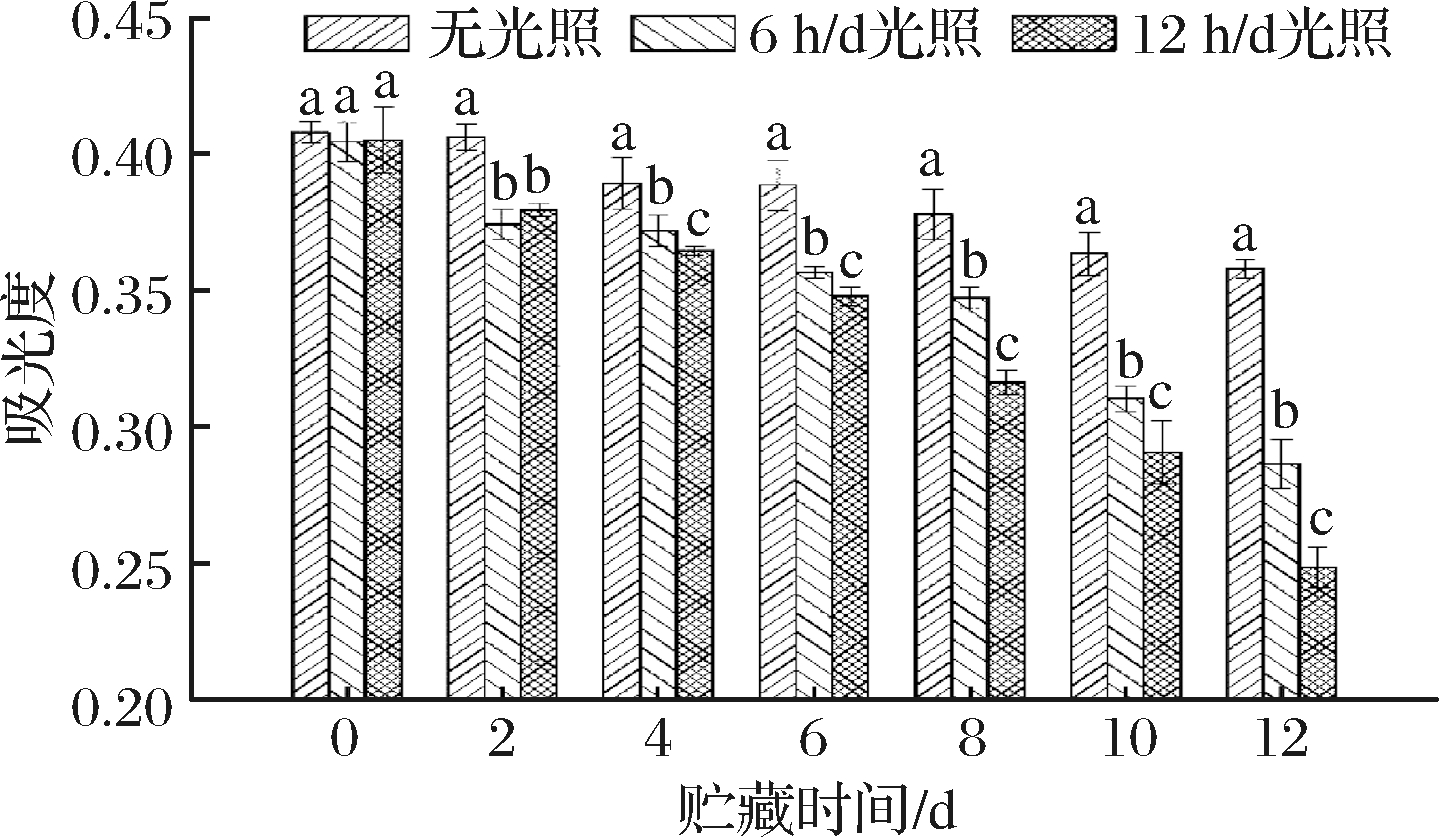
图9 光照对类黑精稳定性的影响
Fig.9 Effect of light on stability of melanoidin
2.4.2 pH
由图10可知,随着放置时间的延长,pH 5、pH 6、pH 7试验3个试验组的类黑精的吸光度均呈逐渐减小的趋势,减小的幅度依次是pH 5>pH 6>pH 7,pH值为8的试验组吸光度稳定在0.39~0.41,变化较小。放置0~2 d时间内,4个pH试验组类黑精的吸光度差异不显著(P>0.05),放置时间4~8 d内,pH值为5的试验组类黑精的吸光度与其他3个试验组出现显著差异(P<0.05),放置时间延长至12 d时,4个pH试验组之间的类黑精吸光度差异显著(P<0.05)。由此说明,pH值对鸭皮类黑精的稳定性有一定影响,且稳定性顺序为pH 8>pH 7>pH 6>pH 5。时川[11]研究黑变红枣枣皮类黑精稳定性时,发现类黑精在中性及弱碱性条件下比较稳定,与本试验结果相同。
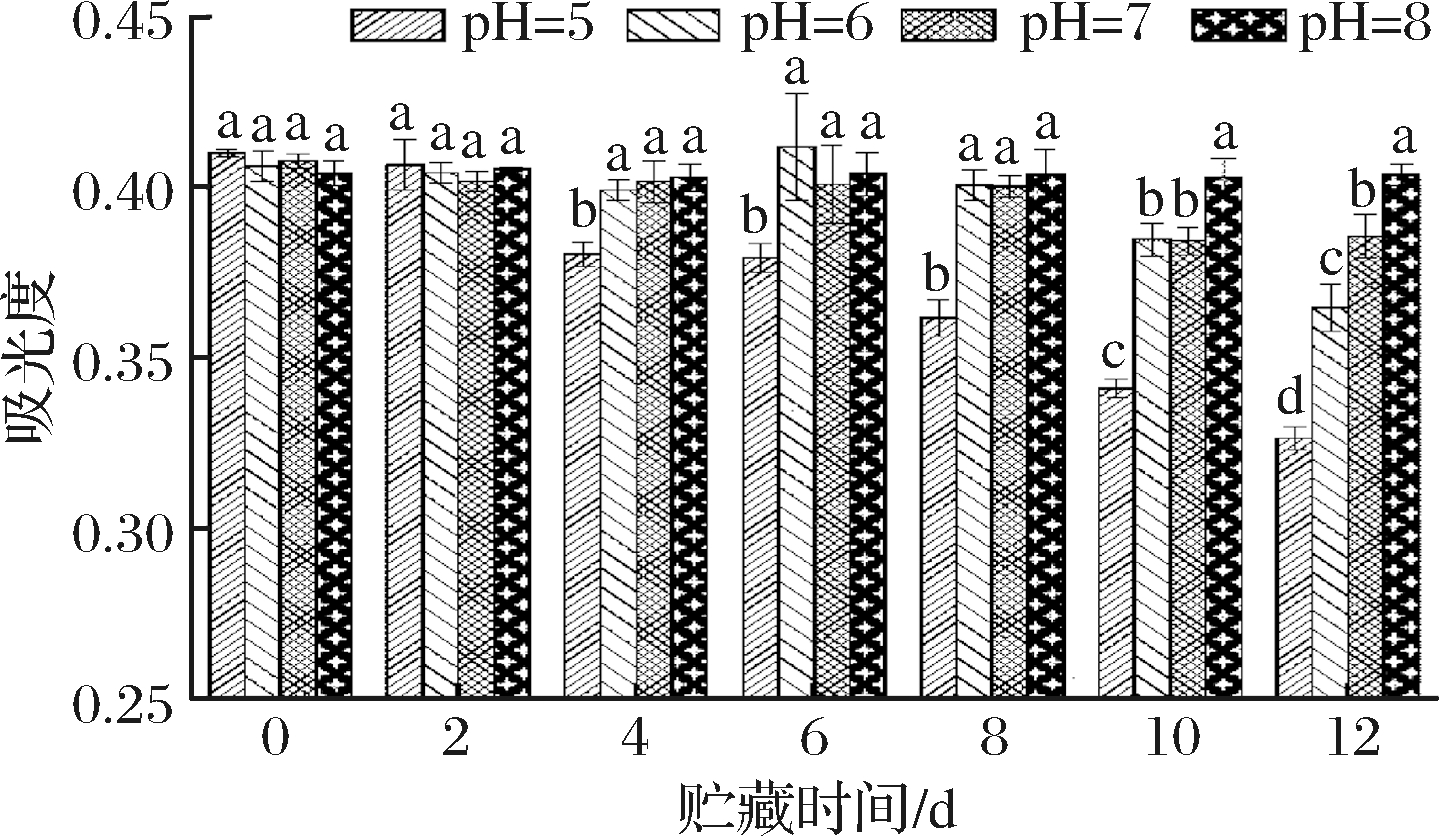
图10 pH对类黑精稳定性的影响
Fig.10 Effect of pH on stability of melanoidin
2.4.3 温度
如图11所示,随着放置时间的延长,4、25、40 ℃ 3个试验组类黑精的吸光度均呈现逐渐减小的趋势,25、40 ℃试验组降幅较大,4 ℃试验组降幅较小。初始时,4、25、40 ℃试验组的体系吸光度均在0.401左右,差异不大(P>0.05);0~4 d内,各试验组的吸光度具有小幅降低,但各组之间未出现明显差异(P>0.05);6 d后,各组吸光度逐渐增大;直至12 d时,4、25、40 ℃试验组类黑精的吸光度分别降低了2.8%、11.45%、22.08%,各组之间差异明显(P<0.05)。由此表明,温度对卤烤鸭鸭皮类黑精的稳定性有一定影响,低温有利于提高类黑精的稳定性,原因可能是低温抑制了鸭皮中类黑精的氧化降解。因此,降低贮藏温度对延缓卤烤鸭产品色泽劣变有一定延缓作用。
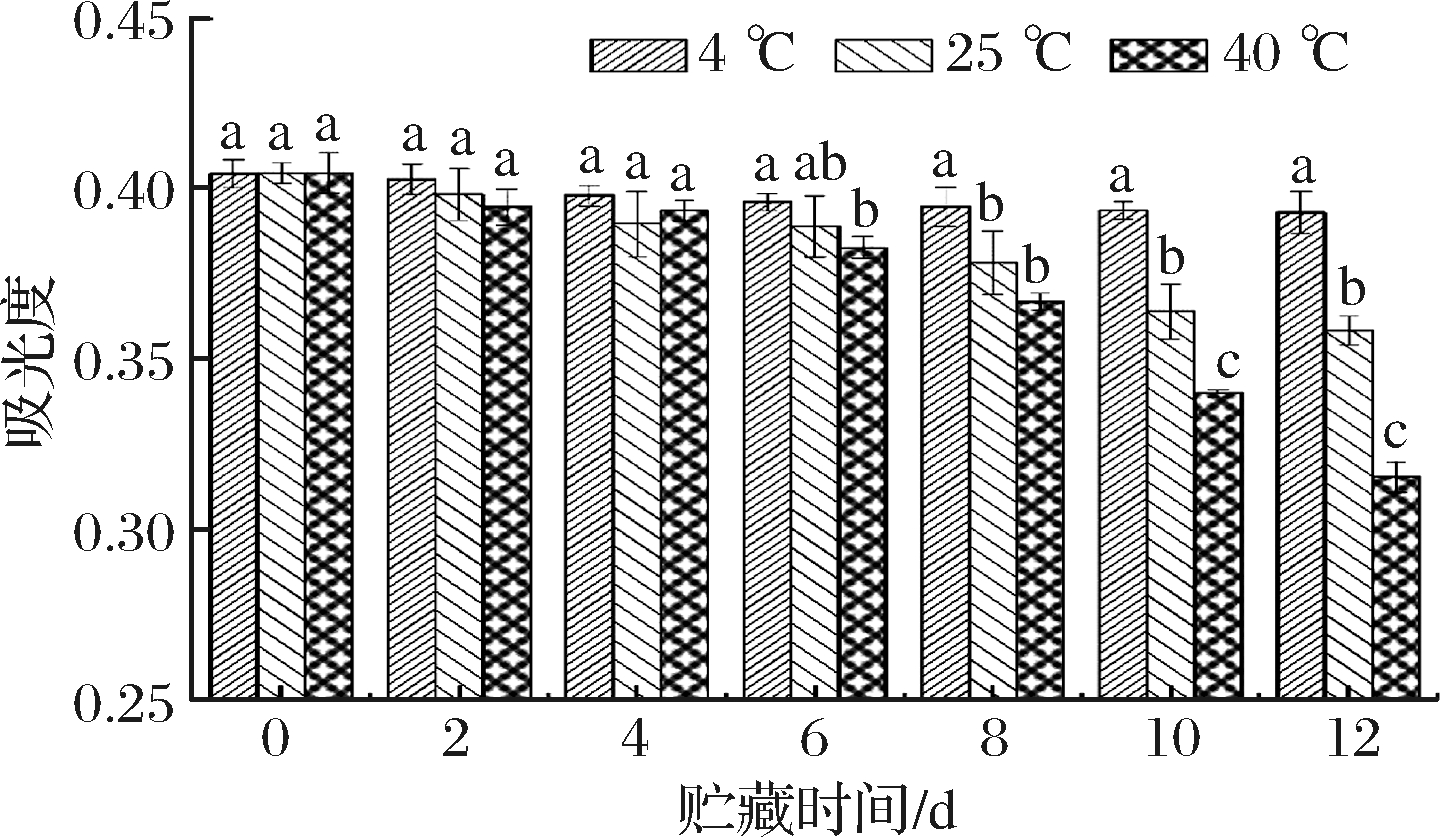
图11 温度对类黑精稳定性的影响
Fig.11 Effect of temperature on stability of melanoidin
2.4.4 还原剂(Na2SO3)
如图12所示,随着放置时间的延长,3个组别类黑精吸光度均呈现逐渐减小的趋势。初始时,3个还原剂试验组的体系吸光度均在0.317左右,差异不大(P>0.05);0~2 d,虽有小幅降低,但未出现明显差异(P>0.05);3~6 d,0.05%、0.10% Na2SO3两个还原剂试验组之间差异不明显(P>0.05),但与对照组有明显差异(P<0.05),直至6 d,0.00%、0.05%、0.10% Na2SO3三个还原剂试验组类黑精吸光度分别降至0.272、0.282、0.288。由此说明,添加还原剂(Na2SO3)可以提高对鸭皮中类黑精的稳定性。

图12 还原剂(Na2SO3)对类黑精稳定性的影响
Fig.12 Effect of reducing agent (Na2SO3) on stability of melanoidin
3 结论
本研究发现,卤烤鸭中类黑精提取的最佳参数为:提取溶剂为5%(体积分数)乙醇、料液比为1∶40(g∶mL)、提取时间4 h、提取温度60 ℃。经过测定,发现鸭皮类黑精具有较强DPPH自由基清除能力,一定的还原力及·OH清除能力,且与浓度显著正相关,但其抗氧化能力弱于VC。随着贮藏时间的增加,卤烤鸭鸭皮中的类黑精含量呈现先升高后降低的趋势,且在贮藏1个月后达到最大值。光照时间(日光)、温度、pH、还原剂(Na2SO3)对卤烤鸭鸭皮中类黑精的稳定性均有一定影响,为提高类黑精的稳定性,延缓色泽劣变,应避免日光照射、降低贮藏温度、调节pH至中性或弱碱性以及适当添加还原剂。
卤烤鸭中的类黑精在卤烤过程产生,可赋予其良好色泽与风味,具有一定的抗氧化活性,外部条件对类黑精稳定性有一定影响,其含量的变化与卤烤鸭色泽的改变关系密切。本研究为探究熟肉制品类黑精的提取工艺与应用提供了理论依据和技术方法。关于卤烤鸭类黑精的结构与其他活性,有待于进一步研究。
[1] STAROWICZ M, ZIELINSKI H.How Maillard reaction influences sensorial properties(color, flavor and texture) of food products?[J].Food Reviews International,2019, 35(8):707-725.
[2] YOO J H, KIM J W, YONG H I,et.al.Effects of searing cooking on sensory and physicochemical properties of beef steak[J].Food Science of Animal Resources,2020, 40(1):44-54.
[3] KIM J.Antioxidant activity of maillard reaction products derived from aqueous and ethanolic glucose-glycine and its oligomer solutions[J].Food Science and Biotechnology,2013, 22(1):39-46.
[4] YU X Y, ZHAO M G, LIU F,et.al.Antioxidants in volatile Maillard reaction products:Identification and interaction[J].LWT-Food Science And Technology,2013, 53(1):22-28.
[5] 钱建亚, 刘靖.美拉德反应产物的抗突变作用[J].食品科学,1997(8):11-13.
QIAN J Y,LIU J.Anti-mutation effect of Maillard reaction products[J]Food Science,1997(8):11-13.
[6] 王忠合, 王军, 胡慧娟.模式类黑精及其分级产物清除自由基能力、抗氧化性及还原力分析[J].食品与发酵工业,2016, 42(1):92-96.
WANG Z H,WANG J,HU H J.Analysis of free radical-scavenging and reducing ability of melanoidins and its fractions[J] Food and Fermentation Industries,2016, 42(1):92-96.
[7] RUFIAN-HENARES A, MORALES F J.Functional properties of melanoidins:In vitro antioxidant, antimicrobial and antihypertensive activities[J].Food Research International,2007, 40(8):995-1 002.
[8] 周小理, 张晓菁, 唐文,等.几种美拉德反应产物对人脐静脉内皮细胞增殖的影响[J].食品科学,2011, 32(15):281-284.
ZHOU X L, ZHANG X J, TANG W, et.al.Effects of several kinds of Maillard reaction products on the proliferation of human umbilical veinendothelial cells[J].Food Science,2011, 32(15):281-284.
[9] RUFI N-HENARES J A, MORALES F J.A new application of a commercial microtiter plate-based assay for assessing the antimicrobial activity of Maillard reaction products[J].Food Research International,2006, 39(1):33-39.
N-HENARES J A, MORALES F J.A new application of a commercial microtiter plate-based assay for assessing the antimicrobial activity of Maillard reaction products[J].Food Research International,2006, 39(1):33-39.
[10] HUANG X Q, TU Z C, XIAO H, et al.Characteristics and antioxidant activities of ovalbumin glycated with different saccharides under heat moisture treatment[J].Food Research International,2012, 48(2):866-872.
[11] 时川. 黑变红枣枣皮类黑精的提取与稳定性研究 [D].泰安:山东农业大学, 2019.
SHI C.Study on the extraction and stability of blacken jujube peel melanoidin[D].Taian:Shandong Agricultural University,2019.
[12] 张会娟, 邱聪, 田青, 等.黄酒类黑精的提取、成分及光谱特性研究[J].河南工业大学学报(自然科学版),2016, 37(4):57-62.
ZHANG H J, QIU C, TIAN Q, et.al.Extraction, composition and spectral properties of melanoidins from chinese rice wine[J].Journal of Henan University of Technology (Natural Science Edition),2016, 37(4):57-62.
[13] 赵一梦, 丁彦方, 邓云.黑蒜类黑精高静水压辅助提取工艺及其抗氧化性和稳定性研究[J].上海交通大学学报(农业科学版),2019, 37(5):76-82.
ZHAO Y M, DING Y F, DENG Y.Optimization of high hydrostatic pressure assisted extraction of melanoidins from black garlic and its anti-oxidation and stability [J] Journal of Shanghai Jiaotong University(Agricultural Science),2019, 37(5):76-82.
[14] 郑金德. 啤酒类黑精及其抗氧化活性的初步研究 [D].广州:华南理工大学, 2017.
ZHENG J D.Preliminary study on beer melanoidinsand its antioxidant activity[D].Guangzhou:South China University of Technology,2017.
[15] LEE W, PARK S H, LEE S Y,et al.Increase in antioxidant effect of ginsenoside re-alanine mixture by Maillard reaction[J].Food Chemistry,2012, 135(4):2 430-2 435.
[16] 潘牧, 陈超, 雷尊国,等.马铃薯蛋白质酶解前后抗氧化性的研究[J].食品工业,2012, 33(10):102-104.
PAN M, CHEN C, LEI Z G, et.al.Study on the change of antioxidant of potato before and after enzymolysis[J].Food Industry,2012, 33(10):102-104.
[17] KANG O J.Evaluation of melanoidins formed from black garlic after different thermal processing steps[J].Preventive Nutrition and Food Science,2016, 21(4):398-405.
[18] HAYASE F, USUI T, WATANABE H.Chemistry and some biological effects of model melanoidins and pigments as Maillard intermediates[J].Molecular Nutrition & Food Research,2006, 50(12):1 171-1 179.
[19] 王明慧. 糯米藕非酶褐变及其产物的分离、初步鉴定和抗氧化研究与褐变控制 [D].南京:南京农业大学, 2015.
WANG M H.Purification, preliminary structure identificantion and antioxidant activity of products derived from non-enzymatic browning in lotus root filled with sticky rice and control of non-enzymatic browning[D]Nanjing:Nanjing Agricultural University,2015.
[20] DONG S Y, PANYA A, ZENG M Y,et.al.Characteristics and antioxidant activity of hydrolyzed beta-lactoglobulin-glucose Maillard reaction products[J].Food Research International,2012, 46(1):55-61.
[21] WANG W Q, BAO Y H, CHEN Y.Characteristics and antioxidant activity of water-soluble Maillard reaction products from interactions in a whey protein isolate and sugars system[J].Food Chemistry,2013, 139(1-4):355-361.
[22] 张燕, 张洪斌, 王和飞.圣女果色素稳定性研究[J].农产品加工,2018(15):13-15;18.
ZHANG Y, ZHANG H B, WANG H F.Study on the stability of the pigment of Lycopersionesculentum Mill.[J].Farm Products Processing,2018, (15):13-15;18.
[23] 温丹华, 李鑫, 黄登宇.食品中类黑精的研究进展[J].食品安全质量检测学报,2018, 9(9):2 004-2 009.
WEN D H, LI X, HUANG D Y.Research progress on melanoidins in food [J].Journal of Food Safety and Quality,2018, 9(9):2 004-2 009.
[24] 李娜, 董明, 张国庆,等.响应面法优化榴莲皮中总黄酮的提取工艺[J].食品工业科技,2011, 32(9):325-328;332.
LI N, DONG M, ZHANG G Q, et.al.Optimization of extraction of total flavonoids from durian shell by response surface methodology [J].Science and Technology of Food Industry,2011, 32(9):325-328;332.
[25] 于修烛, 李志西, 杜双奎.苹果籽油超声波辅助浸提及产品理化特性研究[J].农业工程学报,2005(9):155-159.
YU X Z, LI Z X, DU S K.Ultrasonic extraction of apple seed oil and its physical-chemical properties [J].Transactions of the CSAE,2005(9):155-159.
[26] 廖建民, 张瑾, 沈子龙.超声波法提取海带多糖的研究[J].药物生物技术,2002(3):157-160.
LIAO J M, ZHANG J, SHEN Z L.Extraction of laminaran by supersonic method[J].Pharmaceutical Biotechnology,2002(3):157-160.
[27] 娄涛涛, 金玲, 陀扬凌,等.Box-Behnken响应面法优化水浴恒温浸提法提取黑果枸杞色素工艺研究[J].亚太传统医药,2016, 12(3):31-36.
LOU T T, JIN L, TUO Y L,et,al.Optimization of extraction technique of pigment from Lycium ruthenicum murr by central composite design and response surface methodology[J].Asia-Pacific Traditional Medicine,2016, 12(3):31-36
[28] 潘瑶, 郑时莲, 邹兴平,等.葡萄、芒果、草莓乙醇提取物抗氧化活性组分分析及其抗氧化相互作用[J].食品科学,2017, 38(4):133-140.
PAN Y,ZHENG S L,ZHOU X P,et al.Analysis of antioxidant compounds in ethanol extracts of grape,mango and strawberry and their interactions[J]Food Science,2017, 38(4):133-140.
[29] 项惠丹, 许时婴, 王璋.蛋白质与还原糖美拉德反应产物的抗氧化活性[J].食品科学,2008,29(7):52-57.
XIANG H D, XU S Y, WANG Z.Antioxidant activities of maillard reaction products of protein and reducing sugar[J] Food Science,2008,29(7):52-57.
[30] BEKEDAM E K, SCHOLS H A, VAN B M A J S,et al.High molecular weight melanoidins from coffee brew[J].Journal of Agricultural and Food Chemistry,2006, 54(20):7 658-7 666.
[31] 谢凡. 烤鸭中美拉德反应的研究 [D].上海:上海应用技术学院, 2015.
XIE F.Study of maillard reaction in roast duck[D].Shanghai:Shanghai Institute of Technology,2015.