滁菊属菊科,主要产于安徽省滁州地区,为“四大皖药”之一。滁菊既可入药也可制茶,《本草纲目拾遗》中记载,利用滁菊制作药枕可缓解头痛眩晕症状。现代药理检测分析表明,滁菊富含黄酮、挥发油、氨基酸和微量元素,其挥发油中桉叶油素、龙脑、桉叶二烯酮明显高于其他菊花[1];硒含量为其他菊花的8~40 倍,黄酮含量比其他菊花高32%~61%[2-3]。我国滁菊食用历史悠久,至今延用着以干花冲泡为主的传统方式。但干花冲泡功效成分提取率低、热损失大,脂溶性成分流失严重[4-5]。传统、单一的食用形式限制了滁菊的有效利用。
本研究以滁菊为原料、以白酒为浸泡基酒,以低聚半乳糖作为甜味剂,采用低温超声萃取技术,研制了富含黄酮低度滁菊浸泡酒。本研究创新之处在于(1)低温超声萃取能够在提高浸提效率的同时较好地保持成分功效;(2)以基酒作为溶剂对原料进行一站式浸提,消除了传统工艺中有机溶剂挥发及废液排放所导致的环境污染;(3)产品酒精度低、肠道刺激作用小,能够在加速血液循环的同时促进成分吸收[6];(4)低聚半乳糖作为甜味剂具有改善口感和营养强化双重功效[7-8]。本研究为滁菊的食用开发提供了理论参考与技术支撑。
滁菊,安徽滁州滁菊研究所提供;42°牛栏山二锅头(桶装,酒精度42%vol),北京顺鑫农业股份有限公司牛栏山酒厂;低聚半乳糖(食品级)、芦丁标准品,上海源叶生物科技有限公司;对照样品,均为市售。
乙醇、NaNO2、Al(NO3)3、NaOH、铁氰化钾、三氯乙酸、Tris-HCl溶液、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻苯三酚、抗坏血酸、氯化高铁(均为分析纯),乙腈、甲醇、异丙醇(均为色谱纯),国药集团化学技术有限公司。
L3S紫外分光光度计,上海精密科学仪器有限公司;FA2204B电子天平,上海越平科学仪器有限公司;30-70酒精计,武强县新林仪器仪表有限公司;K400L电子舌,上海昂申有限公司;EC2000高效液相色谱(high performance liquid chromatography,HPLC)仪,大连依利特分析仪器有限公司;3300型蒸发光散射检测器(evaporative light-scattering detector,ELSD),大连依利特分析仪器有限公司;UWave-1000微波·紫外·超声波三位一体合成萃取反应仪,上海新仪微波化学科技有限公司;UP300-EUVF超纯水机,上海和泰仪器有限公司。
1.3.1 低度滁菊浸泡酒工艺流程及操作要点
低度除菊浸泡酒制作工艺流程如下:
滁菊干花→基酒预浸泡→低温超声萃取→静置浸泡→降度→过滤→调配(添加低聚半乳糖)→杀菌→包装→成品
操作要点如下:
(1)原料预处理
筛选完整干花、无腐烂变质。
(2)预浸泡
滁菊干花∶基酒=1∶50 (g∶mL),基酒酒精度为42%vol,预浸泡时长60 h。
(3)低温超声萃取
冰浴(0 ℃)条件下超声(160 W,工作3 s停3 s)萃取,总工作时长25 min。
(4)降度
静置48 h后过滤,将滤液按公式(1)降度得低度浸泡酒产品:
基酒体积×基酒酒精度=降度酒体积×降度酒酒精度
(1)
(5)调味
添加50 mg/mL低聚半乳糖于低度滁菊浸泡酒中搅拌混匀。
(6)杀菌,灌装
采用87 ℃高压灭菌20 min,待冷却至室温后灌装。
1.3.2 工艺优化
根据超声时间、超声波功率、料液比及浸泡时间单因素试验结果,设计L9(34)正交试验对工艺进行优化。因素水平如表1所示。
表1 滁菊浸泡酒工艺正交试验设计
Table 1 The Chuzhou chrysanthemum-soaked liquor process factors orthogonal test
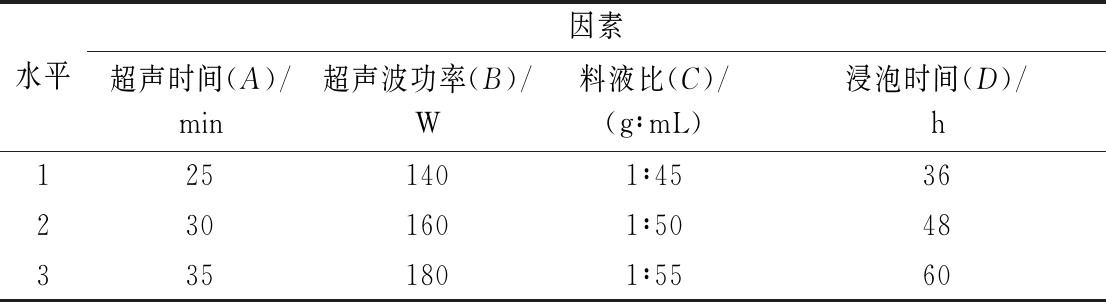
水平因素超声时间(A)/min超声波功率(B)/W料液比(C)/(g∶mL)浸泡时间(D)/h1251401∶45362301601∶50483351801∶5560
1.4.1 总黄酮含量测定
称取芦丁标准品3.0 mg,用60%(体积分数)乙醇定容至10 mL。取6支10 mL容量瓶,分别取标准品溶液0、0.5、1.0、1.5、2.0和2.5 mL进行编号。量取60%乙醇溶液2.4 mL,0.7 mol/L NaNO2溶液0.4 mL,混匀静置6 min后,加入1 mol/L NaOH溶液4 mL,再以60%乙醇定容,反应15 min。在λ=508 nm波长处测定吸光值。以质量浓度(mg/mL)为y轴,吸光值为x轴绘制标准曲线。
取1 mL待测样品,按照上述步骤测得吸光值带入标准曲线得总黄酮质量,并按公式(2)计算样品总黄酮含量[9]:
总黄酮含量![]()
(2)
1.4.2 DPPH自由基清除率测定
取10 mL离心管,按照表2所示,体系移取试剂并混匀。避光反应0.5 h后以无水乙醇为空白对照,在λ=517 nm处测吸光值,代入公式(3)计算DPPH自由基清除率[10-11]。
表2 DPPH自由基清除率测定体系
Table 2 Determination system of DPPH free radical scavenging rate
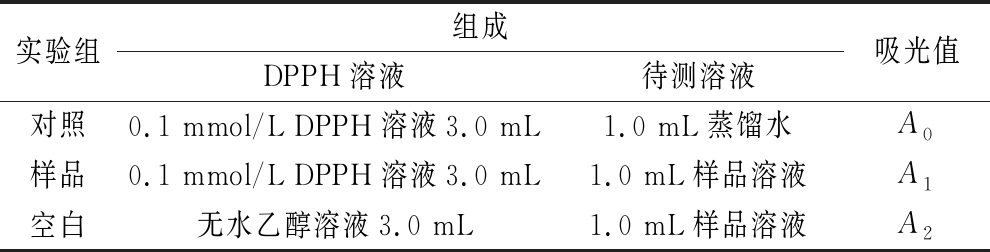
实验组组成DPPH溶液待测溶液吸光值对照0.1 mmol/L DPPH溶液3.0 mL 1.0 mL蒸馏水A0样品 0.1 mmol/L DPPH溶液3.0 mL1.0 mL样品溶液A1空白无水乙醇溶液3.0 mL1.0 mL样品溶液A2
(3)
1.4.3 超氧阴离子自由基![]() 清除率测定[12]
清除率测定[12]
按照表3所示,反应体系移取各组分并迅速混匀,在λ=320 nm下每隔30 s扫描读取吸光值,总时长3 min。以线性范围内,1 min吸光值增值(ΔA)作为自氧化速率,按公式(4)计算超氧阴离子自由基清除率。
表![]() 清除率测定体系
清除率测定体系
Table 3 Determination system of superoxide anion free radical scavenging rate

实验组体系组成/mLTris-HCl (pH=8.2)重蒸水3 mol/L邻苯三酚待测溶液氧化速率空白4.54.20.30S空白样品4.53.20.31.0S样品
![]() 清除率
清除率![]()
(4)
式中:S空白为邻苯三酚自氧化速率;S样品为样品自氧化速率。
1.4.4 总还原能力测定
取1 mL待测样品加入0.2 mol/L磷酸盐缓冲液(pH 6.6) 2.5 mL,30 mmol/L 铁氰化钾溶液2.5 mL。50 ℃保温20 min后,加入0.6 mol/L三氯乙酸溶液2.5 mL混匀,650 r/min离心10 min。取上清液2.5 mL,加去离子水2.5 mL,4 mmol/L氯化高铁溶液0.5 mL混匀。测定λ=700 nm处吸光值[12]。
1.4.5 低聚半乳糖测定[13-14]
配制葡萄糖、乳糖、半乳糖和低聚半乳糖标准品,根据高效液相色谱出峰时间进行定性分析;进而根据各组分峰面积,采用归一化法计算样品低聚半乳糖含量。
高效液相色谱条件为色谱柱:氨基柱,250 mm×4.6 mm,5 μm;柱温30 ℃;流动相∶V(乙腈)∶V(水)=67∶37;流速1.0 mL/min;ELSD检测器条件:检测器温度80 ℃;载气流速2.0 L/min;增益值2;进样量20 μL。
1.4.6 风味测定[15-16]
准确称取待测滁菊浸泡酒及相关对照样品(鸡尾酒、菊花茶、白酒、红酒、杨梅浸泡酒及水)加入电子舌专用样品杯中。设定分析程序:参比液清洗120 s,传感器平衡30 s,测试30 s。每组样品循环检测5次,去除第1组数据,取后4组循环数据均值作为终值。利用电子舌系统自带软件进行主成分分析(principal components analysis,PCA)。
单因素试验结果表明,超声时间、超声波功率、料液比以及超声萃取后的静置浸泡时间对原料总黄酮浸出含量影响较大。因此以总黄酮含量为检测指标,对上述4个因素进行L9(34)正交优化得到最佳工艺,结果如表4所示。
根据极差R值大小可以看出4个因素对滁菊总黄酮浸出含量影响程度依次为料液比>静置浸泡时间>超声波功率>超声时间。最优工艺为A1B2C2D2,即采用料液比1∶50 (g∶mL)在超声波160 W功率下,冰浴(0 ℃)萃取25 min后静置浸泡48 h,总黄酮浸出含量达到最大值为79.51 mg/g。
通过梯度稀释得到酒精度为3%vol~15%vol系列低度酒,并对其总黄酮含量进行分析。结果如图1所示,不同低度滁菊浸泡酒总黄酮含量均随时间延长而降低。表明黄酮类化合物在本产品中不稳定,且酒精度越低,总黄酮含量损失越大。其中,酒精度为15%vol的产品中总黄酮含量减少了26.85%,而酒精度为3%vol的产品中总黄酮含量减少了83.56%。已有研究显示,黄酮类化合物在中性、碱性环境中不稳定,且不同植物源黄酮提取物存在稳定性差异[17-19]。本研究结果表明,酒精度对滁菊来源黄酮类化合物稳定性亦有影响。综合产品中对总黄酮含量、活性成分稳定性及酒精度要求,确定酒精度为8%vol较佳。
表4 正交试验及结果
Table 4 Orthogonal test and results

试验编号因素超声时间/min超声波功率/W料液比(g∶mL )浸泡时间/h总黄酮含量/(mg·g-1)1 111166.112 122279.513 133350.494 212368.765 223159.196 231266.637 313266.508 321362.839 332165.98K1196.115 6201.368 5195.571 3191.277 8K2194.580 6201.533 9214.252 0212.642 9K3195.309 2183.102 9176.182 1182.084 8k165.371 967.122 865.190 463.759 3k264.860 267.178 071.417 370.881 0k365.103 161.034 358.727 460.694 9R0.511 76.143 712.690 010.186 0因素主→次CDBA最优组合A1B2C2D2
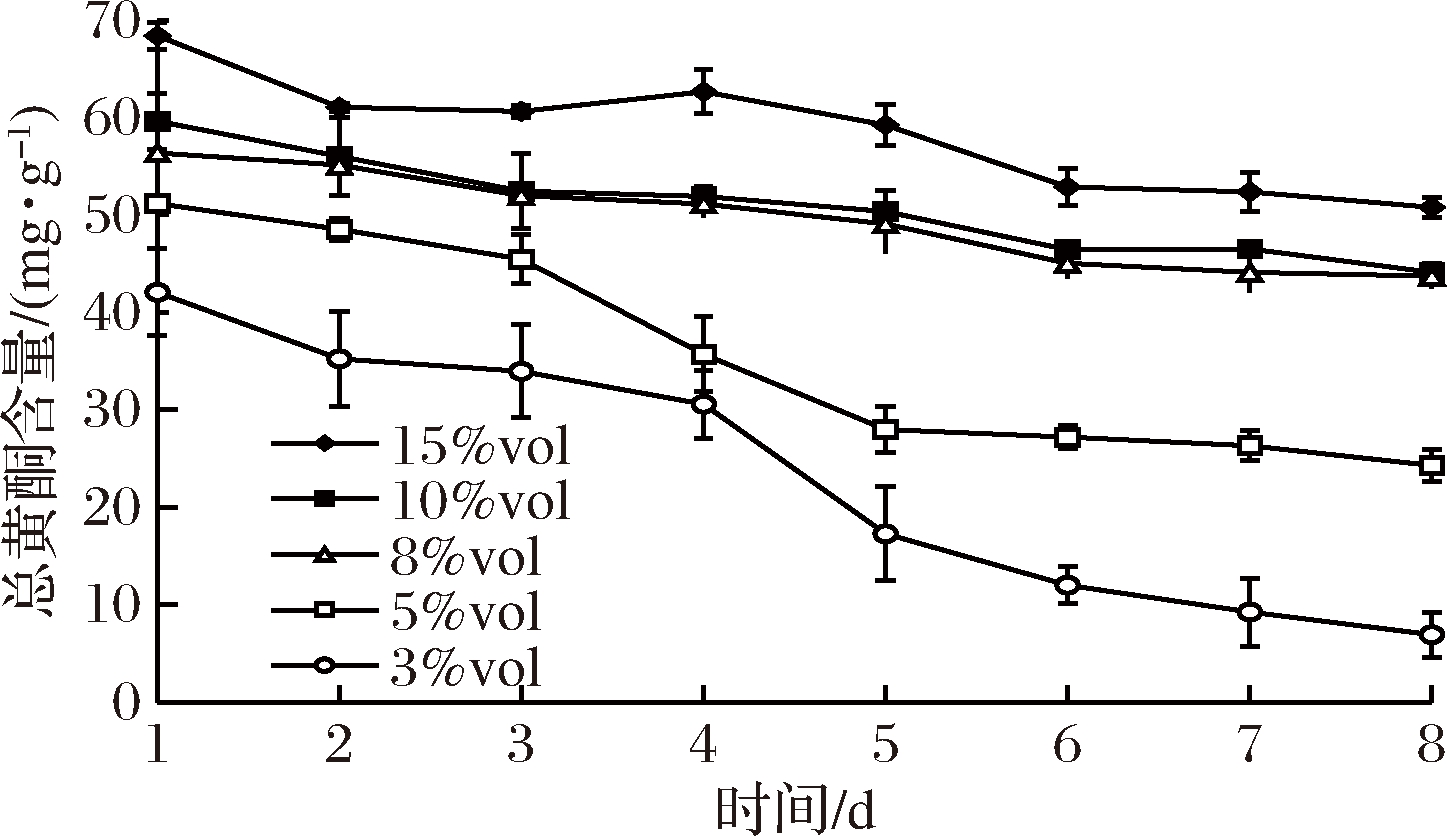
图1 酒精度对滁菊浸泡酒总黄酮含量影响
Fig.1 Effect of alcohol on the content of total flavonoids in the Chuzhou chrysanthemum-soaked liquor
2.3.1 低度滁菊浸泡酒抗氧化性分析与比较
氧自由基积累会损害细胞结构和功能而导致病变[20-21],而生物活性类黄酮能够阻止自由基链式反应的引发以及脂质过氧化[22-23]。为了评价低度滁菊浸泡酒中黄酮类物质生物活性及食用功能性,选择代表性相关产品(杨梅浸泡酒、RIO鸡尾酒、菊花茶、红酒及VC)与本产品进行体外抗氧化活性对比分析。结果如图2所示,本产品![]() 清除率为79.91%,与VC相当且高于其他样品;本产品DPPH自由基清除率为88.86%,在对比样品中仅低于红酒;总还原能力在对比样品中仅低于菊花茶。
清除率为79.91%,与VC相当且高于其他样品;本产品DPPH自由基清除率为88.86%,在对比样品中仅低于红酒;总还原能力在对比样品中仅低于菊花茶。
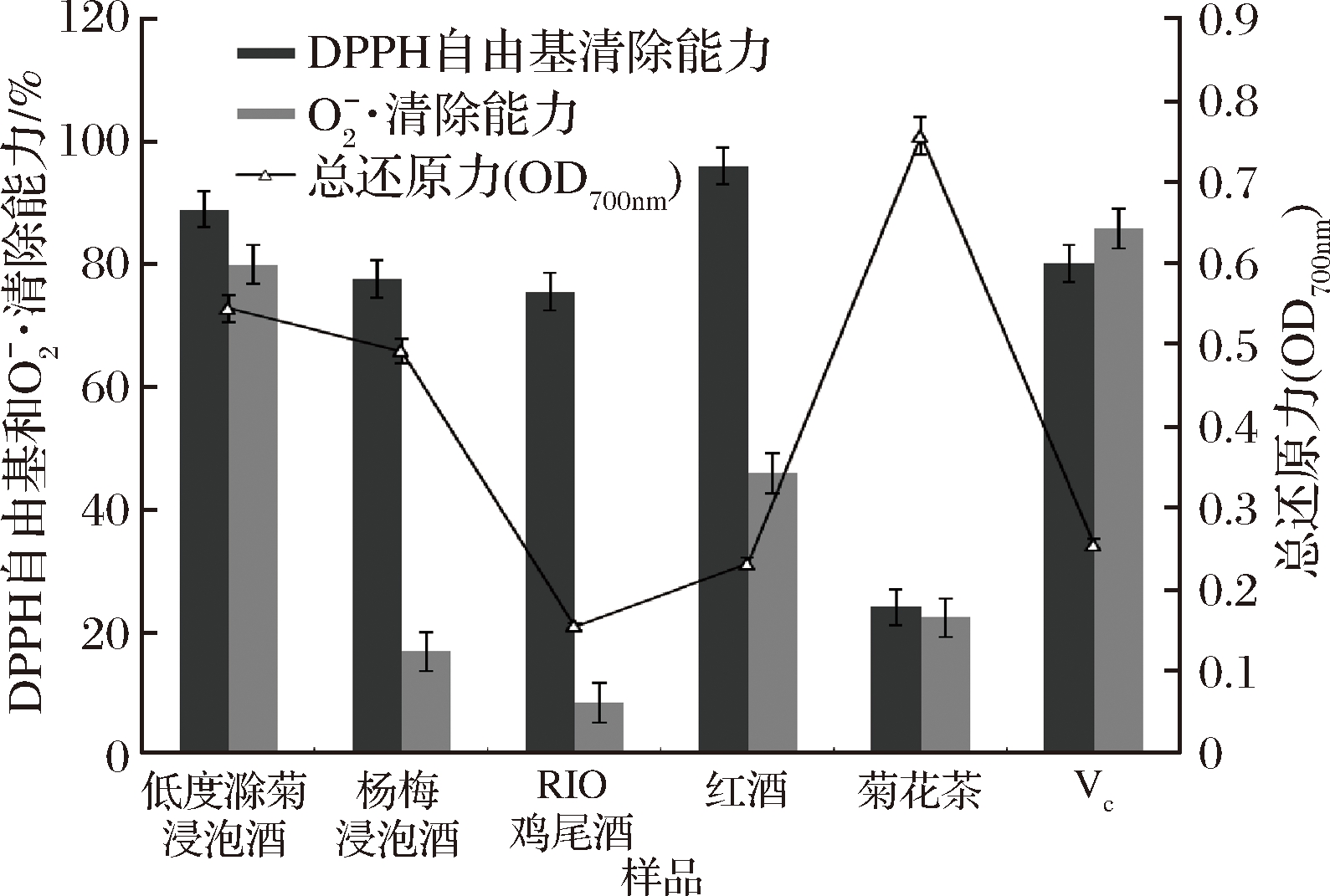
图2 低度滁菊浸泡酒与代表性相关产品体外抗氧化活性比较
Fig.2 Comparison of antioxidant activity of the low alcohol Chuzhou chrysanthemum-soaked liquor and representative related products in vitro
2.3.2 低聚半乳糖在低度滁菊浸泡酒中稳定性分析
低聚半乳糖具有良好的耐热性与耐酸性,但在酒精中的稳定性尚无报道[24-26]。本研究利用HPLC-ELSD测得产品中低聚半乳糖保留量为44.31 mg/mL(图3)。与初始添加量50.00 mg/mL(纯度为90%)相比,低聚半乳糖保留率达98.47%,表明其可在本产品中稳定存在。

a-GOS标准品HPLC-ELSD色谱图;b-低度滁菊浸泡酒HPLC-ELSD色谱图
图3 低度滁菊浸泡酒中低聚半乳糖稳定性分析
Fig.3 Stability analysis of galactooligos accharides in the low alcohol Chuzhou chrysanthemum-soaked liquor
2.3.3 低度滁菊浸泡酒风味特征分析
低度滁菊浸泡酒与鸡尾酒、菊花茶、杨梅浸泡酒、白酒及水等代表性样品电子舌分析结果如图4所示。第一和第二主成分贡献率分别为82.9%和13.0%,DI为97.9%。供试样品可分为7个特征区,即白酒区、水区、红酒区、杨梅浸泡酒区、低度滁菊浸泡酒区、鸡尾酒区和菊花茶区,表明供试样品主成分气味特征差异较大。与其他供试样品相比,本产品与基酒特征气味既相互接近又存在差异,表明基酒及其浸泡物均对本产品气味特征产生影响。
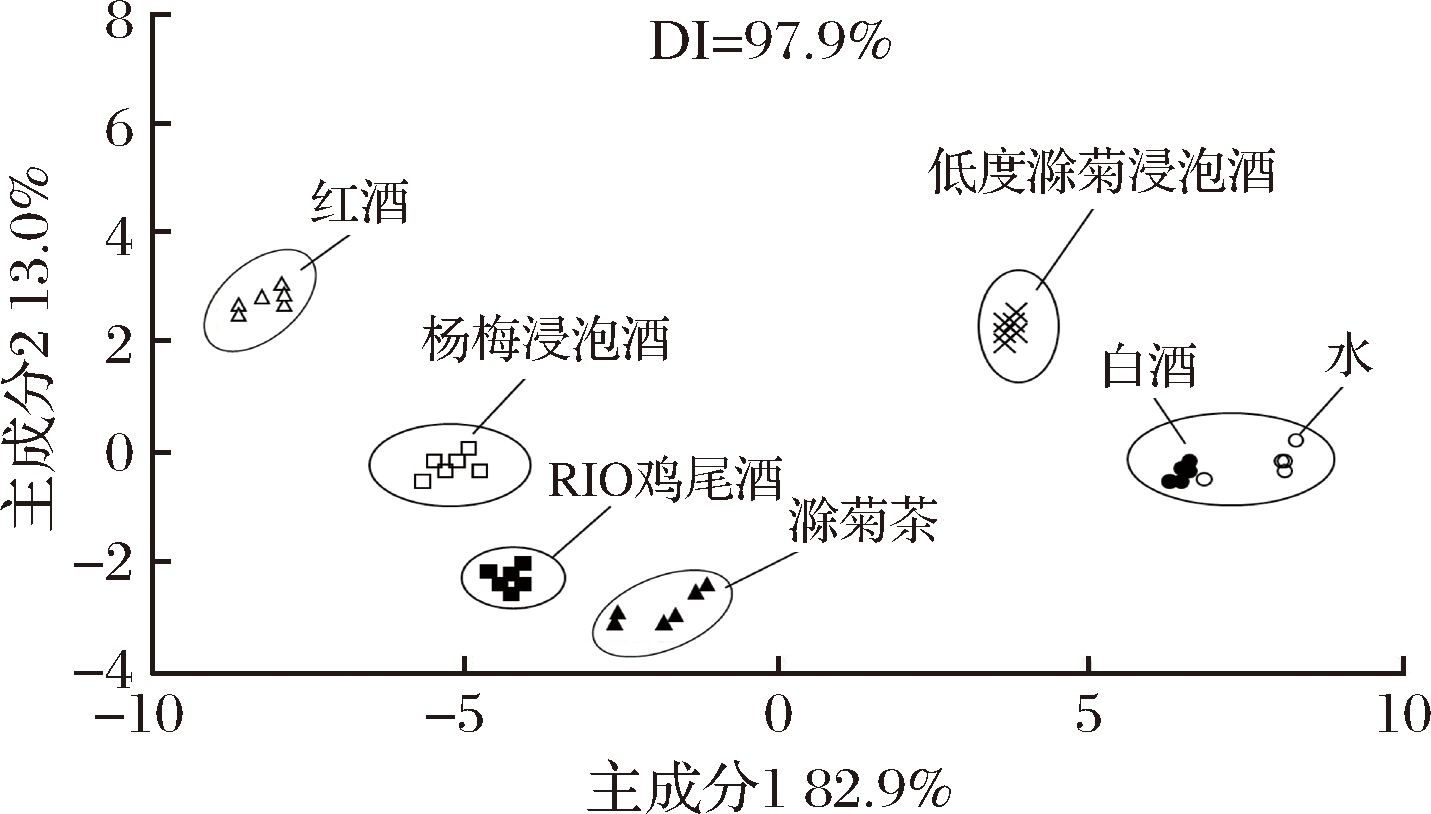
图4 低度滁菊浸泡酒与代表性相关产品的电子舌主成分分析图
Fig.4 PCA of the low alcohol Chuzhou chrysanthemum-soaked liquor and representative related products by electronic tongue
以滁菊为原料,采用低温超声萃取技术,研制了富含黄酮低度滁菊浸泡酒。最佳工艺为将滁菊干花与基酒按料液比1∶50(g∶mL)预浸泡,于160 W超声波功率下冰浴(0 ℃)浸提25 min。静置浸泡48 h后将酒精度降至8%vol,添加低聚半乳糖50 mg/mL。产品总黄酮含量达79.51 mg/g,低聚半乳糖保留量达98.47%,体外抗氧化活性优于代表性相关样品,产品特征风味受到基酒及其浸泡物的双重影响。本研究为滁菊这一经典药材的食用开发与应用推广提供了技术支撑。
[1] 张蓓蓓, 陈岩, 贲培玲, 等.滁菊总黄酮的抗炎作用及部分机制研究[J].齐齐哈尔医学院学报, 2015, 36(17):24-97.
ZHANG B B, CHEN Y, BEN P L, et al.Anti-inflammatory effects of total flavonoids of Chuzhou chrysanthemum and its mechanism[J].Journal of Qiqihar University of Medicine, 2015, 36(17):24-97.
[2] 邓玺玮, 周正莲, 易亚乔, 等.菊花中黄酮类化合物及挥发油的研究进展[J].湖南中医药大学学报, 2014, 34(11):61-64.
DENG X W, ZHOU Z L, YI Y Q, et al.Recent advance in flavonoids and volatile oils from chrysanthemum[J].Journal of Hunan University of Chinese Medicine, 2014, 34(11):61-64.
[3] 姜自红, 安晓婷, 梁建军.5种茶用菊不同提取方法总黄酮含量的比较[J].湖南文理学院学报(自然科学版), 2019, 31(2):27-29;63.
JIANG Z H, AN X T, LIANG J J.Comparison of total flavonoids in different extraction methods of five kinds of tea chrysanthemum[J].Journal of Hunan University of Arts and Science(Science and Technology), 2019, 31(2):27-29;63.
[4] 张蓓蓓, 陈岩, 贲培玲.滁菊总黄酮研究进展[J].齐齐哈尔医学院学报, 2016, 37(17):2 211-2 213.
ZHANG B B, CHEN Y, BEN P L.Research progress of total flavonoids from Chuzhou chrysanthemum[J].Journal of Qiqihar University of Medicine, 2016, 37(17):2 211-2 213.
[5] 田明杰, 谭宏渊, 叶帆宇, 等.福白菊总黄酮的微波辅助提取工艺优化及其抗氧化活性研究[J].中国酿造, 2020, 39(1):170-174.
TIAN M J, TAN H Y, YE F Y, et al.Optimization of microwave-assisted extraction process of total flavonoids from Chrysanthemum morifolium and its antioxidant activity[J].China Brewing, 2020, 39(1):170-174.
[6] 范观宇, 贺璐, 郑淘, 等.酒精摄入量对小鼠肠道微生物、酶活性和血常规的影响[J].微生物学通报, 2018, 45(7):1 462-1 469.
FAN G Y, HE L, ZHENG T, et al.Effect of alcohol intake on blood and intestinal microbiota and enzyme activities of mice[J].Microbiology China, 2018, 45(7):1 462-1 469.
[7] 王学敏, 陈朝青, 孙丰义, 等.5种益生元润肠通便功能的比较研究[J].食品工业科技, 2019, 40(24):291-295.
WANG X M, CHEN Z Q, SUN F Y, et al.Comparative study of five prebiotics on the laxative function[J].Science and Technology of Food Industry, 2019, 40(24):291-295.
[8] 赵思琪, 秦翠丽, 王辉, 等.高通量测序研究三种非消化性寡糖及其组合对小鼠肠道菌群的影响[J].营养学报, 2019, 41(6):576-579;586.
ZHAO S Q, QIN C L, WANG H, et al.Effect of three non-digestible oligosaccharides and their combinations on intestinal microbiota in mice evaluated by illumina high-throughput sequencing[J].Acta Nutrimenta Sinica, 2019, 41(6):576-579;586.
[9] 倪良旭, 孙艳辉, 苗文娟.滁菊茶汤中总黄酮类化合物稳定性研究[J].滁州学院学报, 2016, 18(2):80-84.
NI L X, SUN Y H, MIAO W J.A study on the stability of flavonoids in Chuzhou chrysanthemum tea[J].Journal of Chuzhou University, 2016,18(2):80-84.
[10] 陈苏丹, 汪亚祺, 李秀珍, 等.超声辅助提取款冬总黄酮工艺及抗氧化活性研究[J].河南科技大学学报(自然科学版), 2020, 41(4):82-87;89.
CHEN S D, WANG Y Q, LI X Z, et al.Study of ultrasonic-assisted extraction technology and antioxidant activity of total flavonoids from Tussilago farfara L.[J].Journal of Henan University of Science and Technology(Natural Science), 2020, 41(4):82-87;89.
[11] 王婷婷, 王少康, 黄桂玲, 等.菊花主要活性成分含量及其抗氧化活性测定[J].食品科学, 2013,34(15):95-99.
WANG T T, WANG S K, HUANG G L, et al.Bioactive component content and antioxidant activity of chrysanthemum flower (Chrysanthemum morifolium Ramat) extract[J].Food Science, 2013,34(15):95-99.
[12] 李思斯, 江波, 张涛, 等.银杏外种皮总黄酮的提取及其抗氧化活性研究[J].食品工业科技, 2011, 32(8):291-294.
LI S S, JIANG B, ZHANG T, et al.Extraction and antioxidant activities of total flavonoids from ginkgo biloba exocarp[J].Science and Technology of Food Industry, 2011, 32(8):291-294.
[13] 董艺凝, 陈卫, 邓文君, 等.基于指纹图谱的食品级低聚半乳糖组成分析与有效组分含量推算[J].食品与机械, 2018, 34(7):54-58.
DONG Y N, CHEN W, DENG W J, et al.Composition analysis and calculation of food-grade galacto-oligosaccharides based on HPLC fingerprint[J].Food and Machinery, 2018, 34(7):54-58.
[14] 张媛媛, 张彬, 俞龙泉, 等.利用蒸发光散射检测器测定食品中的低聚果糖[J].食品研究与开发, 2015, 36(23):131-134.
ZHANG Y Y, ZHANG B, YU L Q, et al.Determination of fructooligosaccharides in food by evaporative light scattering detection[J].Food Research and Development, 2015,36(23):131-134.
[15] 汤海青, 顾晓俊, 陈祖满, 等.基于电子舌的料酒味觉特征辨识与定量分析[J].核农学报, 2020, 34(5):1 054-1 060.
TANG H Q, GU X J, CHEN Z M, et al.Taste identification and quantitative analysis of cooking wines based on electronic tongue[J].Journal of Nuclear Agricultural Sciences, 2020, 34(5):1 054-1 060.
[16] 许春华, 肖作兵, 牛云蔚, 等.电子鼻和电子舌在果酒风味分析中的应用[J].食品与发酵工业, 2011, 37(3):163-167.
XU C H, XIAO Z B, NIU Y W, et al.Flavor analysis of fruit wine by electronic nose and electronic tongue[J].Food and Fermentation Industries, 2011, 37(3):163-167.
[17] 肖咏梅, 李明, 毛璞, 等.黄酮类化合物生物改性及活性的研究进展[J].河南工业大学学报, 2019, 40(2):123-131;139.
XIAO Y M, LI M, MAO P, et al.Research progress on biological modification and activity of flavonoids[J].Journal of Henan University of Technology, 2019, 40(2):123-131;139.
[18] AHMED M, EUN J B.Flavonoids in fruits and vegetables after thermal and nonthermal processing:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(18):3 159-3 188.
[19] LANG G H, LINDEMANN I D S, FERREIRA C D, et al.Effects of drying temperature and long-term storage conditions on black rice phenolic compounds[J].Food Chemistry, 2019, 287:197-204.
[20] KALYANARAMAN B, HARDY M, PODSIADLY R, et al.Recent developments in detection of superoxide radical anion and hydrogen peroxide:Opportunities, challenges, and implications in redox signaling[J].Archives of Biochemistry and Biophysics, 2017, 617:38-47.
[21] BURLAKA A P, BURLAKA A A, VIRKO S V, et al.Molecular mechanisms of oxidation damage and liver cell dysfunction in patients with metastatic colorectal cancer[J].Experimental Oncology,2019, 41(4):328-334.
[22] WANG T Y, LI Q, BI K S.Bioactive flavonoids in medicinal plants:Structure activity and biological fate[J].Asian Journal of Pharmaceutical Sciences, 2018, 13(1):12-23.
[23] YI L Z, MA S S, REN D B.Phytochemistry and bioactivity of Citrus flavonoids:A focus on antioxidant, anti-inflammatory, anticancer and cardiovascular protection activities[J].Phytochemistry Reviews, 2017, 16(3):479-511.
[24] HUTKINS R W, KRUMBECK J A, BINDELS L B, et al.Prebiotics:Why definitions matter[J].Current Opinion in Biotechnology, 2016, 37:1-7.
[25] SUWATTANA P, THU-HA N, DIETMAR H, et al.Fractionation of a galacto-oligosaccharides solution at low and high temperature using nanofiltration[J].Separation and Purification Technology,2015, 151:124-130.
[26] COSTABILE A, WALTON G E, TZORTZIS G, et al.Effects of orange juice formulation on prebiotic functionality using an in vitro colonic model system[J].PLoS One, 2015, 10(3):e0121955.