泡菜是中国最古老的发酵蔬菜制品之一,历史悠久。新鲜蔬菜在盐水浸渍过程中,来自原辅料表面的微生物利用蔬菜中的糖类等营养物质进行生长代谢,使泡菜具有清香、嫩脆、开胃等特点[1]。大量研究表明泡菜中的微生物以乳酸菌为主导[2-3],代谢产生乳酸、乙酸等物质,对泡菜风味品质和安全性起着重要作用[4-5]。
目前泡菜大多采用自然发酵模式,其微生物菌群和风味复杂,品质难以调控。泡菜受不同条件影响而千差万别,其中温度是最重要的因素。受季节气候的影响,温度的变化影响了泡菜发酵速度,从而影响泡菜的成熟时间[6]。一般情况下,高温发酵速度更快,如四川泡菜发酵成熟时间一般为1~5 d,而东北酸菜、朝鲜泡菜则采用低温发酵为主,成熟时间需要10 d 以上;温度甚至是区分泡菜加工工艺的重要指标[7],如东北酸菜、朝鲜泡菜以中低温(5~15 ℃)发酵为主,而四川泡菜等以中高温(15~30 ℃)发酵为主。风味是评价泡菜品质的重要指标,很大程度上决定了消费者的选择,也是泡菜新工艺、新产品开发的重要衡量指标。泡菜中的风味物质包括挥发性成分和非挥发性成分,风味物质的种类和数量决定着泡菜的品质,综合性由人体嗅觉和味觉等感官的整体效果来评估。泡菜风味物质的形成与泡菜菌群结构有关,泡菜中明串珠菌属启动发酵,产生甘露醇、乙酸等挥发性成分,增加泡菜香味。泡菜发酵后期以乳杆菌属为主导,快速产生乳酸,增加泡菜风味种类[8]。温度影响了泡菜体系中的菌群结构,进而影响了泡菜的风味物质。熊涛等[9]研究了3 种温度下传统四川泡菜发酵过程中微生物的数量变化、代谢底物和产物含量变化的影响,发现温度对传统四川泡菜发酵过程中的微生物数量和代谢有显著影响。PARK等[10]研究4、12、20 ℃对韩国泡菜代谢产物的影响,表明差异特征产物为丙氨酸、丙二醇、富马酸、苹果酸、柠檬酸和半乳糖二酸。然而,目前有关温度对四川泡菜挥发性成分的影响还鲜有报道。
基于此,采用传统四川泡菜工艺,以结球甘蓝为原料,采用低温(10 ℃)、中温(15 ℃)、常温(25 ℃)和高温(35 ℃)恒温发酵甘蓝泡菜,对泡菜液发酵过程中的基本理化特性、有机酸、氨基酸和挥发性成分进行解析,探讨温度对泡菜液风味的影响。研究结果对实现泡菜风味调控和保藏具有重要意义。
1 材料和方法
1.1 材料与试剂
结球甘蓝(Brassica oleracea L.var.capitata L.)、食盐,眉山某超市;陶制泡菜坛,眉山某市场;有机酸(柠檬酸、苹果酸、乳酸和乙酸)标准品、17种氨基酸混合标准品(天门冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、酪氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸),美国sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
GCMS-TQ8040气相色谱质谱联用仪、LC-2030高效液相色谱分析仪,日本岛津仪器公司;色谱柱VF-WAXms(60 m×0.25 mm,0.25 μm),美国安捷伦公司;色谱柱Carbomix H-NP10:8%(10 μm, 7.8×300 mm),苏州赛分科技有限公司;色谱柱Ultimate Amino Acid(5 μm, 4.6 mm×250 mm),月旭科技(上海)股份有限公司;顶空进样瓶(15 mL)、固相微萃取(solid phase mircro exraction,SPME)装置(50/30 μm, DVB/CAR/PDMS萃取头),美国Supelco公司;JN-400i无菌均质器,宁波江南仪器厂;PHS-3C pH计,上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 泡菜制作及取样
甘蓝泡菜制备[1]:将结球甘蓝清洗干净,晾干,切成2~3 cm块状,装入2.5 L土陶坛中,用手将坛子中的蔬菜压紧;然后向坛子中加入食盐水(冷开水配制),加至坛沿处,菜和盐水质量比为1∶2,控制盐度为总质量的3%。坛沿加水密封,分别置于10、15、25、35 ℃恒温培养箱中发酵,每组3个平行。泡菜是属于固液混合发酵体系,乳酸菌主要在泡菜液中进行生长代谢,选择泡菜液进行分析有助于建立泡菜中乳酸菌及其代谢关系。根据发酵规律,10、15 ℃发酵泡菜取0、2、4、8、12、16、20 d泡菜液,25、35 ℃发酵泡菜取0、1、2、3、5、7、10 d泡菜液进行分析。
1.3.2 泡菜液pH和可滴定酸的测定
泡菜液pH值测定参考GB/T 10468—1989 《水果和蔬菜产品pH值的测定方法》。可滴定酸(titratable acid,TTA)测定参考GB/T12456—90《食品中总酸的测定方法》中电位滴定法,用0.05 mol/L盐酸标准滴定溶液反滴定至pH值为8.2,以乳酸计。
1.3.3 泡菜液有机酸含量分析
参考文献[11]的方法稍微修改,将泡菜液经6 000 r/min离心5 min,取1 mL上清液和质量浓度为1 g/L的有机酸标准品过0.22 μm水系滤膜后用于高效液相色谱分析。分析条件为色谱柱:Carbomix H-NP10:8% (10 μm, 7.8 mm×300 mm),流动相A:10 mmol/L H2SO4,流动相B:超纯水,柱温65 ℃,流速0.4 mL/min,V(A)∶V(B)=2∶3,进样量10 μL,检测器UV 210 nm。
1.3.4 泡菜液氨基酸含量分析
参考迟原龙等[12]的方法稍微修改,将100 μL氨基酸标准品或泡菜液离心后的上清液置于5 mL试管中,加入200 μL衍生试剂(1 600 μL乙腈、200 μL三乙胺和20 μL异硫氰酸苯酯),涡旋混合20 s后放置60 min;然后加入2 mL H2O和1 mL正己烷,涡旋混合1 min后除去上层溶液,再次加入1 mL正己烷后涡旋混合1 min,静置10 min后取下层溶液过0.22 μm水系滤膜用于高效液相色谱分析。色谱柱:月旭Ultimate Amino Acid (5 μm, 4.6 mm× 250 mm),流动相A为V[0.1 mol/L CH3COONa(pH 6.50)]∶V(乙腈)=93∶7,流动相B为V(超纯水)∶V(乙腈)=20∶80,柱温40 ℃,流速1.0 mL/min,进样量10 μL,检测器UV 210 nm。
1.3.5 泡菜液挥发性成分分析
样品处理和检测条件[13]:取泡菜液2 mL、2.5 g NaCl和5 μL内标(4-甲基-2-戊醇甲醇溶液,质量浓度为0.4 μg/mL)加入15 mL顶空进样瓶中,混匀密封置于40 ℃恒温槽中水浴加热平衡30 min,将老化后的SPME萃取头插入到顶空进样瓶中吸附30 min,于250 ℃条件下解析5 min,每个样品独立测定2次。气相色谱(gas chromatography,GC)条件:不分流进样模式;进样温度40 ℃;进样口温度250 ℃;总流量50 mL/min;载气He;载气流量1.2 mL/min。柱温程序40 ℃(0 min)以16 ℃/min到75 ℃(保持0 min),以2 ℃/min到94 ℃(保持1 min),以2 ℃/min到110 ℃(保持1 min),以3 ℃/min到122 ℃(保持1 min),以2 ℃/min到130 ℃(保持1 min),以2 ℃/min到136 ℃(保持1 min),以2 ℃/min到143 ℃(保持1 min),以6 ℃/min到200 ℃(保持5 min)。质谱(mass spectrometry,MS)条件:电子离子源(EI),电子能量70 eV,离子源温度230 ℃;接口温度250 ℃;检测器电压0.1 kV;扫描采集方式,扫描质量范围(m/z)35.00~350.00 amu。
定性和定量分析:由GC-MS得到的色谱图,经计算机在标准谱库NIST17和FFNSC1.3中比对检索,选取相似度>80的物质进行定性分析,并准确地鉴定出各样品的挥发性成分,同时采用4-甲基-2-戊醇甲醇(0.4 μg/mL)为内标进行半定量分析,得到各组分的质量浓度。
1.3.6 数据处理
使用Origin Pro 9.1对pH、总酸、有机酸和氨基酸进行作图。风味成分在SPSS 22.0中进行主成分分析(principal component analysis, PCA)。
2 结果与分析
2.1 泡菜液pH和可滴定酸的变化
pH和酸度是泡菜重要的理化参数,不仅反映泡菜品质,而且还显示泡菜微生物生长情况[14]。如图1所示,泡菜发酵过程中泡菜液pH呈下降趋势,泡菜发酵中后期pH下降速度减缓或处于平稳状态。温度越高,pH下降越快,说明升高温度,加快了乳酸菌代谢产酸。泡菜发酵后期积累大量的乳酸和H+,此时乳酸菌生长受到抑制[15]。一般认为泡菜pH<4表示成熟[14],温度越高,成熟期越短,10 ℃成熟期为16 d,15 ℃成熟期为12 d,25 ℃成熟期为3 d,35 ℃成熟需要2 d。泡菜可滴定酸含量随着发酵的进行呈上升趋势,且温度越高,上升越快,说明低温贮藏有利于防止泡菜酸败。然而,35 ℃发酵泡菜可滴定酸含量在5 d后开始下降,此时乳酸可能被其他微生物消耗,说明提升温度对泡菜产酸是有限的。

A-pH;B-可滴定酸度
图1 温度对发酵酸度和pH的影响
Fig.1 Effect of temperature on fermentation acidity and pH
2.2 泡菜液有机酸含量
有机酸是衡量泡菜风味品质的重要指标,也能反映出甘蓝泡菜液中主导乳酸菌的发酵类型。如图2所示,甘蓝原料中含有柠檬酸和苹果酸,发酵初期作为微生物生长的碳源,随着发酵进行而被大量消耗,且温度越高,消耗越快,10 d后消耗殆尽,表明其对泡菜成熟后风味影响较小。
提高温度有利于提高乳酸菌代谢产生的乳酸和乙酸含量。其中乳酸的酸味柔和,有后酸味,可提供柔和的风味[16]。泡菜中乙酸主要由发酵初期的醋酸菌和异型乳酸菌代谢产生,乙酸有较强的刺激味,有强化食欲的功能,能与醇类产生乙酸乙酯等香味物质,对泡菜风味具有促进作用[17]。有机酸含量变化反映出泡菜品质的差异,不同的温度发酵甘蓝泡菜液中有机酸含量变化差异显著。除35 ℃发酵泡菜外,有机酸主要以乳酸为主,其对泡菜的风味和泡菜菌群演变影响较大[18]。10 ℃发酵泡菜16 d后乳酸含量稳定在0.12 g/100mL,表明乳酸菌生长代谢受到抑制。以低温发酵为代表的韩国泡菜、东北酸菜,发酵过程中细菌以明串珠菌属、乳球菌属、魏斯氏菌属为主导[19],这些微生物耐酸性差,发酵后期菌群相对稳定,其乳酸含量稳定,这也与低温下乳酸代谢相关酶活性低有关。15 ℃发酵泡菜乳酸含量一直上升,发酵20 d达到0.25 g/100mL。25、35 ℃发酵初期乳酸和乙酸含量快速增加,发酵后期乳酸含量降低。泡菜发酵中后期,兼性异型发酵乳酸菌占据主导,代谢产生大量的乳酸,耐受性差的异型乳酸菌逐渐消失,常报道韩国泡菜和四川泡菜发酵后期以植物乳杆菌为主导发酵[19-20]。
35 ℃发酵泡菜乙酸含量在发酵7 d后快速增加,可能与高温体系下菌群发生改变有关。高温组泡菜在发酵后期出现微弱腐败,具有刺激性气味,乙酸及其相关微生物可能是腐败泡菜的特征指标。有研究报道在缺少己糖的情况下,兼性异型发酵的植物乳杆菌也可以产生乙酸、乙醇和甲酸[21]。布氏乳杆菌、丙酸菌属和梭菌属利用乳酸代谢丙酸等物质[22],从而使泡菜发酵后期pH升高。在泡菜生产加工过程中,当泡菜成熟后应采用低温来延长泡菜保质期,防止泡菜酸败。
2.3 泡菜液游离氨基酸含量变化
食品中的游离氨基酸大多为L型氨基酸,是重要的滋味物质。根据KATO等[23]将分析中的17种氨基酸分为4类,鲜酸味(门冬氨酸和谷氨酸)、甜味(丙氨酸、甘氨酸、丝氨酸和苏氨酸)、苦味(精氨酸、组氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、缬氨酸、脯氨酸和赖氨酸)、无味(胱氨酸和酪氨酸)。如图3所示,发酵初期,泡菜液中含有大量的精氨酸、脯氨酸、丙氨酸、丝氨酸、门冬氨酸等,其中呈苦味特征的精氨酸含量达到1.04 g/100mL。随着发酵的进行,蔬菜中的微生物和酶将蛋白质水解生成游离氨基酸,以乳酸菌为主导的微生物在发酵过程中大量消耗氨基酸进行生长代谢,氨基酸作为氨基丙酸乙酯和烯醛类等香味物质的前体物[24],使泡菜液发酵过程中的游离氨基酸含量快速降低。
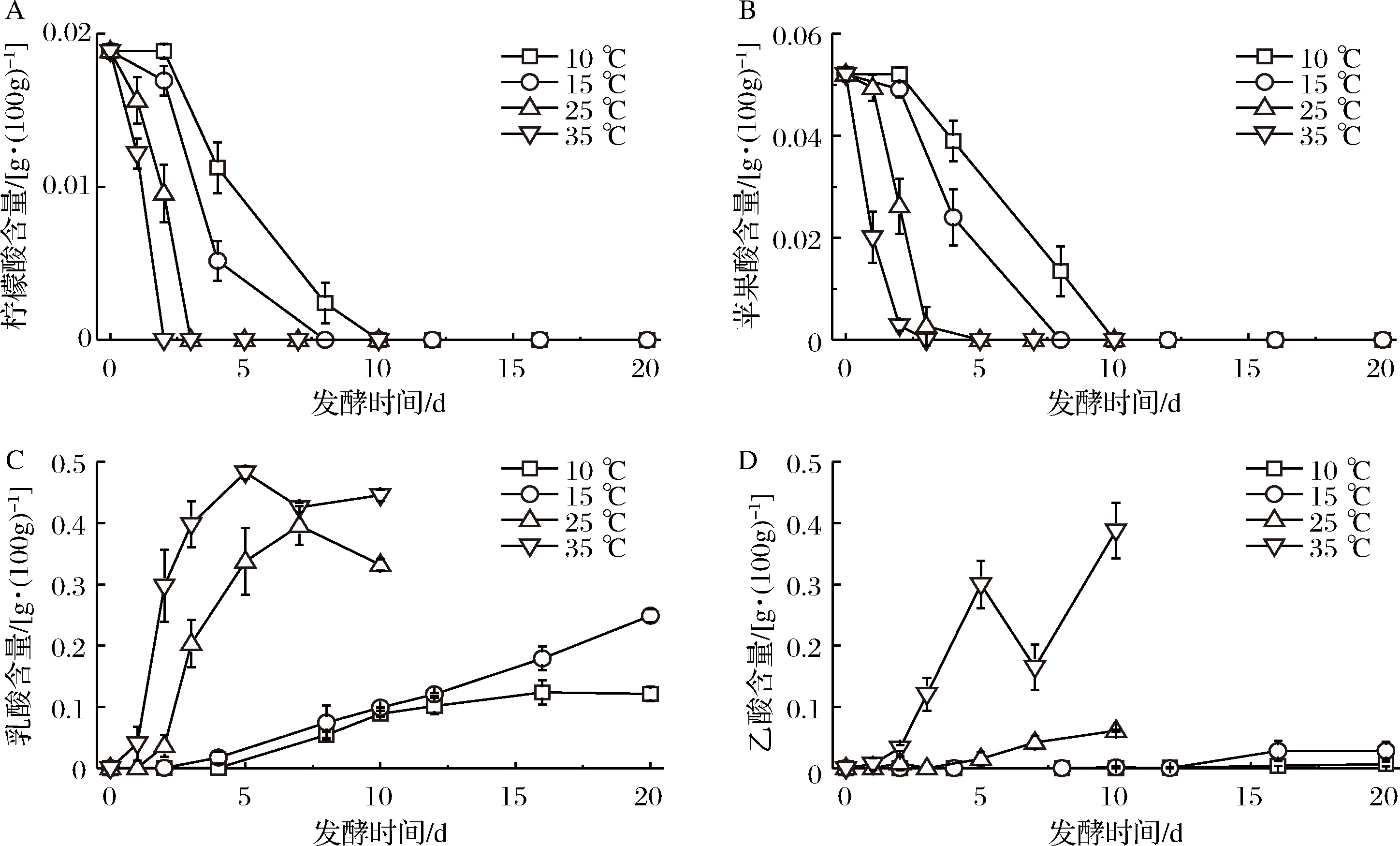
A-柠檬酸;B-苹果酸;C-乳酸;D-乙酸
图2 温度对泡菜有机酸的影响
Fig.2 Effect of temperature on organic acids in Paocai
氨基酸含量的高低反映发酵的程度及菌群差异。温度越高,总的氨基酸含量下降越快,说明高温下乳酸菌利用氨基酸快速增殖,但35 ℃发酵泡菜在后期的氨基酸含量高于25 ℃。甜味、苦味和鲜酸味氨基酸随着发酵进行而降低,10 ℃发酵泡菜中甜味氨基酸总量随发酵进行先增加后减少,在第5天达到最大值,其中丙氨酸随发酵快速下降,而甘氨酸、丝氨酸和苏氨酸随发酵进行先增加后减少,与其他温度组有极显著差异(P<0.001)。苦味氨基酸以精氨酸和脯氨酸为主,除10 ℃中的脯氨酸外,都成下降趋势。鲜酸味氨基酸以门冬氨酸和谷氨酸为主,门冬氨酸先呈下降趋势,后趋于稳定。除35 ℃外,谷氨酸均呈先增加后减少的趋势。可见,不同的发酵温度,泡菜中游离氨基酸的组成不同,赋予了泡菜独特的风味,这与温度影响了泡菜菌群结构有关。发酵结束时,苦味氨基酸的含量较高,但受阈值的影响,苦味的呈味效果也可能会受到NaCl和有机酸的抑制[25-26],谷氨酸和NaCl结合会增强泡菜的鲜味[27],所以泡菜的主导滋味是咸味和鲜味。
2.4 泡菜液挥发性成分
采用顶空固相微萃取-气相色谱-质谱联用技术对不同温度发酵过程中的56个甘蓝泡菜液进行分析,总计分析出挥发性风味物质48种。其中10 ℃ 39种;15 ℃ 38种;25 ℃ 47种;35 ℃ 45种,高温发酵泡菜含有更多种类的挥发性成分。48种挥发性成分中包含酯类(A:12种)、醇类(B:7种)、酮类(C:8种)、醛类(D:9种)、酚类(E:2种)、烯烃类(F:4种)和其他类(G:6种),分类结果如图4所示。泡菜发酵初期,甘蓝泡菜液的挥发性成分含有大量的酯类和醛类成分,含量分别达到2.14、2.65 ng/mL。随着发酵进行,来自原料中的成分呈减少趋势。发酵结束时,10 ℃发酵泡菜液中的挥发性成分含量总量最高,存在大量酯类、醇类和醛类;15 ℃发酵泡菜液主要为酯类和醇类;25 ℃和35 ℃发酵泡菜液主要为酯类。
甘蓝泡菜液发酵过程中伴随着挥发性成分种类和数量的变化。发酵初期,甘蓝原料溢出到泡菜液中含量>0.2 ng/mL的挥发性成分有异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯、2,2,4-三甲基戊二醇异丁酯、1-己醛、2,4-二叔丁基苯酚、3,5-辛二烯-2-酮、1-己醇和柏木醇。原料中溢出的异硫氰酸苯乙酯、2-苯乙基异氰酸酯、三芥酸甘油酯、3-丁烯基异硫氰酸酯、异硫氰酸烯丙酯和三芥酸甘油酯,这些成分作为芥子苷或硫代葡萄糖甙水解产物,具有刺激性[28]。在发酵初期,异硫氰酸烯丙酯含量较高,随着发酵进行被水解。原料中溢出的2,4-二叔丁基苯酚具有抗氧化和抗真菌能力[29],随着发酵进行,而逐渐被转化,在所有温度组发酵后期都检测到1,3-二叔丁基-苯,可能作为2,4-二叔丁基苯酚转化产物。发酵初期还发现了邻苯二甲酸二异丁酯、2-乙基-1-己醇、2,4-庚二烯醛、壬醛、D-柠檬烯和苯代丙腈,这些成分贯穿了整个发酵过程,可能作为发酵甘蓝泡菜液中特有风味。经过微生物的作用,所有样品中都含有松油醇、异硫氰酸苯乙酯、2-苯乙基异氰酸酯、软脂酸乙酯、异戊氧乙烯乙酸酯、1-辛烯-3-醇、甲基庚烯酮、苯乙酮、2-庚烯醛、辛醛、2-已烯醛、3,5,5-三甲基-2-己烯、1,3-二叔丁基-苯和4-甲硫基丁腈。其中温度越高,软脂酸乙酯出现越早,其呈微弱蜡香、果爵和奶油香气,由软脂酸和乙醇反应生成[30];1-辛烯-3-醇、甲基庚烯酮、苯乙酮和辛醛主要发生在泡菜成熟之前,可能是不耐酸微生物的代谢香气。1-辛烯-3-醇具有蘑菇、薰衣草、玫瑰和干草香气;甲基庚烯酮具有柠檬草和乙酸异丁酯般的香气;苯乙酮有山楂的气味;辛醛具有很强的水果香味[30]。低温、中温和常温发酵甘蓝泡菜液中特有成分为己酸乙酯,中温和常温中特有成分为癸醛和辛酸;常温和高温中特有成分为2-羟基丙酸乙酯、苯乙醇、甲基异丁酮、柠檬醛、4-乙基苯酚、2,5-二甲基-2-十一烯和邻二甲苯,表明高温组还有更丰富的挥发性成分。

A-总氨基酸;B-鲜、酸味氨基酸;C-甜味氨基酸;D-苦味氨基酸;E-丙氨酸;F-甘氨酸;G-丝氨酸;H-苏氨酸;I-精氨酸;J-脯氨酸;K-门冬氨酸;L-谷氨酸
图3 温度泡菜游离氨基酸的影响
Fig.3 Effect of temperature on free amino acids in Paocai
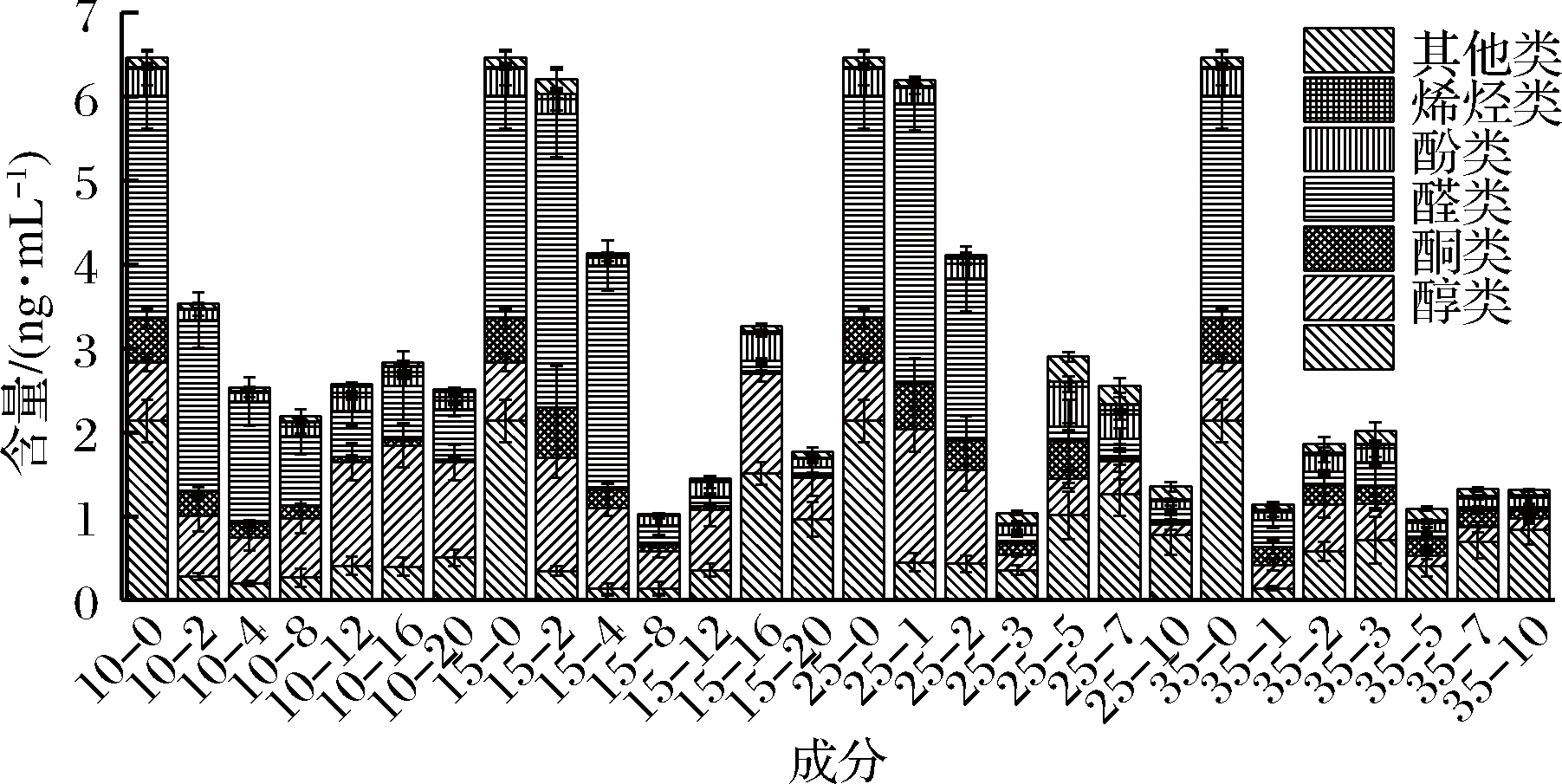
图4 不同温度发酵甘蓝泡菜液挥发性成分分类
Fig.4 Classification of volatile components of fermented cabbage Paocai brine at different temperatures
为反映各温度组甘蓝泡菜液发酵过程中样本间差异及显著影响成分,采用无监督的PCA进行分析。结果如图5-A所示,各温度组甘蓝泡菜液挥发性成分的特征变量44.8%的累计差异被描述,同一95%置信区域显示4种温度发酵甘蓝泡菜液分布差异明显,表明其挥发性成分差异较大。甘蓝泡菜液发酵初期与0 d之间的距离较大,表明甘蓝在盐水浸泡和微生物的作用下,泡菜液中的挥发性成分发生了较大变化。根据样品的位置分布可以看出,温度越高,样品间的差异越大,表明样品的风味差异越大。所有温度组中25 ℃发酵泡菜液发酵前后差异之间较大,所有泡菜液发酵后期分布都相对聚集,表明发酵后期风味趋于稳定。图5-B~图5-E分别展示了10、15、25、35 ℃发酵甘蓝泡菜液PCA中载荷数>0.8的主要影响成分,以载荷系数在PCA1上>0.9作为显著影响甘蓝泡菜液的重要挥发性物质,其中10 ℃发酵过程中起正相关的重要挥发性风味为2-乙基-1-己醇、苯乙酮和2,4-庚二烯醛,起负相关的为2,2,4-三甲基戊二醇异丁酯和1-己醇。15 ℃发酵甘蓝泡菜液中起正相关的为苯乙酮、2-[羟基(苯基)甲基]环己酮、2,4-庚二烯醛和壬醛,无显著负相关成分;25 ℃发酵甘蓝泡菜液中起正相关的为三芥酸甘油酯,无显著负相关成分;35 ℃发酵甘蓝泡菜液中起正相关的为异硫氰酸苯乙酯、壬醛和苯代丙腈,无显著负相关成分。
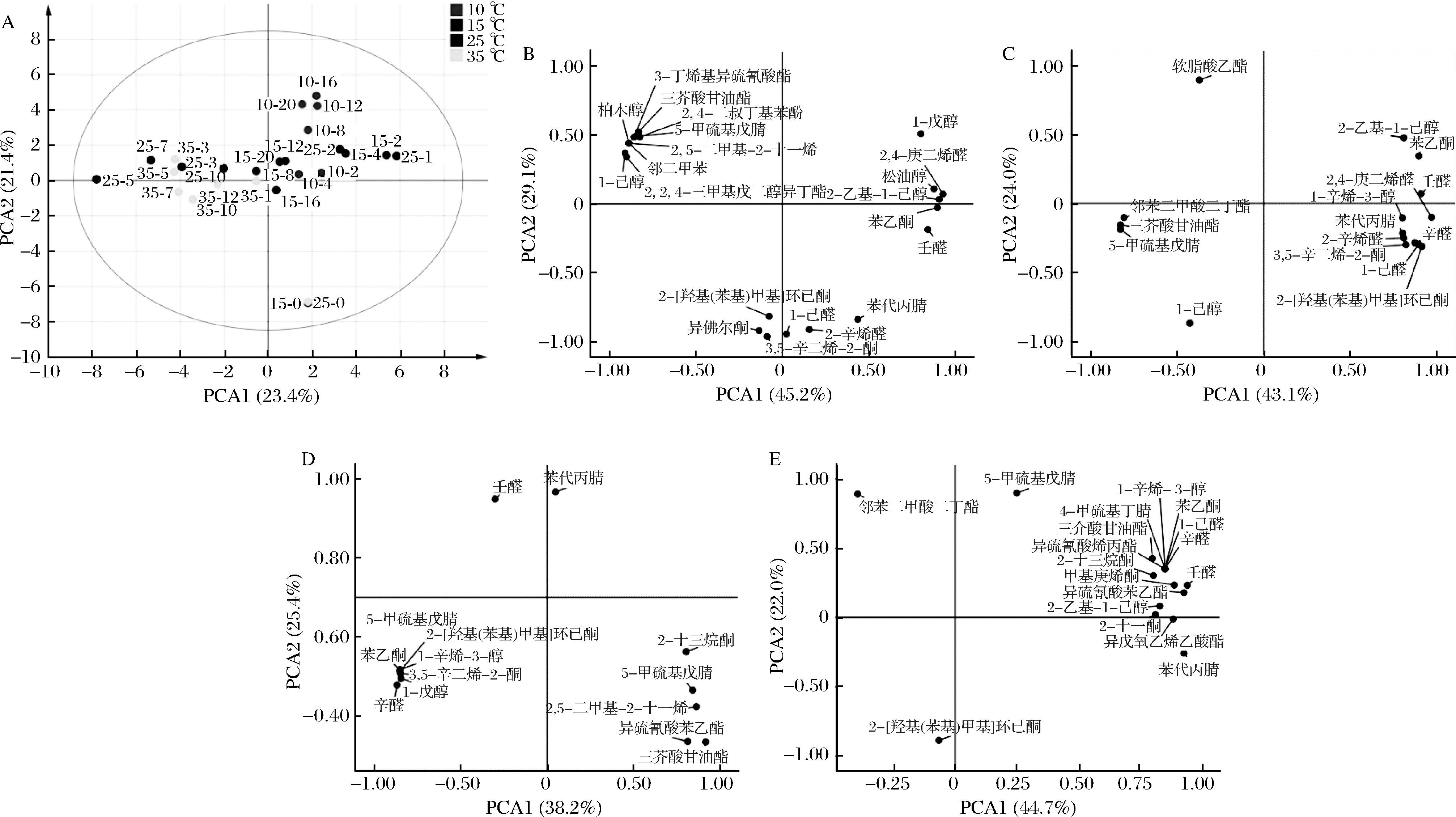
A-PCA组合分析;B-10 ℃载荷图;C-15 ℃载荷图;D-25 ℃载荷图;E-35 ℃载荷图
图5 不同温度发酵甘蓝泡菜液中挥发性成分PCA分析和载荷图(载荷系数>0.8)
Fig.5 Principal component analysis and load diagram of volatile components of fermented cabbage Paocai brine at different temperatures
注:载荷系数>0.8,图5-A中数字代表“发酵温度-发酵时间”
由于泡菜大多采用自然发酵模式,工艺、原料、环境等的差异性,导致菌群结构复杂,所以泡菜挥发性成分迥异。章献等[31]采用气质联用技术从2种韩国泡菜中分离出34种共同的挥发性成分,包括乙醇、乙酸、烯类和硫醚类等物质。徐丹萍等[32]采用顶空固相微萃取结合气相色谱-质谱联用技术发现老泡菜水发酵泡菜中检出异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯、1-壬醇、苯乙醇、3-甲基异硫氰酸丁酯等20种化合物。汪冬冬等[13]研究不同原料泡菜发现乙醇、苯乙醇、2-乙基己醇、乙酸、丁酸、乙酸乙酯可以用于区分发酵型和不发酵型泡菜。虽然泡菜挥发性成分研究较多,但有关泡菜香气的鉴定及特征描述还鲜有报道,这需要多种手段相互结合,如采用气相色谱-嗅闻法、香气活性值和感官评定等确定挥发性成分贡献度和风味特性,并结合香气重组、香气遗漏、香气添加等实验确定泡菜关键香气。根据工艺、原料等差异,多种不同风味物质以特定含量比例存在于泡菜体系中,决定了泡菜独有的发酵风味特征。未来应当考虑从环境、微生态以及风味代谢物等不同方向突破泡菜的风味化学研究。
3 结论
本文对10、15、25、35 ℃恒温发酵甘蓝泡菜风味成分进行了动态分析,确定了特征性风味成分,阐述了温度对泡菜风味的影响。温度对泡菜的影响是有限的,在10~35 ℃,温度越低,发酵速度越慢,提高发酵温度有利于泡菜快速产生乳酸和乙酸,缩短成熟期。温度的差异导致了泡菜发酵过程中底物和代谢产物的差异,提高发酵温度可以增加泡菜挥发性成分。研究发现低温有利于防止泡菜酸败,而高温长时间发酵容易出现腐败,产生乙酸,这为人工控制泡菜提供参考。泡菜风味受工艺、盐度等多因素的影响,关键香气成分和阈值还有待研究,还需要深入研究环境因子、微生物群落与风味之间的相互关系。
[1] 陈功. 中国泡菜加工技术[M].北京:中国轻工业出版社, 2011.
CHEN G.Chinese paocai processing technology[M].Beijing:China Light Industry Press, 2011.
[2] PARK E J, CHUN J, CHA C J, et al.Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing.[J].Food Microbiology, 2012, 30(1):197-204.
[3] HONG Y, YANG H S, CHANG H C, et al.Comparison of bacterial community changes in fermenting kimchi at two different temperatures using a denaturing gradient gel electrophoresis analysis[J].Journal of Microbiology & Biotechnology, 2013, 23(1):76-84.
[4] YAN P M, XUE W T, TAN S S, et al.Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J].Food Control, 2008, 19(1):50-55.
[5] JI Y J, LEE S H, CHE O J.Kimchi microflora:History, current status, and perspectives for industrial kimchi production[J].Applied Microbiology & Biotechnology, 2014, 98(6):2 385-2 393.
[6] ZHANG Q S, CHEN G, SHEN W X, et al.Microbial safety and sensory quality of instant low-salt Chinese paocai[J].Food Control, 2016, 59:575-580.
[7] LEE D Y, KIM S, CHO J, et al.Microbial population dynamics and temperature changes during fermentation of kimjang kimchi[J].Journal of Microbiology, 2008, 46(5):590-593.
[8] LEE M E, JANG J Y, LEE J H, et al.Starter cultures for kimchi fermentation[J].J Microbiol Biotechnol, 2015, 25(5):559-568.
[9] 熊涛, 肖阳生, 李军波, 等.温度对四川泡菜中菌系及其代谢产物分布的影响[J].食品与发酵工业, 2016, 42(2):77-81.
XIONG T, XIAO Y S, LI J B, et al.Effects of temperature on strains and metabolism of Sichuan pickled cabbage[J].Food and Fermentation Industries, 2016, 42(2):77-81.
[10] PARK S E, SEO S H, KIM E J, et al.Effects of different fermentation temperatures on metabolites of kimchi[J].Food Bioscience, 2018, 23:100-106.
[11] 段先哲, 李南, 谭凯旋, 等.高效液相色谱法测定苹果酸中的其它有机酸[J].分析仪器, 2016 (1):17-20.
DUAN X Z, LI N, TAN K X, et al.Determination of other organic acids in malic acid by high performance liquid chromatography[J].Analytical Instrumentation, 2016 (1):17-20.
[12] 迟原龙, 张琦弦, 廖学品, 等.柱前衍生高效液相色谱法分析制革皮屑水解物的氨基酸组成[J].工程科学与技术, 2012, 44(5):179-183.
CHI Y L, ZHANG Q X, LIAO X P, et al.Analysis of amino acid composition in tannery skin bit hydrolysates by HPLC with pre-column derivatization[J].Engineering Science Edition, 2012, 44(5):179-183.
[13] 汪冬冬, 张其圣, 陈功, 等.不同蔬菜原料发酵泡菜挥发性成分解析[J].食品工业科技, 2018, 39(3):234-242.
WANG D D, ZHANG Q S, CHEN G, et al.Analysis of volatile compounds in paocai fermented in different vegetable raw materials[J].Science and Technology of Food Industry, 2018, 39(3):234-242.
[14] CHEIGH H S, PARK K Y, LEE C Y.Biochemical, microbiological, and nutritional aspects of kimchi (Korean fermented vegetable products)[J].Critical Reviews in Food Science & Nutrition, 1994, 34(2):175-203.
[15] XIONG T, GUAN Q Q, SONG S H, et al.Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J].Food Control, 2012, 26(1):178-181.
[16] 周相玲, 胡安胜, 王彬, 等.人工接种泡菜与自然发酵泡菜风味物质的对比分析[J].中国酿造, 2011(1):159-160.
ZHOU X L, HU A S, WANG B, et al.Comparison analysis of flavor compounds in pickles produced by inoculated fermentation and natural fermentation[J].China Brewing, 2011(1):159-160.
[17] 王晓飞. 纯种发酵泡菜及其风味物质的研究[D].南京:南京工业大学, 2005.
WANG X F.Studies on pure fermenting pickles and the volatile flavor components[D].Nanjing:Nanjing Medical University, 2005.
[18] 熊涛, 李军波, 彭飞, 等.食盐质量浓度对传统自然发酵圆白菜的菌系结构和代谢的影响[J].食品科学, 2015, 36(11):172-176.
XIONG T, LI J B, PENG F, et al.Effect of salt concentration on microbial community composition and metabolism in traditional pickled cabbage[J].Food Science.2015, 36(11):172-176.
[19] JEONG S H, JUNG J Y, LEE S H, et al.Microbial succession and metabolite changes during fermentation of dongchimi, traditional Korean watery kimchi[J].Int J Food Microbiol, 2013, 164(1):46-53.
[20] 陈功, 张其圣, 李恒, 等.中国泡菜发酵态相对稳定性的研究及应用[J].食品与发酵科技, 2020, 56(1):54-63;72.
CHEN G, ZHANG Q S, LI H, et al.Research and application of the stable fermentation stage of Chinese paocai[J].Sichuan Food and Fermentation, 2020, 56(1):54-63;72.
[21] GARRITY G, BOONE D R, CASTENHOLTZ R W.Bergey's manual of systematic bacteriology:Volume 3:The Firmicutes[M].Berlin:Springer Science & Business Media, 2011.
[22] BREIDT F, MEDINA E, WAFA D, et al.Characterization of cucumber fermentation spoilage bacteria by enrichment culture and 16S rDNA cloning[J].Journal of Food Science, 2013, 78(3):470-476.
[23] KATO H, RHUE M R, NISHIMURA T.Role of free amino acids and peptides in food taste[J].Flavor Chemistry,1989,388:158-174.
[24] KRANENBURG R V, KLEEREBEZEM M, VLIEG J V H, et al.Flavour formation from amino acids by lactic acid bacteria:Predictions from genome sequence analysis[J].International Dairy Journal, 2002, 12(2-3):111-121.
[25] BRESLIN P A S.Interactions among salty, sour and bitter compounds[J].Trends in Food Science & Technology, 1996, 7(12):390-399.
[26] KEAST R S J, BRESLIN P A S.An overview of binary taste-taste interactions[J].Food Quality and Preference, 2003, 14(2):111-124.
[27] KIRIMURA J, SHIMIZU A, KIMIZUKA A, et al.Contribution of peptides and amino acids to the taste of foods[J].Journal of Agricultural and Food Chemistry, 1969, 17(4):689-695.
[28] RADOM R P,JAN V,HELENA H.Decomposition products of allyl isothiocyanate in aqueous solutions[J].J Agric Food Chem, 1997, 45(12):4 584-4 588.
R P,JAN V,HELENA H.Decomposition products of allyl isothiocyanate in aqueous solutions[J].J Agric Food Chem, 1997, 45(12):4 584-4 588.
[29] RATHNA J, BAKKIYARAJ D, PANDIAN S K.Anti-biofilm mechanisms of 3,5-di-tert-butylphenol against clinically relevant fungal pathogens[J].Biofouling, 2016, 32(9):979-993.
[30] 孙宝国. 食用调香术[M].北京:化学工业出版社, 2003.
SUN B G.Food flavoring technology[M].Beijing:Chemical Industry Press, 2003.
[31] 章献, 赵勇, 刘源, 等.2种韩国泡菜挥发性风味物质分析研究[J].食品与发酵工业, 2009, 35 (1):150-156.
ZHANG X, ZHAO Y, LIU Y, et al.Analysis of the volatiles in two kinds of Korea kimchi by gas chromatograph-mass spectrometry with solid phase microextraction[J].Food and Fermentation Industries, 2009, 35 (1):150-156.
[32] 徐丹萍, 蒲彪, 刘书亮, 等.不同发酵方式的泡菜挥发性成分分析[J].食品科学, 2015, 36 (16):94-100.
XU D P, PU B, LIU S L, et al.Analysis of volatile components in pickles fermented with different starter cultures[J].Food Science, 2015, 36 (16):94-100.