人体细胞在代谢过程中会产生大量的活性氧(reactive oxygen species,ROS),机体的抗氧化防御系统可以有效地清除这些ROS,即正常情况下,ROS的产生和消除处于一种微妙的平衡状态[1]。当ROS产生过多或机体抗氧化防御系统失效时,这种平衡就会被打破,机体将处于氧化应激状态[2]。由过量ROS引起的氧化应激会破坏细胞的氧化还原稳态,诱导细胞自噬,引发细胞凋亡,并引起不可逆的组织损伤[3]。已经证实,氧化应激引起的损害可导致癌症、糖尿病、炎症、心血管疾病、哮喘以及阿尔茨海默病等多种慢性疾病[4-6]。此外,ROS在食品加工和贮存过程中也发挥着重要作用,它会导致食品酸败、异味、质地退化、营养价值降低,进而给人们带来经济损失和健康风险[7]。因此,需要更多的关注如何增强组织和细胞对ROS的防御以及如何延缓食品在加工和贮藏过程中的氧化变质。
抗氧化剂在减轻机体的氧化损伤以及预防食品的氧化变质方面起着非常重要的作用。虽然合成抗氧化剂,如丁基羟基茴香醚、没食子酸丙酯、丁基羟基甲苯和叔丁基氢醌等,具有高效和价格低廉的优点,但是其潜在的毒性和致癌性导致其在食品工业中的应用受到限制,所以,人们将更多的注意力集中于天然抗氧化剂上[6]。抗氧化肽是近年来被广泛研究的一类天然生物活性肽。抗氧化肽作为一种天然抗氧化剂,其结构相对简单、易吸收、稳定性好、无免疫反应性,不仅具有较强的抗氧化活性,还具有降血压和抗癌等其他保健功效,在食品和医疗保健品领域越来越受到人们的关注[4, 6, 8]。在Web of Science数据库中以“抗氧化肽”(antioxidant peptide或antioxidative peptide)作为检索词进行标题检索,结果显示,2000—2020年,国内外学者累计发表了3 089篇抗氧化肽的相关文章,且文献的数量呈现逐年增加的趋势。截至2020年6月,已有652个长度在2~30个残基的抗氧化肽序列被存入BIOPEP数据库[9]。综上表明,抗氧化肽是一个非常重要的科学研究领域。因此本文综述了近年来抗氧化肽的相关研究进展,分析和总结了抗氧化肽在研究和开发过程中存在的具体问题,并对其未来的开发应用前景进行了展望,旨在为抗氧化肽的深度开发利用提供参考。
1 抗氧化肽的制备
目前,抗氧化肽的制备途径主要有3种:(1)直接从生物体中分离提取内源性抗氧化肽;(2)通过蛋白酶酶解、酸水解或发酵法降解可食性蛋白质制备抗氧化肽;(3)通过化学反应或DNA重组手段人工合成抗氧化肽。在这些方法中,酶解法因具有条件温和、易于控制、专一性较强、副产物少、安全性高和易于推广等优点,研究得最多[10-11]。动物和植物蛋白是酶解法生产抗氧化肽的重要原料来源。当前,植物性蛋白的原料主要有大豆、玉米、小麦、花生、水稻和菜籽等,其中作为粮食的大豆、玉米和小麦及其加工的附产品研究得较多,也较为深入;动物性蛋白原料以乳蛋白居多,其次是肉类蛋白。乳蛋白包括全乳、乳清蛋白和乳酪蛋白等,而肉蛋白以鱼类加工的副产品居多。除了动物和植物蛋白,近年来以食用菌分离蛋白为原料制备抗氧化肽的研究也越来越多,如源自阿魏菇[12]、元蘑[13]和双孢菇[14]等食用菌蛋白的抗氧化肽均有报道。风味蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶和碱性蛋白酶等各种商用蛋白酶是抗氧化肽制备经常使用的水解酶[15]。这些酶可以单独作用,也可联合作用。在一些研究中,用胃蛋白酶-胰蛋白酶的连续水解模拟人体的胃肠道消化来生产抗氧化肽[16]。表1给出了近年来酶解法制备抗氧化肽的一些实例,这些研究成功地从多种不同原料蛋白中制备出具有较强活性的抗氧化肽。从这些文献报道可知,酶解过程中,所使用蛋白酶的种类直接影响着所得抗氧化肽的大小、组成以及氨基酸顺序,并最终影响其抗氧化活性。另外,反应时间、温度、pH、酶/底物比例等催化反应条件也会对抗氧化肽的活性产生重要影响。
表1 酶解法制备抗氧化肽实例
Table 1 Examples of producing antioxidant peptide by enzymatic hydrolysis

蛋白来源蛋白酶水解条件参考文献黑豆碱性蛋白酶pH 8.0,50 ℃,[E]/[S] 1%,3 h[5]麦胚碱性蛋白酶pH 9.0,50 ℃,[E]/[S] 4 000 U/g,4 h[17]玉米碱性蛋白酶pH 10.0,45 ℃,[E]/[S] 7%,3 h[18]米糠胃蛋白酶-胰蛋白酶pH 2.0,37 ℃,[E]/[S] 2%,2 h;pH 7.5,37 ℃,[E]/[S] 4%,2 h[16]乳清胰蛋白酶pH 8.0,41.1 ℃,[E]/[S] 1.7%,4.31 h[19]虹鳟鱼碱性蛋白酶-风味蛋白酶pH 8.5,58 ℃,[E]/[S] 1%,1.5 h;pH 7.0,50 ℃,[E]/[S] 1%,1.5 h[20]泥蚶碱性蛋白酶-中性蛋白酶pH 8.5,50 ℃,[E]/[S] 1.5%,1.5 h;pH 7.0,55 ℃,[E]/[S] 1.5%,1.5 h[21]元蘑风味蛋白酶pH 7.6,42 ℃,[E]/[S] 6 000 U/g,3 h[13]
2 抗氧化肽的分离纯化与结构鉴定
分离纯化是抗氧化肽研究开发的重要环节。抗氧化肽分离纯化与结构鉴定的操作程序一般如图1所示[22]。原料蛋白经过酶法水解后,产物一般是蛋白质、肽及氨基酸的混合物,而且混合物中的各种小肽分子大多分子质量相近、亲水性和疏水性也相似,分离纯化比较困难。当前对抗氧化肽的分离和纯化主要基于它们的理化特性,例如分子质量大小、电荷、极性、溶解度以及特定的共价或非共价相互作用等。现有的研究中,一般采用多种分离纯化方法相结合的方式获得目标抗氧化肽。常采用的分离纯化方式有超滤、凝胶过滤层析、离子交换层析、亲和层析和反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HLPC)等。
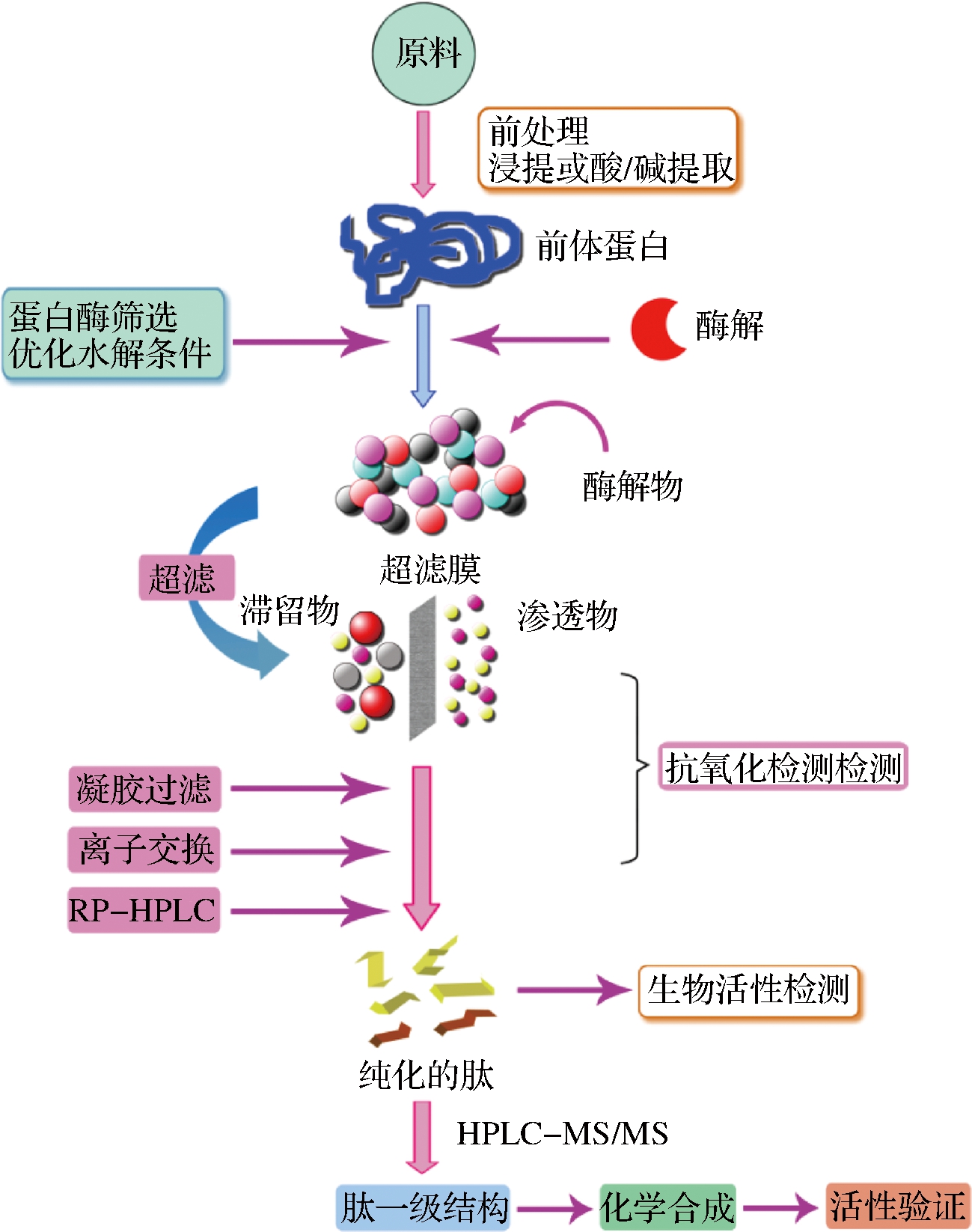
图1 抗氧化肽的分离纯化与结构鉴定流程
Fig.1 Procedure for the isolation and identification of antioxidant peptides
结构鉴定是开发新型抗氧化肽的必要步骤。目前常用的抗氧化肽结构鉴定方法有蛋白质/肽序列分析仪法、质谱法(mass spectrometry, MS)和核磁共振(nuclear magnetic resonance, NMR)等。蛋白质/肽序列分析仪对样品纯度要求非常高,且在有些情况下会遇到困难,如N端有封头,肽链中有改性氨基酸以及肽的疏水性很强等都会使测定无法进行或者发生错误,一般认为该法在30步内比较可靠[23]。质谱法具有高灵敏度和高效率等优点,使之适用于肽类物质的一级结构检测。可用于抗氧化肽结构鉴定的质谱方法有快原子轰击质谱、电喷雾电离质谱(electrospray ionization-mass spectrometry,ESI-MS)和基质辅助激光解析电离飞行时间质谱[24]。质谱法与高效液相色谱的联用技术使抗氧化肽的结构鉴定更加高效。当前,液相色谱-三重四极杆质谱联用仪(liquid chromatograph-mass spectrometer/mass spectrometer,LC-MS/MS)已广泛用于肽类物质一级结构的鉴定。核磁共振由于图谱信号的纯数字化、范围过宽、过度的重叠、核信号弱和图谱分辨率低等原因,在抗氧化肽的结构鉴定中应用不多。相信随着二维、三维以及四维NMR的应用,以及分子生物学、计算机处理技术的发展,NMR也有望在肽类物质的分析鉴定中得到越来越广泛的应用[23]。
表2总结了近两年来国内外科研人员已分离和鉴定的部分抗氧化肽。由表2可知,当前国内外的很多实验室都在优选抗氧化肽的分离纯化方法,有越来越多的抗氧化肽被分离和鉴定出来,但普遍存在分离过程繁杂、仪器昂贵、成本较高、产率较低、普适性差以及难以实现工业化等问题。
表2 2019—2020年分离鉴定的抗氧化肽精选
Table 2 Selected antioxidant peptides isolated and identified during 2019—2020

蛋白来源纯化方法鉴定方法肽一级结构参考文献苦荞超滤、离子交换、凝胶过滤和RP-HPLC肽测序仪和ESI-MSGEVPW,YMENF和AFYRW[25]绿豆超滤和凝胶过滤UPLC-Q-TOF-MSWGN,AW,RGWYE和GVPFW[26]赤芍超滤、离子交换和RP-HPLCLC-MS/MSFSAP,PVETVR,QEPLLR,EAAY和VLRPPLS[27]龙须菜超滤、凝胶过滤和RP-HPLCUPLC-MS/MSELWKTF[28]小黄鱼超滤、离子交换、凝胶过滤和RP-HPLC蛋白测序仪和ESI-MSDGPEGR,GPEGPMGLE,EGPFGPEG,YGPDGPTG,GFIGPTE和IG-PLGA[29]安康鱼超滤、离子交换、凝胶过滤和RP-HPLC蛋白测序仪和ESI-MSEDIVCW,MEPVW和YWDAW[30]鸭血超滤、凝胶过滤和RP-HPLCnano-LC-MS/MSLDGP,TGVGTK,EVGK,RCLQ,LHDVK,KLGA和AGGVPAG[31]羊肉火腿凝胶过滤、离子交换和RP-HPLCLC-MS/MSMWTD,APYMM和FWIIE[32]
抗氧化肽的抗氧化活性与其分子质量大小、疏水性以及氨基酸组成和序列密切相关。分子质量较小的肽通常比分子质量大的肽具有更强的抗氧化活性,因为它们更易于与目标自由基相互作用,终止连锁反应,大多数抗氧化肽的分子质量为500~1 800 Da[30, 33]。疏水性是影响肽的抗氧化活性的关键因素之一,色氨酸、脯氨酸、缬氨酸、苯丙氨酸、亮氨酸、丙氨酸和甲硫氨酸等疏水性氨基酸残基能够促进肽在脂质-水界面处的溶解,从而更好地发挥清除自由基的作用[15, 31]。特别是亮氨酸或缬氨酸位于N-末端时,肽的抗氧化活性通常更强[34]。芳香性氨基酸也对肽的抗氧化活性具有重要影响,因为色氨酸、苯丙氨酸和酪氨酸残基中的芳香族基团可以通过提供氢质子来清除自由基[30]。另外,资料表明,酸性或碱性氨基酸如天冬氨酸、谷氨酸、精氨酸和组氨酸等对肽的抗氧化活性起着重要作用,这些氨基酸残基所带的电荷直接决定着肽对金属离子(如Fe2+和Cu2+)的螯合能力[16, 35]。总之,较低的分子质量、特定氨基酸残基的疏水性、供氢体作用以及螯合金属离子作用可能是抗氧化肽具有较强抗氧化活性的重要原因。
3 抗氧化肽的分子修饰
酶解法水解底物蛋白制备的抗氧化肽,其抗氧化活性必定受原料蛋白一级结构的限制,因此,为进一步提高抗氧化肽的生物学效用,有必要对其结构作进一步的修饰处理。分子修饰的目的是为了延长和提高抗氧化肽在目标靶位的生物活性。对肽类进行分子修饰,即在其氨基酸序列上偶合糖类、脂类、微量元素等修饰基团,可将修饰基团的优良性质(如水溶性、低抗原性和功能性)赋予肽分子,同时修饰基团的空间位阻可抑制蛋白酶对肽键的水解,分子质量的提高可避免肾小球的过滤,从而提高肽在体内的稳定性,延长其半衰期和药效。分子修饰是解决制约活性肽发展与应用问题行之有效的策略之一,也是近年来食品科学和药学领域研究中的一个重要发展方向。脂质化、改变肽本身的结构(D型或非天然氨基酸替换、在肽链中引入非肽键结构)、阳离子化、糖基化以及聚乙二醇化等是常见的活性肽的化学修饰方式[36]。目前已报道的活性肽的化学修饰大多集中在抗菌肽上,抗氧化肽的相关研究相对较少。WANG等[37]研究发现,Zn2+配位修饰可显著提高抗氧化肽对胃蛋白酶的消化抗性;CHEN等[38]研究证实,借助美拉德反应的糖基化修饰显著增强了鱼鳞肽的抗氧化活性。LIN等[39]用脉冲电场处理松籽抗氧化肽,产物的抗氧化活性得到了显著的改善;ZHAO等[40]通过类蛋白反应修饰大豆蛋白水解物,发现产物的抗氧化活性明显提高。YE等[41]以亚硒酸钠为硒源,对大豆肽进行硒螯合修饰,发现与原大豆肽相比,大豆肽-硒螯合物的还原力和清除羟自由基的能力得到大幅度提升。总的来说,目前抗氧化肽的分子修饰大多采用简单的物理或化学手段,还处于起步探索阶段,仍有很大的潜力可供挖掘。
分子修饰后的抗氧化肽的安全性是一个必须要考虑的问题。郭洪辉等[42]通过小鼠急性毒性试验证实,河豚鱼皮胶原肽锌螯合物的LD50为6.847 9 g/kg,属于无毒级;YE等[41]用大豆肽的硒螯合物饲喂小鼠,结果表明,在实验设定的处理条件下,大豆肽的硒螯合物既没有导致小鼠氧化损伤,也未引起其他临床变化。WANG等[43]研究发现,鸡骨蛋白肽的糖基化修饰物在大鼠试验中未显示任何的毒副作用。当前,有关抗氧化肽分子修饰物安全性的报道较少,研究也不够系统和深入。因此,抗氧化肽及其分子修饰物在作为天然抗氧化剂应用于功能性食品、化妆品以及医药行业之前,有必要进行一系列的毒理学检测以及人类临床试验以进一步证实其安全性。
4 抗氧化肽的活性评价和作用机理
因为食物或生物系统中氧化过程的复杂性以及不同抗氧化剂可能有不同的抗氧化机制,所以寻找一种全面表征抗氧化肽抗氧化能力的方法并不容易。当前,国内外评价抗氧化肽抗氧化活性的方法主要有3种:(1)化学模型法,即通过检测还原力、对各种自由基的清除能力、对过渡金属离子的螯合能力及抗脂质过氧化能力等来反映抗氧化肽的抗氧化活性;(2)细胞生物法,即采用生物细胞或组织匀浆,通过引入ROS诱发氧化应激损伤,再根据一些相关的氧化和非氧化指标的检测结果来评价抗氧化活性。细胞生物法比化学法更具生物学相关性,因为它考虑了抗氧化肽的细胞摄取、分布以及代谢等方面;(3)体内实验法,即使用动物模型,通过测定血浆、肝脏、心脏及脑等组织超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和丙二醛等抗氧化指标的变化来评估抗氧化肽的疗效[44]。3种方法中,由于化学模型法具有操作简便、高效、损耗小、便于重复及实验周期短等特点,所以一直以来,抗氧化肽抗氧化活性的研究大多都浅表地停留在化学模型法检测其是否具有体外抗氧化能力的层面上,仅有部分研究采用细胞模型或动物实验对抗氧化肽的抗氧化活性进行深入分析[34]。另外,上述方法存在着“不同底物体外化学法的研究结果存在不一致性”、“体外化学法和细胞生物法的研究结果存在不一致性”以及“体内和体外实验研究的结果存在不一致性”等问题。例如,通过检测氧自由基吸收能力从卵转铁蛋白中鉴定出的16种抗氧化肽在人脐静脉内皮细胞中并未显示出抗氧化活性[33]。因此,如果抗氧化肽的目标应用涉及生物系统,那么评估肽的抗氧化活性仅用体外化学法是不够的,至少还应在细胞培养模型中确定其抗氧化功效,然后再对其进行深入研究才有意义。
抗氧化肽的抗氧化作用涉及许多复杂机制的参与。据现有文献报道[33],抗氧化肽可通过提供还原力、清除自由基、螯合金属离子、氧化损伤保护以及调节机体抗氧化/解毒酶活性等多种方式发挥抗氧化作用(图2)。

图2 抗氧化肽的作用机制
Fig.2 Action mechanism of antioxidant peptides.
在体外化学模型中,抗氧化肽的抗氧化作用主要体现在清除自由基和抑制脂质过氧化。抗氧化肽清除自由基的机制有2种:氢原子转移(hydrogen atom transfer,HAT)和单电子转移(single electron transfer,SET)[2]。氧自由基吸收能力、总氧自由基清除能力和总抗氧化活性等是基于HAT的抗氧化活性检测方法;铁离子还原法是基于SET的抗氧化活性检测方法;清除2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力的测定既利用了SET的直接还原机制,也涉及HAT机制来猝灭自由基[11]。含有酪氨酸、组氨酸和其他容易提供质子氨基酸的抗氧化肽的抗氧化作用通常是利用HAT机制,而富含组氨酸、半胱氨酸和色氨酸的抗氧化肽的抗氧化作用则使用SET机制[10]。亚油酸,低密度脂蛋白以及动植物脂肪等常用于体外化学模型中以评估抗氧化肽对脂质过氧化的抑制作用。在这些模型体系中,直接清除自由基、提供质子以阻断自由基链式反应以及螯合金属离子是抗氧化肽发挥脂质过氧化抑制作用的主要机制[2]。在细胞或动物模型中,抗氧化肽可通过减轻氧化应激反应来保护细胞或组织器官(如心、肝、肾及脑等)免受氧化损伤,其作用机制涉及清除自由基、调节氧化还原酶(如谷胱甘肽过氧化物酶、超氧化物岐化酶和过氧化氢酶等)的活性、降低氨基酸转移酶(谷草转氨酶,谷丙转氨酶)的活性、调节谷胱甘肽代谢以及调节抗氧化基因表达等多个方面,其中激活Nrf2-ARE信号通路以增强内源性抗氧化酶防御系统对于抗氧化肽在模型细胞或动物体内发挥抗氧化作用至关重要[2, 10, 15]。总的来说,当前通过细胞和动物模型对抗氧化肽作用机制的研究是有限的,抗氧化肽究竟以什么方式、何种途径对生物细胞的氧化损伤进行保护和调控尚缺乏明确的共识。
5 生物信息学工具在抗氧化肽研究中的应用
生物信息学工具(In silico tools)为预测、分析和筛选抗氧化肽提供了一种经济、有效的手段,成为近年来抗氧化肽研究的一种新兴方法。利用生物信息学工具可分析和挖掘数据库中的各种蛋白质序列信息,寻找生物活性肽的潜在前体;预测所选蛋白质序列的潜在生物活性图谱,计算所选蛋白质序列中潜在生物活性片段的出现频率;分析酶切位点,筛选合适的蛋白酶,优化母体蛋白的可控水解;进行目标肽的生物活性预测,二级结构预测,感官特性(甜、苦、鲜味等)、毒性和过敏性预测以及理化性质(分子质量、等电点、疏水性、溶解性等)评价和构效关系分析等[45- 46]。基于局部比对算法的搜索工具(BLAST)、BIOPEP数据库工具以及分子对接工具(Molecular docking)等一些流行的生物信息学工具(表3)已广泛应用于抗氧化肽的相关研究中。在这些工具的辅助下,已从动物、植物以及肉类等产品中成功地获得了多种不同的抗氧化活性肽[35, 47-49]。
表3 抗氧化肽研究中的常用数据库及工具
Table 3 Common database and tools for discovery and development of antioxidant peptides

种类名称网址蛋白质/肽序列UniProtKBhttp://www.uniprot.org/NCBI Proteinhttp://www.ncbi.nlm.nih.gov/proteinRCSB Protein Data Bankhttps://www.rcsb.org/pdb/home/home.doBIOPEPhttp://www.uwm.edu.pl/biochemiaPeptideDBhttp://www.peptides.be/PepBankhttp://pepbank.mgh.harvard.edu/SwePephttp://www.swepep.org/EROP‐Moscowhttp://erop.inbi.ras.ru/模拟酶解PeptideCutterhttp://web.expasy.org/peptide_cutterBIOPEPhttp://www.uwm.edu.pl/biochemia/index.php/en/biopepPOPShttp://pops.csse.monash.edu.au/pops-cgi/index.phpEnzyme Predictorhttp://bioware.ucd.ie/~enzpred/Enzpred.phpProtein Digestion Simula-torhttps://omics.pnl.gov/software/protein-digestion-simulator理化性质/活性ProtParamhttps://web.expasy.org/protparam/PeptideRankerhttp://distilldeep.ucd.ie/PeptideRanker/Innovagen ABhttp://www.innovagen.com/proteomics-toolsPepDrawhttp://www.tulane.edu/~biochem/WW/PepDraw/index.htmlHemoPIhttps://webs.iiitd.edu.in/raghava/hemopi/design.phpCellPPDhttps://webs.iiitd.edu.in/raghava/cellppd/multi_pep.php毒性/致敏性/苦味ToxinPredhttp://www.imtech.res.in/raghava/toxinpred/AlgPredhttp://www.imtech.res.in/raghava/algpred/BitterPredit,http://bitterdb.agri.huji.ac.il/dbbitter.php#BitterPredict分子对接DOCK Blasterhttp://blaster.docking.org/SwissDockhttp://www.swissdock.ch/1-CLICK DOCKINGhttps://mcule.com/apps/1-click-docking/CABShttp://biocomp.chem.uw.edu.pl/CABSdock/BSP-SLIMhttps://zhanglab.ccmb.med.umich.edu/BSP-SLIM/GalaxyWEBhttp://galaxy.seoklab.org/cgi-bin/submit.cgi?type=PEPDOCK
利用生物信息学工具进行抗氧化肽的初步模拟筛选,能够让研究人员可以专注于少数最有可能具有高效抗氧化活性的候选多肽。这种方法允许科研人员在用选定的蛋白质和酶的组合进行实验操作之前,预先预测所得肽的种类、理化性质、感官特性以及生物活性[50];生物信息学工具所预测肽的物理化学性质也可以为后续肽的分离纯化提供指导[51]。生物信息学工具的应用,使抗氧化肽的研究变得更加经济和高效,但利用这些工具进行计算机模拟的结果并非在实验室操作中完全适用,因为,通过生物信息学工具的酶解过程以及生物活性的假设等是建立在蛋白质一级结构的基础上,并未考虑二硫键、肽链的折叠状态、蛋白翻译后的修饰以及空间结构等对酶解作用的影响,也未考虑温度、pH和离子强度等各种干扰因素的作用。因此,未来还需要进一步的工作来提升生物信息学工具对抗氧化肽的分析和预测能力。
6 抗氧化肽的开发前景与挑战
不同来源的抗氧化肽具有分子质量小、活性较强、安全性好、成本低、易于吸收等优点,是合成抗氧化剂的潜在替代品,能够对人类健康产生积极的影响,可作为控制食品氧化变质的功能性成分,也可以作为生产保健品、功能性食品、化妆品乃至药品的多功能原料,在食品科学、药学和生物学等领域都已显示出极为广阔的研究开发前景。然而,在抗氧化肽作为天然抗氧化剂大规模地应用到人类营养和健康领域之前,仍有许多科学和技术问题亟需解决:(1)由于酶解法产生的很多小肽结构相近,分子质量也相差不大,如何将目标抗氧化肽高效地进行分离纯化以方便进行规模化生产是需要解决的首要问题。(2)尽管抗氧化肽在一些体内和体外试验中显示出良好的抗氧化活性,能预防氧化相关的疾病,并对人体健康产生有益的影响。但是,目前,尚无可用于评估肽抗氧化能力的标准化程序。(3)抗氧化肽的不稳定性是限制其在食品和药物中应用的一个巨大障碍。有些抗氧化肽存在口服生物利用度低、半衰期短、肝脏和肾脏清除快等缺点,而且这些抗氧化肽还可能与食物基质中的组分相互作用,导致其活性降低,甚至产生不良产物。(4)抗氧化肽的定量构效关系还有待进一步验证,在体内的作用机制尚未被完全阐明,这在一定程度上阻碍了抗氧化肽的工业化和商品化进程。(5)有关抗氧化活性以外的其他人类健康促进作用以及抗氧化肽的生物利用度、体内持久性和体内靶向性仍需要进一步研究。(6)部分抗氧化肽的苦味是其成为功能性食品或防治氧化损伤相关慢性疾病的药物过程中的另一主要缺点。不过,随着科学研究的不断深入以及现代分离纯化与检测技术、分子修饰技术、分子与细胞生物学和各种组学技术以及生物信息学应用工具的快速发展,相信这些问题都将被一一解决,从而为抗氧化肽的开发应用开辟更加广阔的空间。
[1] LI S, TAN H Y, WANG N, et al.The role of oxidative stress and antioxidants in liver diseases[J].International Journal of Molecular Sciences, 2015, 16(11):26 087-26 124.
[2] ESFANDI R, WALTERS M E, TSOPMO A.Antioxidant properties and potential mechanisms of hydrolyzed proteins and peptides from cereals[J].Heliyon, 2019, 5(4):e01 538.
[3] SHEN R, LIU D S, HOU C C, et al.Protective effect of Potentilla anserina polysaccharide on cadmium-induced nephrotoxicity in vitro and in vivo[J].Food & Function, 2017, 8(10):3 636-3 646.
[4] JIN J E, AHN C B, JE J Y.Purification and characterization of antioxidant peptides from enzymatically hydrolyzed ark shell (Scapharca subcrenata)[J].Process Biochemistry, 2018, 72:170-176.
[5] CHEN Z, BERTIN R, FROLDI G.EC50estimation of antioxidant activity in DPPH center dot assay using several statistical programs[J].Food Chemistry, 2013, 138(1):414-420.
[6] FENG Y X, RUAN G R, JIN F, et al.Purification, identification, and synthesis of five novel antioxidant peptides from Chinese chestnut (Castanea mollissima Blume) protein hydrolysates[J].Lwt-Food Science and Technology, 2018, 92:40-46.
[7] ZENG Y Y, JIAN H Q.Comparison of antioxidant activities of melanin fractions from chestnut shell[J].Molecules, 2016, 21(4):487.
[8] ZENG W C, SUN Q, ZHANG W H, et al.Antioxidant activity in vivo and biological safety evaluation of a novel antioxidant peptide from bovine hair hydrolysates[J].Process Biochemistry, 2017, 56:193-198.
[9] MINKIEWICZ P, IWANIAK A, DAREWICZ M.BIOPEP-UWM database of bioactive peptides:Current opportunities[J].International Journal of Molecular Sciences, 2019, 20(23):5 978.
[10] ASHAOLU T J.Antioxidative peptides derived from plants for human nutrition:Their production, mechanisms and applications[J].European Food Research and Technology, 2020, 246(5):853-865.
[11] BORRAJO P, PATEIRO M, BARBA F J, et al.Antioxidant and antimicrobial activity of peptides extracted from meat by-products:A review[J].Food Analytical Methods, 2019, 12(11):2 401-2 415.
[12] 郑晓吉, 许程剑, 牛博楠, 等.新疆阿魏菇抗氧化肽分离纯化及抗氧化性质[J].食品与生物技术学报, 2015, 34(5):524-529.
ZHENG X J, XU C J, NIU B N, et al.Separation, purification and antioxidant activity study of antioxidant peptides from Pleurotus ferulae lenzi in Xinjiang[J].Journal of Food Science and Biotechnology, 2015, 34(5):524-529.
[13] 栗铭鸿, 姜伊悦, 张小勇, 等.酶法制备元蘑蛋白肽及其分级组分抗氧化活性研究[J].食品与机械, 2019, 35(11):176-181.
LI M H, JIANG Y Y, ZHANG X Y, et al.Preparation and antioxidant activity of protein peptides by enzymatic from Hohenbuehelia serotina[J].Food & Machinery, 2019, 35(11):176-181.
[14] 李桂峰, 王向东, 赵国建, 等.酶解双孢菇蛋白制备抗氧化肽的研究[J].中国食品学报, 2011, 11(5):37-43.
LI G F, WANG X D, ZHAO G J, et al.Enzymolysis technology for preparation of antioxidant peptides from Agaricus bisporus protein[J].Journal of Chinese Institute of Food Science and Technology, 2011, 11(5):37-43.
[15] WONG F C, XIAO J B, WANG S Y, et al.Advances on the antioxidant peptides from edible plant sources[J].Trends in Food Science & Technology, 2020, 99:44-57.
[16] PHONGTHAI S, RAWDKUEN S.Fractionation and characterization of antioxidant peptides from rice bran protein hydrolysates stimulated by in vitro gastrointestinal digestion[J].Cereal Chemistry, 2020, 97(2):316-325.
[17] ZHANG J, WEN C, LI C, et al.Antioxidant peptide fractions isolated from wheat germ protein with subcritical water extraction and its transport across Caco-2 cells[J].Journal of Food Science, 2019, 84(8):2 139-2 146.
[18] ZHANG S, ZHANG M, YANG R, et al.Preparation, identification, and activity evaluation of antioxidant peptides from protein hydrolysate of corn germ meal[J].Journal of Food Processing and Preservation, 2019, 43(10):e14 160.
[19] BALLATORE M B, DEL R B M, BRABER N L V, et al.Antioxidant and cytoprotective effect of peptides produced by hydrolysis of whey protein concentrate with trypsin[J/OL].Food Chemistry, 2020.DOI:10.1016/j.foodchem.2020, 319:126472.
[20] YAGHOUBZADEH Z, GHADIKOLAII F P, KABOOSI H, et al.Antioxidant activity and anticancer effect of bioactive peptides from rainbow trout (Oncorhynchus mykiss) skin hydrolysate[J].International Journal of Peptide Research and Therapeutics, 2020, 26(1):625-632.
[21] YANG X R, QIU Y T, ZHAO Y Q, et al.Purification and characterization of antioxidant peptides derived from protein hydrolysate of the marine bivalve mollusk Tergillarca granosa[J].Marine Drugs, 2019, 17(5):251.
[22] ADMASSU H, GASMALLA M A A, YANG R J, et al.Bioactive peptides derived from seaweed protein and their health benefits:Antihypertensive, antioxidant, and antidiabetic properties[J].Journal of Food Science, 2018, 83(1):6-16.
[23] 曹亚兰. 大豆抗氧化肽的制备、分离纯化及结构鉴定[D].广州:华南理工大学, 2012.
CAO Y L.Study on the preparation, purification and identification of soybean antioxidant peptide[D].Guangzhou:South China University of Technology, 2012.
[24] 王俊杰. 胚胎蛋源性抗氧化肽的制备、分离纯化与结构鉴定[D].南昌:南昌大学, 2014.
WANG J J.Study on separation, purification and identification of embryonated eggs antioxidant peptide[D].Nanchang:Nanchang University, 2014.
[25] LUO X, FEI Y, XU Q, et al.Isolation and identification of antioxidant peptides from tartary buckwheat albumin (Fagopyrum tataricum Gaertn.) and their antioxidant activities[J].Journal of Food Science, 2020, 85(3):611-617.
[26] XIA J A, SONG H, HUANG K, et al.Purification and characterization of antioxidant peptides from enzymatic hydrolysate of mungbean protein[J].Journal of Food Science, 2020, 85(6):1 735-1 741.
[27] WANG M, LI C, LI H, et al. In vitro and in silico antioxidant activity of novel peptides prepared from Paeonia ostii ‘Feng Dan’ hydrolysate[J].Antioxidants, 2019, 8(10):433.
[28] ZHANG X, CAO D, SUN X, et al.Preparation and identification of antioxidant peptides from protein hydrolysate of marine alga Gracilariopsis lemaneiformis[J].Journal of Applied Phycology, 2019, 31(4):2 585-2 596.
[29] WANG W Y, ZHAO Y Q, ZHAO G X, et al.Antioxidant peptides from collagen hydrolysate of redlip croaker (Pseudosciaena polyactis) scales:Preparation, characterization, and cytoprotective effects on H2O2-damaged HepG2 Cells[J].Marine Drugs, 2020, 18(3):156.
[30] HU X M, WANG Y M, ZHAO Y Q, et al.Antioxidant peptides from the protein hydrolysate of monkfish (Lophius litulon) muscle:Purification, identification, and cytoprotective function on HepG2 cells damage by H2O2[J].Marine Drugs, 2020, 18(3):153.
[31] YANG J, HUANG J, DONG X, et al.Purification and identification of antioxidant peptides from duck plasma proteins[J/OL].Food Chemistry, 2020.DOI:10.1016/j.foodchem.2020.126534.
[32] WANG J, LU S, LI R, et al.Identification and characterization of antioxidant peptides from Chinese dry-cured mutton ham[J].Journal of the Science of Food and Agriculture, 2020, 100(3):1 246-1 255.
[33] CHAI T T, LAW Y C, WONG F C, et al.Enzyme-assisted discovery of antioxidant peptides from edible marine invertebrates:A review[J].Marine Drugs, 2017, 15(2):42.
[34] NWACHUKWU I D, ALUKO R E.Structural and functional properties of food protein-derived antioxidant peptides[J].Journal of Food Biochemistry, 2019, 43(1):e12 761.
[35] ZHANG J, DU H Y, ZHANG G N, et al.Identification and characterization of novel antioxidant peptides from crucian carp (Carassius auratus) cooking juice released in simulated gastrointestinal digestion by UPLC-MS/MS and in silico analysis[J].Journal of Chromatography B, 2020, 1 136:121 893.
[36] WITT K A, GILLESPIE T J, HUBER J D, et al.Peptide drug modifications to enhance bioavailability and blood-brain barrier permeability[J].Peptides, 2001, 22(12):2 329-2 343.
[37] WANG C, LI B, WANG B, et al.Degradation and antioxidant activities of peptides and zinc-peptide complexes during in vitro gastrointestinal digestion[J].Food Chemistry, 2015, 173:733-740.
[38] CHEN X, FANG F, WANG S.Physicochemical properties and hepatoprotective effects of glycated Snapper fish scale peptides conjugated with xylose via maillard reaction[J/OL].Food and Chemical Toxicology, 2020.DOI:10.1016/j.fct.2020.111115.
[39] LIN S, LIANG R, XUE P, et al.Antioxidant activity improvement of identified pine nut peptides by pulsed electric field (PEF) and the mechanism exploration[J].LWT-Food Science and Technology, 2017, 75:366-372.
[40] ZHAO X H, SONG J T.Evaluation of antioxidant properties in vitro of plastein-reaction-stressed soybean protein hydrolysate[J].International Journal of Food Properties, 2014, 17(1):152-162.
[41] YE Q, WU X, ZHANG X, et al.Organic selenium derived from chelation of soybean peptide-selenium and its functional properties in vitro and in vivo[J].Food Function, 2019, 10(8):4 761-4 770.
[42] 郭洪辉, 陈晖, 俞云, 等.河豚鱼皮胶原肽螯合锌的组成与急性毒性研究[J].食品与发酵工业, 2020, 46(23):41-46.
GUO H H, CHEN H, YU Y, et al.Study on the composition and acute toxicity of collagen peptide chelated zinc from puffer skin[J].Food and Fermentation Industries, 2020, 46(23):41-46.
[43] WANG J Z, SUN H M, ZHANG C H, et al.Safety assessment of Maillard reaction products of chicken bone hydrolysate using Sprague-Dawley rats[J].Food & Nutrition Research, 2016, 60:27 827.
[44] 阚旭辉, 郭红英, 谭兴和, 等.可食性植物源抗氧化肽的研究进展[J].湖南农业科学, 2016(9):111-114.
KAN X H,GUO H Y,TAN X H, et al.Research progress on antioxidant peptides from edible plants source[J].Hunan Agricultural Sciences, 2016(9):111-114.
[45] RANI S, POOJA K, PAL G K.Exploration of rice protein hydrolysates and peptides with special reference to antioxidant potential:Computational derived approaches for bio-activity determination[J].Trends in Food Science & Technology, 2018, 80:61-70.
[46] AGYEI D, TSOPMO A, UDENIGWE C C.Bioinformatics and peptidomics approaches to the discovery and analysis of food-derived bioactive peptides[J].Analytical and Bioanalytical Chemistry, 2018, 410(15):3 463-3 472.
[47] ZHENG Y J, WANG X, ZHUANG Y L, et al.Isolation of novel ACE-inhibitory and antioxidant peptides from quinoa bran albumin assisted with an in silico approach:Characterization, in vivo antihypertension, and molecular docking[J].Molecules, 2019, 24(24):4 562.
[48] SHANG W H, TANG Y, SU S Y, et al.In silico assessment and structural characterization of antioxidant peptides from major yolk protein of sea urchin Strongylocentrotus nudus[J].Food & Function, 2018, 9(12):6 435-6 443.
[49] BECHAUX J, FERRARO V, SAYD T, et al.Workflow towards the generation of bioactive hydrolysates from porcine products by combining in silico and in vitro approaches[J].Food Research International, 2020, 132:109 123.
[50] CARRASCO-CASTILLA J, HERN NDEZ-
NDEZ- LVAREZ A J, JIMÉNEZ-MART
LVAREZ A J, JIMÉNEZ-MART NEZ C, et al.Use of proteomics and peptidomics methods in food bioactive peptide science and engineering[J].Food Engineering Reviews, 2012, 4:224-243.
NEZ C, et al.Use of proteomics and peptidomics methods in food bioactive peptide science and engineering[J].Food Engineering Reviews, 2012, 4:224-243.
[51] AGYEI D, ONGKUDON C M, WEI C Y, et al.Bioprocess challenges to the isolation and purification of bioactive peptides[J].Food and Bioproducts Processing, 2016, 98:244-256.