马铃薯作为全球四大粮食作物之一,其在贮藏期间会进入休眠状态。休眠是植物通过进入生长暂停状态来应对外界胁迫的一种生理反应[1]。当马铃薯的休眠被打破时其芽就会萌发。传统控制马铃薯在贮藏期间发芽的主要方法是使用化学抑制剂。氯苯胺灵(3-chlorophenyl carbamicacid,CIPC)是马铃薯贮藏中最有效的芽抑制剂,已经使用了40多年[2]。然而,大量滥用包括CIPC在内的合成化学抑制剂会对环境造成许多问题,并影响到其他生物[3]。因此人们对寻找新的安全高效的马铃薯发芽抑制剂越来越感兴趣。植物精油已被证明可以抑制马铃薯块茎的发芽。薄荷精油可以抑制不同品种马铃薯块茎的发芽[4],并较CIPC处理能够使马铃薯块茎保有更高的水分,降低块茎的失重率[5];薄荷精油的主要成分薄荷醇,已被研制为有效的马铃薯发芽抑制剂[6];添加迷迭香精油还更多保留了马铃薯块茎中的抗坏血酸和总多酚,从而维持了其抗氧化活性[7];香茅精油可以抑制马铃薯的发芽,让其在10 ℃以下存放60 d而不发芽[8]。
直接使用精油来抑制马铃薯发芽需要较高剂量才能达到预期效果,这会导致块茎感官品质降低,增加块茎处理成本。精油具有不稳定性、高疏水性和挥发性等特点。因此,许多研究对于精油在微胶囊、微球、纳米乳、脂质体等多种分散体系中的包合性进行了评价,旨在提高精油的分散性,通过缓释降低挥发损失,提高其生物效能[9]。崔婷的研究发现以白芨多糖作为壁材包埋的桂花精油保持了原有的抗氧化活性并与壁材产生协同作用[10];任婧楠等发现使用甜橙精油制成的纳米乳液对于多种细菌具有良好的抑制作用[11]。活性氧代谢是控制马铃薯块茎休眠与发芽的一个重要因素。
外源性活性氧(reactive oxygen species,ROS)的应用可以诱导马铃薯块茎打破休眠[12]。抗氧化物质和抗氧化酶在维持马铃薯块茎的ROS动态平衡中起关键作用[13]。过氧化氢(H2O2)和过氧化氢酶(catalase,CAT)抑制剂的应用均可缩短马铃薯块茎的休眠期,促进其快速发芽[14]。超氧化物歧化酶(superoxide dismutase,SOD)是抗氧化保护酶系中主要的ROS清除酶[15];过氧化物酶(peroxidase,POD)能够通过氧化酚类物质来降解![]() 此外,含铜的多酚氧化酶(polyphenol oxidase,PPO)在氧分子活化过程中起重要作用,而被活化的氧分子会通过芬顿反应产生更多的H2O2和其他的ROS[17-20]。另外,抗氧化物质如抗坏血酸,谷胱甘肽等[12]及细胞还原力[21]也在维持ROS的动态平衡中具有重要的作用。但目前尚未有关于精油纳米乳对于马铃薯块茎发芽的抑制方面的报道,对于精油如何抑制马铃薯块茎发芽的机理研究更少。
此外,含铜的多酚氧化酶(polyphenol oxidase,PPO)在氧分子活化过程中起重要作用,而被活化的氧分子会通过芬顿反应产生更多的H2O2和其他的ROS[17-20]。另外,抗氧化物质如抗坏血酸,谷胱甘肽等[12]及细胞还原力[21]也在维持ROS的动态平衡中具有重要的作用。但目前尚未有关于精油纳米乳对于马铃薯块茎发芽的抑制方面的报道,对于精油如何抑制马铃薯块茎发芽的机理研究更少。
“陇薯7号”马铃薯块茎是晚熟品种,其休眠期长达4个月[22],出于控制实验周期的目的,我们选用贮藏在10 ℃条件下120 d的“陇薯7号”商品薯[23]进行实验。为了控制精油抑芽处理的成本,本试验将4种伞形科植物精油进行复配制备出复配精油纳米乳,并选用雾化的方式对马铃薯块茎进行处理,探究复配精油纳米乳(mixed essential oil nanoemulsion,MEON)处理对马铃薯块茎抑芽的影响,从氧化抗氧化内稳态平衡维持的角度探讨其抑制发芽的机理,对马铃薯块茎的发芽率、失重率、H2O2含量进行测定,并对关键抗氧化物质和酶活的变化进行了评价,找到一种新的天然马铃薯块茎抑芽剂。
1 材料与方法
1.1 试验材料
4种伞形科植物种子孜然(Cuminum cyminum L.)、芫荽(Coriandrum sativum L.)、葛缕子(Carum carvi)和莳萝(Anethum graveolens L.)分别产自甘肃省酒泉市玉门饮马农场、甘肃省酒泉市玉门饮马农场、山东省山东省莱芜市金篓种植专业合作社和山东省莱芜市正香园香辛料种植专业合作社。
供试马铃薯‘陇薯7号’由甘肃省定西市爱兰马铃薯种业有限责任公司香泉基地提供,采收当天运回实验室,4 ℃冷库贮藏至第二年春季实验待用。
1.2 方法
1.2.1 精油的提取及复配
采用水蒸馏法提取精油。将不同原料分别用高效植物样品粉碎机粉碎。物料粉与蒸馏水按1∶10的料液比加入,蒸馏3 h停止加热。油水分离收集精油并用无水硫酸钠干燥,4 ℃保存。复配精油按照本实验室的方法分别用孜然精油58.3%、芫荽精油14.1%、莳萝精油23.7%、葛缕子精油3.9%进行复配。
1.2.2 超声波法制备复配精油纳米乳
在室温下,用去离子水制备不同质量分数的Tween80,将Tween80与复配精油以8∶1的比例混合,在45 ℃下用磁力搅拌器以2 000 r/min混合2 min至均匀,形成粗乳液。使用超声波细胞破碎仪对粗乳进行20 min的超声均质。在均质过程中,将乳剂置于冰中,防止超声过热破坏乳液。
1.2.3 复配精油纳米乳对马铃薯块茎的雾化处理
参照李永才等[24]的方法并稍作修改进行发芽实验。选取4 ℃条件下贮藏4个月待用的“陇薯7号”马铃薯块茎,在10 g/L的次氯酸钠溶液中浸泡5 min进行消毒,无菌水冲洗3次,晾干。处理组用3.5、7 μL/mL的纳米乳雾化处理10 min,对照组用无菌水雾化处理10 min。每组处理12个块茎,实验重复3次。将处理好的马铃薯放置在适宜的发芽条件下(温度20 ℃,避光,相对湿度90%)[12,25]进行贮藏,于第10天观察其发芽情况,具有至少一个长于3 mm的芽的块茎被认为是发芽马铃薯块茎。
测定指标:
(1) 发芽率的测定:按芽眼数计算,如公式(1)所示:
发芽率![]()
(1)
(2) 失重率的测定:采用差量法,如公式(2)所示:
失重率![]()
(2)
1.2.4 马铃薯芽眼部位取样
选择健康、新鲜的马铃薯块茎,在1%的次氯酸钠溶液中浸泡5 min进行消毒,无菌水冲洗3次,晾干,12个为一组放置在10 L的密闭保鲜盒中。处理组在室温下用3.5、7 μL/mL纳米乳熏蒸处理10 min,对照组用无菌水熏蒸处理10 min。每个处理组12个块茎,实验重复3次。于处理后第0天、第3天、第6天和第9天取马铃薯芽眼部位组织3 g。用锡箔纸包装后液氮冷冻并在-80 ℃贮藏待用。
1.2.5 芽眼部位H2O2含量的测定
H2O2含量的测定参考PROCHAZKOVA等[26]的方法并修改。H2O2含量的测定是通过钛-过氧化氢络合物的形成进行评估的。将2 g块茎组织粉末与预冷丙酮混匀,提取10 min,在4 ℃,8 000×g条件下离心30 min。取出1 mL的上清液,先后加入100 μL 20% TiCl4(溶于体积分数37%浓HCl)和100 μL浓氨水,均质10 min,继续离心10 min,保留沉淀,将沉淀用预冷丙酮洗涤3次,最后用2.0 mL 1 mmol/L H2SO4溶液进行溶解,在410 nm处测定溶液的OD值。通过标准曲线计算出H2O2的含量,以mmol/g表示。
1.2.6 关键抗氧化相关酶活的测定
SOD活性的测定参考PROCHAZKOVA等[26]的方法并改进。取2 g块茎组织粉末于50 mmol/L磷酸缓冲液中提取10 min,在4 ℃条件下,8 000×g离心30 min,取上清液用于SOD活性的测定。酶活测定体系包括:1.5 mL 50 mmol/L磷酸缓冲溶液(pH 7.8),200 μL 100 mmol/L的蛋氨酸,100 μmol/L EDTA-Na2,750 μmol/L的氮蓝四唑,200 μL的粗酶液,100 μL的核黄素。对照以缓冲溶液代替酶液,在15 000 lx日光灯下反应结束后于560 nm处分别测定吸光度值。以每克鲜重抑制氮蓝四唑光化还原的50%为一个酶活性单位来表示SOD的活性。
CAT活性的测定参考FAN等[27]方法并修改。取2 g块茎组织粉末,加入5 mL 0.1 mol/L磷酸缓冲液(pH 7.5,含有5 mmol/L二硫苏糖醇和20 g/L PVPP),振荡混匀,冰浴条件浸提10 min,于4 ℃、8 000×g的条件下离心30 min,取上清液测定CAT活性。酶活反应体系包括:2 mL 10 mmol/L H2O2(用50 mmol/L pH 7.5的磷酸缓冲液配制)和100 μL粗酶液。在240 nm处测定反应体系120 s内的吸光值变化。CAT活性以U/g FW来表示。
PPO活性的测定参照NETSANET等[28]的方法并改进。反应体系由2 mL 50 mmol/L的醋酸缓冲溶液(pH 5.5)、200 μL酶液和0.6 mL 1 mol/L邻苯二酚溶液组成。从加入酶液启动反应1 min后,开始记录每秒钟反应体系在420 nm的吸光度值,连续测定2 min。以每分钟ΔOD420为一个酶活单位U,即PPO酶活性表示为U/g FW。
POD活性的测定参照TEREFE等[28]的方法并改进。反应体系由2.6 mL 25 mmol/L愈创木酚溶液[用50 mmol/L醋酸缓冲液(pH5.5)配制]、0.2 mL 250 mmol/L H2O2溶液和0.4 mL酶液组成。加酶液启动反应后1 min开始记录每秒钟反应体系在470 nm的吸光度值,连续测定2 min。以每分钟ΔOD470为一个酶活单位U,即POD酶活性表示为U/g FW。
1.2.7 关键抗氧化物质的测定
氧化型谷胱甘肽(glutathione disulfide,GSSG)含量的测定参照王立梅等[29]的方法进行,氧化型谷胱甘肽(glutathione disulfide,GSSG)含量采用试剂盒2-VP法测量,GSSG的含量表示为μmol/g FW。
还原性谷胱甘肽(reduced glutathione,GSH)含量的测定参照王立梅等[29]的方法进行,通过[5,5′-Dithiobis(2-nitrobenzoic acid),DTNB]与GSH反应生成复合物,在412 nm处有特征吸收峰;其吸光度与GSH含量成正比,采用相应试剂盒测量,GSH的含量表示为μmol/g FW。
还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的含量参考LIU等[12]的方法使用试剂盒进行测定,NADPH在碱性条件下稳定,0.1 mol/L HCl和0.1 mol/L NaOH可将烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)和NADPH分开。NADP可被6-磷酸葡萄糖脱氢酶还原为NADPH,NADPH通过吩嗪硫酸甲酯的递氢作用,使氧化型噻唑蓝还原为甲臜,高浓度的NaCl可使酶反应终止,并使甲臜沉淀下来,加入体积分数96%乙醇使之溶解,显紫色,570 nm下检测吸光值,吸光值的高低与NADP和NADPH的含量高低成正比,NADPH的含量表示为mol/g FW。
总酚含量的测定根据ISABEL等[30]的方法稍作修改,在室温下,将100 mg样品溶于1 mL含1%(体积分数)HCl的80%(体积分数)甲醇溶液,在设定为200 r/min的轨道摇床上萃取2 h。以1 000×g离心15 min,收集上清液用于酚类测定。酚类物质的测定:取100 μL提取液到5 mL容量瓶中与0.75 mL FolinCiocalteu试剂(之前用蒸馏水稀释10倍)混合,在22 ℃下静置5 min后;向混合物中加入0.75 mL Na2CO3溶液(60 g/L),在22 ℃ 90 min后于725 nm处测定吸光值,制定没食子酸标准曲线评估总酚含量,表示为mg/100mg FW。
总黄酮含量的测定参考钟秋平等[31]的方法并稍作修改,将100 mg样品溶于1 mL含1%体积分数HCl的80%体积分数甲醇溶液,在设定为200 r/min的轨道摇床上萃取2 h。以1 000×g离心15 min,收集上清液用于总黄酮测定。总黄酮类物质测定:取0.5 mL提取液至10 mL离心管,加入0.2 mL 50 g/L NaNO2溶液,摇匀,常温下反应6 min,加入0.2 mL 100 g/L Al(NO3)3溶液,常温下反应6 min,加入40 g/L NaOH溶液2 mL,常温下反应15 min,蒸馏水定容至5 mL。以乙醇为对照,测定在510 nm处的OD值,表示为mg/100mg FW。
1.2.8 数据统计
本实验采用Origin 2017和SPSS 19.0统计分析软件进行数据统计处理并作图。
2 结果与分析
2.1 复配精油纳米乳熏蒸抑制马铃薯发芽
不同浓度的复配精油纳米乳处理马铃薯,马铃薯的发芽率有明显变化而失重率没有显著变化。可见复配精油纳米乳处理可以抑制马铃薯的发芽,并且块茎对复配精油纳米乳有浓度依赖性,当浓度为3.5 μL/mL和7.0 μL/mL时发芽率为37.7%和26.6%,相比对照组发芽率53.3%有明显降低,表明马铃薯块茎对复配精油纳米乳具有浓度依赖性且不同浓度的复配精油纳米乳对于抑制马铃薯块茎发芽都具有抑制作用(图1)。
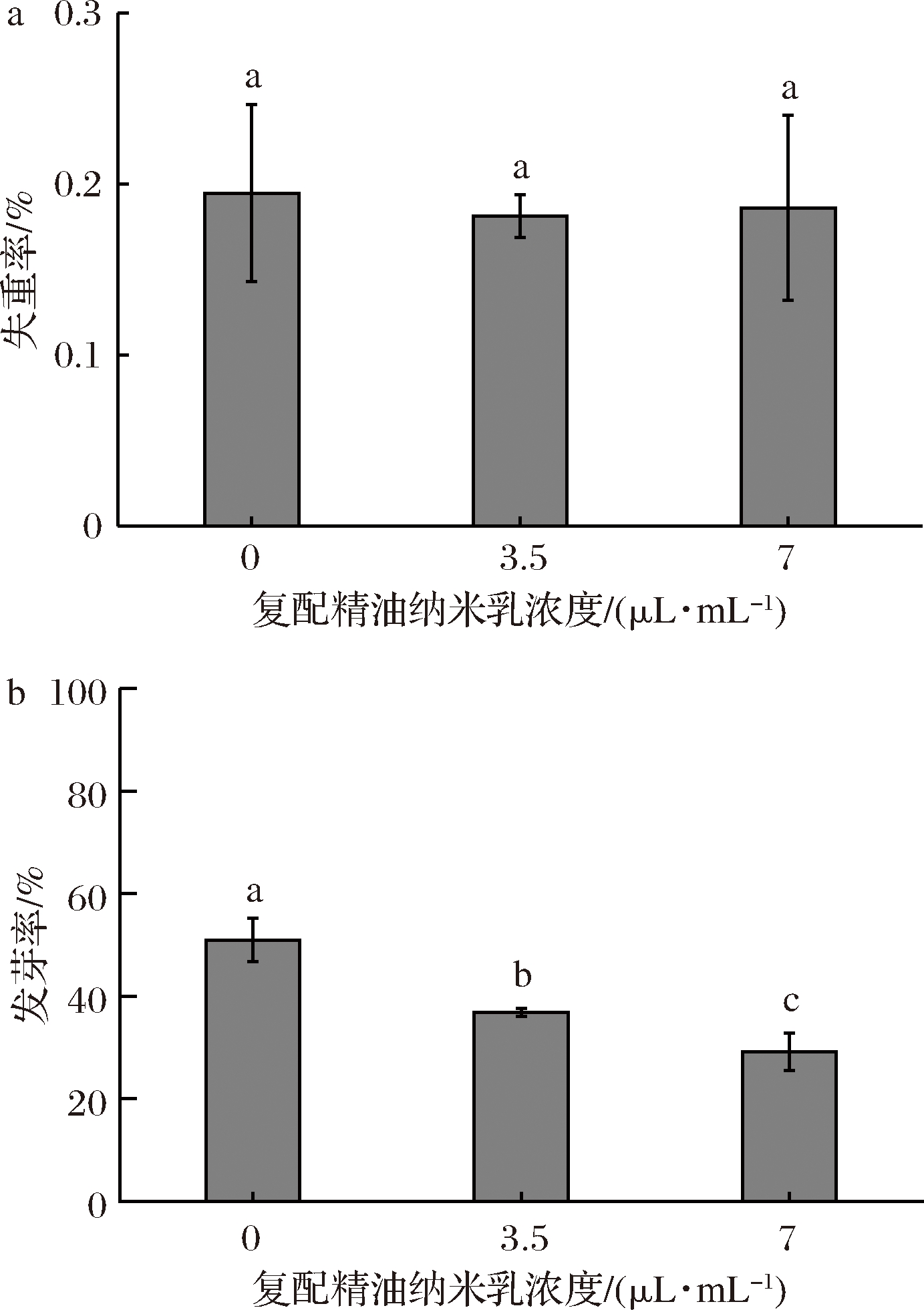
a-失重率;b-发芽率
图1 纳米乳雾化对马铃薯失重率和发芽率的影响
Fig.1 Effects of potato sprouting and weight loss rate by nanoemulsion fogging
注:不同字母代表数据之间达到差异显著水平(P≤0.05), 相同字母表示观测值在0.05水平上差异不显著;图中竖线表示标准偏差(±SD)
2.2 复配精油纳米乳雾化降低了马铃薯芽眼部位的H2O2含量
复配精油纳米乳处理的马铃薯块茎芽眼部位H2O2含量有明显的变化。对照组和处理组呈现出先下降后上升的趋势,在0 d时对照组和处理组没有显著差异,在3 d时3.5 μL/mL复配精油纳米乳处理的H2O2含量是对照组2.07倍,7.0 μL/mL复配精油纳米乳处理的H2O2含量事对照组的2.96倍,而在9 d时2个处理组的H2O2含量分别低于对照组19%和31.7%。MOHAMMED等[14]发现H2O2的提高能够缩短休眠时间,马铃薯休眠时H2O2含量会有短暂显著的增加,促进马铃薯发芽,本实验中处理组的H2O2含量明显低于对照组的H2O2含量,这会有助于延长马铃薯块茎的休眠时间且抑制马铃薯块茎的发芽(图2)。
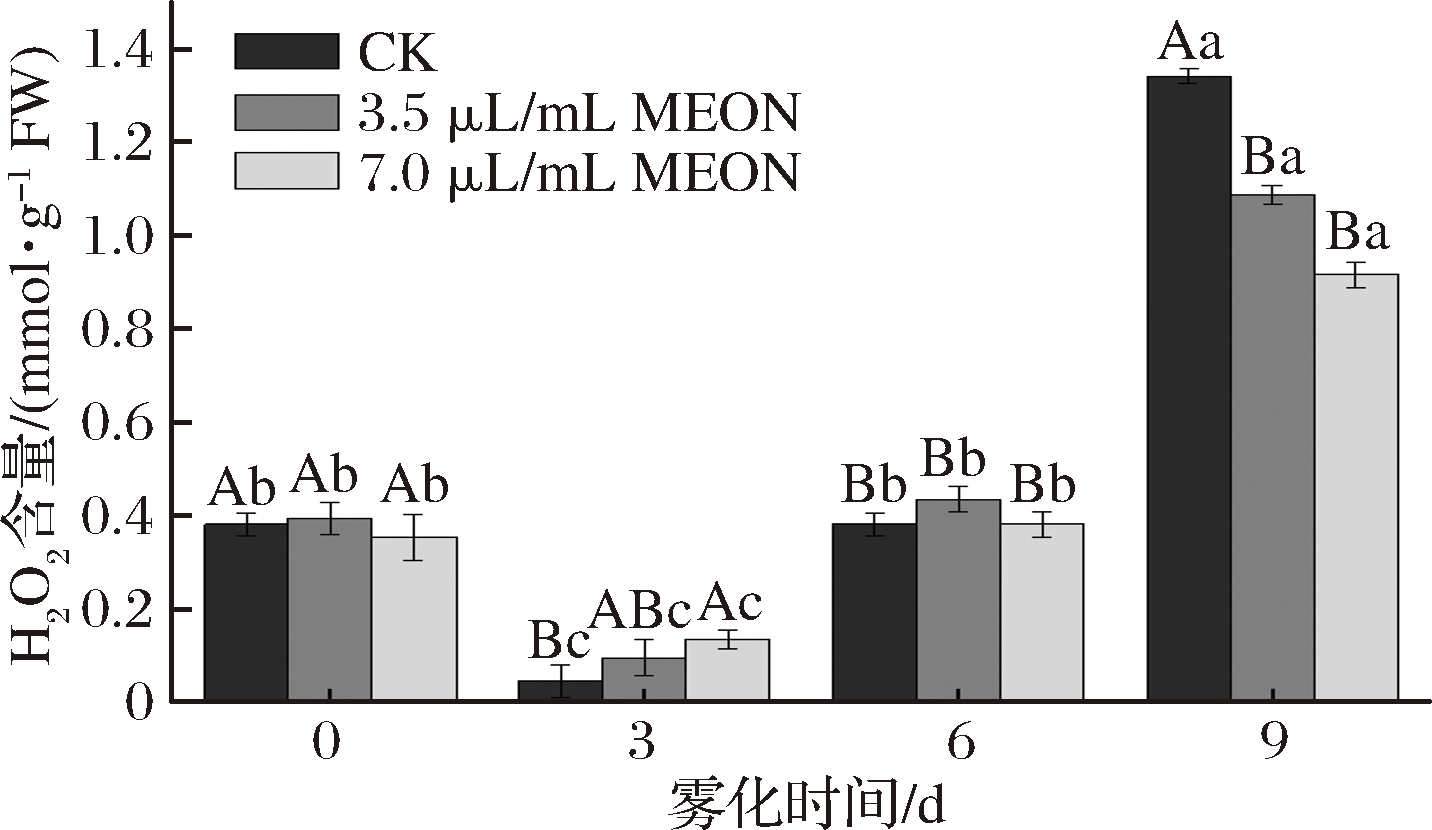
图2 纳米乳雾化改变马铃薯芽眼部位的H2O2含量
Fig.2 Nanocrystalline fogging changed the content of H2O2 in potato bud eye area
注:不同字母代表数据之间达到差异显著水平(P≤0.05), 大写字母代表组内数据之间达到差异显著水平(P≤0.05),小写字母代表组间数据之间达到差异显著水平(P≤0.05),相同字母表示观测值在0.05水平上差异不显著;图中竖线表示标准偏差(±SD);CK为对照(下同)
2.3 复配精油纳米乳雾化改变了马铃薯芽眼部位关键抗氧化酶活性
SOD的活性呈现先下降后上升的趋势,7.0 μL/mL复配精油纳米乳处理能够减缓SOD活性的降低。在3 d时2种浓度的复配精油纳米乳处理的SOD活性都明显高于对照组;在6 d时7.0 μL/mL复配精油纳米乳处理组的SOD活性最高,是对照组的1.42倍。6 d后对照组和处理组皆有下降趋势。BAKER等[15]发现SOD作为一种活性氧清除酶对于活性氧的积累具有抑制作用,而在本实验中观察到6 d时高浓度处理组的SOD活性与对照组相比有明显的提高,说明SOD活性的升高对块茎的发芽有抑制作用(图3)。
CAT的活性表现出先下降后上升再下降的趋势。在6 d时处理组与对照组的CAT活性差异达到最大,3.5 μL/mL和7.0 μL/mL复配精油纳米乳处理的CAT活性分表高于对照组16.5%和58.3%。MOHAMMED等[14]研究发现抑制CAT的活性可以减缓马铃薯的休眠打破,延缓马铃薯芽的生长,这与本实验所得到的结果一致,可以说明CAT活性的抑制延长了马铃薯块茎的休眠时间从而抑制了马铃薯块茎的发芽(图3)。
POD的活性呈现先上升再下降的趋势。在前3 d,复配精油纳米乳处理组和对照组的POD活性都有所升高;在3 d时复配精油纳米乳处理组和对照组的POD活性都达到峰值,7.0 μL/mL复配精油纳米乳处理组的POD活性高于对照组23.1%。GRAHAM等[16]认为POD作为一类氧化还原酶具有清除H2O2的能力,本实验则发现高浓度处理组的POD活性要高于低浓度处理组和对照组的POD活性,结果与预期一致,说明POD抑制了H2O2积累,减缓了ROS积累以抑制马铃薯块茎的发芽(图3)。
块茎的PPO活性整体呈现上升的趋势。从3 d开始7.0 μL/mL的复配精油纳米乳处理组的PPO活性在3 d、6 d、9 d时分别高于对照组24.3%、29.5%、29.5%。SOLOMON等[17]认为PPO是一种含铜金属酶,其催化酚依赖于氧的氧化形成醌,其与氧分子的结合密切相关,并通过芬顿反应产生ROS。本实验发现在马铃薯块茎的发芽过程中高浓度处理组的PPO活性高于低浓度处理组和对照组的PPO活性,可以说明PPO活性的提高与ROS的生成为负相关的关系,进一步说明PPO活性的提高抑制了马铃薯块茎的发芽(图3)。
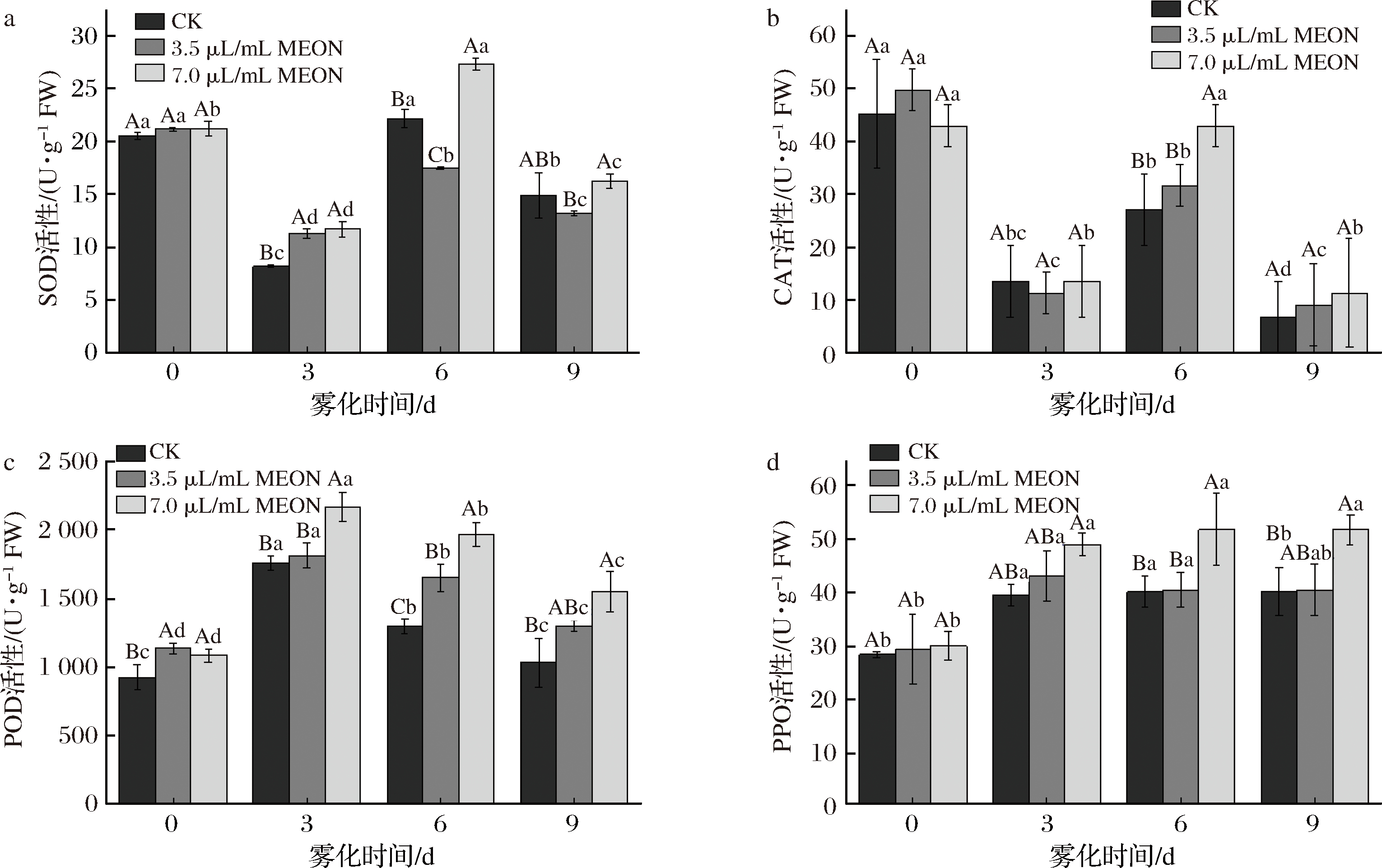
a-SOD活性;b-CAT活性;c-POD活性;d-PPO活性
图3 纳米乳雾化干预芽眼部位的活性氧相关酶活
Fig.3 Nanoemulsion fogging intervene reactive oxygen species-related enzyme activity in potato bud area
2.4 复配精油纳米乳提高了马铃薯块茎的NADPH含量
NADPH的含量表现为先下降后上升的趋势,在前3 d复配精油纳米乳处理的马铃薯的NADPH含量与对照组无明显差异,在6 d时3.5 μL/mL和7.0 μL/mL的复配精油纳米乳处理组NADPH含量分别高于对照组10%和15.2%。并且在9 d时对照组和7.0 μL/mL处理组的NADPH的含量到达整个贮藏期的峰值,且7.0 μL/mL处理组的NADPH高于对照组16.4%。莘冰茹[21]提出NADPH是一种极为重要的核苷酸类辅酶,其作为供氢体为维持还原型谷胱甘肽稳定有着重要作用,并且还在维持硫氧还蛋白系统的活性,参与细胞转导和抗氧化防御中充当重要的角色,本实验测得高浓度处理组的NADPH含量在6 d开始明显高于对照组,这可能有助于GSH状态的稳定。GSH属于细胞壁的次生代谢产物,其具有使ROS失活的作用[12],所以此实验结果证明NADPH含量的上升有助于抑制马铃薯块茎的发芽(图4)。
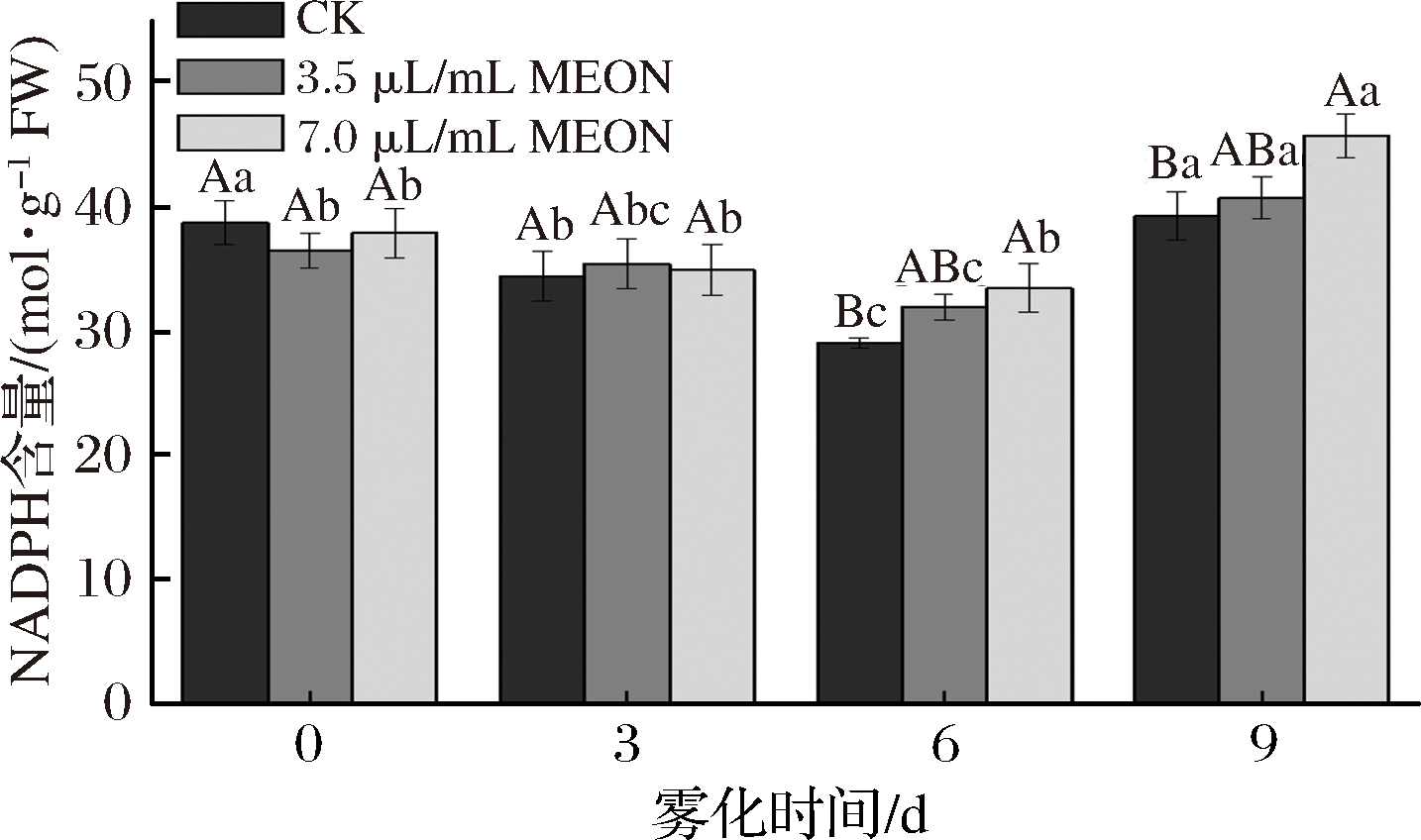
图4 纳米乳雾化干预芽眼部位的NADPH含量
Fig.4 Nanoemulsion fogging interfered with the content of NADPH in potato bud area
2.5 复配精油纳米乳降低了马铃薯总酚和总黄酮的含量
复配精油纳米乳处理对马铃薯块茎的总酚和总黄酮含量有明显抑制。整个贮藏期间对照组总酚的含量呈现先上升在下降的趋势,并且在6 d时到达峰值,对照组总酚含量高于3.5 μL/mL处理组58.2%,高于7.0 μL/mL处理组30.2%。总黄酮的含量随时间延长呈现先降低后升高的趋势,在3 d时出现最低值,7.0 μL/mL处理组的总黄酮含量是对照组的43%。LIU等[12]认为总酚和总黄酮都属于细胞壁的次生代谢产物,其性质类似于GSH,由本实验得到的结果可以发现总酚和总黄酮在处理组马铃薯块茎中的含量低于对照组马铃薯块茎,证明了总酚和总黄酮含量的降低对于马铃薯块茎发芽的抑制有正向作用(图5)。
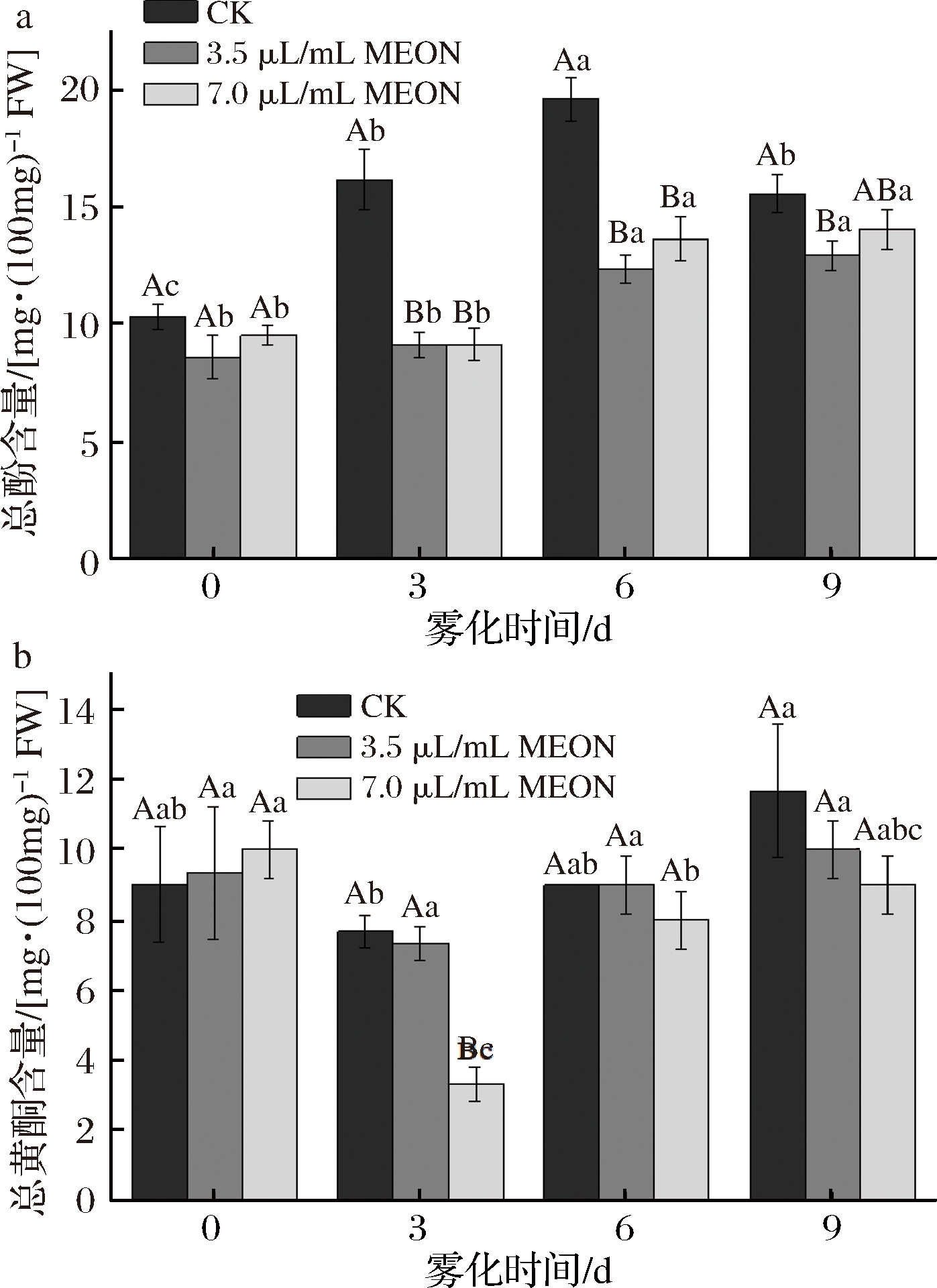
a-总酚含量;b-总黄酮含量
图5 纳米乳雾化干预芽眼部位总酚和总黄酮含量
Fig.5 Nanoemulsion fogging interfered with the total phenols and total flavonoids content in potato bud area
2.6 复配精油纳米乳提高了还原型谷胱甘肽的含量
GSH的含量在整个贮藏期呈现先上升后稳定的态势,并在3 d时到达峰值,其中3.5 μL/mL复配精油纳米乳处理组的GSH是对照组的1.77倍。复配精油纳米乳处理对于GSSG含量的影响整体呈现下降态势,从第3天开始可以看出2个浓度处理组与对照组的GSSG含量存在显著差异,并且6 d后处理组的GSSG含量开始明显低于对照组。这与上文中NADPH含量的实验以及LIU等[12]的研究结果基本一致,说明GSH含量上升抑制了ROS的生成,进一步抑制了马铃薯块茎的发芽(图6)。
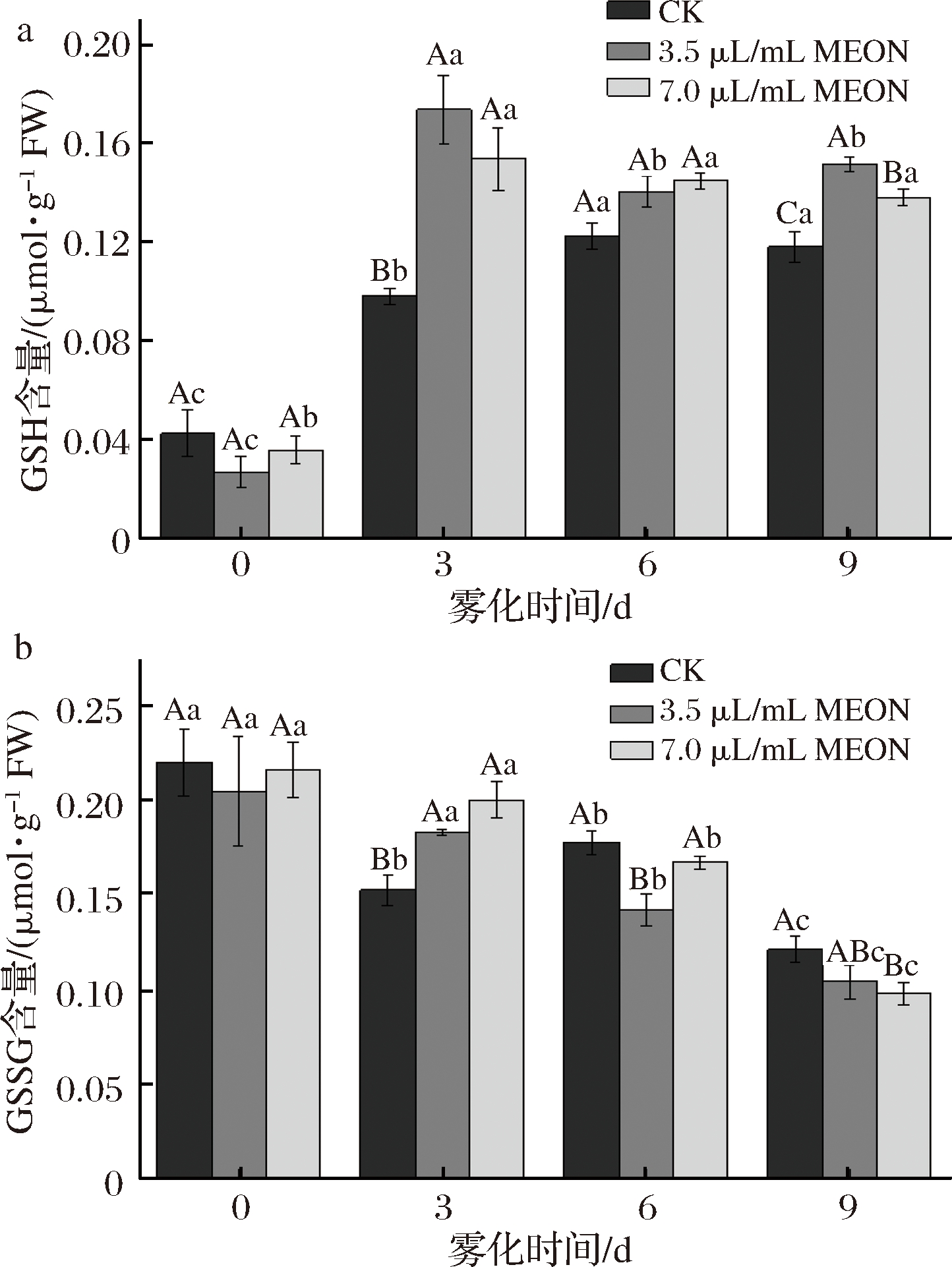
a-GSH含量;b-GSSG含量
图6 纳米乳雾化干预芽眼部位谷胱甘肽的含量
Fig.6 Nanoemulsion fogging interfered with theglutathione content in potato bud area
3 结论
精油对于马铃薯块茎的抑芽作用已经得到证明,但是精油使用的高成本、感官差、时效短等缺点还未得到有效解决,本实验采用4种伞形科植物孜然、芫荽、葛缕子和莳萝的精油制备出的复配精油纳米乳相较于精油具有更好的抑芽作用,采用雾化处理的方式有效提高了精油的利用率且降低了成本,但是对于气味的影响尚无有效的应对措施。4种伞形科植物孜然、芫荽、葛缕子和莳萝的精油制备出的复配精油纳米乳具有较强的抑芽活性,能显著抑制马铃薯的发芽,其机理可能是通过提高NADPH含量使细胞有充足的还原力,让GSH在马铃薯块茎的发芽过程中保持稳定,并抑制了总酚和总黄酮含量来抑制ROS的活性;同时提高SOD、CAT、PPO和POD等关键抗氧化酶的活性,降低H2O2的含量,消除马铃薯块茎中的ROS,来延长马铃薯块茎的休眠时间,并使马铃薯芽的萌发受到抑制。但对于复配精油纳米乳抑制马铃薯块茎发芽的作用位点以及作用方式,还待进一步研究。
[1] CAMPBELL MICHAEL,SEGEAR ERIKA,BEERS LEE,et al.Dormancy in potato tuber meristems:Chemically induced cessation in dormancy matches the natural process based on transcript profiles.[J].Funct Integr Genomics, 2008, 8(4):317-328.
[2] JORGE A S,IVO M R.Inhibition of potato tuber sprouting by pressure treatments[J].International Journal of Food Science & Technology, 2011, 46(1):61-66.
[3] VIJAY P,EZEKIEL R,RAKESH P.Sprout suppression on potato:Need to look beyond CIPC for more effective and safer alternatives[J].Journal of Food Science and Technology,2016,53(1):1-18.
[4] 普红梅,杨万林,刘凌云,等.薄荷精油对不同基因型马铃薯原原种的抑芽效果[J].中国蔬菜,2016(10):67-70.
PU H M,YANG W L,LIU L Y,et al.Sprout inhibition effect of mint essential oil on potato breeder seed of different genotypes[J].China Vegetables,2016(10):67-70.
[5] 普红梅,杨万林,刘凌云,等.薄荷精油对‘云薯304’原原种抑芽效果研究[J].作物研究,2018,32(3):194-197.
PU H M,YANG W L,LIU L Y,et al.Study on the effect of mint essential oil on the germination of ‘Yunshu 304’ Breeder′s seed[J].Crop Research,2018,32(3):194-197.
[6] 黄涛,叶旭,黄雪丽,等.薄荷醇和茉莉精油对马铃薯抑芽效果研究[J].四川农业大学学报,2018,36(5):618-625.
HUANG T,YE X,HUANG X L,et al.Study of menthol and jasmine oil on potato sprout inhibition[J].Journal of Sichuan Agricultural University,2018,36(5):618-625.
[7] VALERIA R,LUANA A,FABIO L,et al.The effect of sous vide packaging with rosemary essential oil on storage quality of fresh-cut potato[J].LWT, 2018, 94:111-118.
[8] JIA B,XU L X,GUAN W Q,et al.Effect of citronella essential oil fumigation on sprout suppression and quality of potato tubers during storage[J].Food Chem, 2019, 284:254-258.
[9] LEBOGANG K,THABANG C L,OLUWOLE S A,et al.Application of taguchi method to optimize garlic essential oil nanoemulsions[J].J Mol Liq, 2017, 244:279-284.
[10] 崔婷. 桂花精油纳米乳的制备及抗氧化活性研究[D].咸宁:湖北科技学院,2020.
CUI T.Preparation and antioxidative activity evaluation of osm anthus essential oil nanoemulsion[D].Xianning:Hubei University of Science and Technology,2020.
[11] 任婧楠,董曼,范刚,等.甜橙精油纳米乳液的制备及其抑菌作用研究[J].食品工业科技,2018,39(23):80-83;104.
REN J N,DONG M,FAN G,et al.Preparation of sweet orange essential oil nanoemulsions and its antibacterial activity[J].Science and Technology of Food Industry,2018,39(23):80-83;104.
[12] LIU B L,ZHAO S,TAN F,et al.Changes in ros production and antioxidant capacity during tuber sprouting in potato[J].Food Chem, 2017, 237:205-213.
[13] MAGBANUA Z V,DE M C M,BROOKS T D,et al.Is catalase activity one of the factors associated with maize resistance to aspergillus flavus?[J].Mol Plant Microbe Interact, 2007, 20(6):697-706.
[14] MOHAMMED B,MAHMOUD M,FRÉDÉRIC G,et al.Catalase inhibition alters suberization and wound healing in potato (Solanum tuberosum) tubers[J].Physiol Plant, 2007, 129(3):472-483.
[15] BAKER C J,ORLANDI E W.Active oxygen in plant pathogenesis[J].Annu Rev Phytopathol, 1995, 33:299-321.
[16] GRAHAM M Y,GRAHAM T L.Rapid accumulation of anionic peroxidases and phenolic polymers in soybean cotyledon tissues following treatment with phytophthora megasperma f.sp.glycinea wall glucan[J].Plant Physiol, 1991, 97(4):1 445-1 455.
[17] SOLOMON E I,CHEN P,METZ M,et al.Oxygen binding, activation, and reduction to water by copper-containing enzymes[J].Angewandte Chemie International Edition,2001, 40(24):4 570-4 590.
[18] DURAN N,ROSA M A, D′ANNIBALE A,et al.Applications of laccases and tyrosinases (phenoloxidases) immobilized on different supports:A review[J].Enzyme Microb Technol,2002, 31:907-931.
[19] LEWIS E A,TOLMAN W B.Reactivity of dioxygen copper systems[J].Chem Rev,2004, 104:1 047-1 076.
[20] TABNER B J,TURNBULL S,EL-AGNAF O M A,et al.Direct production of reactive oxygen species from aggregating proteins and peptides implicated in the pathogenesis of neurodegenerative diseases[J].Current Medicinal Chemistry-Immunology, Endocrine & Metabolic Agents,2003, 3(4): 299-308.
[21] 莘冰茹.外源NADPH对盐胁迫下番茄Trx系统及光合碳同化的影响[D].石河子:石河子大学,2016.
XIN B R.Effect of exogenous NADPH on thioredoxin system and photosynthetic carbon assimilation in tomato seedlings under NaCl stress[D].Shihezi:Shihezi University,2016.
[22] 颉敏华,李梅,冯毓琴.马铃薯贮藏保鲜原理与技术[J].农产品加工(学刊),2007(8):47-50.
XIE M H,LI M,FENG Y Q.Principle and technology review for potato storage[J].Academic Periodical of Farm Products Processing,2007(8):47-50.
[23] 文国宏,王一航,李高峰,等.马铃薯新品种陇薯7号的选育[J].中国蔬菜,2008(4):35-37;70.
WEN G H,WANG Y H,LI G F,et al.A new potato variety-“Longshu No.7”[J].China Vegetables, 2008(4):35-37;70.
[24] 李永才,毕阳.几种新型马铃薯抑芽剂效果评价[J].中国农学通报,2012,28(6):135-139.
LI Y C,BI Y.The assessment of several sprout suppressants for potato tuber[J].Chinese Agricultural Science Bulletin,2012,28(6):135-139.
[25] SILVEIRA A C, ![]() D, ESCALONA V.Effect of the storage temperature and time on native potato quality[J].Acta horticulturae, 2019,1251:145-152.
D, ESCALONA V.Effect of the storage temperature and time on native potato quality[J].Acta horticulturae, 2019,1251:145-152.
[26] PROCHAZKOVA D,SAIRAM R K,SRIVASTAVA G C,et al.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Science, 2001, 161(4):765-771.
[27] FAN M C,LI W X,HU X L,et al.Effect of micro-vacuum storage on active oxygen metabolism, internal browning and related enzyme activities in laiyang pear (Pyrus bretschneideri reld)[J].LWT - Food Science and Technology, 2016, 72:467-474.
[28] NETSANET S T,PHILIPP T,ANJA U,et al.High pressure thermal processing of pears:Effect on endogenous enzyme activity and related quality attributes[J].Innovative Food Science and Emerging Technologies, 2016, 33:56-66.
[29] 王立梅,任清华,郑丽雪,等.内源性氧化胁迫促进酿酒酵母合成谷胱甘肽的潜在机制分析[J].食品科学,2017,38(4):26-31.
WANG L M,REN Q H,ZHEN L X,et al.Elucidation of the underlying mechanism by which endogenous oxidative stress promotes glutathione synthesis of Saccharomyces cerevisiae[J].Food Science,2017,38(4):26-31.
[30] ISABEL M,MAR A J P,GORDON P,et al.Phenolic compounds, lycopene and antioxidant activity in commercial varieties of tomato (Lycopersicum esculentum)[J].J Sci Food Agric, 2002, 82(3):323-330.
A J P,GORDON P,et al.Phenolic compounds, lycopene and antioxidant activity in commercial varieties of tomato (Lycopersicum esculentum)[J].J Sci Food Agric, 2002, 82(3):323-330.
[31] 钟秋平,林美芳.黄皮果中总黄酮含量的测定及其黄酮种类的鉴别[J].食品科学,2007,28(8):411-413.
ZHONG Q P,LIN M F.Determination of contents of flavones and identification of flavones species in fructus clausenae lanii[J].Food Science,2007,28(8):411-413.