马铃薯栽培历史悠久,分布广,产量高,被称为世界第四大粮食作物。我国马铃薯资源丰富,其种植面积与产量均居世界首位。马铃薯营养、经济价值均较高,广泛应用于食品、饲料和淀粉工业等。马铃薯渣是马铃薯淀粉加工过程产生的副产物,平均每生产1 t淀粉产生约6.5~7.5 t湿薯渣[1-2]。目前,只有少量马铃薯渣用作饲料。由于马铃薯渣含有大量水分,其储存困难,易腐败变质,造成环境污染。马铃薯渣的不易利用,已成为制约马铃薯淀粉加工行业发展的瓶颈问题。因此,将马铃薯渣高值化开发利用,既可以减少环境污染,提高资源的利用率,又可以增加马铃薯附加值,从而提高马铃薯淀粉加工企业的经济效益和社会效益。
果胶是植物细胞壁的重要结构物质。果胶是由3个结构区域通过糖苷键连接起来的带有侧链的杂多糖。这3个组成区域分别是均一半乳糖醛酸聚糖区(homogalacturonan region, HG),鼠李半乳糖醛酸聚糖 I 区(rhamnogalacturonan I region, RG-I)和鼠李半乳糖醛酸聚糖 II 区(rhamnogalacturonan II region, RG-II)[3-4]。HG 区是由D-半乳糖醛酸(galacturonic acid,GalA)通过 α-1,4 糖苷键形成的直链多糖。在HG主链中的GalA残基可以在C-6处甲基化,也可以在O-2和/或O-3处乙酰化。根据甲基化程度(degree of methylation,DM),果胶可分为高甲氧基果胶(high methoxyl pectin,HMP) (DM>50%)和低甲氧基果胶(low methoxyl pectin,LMP) (DM<50%)[5]。RG-I 区由结构为[—4)-α-D-半乳糖醛酸-(1—2)-α-L-鼠李糖-(1—]的二糖单位重复连接形成,主链中的鼠李糖的残基在O-4位可被半乳聚糖、阿拉伯聚糖和阿拉伯半乳聚糖等中性糖侧链取代;此外,GalA也可以在C-2或C-3位点乙酰化[3,6]。RG-II区的主链由D-半乳糖醛酸通过 α-1,4 糖苷键连接而成,具有复杂的寡糖侧链[7]。
马铃薯渣由细胞壁多糖(48%)、淀粉(37%)、蛋白质(4%)、灰分(4%)等组成,其中果胶是马铃薯细胞壁的主要多糖(17%)[8]。马铃薯果胶的主要结构特征是,具有较高比例的鼠李糖半乳糖醛酸聚糖(RG I, 75%)和较低比例的均一半乳糖醛酸聚糖(HG, 20%)[9]。马铃薯RG I富含(1—4)-β-半乳聚糖侧链(67%),且具有较高的乙酰化程度(degree of acetylation,DA)(约为14%),与苹果、柑橘果皮等其他细胞壁来源的RG I相反(10%~24%、2%~4%,质量分数)[10-13]。由于马铃薯果胶高含量的中性糖导致低胶凝性,但其富含半乳聚糖侧链和乙酰基链结构特性,使其成为潜在的生物活性分子来源[10,14]。富含半乳聚糖侧链的果胶, 通过阻止半乳糖凝集素-3及其受体的结合来抑制肿瘤的生长和转移[15]。RG-I的阿拉伯半乳聚糖能增加短链脂肪酸的产生,刺激有益菌群生长并调节免疫系统[16]。另一方面,有研究表明,乙酰基和中性糖侧链对果胶的乳化性能具有正向作用,因此,马铃薯果胶独特的结构可能使其成为一种乳化剂[17]。研究表明,使用不同的来源、萃取剂对果胶产量、结构和理化性质可以有不同的影响[18-19]。近年来,一些研究主要研究了聚半乳糖醛酸内切酶和KOH/NaOH 提取马铃薯渣中RG-I域[20-21],以及不同提取方法对马铃薯果胶组成特性的影响[22]。然而,目前对马铃薯果胶的性质研究甚少,这限制了它在食品工业中的应用。果胶水溶液的流变特性是果胶的重要性质之一,果胶溶液的黏度随溶液浓度、温度、剪切速率、pH及金属离子的变化规律,决定着果胶能否应用于特定食品工业(如饮料、酸乳的增稠),同时也显著影响着这些食品的生产工艺与能耗等成本。
本文研究了果胶质量分数、剪切速率、温度、pH、金属离子等因素对马铃薯果胶流变学特性的影响,为其在为食品、药品等方面的应用提供参考。
1 材料与方法
1.1 材料与试剂
马铃薯果胶(potato pectin extracted by chelating agent,PPCH)实验室自制。采用复合盐法萃取马铃薯渣果胶[22]。以马铃薯渣为原料,采用酶法脱除淀粉和蛋白质,以三聚磷酸钠和乙二胺四乙酸(ethylene diamine tetroacetic acid,EDTA)复合盐法从马铃薯渣中提取果胶,经超滤、乙醇沉淀和干燥得到马铃薯果胶。马铃薯渣果胶得率21.01%(对干薯渣,质量分数),酯化度38.99%,半乳糖醛酸含量31.57%(对果胶),中性糖含量52.56%(对果胶,质量分数)(其中鼠李糖、半乳糖、阿拉伯糖、葡萄糖含量分别为9.48%、73.14%、13.57%、3.81%,质量分数)。
试剂均为国产分析纯。
1.2 仪器与设备
KinexusPro+型流变仪,马尔文公司;LD53型冷冻干燥机,美国Millrock公司;TDL-5-A 型低速台式离心机,上海安亭科学仪器厂;101-2-BS 电热恒温鼓风干燥箱,上海跃进医疗器械厂;BS124S分析天平、PB-10酸度计,北京赛多利斯仪器系统有限公司;UF20 超滤装置,河北省大城县华泰净化技术工程有限公司。
1.3 实验方法
1.3.1 PPCH溶液质量分数对PPCH 溶液黏度的影响
高分子流体可以近似地处理成具有非牛顿行为的黏性流体,可以幂律方程表达溶液黏度与剪切速率的函数关系[23],即:η=K×γn-1。式中:η,黏度,Pa·s;K,流体稠度系数;γ,剪切速率,s-1;n,流动指数。当n<1时,流体为假塑性流体;当n=1时,流体为牛顿流体;当n>1时,流体为胀塑性流体。K是黏度的度量,黏度越高,K值也越高。
用去离子水分别配制质量分数为0.4%、0.8%、1.0%和1.5%的PPCH 溶液后,于4 ℃下静置24 h。取约2 mL待测果胶溶液样品于流变仪测试平台中心,选择60 mm平板为夹具,间隙0.5 mm,进行黏度测定。测试温度为25 ℃,在0.001~600 s-1进行剪切速率扫描。绘制果胶溶液的表观黏度受溶液质量分数的影响曲线,用计算机拟合幂律方程,建立黏度η与γ的关系式。
1.3.2 温度对PPCH溶液黏度的影响
高分子溶液流体行为与温度的关系可用Arrhenius方程[23]表示:η= A eEa/RT, 该式反映了溶液黏度随温度不同而发生改变的变化模式。式中:η,特定温度条件下溶液表观黏度,Pa·s;A,常数;R,摩尔系数,8.31 J/(mol·K);T,绝对温度,K;Ea,活化能,J/mol,其反映了高分子流动的难易程度, 与高分子的分子大小和空间结构有密切关联。
用去离子水配制质量分数为0.6%的PPCH溶液后,于4 ℃下静置24 h。取约2 mL待测果胶溶液样品于流变仪测试平台中心,选择60 mm平板为夹具,间隙0.5 mm,进行黏度测定。测试剪切速率分别为50、100、500 s-1,在10~80 ℃进行升温扫描(5 ℃/min)。绘制果胶溶液的表观黏度受温度的影响曲线,并拟合Arrhenius方程,建立黏度η与T的关系式。
1.3.3 pH对PPCH溶液黏度影响
用0.2 mol/L Na2HPO4-柠檬酸缓冲溶液配制pH值分别为3.0、3.5、4.0、4.5、5.0和6.0的质量分数为1% PPCH溶液,于4 ℃下静置24 h。测定果胶溶液黏度条件同1.3.1。绘制果胶溶液的表观黏度受pH的影响曲线,并拟合幂律方程,建立黏度η与γ的关系式。
1.3.4 金属离子对PPCH溶液黏度的影响
用去离子水配制质量分数为1.0%的PPCH溶液, 分别加入CaCl2、MgSO4,调节金属离子(Ca2+和Mg2+)质量浓度为0.05~4 mg/mL,搅拌均匀,于4 ℃下静置 24 h。测定果胶溶液黏度条件同1.3.1。绘制果胶溶液的表观黏度受金属离子的影响曲线。
1.3.5 统计学处理
采用Kinexus data analysis软件进行数据采集、处理。每个实验重复3次。
2 结果与分析
2.1 PPCH溶液质量分数及剪切速率对PPCH溶液黏度的影响
不同质量分数的PPCH溶液,在剪切速率为0.001~600 s-1,测定其黏度/剪切速率曲线如图1所示。同时,利用Kinexus data analysis软件对不同浓度PPCH溶液流动曲线进行幂律方程自动拟合,得到不同果胶溶液的幂律方程及相关参数如表1所示。
由图1和表1可知,当剪切速率相同时,随着果胶溶液质量分数的增大,其表观黏度在增大;流体稠度系数K值从0.013 68逐渐增大到0.030 87。这是因为果胶的流动是通过果胶分子链段跃迁来实现的。生物大分子溶液剪切黏度受大分子链段跃迁的快慢和大分子平移所需的跃迁的次数因素影响。前者与分子间的摩擦力有关, 后者与大分子聚合物的分子结构有关[24]。不同质量分数的果胶溶液的分子质量是相同的,因此,使果胶分子平移所需的跃迁次数也相同,所以剪切黏度主要受果胶分子链段跃迁速度影响。当果胶溶液质量分数增大时, 果胶分子链间缠结增多,分子间摩擦力也增大,果胶分子链段跃迁变慢,使溶液的黏度增大。
由图1可知,随着剪切速率的增大,不同质量分数的溶液表观黏度均降低,出现“剪切变稀”的现象;并且这一现象随着果胶质量分数的增加而更加明显。对于低质量分数的果胶溶液(0.4%、0.8%),在剪切速率低于30 s-1时,溶液表观黏度明显下降,在剪切速率大于30 s-1时,溶液表观黏度缓慢下降,趋于稳定;而较高质量分数的果胶溶液(1.0%、1.5%),在剪切速率低于50 s-1时,溶液表观黏度急剧下降;在剪切速率大于50~150 s-1时,溶液表观黏度明显下降;在剪切速率大于150 s-1时,溶液表观黏度缓慢下降,趋于稳定。不同质量分数的PPCH溶液流动指数n在0.536 0~0.562 5变化,n<1。可见,PPCH溶液属于典型的假塑性非牛顿流体。这是因为果胶分子的流动是通过链段跃迁实现的。果胶分子链有较好的柔顺性,所以当剪切速率增大时,果胶分子很容易通过链段运动而取向,使剪切黏度明显降低[24]。

图1 不同质量分数PPCH溶液流体曲线
Fig.1 Flow curve of PPCH with different concentrations
表1 计算机拟合不同质量分数PPCH溶液的幂律方程相关参数
Table 1 Power law equations parameters of PPCH with different concentrations fitted by computer
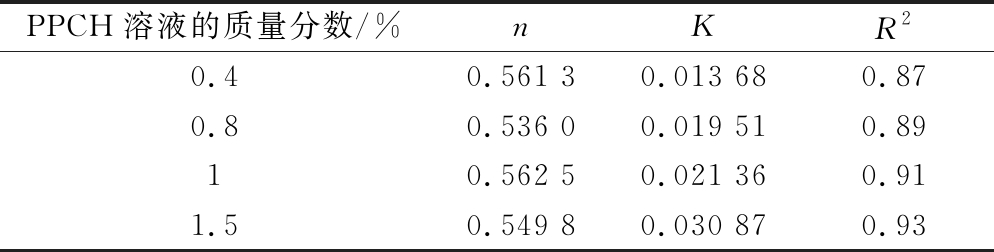
PPCH溶液的质量分数/%nKR20.40.561 30.013 680.870.80.536 00.019 510.8910.562 50.021 360.911.50.549 80.030 870.93
2.2 温度对PPCH溶液流体性能的影响
不同温度下0.6%PPCH溶液的流动曲线如图2所示,对果胶溶液黏度和温度关系进行Arrhenius方程拟合,建立黏度对数lnη与1/T的关系式,得出果胶溶液活化能Ea的变化结果如表2所示,PPCH溶液流体行为受温度的影响。在剪切速率为50 s-1时,温度为10~47 ℃,PPCH溶液表观黏度随着温度升高而急速下降,表观黏度与温度的关系遵循Arrhenius方程规律,活化能Ea为44 917.4 J/mol。其原因是在此升温过程中,内部分子热运动加快,溶液中胶体分子间的缠结大部分得到削弱,故表观黏度降低幅度很大,活化能很大[25-26]。温度为47~65 ℃,PPCH溶液黏度随着温度升高而缓慢波动,则较难以用Arrhenius方程加以解释。温度为65~80 ℃,PPCH溶液黏度随着温度升高而缓慢下降,黏度与温度的关系遵循Arrhenius方程规律,活化能Ea急剧降为19 167.0 J/mol。原因可能是,温度为65~80 ℃时分子间的缠结只剩余小部分,几乎完全削弱,故表观黏度也下降但幅度很小,活化能很小。PPCH溶液该流体性能与文献报道结果类似[27]。在剪切速率为100、500 s-1时,温度为10~80 ℃,PPCH溶液黏度随着温度升高而缓慢下降。黏度与温度的关系遵循Arrhenius方程规律,活化能Ea分别为19 428.8、18 393.4 J/mol。这可能是由于在高速剪切的作用力(100、500 s-1)对分子间的相互作用有明显破坏作用,从而导致其聚集体的解离所致。
温度为10~47 ℃时,当剪切速率由50 s-1增加到100 s-1时,活化能Ea急剧下降低;当剪切速率从100 s-1增加到500 s-1时,活化能Ea缓慢降低。说明温度为10~47 ℃,PPCH溶液活化能Ea与剪切速率有较大的相关性。这可能是由于在100 s-1剪切的作用下,分子间的相互作用有明显破坏作用,从而导致其聚集体的解离所致。温度为65~80 ℃时,当剪切速率50 s-1增加到100 s-1时,活化能Ea略有升高;当剪切速率由100 s-1增加到500 s-1时,活化能Ea略有降低。说明温度为47~80 ℃时,活化能与剪切速率相关性较小。
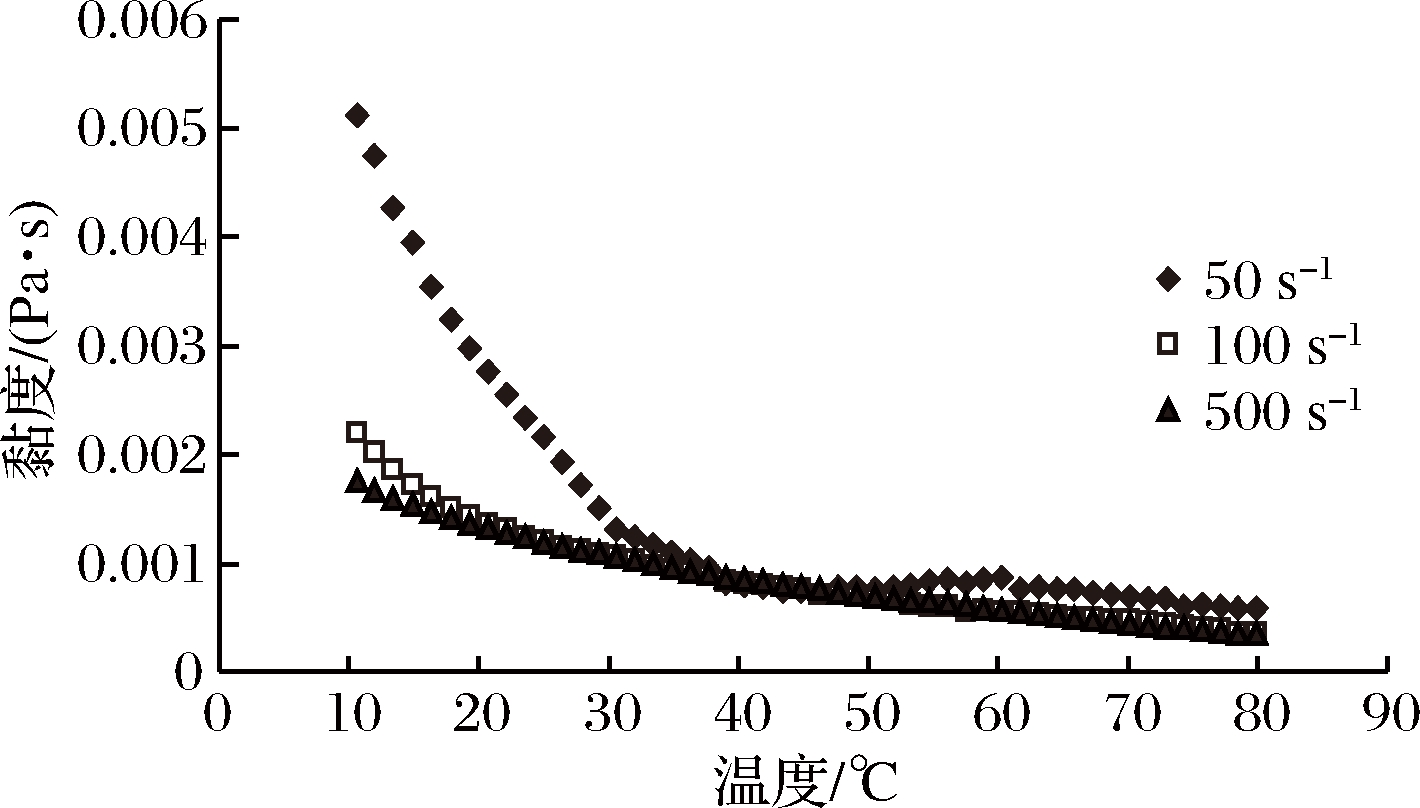
图2 不同温度下PPCH溶液的流动曲线
Fig.2 Effects of temperature on the flow curve of PPCH solution
表2 不同剪切速率下PPCH溶液的活化能
Table 2 Activation energy Ea of PPCH solution with different shear rates
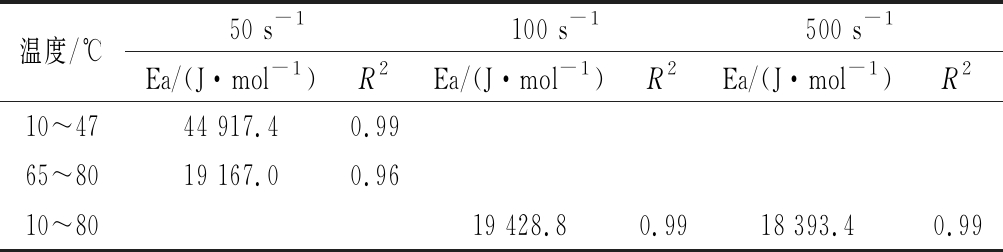
温度/℃50 s-1100 s-1500 s-1Ea/(J·mol-1)R2Ea/(J·mol-1)R2Ea/(J·mol-1)R210~4744 917.40.9965~8019 167.00.9610~8019 428.80.9918 393.40.99
2.3 pH对PPCH溶液流体性能的影响
不同pH的1%PPCH溶液,在剪切速率为0.001~600 s-1时,利用动态流变仪测定其流变曲线,结果如图3所示,同时,对不同pH的果胶溶液流动曲线进行幂律方程拟合,得到的幂律方程及相关参数如表3和图4所示,pH 值对果胶溶液流动性能有较大的影响。随着pH的升高,果胶溶液的黏度呈现先增加后减小的趋势。随着pH 值由3.0增大到3.5时,果胶溶液黏度缓慢增大,稠度系数K缓慢增大,流动指数n缓慢降低;当继续增大pH值至4.0时,溶液黏度快速增大,达到最大值,此时K为0.129 20,n快速降低,说明溶液流动能力变差,溶液流动行为更加偏离理想牛顿流体。当pH 值由4.0增大到5.0时,果胶溶液黏度快速降低,K快速降低,n逐渐增大;当pH值由5.0增大到6.0时,果胶溶液黏度缓慢降低,K缓慢降低,n缓慢增大。分析原因,马铃薯果胶属于酸性多糖,果胶溶液呈酸性,pH会影响半乳糖醛酸上羧基的解离状态,而影响果胶分子间相互作用,从而影响果胶溶液的流动性能。羧基的解离常数(pKa)为3.5,当果胶溶液pH≤pKa时,果胶的大多数羧基都是质子化的,羧基基团电荷量逐渐消失,故当pH值为3.0和3.5时,果胶主链羧基的解离程度更弱,果胶分子只是通过旋转和伸屈占有的空间、分子键相互碰撞,而不具有相同电荷的斥力伸展构型,因而使得果胶溶液黏度较低。而当果胶溶液pH>pKa时,pH值为4.0和4.5时,果胶的大多数羧基以解离状态存在为主,带电荷较多。由于相同电荷较强的斥力使果胶呈伸展构型,增加了链长,果胶占有的体积增大,因而使得果胶溶液的黏度大大提高[28]。在 pH值低于5.0时,果胶溶液中几乎没有离子存在,静电作用较弱,黏度降低[29]。

图3 pH对PPCH溶液流体影响曲线
Fig.3 Effects of pH on the flow curve of PPCH solution
表3 拟合不同pH值PPCH的幂律方程相关参数
Table 3 Power law equations parameters of PPCH solution with different pH values fitted
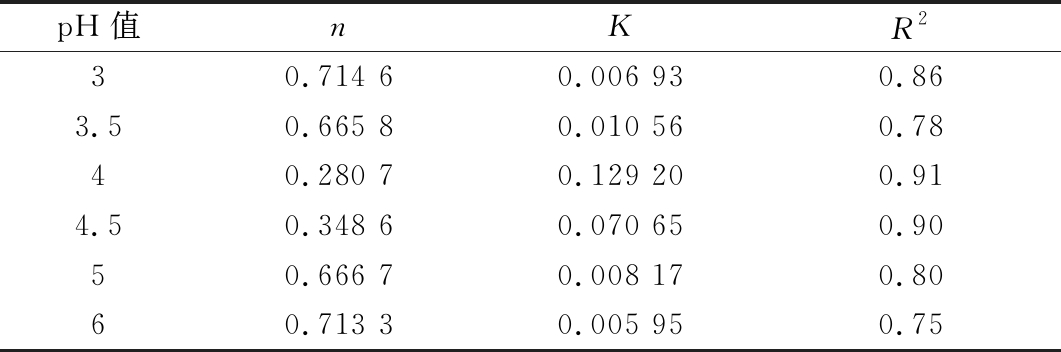
pH值nKR230.714 60.006 930.863.50.665 80.010 560.7840.280 70.129 200.914.50.348 60.070 650.9050.666 70.008 170.8060.713 30.005 950.75
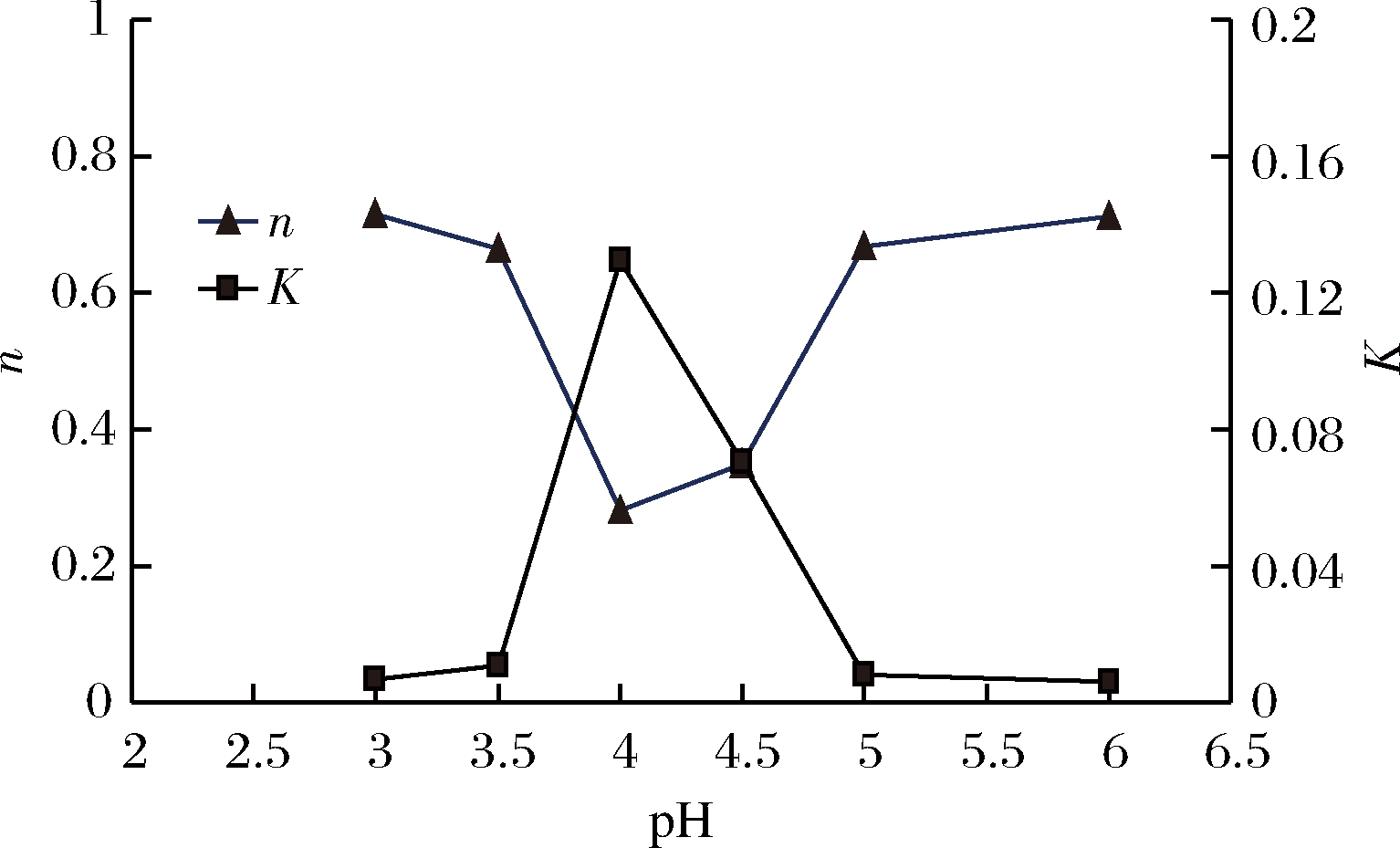
图4 pH 值对K 值和n 值的影响
Fig.4 Effects of pH value on K value and n value
2.4 金属离子对PPCH溶液流体性能的影响
在1%的PPCH中加入不同浓度的Ca2+和Mg2+,考察这2种金属离子对PPCH流变学性能影响的实验结果如图5、图6所示。随着 Ca2+和Mg2+浓度增加,PPCH溶液的黏度随之增大。Ca2+浓度增加对PPCH溶液黏度具有更为显著的影响;而Mg2+对于PPCH溶液黏度的增加幅度明显低于Ca2+,且Mg2+浓度<0.4 mg/mL时PPCH溶液黏度没有显著变化,说明Ca2+的增稠效果优于Mg2+。分析原因,PPCH属于富含RG-I的低酯果胶,由于其分子结构中含有较多的未被甲基化的羧酸基团,分子间的电荷排斥作用明显。多价离子的存在可起到中和电荷及分子间的桥联作用, 从而改变果胶分子的流动性能及聚集状态。形成桥联的密度越高,果胶的黏度越大。桥联的密度则与架桥离子的浓度和架桥离子与羧基的结合能力有关。同价元素随原子半径的增大与果胶羧基的结合能力增强(Ca2+>Mg2+)[30]。在适宜浓度范围内, 分子间的有序排列最终可导致凝胶形成[18]。

图5 Ca2+离子对PPCH溶液流体性能的影响
Fig.5 Effects of Ca2+ on the flow curve of PPCH solution

图6 Mg2+离子对PPCH溶液流体性能的影响
Fig.6 Effects of Mg2+on the flow curve of PPCH solution
3 结论
PPCH溶液的黏度随溶液质量分数上升而增加。随着剪切速率的增大,PPCH溶液黏度下降,出现“剪切变稀”的现象;并且这一现象随着果胶质量分数的增加而更加明显。采用幂律方程拟合不同质量分数PPCH溶液黏度和剪切速率的关系,它们的流动指数n<1,符合幂律方程对非牛顿流体特征的解释,属于非牛顿流体。
PPCH溶液流体行为受温度的影响。在剪切速率为50 s-1时,当温度为10~47 ℃时,PPCH溶液黏度随着温度升高而急速下降,黏度与温度的关系遵循Arrhenius方程规律,活化能Ea较高。在温度为47~65 ℃时,PPCH溶液黏度随着温度升高而缓慢波动,较难以用Arrhenius方程加以解释。在温度为65~80 ℃时,PPCH溶液黏度随着温度升高而缓慢下降,黏度与温度的关系遵循Arrhenius方程规律,活化能Ea较低。在剪切速率为100、500 s-1时,温度为10~80 ℃,PPCH溶液黏度随着温度升高而缓慢下降。黏度与温度的关系遵循Arrhenius方程规律,活化能Ea较低。说明温度为10~47 ℃,PPCH溶液活化能与剪切速率有较大的相关性;温度为47~80 ℃,活化能与剪切速率相关性较小。
pH值对PPCH溶液流动性能有较大的影响。随着pH的升高,果胶溶液的黏度呈现先增加后减小的趋势,当pH值为4.0时,黏度为最大值,且n最低,说明溶液流动能力差,溶液流动行为更加偏离理想牛顿流体。
二价金属离子(Ca2+、Mg2+)可提高PPCH溶液的黏度,Ca2+浓度增加对PPCH溶液黏度增加具有显著的影响;而Mg2+对于PPCH溶液黏度的增加幅度明显低于Ca2+。
[1] 鞠栋,木泰华,孙红男,等.不同工艺马铃薯粉物化特性及氨基酸组成比较[J].核农学报,2017,31(6):1 100-1 109.
JU D, MU T H, SUN H N, et al.Comparison study on physicochemical property and amino acid composition of potato flour made by different processing methods[J].Journal of Nuclear Agricultural Sciences, 2017,31(6):1 100 -1 109.
[2] 顾正彪,程力,洪雁,等.马铃薯淀粉生产过程中薯渣的有效利用技术[J].食品科学技术学报,2013,31(1):64-69.
GU Z B,CHENG L,HONG Y, et al.Effective utilization technology of potato pulp produced from potato starch industry[J].Journal of Food Science and Technology,2013,31(1):64-69.
[3] RIDLEY B L,O′NEILL M A,MOHNEN D.Pectins:Structure,biosynthesis,andoligocalacturonide-related signaling[J].Phytochemistry, 2001,57(6):929-967.
[4] 谢明勇,李精,聂少平.果胶研究与应用进展[J].中国食品学报,2013,13(8):1-14.
XIE M Y, LI J,NIE S P.A review about the research and applications of pectin[J].Journal of Chinese Institute of Food Science and Technology,2013,13(8):1-14.
[5] YAPO B M.Pectic substances:From simple pectic polysaccharides to complex pectins-A new hypothetical model[J].Carbohydrate Polymers,2011,86(2):373-385.
[6] MORRIS G A,RALET M C,BONNIN E,et al.Physicalcharacterisation of the rhamnogalacturonan and homogalacturonan fractions of sugar beet (Beta vulgaris) pectin[J].Carbohydrate Polymers,2010,82(4):1 161-1 167.
[7] TADASHI ISHII,TOSHIRO MATSUNAGA.Isolation and characterization of a boron-rhamnogalacturonan-II complex from cell walls of sugar beet pulp[J].Carbohydrate Research,1996,284(1):1-9.
[8] 曾凡逵,周添红,刘刚.马铃薯淀粉加工副产物资源化利用研究进展[J].农业工程技术(农产品加工业),2013(11):33-37.
ZENG F K,ZHOU T H,LIU G.A review about research on resource utilization of by-products produced from potato starch Industry[J].Agriculture Engineering Technology(Agricultural product processing industry),2013(11):33-37.
[9] MOHNEN D.Pectin structure and biosynthesis[J].Current Opinion in Plant Biology,2008,11(3):266-277.
[10] OOMEN R J F J,DOESWIJK-VORAGEN C H L,BUSH M S,et al.In muro fragmentation of the rhamnogalacturonan I backbone in potato (Solanum tuberosum L.) results in a reduction and altered location of the galactan and arabinan side-chains and abnormal periderm development[J].The Plant Journal,2002,30(4):403-413.
[11] SCHOLS H A, POSTHUMUS M A, VORAGEN A G J.Structural features of hairy regions of pectins isolated from apple juice produced by the liquefaction process[J].Carbohydrate Research,1990,206(1):117-129.
[12] YAPO B M,LEROUGE P,THIBAULT J F,et al.Pectins from citrus peel cell walls contain homogalacturonans homogenous with respect to molar mass,rhamnogalacturonan I and rhamnogalacturonan II[J].Carbohydrate Polymers,2006,69(3):426-435.
[13] VORAGEN A G, SCHOLS H A, PILNIK W.Determination of the degree of methylation and acetylation of pectins by HPLC[J].Food Hydrocolloids,1986,1(1):65-70.
[14] ØBRO J,HARHOLT J,SCHELLER H V,et al.Rhamnogalacturonan I in Solanum tuberosum tubers contains complex arabinogalactan structures[J].Phytochemistry,2004,65(10):1 429-1 438.
[15] NANGIA-MAKKER P, HOGAN V, HONJO Y,et al.Inhibition of human cancer cell growth and metastasis in nude mice by oral intake of modified citrus pectin[J].Journal of the National Cancer Institute,2002,94(24):1 854-1 862.
[16] KELLY G S.Larch arabinogalactan:Clinical relevance of a novel immuneenhancing polysaccharide[J].Alternative Medicine Review,1999, 4(2):96-103.
[17] LEROUX J,LANGENDORFF V,SCHICK G,et al.Emulsion stabilizing properties of pectin[J].Food Hydrocolloids,2003,17(4):455-462.
[18] TURQUOIS T,RINAUDO M, TARAVEL F R,et al.Extraction of highly gelling pectic substances from sugar beet pulp and potato pulp:influence of extrinsic parameters on their gelling properties[J].Food Hydrocolloids,1999,13(3):255-262.
[19] MA S,YU S J, ZHENG X L,et al.Extraction, characterization and spontaneous emulsifying properties of pectin from sugar beet pulp[J].Carbohydrate Polymers,2013,98(1):750-753.
[20] NASTARAN K, SALWA K.Enzymatic extraction of galactan-rich rhamnogalacturonan I from potato cell wall by-product[J].LWT- Food Science and Technology,2014,57(1):207-216.
[21] NASTARAN K,SALWA K.Enzymatic generation of galactose-rich oligosaccharides/oligomers from potato rhamnogalacturonan I pectic polysaccharides[J].Food Chemistry,2016,197:406-414.
[22] 王文霞,张显斌,张慧君,等.不同提取方法对马铃薯果胶多糖组成特性的影响[J].食品与发酵工业,2017,43(12):150-156.
WANG W X,ZHANG X B,ZHANG H J, et al.Effect of different extraction methods on the compositions of potato pectin polysaccharides[J].Food and Fermentation Industries, 2017.43(12):150-156.
[23] 史铁钧,吴德峰.高分子流变学基础[M].北京:化学工业出版社,2009.
SHI T J, WU D F.Fundamentals of Polymer Rheology[M].Beijing:Chemical Industry Press,2009.
[24] 何曼君, 张红东,陈维孝,等.高分子物理[M].3版.上海:复旦大学出版社,2007.
HE M J, ZHANG H D, CHEN W X, et al.Polymer Physics[M].3rd ed.Shanghai:Fudan University Press,2007.
[25] 汪海波,徐群英,汪芳安.低酯果胶的流变学性能研究[J].农业工程学报,2006,22(11):223-227.
WANG H B, XU Q Y, WANG F A.Rheological prope ties of low methoxyl pectin[J].Transactions of the CSAE,2006, 22(11):223-227.
[26] RAO M A.Rheology of Fluid and Semisolid Foods:Principles and Applications[M].Boston:Springer US,2010.
[27] 顾晓俊,陈晓楠,金邦荃,等.猕猴桃果胶的黏度特性与流变性分析[J].食品科学,2017, 38(3):125-130.
GU X J, CHEN X N, JIN B Q, et al.Viscosity and rheological properties of kiwifruit (Actinidia deliciosa) pectin[J].Food Science, 2017, 38(3):125-130.
[28] 梅新.甘薯膳食纤维、果胶制备及物化特性研究[D].北京:中国农业科学院农产品加工研究所,2010.
MEI X.Characterization of dietary fiber and pectin extraction from sweet potato[D].Beijing:Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences,2010.
[29] 亓盛敏.大豆皮果胶的提取及性质研究[D].无锡:江南大学,2012.
QI S M.The study on extrcction and properties of pectin from soybean hull[D].Wuxi:Jiangnan University, 2012.
[30] 杨孝朴,史琦云,文奋武.甜菜果胶黏度特性的研究[J].甘肃农业大学学报,1996,31(1):71-76.
YANG X P,SHI Q Y,WEN F W.The viscosity characters of sugarbeet pectin[J].Journal of Gansu Agricultuey University, 1996,31(1):71-76