茄科枸杞属植物黑果枸杞是重要的药食同源植物[1-2],果实营养丰富、因其具有抗氧化[3-4]、抗动脉粥样化[5]、抗炎[6]、抗疲劳[7-8]、增强肠道屏障功能[9]、防治心脑血管疾病[10]、防痛风性关节炎[11]等功效,而成为现阶段枸杞栽培与育种的热点。经查阅大量文献,有关黑果枸杞的研究多为育种、栽培种植[12-13],化学成分多见花青素[14-16]、多糖[17-18]等。多酚是一类含有羟基和苯环的极性化合物,近年来,由于其在抗炎、抗氧化、抗肿瘤等方面显示出良好作用而具有广泛的应用前景[19],成为生命科学领域研究的热点之一,被称为继膳食纤维之后的“第七类营养素”[20]。关于黑果枸杞多酚纯化分离研究未见报道。
本文采用静态吸附法比较了9种大孔树脂对黑果枸杞粗多酚的吸附、解吸性能,重点研究了HPD500大孔树脂对黑果枸杞多酚的吸附的动力学、热力学特性、吸附机理、动态纯化工艺条件,并对纯化多酚进行了抗氧化性分析。研究结果有利于开发黑果枸杞资源,提高其经济价值。
1 材料与方法
1.1 材料与试剂
植物原料,2018年6月至8月,课题组成员考察并采集于甘肃省民勤县,经陇东学院生命科学与技术学院副教授马世荣鉴定。低温鼓风干燥后机械粉碎、0~5 ℃密封保存、备用。
没食子酸标准品(批号:110831-201605,质量分数90.8%),购于中国食品药品鉴定研究所。实验用大孔树脂,购于沧州宝恩化工有限公司。
1.2 仪器与设备
DHG型电热鼓风干燥箱,上海一恒科学仪器有限公司;FZ102微型植物试样粉碎机,北京中兴伟业仪器有限公司;BSA224S型电子天平,北京赛多利斯科学仪器有限公司;SB-5200DTD型超声波清洗机,宁波新芝生物科技有限公司;800离心机,常州国华电器有限公司;RE-5203旋转蒸发器,上海亚荣生仪器厂;7230G可见分光光度计,上海精密科学仪器有限公司;CHA-S气浴恒温振荡器,江苏省金坛市医疗仪器厂;精密蠕动泵BT100-2 J/YZ1515x,保定兰格恒流泵有限公司;HHS电热恒温水浴锅,上海医疗器械五厂;PHS-3C酸度计,上海仪电科学仪器股份有限公司。
1.3 试验方法
1.3.1 树脂的预处理
实验中所用9种大孔树脂名称和性质如表1所示,树脂预处理方法参考相关文献[21]。
1.3.2 黑果枸杞多酚粗提液的制备
以60%(体积分数)乙醇为溶剂,在最佳工艺条件下进行超声辅助提取,将提取液减压浓缩至无醇味,转移至1 000 mL容量瓶中,用蒸馏水定容、摇匀,备用。
1.3.3 标准曲线绘制及多酚质量浓度的测定
配制9.325~65.276 μg/mL的没食子酸标准溶液,采用福林酚法[22]绘制标准曲线为A=0.012 65C+0.025 58(R=0.998 77),实验中所测各种测定液多酚浓度均以没食子酸当量计。
采用福林酚法测定实验中各种测定液(提取液、静态吸附前、后溶液、动态吸附上样液与洗脱液、纯度测定溶液)的多酚浓度,并根据公式(1)计算相应溶液的多酚质量浓度Y[22]:
(1)
式中:Y =C0、Ce、Cd、Cg等,表示各种测定液的多酚质量浓度,mg GAE/mL;C,通过标准曲线计算的质量浓度,μg/mL;DF,稀释倍数;V,各种测定液的总体积,mL。
1.3.4 静态吸附解吸实验
准确称取2.0 g不同类型的大孔树脂于锥形瓶中,分别加入一定浓度的黑果枸杞多酚稀释液50 mL,在转速 120 r/min,25 ℃下气浴振荡24 h,测定并计算吸附前、后溶液中多酚的质量浓度。树脂吸附达到饱和后,用蒸馏水冲洗除去树脂表面残余样品,以50 mL 60%乙醇为溶剂,保持转速120 r/min、25 ℃气浴振荡进行解吸,24 h后,测定并计算解吸液中多酚的质量浓度,各种大孔树脂对黑果枸杞多酚的吸附量、吸附率与解吸率计算如公式(2)~公式(4)所示:
(2)
(3)
(4)
式中:Q,吸附量,mg/g;C0、Ce,吸附起始及终了时吸附液中的多酚质量浓度,mg/mL;W,树脂质量,g;V0,吸附液体积,mL;E,吸附率,%;P,解吸率,%;Cd,解吸终了时解吸液中多酚的质量浓度,mg/mL;Vd,解吸液体积,mL。
1.3.5 吸附动力学实验
称取2.0 g 处理好的HPD500大孔树脂于三角瓶中,加入50 mL一定浓度的黑果枸杞多酚稀释液,以120 r/min的转速下恒温气浴振荡,温度为25 ℃,每隔30 min取1 mL上清液测定,计算吸附量,以吸附时间为横坐标、吸附量为纵坐标绘制静态吸附曲线,采用公式(5)、公式(6)描述吸附过程并建立动力学方程。
1.3.6 吸附热力学实验
准确称取5份2.0 g的HPD500大孔树脂于150 mL三角瓶中,将黑果枸杞多酚提取液稀释为0.007、0.012 5、0.025、0.05、0.1 mg/mL,各加入50 mL,293 K恒温振荡吸附,吸附完成后测定上清液中多酚的质量浓度并计算吸附量Qe,绘制1/Qe~1/Ce及lnQe~lnCe关系曲线,采用公式(10)和公式(11)进行等温吸附模型拟合并建立热力学方程。303 K、313 K、323 K操作相同。
1.3.7 静态吸附所用到的方程
静态吸附用到的方程如公式(5)~公式(11)所示:
准一级动力学模型
ln(Qe-Qt)=lnQe-K1t
(5)
准二级动力学模型
(6)
液膜扩散模型
-ln(1-F)=kt
(7)
颗粒内扩散模型
Qt =kt0.5
(8)
化学反应控制模型
1-(1-F)1/3=kt
(9)
Langmuir方程
(10)
Freundlich方程
(11)
式中:Qt、Qe,HPD500树脂对黑果枸杞多酚t时刻及吸附平衡时的吸附量,mg/g;F=Qt/Qe;Qmax,HPD500树脂对黑果枸杞多酚的最大吸附量,mg/g;Ce,吸附平衡的多酚质量浓度,mg/mL;K1、K2,动力学参数;k,扩散系数;KL、KF,HPD500树脂吸附黑果枸杞多酚的热力学模型参数;1/n,树脂吸附强度。
1.3.8 动态吸附与解吸工艺参数的考察
称取HPD500大孔树脂15.0 g,湿法装柱(树脂柱体积25 mL,高度185 mm),层析柱规格为φ13 mm×200 mm,分别考察上样流速(1.2、2.4、3.6、4.8 BV/h)、上样体积、pH(2.5、4.5、6.5、8.5、10.5)、上样液浓度(0.6、0.8、1.0、1.2 mg/mL)对吸附率的影响。
完成动态吸附的基础上,考察洗脱剂浓度(40%、50%、60%、70%、80%乙醇)和洗脱流速(1.2、2.4、3.6、4.8 BV/h)对解吸率的影响。
1.3.9 黑果枸杞多酚纯度测定
将黑果枸杞多酚粗提液及动态纯化后的洗脱液分别在0.05 MPa、48 ℃条件下利用旋转蒸发仪减压蒸馏除去溶剂,避光、25 ℃鼓风干燥,得黑果枸杞多酚粗品与精制品,分别准确称取0.2 g,少量60%乙醇溶解,蒸馏水分别定容至100 mL,即为测试液,测定多酚浓度,采用公式(12)计算粗多酚与精制多酚的纯度:
(12)
式中:w为多酚质量纯度,mg/g;Cg为粗品及精制品测试液多酚浓度,mg/mL;n为稀释倍数;100为溶液体积,mL;m,多酚质量,0.2 g;1 000为单位换算系数。
1.3.10 纯化黑果枸杞多酚抗氧化性实验
(1)羟自由基清除实验 参考NAGA等[23]报道的方法测定,并采用公式(13)计算黑果枸杞精制多酚及抗坏血酸的羟自由基清除率:
羟自由基清除率![]()
(13)
式中:Ax0、A0、Ax分别是510 nm处样品本底液、空白对照液及测试液的吸光度。
(2)超氧阴离子自由基清除实验 将5.9 mL pH=7.4的0.05 mol/L Tris-HCl缓冲溶液与0.1 mL 60 mmol/L的连苯三酚溶液在10 mL石英比色皿中迅速混合,25 ℃预热15 min,以Tris-HCl缓冲溶液为参比,在325 nm处测其吸光度,开始计时,每隔30 s读取1次数值A325 nm,至240 s时为止,ΔA0=A325 nm,240 s-A325 nm,30 s。用1 mL样品溶液与4.9 mL上述Tris-HCl缓冲溶液代替5.9 mL缓冲溶液做相同的实验,ΔA=A325 nm,240 s-A325 nm,30 s。通过公式(14)计算黑果枸杞精制多酚及抗坏血酸的超氧阴离子自由基清除率:
超氧阴离子自由基清除率![]()
(14)
1.3.11 数据统计分析
数据处理采用Origin 8.0 软件绘图和拟合。
2 结果与分析
2.1 树脂筛选结果
对9种大孔树脂进行吸附和解吸操作后评价其对黑果枸杞多酚的纯化性能,结果见表1。由表1可知,HPD500是孔径为5.5~7.5 nm的极性树脂,对黑果枸杞多酚的吸附率为72.72%、解吸率为84.86%,比较而言,此树脂对黑果枸杞多酚有良好的吸附和解吸效果,可能与它有较大的比表面积,能提供较多吸附位点有关。因此,笔者选择HPD500大孔树脂进行后续实验,以探讨其对黑果枸杞多酚的吸附分离特性。
表1 九种大孔树脂的吸附率与解吸率
Table 1 Adsorption and desorption rates of the nine kinds of macroporous resins
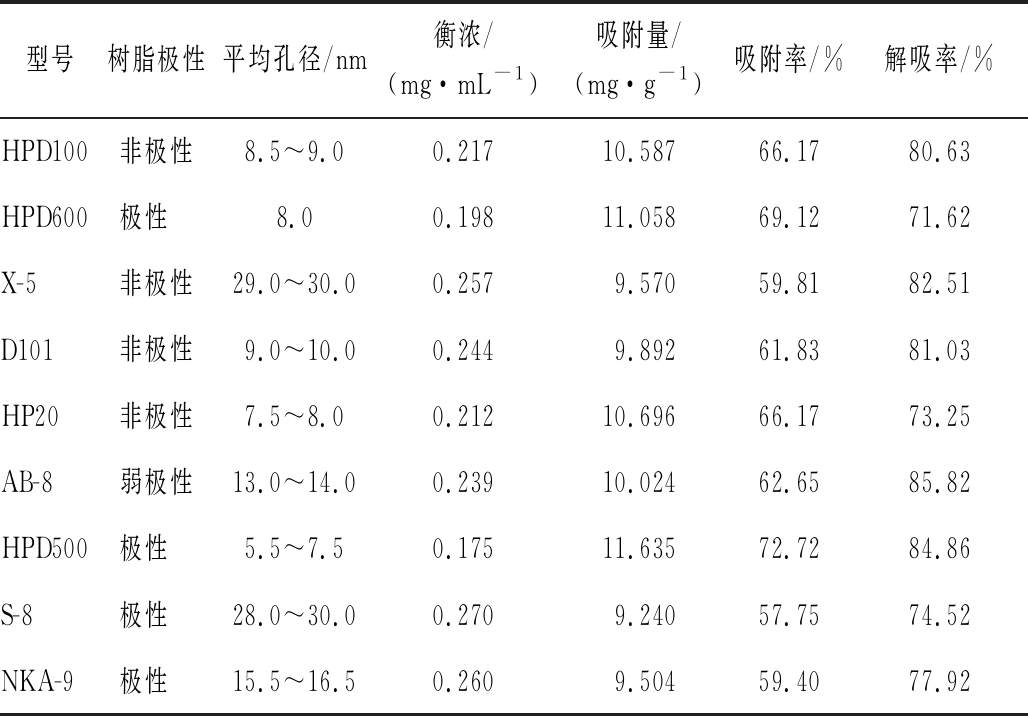
型号树脂极性平均孔径/nm衡浓/(mg·mL-1)吸附量/(mg·g-1)吸附率/%解吸率/%HPD100非极性8.5~9.00.21710.58766.1780.63HPD600极性 8.00.19811.05869.1271.62X-5非极性29.0~30.00.2579.57059.8182.51D101非极性 9.0~10.00.2449.89261.8381.03HP20非极性7.5~8.00.21210.69666.1773.25AB-8弱极性13.0~14.00.23910.02462.6585.82HPD500极性 5.5~7.50.17511.63572.7284.86S-8极性 28.0~30.00.2709.24057.7574.52NKA-9极性 15.5~16.50.2609.50459.4077.92
2.2 吸附动力学研究
2.2.1 吸附动力学曲线
实验拟合得到的吸附动力学曲线见图1。由图1可知,吸附过程经历了快速吸附(0~300 min)、慢速吸附(300~720 min)、吸附平衡(720~1 440 min)3个阶段,吸附速率与吸附剂表面吸附位点与固液两相吸附质的浓度差有关。
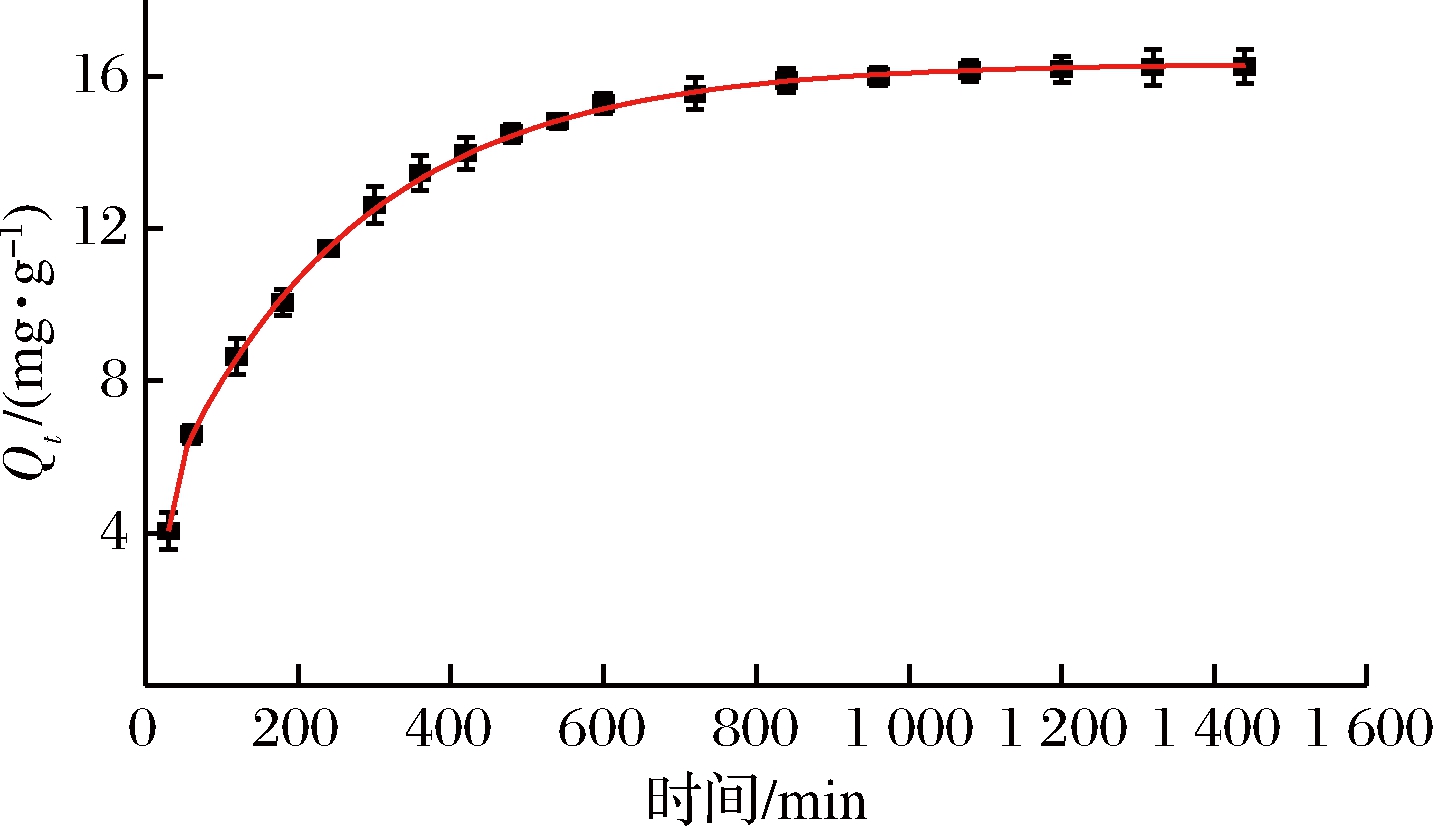
图1 吸附动力学曲线
Fig.1 Adsorption dynamic curve
2.2.2 吸附动力学模型
采用准一级、准二级动力学模型分别描述吸附过程,线性回归得出动力学参数K1、K2、Qe,见表2。
表2 动力学模型及相关系数
Table 2 The dynamic matching models and correlation coefficients

动力学方程相关系数(R2)动力学参数ln(Qe-Qt)=lnQe-K1tY=2.565 76-0.004 4X0.928 90K1=0.004 4Qe=13.010 5tQt=1K2Q2e+tQeY=5.939 66+0.058 33X0.999 24K2=0.020 2Qe=17.143 8
根据表2,准二级动力学模型的相关系数为0.999 24,平衡吸附量理论值为17.143 8 mg/g,表明准二级动力学模型能更好地描述HPD500树脂对黑果枸杞多酚的吸附过程,吸附过程可能通过共用电子或交换电子完成[24]。
2.2.3 吸附控制机制的分析
相关文献显示,一般大孔树脂吸附过程由外扩散、液膜扩散、颗粒内扩散、吸附质与大孔树脂内部活性基发生化学反应4个连续的步骤构成[25]。可通过快速混合消除外扩散对吸附速率的影响,因此,考虑后3步的吸附控制情况[26]。
将动力学实验数据通过公式(7)~公式(9)分别进行线性拟合,结果见表3,绘制颗粒内扩散模型曲线,如图2所示。
表3 HPD500树脂对黑果枸杞多酚扩散拟合方程及相关参数
Table 3 Fitting equation and correlation coefficients of diffusion model of Lycium ruthenicum polyphenols on HPD500 resin

动力学方程回归方程相关系数-ln(1-F)=ktY=0.004 4X+0.198 370.928 85Qt=kt0.5Y=0.322 7X+5.709 790.901 711-(1-F)1/3=ktY=0.000 58X+0.209 020.969 34
根据EWA等的研究成果,如果颗粒内扩散模型为唯一控制步骤,模型拟合得到的结果应为1条曲线,而且经过原点[27]。由图2可以看出,颗粒内扩散模型曲线近似为2条相交且不经过坐标原点的直线,所以不是唯一控制步骤,表3中3种模型的相关系数均大于0.9小于1,顺序为:化学反应模型>液膜扩散>颗粒内扩散,说明化学反应模型对吸附过程控制显著且受其余二者影响。
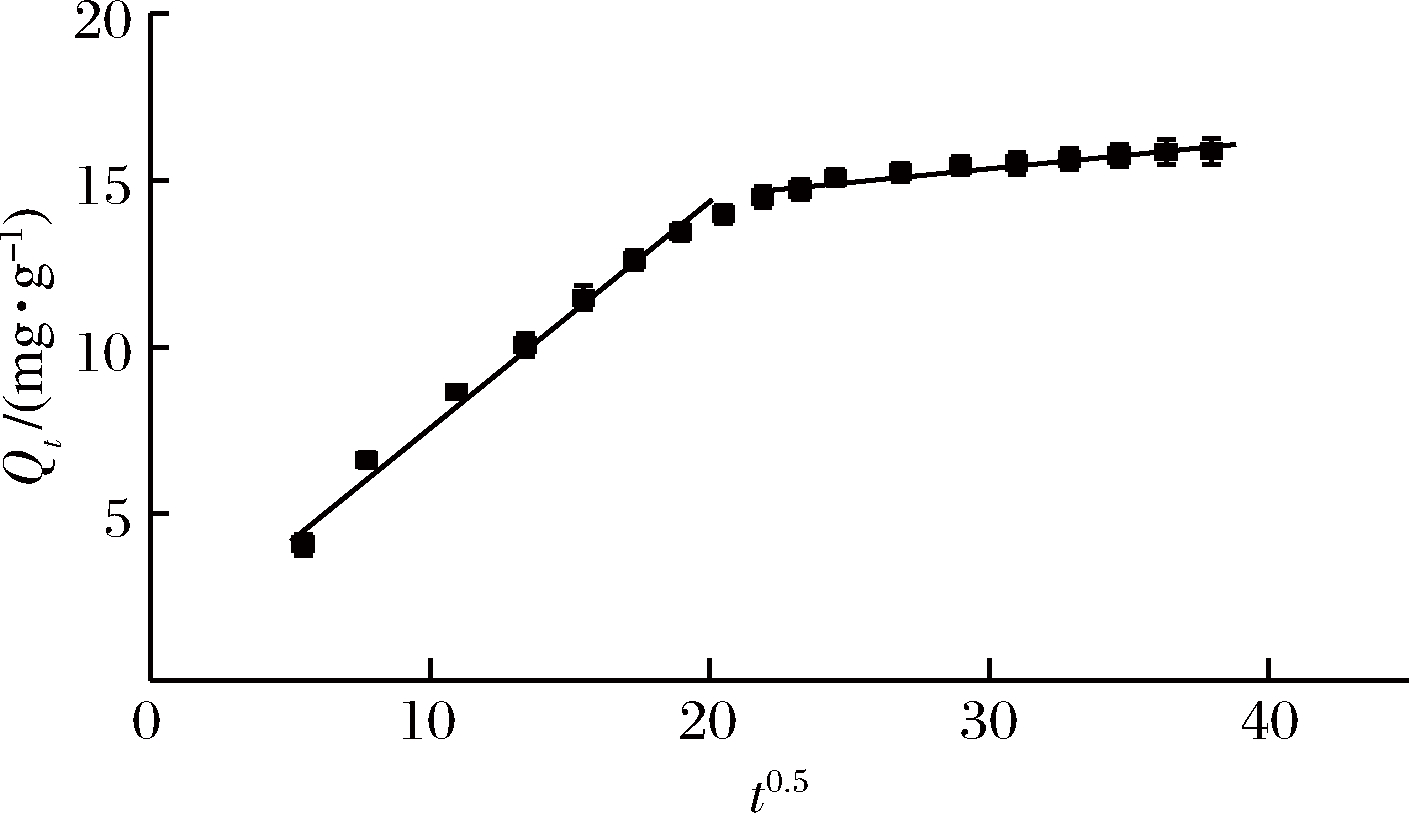
图2 HPD500大孔树脂吸附黑果枸杞多酚的颗粒内扩散模型动力学曲线
Fig.2 Adsorption dynamic curve of intraparticle diffusion model for adsorption of Lycium ruthenicum polyphenols on HPD500 resin
2.3 吸附热力学研究
2.3.1 静态吸附等温线
将静态等温实验所得1/Qe~1/Ce及lnQe~lnCe关系分别进行线性拟合,根据Langmuir方程和Freundlich方程计算模型参数,结果如表4、表5所示。
表4 Langmuir热力学方程及相关系数
Table 4 The Langmuir thermodynamics equations and correlation coefficients
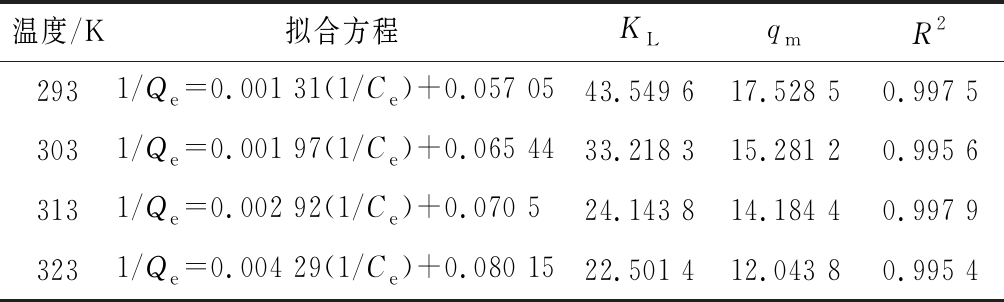
温度/K拟合方程KLqmR22931/Qe=0.001 31(1/Ce)+0.057 0543.549 617.528 50.997 53031/Qe=0.001 97(1/Ce)+0.065 4433.218 315.281 20.995 63131/Qe=0.002 92(1/Ce)+0.070 524.143 814.184 40.997 93231/Qe=0.004 29(1/Ce)+0.080 1522.501 412.043 80.995 4
表5 Freundlich热力学方程及相关系数
Table 5 The Freundlich thermodynamics equations and correlation coefficients
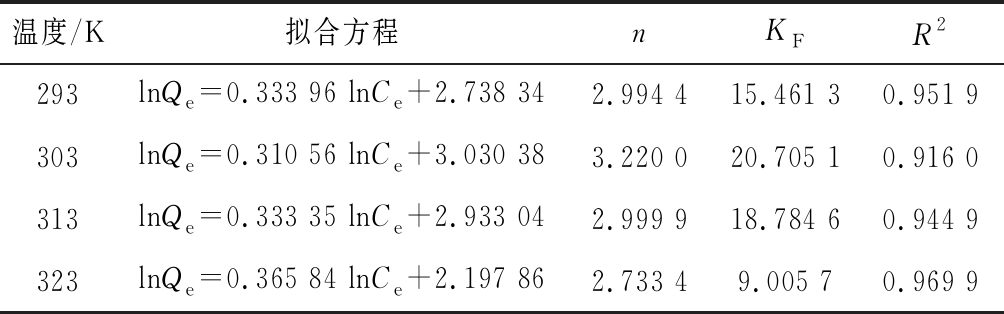
温度/K拟合方程nKFR2293lnQe=0.333 96 lnCe+2.738 342.994 415.461 30.951 9303lnQe=0.310 56 lnCe+3.030 383.220 020.705 10.916 0313lnQe=0.333 35 lnCe+2.933 042.999 918.784 60.944 9323lnQe=0.365 84 lnCe+2.197 862.733 49.005 70.969 9
根据表4、表5,Langmuir方程较Freundlich方程更好地描述了吸附过程,R2均大于0.99。293~323 K的吸附等温线表明平衡吸附量随温度的升高而减小,Langmuir方程拟合参数KL、qm随温度的变化情况与此相符。
2.3.2 静态吸附热力学参数
吸附自由能变ΔG通过Gibbs方程(15)计算[28]:
(15)
式中:X,平衡溶液中吸附质的摩尔分数;Q,吸附量;T,热力学温度,K。
若吸附等温线符合Langmuir,ΔG采用公式(16)计算,其中K为Langmuir方程中的模型参数KL,R是气体常数[8.314 J/(mol·K)]。
ΔG=RTlnK
(16)
吸附焓变ΔH及吸附熵变ΔS采用Gibbs-Helmholtz方程[29]得到,如公式(17)所示,结果见表6。
ΔS=(ΔHΔG)/T
(17)
表6 吸附热力学参数
Table 6 Adsorptive thermodynamic parameters

温度/KΔG/(kJ·mol-1)ΔH/(kJ·mol-1)ΔS/[kJ·(mol·K)-1]R2293303313323-9.193 2-8.824 8-8.285 7-7.861 9-22.503 04-45.330.995 3
由表6可知,ΔG<0,ΔH<0,ΔS<0说明HPD500大孔树脂吸附黑果枸杞多酚可自发进行且为放热熵减过程,降低温度可增强吸附效果、提高吸附率。
2.4 动态吸附、解吸工艺参数
2.4.1 上样流速和上样体积
按“1.3.8”中的方法分别以1.2、2.4、3.6、4.8 BV/h的上样流速上样,其泄漏点(流出液浓度达到上样浓度的10%)分别为240 mL(9.6 BV),200 mL(8.0 BV),160 mL(6.4 BV),110 mL(4.4 BV)可见到达泄漏点时的上样量随上样流速的增大逐渐减小,结果见图3。由于上样速度过快,黑果枸杞多酚与树脂接触时间较短,导致吸附率较低,上样速度过慢,多酚与树脂充分接触,实验循环周期延长,综合考虑,选取上样流速为2.4 BV/h为宜,上样量8.0 BV。
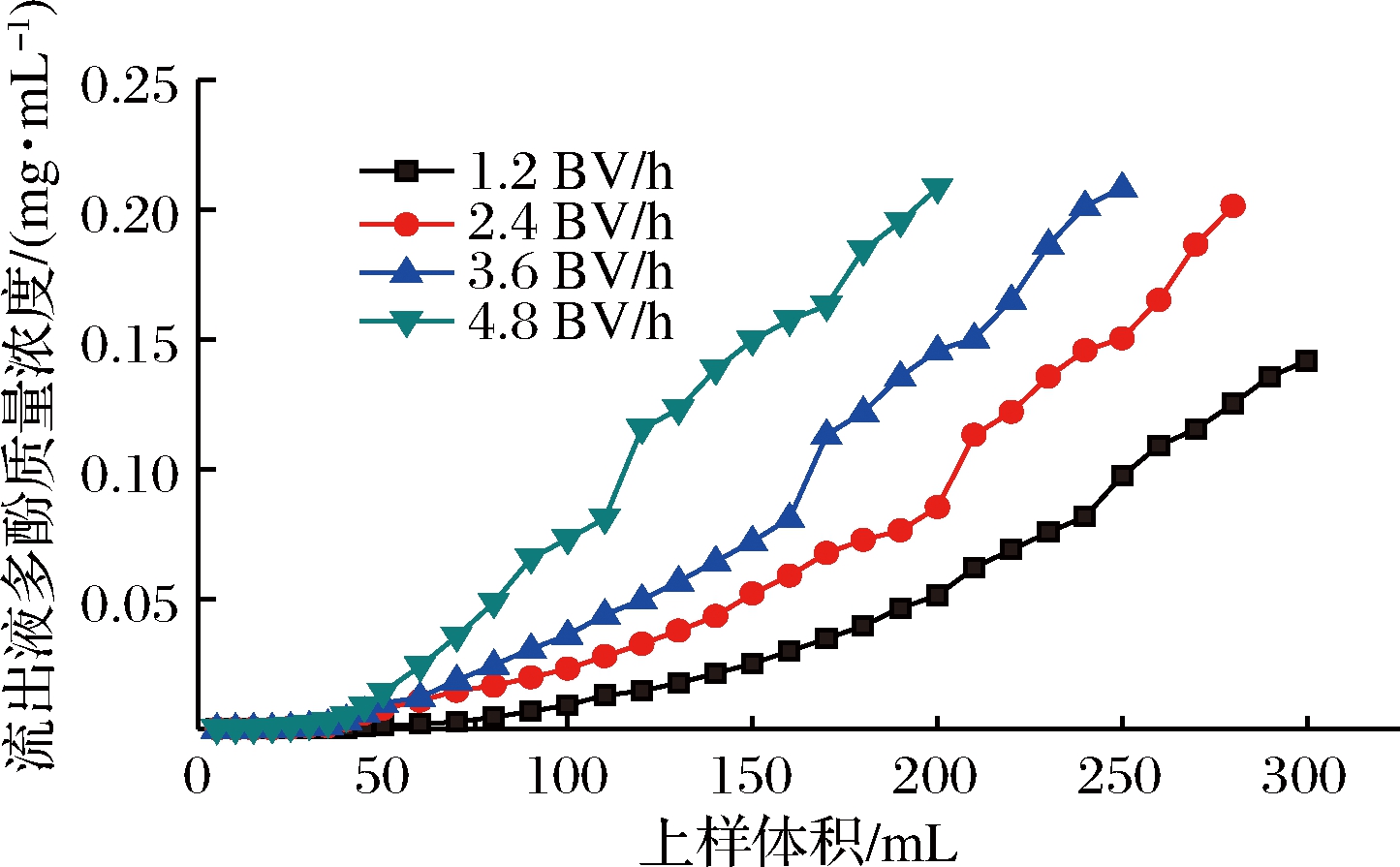
图3 不同流速的吸附泄漏曲线
Fig.3 Adsorption leakage curves at different flow rates
2.4.2 上样pH
按“1.3.8”中的方法考察pH对吸附率的影响,结果如图4所示。由图4可以看出,HPD500树脂对黑果枸杞多酚的吸附率在酸性条件较高且变化幅度不大,黑果枸杞粗多酚样品原液pH为6.5,综合考虑实验中保持黑果枸杞多酚原液pH。
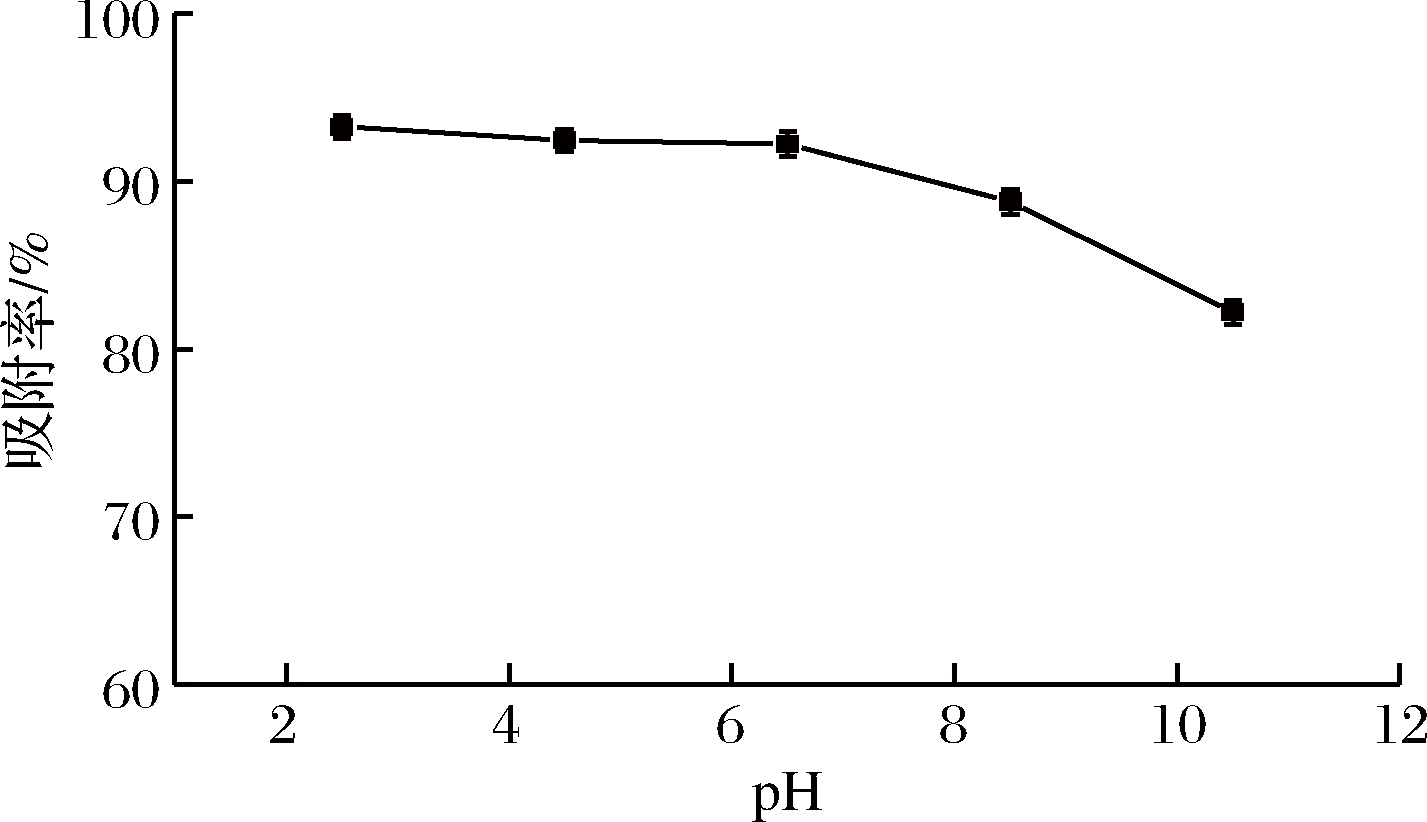
图4 上样液pH对吸附率的影响
Fig.4 Effect of sample solution pH on adsorption rate
2.4.3 上样浓度
上样浓度对吸附率的影响结果如图5所示。由图5可以看出,吸附率随上样浓度的增加先增大后减小,当上样质量浓度增至0.8 mg/mL时,吸附率达到了最大值94.29%,原因是上样液浓度较低时,吸附推动力小,吸附速率小,相同时间内导致吸附率较小,上样浓度增大,上样液中杂质也随之增多,与多酚形成竞争吸附、从而影响吸附效果。因此,选择0.8 mg/mL为适宜的上样浓度。
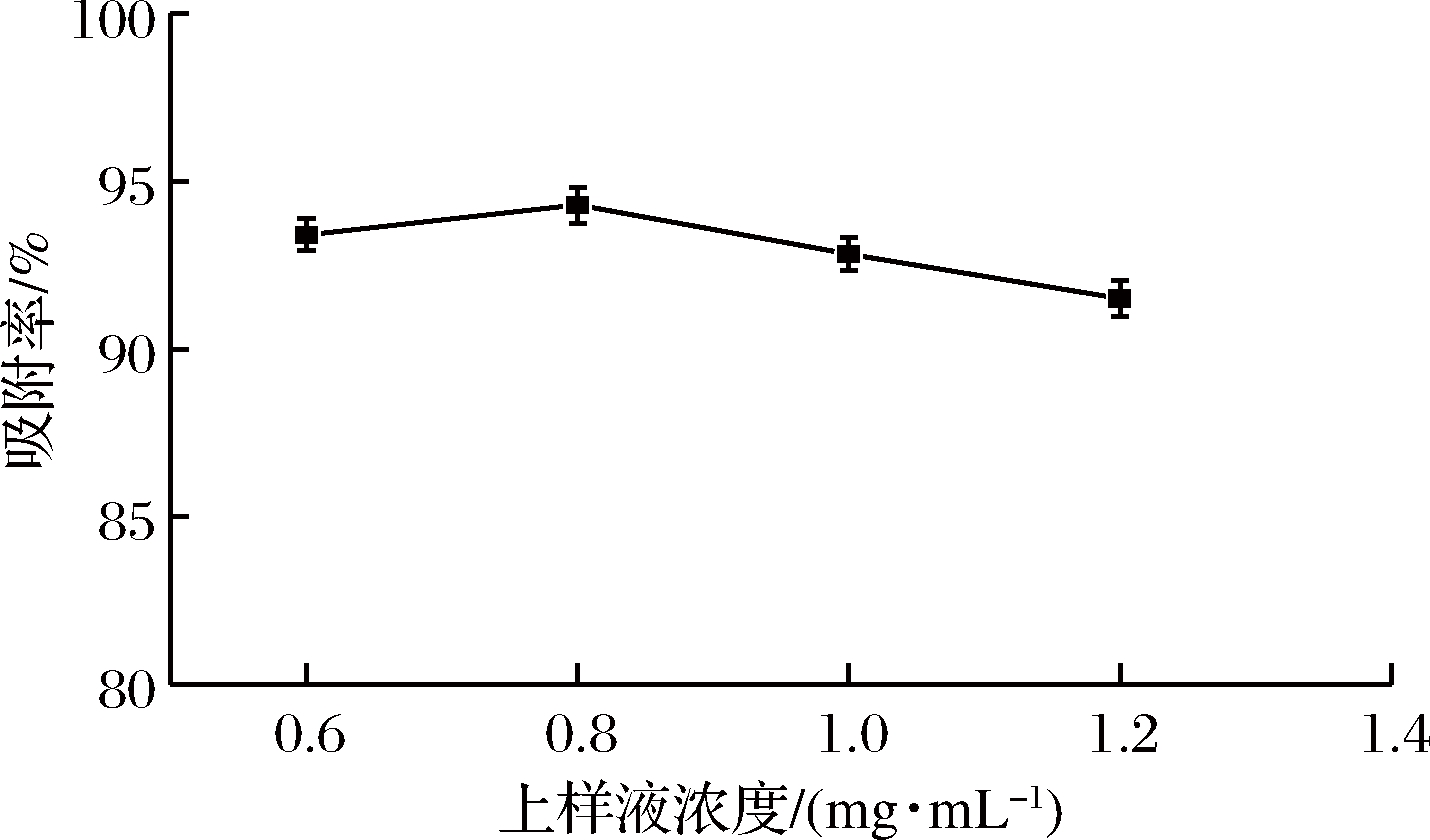
图5 上样液浓度对吸附率的影响
Fig.5 Effect of sample solution concentration on adsorption rate
2.4.4 洗脱剂浓度
以上述得到的较佳动态吸附条件对黑果枸杞多酚粗提液进行吸附并计算吸附量,固定洗脱速率为2.4 BV/h,考察洗脱剂浓度(体积分数)对解吸率的影响,结果如图6所示。
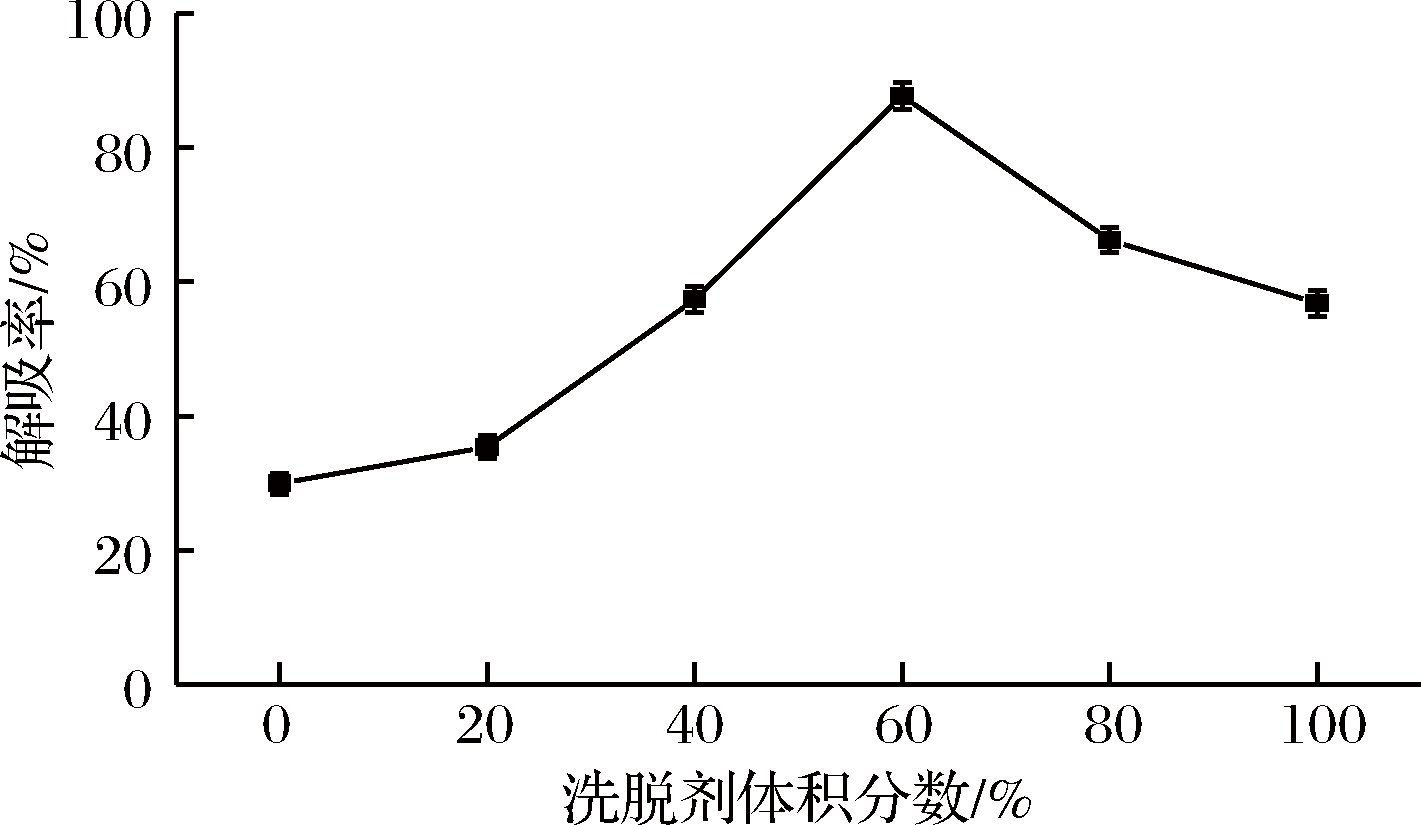
图6 洗脱剂体积分数对解吸率的影响
Fig.6 Effect of eluent volume fraction on desorption rate
由图6可知,随着洗脱剂浓度的增加,解吸率先增大后减小且变化速率较快、曲线较陡峭,当乙醇体积分数为60%时,此时洗脱剂与黑果枸杞多酚极性相似使解吸率达到最大值87.75%。因此,洗脱剂选用60%乙醇。
2.4.5 洗脱剂流速
60%乙醇不同洗脱流速下的洗脱曲线见图7。由图7可以看出,在4种流速下,多酚洗脱流出液区间约为10~150 mL时,流出130 mL后树脂中的多酚量极少,因此,选用10~130 mL为纯化多酚流出液收集区间,计算10~130 mL不同洗脱剂流速下获得的多酚洗脱量,发现流速为2.4 BV/h时多酚的洗脱量最大,为123.06 mg,且峰较集中、没有明显拖尾现象。因此确定2.4 BV/h为洗脱流速。
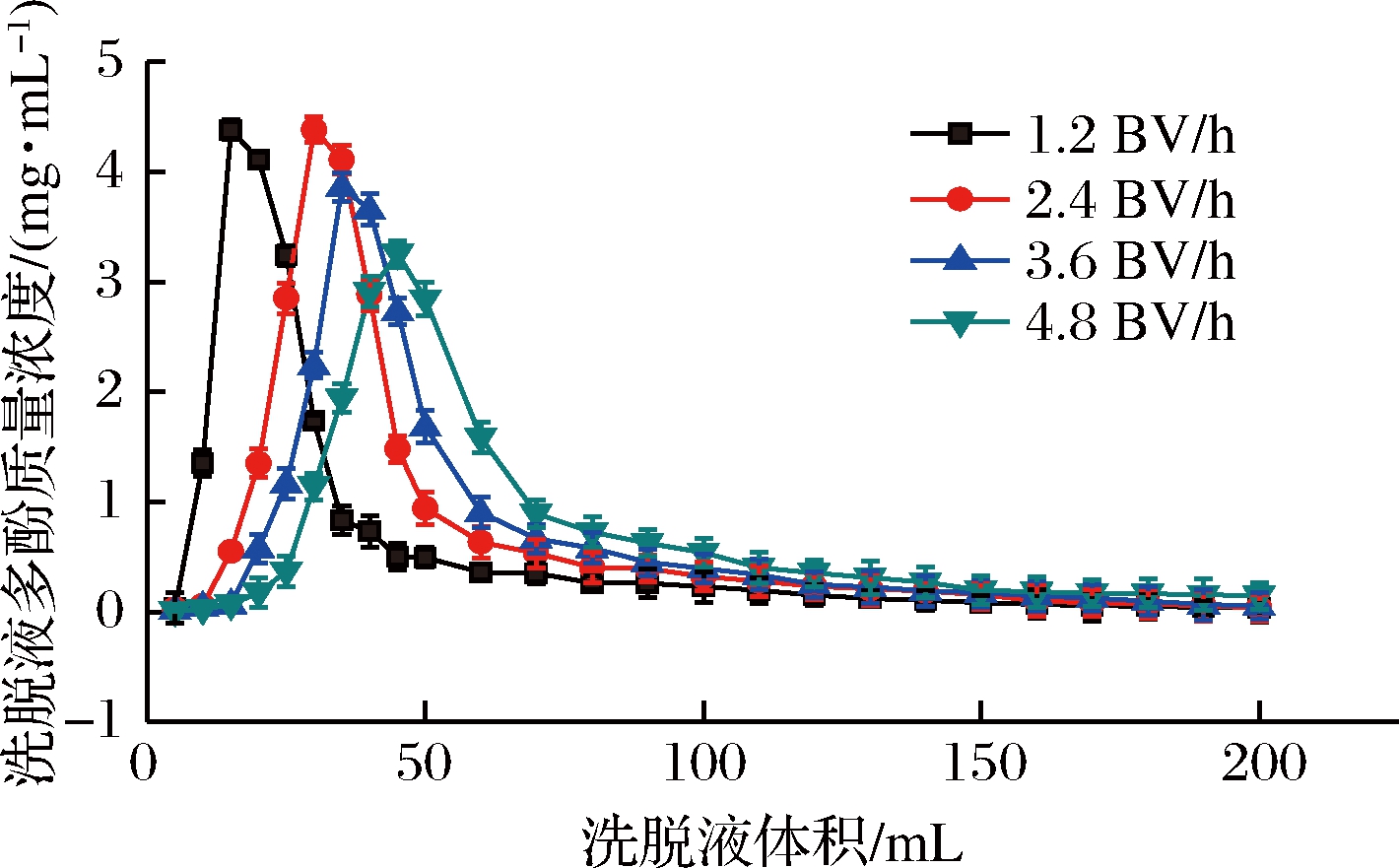
图7 动态洗脱曲线
Fig.7 Dynamic desorption curve
2.5 HPD500大孔树脂对黑果枸杞多酚纯化效果检验
黑果枸杞多酚纯化前后纯度测定结果如表7所示。由表7可以看出,经过HPD500大孔树脂分离纯化后,纯度提高了2.36倍,表明HPD500大孔树脂对黑果枸杞多酚有较好的纯化作用,能够实现成分的富集。
表7 纯化前后总多酚的纯度
Table 7 Purities of polyphenols before and after optimized purification
成分粗提物总多酚纯化后总多酚总多酚含量/(mg·g-1)314.77±1.94742.86±2.58
2.6 抗氧化活性分析
2.6.1 羟自由基清除能力
羟自由基清除实验结果见图8。由图8可以看出,羟自由基清除率随黑果枸杞多酚和抗坏血酸浓度的增大而增大,通过清除率-浓度回归曲线计算黑果枸杞多酚及抗坏血酸的半数抑制浓度分别是1.309 0、5.642 0 mg/mL,可见,黑果枸杞多酚对羟自由基的清除能力强于抗坏血酸。

图8 黑果枸杞多酚及抗坏血酸的羟自由基清除能力
Fig.8 ·OH scavenging force of Lycium ruthenicum polyphenols and ascorbic acid
2.6.2 超氧阴离子自由基清除能力
超氧阴离子自由基的清除实验结果如图9所示。由图9可知,黑果枸杞多酚质量浓度为0.20 mg/mL、抗坏血酸质量浓度为0.03 mg/mL时,二者清除率均达到了100%,通过清除率-浓度回归曲线计算黑果枸杞多酚及抗坏血酸的半数抑制浓度IC50分别是0.070 8、0.007 26 mg/mL,可见黑果枸杞多酚对超氧阴离子自由基的清除作用弱于抗坏血酸。
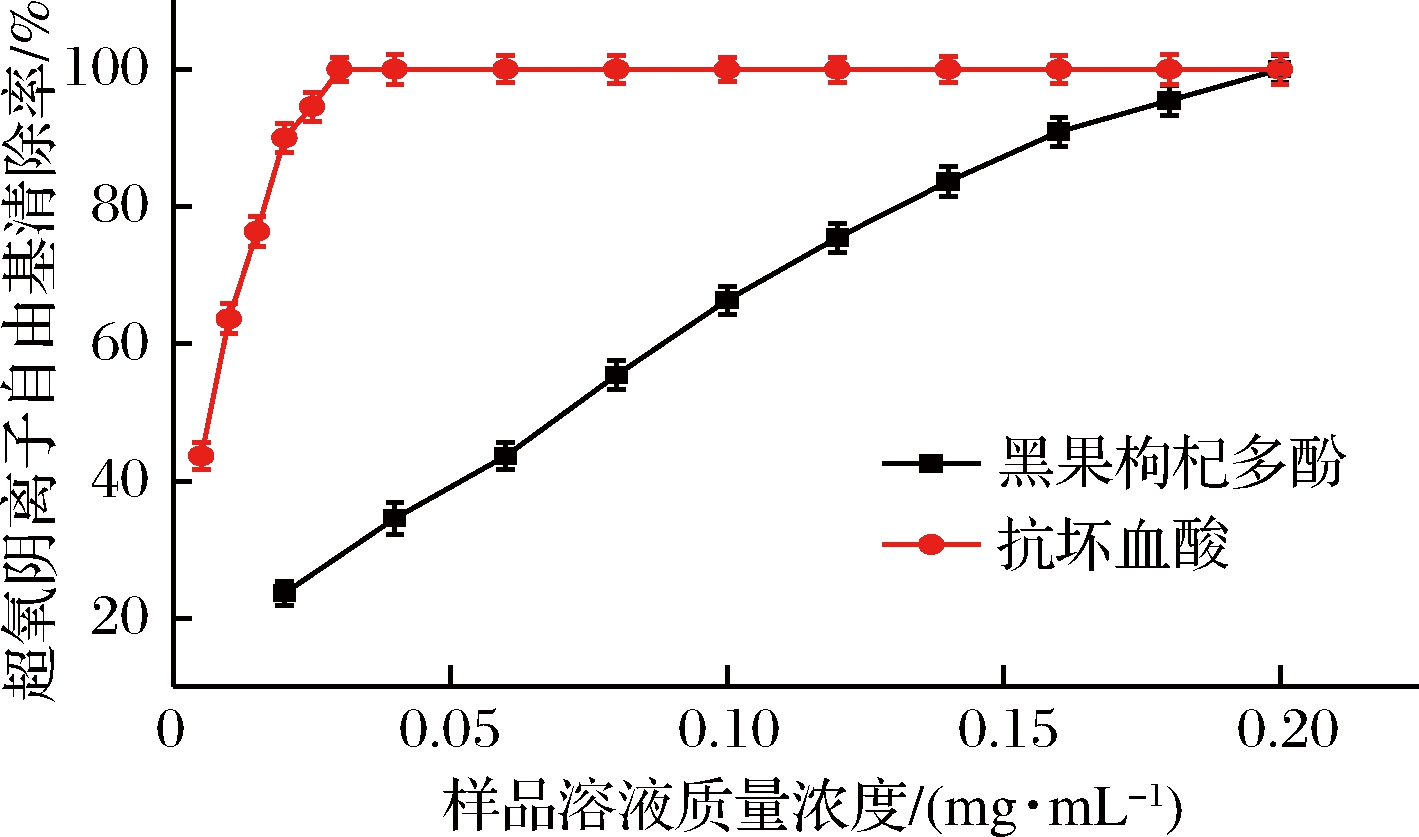
图9 黑果枸杞多酚及抗坏血酸的超氧阴离子自由基清除能力![]() scavenging force of Lycium ruthenicum polyphenols and ascorbic acid
scavenging force of Lycium ruthenicum polyphenols and ascorbic acid
3 结论
通过对9种大孔树脂吸附分离效果的考察,确定了HPD500为黑果枸杞粗多酚较佳的分离树脂。准二级动力学模型能很好地描述了HPD500树脂对黑果枸杞多酚的吸附过程(R2>0.99),动力学参数为K2=0.020 2;吸附热力学实验表明,吸附过程符合Langmuir方程(R2>0.99),且为自发放热过程。
HPD500树脂动态纯化黑果枸杞多酚的较佳工艺条件为:8 BV质量浓度为0.8 mg/mL的黑果枸杞粗提液为上样液,上样流速为2.4 BV/h,60%(体积分数)的乙醇溶液以2.4 BV/h流速洗脱,用量6 BV,纯度较纯化前提高了2.36倍。
黑果枸杞多酚有较强的羟自由基和超氧阴离子自由基清除能力,可作为潜在的抗氧化剂来源。
[1] 林丽, 晋玲, 郭玉环.不同产区黑果枸杞的鉴定[J].时珍国医国药, 2018, 29(11):2 670-2 673.
LIN L, JIN L, GUO Y H.Identification of Lycium ruthenicum Murr.from different regions[J].Lishizhen Medicine and Materia Research, 2018, 29(11):2 670-2 672.
[2] WANG H Q, LI J N, TAO W W, et al.Lycium ruthenicum studies:Molecular biology, phytochemistry and pharmacology[J].Food Chemistry, 2018,240:759-766.
[3] 张霞, 张芳, 高晓娟, 等.不同干燥方法对黑果枸杞中活性成分含量及其抗氧化活性的影响[J].中国中药杂志, 2017,42(20):3 926-3 931.
ZHANG X, ZHANG F, GAO X J, et al.Study on the effects of different drying methods on the content of bioactive component and antioxidant activity in Lycium Ruthenicum Murr.[J].China Journal of Chinese Materias Medica, 2017,42(20):3 926-3 931.
[4] 尹民强, 吴金龙, 王天琦.等.黑果枸杞抗氧化能力评价及比较研究[J].中国果菜, 2019, 39(11):52-56.
YIN M Q, WU J L, WANG T Q, et al.Evaluation and comparative study on antioxidant capacity of Lycium ruthenicum Murr.[J].China Fruit & Vegetable, 2019, 39(11):52-56.
[5] LUO Y, FANG J L, YUAN K, et al.Ameliorative effect of purified anthocyanin from Lycium ruthenicum on atherosclerosis in rats through synergistic modulation of the gut microbiota and NF-κB/SREBP-2 pathways[J].Journal of Functional Foods, 2019,59:223-233.
[6] PENG Y J, YAN Y M, WAN P, et al.Gut microbiota modulation and anti-inflammatory properties of anthocyanins from the fruits of Lycium ruthenicum Murray in dextran sodium sulfate-induced colitis in mice[J].Free Radical Biology and Medicine, 2019, 136:96-108.
[7] NI W H, GAO T T, WANG H L, et al.Anti-fatigue activity of polysaccharides from the fruits of four Tibetan plateau indigenous medicinal plants[J].Journal of Ethnopharmacology, 2013, 150(2):529-535.
[8] 曹茸茸. 黑果枸杞抗运动疲劳作用研究[D].兰州:甘肃中医药大学, 2018:8-15.
CAO R R.Study on the anti-fatigue effects of Lycium ruthenium[D].Lanzhou:Gansu University of Chinese Medicine, 2018:8-15.
[9] TIAN B M, ZHAO J H, AN W, et al.Lycium ruthenicum diet alters the gut microbiota and partially enhances gut barrier function in male C57BL/6 mice[J].Journal of Functional Foods, 2019, 52:516-528.
[10] MASCI A, CARRADORI S, CASADEI M A, et al.Lycium barbarum polysaccharides:Extraction, purification, structural characterisation and evidence about hypoglycaemic and hypolipidaemic effects[J].Food Chemistry,2018,254:377-389.
[11] ZHANG G, CHEN S S, ZHOU W, et al.Anthocyanin composition of fruit extracts from Lycium ruthenicum and their protect- tive effect for gouty arthritis[J].Industrial Crops and Products, 2019, 129:414-423.
[12] 张晶, 杨慧海, 刘芳芳, 等.黑果枸杞的化学成分、药理作用及栽培技术的研究现状[J].食品与生物技术学报, 2018, 37(7):673-678.
ZHANG J, YANG H H, LIU F F, et al.Research progress of chemical constituents、pharmacological activity and cultivation techniques of Lycium ruthenicum Murr.[J].Journal of Food Science and Biotechnology, 2018, 37(7):673-678.
[13] 戴逢斌, 刘丽萍, 李艾佳, 等.多基因型黑果枸杞高效快繁体系的建立[J].生物技术通报, 2019, 35(4):201-207.
DAI F B, LIU L P, LI A J, et al.Establishment of highly efficient and rapid propagation system of Lycium ruthenicum for multiple genotypes[J].Biotechnology Bulletin, 2019, 35(4):201-207.
[14] LI Y, ZOU X, SHEN T, et al.Determination of geographical origin and anthocyanin content of black goji berry(Lycium ruthenicum Murr.) using near infrared spectroscopy and chemometrics[J] Food Analytical Methods, 2017, 10:1 034-1 044.
[15] HU N, ZHENG J, LI W C, et al.Isolation, stability, and antioxidant activity of anthocyanins from Lycium ruthenicum Murray and Nitraria Tangutorum Bobr of Qinghai-Tibetan plateau[J].Separation Science and Technology, 2014, 49(18):2 897-2 906.
[16] WANG Y W, LUAN G X, ZHOU W, et al.Subcritical water extraction, UPLC-Triple-TOF/MS analysis and antioxidant activity of anthocyanins from Lycium ruthenicum Murr.[J].Food Chemistry,2018,249:119-126.
[17] 张佳, 赫军, 张蕾, 等.黑果枸杞果实化学成分研究[J].中国药学杂志, 2016, 51(24):2 150-2 154.
ZHANG J, HE J, ZHANG L, et al.Chemical constituents from fruit of Lycium ruthenicum Murr.[J].Chinese Pharmaceutical Journal, 2016, 51(24):2 150-2 154.
[18] 夏园园, 莫仁楠, 曲炜, 等.黑果枸杞化学成分研究进展[J].药学进展, 2015, 39(5):351-356.
XIA Y Y, MO R N, QU W, et al.Research progress in chemical constituents of Lycium Ruthenicum Murr.[J].Progress in Pharmaceutical Sciences, 2015, 39(5):351-356.
[19] 李巍巍, 李俊发, 郭安臣, 等.植物多酚神经保护作用的研究进展[J].中国卒中杂志, 2015, 10(2):141-146.
GUO W W, LI J F, GUO A C, et al.Neuroprotection of plant polyphenols in cerebral ischmia[J].Chinese Journal of Stroke,2015, 10(2):141-146.
[20] TANG H Y, FANG Z X, NG K.Dietary fiber-based colon-targeted delivery systems for polyphenols[J].Trend in Food Science & Technology, 2020,100:333-348.
[21] 罗磊, 姬青华, 马丽萍, 等.NKA-9大孔树脂对绿豆皮黄酮的纯化研究[J].中国食品学报, 2019, 19(6):157-167.
LUO L, JI Q H, MA L P, et al.Studies on purification of total flavonoids from mung bean hull using NKA-9 macroporous resin[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(6):157-167.
[22] AINSWORTH E A, GILLESPIE K M.Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J].Nature Protocols, 2007, 2(4):875-877.
[23] NAGA L T, Antioxidative activities of water extract and ethanol extract from field horsetai L(tsukushi)Equisetum arvense L[J].Food Chemistry, 2005,91(3):389-394.
[24] 张斌, 孙兰萍, 伍亚华,等.花生壳总黄酮的大孔树脂吸附动力学研究[J].中国油脂,2017,42(3):122-126.
ZHANG B, SUN L P, WU Y H, et al.Adsorption kinetics of flavonoids from peanut hull by macroporous resin[J].China Oils and Fats, 2017,42(3):122-126.
[25] 陈浩, 陈敏, 聂犇.XAD-16大孔树脂对恩拉霉素的吸附热力学和动力学性质研究[J].中国药学杂志,2017,52(18):1 618-1 623.
CHEN H, CHEN M, NIE B.Adsorption thermodynamics and kinetics of enramycin on XAD-16 macroporous resin[J].Chinese Pharmaceutical Journal, 2017, 52(18):1 618-1 623.
[26] 陆敏, 马海乐, 朱莉萍, 等.D301-G大孔树脂吸附菊芋多糖色素机理探究[J].食品工业科技,2019(16):58-70.
LU M, MA H L, ZHU L P, et al.Adsorption mechanism research on Jerusalem artichoke polysaccharide pigment with D301-G macroporous resin[J].Science and Technology of Food Industry, 2019(16):58-70.
[27] EWA L G, GRAZYNA G.Adsorption of lignite-derived humic acids on coal-based mesoporous activated carbons[J].Journal of Colloid and Interface Science,2005,284(2):416-423.
[28] ZOU S P, LIU M, WANG Q L, et al.Preparative separation of echinocandin B from Aspergillus nidulans broth using macroporous resin adsorption chromatography[J].Journal of Chromatography B, 2015,978-979:111-117.
[29] XIONG Q, ZHANG Q, ZHANG D, et al.Preliminary separation and purification of resveratrol from extract of peanut (Arachis hypogaea) sprouts by macroporous adsorption resins[J].Food Chemistry, 2014,145:1-7.