鱼肉中普遍含有丝氨酸蛋白酶,该酶可以引起肌原纤维蛋白降解,导致鱼糜凝胶发生凝胶劣化现象[1]。研究发现,丝氨酸蛋白酶大部分位于肌原纤维部位,少量位于肌浆部分,丝氨酸蛋白酶可以与肌原纤维蛋白紧密结合、难以分离,并具有强活性[2-6]。OSATOMI等[7]首次用高盐溶液酸处理分离纯化鲤鱼肉中的丝氨酸蛋白酶。部分学者在狗母鱼[5]、鲢鱼[3]、鲫鱼[8]等中相继发现并分离出丝氨酸蛋白酶。研究发现,55 ℃下,将纯化后的丝氨酸蛋白酶添加到鲤鱼肌原纤维中,反应1 h后,肌动蛋白被降解成不同的片段,而肌球蛋白重链、α-辅肌动蛋白几乎完全被降解了。相同条件下,蛇鲻的肌球蛋白重链同样被降解了,但其他蛋白几乎不变,故丝氨酸蛋白酶参与凝胶劣化现象,但不同的物种具有差异[2]。为了抑制内源性丝氨酸蛋白酶的活性,添加抑制剂是一种较为有效的手段。
在鱼糜制品生产过程中,为了保证鱼糜制品具有良好的风味、口感及凝胶性能,经常会添加一些外源添加剂。鱼肉加工中经常会添加一些食盐,首要目的是调节鱼肉制品的味道,还可以使盐溶性蛋白溶解,提高鱼糜制品的凝胶特性。文献表明NaCl对肌原纤维蛋白凝胶性能起着重要的作用,可以改变环境中的离子强度,提高肌原纤维蛋白的溶解性,在加热过程中,肌原纤维蛋白发生变性,将水分包裹在内,提高肌原纤维蛋白凝胶的持水性,改善鱼糜的质构特性[9]。有研究发现,离子强度会影响蛋白凝胶的微观结构,在低离子强度下(0.2~0.4 mol/L NaCl),形成较细的链状结构,在高离子强度下则形成粗丝状的网络结构[10-11]。且NaCl具有较强的防腐功能,可以抑制一些腐败菌的生长繁殖,延长食品的保质期[12-13]。有研究证实,在肌原纤维蛋白中添加NaCl,可以引起其膨胀、断裂,使蛋白的持水性增强,黏度增大[14]。本文以养殖大黄鱼肌原纤维蛋白和丝氨酸蛋白酶为对象,由于鱼糜凝胶需加热制备,因此首先探讨丝氨酸蛋白酶的最适温度及pH,可避免长时间在此温度附近逗留以致破坏凝胶特性,并进一步研讨NaCl对丝氨酸蛋白酶活性的影响。在此基础上再探究NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶特性的影响,为后期控制鱼糜凝胶劣化,提高鱼糜凝胶特性提供一些理论依据。
1 材料与方法
1.1 材料与试剂
养殖大黄鱼,购于宁波路林市场;NaCl、乙醇、叔丁醇、Na2HPO4、NaH2PO4、HCl,国药集团化学试剂有限公司;Tris,Solarbio有限公司;Boc-Phe-Ser-Arg-MCA,Peptide Institute;戊二醛、7-氨基-4-甲基香豆素,麦克林试剂有限公司;DEAE-Sephacel,上海基星生物科技有限公司;Phenyl-Sepharose,北京博尔西科技有限公司。
1.2 仪器与设备
TA-XT Plus 物性分析仪,美国FTC公司;Avanti J-26XP冷冻离心机,美国贝克曼库尔特有限公司;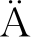 KTA pure LI 蛋白纯化层析仪,GE Healthcare Uppsala Sweden;色差计,上海源琦检测仪器有限公司;恒温水浴锅,上海一恒科学仪器有限公司;ALPHA2-4冷冻干燥仪,上海继谱电子科技有限公司;In Via-Reflex拉曼光谱仪,法国Renishaw公司;F-380内源荧光分光光度计,天津港东科技发展股份有限公司;S-4800场发射扫描电子显微镜,日本日立公司。
KTA pure LI 蛋白纯化层析仪,GE Healthcare Uppsala Sweden;色差计,上海源琦检测仪器有限公司;恒温水浴锅,上海一恒科学仪器有限公司;ALPHA2-4冷冻干燥仪,上海继谱电子科技有限公司;In Via-Reflex拉曼光谱仪,法国Renishaw公司;F-380内源荧光分光光度计,天津港东科技发展股份有限公司;S-4800场发射扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 原料预处理
养殖大黄鱼去头、去尾、去鳞、去内脏等,淋洗干净,沥干取肉,-20 ℃冰箱保存待用。
1.3.2 肌原纤维蛋白的提取
参照CHIN等[15]和JIANG等[16]的研究,稍作修改,取适量鱼糜,加入4倍体积冰提取液(20 mmol/L,pH 7.5磷酸盐缓冲液),高速匀浆机均浆60 s(7 500 r/min),将所得的匀浆液冷冻离心10 min(7 000 r/min,4 ℃),除去上清液。重复3次。得到粗肌原纤维蛋白再加入4倍体积冰洗液(0.1 mol/L NaCl),均浆60 s(7 500 r/min),离心10 min,取沉淀。重复1次上述实验,最后一次匀浆液用3层纱布过滤,以7 000 r/min冷冻离心10 min,取沉淀,-40 ℃冷冻保藏。
1.3.3 丝氨酸蛋白酶的分离纯化
(1)丝氨酸蛋白酶粗提取
参照鲍晓瑾[17]的方法,并略做修改。将冷冻鱼糜解冻完全后取适量于离心管中,加入4倍体积的pH 7.5,25 mmol/L磷酸盐缓冲液,高速匀浆机8 000 r/min匀浆30 s,4 ℃、8 000×g离心10 min,去上清液,取沉淀,重复上述方法4次,最后得到无腥味、半透明状的沉淀。沉淀中加入pH 7.5,25 mmol/L的磷酸盐缓冲液(含0.5 mol/L KCl,1 mmol/L MgCl2,5 mmol/L Na3PO3),高速匀浆后静置30 min,纱布过滤,收集滤液,加入15倍体积的冷蒸馏水,4 ℃下静置过夜,离心后取沉淀,即为肌原纤维[7]。所得肌原纤维与2 mol/L的KCl混合,调整pH至4.0,静置2 h,离心取沉淀。将所得沉淀以1∶5加入2 mol/L的KCl,混合离心去上清液,即丝氨酸蛋白酶粗酶液。透析48 h,冷冻干燥,-40 ℃贮藏,待用[18]。
(2)DEAE-Sephacel离子交换层析
参照翁凌等[19]的方法,将粗酶溶于少量pH 7.5, 20 mmol/L的Tris-HCl溶液,10 000 r/min 4 ℃下离心10 min,取上清液。将上清液上样于平衡后的DEAE-Sephacel柱子(2.5 cm×11 cm),用含0~0.5 mol/L NaCl的20 mmol/L pH 7.5的Tris-HCl缓冲液梯度洗脱,收集各组分并测定A280值。对收集溶液进行酶活测定,选取活性部分。
(3)Sephacryl S-100凝胶层析
参照蔡秋凤等[20]的方法,将收集的活性部分样品上样于平衡后的Sephacryl S-100凝胶柱(1.5 cm×60 cm),用含1 mol/L (NH4)2SO4的20 mmol/L pH 7.5的Tris-HCl缓冲液梯度洗脱,测定各组分A280值及酶活,收集高活性部分的溶液。
1.3.4 丝氨酸蛋白酶的活性测定
丝氨酸蛋白酶酶活测定参照CAO等[21]、鲍晓瑾[17]的方法进行测定,并略作修改。以Boc-Phe-Ser-Arg-MCA为底物检测丝氨酸蛋白酶的酶活,取850 μL的50 mmol/L pH 7.5的Tris-HCl缓冲液于10 mL的离心管中,加入100 μL 100 mmol/L的荧光底物,再加入50 μL的丝氨酸蛋白酶液,55 ℃下反应10 min,立即加入终止液[V(甲醇)∶V(正丁醇)∶V(蒸馏水)=35∶30∶35],室温下静置15 min,内源荧光光度计测量其荧光强度,设置发射波长为380 nm,激发波长为470 nm。Tris-HCl缓冲液作为空白对照,丝氨酸蛋白酶酶活以1 min生产1 μmol Boc-cys(AMC)所需的丝氨酸蛋白酶来表示一个酶活单位。
标准曲线测定,配制标准品AMC为10 μmol/L,将标准品按0、1、2、3、4、5 μmol/L配制成标准曲线,用荧光分光光度计在激发波长380 nm,发射波长470 nm下测定荧光值,每个浓度测3次[22]。得到标准曲线为Y=2.016 1x+0.390 6。
1.3.5 丝氨酸蛋白酶最适温度测定
以Boc-Phe-Ser-Arg-MCA为底物,取100 μL底物,50 μL酶于离心管中,分别置于20~70 ℃水浴锅内,参照2.4方法测定酶活。
1.3.6 丝氨酸蛋白酶最适pH测定
以Boc-Phe-Ser-Arg-MCA为底物,取100 μL底物,50 μL酶于离心管中,以pH为5、6、7、8、9、10的Tris-HCl缓冲液作为反应介质,参照2.4方法测定酶活。
1.3.7 不同NaCl添加量对丝氨酸蛋白酶活性影响
以Boc-Phe-Ser-Arg-MCA为底物,取100 μL底物,50 μL酶于离心管中,分别添加0、10、20、30、40 g/L NaCl后,参照2.4方法测定酶活。
1.3.8 添加丝氨酸蛋白酶的肌原纤维蛋白凝胶制备
取5 g肌原纤维蛋白于离心管中,分别加入含0、10、20、30、40 g/L NaCl的磷酸盐缓冲液(pH 7.5,20 mmol/L),再加入上述提取的丝氨酸蛋白酶100 μL,均质5 min,置于水浴锅中大约以1 ℃/min的升温速度从20 ℃升到70 ℃,加热30 min后立即取出,置于4 ℃冰箱冷藏过夜,测定肌原纤维蛋白凝胶特性前先将样品至于室温下平衡1 h[6]。
1.3.9 质构测定
取养殖大黄鱼肌原纤维蛋白凝胶样品于质构仪载物台上,参照许艳顺等[23]的方法,将养殖大黄鱼鱼糜凝胶的肠衣剥去,切成2 cm左右的厚度,置于质构仪载物台上,采用P/25探头,应变力为0.1 N,测试速度为60 mm/min,形变量为50%,室温下完成测定。
1.3.10 持水性测定
肌原纤维蛋白凝胶的持水性测定参照颜伟华等[24]的方法并略做修改,取养殖大黄鱼肌原纤维蛋白凝胶于离心管内离心10 min(4 ℃、8 000 r/min),离心前样品质量为W1,离心后样品质量为W2,凝胶持水性计算如公式(1)所示:
持水性![]()
(1)
1.3.11 白度测定
将养殖大黄鱼鱼糜凝胶样品切成5 mm左右的薄片,在室温下用色差计测定凝胶白度,白度计算公式参照PARRARAVIVAT等[25]的方法,如公式(2)所示:
(2)
式中:L*,亮度;+a*,偏红,-a*,偏绿;+b*,偏黄,-b*,偏蓝。
1.3.12 拉曼光谱测定
养殖大黄鱼肌原纤维蛋白凝胶样品采用拉曼光谱分析,参考张自业[26]的方法。将制备好的肌原纤维蛋白凝胶样品置于载玻片上,选择50倍长聚焦镜头对肌原纤维蛋白样品进行聚焦。检测参数为所用功率为100 mW,532 nm氩离子激光器,分辨率为1 cm-1,获取的拉曼光谱范围在400~4 000 cm-1。
1.3.13 内源荧光测定
将肌原纤维蛋白凝胶溶于pH 7.5,20 mmol/L的磷酸盐缓冲液中,配制成0.2 mg/mL的肌原纤维蛋白凝胶溶液,选择激发波长为280 nm,发射波长为300~450 nm,狭缝宽度为5 nm[27]。
1.3.14 微观结构观察
参照许艳顺[28]的方法,并略做修改。将养殖大黄鱼鱼糜凝胶切成整齐的块状置于塑料培养皿中,加入一定量的戊二醛,于4 ℃下固定24 h,用0.1 mol/L磷酸盐缓冲液漂洗3~5次,再用不同含量的乙醇及无水乙醇叔丁醇混合溶液(3∶1、1∶1、1∶3)、乙醇、叔丁醇漂洗,最后冷冻干燥,喷金,扫描观察。
1.4 数据处理
所有试验均平行3次,数据采用Excel软件作图,SPSS Statistics软件进行单样本T检验(n=3)、显著性分析及组间相关性分析,不同小写字母表示具有显著性差异。
2 结果与分析
2.1 丝氨酸蛋白酶的分离纯化
研究发现,鱼肉中存在的内源性丝氨酸蛋白酶会使肌原纤维蛋白凝胶重链发生降解[7]。养殖大黄鱼肉经过提取、透析、冻干得到的粗酶,再经过DEAE-Sephace分离纯化结果如图1-a所示,从图中可以看出,有许多无活性的杂蛋白。在NaCl浓度为0.2~0.25 mol/L,有活性的丝氨酸蛋白酶被洗脱下来,收集活性部分进行下一步纯化。取活性部分收集液上样于Sephacryl S-100凝胶层析柱,这一步主要是根据样品分子质量大小而达到分离目的。样品经过Sephacryl S-100凝胶柱分离纯化结果如图1-b所示,Sephacryl S-100凝胶柱有效的除去了大部分杂蛋白,使目标蛋白的纯度增加。选择高吸光值的酶活性峰,收集活性组分。
2.2 丝氨酸蛋白酶的最适温度
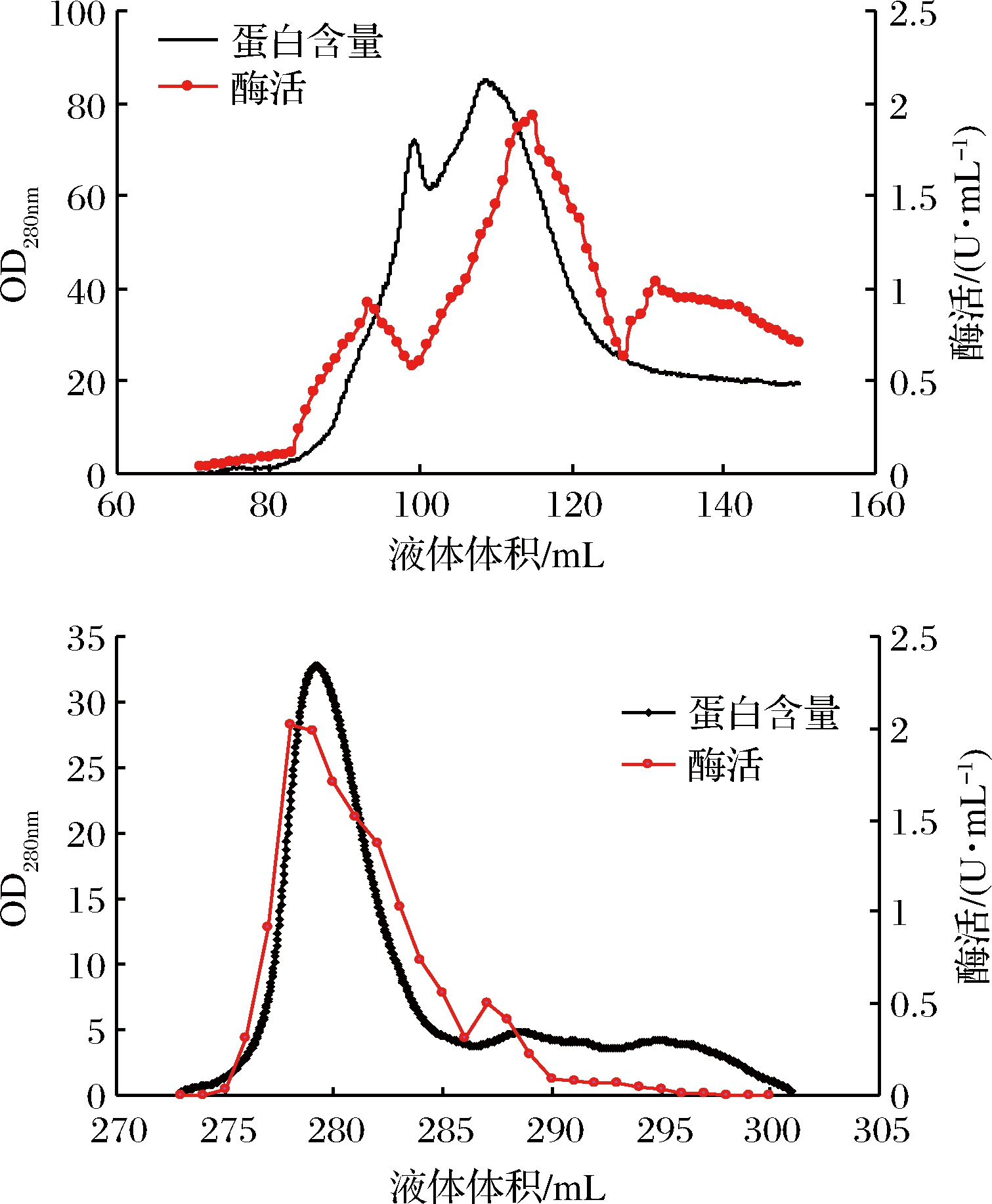
由图2可知丝氨酸蛋白酶的最适温度在20~70 ℃,丝氨酸蛋白酶的相对活力随温度的上升呈先显著增大后显著减小的趋势(P<0.05)。当温度达到50 ℃时,酶活最大。这与鱼糜凝胶在50~55 ℃发生凝胶劣化的温度一致,当温度升到70 ℃时,丝氨酸蛋白酶的酶活显著降低,仅为最大活性的59.98%(P<0.05)。
2.3 丝氨酸蛋白酶的最适pH值
由图3可知,当pH增大时,丝氨酸蛋白酶的相对活力先随之增大,pH为7时相对酶活最大(P<0.05),继续增大pH,相对酶活减小。当pH为5时,丝氨酸蛋白酶的相对酶活为最大酶活的60.86%,当pH达到10时,丝氨酸蛋白酶的相对活性仅为最大酶活的51.51%。过高或过低的pH都不利于丝氨酸蛋白酶的活性,可能是由于酶的结构与构象发生变化,影响活性区域,使酶活降低[29]。
a-DEAE-Sephace;b-Sephacryl S-100;
图1 养殖大黄鱼丝氨酸蛋白酶分离纯化结果
Fig.1 Separation and purification of serine protease from cultured Pseudosciaena crocea
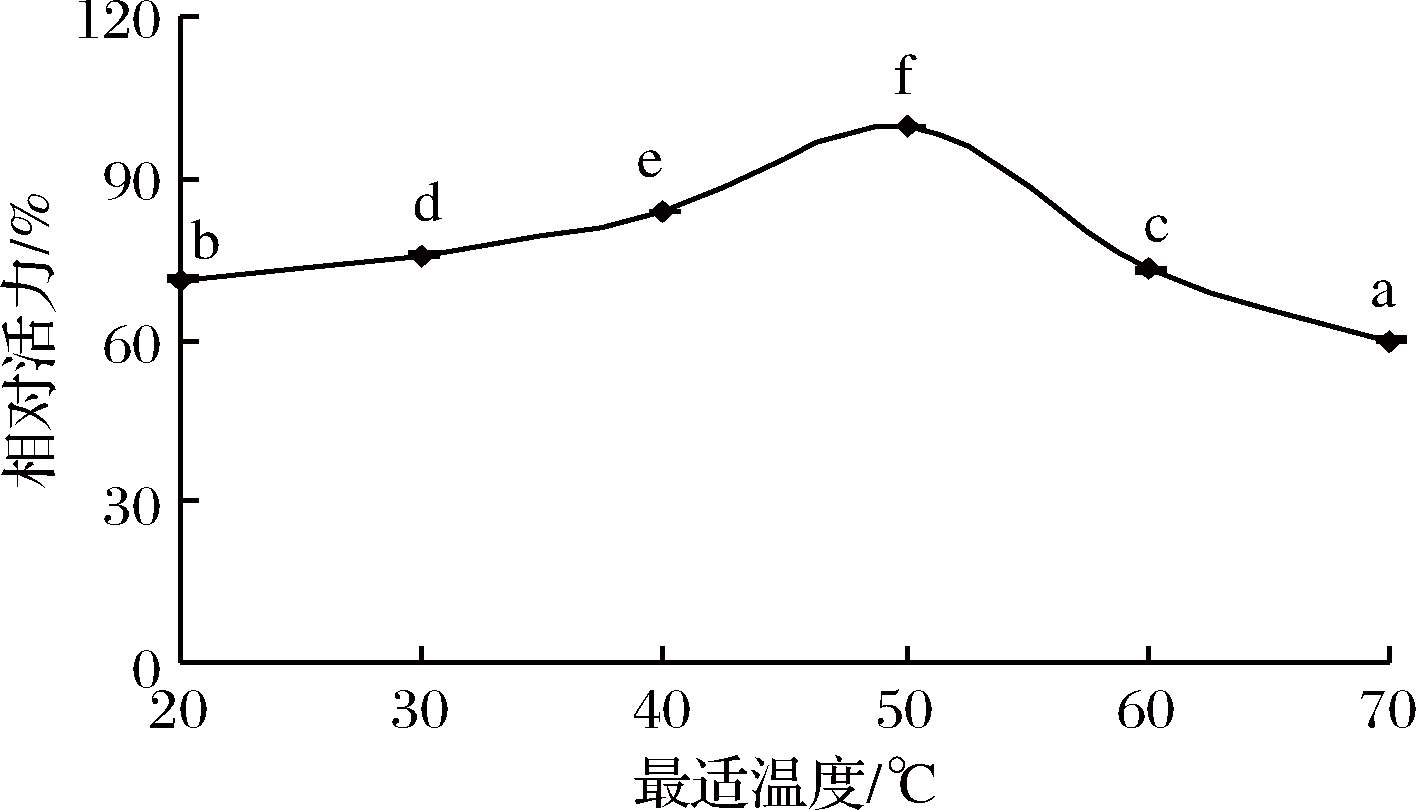
图2 丝氨酸蛋白酶的最适温度
Fig.2 Optimum temperature of serine protease
注:不同小写字母表示具有显著性差异(下同)
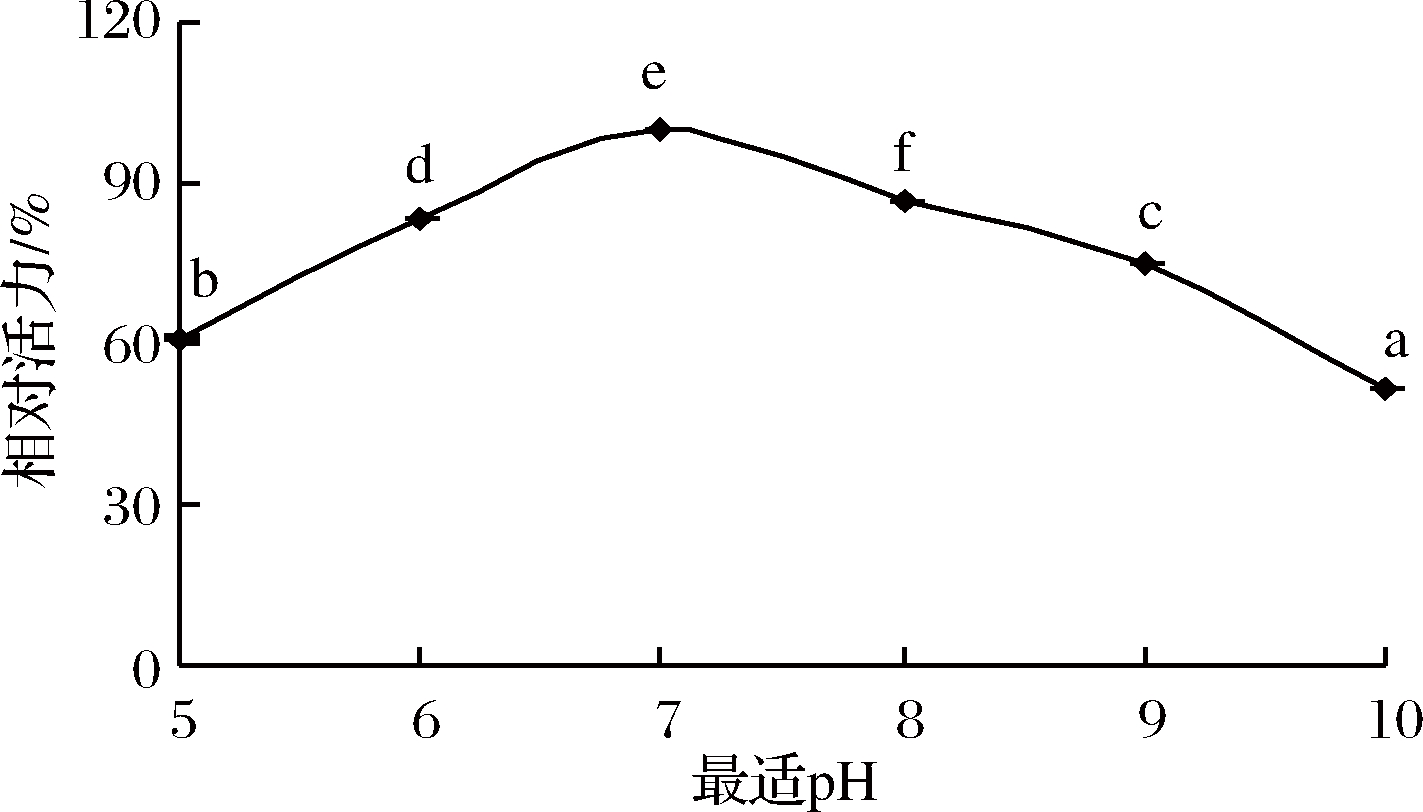
图3 丝氨酸蛋白酶的最适pH值
Fig.3 Optimum pH of serine protease
2.4 不同NaCl添加量对丝氨酸蛋白酶活性的影响
不同NaCl添加量对丝氨酸蛋白酶的活性影响如图4所示,由图4可知,随着NaCl添加量(质量浓度)的增大,丝氨酸蛋白酶的相对活性显著下降(P<0.05),空白组的丝氨酸蛋白酶活性最大,随着NaCl质量浓度的增多,丝氨酸蛋白酶的相对活性逐渐降低,40 g/L NaCl组的活性相对最小,为72.03%(P<0.05)。

图4 不同NaCl添加量(质量浓度)对丝氨酸蛋白酶活性的影响
Fig.4 Effect of different NaCl addition on serine protease activity
2.5 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶质构特性的影响
为了研究NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶质构特性的影响,利用质构仪对肌原纤维蛋白凝胶的质构特性进行分析,由表1可知,NaCl组的养殖大黄鱼肌原纤维蛋白凝胶的质构特性优于空白组,随着NaCl添加量的增多,凝胶硬度先显著上升后显著下降(P<0.05),20 g/L NaCl添加量组凝胶硬度最大,之后随着NaCl添加量的增多,硬度又略有下降(P<0.05)。研究发现,盐浓度可以改变环境中的离子强度,蛋白的电荷分布及蛋白在溶液中的状态,使蛋白之间的相互作用发生变化,影响到蛋白的凝胶特性[30]。并且NaCl降低丝氨酸蛋白酶的活性,减弱其对肌原纤维蛋白的降解,从而使肌原纤维蛋白凝胶的硬度增大。在NaCl添加量为0~20 g/L时,蛋白凝胶的黏附性不断增大(P<0.05),继续增大NaCl的质量浓度,凝胶黏附性又显著减小(P<0.05),当NaCl质量浓度为40 g/L时,凝胶的黏附性最大,为0.065 mJ。随着NaCl质量浓度的增多,养殖大黄鱼肌原纤维蛋白凝胶的内聚性先显著增大(P<0.05),当NaCl质量浓度达到30 g/L时,凝胶的内聚性最大(P<0.05),继续增大NaCl的质量浓度,凝胶的内聚性又略有减小(P<0.05)。在NaCl质量浓度为0~20 g/L,凝胶弹性不断显著增大(P<0.05),当NaCl质量浓度为30、40 g/L时,肌原纤维蛋白凝胶的弹性增大不明显(P>0.05)。在NaCl质量浓度为0~20 g/L,肌原纤维蛋白凝胶的胶黏性、咀嚼性不断上升(P<0.05),20 g/L NaCl质量浓度组凝胶胶黏性、咀嚼性最大,继续增多NaCl的添加量,蛋白凝胶的胶黏性、咀嚼性又略有下降(P>0.05)。
表1 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶质构特性的影响
Table 1 Effects of NaCl on the texture properties of myofibrillar protein gel after adding serine protease
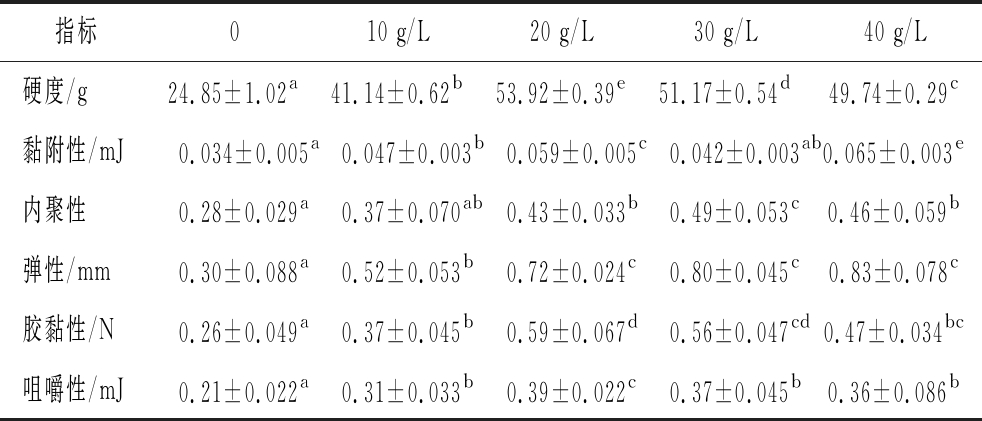
注:不同小写字母表示具有显著性差异(下同)
指标010 g/L20 g/L30 g/L40 g/L硬度/g24.85±1.02a41.14±0.62b53.92±0.39e51.17±0.54d49.74±0.29c黏附性/mJ0.034±0.005a0.047±0.003b0.059±0.005c0.042±0.003ab0.065±0.003e内聚性0.28±0.029a0.37±0.070ab0.43±0.033b0.49±0.053c0.46±0.059b弹性/mm0.30±0.088a0.52±0.053b0.72±0.024c0.80±0.045c0.83±0.078c胶黏性/N0.26±0.049a0.37±0.045b0.59±0.067d0.56±0.047cd0.47±0.034bc咀嚼性/mJ0.21±0.022a0.31±0.033b0.39±0.022c0.37±0.045b0.36±0.086b
2.6 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶持水性的影响
图5是NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶持水性的影响。由图5可知,随着NaCl添加量的增多,凝胶持水性显著增大(P<0.05)。与空白组相比,NaCl组凝胶持水性显著增大(P<0.05),在NaCl质量浓度为40 g/L时,肌原纤维蛋白凝胶的持水性最好。研究表明,适量的NaCl会提高溶液环境里的离子强度,使凝胶形成更加均匀的网络状结构,凝胶孔径小,更容易保留住凝胶中的水分[31]。韩敏义[32]在研究肌原纤维蛋白结构与热诱导凝胶功能特性的关系中发现,随着NaCl质量浓度的增加,凝胶持水性不断增加。丝氨酸蛋白酶会对肌球蛋白重链造成降解,而NaCl抑制了酶活性,减轻其对肌原纤维蛋白凝胶的破坏,故添加了NaCl后,肌原纤维蛋白凝胶的持水性大于空白组。
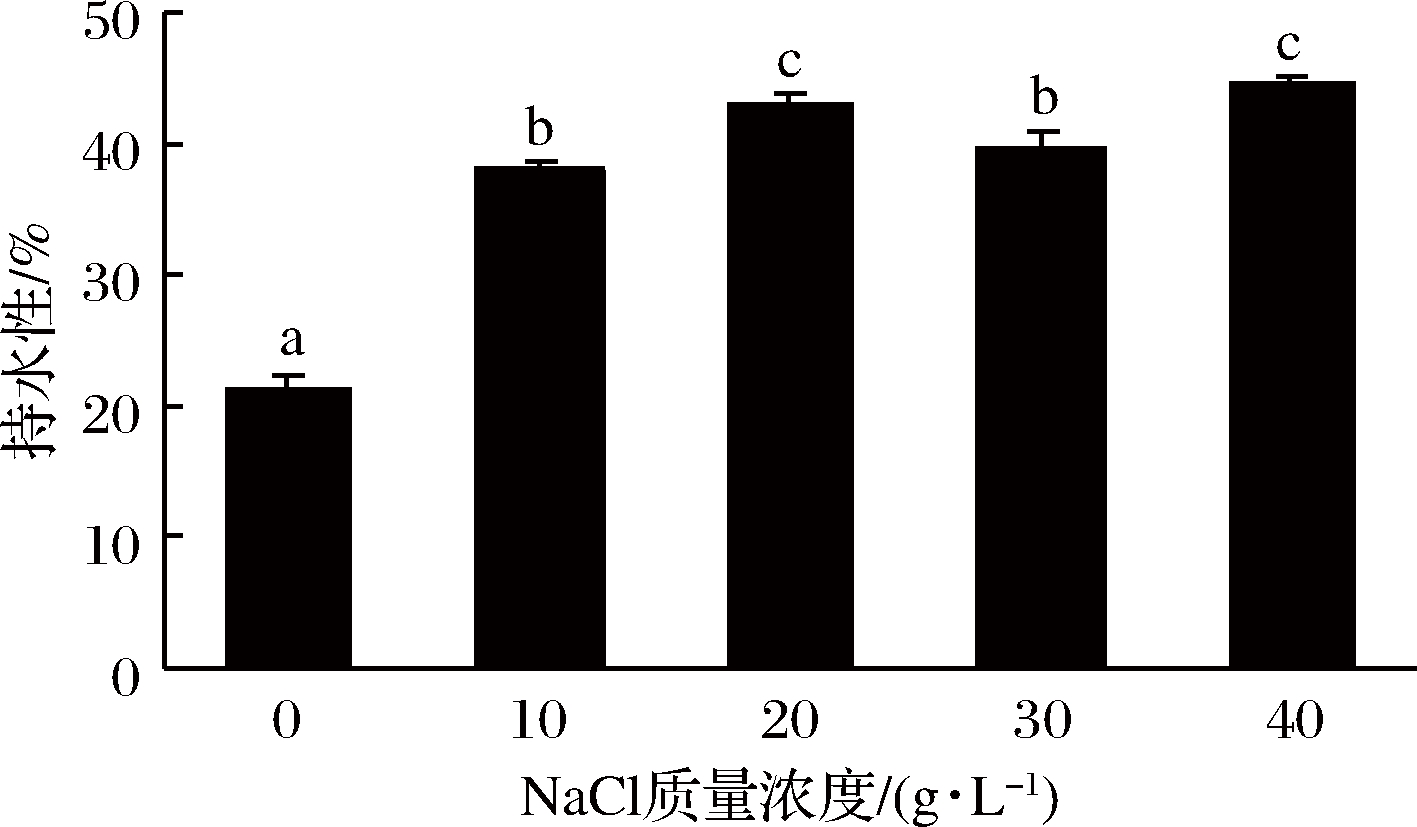
图5 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶持水性的影响
Fig.5 Effect of NaCl on water retention of myofibrillar gel after adding serine protease
2.7 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶白度的影响
由表2可知,NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶白度的影响。空白组中凝胶白度值最小,随着NaCl添加量的增多,凝胶白度不断上升,20 g/L NaCl添加量的凝胶白度最大,为54.35。而30 g/L NaCl添加量的白度值下降,40 g/L NaCl添加量组的凝胶白度略小于20 g/L NaCl添加量组,为53.19。研究发现,白度变化与蛋白质发生结构改变、变性,展开或聚集等情况有关[33]。若鱼糜凝胶的空间网络结构变得更加紧密,其表面可以反射出更多的光,以此提高养殖大黄鱼鱼糜的白度[34-35]。由此可见,NaCl的添加可能导致肌原纤维蛋白结构转变、凝胶空间结构更加致密,从而导致白度上升。
表2 NaCl质量浓度对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶白度的影响
Table 2 Effect of NaCl on the whiteness of myofibrillar gel after adding serine protease

指标010 g/L20 g/L30 g/L40 g/La*-0.04±0.18c0.16±0.037b-0.77±0.053a-0.84±0.034a-0.85±0.084ab*5.76±0.27c6.64±0.56d4.76±0.45ab4.93±0.057b4.27±0.054aL*49.51±0.25a49.18±0.76a54.61±0.16c52.48±0.76b53.39±0.56bcW49.33±0.012a48.75±0.76a54.35±0.13c52.21±0.75b53.19±0.56b
2.8 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶二级结构的影响
对添加了丝氨酸蛋白酶的肌原纤维蛋白凝胶进行拉曼测定,结果如图6所示。
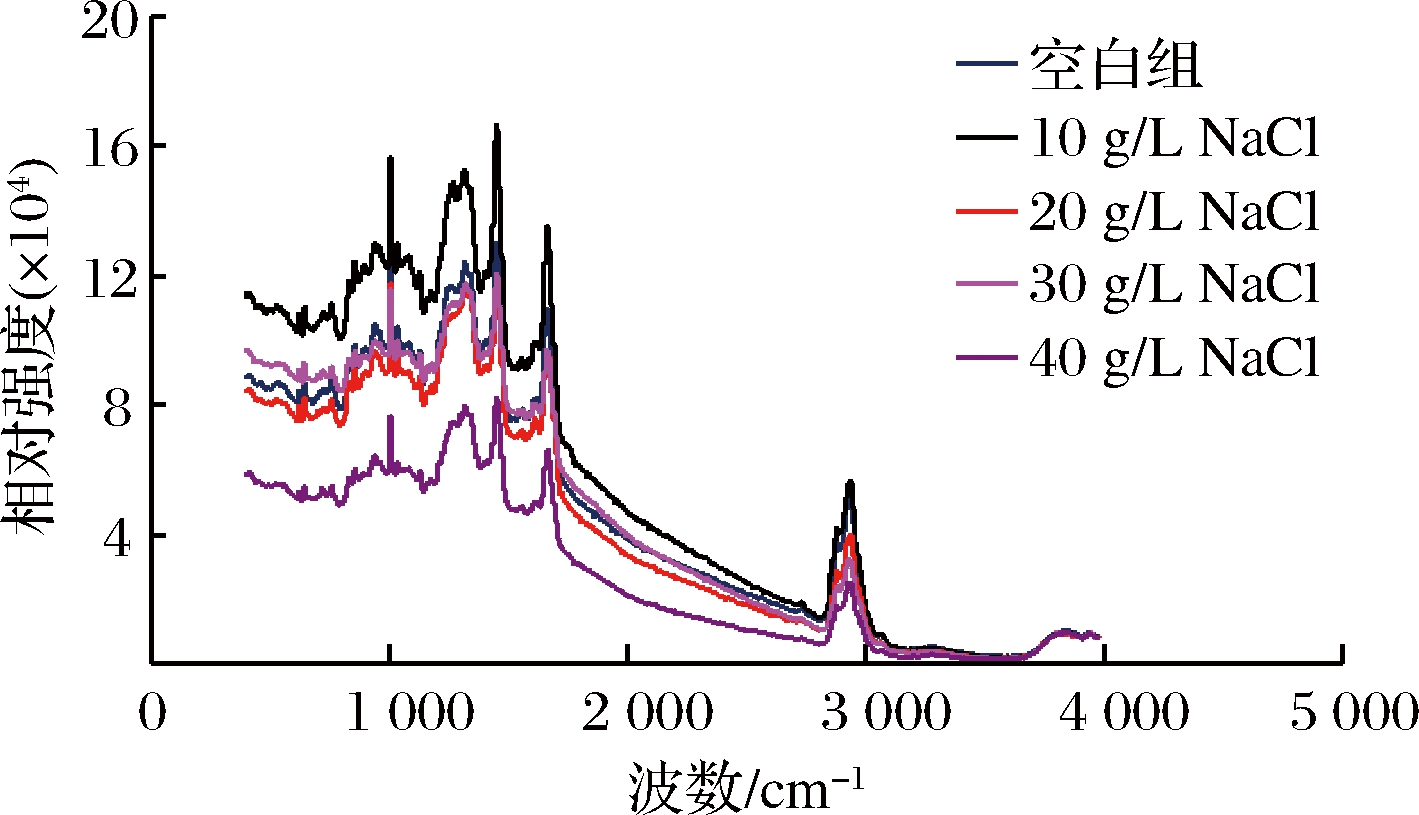
图6 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶拉曼光谱的影响
Fig.6 Effect of NaCl on the raman spectrum of myofibrillar gel after serine protease
由图6可知,NaCl使肌原纤维蛋白凝胶的二级结构发生改变。酰胺I谱带主要来自于C![]() O振动,可以用来表征蛋白质二级结构。在蛋白凝胶中,α-螺旋结构占主要部分,通过添加不同质量浓度的NaCl后,图中属于α-螺旋的特征峰向高波数处移动,表示含有丝氨酸蛋白酶的肌原纤维蛋白凝胶中α-螺旋结构减少,β-折叠以及无规则卷曲结构增多。但是随着NaCl质量浓度的增大,肌原纤维蛋白凝胶体系的蛋白结构变化程度减小,可能是由于NaCl使丝氨酸蛋白酶的活性降低,导致酶对肌原纤维蛋白凝胶的破坏减小,减少凝胶二级结构变化。杨方[36]在研究发酵鱼糜中内源酶对肌原纤维蛋白凝胶结构的影响中发现,白鲢鱼中内源酶会促进肌原纤维蛋白的α-螺旋解旋,而无规则卷曲结构相对增多。
O振动,可以用来表征蛋白质二级结构。在蛋白凝胶中,α-螺旋结构占主要部分,通过添加不同质量浓度的NaCl后,图中属于α-螺旋的特征峰向高波数处移动,表示含有丝氨酸蛋白酶的肌原纤维蛋白凝胶中α-螺旋结构减少,β-折叠以及无规则卷曲结构增多。但是随着NaCl质量浓度的增大,肌原纤维蛋白凝胶体系的蛋白结构变化程度减小,可能是由于NaCl使丝氨酸蛋白酶的活性降低,导致酶对肌原纤维蛋白凝胶的破坏减小,减少凝胶二级结构变化。杨方[36]在研究发酵鱼糜中内源酶对肌原纤维蛋白凝胶结构的影响中发现,白鲢鱼中内源酶会促进肌原纤维蛋白的α-螺旋解旋,而无规则卷曲结构相对增多。
2.9 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶构象的影响
NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶内源荧光强度的影响如图7所示。由图7可知,空白组中肌原纤维蛋白凝胶的荧光强度最大,10 g/L NaCl组的凝胶荧光强度与空白组之间几乎无差别,30、40 g/L组与空白组相差较小。20 g/L NaCl组的荧光强度最低,说明在添加20 g/L NaCl后,可能使肌原纤维蛋白凝胶体系的蛋白结构有所改变,蛋白展开,使内部的色氨酸残基暴露于表面,从而导致荧光强度下降。贾娜等[37]研究表明,猪肉糜中肌原纤维蛋白凝胶的荧光强度与NaCl质量浓度的增加未曾体现规律性变化。但当NaCl与迷迭香提取物协同作用,肌原纤维蛋白内源荧光强度明显下降。
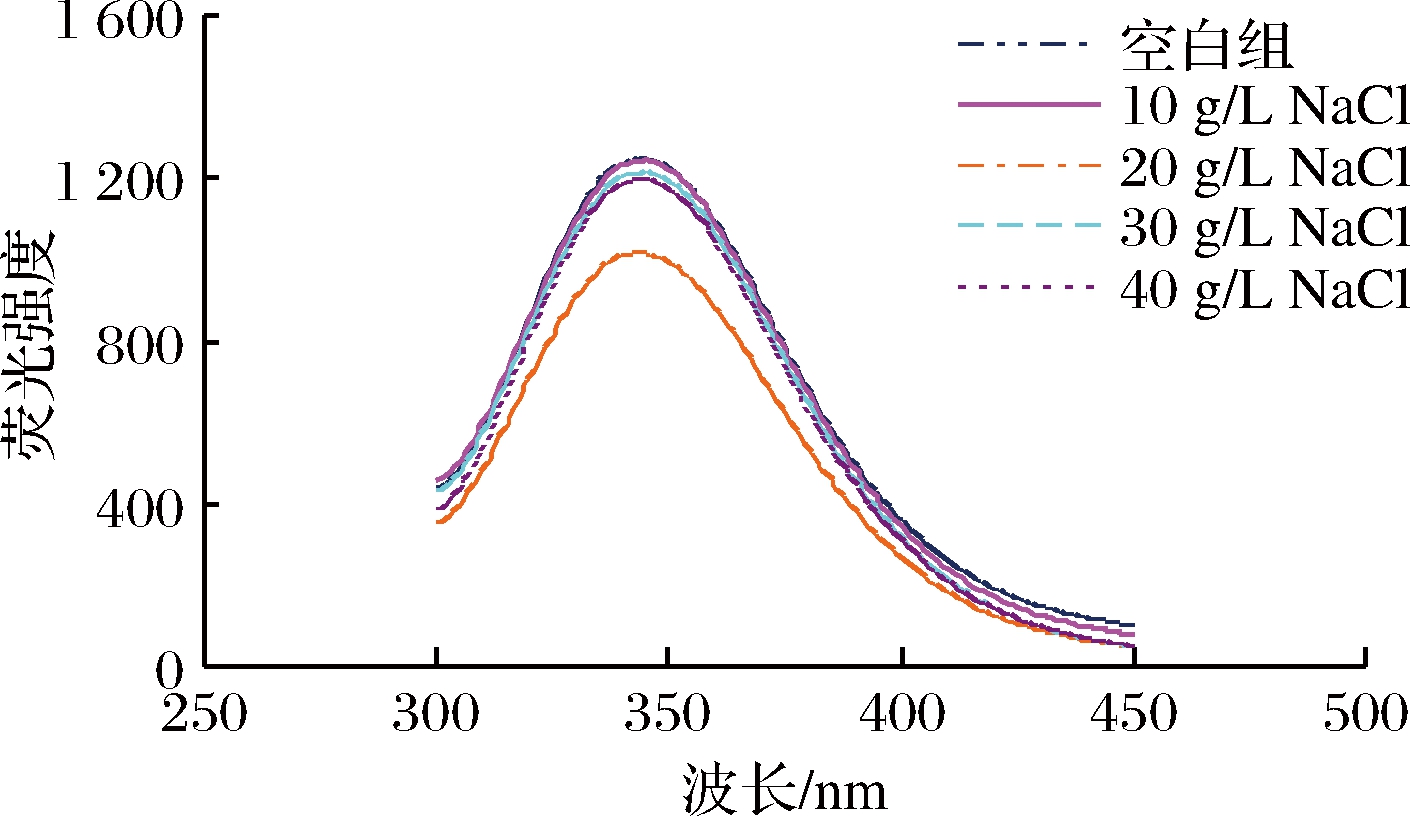
图7 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶内源荧光的影响
Fig.7 Effect of NaCl on endogenous fluorescence of myofibrillar gel after serine protease
2.10 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶微观结构的影响
图8是NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶微观结构的影响,由图8可知,空白组中肌原纤维蛋白凝胶的网络结构杂乱无序,凝胶断裂严重。添加了10 g/L NaCl后,凝胶的结构聚集程度稍微增强,空隙较小。且随着NaCl添加比例的增大,蛋白凝胶结构越来越紧密稳定,孔径越来越小,且致密有序、平整,凝聚度较高,致密有序的结构有助于持水能力的增强。研究表明,原肌纤维蛋白溶解度随着离子强度的升高而增大,肌原纤维蛋白变性展开更充分,这有利于形成更为致密的三维网状结构,可以吸附包裹更多的水分[26]。贾丹[38]研究发现,CaCl2的添加对鱼糜凝胶网状结构也有一定的改良效果。未添加 CaCl2的青鱼和鲢鱼糜凝胶的网络结构孔隙较大,添加40 mmol/kg CaCl2的鱼糜凝胶的孔隙较小,结构均较致密。
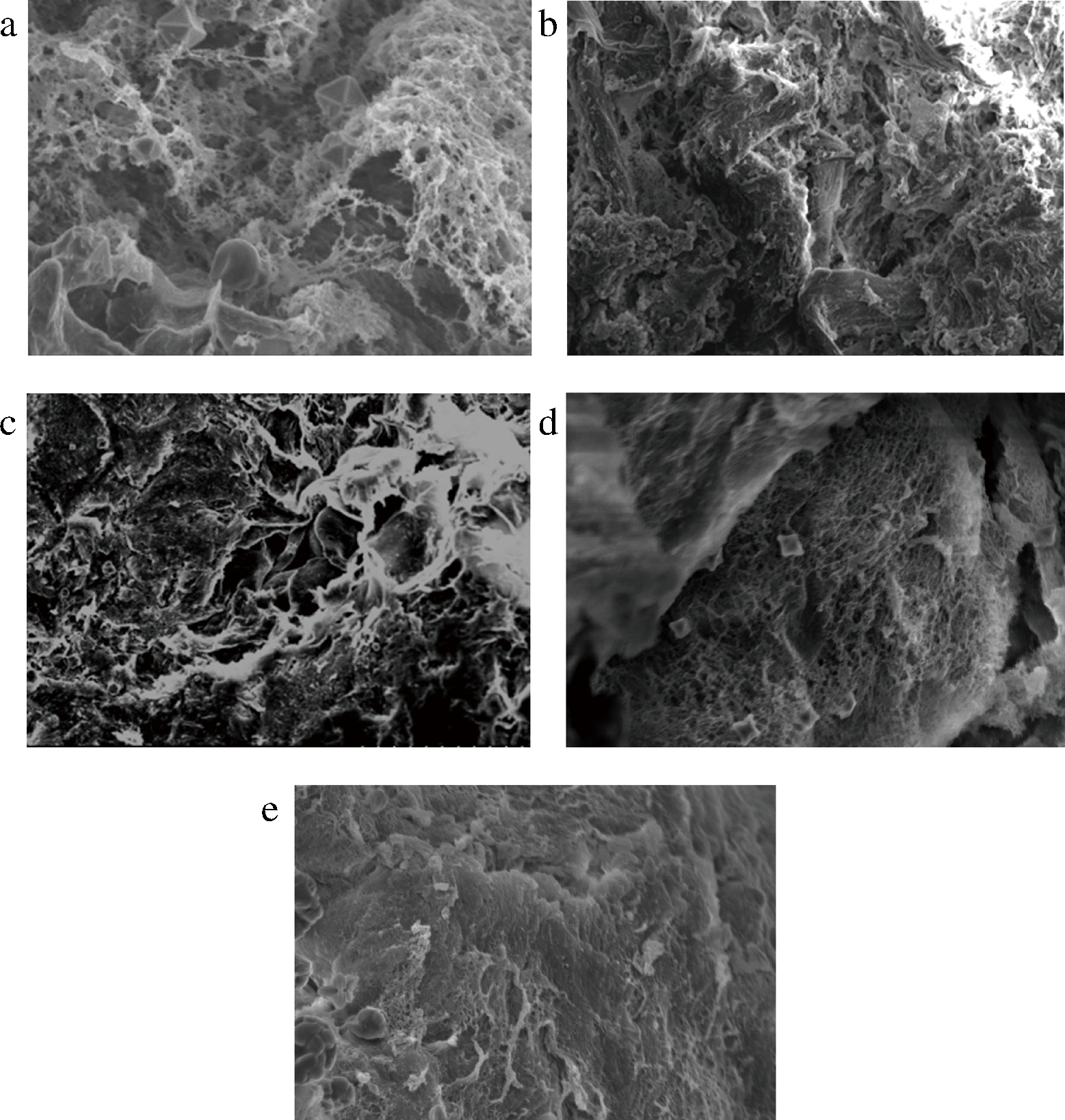
a-空白组;b-10 g/L NaCl组;c-20 g/L NaCl组;d-30 g/L NaCl组;e-40 g/L NaCl组
图8 NaCl对添加丝氨酸蛋白酶后肌原纤维蛋白凝胶微观结构的影响
Fig.8 Effect of NaCl on the microstructure of myofibrillar protein gel after adding serine protease
2.11 添加与未添加丝氨酸蛋白酶的肌原纤维蛋白凝胶相关性分析
将肌原纤维蛋白凝胶及添加丝氨酸蛋白酶后的肌原纤维蛋白凝胶的质构特性、白度、持水性的参数进行相关性分析,得到的结果如表3所示。由表3可知,肌原纤维蛋白凝胶与添加丝氨酸蛋白酶后的肌原纤维蛋白凝胶具有一定的相关性,运用皮尔森相关性进行分析,发现肌原纤维蛋白凝胶的质构特性与添加丝氨酸蛋白酶后的肌原纤维蛋白凝胶的质构特性具有极强的相关性且二者之间的相关性系数分别为0.984、0.977、0.850、0.900、0.944、0.852;而在添加相同含量NaCl中,肌原纤维蛋白凝胶、添加丝氨酸蛋白酶后的肌原纤维蛋白凝胶持水性的相关性系数为0.723,具有中度相关性;此外二者之间的白度值相关性较低,为0.449。研究结果表明,丝氨酸蛋白酶会破坏肌原纤维蛋白凝胶特性,添加丝氨酸蛋白酶与未添加丝氨酸蛋白酶的肌原纤维蛋白凝胶经过不同含量NaCl处理后,未添加丝氨酸蛋白酶的肌原纤维蛋白凝胶性质较好,说明丝氨酸蛋白酶会造成肌原纤维蛋白凝胶劣化,而NaCl在一定程度上抑制了丝氨酸蛋白酶的活性,减轻肌原纤维蛋白凝胶劣化,因此,在不同NaCl添加量组中,NaCl不仅可以促进鱼糜发生凝胶化,还可以抑制鱼糜中内源性丝氨酸蛋白酶的活性。
表3 添加与未添加丝氨酸蛋白酶的肌原纤维蛋白凝胶的皮尔森相关性检验
Table 3 Pearson correlation test of myofibrillar protein gel added with serine protease without addition of serine proteinase
注:r>0.8,高度相关;0.5<r<0.8,中度相关;0.3<r<0.5,低度相关;r<0.3,不相关
指标硬度黏附性内聚性弹性胶黏性咀嚼性白度持水性r0.9840.9770.8500.9000.9440.8520.4490.723
3 结论
本实验研究了不同NaCl添加量(质量浓度)对丝氨酸蛋白酶及含有丝氨酸蛋白酶的肌原纤维蛋白凝胶特性的影响,研究发现:
(1)通过对丝氨酸蛋白酶的最适温度、pH值的研究,发现丝氨酸蛋白酶的最适温度为50 ℃,最适pH值为7。NaCl组的丝氨酸蛋白酶的活性相较与空白组的酶活性低,随着NaCl添加量的增多,丝氨酸蛋白酶的活性显著下降。
(2)随着NaCl添加量的增多,含有丝氨酸蛋白酶的肌原纤维蛋白凝胶的质构特性有所改善,20 g/L NaCl添加量组的硬度、胶黏性、咀嚼性最大,40 g/L添加量组的黏附性、弹性较好。添加NaCl后,肌原纤维蛋白凝胶持水性有显著性提高,NaCl添加量为40 g/L时,蛋白凝胶的持水性最大,为44.58%。添加NaCl后,肌原纤维蛋白凝胶的白度值总体上升,NaCl添加量为20 g/L时,凝胶白度最大。
(3)添加NaCl后,含有丝氨酸蛋白酶的肌原纤维蛋白凝胶二级结构发生变化,α-螺旋减少,β-折叠、无规则卷曲增多,通过内源荧光光谱分析发现,蛋白凝胶三级结构发生改变,蛋白空间结构展开。随着NaCl添加量的增多,肌原纤维蛋白凝胶的微观网络结构越来越紧密。
(4)通过皮尔森相关性分析,发现添加与未添加丝氨酸蛋白酶的肌原纤维蛋白凝胶经不同含量NaCl处理后的凝胶特性具有一定的相关性,研究发现,NaCl本身可以改善肌原纤维蛋白凝胶特性,在此基础上进一步研究发现NaCl降低了丝氨酸蛋白酶的活性,一定程度上阻止了酶对肌原纤维蛋白凝胶的破坏。
[1] 杜翠红,曹敏杰.鱼类肌原纤维结合型丝氨酸蛋白酶研究进展[J].食品科学, 2013, 34(9):336-339.
DU C H, CAO M J.Progress in research on myofibril-bound serine proteinase from fish[J].Food Science, 2013, 34 (9):336-339.
[2] 纪蓉.组织蛋白酶L对鱼糜凝胶劣化机理的研究[D].杭州:浙江大学, 2012.
JI R.Studies of cathepsin L on the mechanism of surimi gel degradation[D].Hangzhou:Zhejiang University, 2012.
[3] CAO M J, WU L L, HARA K, et al.Purification and characterization of a myofibril-bound serine proteinase from the skeletal muscle of silver carp[J].Food Biochem, 2005, 29(5):533-546.
[4] 曹敏杰,李燕,翁凌,等.鲢鱼肌原纤维结合型丝氨酸蛋白酶的研究[J].食品科学, 2005,26(1):91-94.
CAO M J, LI Y, WENG L, et al.Study on myofibril-bound serine proteinase in silver carp[J].Food Science, 2005, 26(1):91-94.
[5] CAO M J, OSATOMI K, HARA K, et al.Identification of a myofibril-bound serine proteinase (MBSP) in the skeletal muscle of lizard fish saurida wanieso which specifically cleaves the arginine site[J].Comparative Biochemistry and Physiology Part B, 2000, 125(2):255-264.
[6] 张宾,汪东风,邓尚贵.豆类胰蛋白酶抑制剂抗鲢鱼鱼糜凝胶劣化的研究[J].食品工业科技,2012,33(14):107-110.
ZHANG B, WANG D F, DENG S G.Inhibitory effect of soybean trypsin inhibitor on surimi modori of silver carp[J].Science and Technology of Food Industry, 2012, 33(14):107-110.
[7] OSATOMI K,SASAI H,CAO M J,et al.Purification and characterization of myofibril-bound serine proteinase from carp cyprinus carpio ordinary muscle[J].Comp Biochem Physio, 1997, 116(2):183-190.
[8] 曾名勇,黄海,李八方.鲫鱼(Carassiu sauratus)肌原纤维蛋白生化特性在冻藏过程中的变化[J].青岛海洋大学学报(自然科学版),2003, 33(2):192-198.
ZENG M Y, HUANG H, LI B F. Study on the denaturation of crucian (Carassius auratus) myofibrillar protein during frozen-storage[J].Journal of Ocean University of Qingdao, 2003,33(2): 192-198.
[9] 李庆云.氯化钾、海藻粉和柠檬酸钠部分替代氯化钠对鸡胸肉肌原纤维蛋白热诱导凝胶特性的影响[D].南京:南京农业大学, 2013.
LI Q Y.Effect of potassium chloride, seaweed powder and sodium citrate on gel characteristics of chicken myofibrillar protein by partical substitute of sodium chloride[D].Nanjing:Nanjing Agricultural University, 2013.
[10] SUN X D,HOLLEY R A.Factors influencing gel formation by myofibrillar proteins in muscle foods[J].Comprehensive Reviews in Food Science & Food Safety, 2011, 10(1):33-51.
[11] 徐幸莲,周光宏,黄鸿兵,等.蛋白质浓度、pH值、离子强度对兔骨骼肌肌球蛋白热凝胶特性的影响[J].江苏农业学报, 2004,20(3):159-163.
XU X L, ZHOU G H, HUANG H B, et al.Effects of protein concentration, pH value and ionic strength on heat-induced gel properties of myosin from rabbit skeletal muscle[J].Jiangsu Journal of Agricultural Sciences, 2004,20(3):159-163.
[12] CAO M J,HARA K,OSATOMI K,et al.Myofibril-bound serine proteinase (MBSP) and its degradation of myofibrillar proteins[J].Food Science, 1999, 64(4):644-647.
[13] 孙乐常.鲫鱼内源性肌原纤维结合型丝氨酸蛋白酶抑制剂的纯化与性质研究[D].厦门:集美大学, 2009.
SUN C L.Study of an endogenous inhibitor to myofibril-bound serine proteinase from crucian carp(Carassius auratus)[D].Xiamen:Jimei University, 2009.
[14] MANAT C J, PANPIPAT W, BENJAKUL S.Physicochemical properties and gel-forming ability of surimi from three species of mackerel caught in Southern Thailand[J].Food Chemistry, 2009, 121(1):85-92.
[15] CHIN K B,GO M Y,XIONG Y L.Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J].Meat Science, 2009, 81(3):565-572.
[16] JIANG X,ZHANG Z,CAI H,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry, 2006, 94(4):498-503.
[17] 鲍晓瑾. 引起鳙鱼鱼糜凝胶劣化的丝氨酸蛋白酶及其抑制研究[D].杭州:浙江工业大学, 2007.
BAO X J.Study on the myofibril-bound seriner protease of modori and its inhibition in big-head fish surimi production[D].Hangzhou:Zhejiang University of Technology, 2007.
[18] 刘茹,钱曼,雷跃磊,等.漂洗方式对鲢鱼鱼糜凝胶劣化性能的影响[J].食品科学, 2010, 31(21):89-93.
LIU R, QIAN M, LEI Y L, et al.Effect of rinsing mode on modori of silver carp surimi[J].Food Science, 2010, 31(21):89-93.
[19] 翁凌,李腾,阴利华,等.南美白对虾丝氨酸蛋白酶的分离纯化及性质研究[J].集美大学学报(自然科学版), 2010, 15(4):272-278.
WENG L, LI T, YIN L H, et al.Isolation, purification and characterization of serine proteinase in South American shrimp [J].Journal of Jimei University (Natural Science), 2010, 15(4):272-278.
[20] 蔡秋凤,林敏,钟婵,等.口虾蛄肌肉中丝氨酸蛋白酶的纯化及性质分析[J].中国食品学报,2013,13(11):185-190.
CAI Q F, LIN M, ZHONG C, et al.Purification and characterization of serine proteinase from mantis shrimp(Squilla Oratoria)[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(11):185-190.
[21] CAO M J,SHAO W,LI Y,et al.Identification of a myofibril-bound serine proteinase in the skeletal muscle of silver carp[J].Journal of Food Biochemistry, 2004, 28(5):373-386.
[22] 孟泽铃.海参体壁中丝氨酸蛋白酶的性质及其与自溶关系的研究[D].大连:大连工业大学, 2013.
MENG Z L.Characterization of serine proteases in the body wall of sea cucumber stichopus japonicas and their relationship with autolysis[D].Dalian:Dalian Polytechnic university, 2013.
[23] 许艳顺,葛黎红,姜启兴,等.盐添加量和热处理对内酯鱼糜凝胶品质的影响[J].食品工业科技, 2013, 34(11):69-72;76.
XU Y S, GE L H, JIANG Q X, et al.Effect of salt content and thermal treatment on gel properties of silver carp mince induced by D-gluconic acid-δ-lactone [J].Science and Technology of Food Industry, 2013, 34(11):69-72;76.
[24] 颜伟华,丁宁,陈丹,等.提取条件对鲨鱼肉盐溶蛋白热诱导凝胶特性的影响[J].食品科学,2010,31(14):14-17.
YAN W H, DING N, CHEN D, et al.Effects of extraction conditions and heating time on heat-induced gel properties of salt-soluble protein from shark muscle[J].Food Science, 2010, 31(14):14-17.
[25] PARRARAVIVAT J, MORIOKA K, SHIRSAKI M.Effect of washing conditions on the removal of lipid from the fatty fish escolar (Lepidocybium flavobrunneum) meat[J].Journal of Biological Sciences, 2008, 8(1):47-52.
[26] 张自业.盐和超高压处理对肌原纤维蛋白凝胶特性与作用力的影响及调控机理研究[D].南京:南京财经大学, 2016.
ZHANG Z Y.Study on effects of salt and high pressure treatment on properties and chemical forces of myofibrillar protein gel and the regulation mechanism[D].Nanjing:Nanjing University of Finance and Economics, 2016.
[27] 曹云刚,马文慧,艾娜丝,等.氧化强度对肌原纤维蛋白结构及凝胶性能的影响[J].食品科学, 2019, 40(20):21-27.
CAO Y G, MA W H, AI N S, et al.Effects of different oxidation intensities on the structure and gel properties of myofibrillar protein[J].Food Science, 2019,40(20):21-27.
[28] 许艳顺.发酵鲢鱼鱼糜凝胶形成及其机理研究[D].无锡:江南大学, 2010.
XU Y H.Study on gelation and gel-forming mechanism of silver carp mince induced by fermentation[D].Wuxi:Jiangnan University, 2010.
[29] 颜龙杰.海参内脏丝氨酸蛋白酶的研究[D].厦门:集美大学, 2014.
YAN L J.Study on serine proteinase from the viscera of sea cucumber(Stichopus japonicus)[D].Xiamen:Jimei University, 2014.
[30] 苏跃中,郑智莺,游岚,等.大黄鱼Pseudosciaena cracea(Richardson)人工繁殖及育苗技术的研究[J].现代渔业信息, 1997, 12(5):21-27.
SU Y Z, ZHENG Z Y, YOU L, et al.Study on Pseudosciaena cracea(Richardson) artificial breeding and seedling technology of the yellow crock[J].Modern Fishery Information, 1997, 12(5):21-27.
[31] 周茹,倪渠峰,林伟伟,等.肌原纤维蛋白溶解度对盐离子浓度的依赖性[J].中国食品学报,2015,15(3):32-39.
ZHOU R, NI Q F, LIN W W, et al.The dependency of the myofibrils solubility on the ion concentration[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(3):32-39.
[32] 韩敏义. 肌原纤维蛋白结构与热诱导凝胶功能特性关系研究[D].南京:南京农业大学,2009.
HAN M Y.Study on the relationship between the pork myofibrillar protein structure and it′s functionality of heat-induced gelation by low field NMR and Raman spectroscopy [D].Nanjing:Nanjing Agricultural University, 2009.
[33] BAJOVIC B, BOLUMAR T, HEINZ V.Quality considerations with high pressure processing of fresh and value added meat products[J].Meat Science, 2012, 92(3):280-289.
[34] 仪淑敏,马兴胜,励建荣,等.超高压对金线鱼鱼肉肠凝胶特性的影响[J].食品工业科技,2014,35(10):129-133.
YI S M, MA X S, LI J R, et al.Effect of ultra-high pressure on gel properties of fish (Nemipterus virgatus) sausage[J].Science and Technology of Food Industry, 2014,35(10):129-133.
[35] GROSSI A, SØLTOFT-JENSEN J, KNUDSEN J C, et al.Synergistic cooperation of high pressure and carrot dietary fibre on texture and colour of pork sausages[J].Meat Science, 2011, 89(2):195-201.
[36] 杨方.鱼肉内源酶对发酵鱼糜凝胶和抗氧化特性影响的研究[D].无锡:江南大学, 2016.
YANG F.Study on gelation and antioxidant properties of fermented fish surimi influenced by fish endogenous muscle enzymes[D].Wuxi:Jiangnan University, 2010.
[37] 贾娜,谢振峰,李儒仁,等.迷迭香提取物与NaCl协同改善肌原纤维蛋白凝胶特性[J].食品科学,2018,39(3):28-33.
JIA N, XIE Z F, LI R R, et al.Synergistic improvement of myofibrillar protein gel properties by combination of rosemary extract and NaCl[J].Food Science, 2018,39(3):28-33.
[38] 贾丹.青鱼肌肉蛋白质及其凝胶特性的研究[D].武汉:华中农业大学, 2016.
JIA D.Study on protein and gelation properties of surimi from black carp[D].Wuhan:Huazhong Agricultural University, 2016.