李果实是我国一种重要的经济性鲜食水果,营养丰富、风味独特。近年来重庆李果实产业发展迅速,但在李果实采摘运输过程中,不可避免的产生碰撞、切割等机械伤,从而为病原菌侵染提供了机会。其中,由美澳型核果褐腐病菌(Monilinia fructicola,M.fructicola)引起的褐腐病是造成其采后损失的主要真菌性病害[1]。长期以来,化学杀菌剂被广泛应用于果蔬采后病害防治,但污染环境、产生抗药性等弊端[2]日益显著;热激处理[3]、超声波清洗[4]、涂膜[5]等方式毒性较小,但单独使用对病害控制效果不佳,实际应用受限,因此寻找更加有效的防治方法已成为研究重点。
生物防治是一种高效广谱且环保的新兴技术,目前已有关于微生物挥发性有机物[6]、篮状菌[7]及单胞菌[8]的相关研究。生防酵母因其生存力强、能快速利用营养物质、可与其他保鲜方式结合使用、遗传学基础明确等多种优点[9],已在桃[10]、柑橘、葡萄[11]等多种水果的采后病害防治中表现出较好生防潜力。诱导抗性是酵母发挥生物防治效果的重要机制之一[12],膜醭毕赤酵母[13]、罗伦隐球酵母[14]等均有诱导宿主产生抗病性的作用。拮抗酵母常通过激活机体的苯丙烷代谢来增强宿主抗病性[15],提高果实自身防御能力以抵御病原菌的侵袭。研究表明,苯丙烷代谢途径对机械胁迫可产生积极的抗性防御作用,可通过苯丙氨酸解氨酶(phenylalanineammonialyase,PAL)、过氧化物酶(peroxidase,POD)、肉桂酸-4-羟基化酶(cinnamate-4-hydroxylase,C4H)、4-香豆酸辅酶A连接酶(4-coumaric acid coenzyme-A-ligase,4CL)等关键酶调控抗性物质的积累[16-17]。ZHANG等[18]将膜醭毕赤酵母接种于桃果实后,发现宿主的苯丙烷代谢酶被激活,从而诱发宿主的抗性防御作用;膜醭毕赤酵母、柠檬形克勒克酵母处理李果实后,其木质素、总酚、类黄酮等代谢产物含量上升,果实抗病性增强[19]。
Pichia galeiformis(P.galeiformis)分离于柠檬果实表面,能有效控制柑橘采后绿霉病[20],在果蔬采后病害防治显示出较大的应用潜力。王友升等[21]研究表明,P.galeiformis可控制多种水果采后病害,但不同拮抗酵母对特定病原菌的生防效果及抗菌机理不同,且目前尚未深入研究其抗病机制。因此,探讨李果实接种P.galeiformis后苯丙烷代谢的变化对于深入了解李果实抗病机理及褐腐病害控制具有重要意义。
综上所述,本研究旨在探究P.galeiformis对李果实采后褐腐病的生防效果,并初步揭示P.galeiformis诱导李果实抗病性的苯丙烷相关机制,以期为P.galeiformis在果蔬采后病害防治中的实际应用提供理论依据。
1 材料与方法
1.1 材料
实验用李果实为巫山“脆红李”,采后6 h内运至实验室,剔除病、伤、畸果,挑选大小、成熟度一致的果实作为实验材料,预冷后放入0 ℃冷库中贮藏待用。
1.2 主要试剂
琼脂粉、酵母浸膏、牛肉膏(均为生物级)、葡萄糖、H3PO4、次氯酸钠、浓HCl、MgCl2、抗坏血酸、H2O2、邻苯二酚、四硼酸钠、溴乙酰、NaOH、硼酸、硼砂、甘油(均为分析纯),成都科龙化工试剂厂;无水乙醇、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、MgSO4(均为分析纯),天津瑞金化学品有限公司;愈创木酚(化学纯),中国佘山化工厂;甲醇(色谱级),天津四友精细化学品有限公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)(均为生化试剂)、三磷酸腺苷(adenosine triphosphate,ATP)、辅酶A(coenzyme A,CoA-SH)(均为优级纯),北京拜尔迪生物技术有限公司;三羟甲基氨基甲烷(Tris)、®-巯基乙醇(均为生化试剂),Sigma;L-苯丙氨酸(生化试剂),上海康达氨基酸厂;对香豆酸(优级纯),上海阿达玛斯有限公司。
1.3 仪器与设备
BXM30R立式高压灭菌锅,上海博讯实业有限公司医疗设备厂;DHG-9140A电热恒温鼓风干燥箱、DHP-9082电热恒温培养箱,上海齐欣科学仪器有限公司;Avanti TM J-30I高速冷冻离心机,美国贝克曼库尔特有限公司;SW-CJ-1F超净工作台,苏净集团安泰有限公司;B203生物显微镜,重庆奥特光学仪器有限公司;XB-K-25血细胞计数板,上海求精生化试剂有限公司;WD-9405B水平摇床,北京市六一仪器厂;KQ52DE超声清洗器,昆山市超声仪器有限公司;UV-1000紫外分光光度计,日本岛津。
1.4 试验方法
1.4.1 M.fructicola孢子悬浮液的制备
将病原菌在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基中25 ℃培养7~8 d,用无菌水清洗孢子,4层纱布过滤,血球计数板计数,无菌条件下用无菌水配制成1×105 spores/mL孢子悬浮液。
1.4.2 P.galeiformis菌悬液的配制
活化:将冻存干酵母以无菌水冲洗、稀释,接种于NYDA培养基,28 ℃培养48 h,重复传代2次;液体培养:接种于NYDB培养基,200 r/min,28 ℃摇床培养24 h;离心分离:5 000 r/min,4 ℃离心10 min,无菌水洗涤2次;重悬浮及浓度确定:无菌水再悬浮,血球计数板计数,用前无菌水分别稀释至1×108 cells/mL、5×108 cells/mL。
1.4.3 P.galeiformis对M.fructicola菌落直径的影响
将0.2 mL处理液(1)无菌水、(2)酵母菌悬液(1×108 cells/mL)分别涂布于PDA平板,放置10 min后在平板中间打孔接入培养5 d的M.fructicola菌饼(直径5 mm;取自菌落边缘),于25 ℃恒温培养箱中培养,从平板背面采用十字交叉法测量病原菌的菌落直径。
1.4.4 P.galeiformis处理对李果实采后褐腐病的控制效果
同孔损伤接种:果实随机分组,用1%(体积分数)次氯酸钠溶液浸泡1 min,清水冲净,在20 ℃,相对湿度(relative humidity,RH)为80%~90%环境下自然风干。用1 mL无菌枪头在果实赤道部位等距打2个孔(深3 mm,直径3 mm),每个伤口接种20 μL,1×108 cells/mL酵母细胞悬液。以等量无菌水处理为对照。4 h后每个孔中接种10 μL,1×105 spores/mL M.fructicola孢子悬浮液。待处理液吸收后,单果包装,20 ℃贮藏,每天统计果实发病率和病斑直径。每组10个果实,重复3组。
异孔损伤接种:分组清洗处理同上。用1 mL无菌枪头在果实赤道部位等距打2个孔(深3 mm,直径3 mm),每个伤口接种20 μL,1×108 cells/mL酵母细胞悬液。以等量无菌水处理为对照。24 h后,在果实原来孔径右边1 cm左右打1个新孔(直径3 mm,深3 mm),并在该孔中接种10 μL,1×105 spores/mL M.fructicola孢子悬液。待处理液吸收后,单果包装,20 ℃贮藏,每天统计果实发病率和病斑直径。每组10个果实,重复3组。
浸泡处理:分组清洗处理同上。分别在无菌水和酵母细胞悬液(5×108 cells/mL)中浸泡3 min,自然晾干,用1 mL无菌枪头在果实赤道部位等距离刺孔2个(深3 mm,直径3 mm),接种10 μL,1×105 spores/mL病原菌孢子悬浮液。待菌液吸收后单果包装,20 ℃贮藏,PE膜覆盖保湿。每天统计发病率和病斑直径,如公式(1)、公式(2)所示。每组10个果实,重复3组。
发病率![]()
(1)
病斑直径![]()
(2)
1.4.5 P.galeiformis处理对李果实苯丙烷代谢途径相关酶活性及代谢产物积累的测定
1.4.5.1 样品处理及取样方法
选择果色均匀,大小、成熟度一致果实,用1%(体积分数)次氯酸钠溶液浸泡1 min,清水冲洗,自然晾干后用1 mL无菌枪头在果实赤道部位等距离刺2个孔(深3 mm,直径3 mm)。每个伤口加入20 μL以下溶液:(1)对照组-无菌水;(2)酵母菌悬液(5×108 cells/mL)。待菌液吸收后,贮藏于20 ℃、RH为85%~90%,PE膜覆盖保湿。
取样方法:常温条件在贮藏第0(以接种后1 h为起始点)、1、2、3、4、5天取样,取样部位为果实打孔伤口外1 cm直径的健康果实组织,去除伤口及发病部位。每组10个果实,每种处理重复3组。该样品用于相关酶活及物质含量的测定。
1.4.5.2 PAL和POD活性的测定
PAL活性测定参照ASSIS等[22]的方法并适当修改。取2 g样品,加入5 mL 100 mmol/L硼酸-硼砂盐缓冲液(pH 8.8,含5 mmol/L ®-巯基乙醇,2 mmol/L EDTA,40 g/L PVP),冰浴研磨,4 ℃,12 000 r/min离心20 min,上清液低温保存备用。反应液为0.5 mL酶提取液;3 mL 50 mmol/L硼酸-硼砂缓冲液(pH 8.8);0.5 mL 20 mmol/L L-苯丙氨酸溶液。对照以等量H2O代替酶液。反应体系置于37 ℃保温60 min后,立即加入0.1 mL 6 mol/L HCl溶液终止反应,蒸馏水为参比,分别测定290 nm处吸光度值,以1 h吸光值变化0.01为1个酶活力单位(U)。重复3次。
POD活性测定参照曹建康等[23]的方法并适当修改。取2 g样品,加入5 mL 4 ℃预冷的0.1 mol/L pH 6.8磷酸缓冲液(含40 g/L PVP),冰浴研磨后于4 ℃、12 000 r/min离心20 min。反应体系为2.7 mL 0.1 mmol/L磷酸缓冲液(pH 6.8),0.1 mL 4%(体积分数)愈创木酚,0.1 mL 0.5%(体积分数) H2O2和0.1 mL上清液,测定470 nm处室温下反应3 min吸光值变化,蒸馏水为参比。以1 min吸光值变化1为一个酶活力单位(U)。重复3次。
1.4.5.3 C4H和4CL活性的测定
C4H活性测定参照范存斐等[24]的方法并适当修改。取1 g样品,加入5 mL 200 mmol/L磷酸盐缓冲液(pH 7.5,含2 mmol/L ®-巯基乙醇),冰浴研磨,12 000 r/min、4 ℃离心20 min,收集上清液备用。反应液为2 mL 50 mmol/L磷酸盐缓冲液,1 mL 2 mmol/L反式肉桂酸,100 μL 0.5 mmol/L氧化型辅酶Ⅱ二钠(triphosphopyridine nucleotide disodium salt,NADP-Na2),100 μL 0.5 mmol/L D-葡萄糖-6-磷酸二钠盐(D-glucose 6-phosphate disodium salt hydrate,G-6-P-Na2),50 μL酶提取液;200 μL 6 mol/L HCl终止反应,于340 nm处测定吸光值,以不加酶液为参比。OD值每l h变化0.01为1个酶活性单位(U)。
4CL活性测定参照LI等[25]的方法并适当修改。称取2 g样品,加5 mL 100 mmol/L Tris-HCl(pH 8.0)提取液(含15 mmol/L ®-巯基乙醇、体积分数30%甘油),冰浴研磨,超声破碎2 min(25 ℃、100 W),4层纱布过滤,4 ℃、12 000 r/min离心20 min,上清液为粗酶提取液。反应体系为0.5 mL酶提取液,0.15 mL 5 μmol/L对香豆酸;0.15 mL 5 μmol/L ATP;0.15 mL 1 μmol/L CoA;0.45 mL 15 μmol/L MgSO4。对照以H2O取代酶液。25 ℃反应10 min,333 nm测定吸光值,以OD值每1 min变化0.001为1个酶活性单位(U),重复3次。
1.4.5.4 总酚、类黄酮、木质素含量的测定
总酚、类黄酮的测定参考DENG等[26]的方法并稍作修改。取1 g样品,加入20 mL预冷的1%(体积分数) HC1-甲醇溶液充分研磨提取,取1 mL滤液加5 mL 1% HCl-甲醇提取液,摇匀后立即用于比色。分别以1 g鲜重在280、325 nm处吸光度值表示总酚、类黄酮含量,表示为OD280/g FW、OD325/g FW,重复3次。
木质素含量测定参照LI等[27]的方法并修改。取1 g 样品,加5 mL 95%(体积分数)乙醇研磨,12 000 r/min,4 ℃离心10 min,沉淀物以3 mL 95%乙醇冲洗3次,3 mL V(乙醇)∶V(正己烷)=1∶2 溶液离心冲洗3次,收集沉淀物,65 ℃干燥12 h。干燥物溶于3 mL 25%(体积分数)溴乙酰冰醋酸溶液,70 ℃恒温水浴中加塞保温30 min(每隔一段时间开塞散热),加0.9 mL 2 mol/L NaOH终止反应,冰醋酸定容至10 mL,9 000 r/min离心10 min,取上清液0.5 mL加9.5 mL蒸馏水,以蒸馏水为参比,280 nm处测定吸光值。以1 g鲜重在280 nm处的吸光值表示木质素含量(OD280/g FW),重复3次。
1.5 数据处理
采用Microsoft Excel 2016进行数据统计整理,SPSS 25对数据进行单因素方差分析,利用Duncan′s多重比较对差异显著性进行分析,P<0.05表示差异显著,用Origin 9.1软件制图。
2 结果与分析
2.1 离体条件下P.galeiformis对M.fructicola菌落直径的影响
经前期实验,确定P.galeiformis的最佳抑菌浓度为1×108 cells/mL。如图1所示,经P.galeiformis(1×108 cells/mL)涂布的PDA平板上,M.fructicola的菌落直径增长幅度较小、扩散生长慢。接种7 d时,P.galeiformis处理组菌落直径为对照组的22.84%。MARTA等[28]、ZHAO等[29]研究发现,在最佳抑菌浓度下,酵母处理可显著抑制褐腐病病原菌生长,显示出增强抗病性的潜力。

A-对照(无菌水);B-P.galeiformis处理组(1×108 cells/mL)
图1 离体条件下P.galeiformis对M.fructicola菌落直径的影响(7 d)
Fig.1 Effect of P.galeiformis on colony diameter of M.fructicola in in vitro assay(7 d)
2.2 P.galeiformis处理对李果实褐腐病的生物防治效果
接种后李果实的发病率和病斑直径情况如图2所示。如图2-A所示,同孔损伤接种时,P.galeiformis处理组果实发病率和病斑直径显著低于对照组(P<0.05)。在贮藏第3天,对照组李果实有明显病变,发病率为28.01%,P.galeiformis处理组发病率为1.67%。7 d时,对照组发病率超过80%且病斑直径为12.66 mm,而P.galeiformis处理组发病率为对照组的23.38%,病斑直径为2.96 mm。如图2-B所示,异孔损伤接种时,3~5 d内P.galeiformis处理可明显抑制李果实病斑直径的扩大,5 d时对照组果实病斑直径扩大至6.22 mm,达P.galeiformis处理组的1.55倍。5~7 d中,P.galeiformis处理组与对照组发病率、病斑直径差异显著(P<0.05)。贮藏第7天,对照组发病率达100%,而P.galeiformis处理组发病率为78.76%。同异孔损伤接种结果表明,P.galeiformis可能具有分泌抗菌物质的作用,但并不是其主要的抗菌机制,这与王智荣等[8]研究结果类似。如图2-C所示,P.galeiformis处理对M.fructicola有较好的拮抗效果,贮藏4 d时,对照组李果实发病率达P.galeiformis处理组的1.80倍,差异显著(P<0.05)。整个贮藏期内,P.galeiformis处理组果实的病斑直径显著低于对照组,在接种第6、7天对照组李果实病斑直径分别为酵母处理组的1.20、1.28倍。SHAO等[30]、LIU等[31]在用Candida intermedia和Pichia kudriavzevii控制桃果实采后病害时发现,酵母对病原菌的强拮抗作用是防止水果发生病变的重要原因。综合同孔、异孔损伤接种及浸泡处理实验结果,P.galeiformis处理能延缓李果实褐腐病的发病进程、降低果实腐烂程度,且该作用可能与诱导李果实产生抗病性有关。
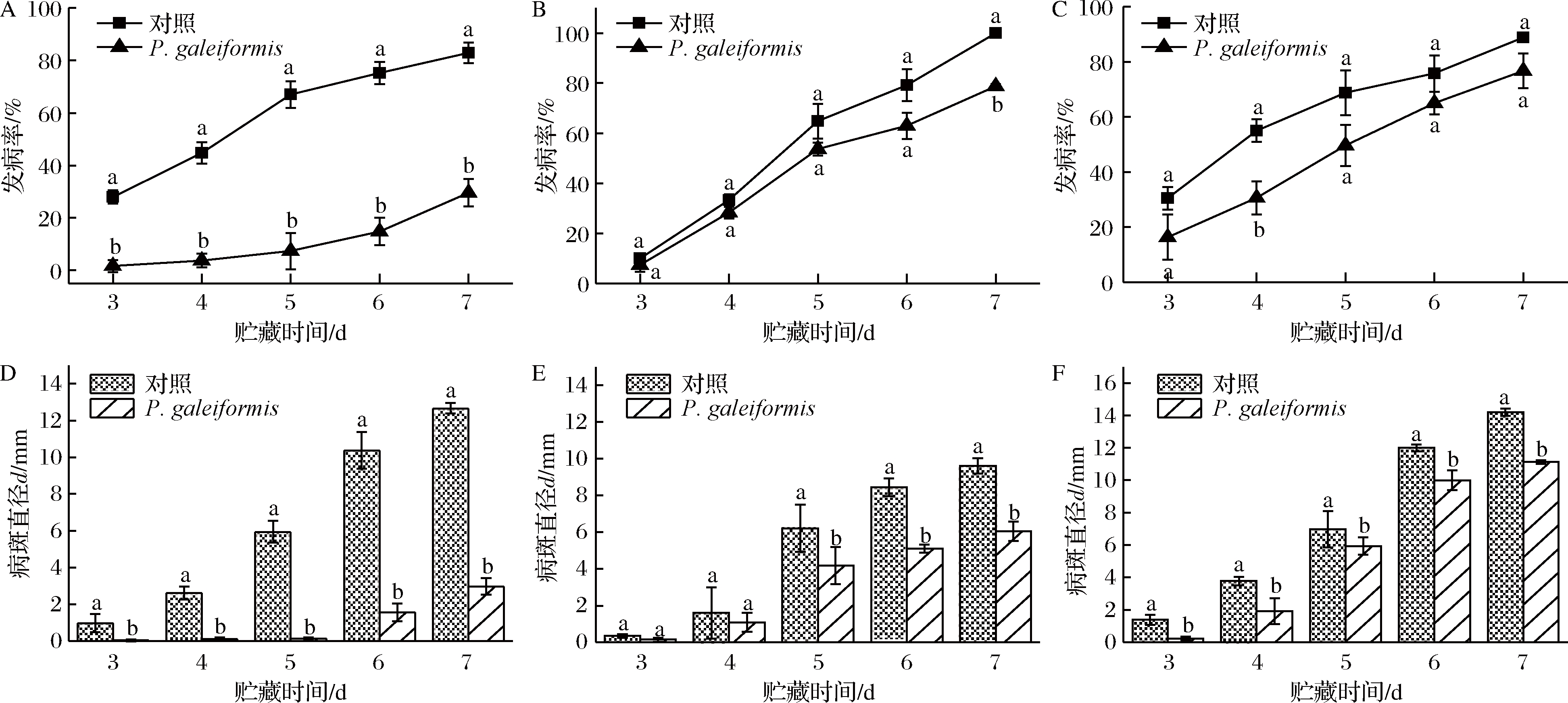
A-同孔损伤处理发病率;B-异孔损伤处理发病率;C-浸泡处理发病率;D-同孔损伤处理病斑直径;E-异孔损伤处理病斑直径;F-浸泡处理病斑直径
图2 P.galeiformis处理对李果实接种发病率和病斑直径影响
Fig.2 Effect of P.galeiformis treatment on disease incidence and lesion diameter of plum
2.3 P.galeiformis处理对李果实抗病性的影响
2.3.1 P.galeiformis处理对李果实PAL和POD活性的影响
PAL是苯丙烷代谢途径中首个作用酶,对增强果实抗性有加速作用;POD参与了果实木质素等结构物质的代谢和积累,是贮藏中典型的防御相关酶。由图3可知,P.galeiformis处理显著提高了李果实PAL、POD活性,可为后续酶活性的增强和抗性物质的积累做准备,从而增强果实抗性。
如图3-A所示,果实PAL酶活性上升,P.galeiformis处理组与对照组变化趋于一致。48 h后,经P.galeiformis处理李果实PAL酶活显著高于对照,贮藏72 h时,P.galeiformis处理组PAL的活性与对照组差异最为显著,达对照组1.29倍(P<0.05)。这与MAHUNU[32]用Pichia caribbica防治苹果青霉病时发现的抗性反应类似,酵母处理有效刺激了PAL酶活性的显著上升,增强了果实抗性反应能力。张婕[19]将P.membranaefaciens接种于李果实发现,酵母处理可通过强化PAL酶活性调控产生香豆酸、阿魏酸等中间代谢产物从而继续催化苯丙烷代谢作用。
如图3-B所示,果实POD酶活性在贮藏期内呈稳定增长趋势。与对照组相比,P.galeiformis处理组果实POD活性升幅明显上调,贮藏第48、72、96、120 h时,P.galeiformis处理组POD酶活性分别为对照组的1.37、1.31、1.15、1.16倍,差异显著(P<0.05)。ZHANG[33]研究表明,接种Pichia guilliermondii能够诱导PAL、POD在果实中的基因表达,从而激活果实苯丙烷代谢。POD作为具有多种功能的氧化还原酶,可直接调控果实防御机制及激素合成;同时,POD酶产物醌类等多酚氧化产物的增加,可有效增强果实在贮藏期间对病原菌的抵抗能力。吴锋[34]在探究Pichia membranaefaciens Y4对桃褐腐病的抗病机制时,发现酵母可通过活化POD酶促进细胞壁木质化,从而提高果实抗病性。
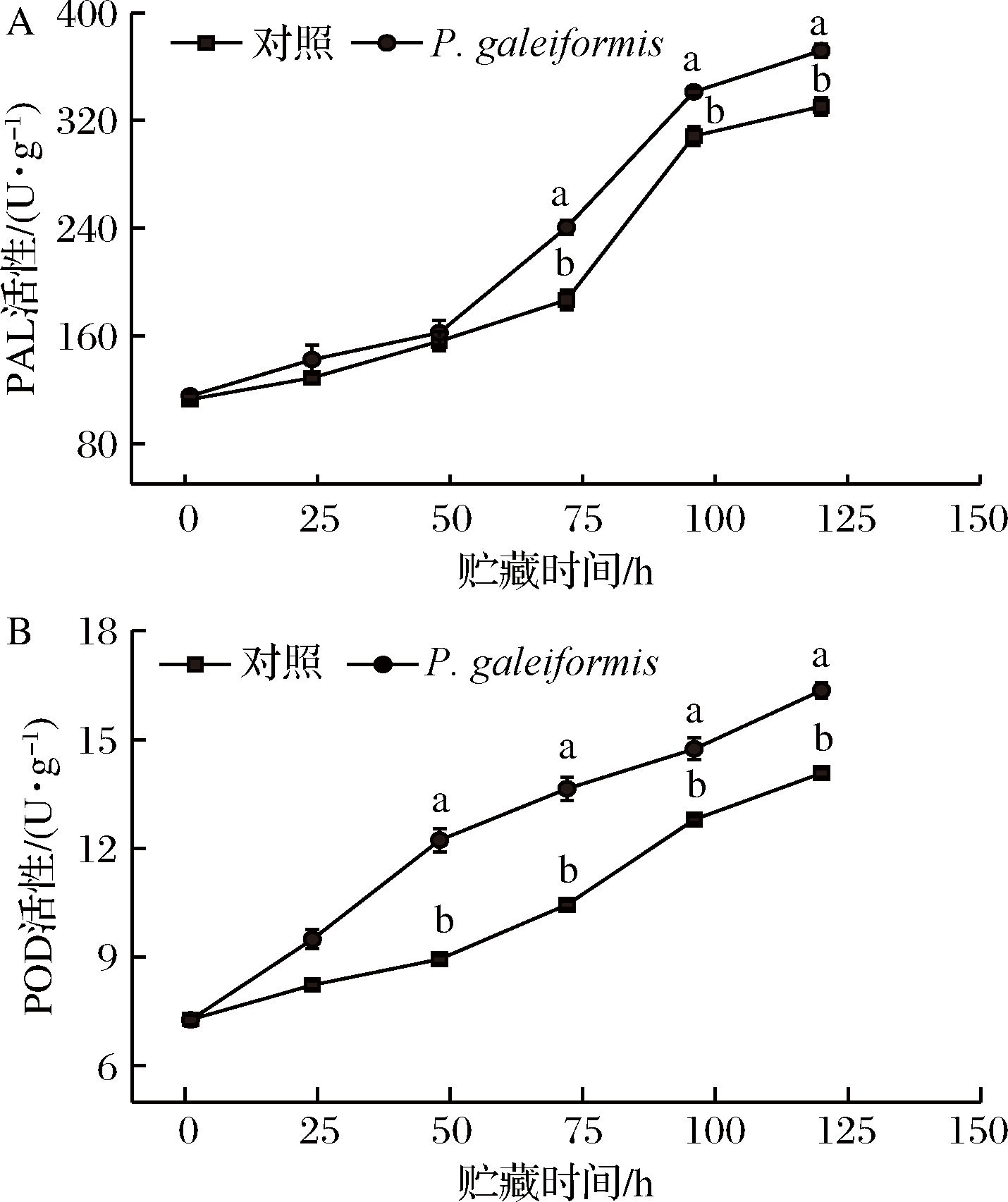
A-PAL活性;B-POD活性
图3 P.galeiformis处理对李果实PAL和POD活性的影响
Fig.3 Effect of P.galeiformis treatment on PAL and POD activities in plum fruits
2.3.2 P.galeiformis处理对李果实C4H和4CL活性的影响
C4H、4CL与植物体内抗性物质的合成积累密切相关,XU等[35]研究表明C4H、4CL是植物苯丙烷代谢的关键分支点酶。如图4-A所示,C4H酶活性呈先升后降趋势,于72 h达峰值。72 h时,P.galeiformis处理组果实C4H酶活性较对照组高35.71%(P<0.05)。与对照相比,P.galeiformis处理显著增强了李果实贮藏期间C4H酶活性,末期虽有所下降,但仍维持在较高的活性水平。这可能是由于C4H作为植物中典型的P450单加氧化酶[36],参与着植物进化的多种分支代谢。ZHANG等[37]研究中也发现类似作用,C4H可参与植物组织向香豆酸的多个分支代谢,激活4CL酶活性,抑制苹果的灰霉病感染。
如图4-B所示,P.galeiformis处理能有效诱导果实4CL活性上升,在观测的48 h及以后促进作用尤为显著(P<0.05),在48、72、96、120 h时,P.galeiformis处理组果实4CL酶活性分别为对照组的1.38、1.20、1.30、1.33倍。4CL在植物中常以基因家族形式存在,是苯丙烷代谢途径总支向不同的次生代谢产物合成的转折点[39],Pt4CL1对木质素的合成反应有较强催化效率,Pt4CL2可为酚类化合物的合成提供底物酶,从而为贮藏后期抗性物质的积累做准备。同时,4CL酶与PAL酶活性存在着一定的伴随效应,PAL酶代谢产物肉桂酸,可经由4CL酶作用直接向分支代谢[40],从而加速抗性物质的合成。相似研究结果在和赵亚婷等[40]的研究中也有报道,但与本实验酶活性高峰出现的时间不同,这可能是由于酶在不同水果中的表达情况不同。综上,P.galeiformis处理可通过活化C4H、4CL来调控果实抗性代谢从而增强其抗侵染能力,这与张培岭等[41]对甜瓜抗病性的研究结果类似。
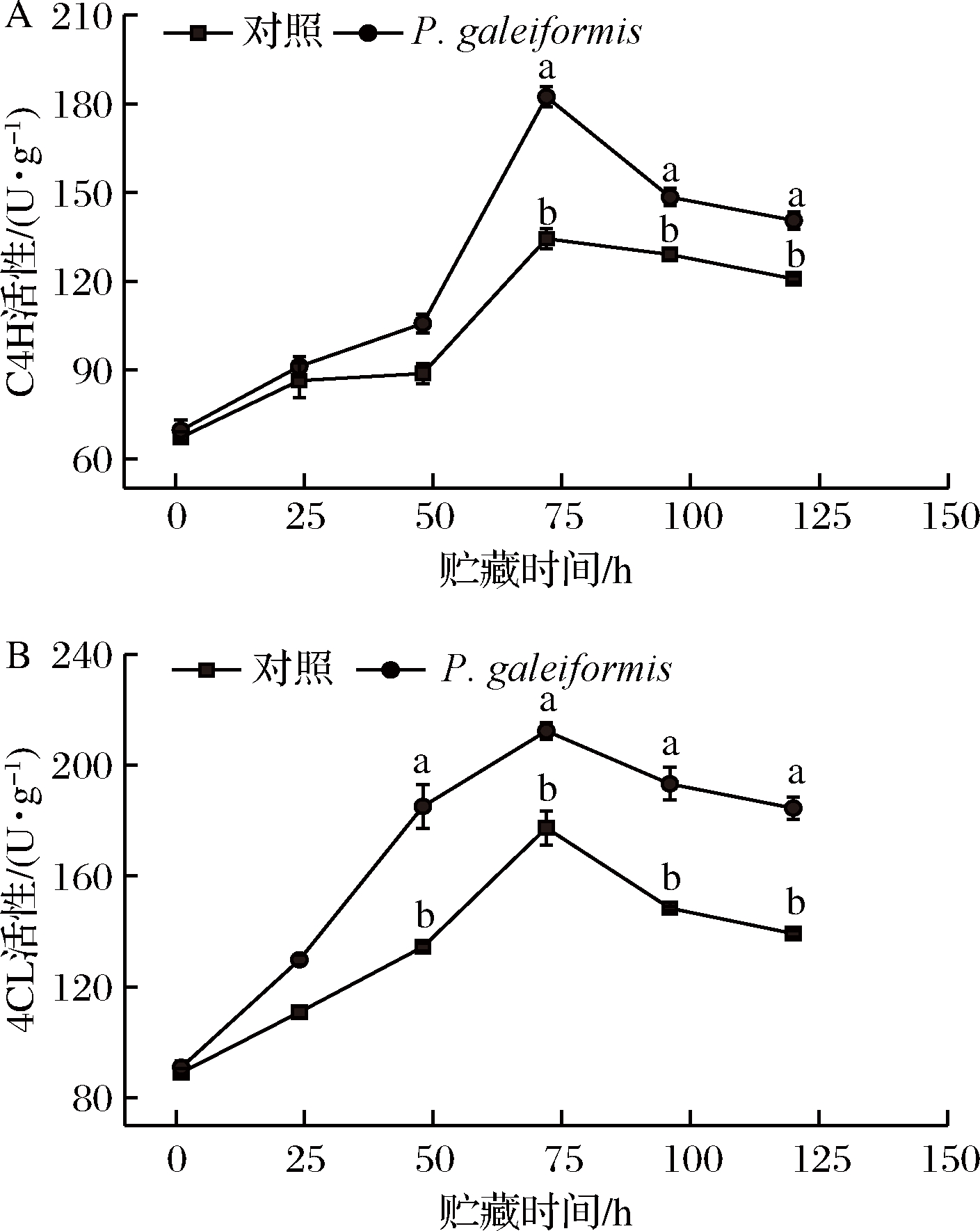
A-C4H活性;B-4CL活性
图4 P.galeiformis处理对李果实C4H和4CL活性的影响
Fig.4 Effect of P.galeiformis treatment on C4H and 4CL activities in plum fruits
2.3.3 P.galeiformis处理对李果实总酚、类黄酮和木质素含量的影响
酚类化合物具有抗真菌活性并能提高植物抗性,类黄酮在植物发育和植物防御中均起着结构和信号分子的重要作用[36]。WANG等[42]研究表明,硝普钠可提高PAL酶活性并刺激总酚类、黄酮类积累,从而激活甜瓜的防御机制提高果实抗病性。如图5-A所示,整个贮藏期内酵母处理组总酚含量始终高于对照组,在贮藏120 h时,P.galeiformis处理组总酚含量比对照组高19.91%(P<0.05)。如图5-B所示,P.galeiformis处理组与对照组的类黄酮含量呈下降-上升-下降趋势,但在整个波动区间内,P.galeiformis处理组类黄酮含量较对照组更高,在96 h时为对照组的1.23倍(P<0.05)。研究结果表明,P.galeiformis可以作为抗性激发子,在PAL、POD、C4H、C4L等酶的综合调控下刺激果蔬体内的总酚、类黄酮积累,以提升抗性作用;同时,酚类被PAL酶氧化后的毒素也可能对病原菌产生直接的抑制作用,如苹果采后P.guilliermondii处理可激活果实创面的活性氧和苯丙烷代谢,促进果实创面愈合[34]。
植物木质素是多种苯丙烷单体的共聚物,酚类化合物和类黄酮是木质素合成的重要前体物质[44],木质素的积累预示着植物愈伤组织的形成和木质化进程加快,因此可以通过监测木质素来衡量李果实对病原菌的抗性作用。如图5-C所示,贮藏期内对照组果实的木质素含量增加缓慢;经P.galeiformis处理后,果实木质素积累显著上升,贮藏120 h时,P.galeiformis处理组木质素含量达对照组1.52倍(P<0.05)。周雅涵[44]将P.membranaefaciens接种于柑橘果实发现,木质素含量的增加可以增强细胞壁抗真菌穿透的能力,同时有效限制真菌对果实中水及营养物质的利用。此外,木质素中的自由基可有效钝化真菌的细胞膜及其有害代谢产物,进而增强果实的抗性。综上,P.galeiformis可以通过调控李果实苯丙烷代谢途径中类黄酮、总酚、木质素等抗真菌化合物的代谢与积累,增强果实的结构抗性和生化抗性,提高果实的抗病原菌侵染能力。
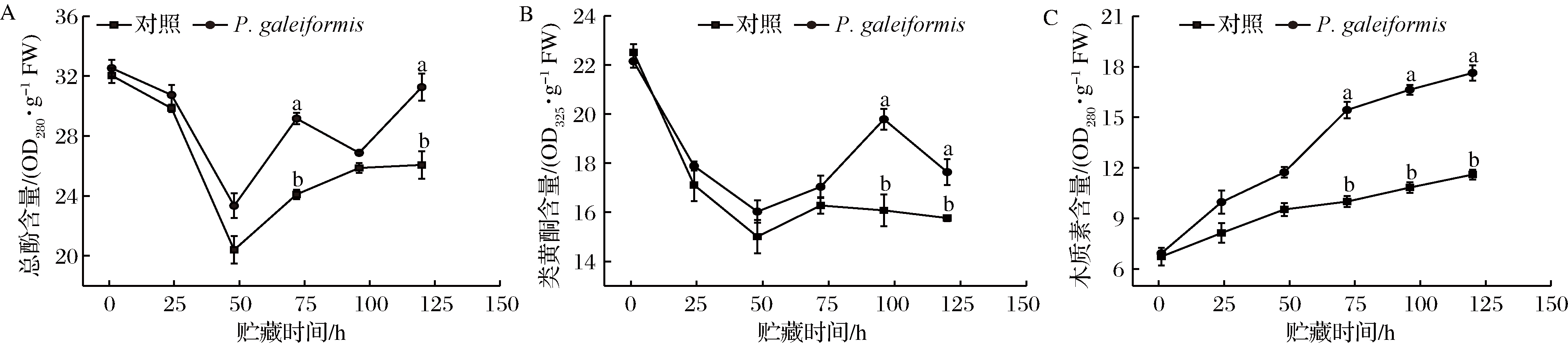
A-总酚含量;B-类黄酮含量;C-木质素含量
图5 P.galeiformis处理对李果实总酚、类黄酮和木质素含量的影响
Fig.5 Effect of P.galeiformis treatment on the contents of phenolics、flavonoid and lignin in plum fruits
3 结论
本实验研究结果表明:(1)P.galeiformis能显著抑制M.fructicola的菌丝生长,有效抑制李果实采后褐腐病的发病率和病斑直径;(2)P.galeiformis可有效提高李果实苯丙烷代谢途径中的关键酶(PAL、POD、C4H、4CL)活性,促进其抗性物质(总酚、类黄酮)代谢,显著增强李果实木质素积累,从而诱导李果实产生抗性提高其对病原体的防御反应。因此,P.galeiformis有望成为一种控制李褐腐病的安全有效工具,在果蔬采后病害防治领域中有较大的应用潜力,可为果蔬采后病害防治提供新的策略。
[1] 高佳缘, 孙伟, 王春艳, 等.利用水性可剥离保护膜防治李子褐腐病[J].黑龙江农业科学, 2018(7):70-72.
GAO J Y, SUN W, WANG C Y, et al.Prevention test of root irrigation with different fungicides combinations on cabbage wilt[J].Heilongjiang Agricultural Sciences, 2018(7):70-72.
[2] 梁建根, 施跃峰, 竺利红, 等.植物病害生物防治的研究现状[J].现代农业科技, 2008(18):158-159.
LIANG J G, SHI Y F, ZHU L H, et al.Research status of biological control of plant diseases[J].Modern Agricultural Science and Technology, 2008(18):158-159.
[3] 杨芝霓, 李其利, 李芝义, 等.热水处理对不同品种芒果采后病害的防治效果研究[J].安徽农业科学, 2020, 48(9):200-202.
YANG Z N, LI Q L, LI Z Y, et al.Study on the control effect of hot water treatment on postharvest diseases of different varieties of mango[J].Anhui Agricultural Sciences, 2020, 48(9):200-202.
[4] 孙思明,林羡,陈于陇,等.超声波清洗在柑橘采后病害防治的应用[J].食品科技, 2018, 43(2):45-50.
SUN S M, LIN X, CHEN Y L, et al.Application of ultrasonic cleaning in the control of citrus postharvest diseases[J].Food Science and Technology, 2018, 43(2):45-50.
[5] 孙思明.柑橘绿色涂膜保鲜技术的研究[D].长春:吉林农业大学,2018.
SUN S M.Reasearch on citrus green coating film fresh technology[D].Changchun:Jilin Agricultura University, 2018.
[6] ZHANG X Y, GAO Z F, ZHANG X X, et al.Control effects of Bacillus siamensis G-3 volatile compounds on raspberry postharvest diseases caused by Botrytis cinerea and Rhizopus stolonifer[J].Biological Control, 2020, 141:104 135.
[7] SUPAPORN S, WEENUSSA E, TIDA D.A novel biological control agent against postharvest mango disease caused by Lasiodioplodia theobromae[J].European Journal of Plant Pathology, 2019, 155(2):583-592.
[8] 王智荣, 梅小飞, 杜木英, 等.荧光假单胞菌ZX对采后锦橙绿霉病的防治及其抑菌机制[J].微生物学报, 2019, 59(5):950-964.
WANG Z R, MEI X F, DU M Y, et al.Biocontrol of green mold decay in Jincheng citrus fruits by Pseudomonas fluorescens ZX[J].Acta Microbiologica Sinica, 2019, 59(5):950-964.
[9] PAIVA E D E, SERRADILLA M J, RUIZ-MOYANO S, et al.Combined effect of antagonistic yeast and modified atmosphere to control Penicillium expansum infection in sweet cherries cv.Ambrunés[J].International Journal of Food Microbiology, 2017, 241:276-282.
[10] 张晓云, 吴锋, 顾香玉, 等.控制桃果实采后病害拮抗酵母的筛选及其固体制剂的制备[J].食品科学, 2020,41(14):210-216.
ZHANG X Y, WU F, GU X Y, et al.Selecting antagnogistic yeast for controlling postharvest disease of peaches solid preparation[J].Food Science, 2020, 41(14):210-216.
[11] 张红印, 李万海, 张晓云, 等.一株控制柑橘和葡萄采后病害的盔形毕赤酵母:中国,CN201610225320.6[P].2016-08-17.[2020-04-27].
ZHANG H Y, LI W H, ZHANG X Y, et al.A Pichiamanshurica controls postharvest disease in citrus and grape.China, CN201610225320.6[P].2016-08-17.[2020-04-27].
[12] 田世平, 产祝龙.诱导抗性在果蔬采后病害防治中的研究与应用[J].植物病理学报, 2004, 34(5):385-394.
TIAN S P, CHAN Z L.Potential of induced resistance in postharvest diseases control of fruits and vegetables[J].Acta Phytopathologica Sinica, 2004, 34(5):385-394.
[13] 张璐, 张瑶, 刘丽丹, 等.膜醭毕赤酵母对草莓采后灰霉病抗病性的诱导[J].食品科学, 2013,34(22):286-291.
ZHANG L, ZHANG Y, LIU L D, et al.Induction of disease resistance to gray mold by Pichia membranaefaciens in postharvest strawberryFruit[J].Food Science, 2013, 34(22):286-291.
[14] 来佳. 罗伦隐球酵母对樱桃番茄果实的抗性诱导作用及其机理研究[D].杭州:浙江大学,2019.
LAI J.Effect of Croptococcus laurentii on inducing disease esistance in chery tomato fruit and the possible defense mechanisms involved[D].Hangzhou:Zhejiang University, 2019.
[15] 夏启中, 张明菊.植物抗病的物质代谢基础[J].黄冈职业技术学院学报, 2004, 6(3):38-41.
XIA Q Z, ZHANG M J.Metabolic Basis of plant-disease resistance[J].Journal of Huanggang Polvtechnic, 2004, 6(3):38-41.
[16] 顾敏. 植物次生代谢在抗氧化胁迫和有机污染物毒害中的作用及调控机制[D].杭州:浙江大学,2010.
GU M.The role of plant secondary metabolism in the resistance to oxidative stresses and organic pollutants and regulation mechanism[D].Hangzhou:Zhejiang University, 2010.
[17] 窦国霞, 蒋春号, 郭虹娜, 等.葡萄汁有孢汉逊酵母对采后草莓灰霉病抗性诱导机理研究[J].园艺学报, 2019, 46(7):1 290-1 302.
DOU G X, JIANG C H, GUO H N, et al.Studies on the resistance induction of Hanseniaspora uvarum to postharvest gray mold in strawberry[J].Acta Horticultural Sinica, 2019, 46(7):1 290-1 302.
[18] ZHANG X Y, WU F, GU N, et al.Postharvest biological control of Rhizopus rot and the mechanisms involved in induced disease resistance of peaches by Pichia membranefaciens[J].Postharvest Biology and Technology, 2020, 163.
[19] 张婕. 两种酵母拮抗菌对采后李果实褐腐病的生物防治效果及机理研究[D].重庆:西南大学,2017.
ZHANG J.Biocontrol efficacy and mechanism of two antagonistical yeasts against postharvest brown rot in pulm fruit[D].Chongqing:Southwest University, 2017.
[20] CHEN O, YI L H, DENG L L, et al.Screening antagonistic yeasts against citrus green mold and the possible biocontrol mechanisms of Pichia galeiformis(BAF03)[J].Journal of the Science of Food and Agriculture, 2020, 155(2):3-7.
[21] 王友升, 黄津津, 王颖, 等.一株拮抗酵母菌Pichia galeiformis及其制备与使用方法:中国,CN201711373886.4[P].2018-04-20.[2020-04-27].
WANG Y S, HANG J J, WANG Y, et al.Preparation and application method of antagonistic yeast Pichia galeiformis.China, CN201711373886.4[P].2018-04-20.[2020-04-27].
[22] ASSIS J S, MALDONADO R, MUNOZ T, et al.Effect of highcarbon dioxide concentration on PAL activity and phenolic contents inripening cherimoya fruit[J].Postharvest Biology & Technology, 2001, 23(1):33-39.
[23] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007:44-45.
CAO J K, JIANG W B, ZHAO Y M.Postharvest Physiological and Biochemical Laboratory Guidance for Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007:44-45.
[24] 范存斐, 毕阳, 王云飞, 等.水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响[J].中国农业科学, 2012, 45(3):584-589.
FAN C F, BI Y, WANG Y F, et al.Effect of salicylic acid dipping on postharvest diseases and phenylpropanoid pathway in muskmelon fruits[J].Scientia Agricultural Sinica, 2012, 45(3):584-589.
[25] LI G J, ZHU S H, WU W X, et al.Exogenous nitric oxide induces disease resistance against Monilinia fructicola through activating the phenylpropanoid pathway in peach fruit[J].Journal of the Science of Food and Agriculture, 2016, 97(9):17-21.
[26] DENG L L, ZENG K F, ZHOU Y H, et al.Effects of postharvest oligochitosan treatment on an thracnose disease in citrus (Citrus sinensis L.Osbeck) fruit[J].European Food Research and Technology, 2015, 240(4):795-804.
[27] LI H, SUO J T, HAN Y, et al.The effect of 1-methylcyclopropene, methyl jasmonate and methyl salicylate on lignin accumulation and gene expression in postharvest‘Xuxiang’kiwifruit during cold storage[J].Postharvest Biology and Technology, 2017, 124:107-118.
[28] MARTA M, CAMILLA M, MICHELA G, et al.两种普鲁兰类酵母菌株Aureobasidium pullulans对三种核果类褐腐病菌Monilinia laxa,Monilinia fructicola和Monilinia fructigena的生物控制作用[J].保鲜与加工, 2012, 12(70):61-62.
MARTA M, CAMILLA M, MICHELA G, et al.The biological control of two kinds of Pullulan yeast, Aureobasidium Pullulans, on Monilinia Laxa,Monilinia fructicola and Monilinia fructigena, three kinds of druid brown rot bacteria[J].Storage and Process, 2012,12(70):61-62.
[29] ZHAO Y, LI Y F, YIN J J.Effects of hot air treatment in combination with Pichia guilliermondii on postharvest preservation of peach fruit[J].Journal of the science of food and agriculture, 2019, 99(2):111-114.
[30] SHAO Y Z, ZENG J K, TANG H, et al.The chemical treatments combined with antagonistic yeast control anthracnose and maintain the quality of postharvest mango fruit[J].Journal of Integrative Agriculture, 2019, 18(5):1 159-1 169.
[31] LIU X, GAO Y, YANG H Y, et al.Pichia kudriavzevii retards fungal decay by influencing the fungal community succession during cherry tomato fruit storage[J].Food Microbiology, 2020, 88:103 404.
[32] MAHUNU G K.Effect of bamboo leaf flavonoid and phytic acid on the control efficacy of Pichia Caribbica against Penicillium Expansum and Patulin Content in apple fruits[D].Zhenjiang:Jiangsu University, 2016.
[33] ZHANG X M, ZONG Y Y, LI Z C, et al.Postharvest Pichia guilliermondii treatment promotes wound healing of apple fruits[J].Postharvest Biology and Technology, 2020, 167:111 228.
[34] 吴锋.膜醭毕赤酵母Y4对桃果采后软腐病的控制及其制剂化研究[D].镇江:江苏大学,2019.
WU F.Studies on the biological control of postharvest disease of peaches by Pichia membranaefaciens Y4 and the preparation of the yeast[D].Zhenjiang:Jiangsu University, 2019.
[35] XU D D, DENG Y Z, XI P G, et al.Fulvic acid-induced disease resistance to Botrytis cinerea in table grapes may be mediated by regulating phenylpropanoid metabolism[J].Food chemistry, 2019, 286(15):226-233.
[36] 谢开珍, 刘佳琪, 任磊, 等.甘薯苯丙烷类代谢及其酶基因研究进展[J].植物学研究, 2019, 8(4):355-365.
XIE K Z, LIU J Q, REN L, et al.Advances in phenylaprapanoid metabolism and its enzyme genes in sweet potato[J].Botanical Research, 2019, 8(4):355-365.
[37] ZHANG M Y, WANG D J, GAO X X, et al.Exogenous caffeic acid and epicatechin enhance resistance against Botrytis cinerea through activation of the phenylpropanoid pathway in apples[J].Scientia Horticulturae, 2020, 268.
[38] 田晓明, 颜立红, 向光锋, 等.植物4香豆酸:辅酶A连接酶研究进展[J].生物技术通报, 2017, 33(4):19-26.
TIAN X M,YAN L H,XIANG G F,et al.Reseach progress on 4-coumarate:coenzyme A ligase(4CL)in plants[J].Biotechnology Bulletin, 2017, 33(4):19-26.
[39] 李莉, 赵越, 马君兰.苯丙氨酸代谢途径关键酶:PAL、C4H、4CL研究新进展[J].生物信息学, 2007, 17(4):45-47.
LI L, ZHAO Y, MA J L.Recent progress on key enzymes:PAL、C4H、4CL of phenylalanine metabolism pathway[J].China Journal of Bioinformatics, 2007, 17(4):45-47.
[40] 赵亚婷, 朱璇, 马玄, 等.采前水杨酸处理对杏果实抗病性及苯丙烷代谢的诱导[J].食品科学, 2015, 36(2):216-220.
ZHAO Y T, ZHU X, MA X, et al.Induction of disease resistance anf phenylpropanoid metabolism in apricot fruits by pre-harvest salicylic acid treatment[J].Food Science, 2015, 36(2):216-220.
[41] 张培岭, 白羽嘉, 马玲, 等.采后链格孢侵染对甜瓜果实苯丙烷代谢的影响[J].保鲜与加工, 2018, 18(6):1-6;12.
ZHANG P L, BAI Y J, MA L, et al.Effects of postharvest Alternaria alternate Infection on phenylpropanoid metabolim in muskmelon fruit[J].Storage and Process, 2018, 18(6):1-6;12.
[42] WANG B, JIANG H, BI Y, et al.Preharvest multiple sprays with sodium nitroprusside promote wound healing of harvested muskmelons by activation of phenylpropanoid metabolism[J].Postharvest Biology and Technology, 2019, 158:110 988.
[43] 周大祥, 汪开拓, 匡文玲, 等.果糖处理对冷藏雷竹笋品质和木质化的影响及其调控机制[J].食品与发酵工业,2020,46(15):175-183.
ZHOU D X, WANG K T, KUANG W L, et al.Effects of fructose treatment on quality and lignification of bamboo shoots (Phyllostachys praecox)during cold storage and its regulation mode involved[J].Food and Fermentation Industries,2020,46(15):175-183.
[44] 周雅涵. 水杨酸、膜醭毕赤酵母、壳寡糖诱导柑橘果实抗病性及其生物学机制研究[D].重庆:西南大学,2017.
ZHOU Y H.Salicylic acid,Pichia membranaefaciens and oligochitosan induced disease resistance of citrus fruit and possible biological mechanisms involved[D].Chongqing:Southwest University, 2017.