人乳寡糖(human milk oligosaccharides,HMOs)是母乳中含量仅次于乳糖和脂类的第三大成分,是200多种不易消化和非营养性碳水化合物的复杂混合物[1-2]。其可作为益生元刺激双歧杆菌和乳杆菌等有益菌群的生长[3],作为受体类似物抑制致病微生物对结肠黏膜的黏附[4],也可作为免疫调节因子,降低免疫相关的非传染性疾病的发生,利于婴儿肠道正常的消化、吸收、分泌及免疫功能的建立[5],同时HMOs还可以提供大脑发育和认知所需的潜在必需营养素,有助于刺激婴幼儿大脑发育以及改善认知学习能力[6]。2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL)作为母乳中分泌最丰富的人乳寡糖,约占总HMOs的30%[7],有研究表明其在预防疟疾的发生有重要作用,由于其具有的营养和医药价值,受到更加广泛的关注[8]。
2′-FL的生产可采用化学合成、酶法合成和微生物发酵。由于微生物发酵具有条件温和、成本低、环境友好等特点,已成为当今研究热点[9]。随着代谢工程和合成生物学的发展,多种微生物合成途径中酶的克隆表达变得越来越广泛。目前研究较多的是以大肠杆菌Escherichia coli作为模式生物,其具有代谢产出鸟嘌呤5′-二磷酸-β-L-岩藻糖(5′-diphospho-β-L-fucose,GDP-L-fucose)的2条完整通路(从头合成途径和补救途径)[10-12],通过构建代谢合成途径中的关键酶基因,以重组质粒转化模式生物进行过量表达,外源表达α-1,2-岩藻糖基转移酶,发酵生产2′-FL。CHIN等[13]通过构建从头合成途径中的基因manB、manC、Gmd和WcaG进行过量表达,同时外源表达来自幽门螺杆菌的α-1,2-岩藻糖基转移酶,以E.coli BL21(DE3)为表达宿主菌生产2′-FL,产量达到0.51 g/L,限于从头合成代谢途径过长,导致产量提高并不显著。ENGELS等[14]以L-岩藻糖和乳糖为底物,外源添加ATP和GTP作为能量,通过体外酶法生产2′-FL,此方法虽可提高2′-FL的生成量,但是相对成本高。由此可见,目前2′-FL的生产并未达到理想水平,为了提高其产量,利用基因工程的方法提高代谢过程中关键酶的表达,进而发酵生产可作为一种较为有效的方法。
本研究通过共表达fkp和futC基因到E.coli表达载体pCDFDuet-1上,获得重组质粒pCD-fkp-futC,建立2′-FL的合成途径。并通过CRISPR/Cas9系统基因敲除β-半乳糖苷酶和UDP-葡萄糖脂质载体转移酶基因LacZ和WcaJ,阻断中间代谢产物的分解,以期降低发酵过程中代谢副产物的产生,从而提高2′-FL的产量,为其工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
实验所需基因来源于脆弱拟杆菌(Bacteroides fragilis)和幽门螺杆菌(Helicobacter pylori)。克隆宿主菌为E.coli DH5α,表达宿主菌为E.coli BL21(DE3),上述2种菌株均为本实验室保藏菌株。E.coli表达载体pCDFDuet-1购自Novagen公司。PCR引物由苏州金唯智生物科技有限公司合成,测序工作委托上海生工生物工程有限公司完成。
1.1.2 主要试剂及仪器
甘油、酵母提取物、胰蛋白胨,国药集团;基因组DNA提取试剂盒,上海生工生物工程有限公司;质粒快速抽提试剂盒、DNA切胶纯化回收试剂盒,南京诺唯赞生物科技有限公司;Taq DNA聚合酶、限制性内切酶等工具酶,TaKaRa(大连)生物有限公司;标准品2′-FL,Sigma(上海)公司;其他试剂均为国产分析纯。
A360紫外可见分光光度计,北京普析通用仪器有限责任公司;DK-8D电热恒温水浴锅,上海博迅实业有限公司医疗设备厂;TGL-16M高速台式大容量离心机,湖南湘仪集团;电转化仪、高速冷冻离心机,德国Eppendorf有限公司;Waters e2695高效液相色谱,美国Waters公司;SDS-PAGE电泳仪、核酸电泳仪、PCR仪,美国Bio-Rad公司。
1.1.3 培养基成分
LB液体培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10。
LB固体培养基:在LB液体培养基的基础上添加15~20 g/L的琼脂粉。
DM培养基(pH 6.8):柠檬酸 1.7 g/L,KH2PO413.5 g/L,(NH4)2PO44 g/L,MgSO4·7H2O 1.4 g/L,微量金属溶液10 mL/L(柠檬酸三铁10 g/L,ZnSO4·7H2O 2.25 g/L,CuSO4·5H2O 1.0 g/L,MnSO4·H2O 0.35 g/L,Na2B4O7·2H2O 0.23 g/L,(NH4)6Mo7O240.11 g/L,CaCl2·2H2O 2.0 g/L)。
1.2 实验方法
1.2.1 共表达质粒的构建
B.fragilis和H.pylori全基因组DNA抽提:取1 mL 过夜培养的细菌菌液,按照细菌基因组 DNA 抽提试剂盒说明书操作进行抽提[15]。
通过NCBI官网查询fkp和futC基因序列,根据其基因序列设计引物,fkp基因引入Nde I和Xho I限制性酶切位点,futC基因引入Nco I和Hind III限制性酶切位点,引物序列fkp-F1/fkp-R1、futC-F2/futC-R2见表1。以抽提的B.fragilis和H.pylori全基因组为模板,PCR扩增得到fkp和futC目的片段。fkp基因的PCR扩增条件为:95 ℃ 3 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 180 s,循环30次,72 ℃ 5 min;futC基因的PCR扩增条件为:95 ℃ 3 min,95 ℃ 15 s,58 ℃ 15 s,72 ℃ 60 s,循环30次,72 ℃ 5 min。PCR扩增产物纯化回收后采用酶切位点双酶切、酶连的方法连接质粒载体。构建共表达质粒pCD-fkp-futC,转化感受态细胞E.coli DH5α,涂布含有链霉素(100 μg/mL)抗性的LB固体平板,37 ℃、200 r/min过夜培养12 h,筛选阳性克隆子,重组质粒pCD-fkp-futC抽提后进行双酶切验证并测序鉴定。
表1 目的基因扩增引物
Table 1 Sequences of target gene amplification primers

引物序列(5'-3')fkp-F1CGCCATATGGCGCCTCAATTCATCGTTGCATCTCAATTTACTfkp-R1CCCTCGAGGGTTATGATCGTGATACTTGGAATCCCTTATCAfutC-F2CCCATGGGATGGCTTTTAAGGTGGTGCAAATTTGCfutC-R2CCAAGCTTGGAGCGTTATACTTTTGGGATTTCACCTCAAAATGGG
注:粗体部分为酶切位点
1.2.2 敲除载体和基因同源修复臂的构建[16-17]
以LacZ基因为例,通过http://www.regenome.net/cas-offinder/设计基因的gRNA,将设计的20 bp序列引入gRNAR中,以gRNAF/gRNAR作为上下游引物,pTargetF质粒为模板进行PCR扩增,扩增产物经限制性内切酶Dpn I酶切,去除多余环状pTargetF质粒。将扩增产物转化E.coli DH5α感受态细胞,小提质粒,用引物gRNAPF/gRNAPR测序鉴定,将构建成功的敲除质粒命名为pTF-ΔLacZ。
选用E.coli BL21(DE3)基因组DNA为模板,利用上游同源臂引物LacZ LF/LacZ LR和下游同源臂引物LacZ RF/LacZ RR分别扩增出同源臂序列片段1和2,产物纯化回收后采用SOE-PCR技术用引物LacZ LF/LacZ RR将片段1和2扩增连接起来获得基因同源修复臂。本研究所用引物和gRNA寡核苷酸序列见表2。
表2 gRNA和引物
Table 2 Sequences of gRNA and primers

1.2.3 基因敲除菌株的构建
以LacZ基因为例,将核酸内切酶pCas质粒转化E.coli BL21(DE3)感受态细胞,转化产物涂布到含有50 μg/mL卡那霉素的LB固体平板,30 ℃培养,筛选获得含有pCas质粒的阳性克隆子E.coli BL21-Δ。将含pCas质粒的E.coli BL21-Δ按照文献描述的方法[18]制备电转化感受态细胞。构建成功的敲除载体pTF-ΔLacZ和基因同源修复臂电转化(1.8 kV,5 ms)上述感受态细胞E.coli BL21-Δ,30 ℃复苏1 h,涂布至含有50 μg/mL卡那霉素和50 μg/mL壮观霉素的LB固体平板,30 ℃培养16 h获得同源重组菌。提取重组菌染色体DNA为模板,以LacZ基因设计上下游敲除鉴定引物LacZ PF/LacZ PR对转化子进行PCR验证,进行回复野生型/重组型的鉴定,并将PCR鉴定为重组型的菌株命名为E.coli BL21-ΔZ。
鉴定成功的E.coli BL21-ΔZ菌株消除pTF-ΔLacZ和pCas质粒抗性,培养于含有卡那霉素的LB液体培养基中,待OD600值达到0.2左右,加入0.5 mmol/L异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG),培养12 h后划线含卡那霉素抗性的LB固体平板,然后克隆子对壮观霉素敏感的确认为重组质粒pTF-ΔLacZ已经被消除。叠加敲除WcaJ基因的操作流程同上述LacZ基因流程,将鉴定敲除菌株命名为E.coli BL21-ΔZΔW。敲除重组菌在42 ℃培养过夜以消除pCas质粒[19]。
1.2.4 发酵培养及诱导表达
将验证成功的重组质粒pCD-fkp-futC转化至E.coli BL21(DE3)、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW感受态细胞,涂布筛选阳性克隆子。鉴定正确的阳性克隆子挑取至LB液体种子培养基,添加100 μg/mL的链霉素,37 ℃、200 r/min过夜培养,吸取体积分数为2%的菌液接种于装有50 mL发酵培养基的250 mL三角瓶中,培养至菌体OD600值为0.6~0.8,添加0.2 mmol/L IPTG诱导重组质粒表达,后添加10 g/L的乳糖和5 g/L的L-岩藻糖作为底物,25 ℃诱导培养100 h,定时取样,利用HPLC定量检测2′-FL的产量。
1.2.5 摇瓶发酵条件优化
(1)不同培养基对2′-FL产量的影响
分别选用LB培养基和DM培养基作为发酵培养基,通过诱导摇瓶发酵生产2′-FL,探究不同发酵培养基对其产量的影响。
(2)不同诱导浓度对2′-FL产量的影响
改变诱导剂IPTG的终浓度为0.1、0.2、0.5、0.8和1 mmol/L,优化适合2′-FL发酵生产的最佳诱导浓度。
(3)不同诱导温度对2′-FL产量的影响
采用不同诱导温度20、25、28、30、37 ℃,摇瓶发酵生产2′-FL,探究不同诱导温度下的产量变化。
(4)不同接种量对2′-FL产量的影响
采用1%、2%、3%、5%、10%接种量,通过发酵生产2′-FL,研究接种量对2′-FL产量的影响。
1.2.6 检测方法
生物量的测定:将发酵液稀释到适当浓度,以空白培养基作为对照,于600 nm下测量菌体OD值。
2′-FL、乳糖、L-岩藻糖和甘油的测定:发酵液于100 ℃使细胞破碎10 min,12 000 r/min离心5 min,取上清液经0.22 μm 膜过滤处理,利用HPLC进行检测。HPLC检测条件:示差折光检测器;色谱柱为Rezex ROA-organic acid(Phenomenex,USA),柱温为50 ℃;流动相为0.005 mol/L的H2SO4水溶液,流速为0.6 mL/min;进样量为10 μL。
1.2.7 数据处理
每组实验3个平行,实验数据以平均值和标准偏差的形式表示,采用SPSS 20.0软件进行数据的差异显著性分析,采用Origin 8.5软件作图。
2 结果与分析
2.1 共表达质粒的构建与鉴定
分别以来源于B.fragilis和H.pylori的基因组DNA为模板,PCR扩增得到成熟的fkp和futC目的基因片段,fkp长度大小为2 850 bp,futC长度大小为903 bp。将fkp和futC目的片段采用酶切位点双酶切、酶连的方法先后连接到质粒pCDFDuet-1中,构建共表达质粒pCD-fkp-futC,转化E.coli DH5α感受态细胞,挑选阳性克隆子,抽提质粒进行双酶切验证,并同时测序鉴定,双酶切结果如图1所示。Fkp和futC基因分别采用Nde I/Xho I和Nco I/Hind III 2个酶切位点进行双酶切验证,结果显示2条明显的条带,且重组质粒双酶切后出现的条带大小与预期相符,同时测序结果与原目的基因序列对比正确,由此表明fkp和futC目的基因已经正确连接到表达载体pCDFDuet-1上。
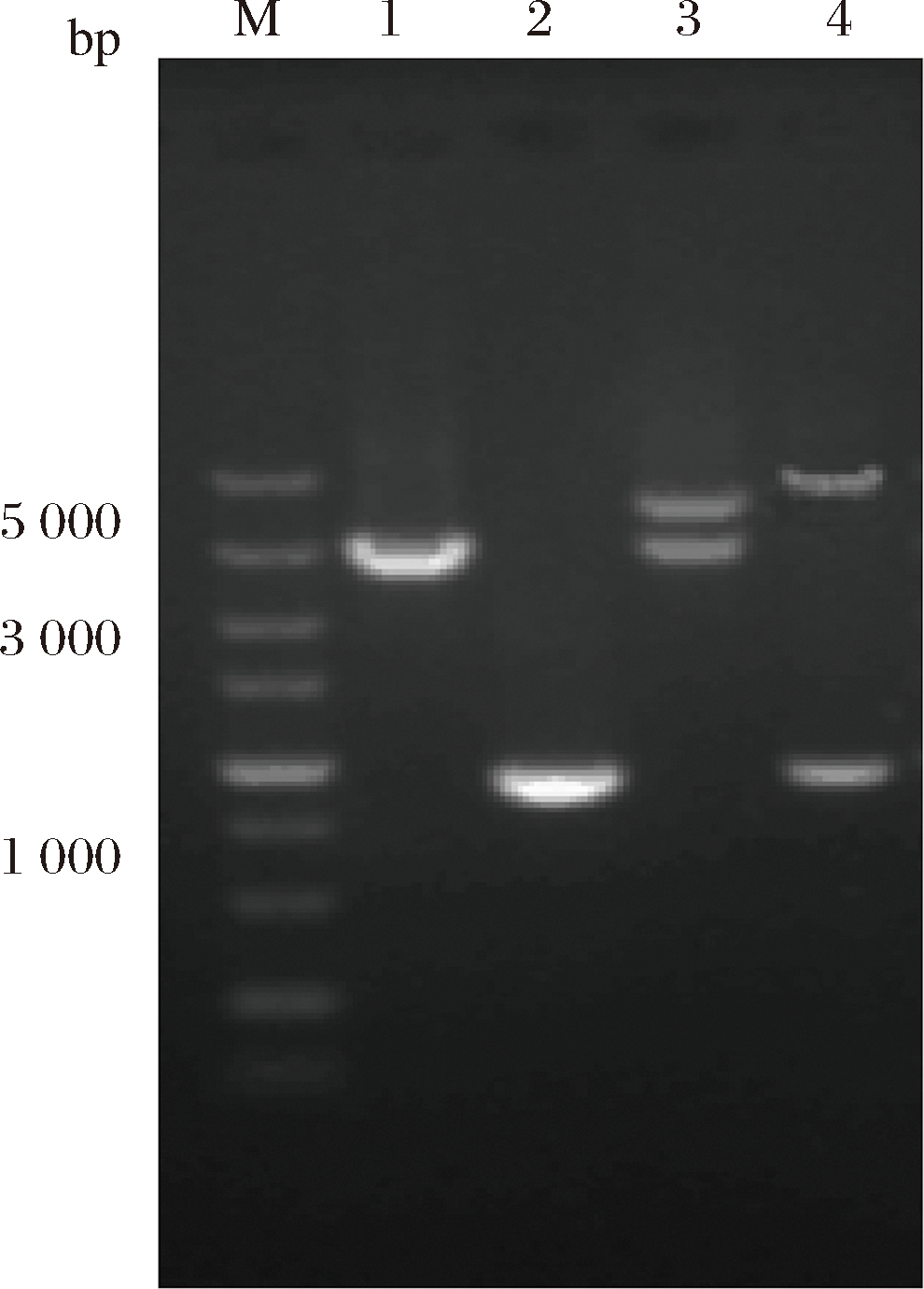
M-DNA标准品;1-fkp基因的PCR克隆产物;2-futC基因的PCR克隆产物;3-pCD-fkp Nde I和Xho I双酶切产物;
4-pCD-fkp-futC Nco I和Hind III双酶切产物
图1 PCR产物和重组质粒双酶切验证的琼脂糖凝胶电泳
Fig.1 Agarose gel electrophoresis verified by double digestion of PCR products and recombinant plasmids

图2 共表达质粒pCD-fkp-futC的构建流程
Fig.2 Construction of recombinant plasmids pCD-fkp-futC
2.2 敲除载体和基因同源修复臂的构建与鉴定
利用1.2.2小节中所述方法构建敲除载体pTF-ΔLacZ和基因同源修复臂,DNA聚合酶对pTargetF质粒、上下游引物进行PCR扩增,获得的产物转化E.coli DH5α感受态细胞,小提质粒后,经引物gRNAPF/gRNAPR测序鉴定,测序结果正确无误,表明敲除质粒pTF-ΔLacZ可用于下一步实验。
利用表2中相应引物LacZ LF/LacZ LR 和LacZ RF/LacZ RR构建lacZ基因的上下游同源修复臂,其长度大小分别为500 bp,上下游同源修复臂经SOE-PCR技术融合后长度大小为1 000 bp。琼脂糖凝胶电泳显示条带位置大小与原先设计预期相符。叠加敲除WcaJ基因时,敲除载体pTF-ΔWcaJ的构建结果正确,基因同源修复臂设计上下游同源修复臂大小各为500 bp,融合后长度大小为1 000 bp(图3)。

M-DNA标准品;1-LacZ基因上游同源片段1;
2-LacZ基因下游同源片段2;3-LacZ基因上下游融合片段
图3 基因同源修复供体的PCR产物
Fig.3 PCR products of gene homology repair donors
2.3 基因敲除菌株的验证
根据GeneBank中E.coli BL21(DE3)的LacZ基因长度为3 075 bp,采用CRISPR/Cas9敲除系统,经过同源重组筛选,PCR验证正确的敲除菌株,提取基因组DNA,并利用表2中相应的引物LacZ PF/LacZ PR验证原始菌株和敲除菌株,片段大小为3 704 bp、629 bp,两片段相差的长度正好为LacZ基因的长度,PCR验证条带电泳如图4所示。挑取的4个阳性交换突变株中的3个菌株显示已敲除,且纯化回收敲除菌株的PCR产物,经测序鉴定确认碱基正确无误,说明LacZ基因敲除成功,E.coli BL21-ΔZ菌株构建成功。

M-DNA标准品;1-E.coli BL21原始菌的PCR产物;2、3、5-敲除成功LacZ基因后的PCR产物;4-未敲除成功LacZ基因的PCR产物;7、10-敲除成功WcaJ基因后的PCR产物;8、9-未敲除成功WcaJ基因的PCR产物
图4 LacZ、WcaJ基因敲除后的PCR鉴定
Fig.4 PCR and sequencing analysis of the post-knockout LacZ and WcaJ gene
敲除载体pTF-ΔWcaJ和WcaJ基因同源修复臂电转化E.coli BL21-ΔZ中,按照1.2.3小节的方法进行抗性筛选突变株,经PCR验证正确的阳性突变株,提取基因组DNA,按照表2中的相应引物WcaJ PF/WcaJ PR验证原始菌株和阳性突变株。突变株与原始株相差WcaJ基因的长度,经PCR鉴定及测序结果显示确认碱基准确无误,说明缺失LacZ基因和WcaJ基因的菌株E.coli BL21-ΔZΔW构建成功。
2.4 重组大肠杆菌的诱导表达
构建成功的共表达质粒pCD-fkp-futC转化E.coli BL21(DE3)、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW菌株,成功筛选出阳性克隆子进行诱导培养,后进行SDS-PAGE分析。Fkp基因编码L-岩藻糖激酶/GDP-L-岩藻糖焦磷酸化酶,共949个氨基酸残基,其蛋白分子质量为106 kDa[20],futC基因编码α-1,2岩藻糖基转移酶,共300个氨基酸残基,其蛋白分子质量为33 kDa[21]。通过SDS-PAGE分析IPTG诱导的E.coli BL21(DE3)、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW菌株重组酶,并在106 kDa和33 kDa处显示出明显的蛋白条带(图5),说明共表达质粒pCD-fkp-futC被成功诱导表达。
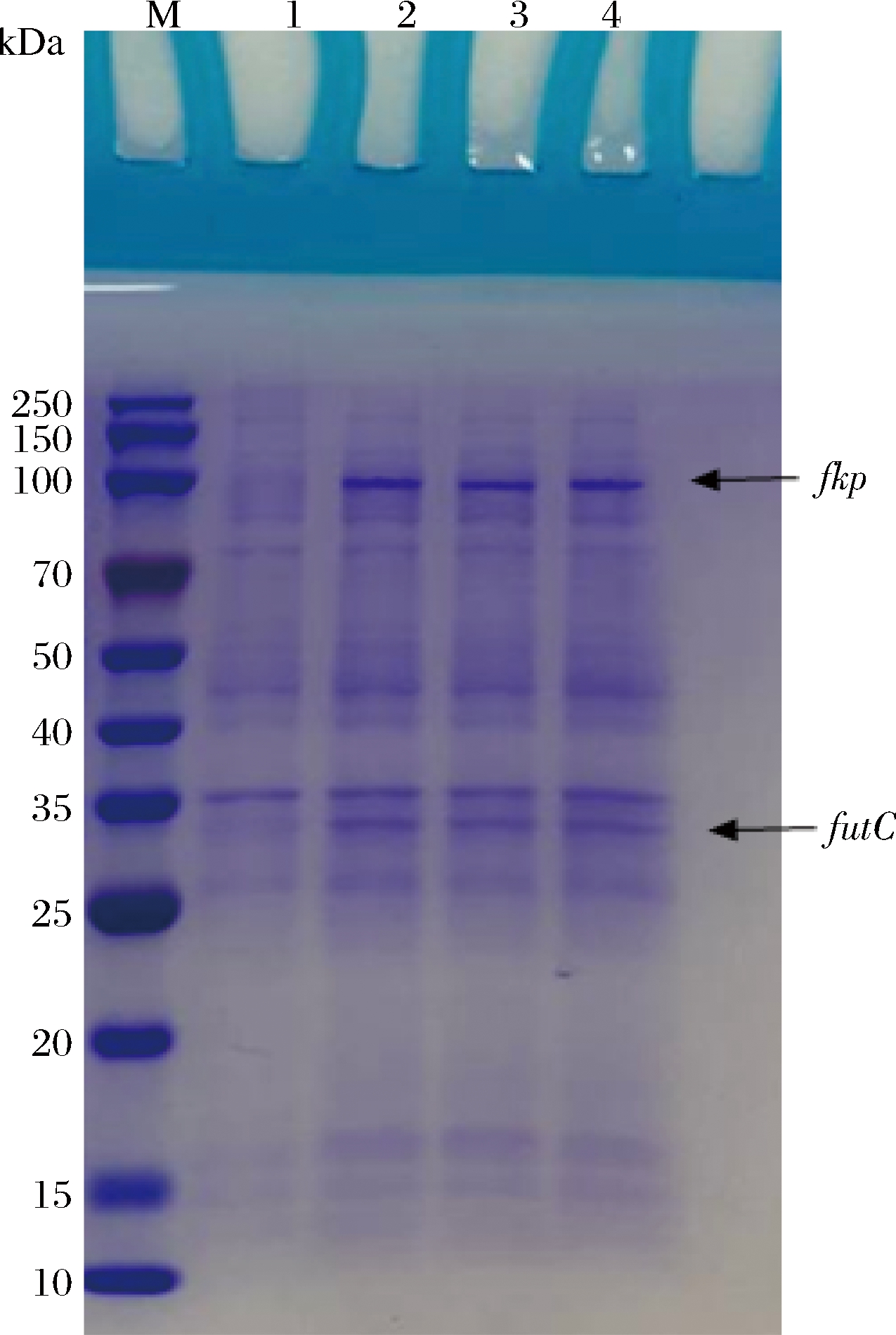
M-蛋白Marker;1-E.coli BL21对照;2-转化pCD-fkp-futC的
E.coli BL21;3-转化pCD-fkp-futC的E.coli BL21-ΔZ;4-转化
pCD-fkp-futC的E.coli BL21-ΔZΔW
图5 重组菌产酶SDS-PAGE分析
Fig.5 SDS-PAGE analysis of recombinant enzyme production
2.5 摇瓶发酵优化结果
2.5.1 发酵培养基
大肠杆菌发酵生产2′-FL可采用多种外加碳源,例如葡萄糖、甘油、甘露糖等,研究发现甘油在多种碳源中较适宜且经济,所以本实验采用甘油作为外加碳源。分别利用LB培养基和DM培养基进行发酵。
从摇瓶发酵结果来看,通过比较3株重组菌E.coli BL21、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW,单敲LacZ基因以及叠加敲除WcaJ基因后,2′-FL的产量均有所提高,且菌体量没有发生显著性变化。在发酵100 h时,E.coli BL21原始菌的产量达到188 mg/L,E.coli BL21-ΔZ缺陷菌株的产量达到353 mg/L,E.coli BL21-ΔZΔW缺陷菌株的产量达到919 mg/L,与原始菌相比产量分别提高1.88和4.89倍。说明敲除LacZ和WcaJ基因后,更多的碳流向了产物2′-FL代谢的方向,阻断了其他代谢副产物的竞争抑制,利于产物的不断积累。
相比LB培养基,采用DM培养基作为发酵培养基,2′-FL的产量更高。由图6可知,LB培养基的生物量比DM培养基更高,虽然LB培养基提供了更多的有机氮源碳源,可是2′-FL产量反而相对较低,原因可能是有机氮源碳源主要提供菌体内源生长和主物质代谢,不利于2′-FL的代谢积累。通过对比2种不同培养基,优选DM培养基作为发酵培养基。

图6 不同培养基对2′-FL生产的影响
Fig.6 Effect of different media on the production of 2′-fucosyllactose
2.5.2 诱导浓度
IPTG是一种诱导外源基因表达的诱导剂,可作为乳糖的类似物与大肠杆菌表达载体上的乳糖操纵子结合,进一步诱导表达载体上目的基因的转录表达,目前被广泛用于诱导表达系统[22]。诱导剂IPTG的浓度对2′-FL的产量有一定影响,寻找合适的诱导浓度对发酵生产显得尤为重要。由图7可知,采用终浓度为0.1、0.2、0.5、0.8和1 mmol/L进行摇瓶诱导发酵,E.coli BL21、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW均显示相同的诱导产量趋势,0.2 mmol/L IPTG作为最佳的诱导浓度。在此诱导浓度下,2′-FL的产量可达到近1 g/L,可以看出诱导浓度对合成2′-FL具有显著影响。因此从促进底物转化及经济效益来说,选择0.2 mmol/L的诱导剂IPTG作为最佳诱导浓度。
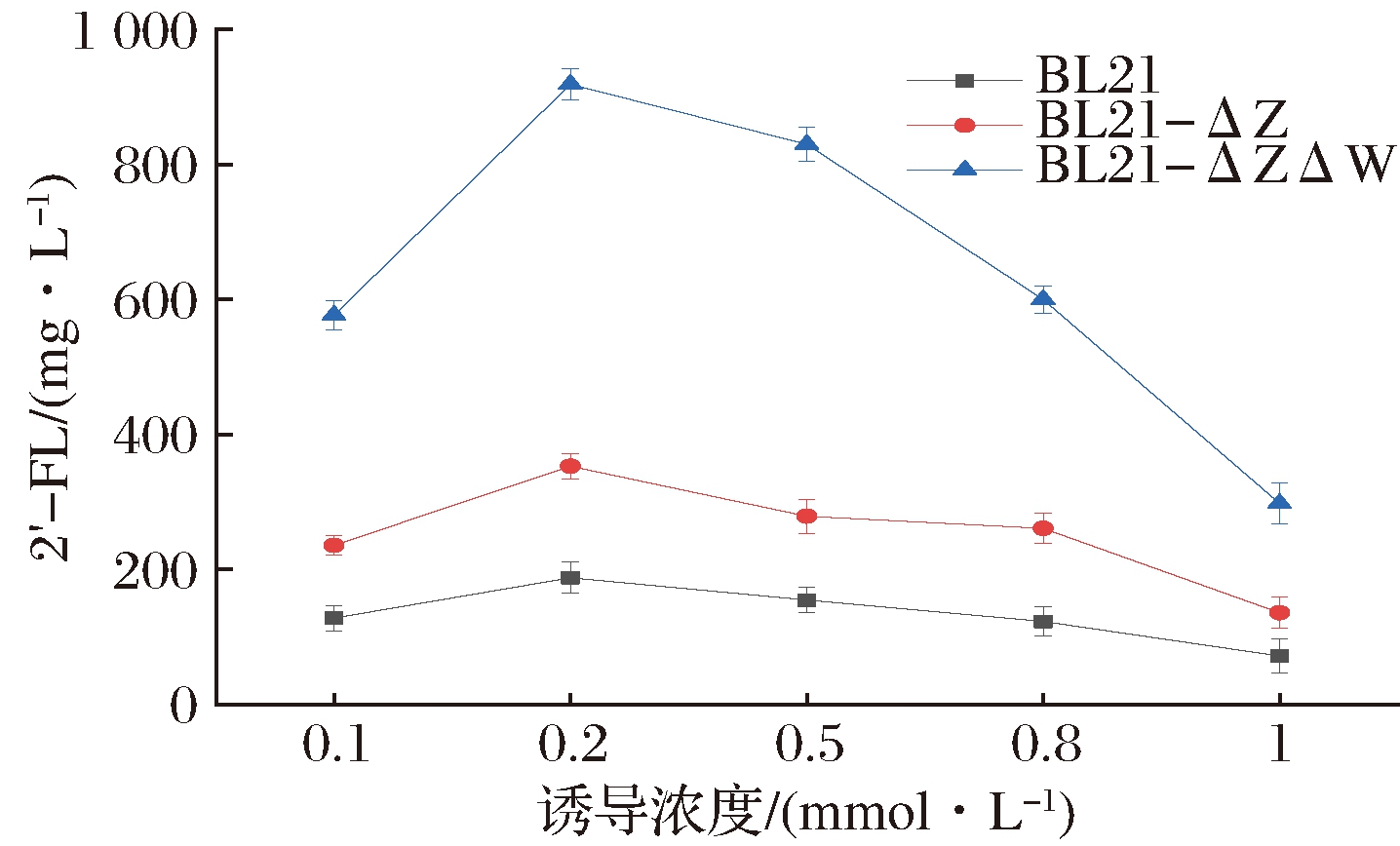
图7 不同诱导浓度对2′-FL生产的影响
Fig.7 Effects of different induced concentrations on the production of 2′-fucosyllactose
2.5.3 诱导温度
温度是影响基因工程菌生长、质粒稳定性和重组产物形成的重要环境因素,大肠杆菌的最适生长温度是37~39 ℃,然而在较高温度下,细菌的比生长速率较高,发酵过程中容易积累代谢副产物,反之则抑制菌体生长和目的产物的表达[23]。只有找到细菌生长和合成产物所需的最适温度,才可能提高重组菌的密度培养和产物的高表达。
从图8可以看出,温度对产物合成有显著影响,随着温度的降低,2′-FL合成途径中的关键酶活性上升,其产量呈现一个上升的趋势,以E.coli BL21-ΔZΔW为例,菌体合成2′-FL的产量从406 mg/L(37 ℃)升高到919 mg/L(25 ℃),进一步降低发酵温度,关键酶的酶活力受到抑制,2′-FL产量也随之降低。这说明在一定温度范围内,适当的降低温度有利于2′-FL的表达,但温度不能过低。通过诱导温度实验,确定了25 ℃为3株重组菌E.coli BL21、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW发酵合成2′-FL的最适温度。
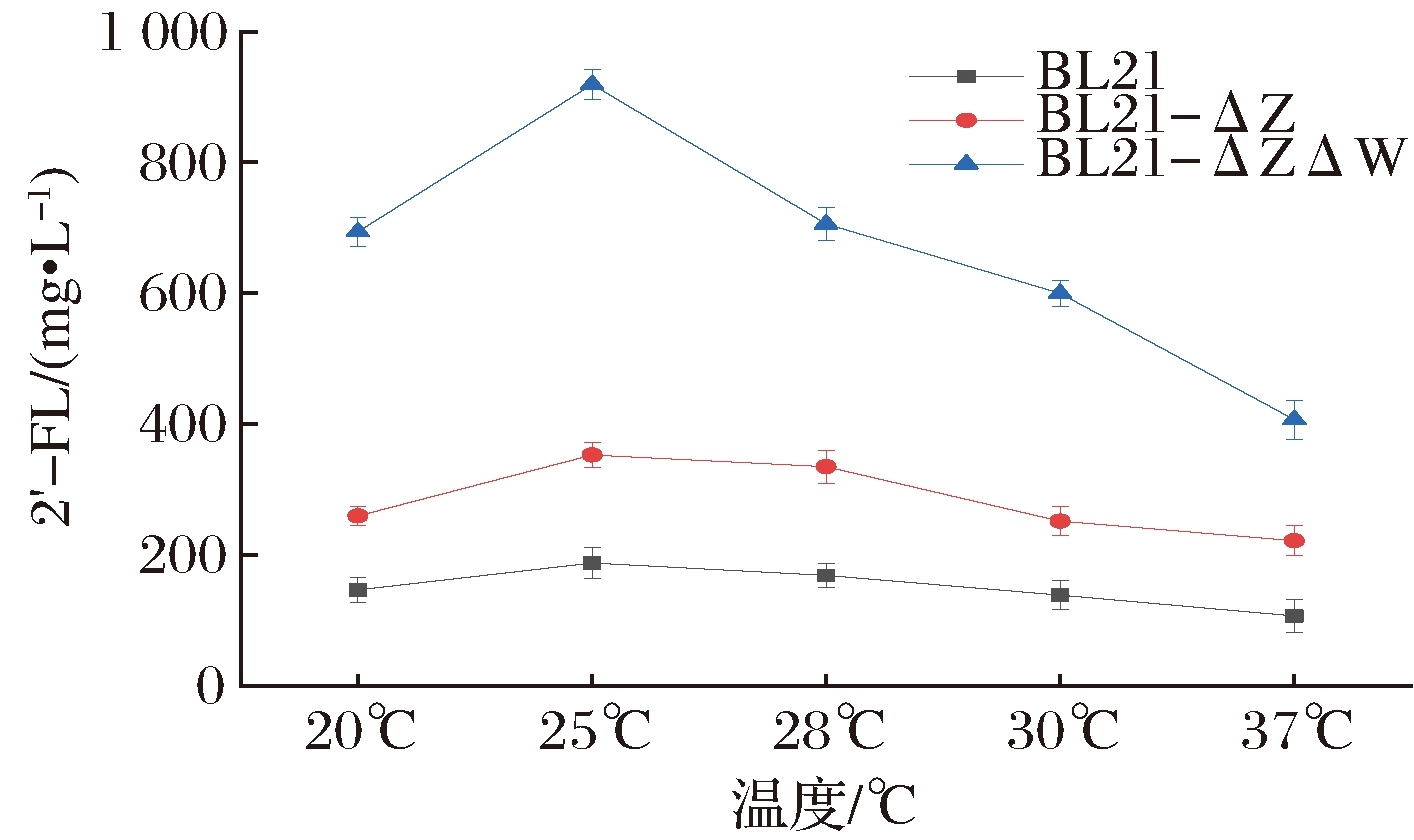
图8 不同诱导温度对2′-FL生产的影响
Fig.8 Effect of different induced temperatures on the production of 2′-fucosyllactose
2.5.4 接种量
在微生物发酵过程中,接种量的改变会对微生物的发酵时间、目标产物量以及底物利用率产生影响。当摇瓶中菌体不足时,微生物生长速率变慢,其菌体延滞期会延长,当菌体量过多时,在发酵过程中代谢副产物会大量积累,进而影响目标产物的得率。因此,选择合适的接种量显得尤为重要。分别在1%、2%、3%、5%、10%接种量下进行实验,发酵结果见图9,接种量为5%时对于菌体发酵更为有利,3株重组菌E.coli BL21、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW的2′-FL产量分别提高1.87、1.69和1.56倍,2′-FL的最高积累量可达到1.44 g/L。当接种量小于5%时,2′-FL产量偏低,可能是由于接种量较少,细胞生长较为缓慢,导致其积累量也减少;当接种量大于5%时,菌体延滞期变短,菌量变多,大量的碳源用于菌体生长,仅有少量的2′-FL合成。因此选择接种量为5%作为最佳接种量。
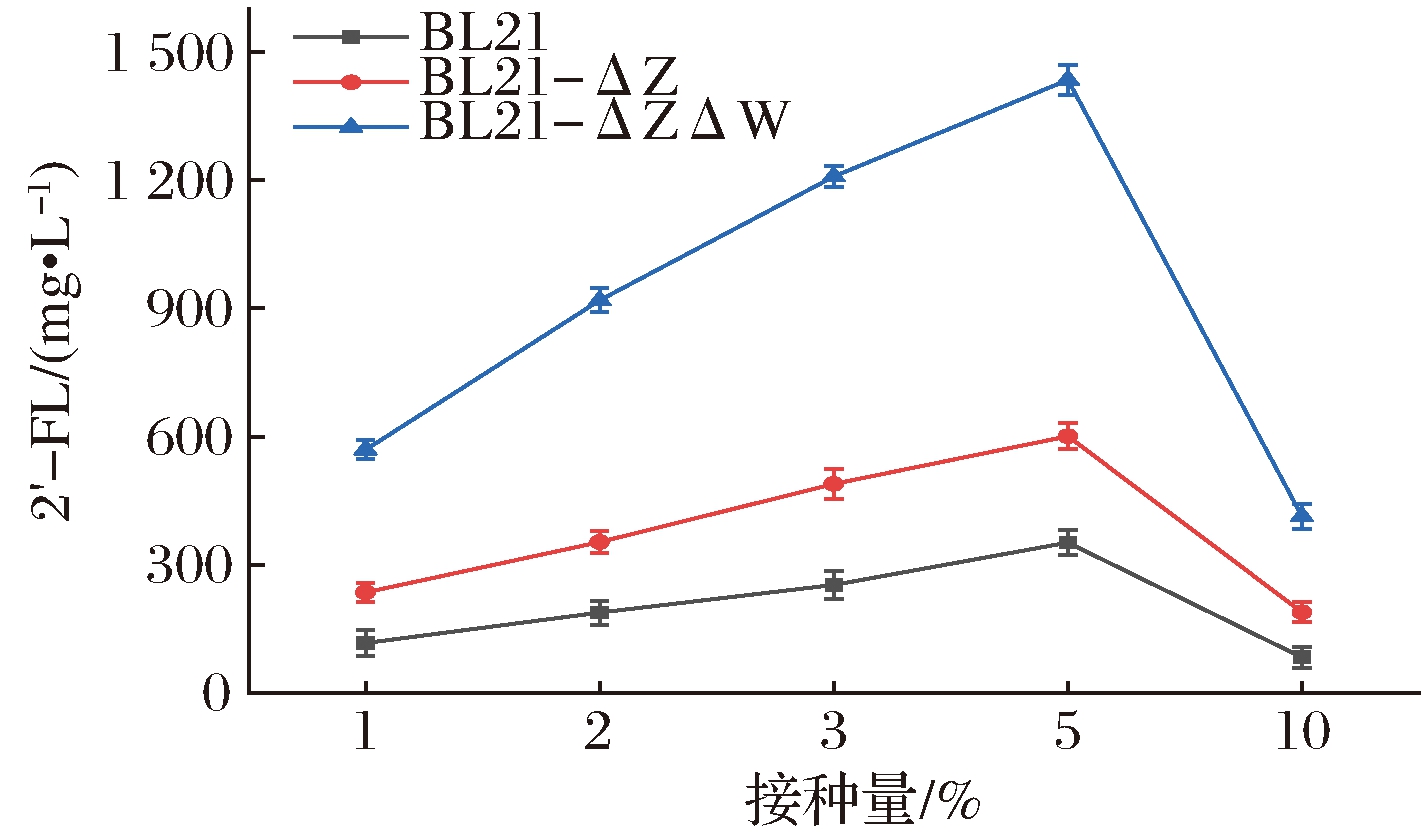
图9 不同接种量对2′-FL生产的影响
Fig.9 Effects of different inoculation doses on the production of 2′-fucosyllactose
3 结论
2′-FL是一种含量丰富的人乳寡糖,在婴幼儿成长发育过程中起到不可替代的作用,改善肠道微环境,增强肠道屏障功能,调节免疫系统,刺激大脑发育,改善学习和记忆能力等,越来越多地添加在婴幼儿配方奶粉中,其受关注度也日益增加。本文通过对来源于B.fragilis和H.pylori的fkp基因和 futC基因克隆表达载体pCDFDuet-1,利用CRISPR/Cas9系统敲除阻碍代谢途径中的β-半乳糖苷酶和UDP-葡萄糖脂质载体转移酶基因LacZ和WcaJ,重组质粒转化E.coli BL21原始菌、E.coli BL21-ΔZ和E.coli BL21-ΔZΔW基因缺陷菌,结果表明,通过重组缺陷菌的摇瓶发酵优化,2′-FL产量可达到1.44 g/L,这对进一步实现2′-FL的工业化生产具有重要意义。因此基因水平上的进一步改造及发酵罐的高密度发酵生产等是今后研究的方向。
[1] ZIVKOVIC A M,GERMAN J B,LEBRILLA C B,et al.Human milk glycobiome and its impact on the infant gastrointestinal microbiota[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(Suppl.1):4 653-4 658.
[2] NINONUEVO M R,PARK Y,YIN H F,et al.A strategy for annotating the human milk glycome[J].Journal of Agricultural and Food Chemistry,2006,54(20):7 471-7 480.
[3] THONGARAM T,HOEFLINGER J L,CHOW J,et al.Human milk oligosaccharide consumption by probiotic and human-associated Bifidobacteria and Lactobacilli[J].Journal of Dairy Science,2017,100(10):7 825-7 833.
[4] BODE L.Human milk oligosaccharides:Every baby needs a sugar mama[J].Glycobiology,2012,22(9):1 147-1 162.
[5] 逯莹莹, 刘鹏,孙景珠,等.母乳低聚糖的研究进展[J].中国乳品工业,2018,46(12):23-33.
LU Y Y,LIU P,SUN J Z,et al.Research progress of human milk oligosaccharides[J].China Dairy Industry,2018,46(12):23-33.
[6] VANDENPLAS Y,BERGER B,CARNIELLI V P,etal.Human milk oligosaccharides:2′-fucosyllactose(2′-FL) and Lacto-N-Neotetraose (LNnT) in infant formula[J].Nutrients,2018,10(9):1 161-1 161.
[7] LEE W H,PATHANIBUL P,QUARTERMAN J,et al.Whole cell biosynthesis of a functional oligosaccharide,2′-fucosyllactose,using engineered Escherichia coli[J].Microbial Cell Factories,2012,11(1):48-48.
[8] HEGAR B,WIBOWO Y,BASROWI R W,et al.The role of two human milk oligosaccharides,2′-fucosyllactose and Lacto-N-Neotetraose,in Infant nutrition[J].Pediatric Gastroenterology Hepatology Nutrition,2019,22(4):330-340.
[9] 王永胜, 王硕,张慧林,等.L-岩藻糖对母乳寡糖(HMOs)合成的意义及其产业化研究进展[J].中国农学通报,2019,35(11):127-132.
WANG Y S,WANG S,ZHANG H L,et al.L-fucose:The significance to synthesis of human milk oligosaccharides (HMOs) and its research progress of industrialization[J].Chinese Agricultural Science Bulletin,2019,35(11):127-132.
[10] CHIN Y W,SEO N,KIM J H,et al.Metabolic engineering of Escherichia coli to produce 2′-fucosyllactose via salvage pathway of guanosine 5′-diphosphate (GDP)-L-fucose[J].Biotechnology and Bioengineering,2016,113(11):2 443-2 452.
[11] ZHAI Y F,HAN D L,PAN Y,et al.Enhancing GDP-fucose production in recombinant Escherichia coli by metabolic pathway engineering[J].Enzyme and Microbial Technology,2015,69:38-45.
[12] 陈坚, 邓洁莹,李江华,等.母乳寡糖的生物合成研究进展[J].中国食品学报,2016,16(11):1-8.
CHEN J,DENG J Y,LI J H,et al.Advances in biosynthesis of breast milk oligosaccharides[J].Journal of Chinese Institute of Food Science and Technology,2016,16(11):1-8.
[13] CHIN Y W,KIM J Y,LEE W H,et al.Enhanced production of 2′-fucosyllactose in engineered Escherichia coli BL21 star(DE3) by modulation of lactose metabolism and fucosyltransferase[J].Joural of Biotechnology,2015(210):107-115.
[14] ENGELS L,ELLING L.WbgL:A novel bacterial α1,2-fucosyltransferase for the synthesis of 2′-fucosyllactose[J].Glycobiology,2014,24(2):170-178.
[15] 萨姆布鲁克J,拉塞尔著.分子克隆实验指南[M].(第三版).北京:科学出版社,2003:1 217-1 265.
SAMBROOK J,RUSSELL D W.Molecular cloning:A laboratory manual[M].3rd ed.Beijing:Science Press,2003:1 217-1 265.
[16] JIANG Y,CHEN B,DUAN C L,et al.Multigene editing in the Escherichia coli genome via the CRISPR-Cas9 system[J].Applied and Environmental Microbiology,2015,81(7):2 506-2 514.
[17] TANG Q,LOU C B,LIU S J.Construction of an easy-to-use CRISPR-Cas9 system by patching a newly designed EXIT circuit[J].Journal of Biological Engineering,2017,11(1):32-32.
[18] JIANG W Y,BIKARD D,COX D,et al.RNA-guided editing of bacterial genomes using CRISPR-Cas systems[J].Nature Biotechnology,2013,31(3):233-241.
[19] WANG X Z,HE J H,LE K Y.Making point mutations in Escherichia coli BL21 genome using CRISPR-Cas9 system[J].FEMS Microbiology Letters,2018,365(14):1-6.
[20] WANG G,BOULTON P G,CHAN N W C,et al.Novel Helicobacter pylori alpha1,2-fucosyltransferase,a key enzyme in the synthesis of Lewis antigens[J].Microbiology,1999,145(11):3 245-3 253.
[21] KOTAKE T,HOJO S,TAJIMA N,et al.A bifunctional enzyme with L-fucokinase and GDP-L-fucose pyrophosphorylase activities salvages free L-fucose in Arabidopsis[J].Journal of Biological Chemistry,2008,283(13):8 125-8 135.
[22] 肖玲玲. IPTG对大肠杆菌内重组牙龈卟啉单胞菌GroEL表达的影响[D].南京:南京大学,2017.
XIAO L L.The effect of IPTG concentrations on recombinant Porphyromonas gingivalis GroEL expression in Escherichia coli[D].Nanjing:Nanjing University,2017.
[23] 叶姣, 陈长华,夏杰,等.温度对重组大肠杆菌生长及外源蛋白表达的影响[J].华东理工大学学报,2008,28(2):364-367.
YE J,CHEN C H,XIA J,et al.Effect of temperature on the growth of recombinant E.coli and on the expression of recombinant protein[J].Journal of East China University of Science and Technology,2008,28(2):364-367.