蛋黄粉是以新鲜鸡蛋黄为原料,经过清洗、消毒、干燥等工序得到的含水量低于5%的粉质,具有优异的乳化性和凝胶性,被广泛地作为食品添加剂用于食品加工业[1-2]。而在蛋黄粉加工过程中,杀菌和干燥过程由于温度过高,会严重影响蛋黄粉的功能性质,使所得蛋黄粉难以满足工业需求。FABIEN 等[3]研究表明74 ℃加热12 min会使蛋白质发生热变性,形成不溶性聚集体使溶解度呈直线下降,热变性还会影响乳液滴粒径和絮凝性能进而影响乳液的流变性能。乔立文[4]研究发现,热处理会导致不同蛋白质的变性,在加热过程中蛋白质不断展开与聚合,导致总的表面疏水性与巯基含量随加热温度与时间发生复杂的变化,使全蛋液黏度增加,并在67 ℃时全蛋液由牛顿流体变为假塑性流体,最终导致蛋白质变性影响其功能性质。
因此,如何有效提高蛋黄粉功能性质显得至关重要。对提高蛋黄粉功能性质研究较多的是酶法改性。谷氨酰胺转氨酶(glutamine transaminse,TGase)是转移反应的转移酶,在肽链中谷氨酰胺残基的 γ-羧基(酰基供体)和不同酰基受体之间的转移,使蛋白质发生交联反应,改善蛋白质的结构与功能,从而提高蛋白质的乳化性、保水性和凝胶性等功能性质。TGase由于其优异的酶改性效果,被广泛应用于食品加工业,如LUCILLA 等[5]研究发现TGase交联作用可促进谷醇溶蛋白形成蛋白质网络结构,从而影响无麸质面粉的感官特性。QIU 等[6]研究发现TGase有限的交联可通过展开蛋白质结构使更多的疏水基团暴露,蛋白质分子的解折叠和最初埋在蛋白质分子中的巯基基团的暴露,从而改善花生球蛋白和伴花生球蛋白的溶解性、乳化性和凝胶性等。然而TGase在鸡蛋中的研究报道很少,在蛋黄粉中的运用未见报道。
本研究将TGase作用于蛋黄液,对蛋黄液中的蛋白质进行改性,通过喷雾干燥得到蛋黄粉,研究经TGase交联作用之后的蛋黄粉乳化性和凝胶性能的变化,并通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和测定表面巯基数分析TGase作用机理,为专一性蛋黄粉的生产提供理论支持,促进鸡蛋深加工业的发展。
1 材料与方法
1.1 材料与试剂
鸡蛋,雅安名山黄家鲜鸡蛋门市(蛋鸡品种:大五金凤);精炼一级大豆油,益海嘉里食品营销有限公司;谷胺酰胺转氨酶(酶活力为100 U/g),南京庞博生物有限公司。
三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane THAM,Tris),江苏恩莫阿赛生物技术有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),博士德生物技术有限公司;2-硝基苯甲酸(2-nitrobenzoic acid,DTNB)、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝G-250,成都市科隆化工试剂厂;NaCl、KBr、NaOH、甘氨酸、盐酸、尿素、盐酸胍、柠檬酸、磷酸、无水乙醇、甲醇、乙酸等试剂均为分析纯。
1.2 仪器与设备
B-290小型喷雾干燥仪,瑞士BUCHI公司;Varioskan Flash酶标仪,美国Thermo Fisher科技公司;DYCZ-240型电泳仪及电源,北京市六一仪器厂;Thermo-ST16R低温高速离心机,北京联合科力科技有限公司;TA-XTPlus型物性测试仪,英国SMS公司;Thermo Scientific NicoletIS10型傅里叶变换红外光谱仪,赛默飞世尓科技有限公司。
1.3 实验方法
1.3.1 蛋黄粉加工工艺流程
拣蛋→洗蛋→消毒→清水喷淋→吹干→打蛋、分蛋→酶处理→巴士杀菌→冷却、过滤→喷雾干燥→出粉→包装
(1)消毒:将完好洁净的鲜鸡蛋于清水中清洗,再置于4 g/L NaOH溶液中浸泡5 min,最后用蒸馏水清洗晾干备用。
(2)酶处理:用蒸馏水将鲜蛋黄液稀释1.5倍,并调节pH值为7.5,加入现配的TGase溶液,添加量分别为0、0.5、1、1.5、2、2.5、3、3.5 U/g蛋黄,混匀并密封置于35 ℃的恒温水浴锅中反应3.5 h,得到TGase处理后的蛋黄液样品。
(3)喷雾干燥:将酶处理所得蛋黄液于喷雾干燥进口温度为150 ℃,进料温度45 ℃,进料速率30%条件下进行干燥,得到蛋黄粉并进行指标测定。
1.3.2 蛋黄粉热凝胶强度测定
凝胶测定参考车用真[7]的方法,并略作修改。
(1)凝胶的制备:蛋黄粉与蒸馏水按质量比1∶3复溶→取溶液10 mL放于20 mL的烧杯中→用保鲜膜封口,并用橡皮筋扎紧→置于80 ℃水浴加热50 min→立即放入冰水中冷却20 min→存放于4 ℃冰箱中过夜→恢复到室温→测定凝胶强度。
(2)凝胶强度的测定:测试前速度5 mm/s,测试速度2 mm/s,测试后速度5 mm/s,测试距离为15 mm,选用P/5探头,凝胶强度用硬度即探头下压过程中的最大感应力(g)表示,重复3次取平均值。
1.3.3 蛋黄粉溶液热凝胶持水力测定
参照HANDA 等[8]研究方法,略有改动。蛋黄溶液按照质量比为1∶3向蛋粉中加入蒸馏水进行配制。量取5 mL蛋黄溶液于离心管中,于80 ℃水浴40 min,立即在冰水中冷却至25℃后,8 000×g离心20 min,小心将离心液倒出,称取沉淀质量。蛋黄粉溶液热凝胶持水力(water holding capacity,WHC)按照公式(1)进行计算:
(1)
式中:m0为离心之前蛋黄凝胶质量,g;m1为离心之后沉淀的质量,g。
1.3.4 乳化性测定
根据GUO等[9]的研究方法进行调整。在25 ℃下,将不同条件下制得蛋黄粉末加入蒸馏水中制备质量分数为0.5%的蛋黄溶液。将15 mL蛋黄溶液和15 mL大豆油加入高速匀浆机,在10 000 r/min匀浆均质2 min。然后立即从乳液底部吸取50 μL与5 mL 1 g/L SDS溶液混合,并在500 nm波长下测量混合物的吸光度。用乳化活性指数(emulsification activity index,EAI)和乳化稳定性指数(emulsification stability index,ESI)来评价乳化性质,EAI可根据蛋白乳液的吸光值确定,ESI按照公式(2)进行计算:
(2)
式中:A0和A10是蛋白乳液在0和10 min下测定吸光度值。
1.3.5 表面巯基数测定
参考BEVERIDGE等 [10]方法略作修改。75 mg蛋黄粉样品用1 mL Tris-甘氨酸缓冲液(10.4 g Tris,6.9 g甘氨酸,1.2 g EDTA,用0.1 mol/L HCl溶液调pH至8.0,定容至1 000 mL)混匀后加4.7 g盐酸胍,用缓冲液定容至10 mL。测定巯基时,取1 mL上述溶液加4mL脲-盐酸胍溶液和0.05 mL Ellman’s试剂,以不加Ellman’s试剂的为空白对照,于412 nm 处测定吸光值。按公式(3)计算蛋黄粉表面巯基数:
表面巯基数![]()
(3)
式中:A412为412 nm处的吸光值;D为稀释因子,为5.02;ρ为样品质量浓度,mg/mL。
1.3.6 SDS-PAGE电泳分析
参照PANOZZO [11]的方法,略有改动。采用SDS-PAGE进行电泳分析,并分析TGase对蛋黄粉中蛋白质的交联情况。
1.3.7 FTIR
本实验参照葛绍阳等[12]的研究方法进行测定。取在不同处理条件下制得的蛋黄粉与KBr,研磨均匀,压片。实验条件:光谱分辨率4 cm-1,测量范围4 000~400 cm-1,扫描信号累加32次,对蛋黄粉中蛋白质二级结构进行分析,探究TGase处理对蛋黄粉品质影响的机理。
1.4 数据统计与分析
实验均重复3次,数据结果均采用均值±标准差形式。FTIR实验数据采用OMNIC 8.0及Origin 9_64软件处理及绘图。实验数据采用SPSS软件进行统计学分析处理,数据差异性采用单因素方差分析中的最小显著差异法,P<0.05表示差异显著。
2 结果与分析
2.1 不同TGase添加量的蛋黄粉凝胶性的变化
由图1可知,随TGase添加量的增加,蛋黄粉的凝胶性和WHC均呈现先增加后降低的趋势,在TGase添加量为1.5 U/g蛋黄时均达到最大。在TGase添加量为0~1.5 U/g蛋黄范围内,随着TGase添加量的增加,促使蛋黄中蛋白质交联形成分子质量相对较大的蛋白,形成的网络结构能结合更多的水分子,因此样品的WHC和凝胶硬度也随之增强,当TGase添加量为1.5 U/g 蛋黄时,TGase 对蛋黄中的蛋白质交联作用达到最佳。但当TGase添加量超过1.5 U/g 蛋黄时,随着酶的添加,蛋黄粉的凝胶强度和保水性开始下降,可能是因为交联过度,形成的凝胶网络结构致密,不利于与周围自由水水分子的结合,从而使WHC和凝胶硬度均降低[13]。
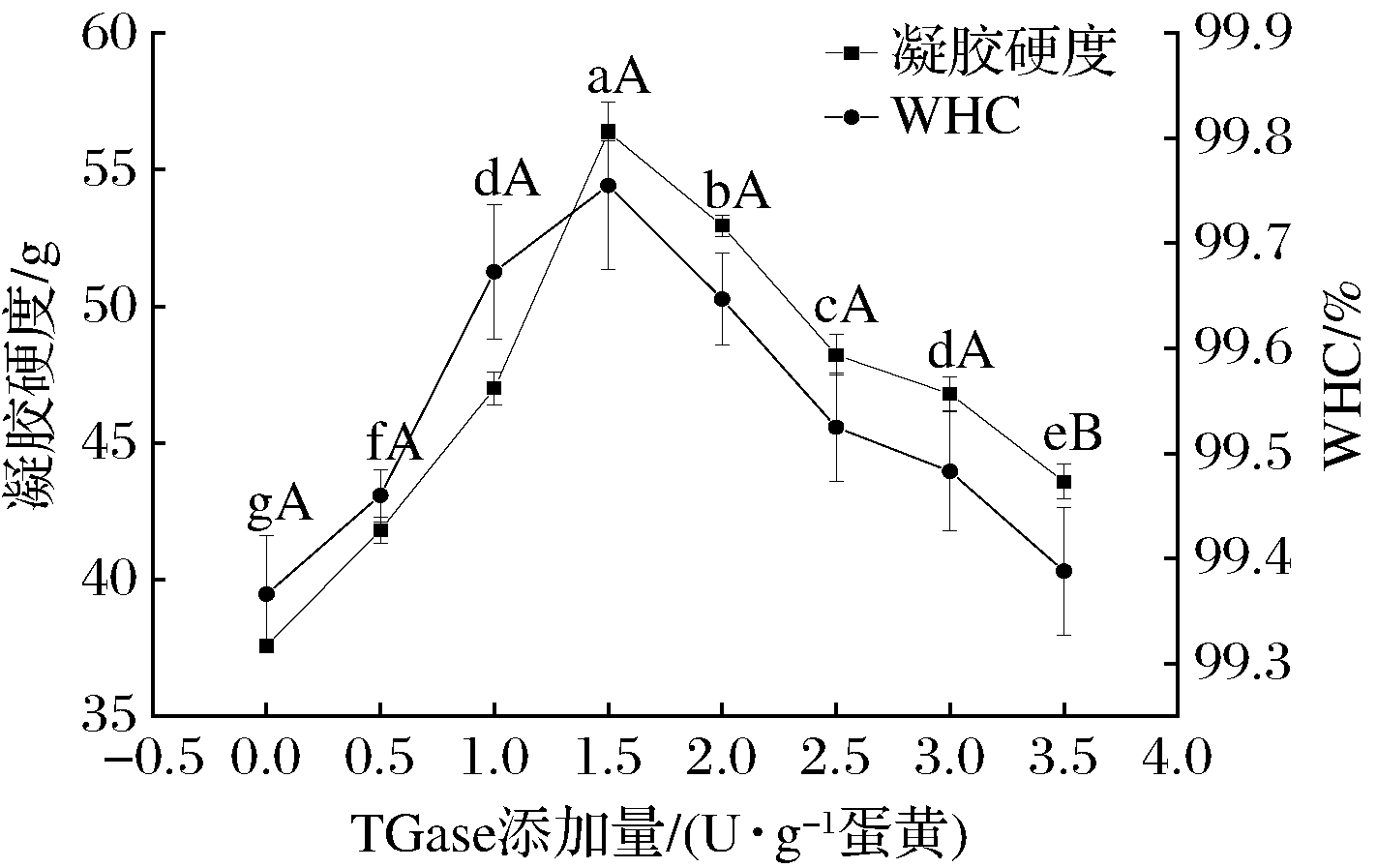
图1 TGase添加量对蛋黄粉的凝胶性和持水性的影响
Fig.1 Effect of TGase closagen on the gel hardness and water holding capacity of egg yolk powder
注:a-g和A-B分别表示不同TGase添加量的蛋黄粉凝胶硬度和持水性具有显著差异
2.2 不同TGase添加量的蛋黄粉乳化性的变化
由图2可知,随着TGase添加量的增加,蛋黄粉的EAI呈现先升高后降低的趋势,在蛋黄粉添加量为2 U/g蛋黄时达到最大。在TGase添加量为0~2 U/g蛋黄范围内,随着酶添加量的增加蛋白质聚合物增多,使油水界面单位面积的蛋白质聚合物数量增加,降低了油水界面的表面张力,因此EAI增大。当TGase添加量超过2 U/g蛋黄时,过度交联会使蛋白质聚集的效果增强,蛋白质溶解度降低,油水界面单位面积的蛋白质数量减少,因此EAI减小。
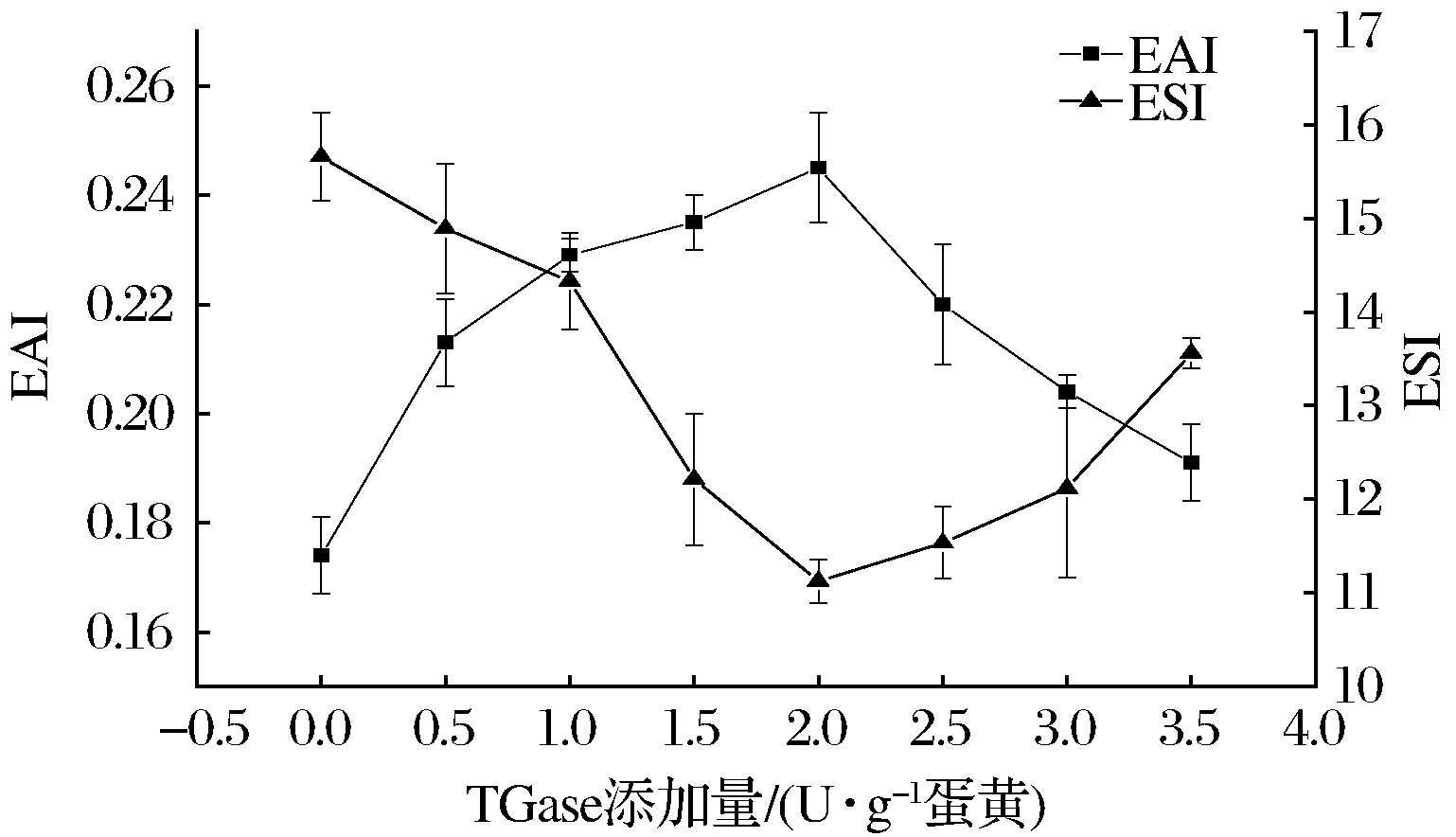
图2 TGase添加量对蛋黄粉的乳化性的影响
Fig.2 Effect of TGase closage on the emulsifying properties of egg yolk powder
蛋黄粉的ESI随 TGase 添加量的增加呈现先降低后升高的趋势,在 TGase 添加量为 2 U/g 蛋黄时,取到最小值,在 TGase 添加量为 0~2 U/g 蛋黄范围内,随着 TGase 添加量的增加,蛋黄中蛋白质 的交联程度越来越大,小分子交联形成较大分子量的蛋白质,使得微粒尺寸增大,ESI 降低,当 TGase 添加量超过 2 U/g 蛋黄时,交联过度,大分子蛋白质网络结构更加紧密,微粒尺寸减小,ESI 升高[14]。
2.3 TGase对蛋黄粉凝胶表面巯基数的影响
由图3可知,随TGase添加量的增加,蛋黄粉凝胶表面巯基数呈现逐渐降低的趋势,在酶添加量大于2 U/g蛋黄时下降较快。随着TGase添加量的增加,小分子蛋白质交联形成一定空间网络结构的大分子蛋白质,水分子进入此空间可能与蛋白质肽链发生结合,使肽链间的巯基裂解转化为二硫键(二硫键是凝胶形成过程中最主要的作用力),导致巯基数减少。当交联过度时,形成的网络空间更加紧密,巯基被包埋于蛋白质内部[15],以及TGase发挥交联作用时,新形成的交联肽链中含有硫氨基酸,硫氨基酸之间相互接近,通过氧化形成二硫键,导致巯基数下降较快[16]。
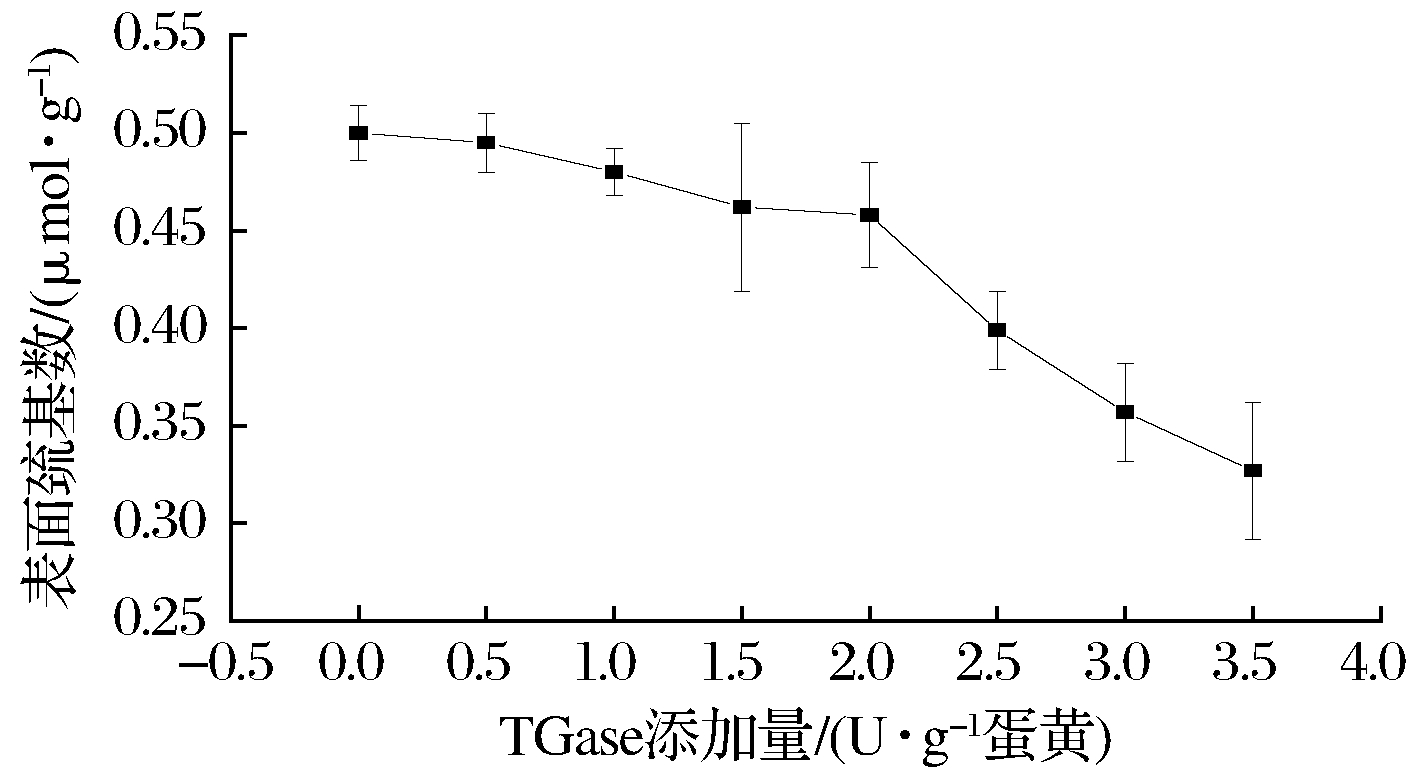
图3 TGase对蛋黄粉凝胶表面巯基数的影响
Fig.3 Effect of TGase addition on the gel surface thiol number of egg yolk powder
2.4 SDS-PAGE电泳分析
由图4可以看出,随TGase添加量的增加,条带c(分子质量为48 kDa)和条带d(分子质量为25 kDa)及分子质量小于25 kDa的蛋白质分子条带颜色逐渐变浅,条带a(分子质量大于245 kDa)和条带b(分子质量为180 kDa)颜色逐渐加深,在TGase添加量为1.5 U/g蛋黄时变化较明显。结合图1凝胶性测定可知,随TGase添加量的增加,小分子蛋白质交联成分子质量较大的蛋白质,且形成的凝胶网络结构有利于水分子的结合,因此小分子质量的条带变淡,当TGase添加量为1.5 U/g蛋黄时,蛋白质分子内和分子间交联反应强,过度的交联形成的大分子蛋白质数量增多,形成的凝胶网络结构紧密,不利于水分子的结合,因此大分子质量的条带颜色变深。

图4 不同TGase添加量处理的蛋黄粉蛋白SDS-PAGE电泳图
Fig.4 SDS-PAGE electrophoretogram of egg yolk powder treated by TGase under different TGaseclosage
注:泳道1~8分别是TGase添加量为0、0.5、1、1.5、2、2.5、3、3.5 U/g的蛋黄粉
2.5 蛋黄粉中蛋白质二级结构变化
对蛋黄粉功能性质贡献较大的为蛋白质成分,在正常情况下蛋白质以紧密折叠结构存在,当受到外界条件影响时,蛋白质发生变性,二级结构发生改变,导致功能性质发生变化。由图5可知,不同TGase添加量处理下的蛋黄粉中蛋白质的FTIR图谱较为相似。图谱中1 163 cm-1附近是蛋黄中碳水化合物的吸收峰,1 744和1 646 cm-1附近是蛋白质的吸收峰,2 924和2 856 cm-1附近是油脂的吸收峰,3 426 cm-1附近是水分的伸缩振动吸收峰[17]。FTIR图谱中的酰胺Ⅰ区(1 600~1 700 cm-1)是蛋白质二级结构信息量最大的部分,该区域的红外吸收主要与C![]() O的伸缩振动有关,对氢键结构非常敏感,其变化一般反映了二级结构的相应改变。
O的伸缩振动有关,对氢键结构非常敏感,其变化一般反映了二级结构的相应改变。

图5 不同TGase添加量处理下的蛋黄中蛋白质的FITR图
Fig.5 FITR spectra of egg yolk powder treated by TGase under different TGase dosage
注:曲线1~8分别是TGase添加量为0、0.5、1、1.5、2、2.5、3、3.5 U/g的蛋黄粉
BLUME等[18]研究指出,1 600~1 639 cm-1为 β-折叠,1 640~1 650 cm-1为 γ-随机结构,1 651~1 660 cm-1为 α-螺旋结构,1 661~1 700 cm-1为 β-转角结构,β+α结构被指认为是蛋白质分子内总相互作用的氢键,代表蛋白质分子的紧密程度。
对图5中不同TGase添加量处理下的蛋黄粉的图谱进行酰胺Ⅰ区分峰拟合,计算峰面积,得到蛋黄粉中蛋白质各二级结构所占的百分比。由表6可知,随TGase添加量的增加,α-螺旋百分量呈现先增加后下降的趋势,而 β-折叠百分量趋势相反,呈现先降低后增加的趋势,β+α结构含量基本无变化。适度的交联反应能促使蛋白质二级结构中的 β-折叠转化为 α-螺旋,提高乳化液油水界面的张力,能更紧致的包裹油滴,因此形成的乳液平均值粒径更小,当交联过度时,分子之间的相互作用使 α-螺旋转化为 β-折叠,乳化液油水界面的张力减小,油滴的体积增大,因此形成的乳液平均值粒径变大。
表6 不同TGase添加量处理下蛋黄中蛋白质二级结构的变化
Table 6 Changes of secondary structure of protein in egg yolk under different TGase dasage
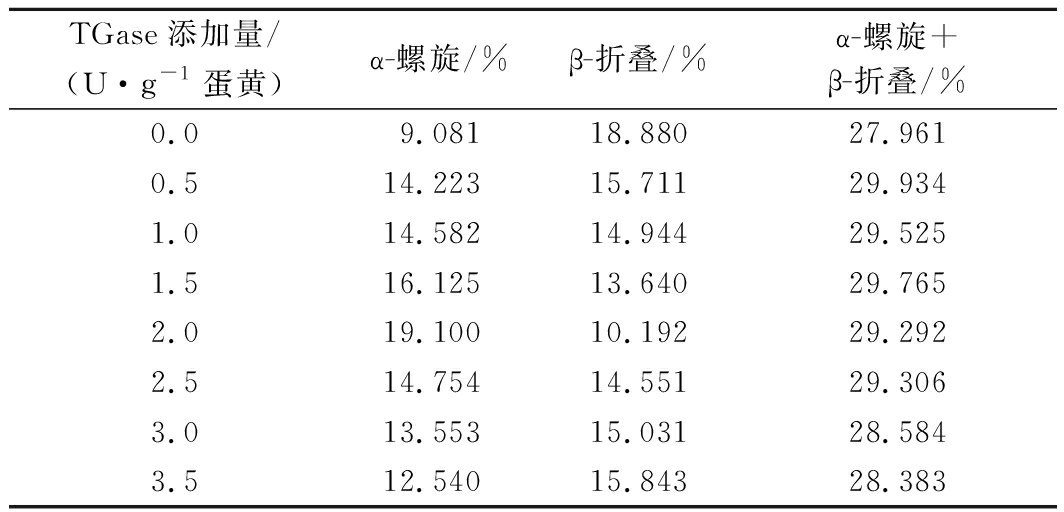
TGase添加量/(U·g-1蛋黄)α-螺旋/%β-折叠/%α-螺旋+β-折叠/%0.09.081 18.880 27.961 0.514.223 15.711 29.934 1.014.582 14.944 29.525 1.516.125 13.640 29.765 2.019.100 10.192 29.292 2.514.754 14.551 29.306 3.013.553 15.031 28.584 3.512.540 15.843 28.383
3 结论
凝胶性和乳化性能作为蛋黄粉主要的功能性质,在食品加工业中具有重要的地位[19],通过酶改性提高蛋黄粉的凝胶性和乳化性能扩大其运用领域。本实验结果表明:
(1)TGase添加量为1.5 U/g蛋黄时,由于适度的交联反应,使蛋黄粉中部分巯基转换为二硫键,以及小分子蛋白质间交联形成的网络结构有利于水分子与肽链之间的结合,水分子的结合使连接肽链间的共价键的数目增加,凝胶性硬度增强[20],因此,能获得凝胶性较高的蛋黄粉。
(2)TGase添加量为1.5 U/g蛋黄时,由于适度的交联反应能改变蛋黄中蛋白质的二级结构,使 α-螺旋结构含量增加,蛋白质中 α-螺旋结构的增加会增大蛋白质分子的柔韧性,有助于其在油水界面的吸附和展开,加快蛋白质在油水界面的扩散和吸附的速率,因此,乳化活性提高;但当交联过度时,会造成 α-螺旋内部氢键断开,解螺旋并展开,形成 β-折叠,从而降低乳化活性[12],因此,TGase添加量为1.5 U/g蛋黄时,能得到乳化性最佳的蛋黄粉。
[1] KIOSSEOGLOU V.Egg yolk protein gels and emulsions[J].Current Opinion in Colloid and Interface Science,2003,8(4):365-370.
[2] MONICA P,TONG W,NURIA C A.Characterization of mayonnaise properties prepared using frozen-thawed egg yolk treated with hydrolyzed egg yolk proteins as anti-gelator[J].Food Hydrocolloids,2019,96(6):529-536.
[3] FABIEN GUILMINEAU,ULRICH KULOZIK.Impact of a thermal treatment on the emulsifying properties of egg yolk.Part 1:Effect of the heating time[J].Food Hydrocolloids,2005,20(8):1 105-1 113.
[4] 乔立文,杨新宇,杨严俊.热处理对于鸡蛋全蛋液功能性质的影响[J].食品工业科技,2011,32(11):134-137.
QIAO L W,YANG X Y,YANG Y J.Effect of heat-treatment on the functional properties of whole egg[J].Science and Technology of Food Industry,2011,32(11):134-137.
[5] LUCILLA S,DIANA I S,IRIS A,et al.Combination of transglutaminase and sourdough on gluten-free flours to improve dough structure[J].Amino Acids,2016,48(10):2 453-2 465.
[6] QIU C Y,HU X,LI L H,et al.Effect of transglutaminase cross-linking on the conformational and emulsifying properties of peanut arachin and conarachin fractions[J].European Food Research and Technology,2016,243(6):913-920.
[7] 车永真. 高凝胶性蛋清粉的研究[D].无锡:江南大学,2008:8-9.
CHE Y Z.The study of high gel strength egg white powder[D].Wuxi:Jiangnan University,2008:8-9.
[8] HANDA A,TAKAHASHI K,KURODA N,et al.Heat-induced egg white gels as affected by pH[J].Journal of Food Science,1998,63(3):403-407.
[9] GUO Q,MU T H.Emulsifying properties of sweet potato protein:Effect of protein concentration and oil volume fraction[J].Food Hydrocolloids,2011,25(1):98-106.
[10] BEVERIDGE T,TOMA S J,NAKAI S.Determination of SH-and SS-groups in some food proteins using Ellman’s reagent[J].Journal of Food Science,2006,39(1):49-51
[11] PANOZZO A,MANZOCCO L,CALLIGARIS S,et al.Effect of high pressure homogenisation on microbial inactivation,protein structure and functionality of egg white[J].Food Research International,2014,62(8):718-725.
[12] 葛绍阳, 刘美玉,朱珺,等.应用FTIR法研究磷脂酶A2改性蛋黄粉乳化性的构效关系[J].光谱学与光谱分析,2011,31(8):2 090-2 093.
GEI S Y,LIU M Y,ZHU J,et al.FTIR analysis of cosrelation between emulsifying properties and the secondary structure of the proteins in modified egg yolk powder[J].Spectroscopy and Spectral Analysis,2011,31(8):2 090-2 093.
[13] 徐幸莲, 程巧芬,周光宏.转谷氨酰胺酶对蛋白质凝胶性能的影响[J].食品科学,2003,24(10):38-43.
XUN X L,CHENG Q F,ZHOU G H.Gelling properties of proteins modified by transglutaminase[J].Food Science,2003,24(10):38-43.
[14] YANG G,JUN H L,CUI H C,et al.Effect of enzymatic hydrolysis on heat stability and emulsifying properties of egg yolk[J].Food Hydrocolloids,2019,97(7):1-7.
[15] 胡晓. 酶法交联与微射流均质改性花生蛋白及其结构与功能特性研究[D].广州:华南理工大学,2011:55-56.
HU X.Effects of enzymatic cross-linking and microfluidization treatment on conformational and functional properties of peanut protein[D].Guangzhou:South China University of Technology,2011:55-56.
[16] AHN H J,KIM J H,NG P K W.Functional and thermal properties of wheat,barley,and soy flours and their blends treated with a microbialtrans glutaminase[J].Journal of Food Science,2005,70(6):380-386.
[17] Subramanian A,HARPER W J,RODRIGUEZ-SAONA H L.Cheddar cheese classification based on flavor quality using a novel extraction method and Fourier transform infrared spectroscopy[J].Journal of Dairy Science,2009,92(1):87-94.
[18] BLUME K,DIETRICH K,LILIENTHAL,et al.Exploring the relationship between protein secondary structures,temperature-dependent viscosities,and technological treatments in egg yolk and LDL by FTIR and rheology[J].Food Chemistry,2015,173:584-593.
[19] 周长旭. 鸡蛋热诱导凝胶形成及凝胶特性的研究[D].南京:南京农业大学,2012:2-12.
ZHOU C X.Study on heat-induced gel formation and gel properties of egg[D].Nanjing:Nanjing Agricultural University,2012:2-12.
[20] 雷明辉, 叶劲松,张铭容,等.谷氨酰胺转氨酶对鸡蛋蛋白热凝固性的影响[J].食品工业科技,2015,36(13):143-149.
LEI M H,YE J S,ZHANG M R,et al.Effect of transglutaminase on the heat coagulation of egg white[J].Science and Technology of Food Industry,2015,36(13):143-149.