海藻糖是一种甜度较低的非还原性二糖,在生物细胞中与蛋白质或脂质之间形成的氢键在胁迫条件下具有稳定细胞膜和蛋白质结构的特性[1-2]。相较葡萄糖等其他糖类,化学性质稳定,可以通过影响细胞壁的合成而对细胞的生长和毒力产生影响[3]。由于海藻糖的特殊性,在食品领域不仅可以作为食品添加剂与其他甜味剂混合使用来降低甜味剂产生龋齿的副作用,还可以防止食品中的蛋白质在干燥或冷冻环境中发生变性[4];在化妆品领域,海藻糖由于自身所具有的保湿性而广泛应用于化妆品中,可有效地缓解皮肤的干燥问题[5];在医学领域,可制成衍生物用于抗癌剂[6]、抗肿瘤剂[7]中,作为功能糖可防止代谢综合症[8]、缓解亨廷顿病[9]和有助于治疗许多涉及氧化应激和自噬功能障碍的慢性疾病[10];在农业领域,海藻糖可增强农作物的抗逆性[11-12],运用转基因技术培育耐盐碱型农作物、抗冻果蔬等[13]。
目前主要通过化学合成、微生物发酵和提取、酶合成方法制备海藻糖[11,14]。其中酶合成法大多与基因工程技术联用[15-18],虽然该方法可有效提高海藻糖的合成率,但应用于食品等领域因涉及转基因问题,需要引起人们的特别重视。从食品级微生物如酿酒酵母或面包酵母中提取或通过发酵的方法来合成海藻糖的研究受到广泛重视[19-20]。研究表明,在干燥、高温、高渗透等恶劣环境下,酵母内的应激物代谢机制导致其胞内海藻糖积累量会明显上升[21-23],改变细胞培养条件是提高海藻糖产量的关键之一。
因此,为实现利用食品级微生物并通过微生物发酵这一途径合成海藻糖的目的,本研究以从蜂蜜中分离并经保藏的耐高糖酵母LGL-2为研究对象,由于该酵母具有耐高渗的特性,应激物代谢更为活跃使其具有高产海藻糖的能力[24],并通过单因素和响应面试验确定其高产海藻糖的最优培养条件,为该菌株的产业化应用提供参考。
1 材料与方法
1.1 实验菌株
蜂蜜接合酵母LGL-2,保藏于中国典型培养物保藏中心,菌种保藏号为:CCTCC M 2016787。
1.2 试剂与仪器
葡萄糖,广东环凯微生物科技股份有限公司;无水亚硫酸钠、蒽酮,天津市福晨化学试剂厂;浓硫酸,天津市大茂化学试剂厂;苯酚,西陇科学股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),天津市永大化学试剂有限公司;酒石酸钾钠,天津市百世化工有限公司;以上试剂均为分析纯。
高速冷冻离心机(Neo15R),上海力申科学仪器有限公司;双光束紫外可见分光光度计(TU-1901),北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 菌种的活化与扩培
从超低温冰箱中取出蜂蜜接合酵母LGL-2,于28 ℃培养箱中培养30 min。制备糖质量浓度为700 g/L的试管斜面固体培养基,挑取1环酵母在培养基斜面划线培养96 h,直至出现菌落。从斜面中挑取2环活化的菌株于10 mL糖质量浓度为400 g/L的培养液中,28 ℃、180 r/min恒温摇床培养48 h后,将10 mL发酵液倒入90 mL糖质量浓度为400 g/L的培养液中,28 ℃、180 r/min恒温摇床培养48 h,即成接种液。
1.3.2 酵母细胞中海藻糖的提取
将100 mL发酵液分成2份,参照酵母细胞中海藻糖的提取方法[25],利用高温使酵母的细胞壁破裂,使其胞内海藻糖流出。处理完后取1 g酵母泥加入10 mL去离子水,经水浴和离心即得酵母海藻糖提取液。
1.3.3 海藻糖的测定
蒽酮-硫酸比色法结合DNS比色法测得的非还原糖含量与高效液相色谱法测得的结果相似[26],可用来简便地测量海藻糖含量。
1.3.3.1 DNS比色法测还原糖
取1 mL待测液,采用DNS法[27]测定发酵液中的还原糖质量浓度(ρ1),单位为mg/mL。
1.3.3.2 蒽酮-硫酸比色法测总糖
取待测溶液2 mL,参照蒽酮-硫酸比色法[28]检测发酵液中的吸光度A。
1.3.3.3 海藻糖的含量计算
标准曲线方程如表1所示。
表1 比色法的标准曲线方程及相关系数
Table 1 Standard curve equation and correlation coefficient of colorimetry

海藻糖的含量按公式(1)计算:
(1)
式中:ρ,海藻糖含量,mg/g;f,海藻糖提取液的稀释倍数;m,所得酵母泥的干质量,g;10,酵母泥的稀释倍数。
1.3.4 单因素试验
1.3.4.1 发酵时间对蜂蜜接合酵母积累海藻糖的影响
以体积分数为10%的接种量将蜂蜜接合酵母接种在糖质量浓度为400 g/L的培养液中,在28 ℃,180 r/min的摇床中分别培养 48、60、72、84 和96 h,发酵结束后按照1.3.2和1.3.3小节中的方法对酵母胞内海藻糖进行提取和测定。
1.3.4.2 接种量对蜂蜜接合酵母积累海藻糖的影响
分别以体积分数为4%、6%、8%、10%和12%的接种量,将蜂蜜接合酵母接种在糖质量浓度为400 g/L的培养液中,在28 ℃,180 r/min的摇床中培养84 h,发酵结束后按照1.3.2和1.3.3小节中的方法对酵母胞内海藻糖进行提取和测定。
1.3.4.3 培养温度对蜂蜜接合酵母积累海藻糖的影响
以最适接种量将蜂蜜接合酵母接种在糖质量浓度为400 g/L的培养液中,分别在20、24、28、30 和32 ℃和180 r/min的摇床中分别培养84 h,发酵结束后按照1.3.2和1.3.3小节中的方法对酵母胞内海藻糖进行提取和测定。
1.3.4.4 葡萄糖初始质量浓度对蜂蜜接合酵母积累海藻糖的影响
以最适接种量将蜂蜜接合酵母接种在糖质量浓度分别为300、400、500、600和700 g/L的培养液中,在最适温度和180 r/min的摇床中分别培养84 h,发酵结束后按照1.3.2和1.3.3小节中的方法对酵母胞内海藻糖进行提取和测定。
1.3.4.5 转速对蜂蜜接合酵母积累海藻糖的影响
以最适接种量将蜂蜜接合酵母接种在最适糖质量浓度的培养液中,以最适温度,在摇床转速分别为90、120、150、180和210 r/min的摇床中分别培养84 h,发酵结束后按照1.3.2和1.3.3小节中的方法对酵母胞内海藻糖进行提取和测定。
1.3.5 Box-Behnken响应面试验
选取发酵时间、培养温度、葡萄糖初始质量浓度3个因素,借助实验设计软件Design-Expert(Version 8.0.6),以海藻糖的产量为响应值,设计3因素3水平的响应面优化实验。再拟定回归方程确定蜂蜜接合酵母积累海藻糖的最佳参数。利用响应面模型优化的最佳培养条件进行发酵实验,以海藻糖最高产量的试验组进行验证实验。
1.4 数据处理
每个实验重复3次,取平均值。采用SPSS 17.0进行单因素方差分析与显著性差异分析,运用Origin 9.0软件进行作图,Design-Expert 8.0.6进行Box-Behnken试验设计。
2 结果与分析
2.1 单因素试验结果
2.1.1 发酵时间对蜂蜜接合酵母积累海藻糖的影响
由图1可知,在酵母的发酵时间由48 h增加到84 h的过程中,酵母积累代谢产生的海藻糖随发酵时间的增加而明显增多,发酵84 h时,海藻糖积累量达到最大值,此时的海藻糖含量为65.27 mg/g;当发酵时间大于84 h时,随着发酵时间的增加,海藻糖的积累量不再呈上升趋势,因此,选取84 h为蜂蜜接合酵母的最佳发酵时间。根据以往研究,该酵母在50 h左右进入平稳期,开始积累代谢产物,84 h时代谢产物积累量达到最大,菌体开始进入衰亡期。王玲等[29]研究了菠萝果酒酵母菌的生长曲线,发现在对数生长期时海藻糖几乎没有积累,但当到达稳定期时,酵母细胞内的海藻糖-6-磷酸合成酶的活性大幅度提高,本实验结果与其一致,解释了海藻糖含量在48~84 h内的激增原因。
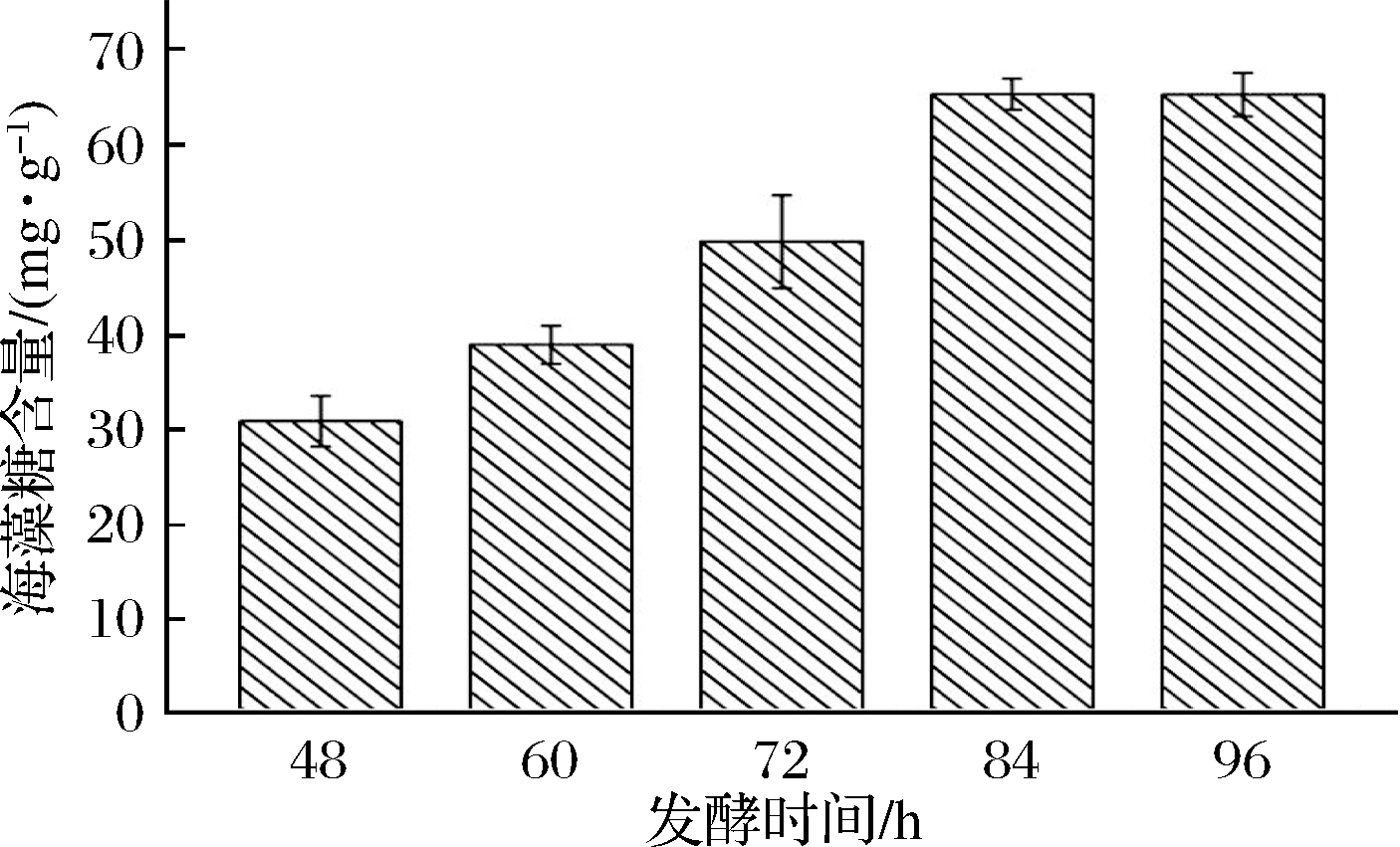
图1 发酵时间对蜂蜜接合酵母积累海藻糖的影响
Fig.1 Effects of fermentation time on trehalose production in yeast
2.1.2 接种量对蜂蜜接合酵母积累海藻糖的影响
由图2可知,当酵母的接种量从4%(体积分数)提升到10%时,酵母积累代谢产生的海藻糖随着接种量的提高而逐渐增加,接种量为10%时海藻糖积累量达到最大值,此时的海藻糖含量为68.22 mg/g;当接种量大于10%时,海藻糖的积累量随着接种量的提高反而明显下降,因此,选取10%接种量为蜂蜜接合酵母的最佳接种量。当接种的酵母数量过多时,在基质浓度一定的培养环境中,酵母菌得不到足够的营养物质,反而会导致其生长代谢受限制,同时,海藻糖作为细胞的代谢产物有可能作为供能物质而被消耗,致使海藻糖含量降低;当接种的酵母数量过少时,菌体的群体数量相对减少,导致整体的发酵速度缓慢,积累代谢产生海藻糖的量也随之减少。柴丽红等[30]以酿酒酵母为实验材料,研究了接种量对其海藻糖积累量的影响,发现当接种量为10%时,酵母中海藻糖产量达到最大值,说明过高或过低的接种量都会导致海藻糖的产量下降。
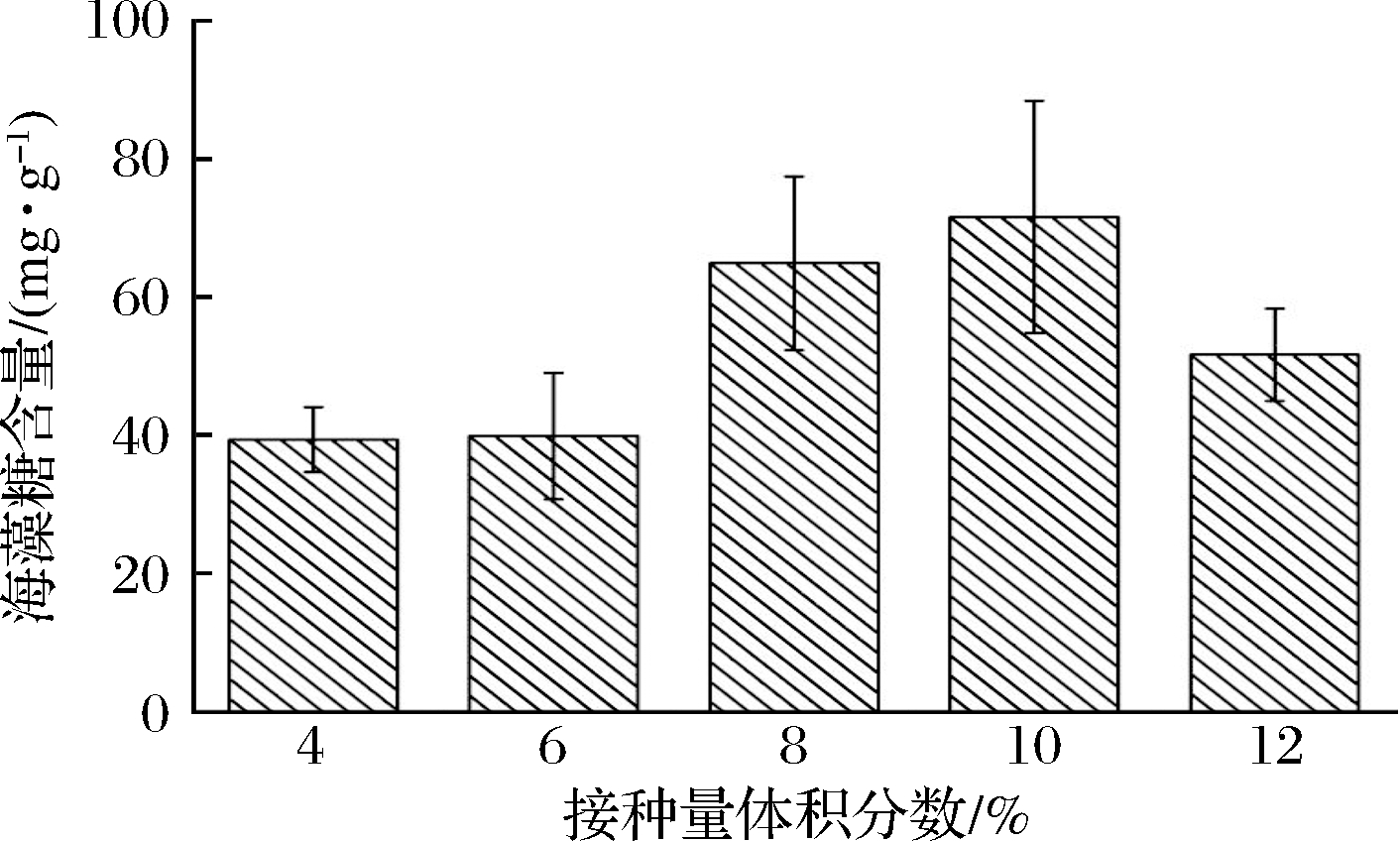
图2 接种量对蜂蜜接合酵母积累海藻糖的影响
Fig.2 Effects of inoculum on trehalose production in yeast
2.1.3 培养温度对蜂蜜接合酵母积累海藻糖的影响
由图3可知,当培养温度在20~28 ℃范围内上升时,酵母积累代谢产生的海藻糖随着培养温度的上升而逐渐增加,培养温度为28 ℃时海藻糖积累量达到最大值,此时的海藻糖含量为71.10 mg/g;当培养温度达到32 ℃时,海藻糖的积累量没有明显的变化,但超过32 ℃后,海藻糖累积量随着培养温度的升高反而明显下降,考虑能耗问题,选取28 ℃为蜂蜜接合酵母的最佳培养温度。过低的温度会抑制酵母细胞内与海藻糖合成相关酶的活性,导致海藻糖的积累量降低;而这些酶的活性会随着温度的升高而增强,逐渐积累海藻糖;但过高的温度也会影响酵母的生长繁殖,因此,要在适当范围内提高培养温度。赵玉巧[31]在5 L发酵罐中研究温度对酿酒酵母积累海藻糖的影响,发现在37 ℃时海藻糖产量达到最高为182 mg/g,而菌体生物量则在27 ℃时达到最大,说明海藻糖积累的最适温度与菌株的最适生长温度不一致,这与海藻糖需要在苛刻环境下才会在微生物体内大量积累的结论相吻合[32]。
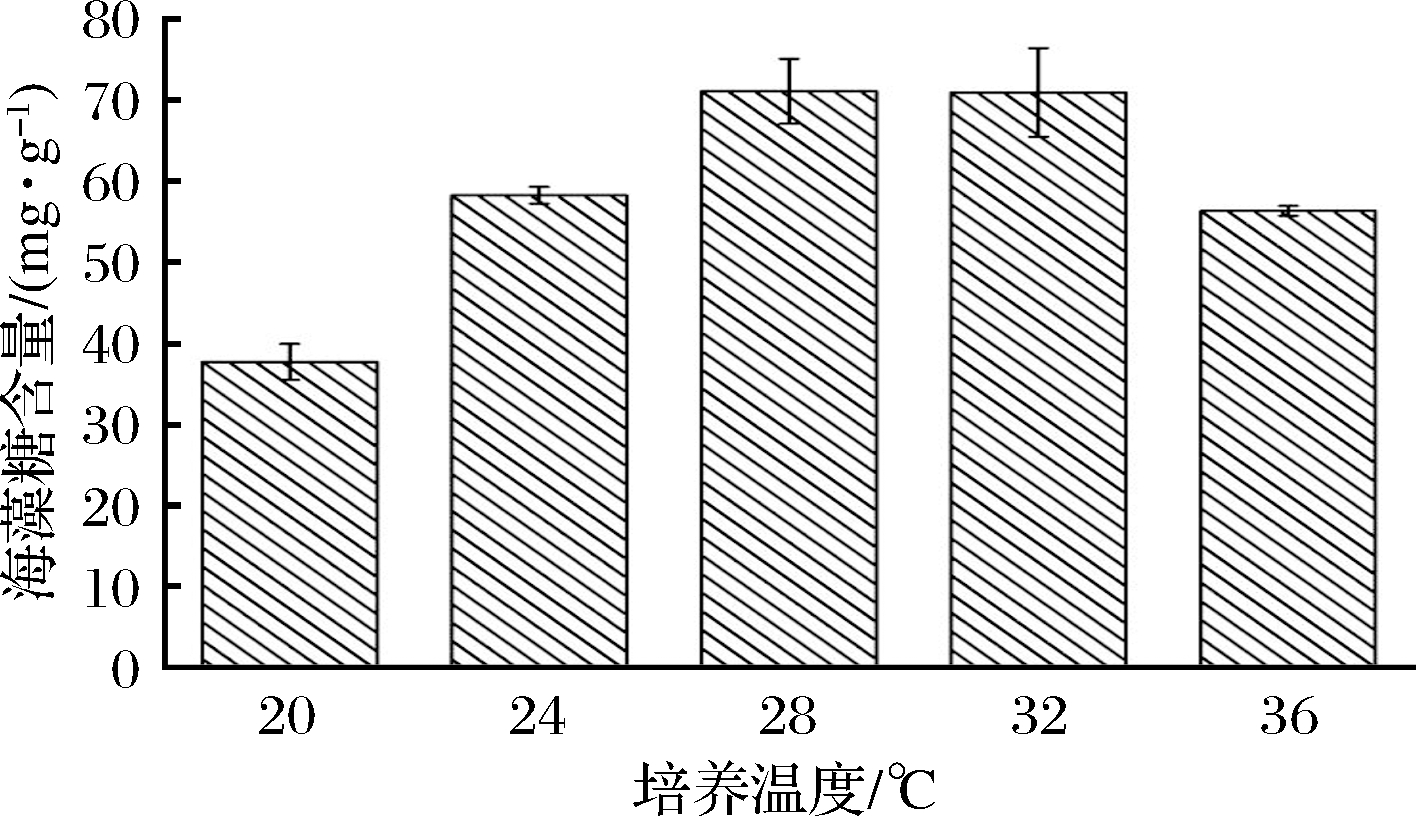
图3 培养温度对蜂蜜接合酵母积累海藻糖的影响
Fig.3 Effects of culture temperature on trehalose production in yeast
2.1.4 葡萄糖初始质量浓度对蜂蜜接合酵母积累海藻糖的影响
由图4可知,当发酵液的起始糖质量浓度由300 g/L升高至400 g/L时,酵母积累代谢产生的海藻糖随着葡萄糖初始质量浓度的升高而逐渐增加,发酵液的起始糖质量浓度为400 g/L时海藻糖积累量达到最大值,此时的海藻糖含量为42.47 mg/g;当葡萄糖初始质量浓度高于400 g/L时,海藻糖的积累量随着糖质量浓度的提高反而明显下降,因此,选取400 g/L为蜂蜜接合酵母的最佳葡萄糖初始浓度。海藻糖是重要的抗高渗保护剂,在一定范围内的高渗环境胁迫下,蜂蜜接合酵母会应激产生更多的海藻糖来对抗外界的不良环境;但当发酵液的糖质量浓度过高时,外界的高渗透压就会对酵母细胞产生毒害作用,使酵母的活性减弱,影响酵母的生长。彭郦等[23]研究了起始糖质量浓度对酿酒酵母生物量和海藻糖积累量的影响,发现糖质量浓度对细胞数量的增长影响不大,而在180~400 g/L的糖质量浓度范围内,酵母胞内海藻糖的积累量随着糖质量浓度的提高而增加。
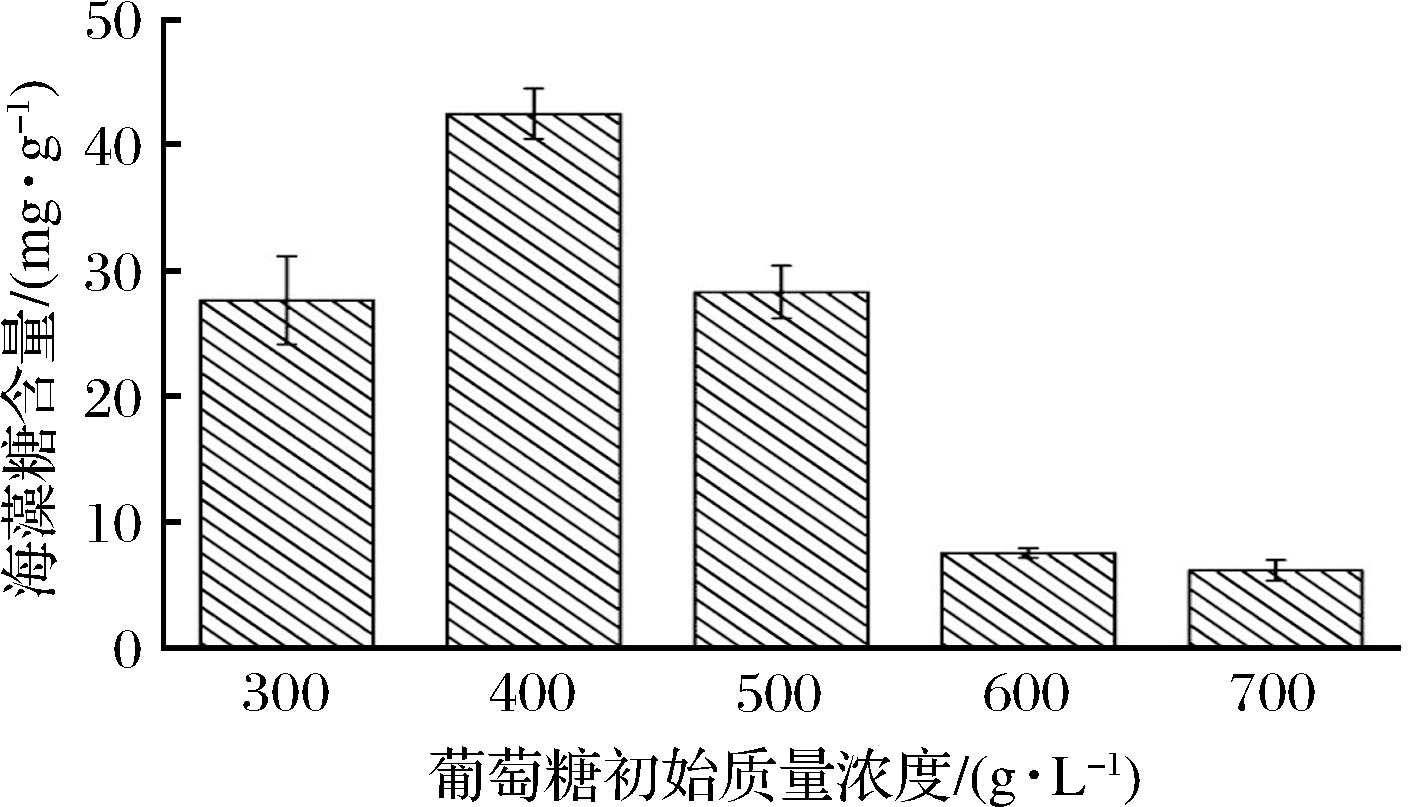
图4 葡萄糖初始质量浓度对蜂蜜接合酵母积累海藻糖的影响
Fig.4 Effects of glucose initial concentration on trehalose production in yeast
2.1.5 转速对蜂蜜接合酵母积累海藻糖的影响
由图5可知,摇床的转速由90 r/min升高至210 r/min时,酵母积累代谢产生的海藻糖随着摇床转速的增加而逐渐增加,摇床转速为210 r/min时海藻糖积累量达到最大值,此时的海藻糖含量为42.99 mg/g;虽然海藻糖含量在210 r/min时达到最大,但与转速在180 r/min时相差不大,考虑成本等问题,选用180 r/min为最适摇床转速。摇床转速的增加有利于加速氧的溶解,发酵前期为酵母的生长期,氧气的快速溶解有利于酵母的大量生长繁殖,因此,发酵后期海藻糖的积累量也增多;当摇床转速达到180 r/min时,酵母的生长量已经达到了极限,因此,再增加转速对酵母的生长繁殖影响不大。郑辉杰等[33]研究了摇床转速对酿酒酵母积累海藻糖的影响,发现海藻糖的产量随着摇床转速的增加而增加,即使转速达到240 r/min,对海藻糖的积累并无不利的影响。

图5 转速对蜂蜜接合酵母积累代谢产生海藻糖的影响
Fig.5 Effects of rotational speed on trehalose production inyeast
2.2 响应面优化
根据单因素试验结果,综合考虑各因素对海藻糖积累量的影响,选取发酵时间、葡萄糖初始质量浓度、培养温度作为试验因素,海藻糖含量作为响应值设计试验,共17个设计点。响应面的实验设计及结果见表2。
表2 响应面实验结果
Table The response surface with results
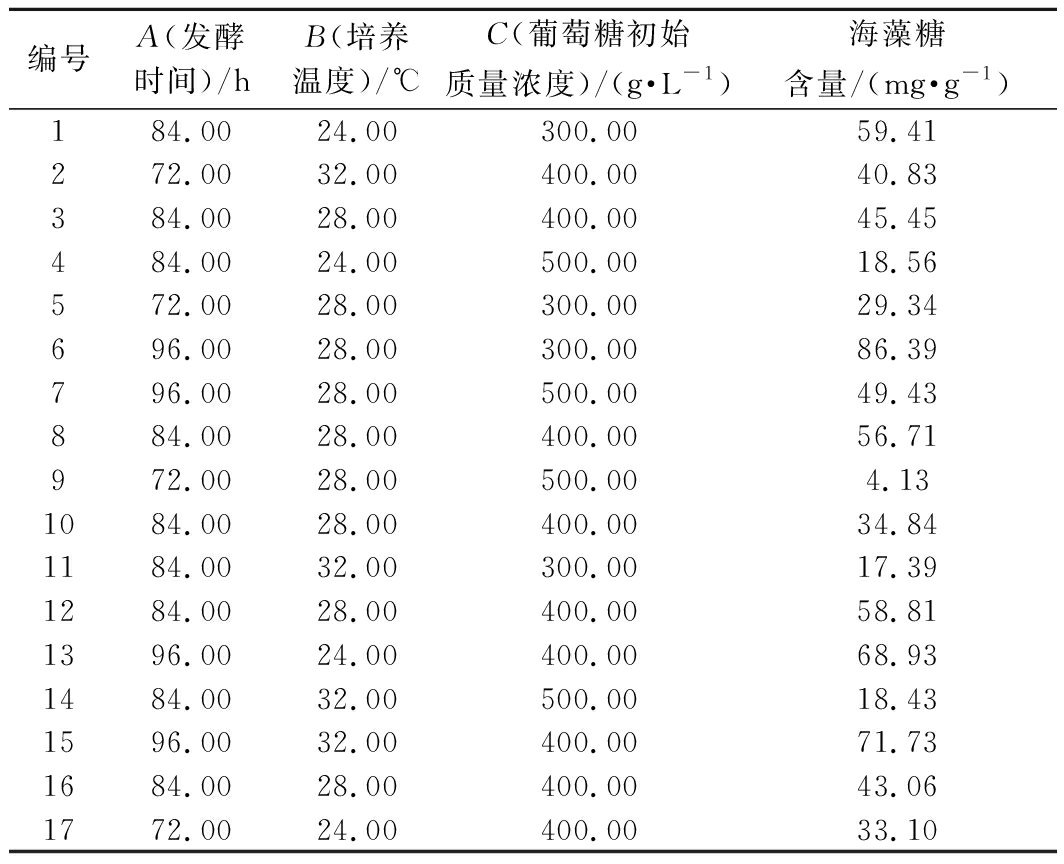
编号A(发酵时间)/hB(培养温度)/℃C(葡萄糖初始质量浓度)/(g·L-1)海藻糖含量/(mg·g-1)184.0024.00300.0059.41272.0032.00400.0040.83384.0028.00400.0045.45484.0024.00500.0018.56572.0028.00300.0029.34696.0028.00300.0086.39796.0028.00500.0049.43884.0028.00400.0056.71972.0028.00500.004.131084.0028.00400.0034.841184.0032.00300.0017.391284.0028.00400.0058.811396.0024.00400.0068.931484.0032.00500.0018.431596.0032.00400.0071.731684.0028.00400.0043.061772.0024.00400.0033.10
使用Design-Expert(Version8.0.6)软件对以海藻糖含量为响应值进行二次多项式回归拟合分析,得到回归方程预测模型:Y=47.77+21.14A-3.95B-12.75C-1.23AB-2.94AC+10.47BC+9.88A2-4.00B2-15.32C2。
对模型进行方差分析得到的结果见表3。由表3可知,模型的P<0.05,表明该模型显著以及各因素对响应值有显著影响;失拟项P值为0.269 3>0.05,表明失拟项不显著,二次模型是合理的;R2=0.877 2,表明因变量与所考察的自变量之间的线性关系显著,该模型能解释87.72%响应值的变化。从F值的大小可知,各因素对海藻糖产量影响的强弱顺序为:A-发酵时间>C-葡萄糖初始浓度>B-培养温度,单因素A、C的P值远远小于0.05,说明发酵时间和葡萄糖初始质量浓度对蜂蜜接合酵母积累代谢海藻糖的产量有显著影响。各因素交互作用的响应面及等高线见图6。
表3 响应面方差分析
Table 3 Analysis of variance in the response surface
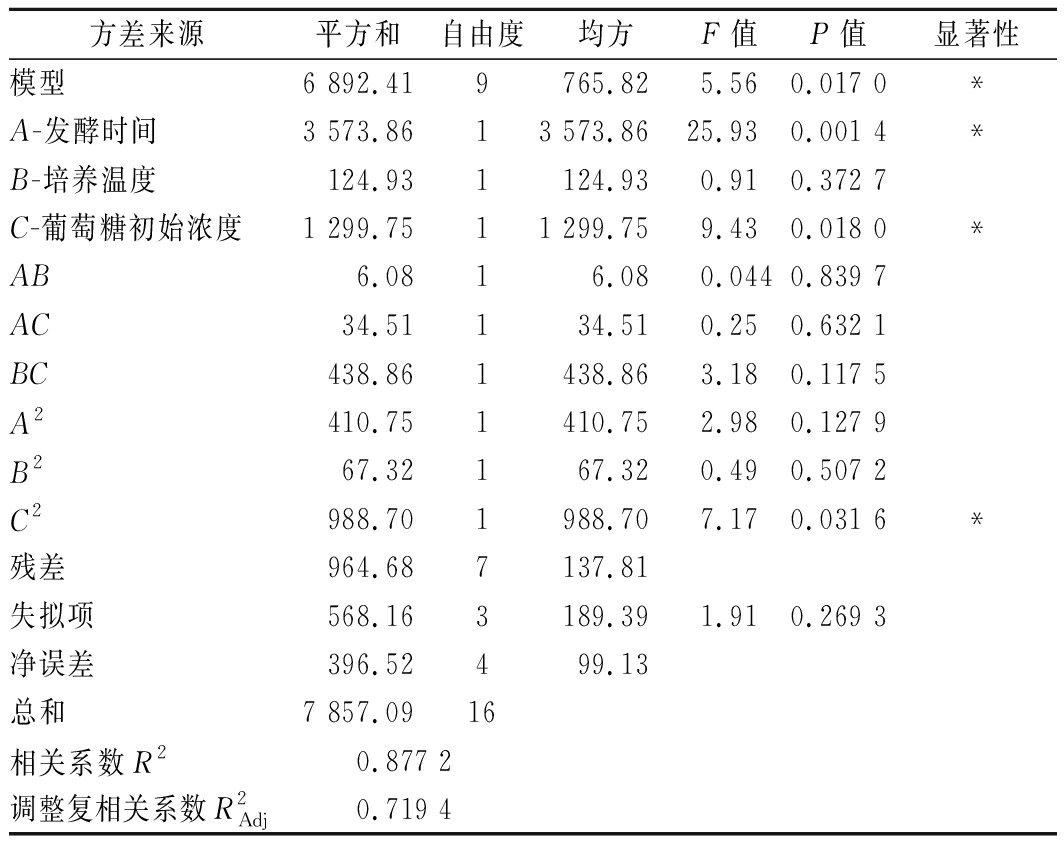
方差来源平方和自由度均方F值P值显著性模型6 892.419765.825.560.017 0*A-发酵时间3 573.8613 573.8625.930.001 4*B-培养温度124.931124.930.910.372 7C-葡萄糖初始浓度1 299.7511 299.759.430.018 0*AB6.0816.080.0440.839 7AC34.51134.510.250.632 1BC438.861438.863.180.117 5A2410.751410.752.980.127 9B267.32167.320.490.507 2C2988.701988.707.170.031 6*残差964.687137.81失拟项568.163189.391.910.269 3净误差396.52499.13总和7 857.0916相关系数R20.877 2调整复相关系数R2Adj0.719 4
注:*表示P<0.05

图6 各因素交互作用对蜂蜜接合酵母中海藻糖产量影响的响应面图
Fig.6 Response surface diagram of the effects of interaction of various factors on trehalose yield in yeast
2.3 验证实验
根据所建立的数学模型,用Design-Expert 8.0.6软件对方程进行求解,得到蜂蜜接合酵母积累代谢产生海藻糖的最佳发酵条件为:发酵时间96 h,培养温度24 ℃,葡萄糖初始质量浓度300 g/L。结合响应面试验中海藻糖最高产量的试验组进行验证实验,结果表4所示,优化后的海藻糖含量为92.32 mg/g。安宁[25]以酿酒酵母SC2为实验菌株,对其进行紫外和硫酸二乙酯逐级诱变处理,胞内海藻糖含量由48.1 mg/g提高至64.3 mg/g,后续实验可研究蜂蜜接合酵母LGL-2通过诱变、融合、基因重组等方法选育出海藻糖产量更高的菌株。
表4 验证试验设计及结果
Table 4 Verify test design and results
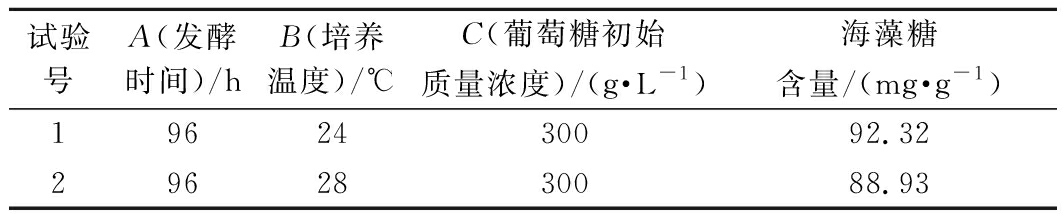
试验号A(发酵时间)/hB(培养温度)/℃C(葡萄糖初始质量浓度)/(g·L-1)海藻糖含量/(mg·g-1)1962430092.322962830088.93
3 结论
本文以蜂蜜接合酵母LGL-2为实验菌株,通过单因素试验,确定发酵时间、葡萄糖初始质量浓度与培养温度是影响海藻糖的积累量的主要因素。通过响应面优化试验,得到最佳发酵条件为:发酵时间96 h、种量10%、葡萄糖初始质量浓度300 g/L、温度24 ℃、转速180 r/min。经优化后海藻糖的产量达到了92.32 mg/g,相比优化前提高了29.34%。本实验结果中24 ℃并非该酵母的最适生长温度,但从验证实验中可知该温度下的海藻糖产量更高,说明了低温与高渗环境对酵母的应激物代谢机制具有一定影响。
[1] 杨少龙, 吕珊珊,刘波,等.海藻糖的作用及生产方法研究进展[J].食品工业,2016,37(10):212-216.
YANG S L,LV S S,LIU B,et al.Recent progress in trehalose function and production methods[J].The Food Industry,2016,37(10):212-216.
[2] MESSINA M S,KO J H,YANG Z Y,et al.Effect of trehalose polymer regioisomers on protein stabilization[J].Polymer Chemistry,2017,8(33):4 781-4 788.
[3] CORDONE L,COTTONE G,CUPANE A,et al.Proteins in saccharides matrices and the trehalose peculiarity:Biochemical and biophysical properties[J].Current Organic Chemistry,2015,19(17):1 684-1 706.
[4] 马路凯, 张宾,王晓玲,等.海藻糖、海藻胶及寡糖对蒸煮南美白对虾的抗冻保水作用[J].食品科学,2015,36(16):266-271.
MA L K,ZHANG B W,WANG X L,et al.Comparison of the cryoprotective effects of trehalose,alginate and alginate-derived oligosaccharides on cooked shrimp(Litopenaeus vannamei)[J].Food Science,2015,36(16):266-271.
[5] 张丽杰, 张雪莲,邸进申.新型食品添加剂海藻糖的发展前景[J].中国食品添加剂,2004(2):61-65.
ZHANG L J,ZHANG X L,DI J S,et al.Developmental foreground of a new food additive-trehalose[J].China Food Additives,2004(2):61-65.
[6] 朱明. 海藻糖的功能及其应用[J].粮食科技与经济,2003(5):43-44.
ZHU M.Function and application of trehalose[J].Grain Science and Technology and Economy,2003(5):43-44.
[7] CHRISTOVA,LANG S,WRAY V,et al.Production,structural elucidation and in vitro antitumor activity of trehalose lipid biosurfactant from Nocardia farcinica strain[J].Journal of Microbiology and Biotechnology,2015,25(4):439-447.
[8] ARAI C,ARAI N,MIZOTE A,et al.Trehalose prevents adipocyte hypertrophy and mitigates insulin resistance[J].Nutrition Research,2010,30(12):840-848.
[9] TANAKA M,MACHIDA Y,NIU S,et al.Trehalose alleviates polyglutamine-mediated pathology in a mouse model of Huntington disease[J].Nature Medicine,2004,10(2):148-154.
[10] MIZUNOE Y,WATANABE S,SUDO Y,et al.Trehalose protects against oxidative stress by regulating the Keap1-Nrf2 and autophagy pathways[J].Redox Biology,2018,15:115-124.
[11] 曲茂华, 张凤英,何名芳,等.海藻糖生物合成及应用研究进展[J].食品工业科技,2014,35(16):358-362.
QU M H,ZHANG F Y,HE M F,et al.Research progress in trehalose biosynthesis and applications[J].Science and Technology of Food Industry,2014,35(16):358-362.
[12] 涂国云.海藻糖的性质、生产及应用[J].山西食品工业,2003(3):33-35.
TU G Y.Properties,production and application of trehalose[J].Food Engineering,2003(3):33-35.
[13] G MEZ D L,GILDAY A,FEIL R,et al.AtTPS1-mediated trehalose 6-phosphate synthesis is essential for embryogenic and vegetative growth and responsiveness to ABA in germinating seeds and stomatal guard cells[J].The Plant Journal,2010,64(1):1-13.
MEZ D L,GILDAY A,FEIL R,et al.AtTPS1-mediated trehalose 6-phosphate synthesis is essential for embryogenic and vegetative growth and responsiveness to ABA in germinating seeds and stomatal guard cells[J].The Plant Journal,2010,64(1):1-13.
[14] 张玉华, 凌沛学,籍保平.海藻糖的研究现状及其应用前景[J].食品与药品,2005,7(3):8-13.
LING P X,JI B P.Current status of research for trehalose and its prospective applications[J].Food and Drug,2005,7(3):8-13.
[15] LEE J H,Lee K H,LIM C G,et al.Cloning and expression of a trehalose synthase from Pseudomonas stutzeri CJ38 in Escherichia coli for the production of trehalose[J].Applied Microbiology and Biotechnology,2005,68(2):213-219.
[16] 黄珍. 海藻糖合酶基因的克隆、表达及固定化研究[D].武汉:湖北工业大学,2018.
HUANG Z.Research on cloning,expression and immobilization of trehalose synthase[D].Wuhan:Hubei University of Technology,2018.
[17] 池小琴. 酿酒酵母海藻糖代谢工程与抗逆性相关机制研究[D].杭州:浙江大学,2010.
CHI X Q.The metabolic engineering of trehalose and related mechanisms of stress resistance in Saccharomyces cerevisiae[D].Hang zhou:Zhejiang University,2010.
[18] LI Ning,WANG Hengwei,LI Lijuan,et al.Integrated approach to producing high-purity trehalose from maltose by the yeast yarrowia lipolytica displaying trehalose synthase (TreS) on the cell surface[J].Journal of Agricultural and Food Chemistry,2016,64(31):6 179-6 187.
[19] 洪厚胜, 窦冰然,郭会明.基于面包酵母中海藻糖提取工艺优化及菌株筛选的高密度培养工艺[J].食品科学,2018,39(6):122-129.
HONG H S,DOU B R,GUO H M.Optimization of extraction process for trehalose from baker’s yeast for strain screening and high density culture[J].Food Science,2018,39(6):122-129.
[20] 杨晓红, 王元秀,郑明洋.响应面法优化啤酒酵母海藻糖提取工艺[J].济南大学学报(自然科学版),2013,27(3):270-274.
YANG X H,WANG Y X,ZHENG M Y,et al Optimization of extraction process for yeast trehalose by response surface method[J].Journal of University of Jinan(Science and Technology),2013(3):270-274.
[21] 池振明, 梁丽琨,朱开玲,等.酵母海藻糖的代谢与调控研究进展[J].中国海洋大学学报(自然科学版),2006(2):209-214.
CHI Z M,LIANG L K,ZHU K L,et al.Advanced in metabolism and regulation of trehalose in yeast[J].Periodical of Ocean University of China,2006(2):209-214.
[22] 胡梦蝶, 陈雄,李欣,等.不同胁迫条件对鲁氏酵母胞内海藻糖积累的影响研究[J].食品工业科技,2016,37(11):130-133.
HU M D,CHEN X,LI X,et al.Intracellular trehalose metabolism characteristics of Zygosaccharomyces rouxii under different stresses[J].Science and Technology of Food Industry,2016,37(11):130-133.
[23] 彭郦, 曾新安.高糖胁迫对生长期酿酒酵母生理代谢的影响[J].现代食品科技,2011,27(4):397-399.
PENG L,ZENG X A.Effect of High-glucose addition on metabolism of Saccharomyces cerevisiae during logarithm phrase[J].Modern Food Science and Technology,2011,27(4):397-399.
[24] MORAN J W,WITTER L D.Effect of sugars on D-arabitol production and glucose metabolism in Saccharomyces rouxii[J].Journal of Bacteriology,1979,138(3):823-831.
[25] 安宁. 酵母菌生产海藻糖的研究[D].无锡:江南大学,2012.
AN N.Study on the production of trehalose by yeast[D].Wuxi:Jiangnan University,2012.
[26] 安宁, 葛向阳,张伟国.酵母发酵过程中海藻糖的定性与定量测定[J].食品与生物技术学报,2011,30(4):636-640.
AN N,GE X Y,ZHANG W G.Qualitative and quantitative determination of trehalose in yeast extract[J].Journal of Food Science and Biotechnology,2011,30(4):636-640.
[27] 关凤梅. 生物化学实验[M].济南:山东轻工业学院,2003.
GUAN F M.Biochemistry experiment[M].Jinan:Shandong Polytechnic University,2003.
[28] 李艳玲, 张显忠,苗苗,等.蒽酮-硫酸法测定海藻糖含量显色条件的改进[J].食品工业科技,2009,30(2):296-298.
LI Y L,ZHANG X Z,MIAO M.Improvement of chromogenic conditions on trehalose determination by anthrone-sulphuric acid method[J].Science and Technology of Food Industry,2009,30(2):296-298.
[29] 王玲, 匡钰,唐德强.增香型菠萝果酒活性干酵母制备过程中内源海藻糖积累条件优化[J].热带作物学报,2013,34(7):1 347-1 353.
WANG L,KUANG Y,TANG D Q.Optimizing endogenous trehalose accumulation during the preparation of aroma-producing active dried yeast for pineapple wine[J].Chinese Journal of Tropical Crops,2013,34(7):1 347-1 353.
[30] 柴丽红, 徐磊.酿酒酵母积累海藻糖条件的研究[J].河南工业大学学报(自然科学版),2007(6):24-28.
CHAI L H,XU L.Study on trehalose accumulation conditions of Saccharomyces cerevisiae[J].Journal of Henan University of Technology(Natural Science Edition),2007(6):24-28.
[31] 赵玉巧. 产海藻糖酵母的培养条件优化研究[J].淮海工学院学报(自然科学版),2010,19(1):80-83.
ZHAO Y Q.Study on the optimized culture conditions for yeast producing trehalose[J].Journal of Huaihai Institute of Technology(Natural Science Edition),2010,19(1):80-83.
[32] 朱宝生, 刘功良,白卫东,等.耐高糖酵母筛选及其高糖胁迫机制的研究进展[J].中国酿造,2016,35(6):11-14.
ZHU B S,LIU G L,BAI W D.Screening of high-sugar-tolerant yeast and research on its high sugar stress mechanism[J].China Brewing,2016,35(6):11-14.
[33] 郑辉杰, 张洪起,刘伟,等.从啤酒废酵母中提取海藻糖的工艺研究[J].酿酒科技,2008(5):101-104.
ZHENG H J,ZHANG H Q,LIU W.Extraction of trehalose from waste beer yeast[J].Liquor-Making Science & Technology,2008(5):101-104.