藜麦是1年生藜科双子叶植物,富含蛋白质、膳食纤维、矿物质、维生素以及多酚、黄酮、皂苷等植物化学成分,被国际营养学家誉为“超级谷物”、“营养黄金”和“未来食品”[1]。长期食用具有增强耐力、降血糖、降血脂、抗肿瘤和预防心血管疾病等功效[2]。近年来,藜麦的生物活性逐渐成为研究的热点,而藜麦蛋白及其多肽的生物活性是研究热点之一。
藜麦多肽具有抗氧化、降血糖、降血脂、降血压和抗癌等活性[3]。范三红等[4]用碱性蛋白酶和风味蛋白酶对藜麦糠进行酶解,利用超滤技术分离纯化藜麦糠抗氧化肽,表明分子质量为5 k~10 ku 的抗氧化肽较其他分子质量的抗氧化活性好。NONGONIERMA等[5]采用木瓜蛋白酶对藜麦蛋白进行酶解得到具有降血糖活性的肽。叶凯等[6]用胰蛋白酶酶解得到的藜麦多肽对α-淀粉酶抑制率最好(45.54%),可作为糖尿病患者的药用添加剂。VILCACUNDO等[7]研究发现了17种藜麦多肽具有较高的抗癌能力并对3种不同细胞(Caco-2、HT-29、HCT-116)抑制率进行测定,当肽分子质量>5 ku时对结肠癌的抑制率明显高于其他肽分子质量。REN等[8]分离到的藜麦lunasin肽,在质量浓度为0.4 g/L时对NO、TNF-α和Interlenukin-6的抑制率分别为44.77%、39.81%和33.50%,具有较强的体外消炎能力。ALUKO等[9]用碱性蛋白酶酶解藜麦蛋白,经超滤膜过滤得到IC50值分别为0.075、0.015和0.030 mg/mL的多肽,均表明藜麦多肽具有降血压活性。
藜麦的食用过程与小麦等类似,加工过程会产生大量麸皮,其富含蛋白且营养丰富,但都作为饲料或被丢弃,没有被深入的开发利用,造成极大浪费[10]。目前,藜麦蛋白多肽的提取工艺多采用碱溶酸沉法提取蛋白,然后进行酶水解[5]。本研究采用2次醇沉工艺可同时得到多糖和多肽,提高了藜麦麸皮的利用率。本文以第一次醇沉得到的粗蛋白为原料,研究了不同蛋白酶对所提藜麦麸皮蛋白的酶解能力以及经不同蛋白酶酶解后多肽的活性,为藜麦麸皮的开发提供理论依据,也为后续探讨藜麦麸皮多肽的活性奠定基础。
1 材料和方法
1.1 材料与试剂
藜麦麸皮,山西省静乐县山西亿隆;牛血清蛋白、菲咯嗪(ferrozine)、酪氨酸酶、α-葡萄糖苷酶、多巴(levodopa,L-DOPA)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),Sigma 公司;中性蛋白酶Neutrase 1.5 MG、风味蛋白酶Flavourzyme 500 MG、碱性蛋白酶Alcalase 3.0 T、复合蛋白酶Protamex,诺维信生物技术有限公司;磷酸缓冲盐溶液(phosphate buffer saline,PBS)、4-硝基苯基-α-D-呲喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,PNPG)、阿卡波糖、抗坏血酸,北京索莱宝科技有限公司;福林酚试剂,国药集团化学试剂有限公司,其余试剂均为国产分析纯试剂。
1.2 仪器与设备
台式冷冻离心机(3-16KL),德国 Sigma 公司;数控超声波清洗器(KQ-500DE),昆山市超声仪器有限公司;自动凯氏定氮仪(K9840),济南海能仪器股份有限公司;台式酸度计(FE28),梅特勒-托利多集团;电热恒温鼓风干燥箱(K101-1BS),上海跃进医疗器械有限公司;紫外可见分光光度计(UV-5100B),上海元析仪器有限公司;旋转蒸发仪(SB-1300),日本EYELA 公司;酶标仪(Thermo1510),美国赛默飞世尔科技公司;冷冻干燥机(FDU-2110),日本EYELA 公司。
1.3 实验方法
1.3.1 藜麦麸皮多肽制备工艺流程
藜麦麸皮蛋白多肽的提取按照图1进行。
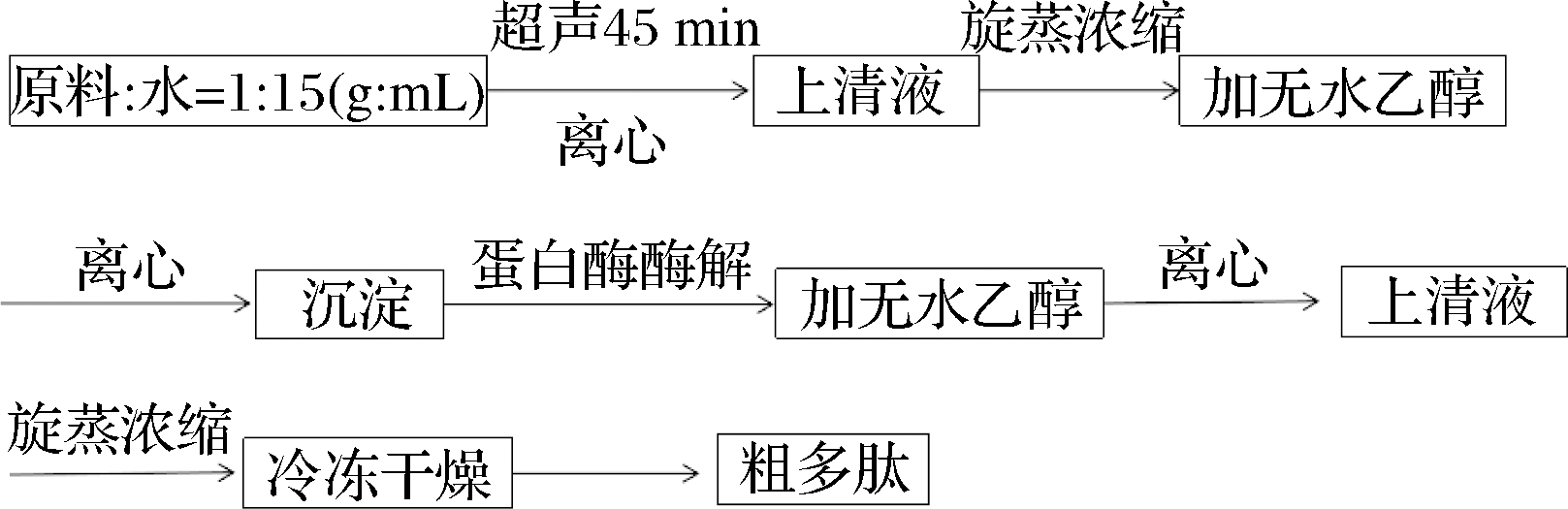
图1 藜麦麸皮多肽制备工艺流程图
Fig.1 Process flow chart for preparation of quinoa husk peptides
1.3.2 藜麦麸皮蛋白分子质量的分布及氨基酸组成测定
称取30 g藜麦麸皮于烧杯中,按照料液比1∶15(g∶mL)加入蒸馏水,超声45 min后于4 000 r/min离心10 min,收集上清液旋蒸后加入无水乙醇溶液,使混合液乙醇的体积分数在75%~80%维持30 min以除去小分子物质,5 000 r/min离心30 min取沉淀,乙醇挥发后根据下列方法测定蛋白质的氨基酸组成和分子质量分布。
氨基酸测定:根据 GB 5009.124—2016 《食品安全国家标准 食品中氨基酸的测定》。
分子质量分布:参考姜燕蓉等[11]的方法对藜麦麸皮蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SPS-PAGE)测定。
1.3.3 藜麦麸皮多肽的制备
取1.3.2小节的沉淀按照料液比为1∶10(g∶mL)的比例加入蒸馏水,搅拌均匀后用0.05 mol/L NaOH溶液调节pH值至酶最适pH后,加入蛋白酶[E]/[S](3 000 U/g),在最适条件(表1)下酶解3 h,期间用0.05 mol/L NaOH溶液维持反应体系的pH。
表1 藜麦麸皮蛋白酶解工艺参数
Table 1 Technological parameters of enzymatic hydrolysis of quinoa husk protein

酶种类酶解条件碱性蛋白酶Alcalase 3.0T50 ℃,pH 8.0中性蛋白酶Neutrase 1.5MG50 ℃,pH 6.5复合蛋白酶Protamex50 ℃,pH 8.0风味蛋白酶Flavourzyme 500MG50 ℃,pH 7.0
将酶解液旋蒸浓缩后加入无水乙醇溶液,使乙醇的体积分数在75%~80%并静置30 min后,5 000 r/min下离心30 min取上清液,旋蒸浓缩后冷冻干燥获得粗多肽粉末。
1.3.4 蛋白水解度的测定
在中性及碱性条件下采用 pH-stat 法计算蛋白水解度[12]。
1.3.5 肽得率的计算
多肽含量测定方法采用福林酚法,蛋白质含量根据 GB/T 5009.5—2016 中的凯氏定氮法测定。藜麦麸皮多肽得率按公式(1)计算:
肽得率![]()
(1)
1.4 多肽活性测定
将上述粗多肽采用DA201-C大孔吸附树脂脱盐后,用体积分数为80%的乙醇洗脱,除去乙醇,冷冻干燥,用于活性测定。
1.4.1 多肽α-葡萄糖苷酶抑制率的测定
参照沈佳奇等[13]的方法,稍作调整。实验分为空白、对照、样品空白和样品组,在96孔板中依次加入PBS缓冲液、抑制剂溶液和2.5 mmol/L PNPG底物溶液,充分混合后于37 ℃水浴10 min,取出96孔板在样品组中加入0.3 U/mL α-葡萄糖苷酶溶液充分混匀后于37 ℃水浴20 min,然后加150 μL 0.2 mol/L的Na2CO3溶液终止反应,每组试验做3个平行。用酶标仪测量405 nm处的吸光度值,根据公式(2)计算各样品的α-葡萄糖苷酶抑制率:
抑制率![]()
(2)
式中:AC,对照组;AB,空白组;AS,样品组;ASB,样品空白组。
1.4.2 酪氨酸酶抑制率的测定
称量不同蛋白酶酶解的多肽并配制成1、5、10和20 mg/mL的样品溶液。按表2的剂量在96孔板中依次加入药品,最后加入酪氨酸酶溶液,摇匀,置于25 ℃恒温反应20 min[14]。用酶标仪测量475 nm处的吸光度值,以抗坏血酸为阳性对照,每组试验3个平行,按照按公式(3)计算酪氨酸酶抑制率:
抑制率![]()
(3)
表2 反应物添加剂量 单位:μL
Table 2 Reactant addition dose
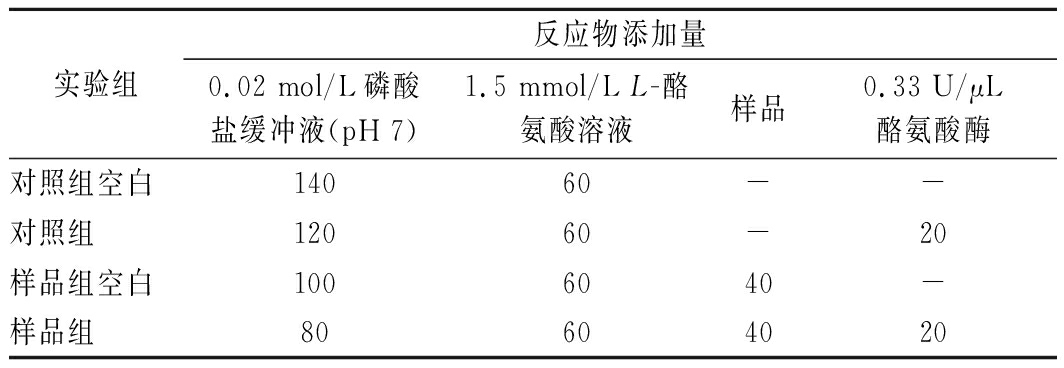
实验组反应物添加量0.02 mol/L磷酸盐缓冲液(pH 7)1.5 mmol/L L-酪氨酸溶液样品0.33 U/μL酪氨酸酶对照组空白14060--对照组12060-20样品组空白1006040-样品组80604020
1.4.3 Fe2+螯合率的测定
根据DECKER等[15]的方法改进。取1 mL样品溶液于试管,滴加0.05 mL 2 mmol/L FeCl2溶液并用蒸馏水定容至1.90 mL,混合均匀后,再滴加0.1 mL 5 mmol/L菲咯嗪试剂,充分振荡混合后室温静置10 min,于波长562 nm处测定吸光度,每组试验3个平行。Fe2+螯合率按公式(4)计算:
螯合率![]()
(4)
1.4.4 DPPH 自由基清除率的测定
DPPH 自由基清除率的测定方法参照文献[16]。
1.5 数据处理
每组试验设置 3 次平行,数据表示为平均值±标准偏差,利用t检验进行组间差异比较,P<0.05 为差异显著,P<0.01 为差异极显著,采用GraphPad Prism 8.0等软件进行数据处理和绘图。
2 结果与分析
2.1 藜麦麸皮蛋白分子质量分布
对多肽提取工艺中第一次醇沉的蛋白通过12%的SDS-PAGE 凝胶电泳分析,如图2所示。藜麦麸皮蛋白电泳图谱共分离出3条蛋白亚基带,根据位移标准曲线计算可知条带主要分布在22.8 k、39.1 k、52.7 kDa。RUIZ等[17]采用碱溶酸沉法对藜麦种子进行蛋白提取,测定在不同碱性条件下提取的蛋白分子质量分布,主要条带为6 k、33 k、38和50 kDa。在碱溶酸沉提取中,随着提取pH值增加,高、中分子质量的蛋白质条带会较暗,因其在较高提取pH值下,蛋白质被水解成较低分子质量的蛋白,并通过增加的疏水相互作用和分子间二硫键结合成不溶性聚集体,这些聚集体在进行电泳前通过离心去除,低分子质量的蛋白会更容易被提取[18]。藜麦分离出的蛋白主要由11S球蛋白和2S白蛋白(分子质量主要由8 k~9 kDa的多肽组成),本研究在提取蛋白时没有采用碱溶酸沉法并未在较高pH值条件下提取,因此分离出来的主要是11S球蛋白,不存在较低分子质量的蛋白。
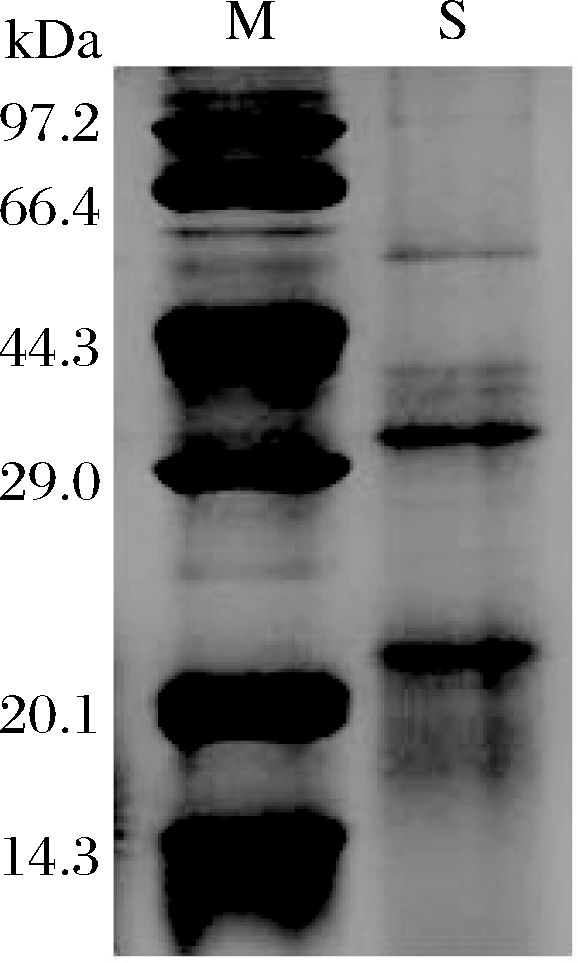
M-标准蛋白;S-藜麦麸皮蛋白
图2 藜麦麸皮蛋白电泳图
Fig.2 Electrophoretic map of quinoa husk protein
2.2 藜麦麸皮蛋白氨基酸组成
从营养学角度看,食物中蛋白质的质量与其所含有氨基酸的种类和含量有关。由表3可知,藜麦麸皮蛋白中必须氨基酸占35.17%,接近FAO/WHO标准规定的40%,因此藜麦蛋白可为氨基酸比例均衡的理想蛋白。
表3 藜麦麸皮蛋白氨基酸组成 单位:g/100 g
Table 3 Amino acid composition of quinoa husk protein
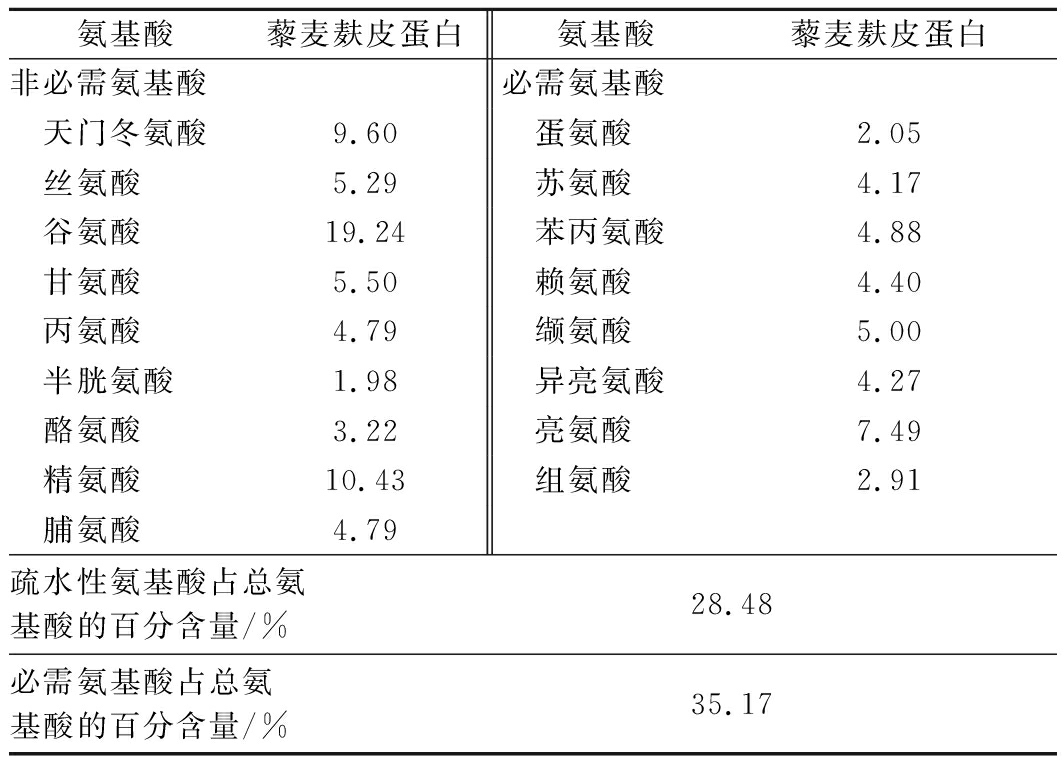
氨基酸藜麦麸皮蛋白氨基酸藜麦麸皮蛋白非必需氨基酸必需氨基酸天门冬氨酸9.60蛋氨酸2.05丝氨酸5.29苏氨酸4.17谷氨酸19.24苯丙氨酸4.88甘氨酸5.50赖氨酸4.40丙氨酸4.79缬氨酸5.00半胱氨酸1.98异亮氨酸4.27酪氨酸3.22亮氨酸7.49精氨酸10.43组氨酸2.91脯氨酸4.79疏水性氨基酸占总氨基酸的百分含量/%28.48必需氨基酸占总氨基酸的百分含量/%35.17
相关研究表明,从蛋白质中提取出的疏水性氨基酸的含量,氨基酸组成和肽序列中独特的氨基酸位置对生物活性有很大影响。疏水性氨基酸残基位于细胞间和C端,对抗氧化活性有重要影响且含有大量疏水氨基酸的多肽具有较强的ACE抑制活性[19]。除此之外,疏水性氨基酸残基(如丙氨酸)还可提高酪氨酸酶抑制活性,并且丙氨酸还显示出阻断黑素生成的能力。含硫氨基酸(Met、Cys)还可以促进机体和肠道黏膜的生长发育,并增强肠道对营养物质的吸收。由表3可知,疏水性氨基酸占总氨基酸比例约1/3,含量较高,因此可以推断藜麦麸皮蛋白具有多种生物活性。
2.3 不同蛋白酶对藜麦麸皮蛋白的水解
将藜麦麸皮蛋白溶液分别用碱性蛋白酶、风味蛋白酶、中性蛋白酶和复合蛋白酶按照表1的条件进行水解,酶与底物浓度比[E]/[S](3 000 U/g),酶解时间均为3 h。在酶解过程中水解度至关重要,因其反映蛋白质对底物的酶解能力,包括游离氨基酸和所得肽的分子质量。不同蛋白酶对藜麦麸皮蛋白的水解度如图3所示,总的来说,随着酶解时间增加,水解度增加。在所有蛋白酶中,碱性蛋白酶的水解程度最好,在120 min时水解度达到13%,其次为中性蛋白酶,复合蛋白酶和风味蛋白酶水解度基本一致。
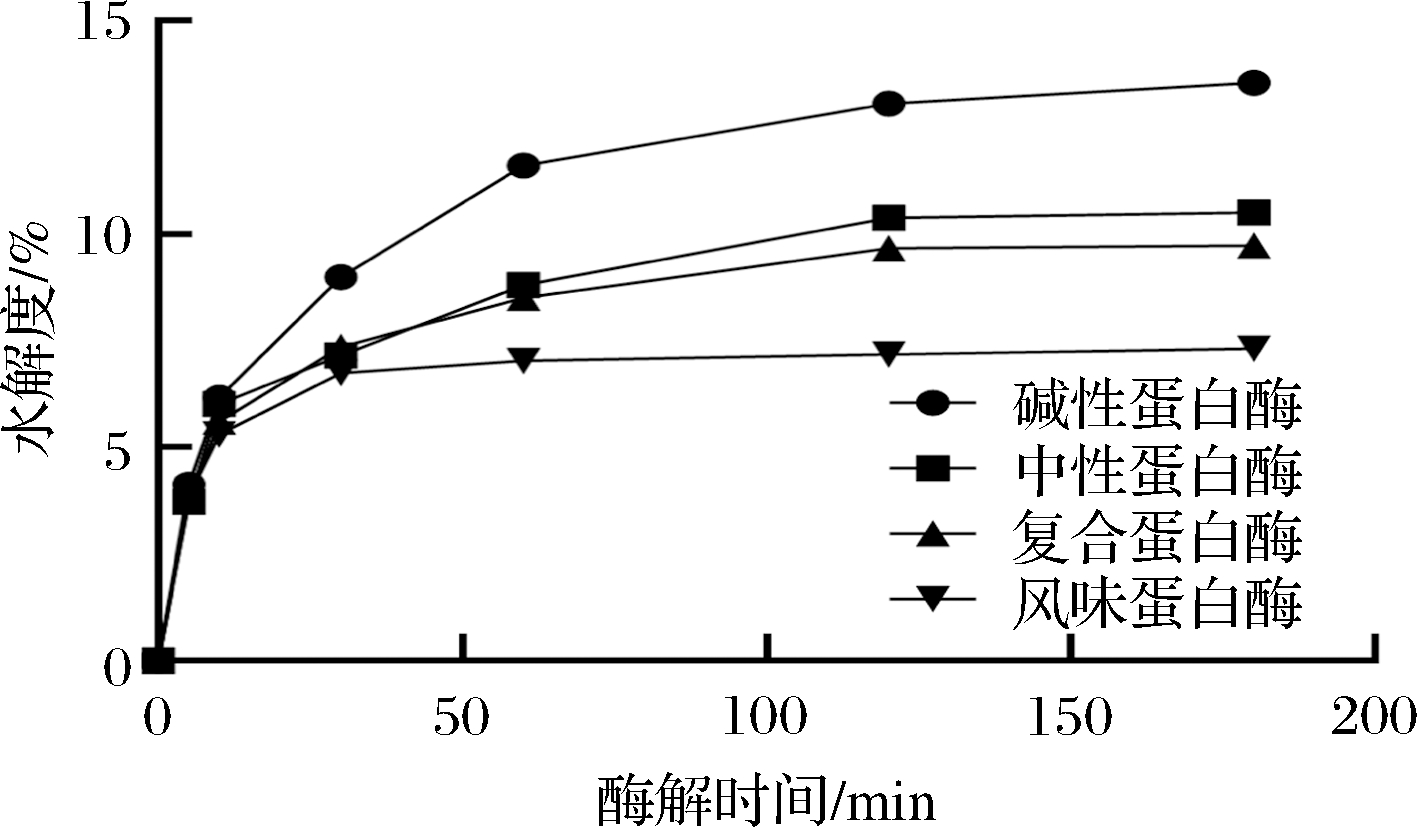
图3 不同蛋白酶的水解进程
Fig.3 Hydrolysis process of different proteases
水解度越大,酶解越彻底,水解物中所含的小分子蛋白越多,多肽提取率就越高。由图4可知,碱性蛋白酶酶解后的多肽得率达到88.88%,几乎可以将蛋白全部水解,其水解度高于其余3种蛋白酶(图3)。不同蛋白酶酶解蛋白的作用位点不同,碱性蛋白酶Alcalase 3.0T属于外源酶,对羧端水性氨基酸的酶解有较强专一性,可水解藜麦麸皮蛋白中的Glu、Met、Leu、Tyr、Lys的羧端肽键[20]。藜麦麸皮蛋白中含有较高的谷氨酸(表3),因此碱性蛋白酶酶解彻底,可获得大量多肽。
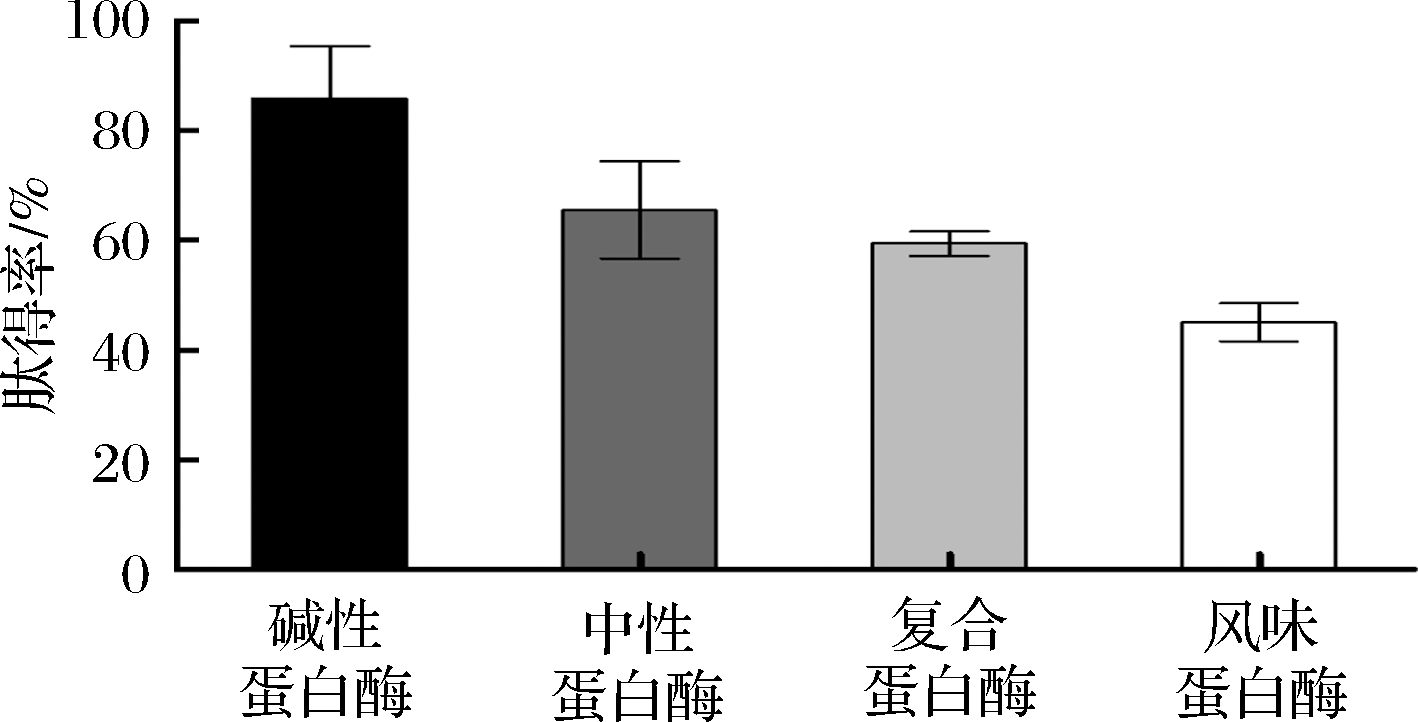
图4 不同蛋白酶酶解产物的肽得率
Fig.4 Peptide yield of hydrolyzed products of different proteases
2.4 多肽对α-葡萄糖苷酶抑制率的测定
α-葡萄糖苷酶是糖尿病发病的主要因素,是胰岛素功能精细调节的关键酶,是延缓葡萄糖吸收和抑制餐后高血糖的靶点。因此,抑制α-葡萄糖苷酶活性是治疗糖尿病的关键。临床上常用的α-葡萄糖苷酶抑制剂有阿卡波糖、伏格列糖和米格列醇,但会产生一些副作用(如肠胃胀气、胃痛、腹泻和肝损伤)[21]。因此,需要寻找更安全有效的α-葡萄糖苷酶抑制剂。
由图5可知,阿卡波糖随质量浓度增加抑制作用虽不明显,但效果很好。4种多肽在10 mg/mL和20 mg/mL质量浓度下,与阳性对照组比均有极显著差异。4种多肽均对α-葡萄糖苷酶有抑制作用,随着质量浓度增大抑制作用增强。碱性蛋白酶肽、中性蛋白酶肽、复合蛋白酶肽和风味蛋白酶肽在10 mg/mL时抑制率分别为17.72%、22.01%、16.22%和40.48%,而在20 mg/mL时抑制率均有提高,分别为33.30%、32.45%、39.19%和81.67%,其中风味蛋白酶水解的多肽抑制效果较其他蛋白酶明显增强且随着质量浓度的增大抑制率增幅最大。因此可选择风味蛋白酶肽制作α-葡萄糖苷酶抑制剂。
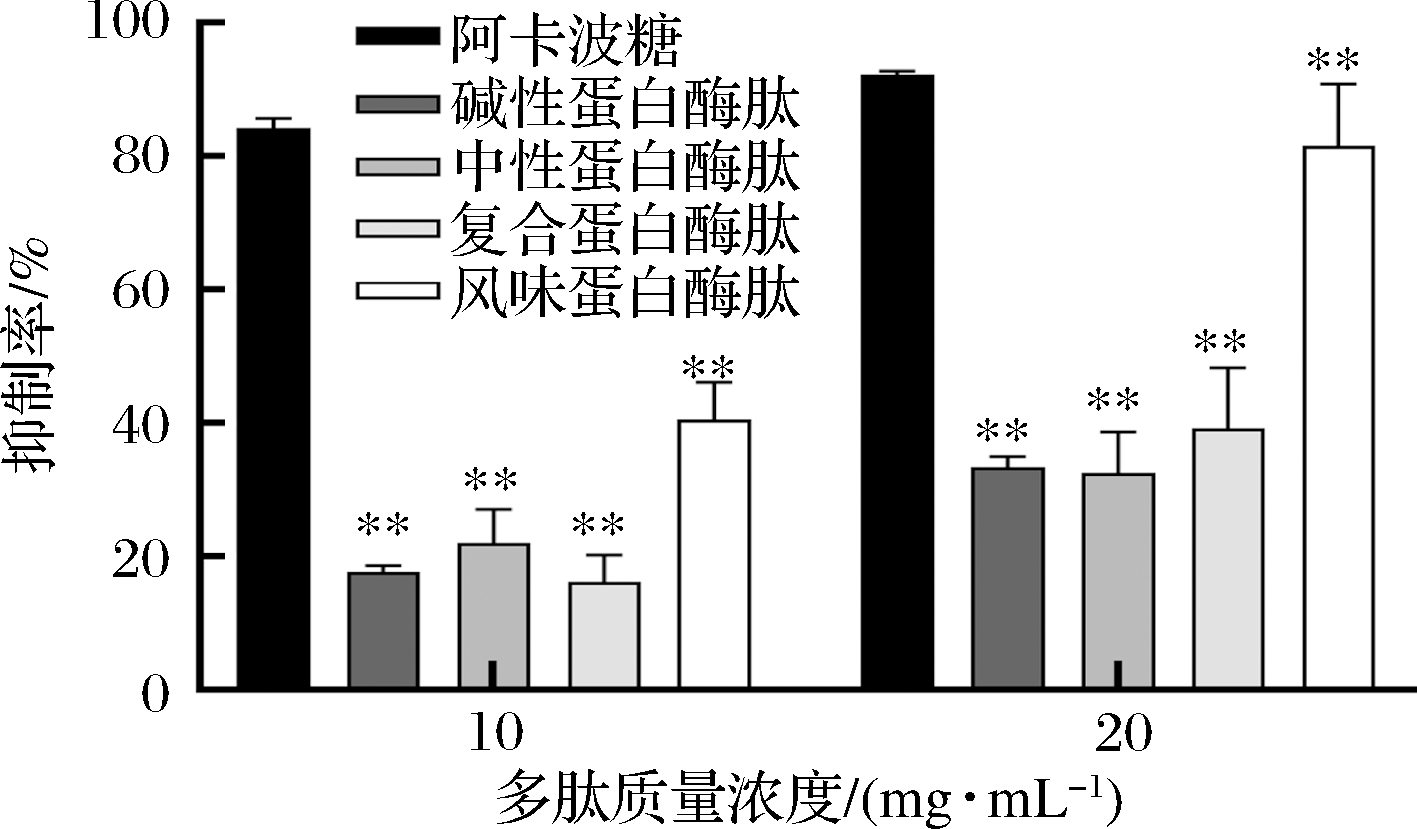
图5 多肽对α-葡萄糖苷酶抑制率
Fig.5 Inhibition rate of polypeptides on α-glucosidase
注:**与阳性对照组相比具有极显著差异(P<0.01)
2.5 多肽对酪氨酸酶的抑制率
酪氨酸酶是黑色素产生的关键酶,控制着黑素的形成过程,其活性程度对色素的沉积起主要作用。黑色素水平的增加会导致蔬菜、水果和人体皮肤的色素沉着障碍,如黄褐斑、雀斑、老年斑和恶性黑色素瘤。因此,开发和筛选有效的酪氨酸酶抑制剂在近几年备受关注[22]。
本实验中,测定了4种蛋白酶肽对酪氨酸酶活性的抑制作用。由图6可知,抗坏血酸对酪氨酸酶抑制作用随着质量浓度增大而增强。碱性蛋白酶肽、中性蛋白酶肽、复合蛋白酶肽对酪氨酸酶的抑制性也随浓度增大而增强,而风味蛋白酶肽随质量浓度增加增幅不明显,基本维持在30%左右。在20 mg/mL时,除风味蛋白酶肽外其他多肽与阳性对照组无显著性差异,说明碱性蛋白酶肽、中性蛋白酶肽、复合蛋白酶肽在最高质量浓度20 mg/mL与阳性对照组抑制效果接近。
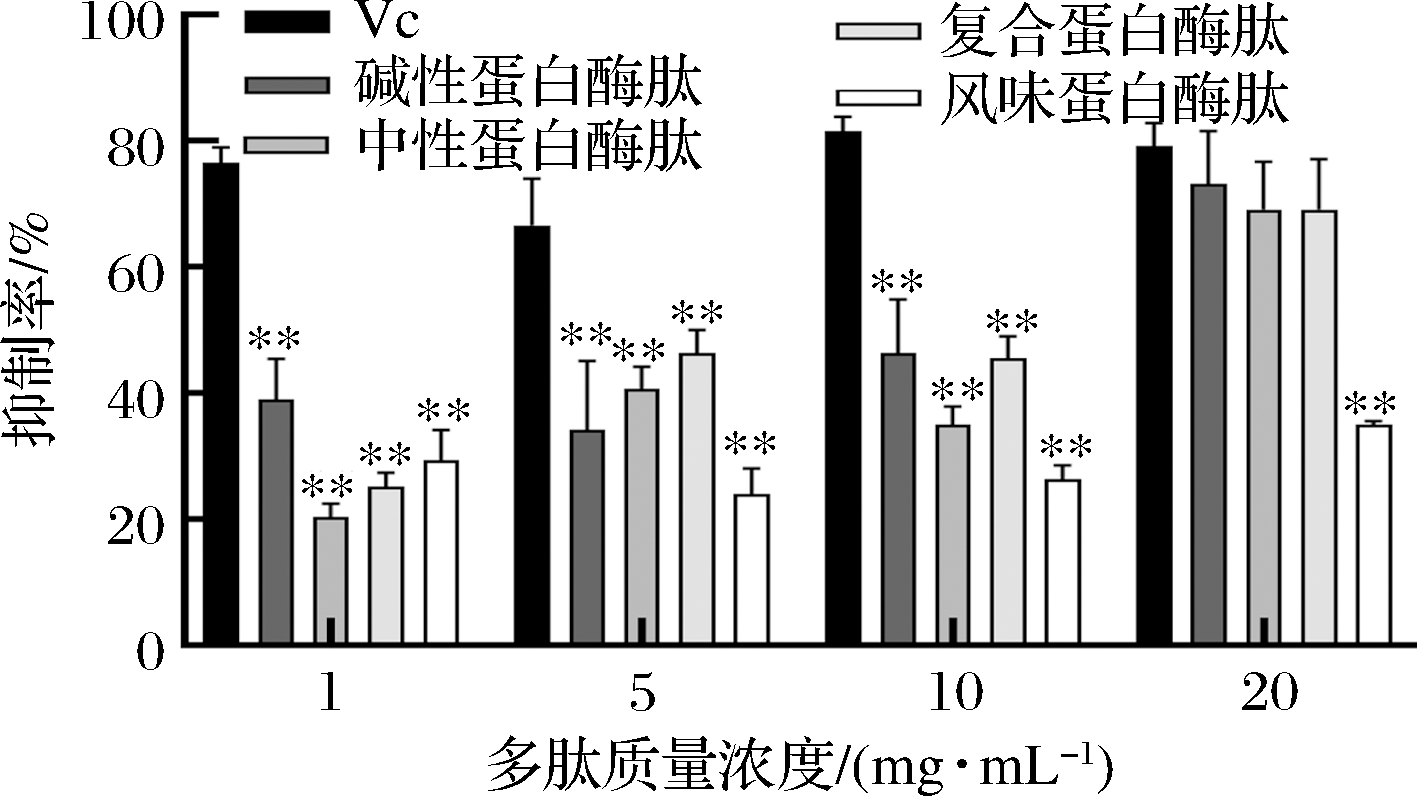
图6 多肽对酪氨酸酶的抑制率
Fig.6 Inhibition rate of polypeptides on tyrosinase
注:**与阳性对照组相比具有极显著差异(P<0.01)
2.6 多肽与Fe2+的螯合率
铁是人体营养中必不可少的元素,可以通过盐、金属螯合剂和铁螯合肽的形式提供。然而,金属盐由于其生物利用度低、吸附性差、稳定性差等特点,正在被替代。目前,许多研究表明,铁螯合肽由于在提高生物利用度、吸收和稳定性方面的优势,可望被用作铁营养补充剂[23]。由图7可知,碱性蛋白酶肽和中性蛋白酶肽与Fe2+螯合率均随浓度增加而增强,在较高质量浓度(10和20 mg/mL)时,抑制率均大于60%。

图7 多肽与Fe2+的螯合率
Fig.7 Chelating rate of peptides with Fe2+
复合蛋白酶肽和风味蛋白酶肽与Fe2+螯合率随质量浓度增加而减弱,复合蛋白酶肽在10 mg/mL螯合率达到最大值(66.10%),风味蛋白酶肽在各个质量浓度下与Fe2+螯合率均能达到80%以上,说明风味蛋白酶肽具有较好的Fe2+螯合能力,因此可以用风味蛋白酶酶解后的多肽制作铁营养补充剂。
2.7 多肽对DPPH自由基的清除效果
由图8可知,经4种蛋白酶水解后的多肽对DPPH 自由基的清除能力随着质量浓度的升高而增大。在10 mg/mL时,中性蛋白酶酶解后的多肽对DPPH清除率达到85%,与阳性对照相比,中性蛋白酶肽和风味蛋白酶肽的清除能力较强,其余两种蛋白酶酶解肽的清除能力较弱。

图8 多肽对DPPH 自由基清除能力的影响
Fig.8 Effect of polypeptides on scavenging ability of DPPH free radicals
注:**与阳性对照组相比具有极显著差异(P<0.01);
*与阳性对照组相比具有显著差异(P<0.05)
3 结论
本文以藜麦麸皮为原料,先采用体积分数为75%~80%的醇沉淀出大分子蛋白,经4种蛋白酶水解后,再用体积分数为75%~80%的醇沉淀法除去多糖和未水解的大分子蛋白,得到多肽,其中碱性蛋白酶对藜麦麸皮蛋白的酶解能力较强,多肽得率最高。经测定,4种蛋白酶酶解的多肽都具有良好的Fe2+螯合能力,中性蛋白酶酶解的多肽对DPPH自由基具有较强的清除能力,并随着多肽质量浓度的增加而增加,风味蛋白酶肽和碱性蛋白酶肽分别对α-葡萄糖苷酶和酪氨酸酶具有较高的抑制率。本研究结果揭示了藜麦麸皮蛋白被不同蛋白酶酶解后,多肽所具有的活性程度不同,为后续研究多肽活性奠定了基础。
[1] VEGA-GALVEZ A,MIRANADA M,VERGARA J,et al.Nutrition facts and functional potential of quinoa (Chenopodium quinoa willd.),an ancient Andean grain:A review[J].Journal of the Science of Food and Agriculture,2010,90(15):2 541-2 547.
[2] AYYASH M,JOHNSON S K,LIU S Q,et al.Cytotoxicity,antihypertensive,antidiabetic and antioxidant activities of solid-state fermented lupin,quinoa and wheat by Bifidobacterium species:In vitro investigations[J].LWT-Food Science and Technology,2018,95:295-302.
[3] 丁云双,曾亚文,闵康,等.藜麦功能成分综合研究与利用[J].生物技术进展,2015,5(5):340-346.
DING Y S,ZENG Y W,MIN K,et al.Comprehensive research and utilization of functional components in quinoa[J].Current Biotechnology,2015,5(5):340-346.
[4] 范三红,田旭静,张锦华.藜麦糠抗氧化肽的超滤分离及其体外抗氧化活性[J].食品工业科技,2018,39(5):59-64.
FAN S H,TIAN X J,ZHANG J H.The separation of the antioxidant peptide from quinoa chaff by ultrafiltration and its antioxidant activity in vitro[J].Science and Technology of Food Industry,2018,39(5):59-64.
[5] NONGONIERMA A B,LE M S,DUBRULLE C,et al.Quinoa (Chenopodium quinoa Willd.) protein hydrolysates with in vitro dipeptidyl peptidase IV (DPP-IV) inhibitory and antioxidant properties[J].Journal of Cereal Science,2015,65:112-118.
[6] 叶凯,李小强,周金虎,等.响应面法酶解藜麦蛋白制备α-淀粉酶抑制肽的工艺研究[J].中国调味品,2019,44(12):6-11.
YE K,LI X Q,ZHOU J H,et al.Study on enzymatic hydrolysis of quinoa protein for preparing α-amylase inhibitory peptide by response surface methodology[J].China Condiment,2019,44(12):6-11.
[7] VILCACUNDO R,MIRALLES B,CARRILLO W,et al.In vitro chemopreventive properties of peptides released from quinoa (Chenopodium quinoa Willd.) protein under simulated gastrointestinal digestion[J].Food Research International,2018,105:403-411.
[8] REN G X,ZHU Y,SHI Z,et al.Detection of lunasin in quinoa (Chenopodium quinoa Willd.) and the in vitro evaluation of its antioxidant and anti‐inflammatory activities[J]. Journal of the Science of Food and Agriculture,2017,97(12):4 110-4 116.
[9] ALUKO R E,MONU E.Functional and bioactive properties of quinoa seed protein hydrolysates[J].Journal of Food Science,2003,68(4):1 254-1 258.
[10] 赵雷,李晓娜,史龙龙,等.藜麦麸皮营养成分测定及其油脂的抗氧化活性研究[J].现代食品科技,2019,35(11):199-205;151.
ZHAO L,LI X N,SHI L L,et al.Determination of the nutritional components in quinoa bran and the antioxidant activity of its derived oils[J].Modern Food Science and Technology,2019,35(11):199-205;151.
[11] 姜燕蓉,张亚飞,齐筱莹,等.等电点沉淀法提取牡蛎蛋白及其蛋白组成分析[J].渔业研究,2019,41(2):106-112.
JIANG Y R,ZHANG Y F,et al.Isoelectric point precipitation method was used to extract oyster protein and analyze its composition[J].Journal of Fisheries Research,2019,41(2):106-112.
[12] NISSEN J A.Enzymatic hydrolysis of food proteins[M].London:Elsevier Applied Science Publishers,1986.
[13] 沈佳奇.麦芽根多肽制备及其抑制α-葡萄糖苷酶活性的研究[D].广州:华南理工大学,2019.
SHEN J Q.Preparation of malt root polypeptide and its inhibition on α-glucosidase activity[D].Guangzhou:South China University of Technology,2019.
[14] MEDINA-MEZA I G,ALUWI N A,SAUNDERS S R,et al.Profiling of triterpenoid saponins from 28 quinoa varieties (Chenopodium quinoa Willd) grown in Washington State by GC-MS[J].Journal Agricultural Food Chemistry,2016,64(45):8 583-8 591.
[15] DECKER E A,WELCH B.Role of ferritin as a lipid oxidation catalyst in muscle food[J].Journal of Agricultural & Food Chemistry,1990,38(3):674-677.
[16] 赵璇.洋葱蛋白及多肽的制备及其体外抗氧化活性评价[J].中国调味品,2020,45(2):112-115.
ZHAO X.Preparation of onion protein and peptides and evaluation of their antioxidant activity in vitro[J].China Condiment,2020,45(2):112-115.
[17] RUIZ G A,WU K X,MARTINUS V B,et al.Effect of extraction pH on heat-induced aggregation,gelation and microstructure of protein isolate from quinoa (Chenopodium quinoa Willd)[J].Food Chemistry,2016,209:203-210.
[18] VALENZUELA C,ABUGOCH L,TAPIA C,et al.Effect of alkaline extraction on the structure of the protein of quinoa (Chenopodium quinoa Willd.) and its influence on film formation[J].International Journal of Food Science & Technology,2013,48(4):843-849.
[19] CHEN H M,MURAMOTO K,YAMAUCHI F.Structural analysis of antioxidative peptides from soybean b-conglycinin[J].Journal of Agricultural and Food Chemistry,1995,43:574-578.
[20] ADAMSON N J,REYNOLDS E C.Characterization of casein phosphopeptides prepared using alcalase:Determination of enzyme specificity[J].Enzyme and Microbial Technology,1996,19(3):202-207.
[21] ZENG L,ZHANG G,LIAO Y,et al.Inhibitory mechanism of morin on α-glucosidase and its anti-glycation properties[J].Food & Function,2016,7(9):3 953-3 963.
[22] INES K,OLFA T,DORRA G,et al.Antioxidant,antityrosinase and antibiofilm activities of synthesized peptides derived from Vicia faba protein hydrolysate:A powerful agents in cosmetic application[J].Industrial Crops & Products,2017,109:310-319.
[23] GUO L,HOU H,LI B,et al.Preparation,isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Process Biochemistry,2013,48(5-6):988-999.