食品生产工业中,着色剂因可修饰产品外观色泽而发挥着巨大作用。按照来源不同,着色剂可分为天然色素和合成色素。合成色素因成本低廉、稳定性好而被广泛用于食品行业。亮蓝是一种水溶性偶氮酸性着色剂(分子结构见图1),易溶于水及乙醇,其耐光和耐热性较强,对酸和碱均不敏感[1],现已用于酸奶[2]、果味饮料、果酱[3]、茶叶[4]等产品的染色。目前,国家已颁布相应标准对食品中亮蓝着色剂的最大添加量进行了限定。现阶段对食品中合成着色剂的检测方法较多,如薄层色谱法[5-6]、高效液相色谱法[7-9]、液相色谱-质谱联用法[10-11]、分光光度法[12]、电化学传感器法[13-14]、表面增强拉曼散射法[15-17]等。
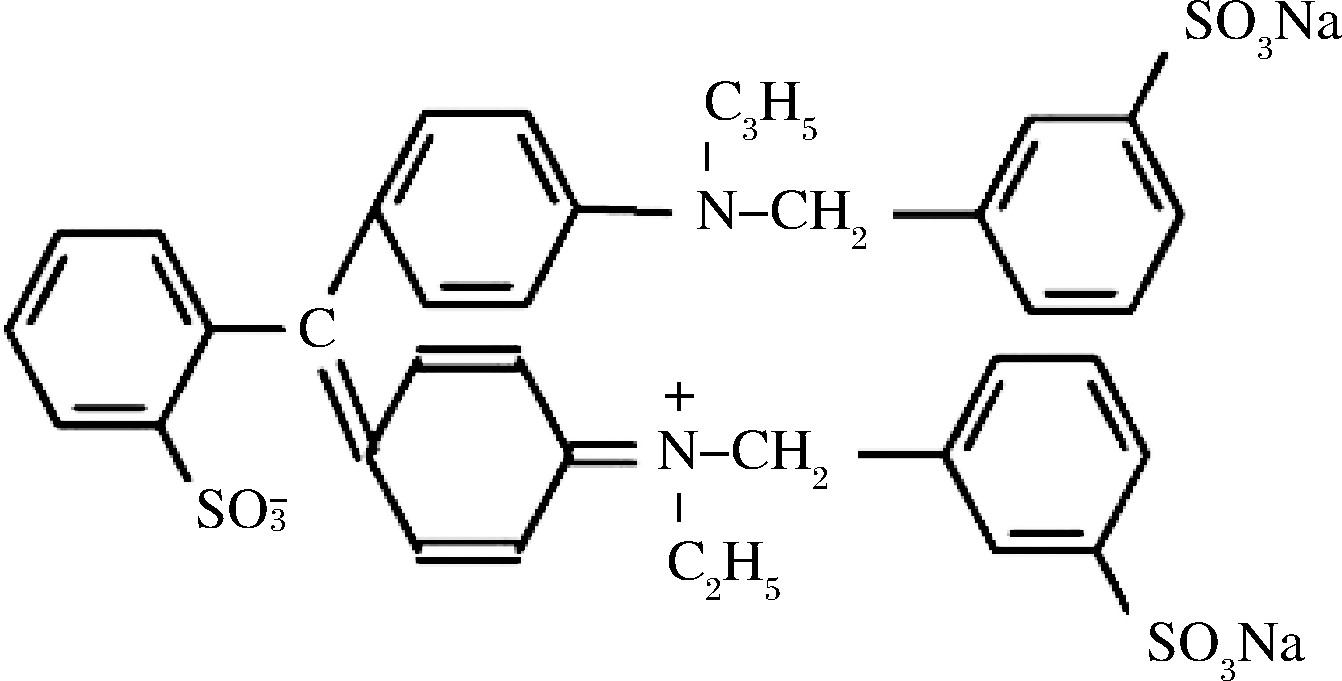
图1 亮蓝分子结构图[18]
Fig.1 Bright blue molecular structure diagram
黑米,属珍贵粮油作物,是一种药食兼用的有色大米,分为糯米和黏米两种[19],具有极高的营养价值、药用及保健功能。黑米中显现出来的颜色来源于种皮上沉积的色素,经研究证明其内部含有花色苷类化合物,是一种天然水溶性色素。黑米花色苷主要活性成分为矢车菊素-3-葡萄糖苷,其结构内部含有酚羟基,表现出抗氧化活性[20-21]。黑米色素易溶于极性大的溶剂,如水、乙醇等,难溶于非极性溶剂[22]。黑米具有免疫调节、降血脂、抗癌、抗粥样动脉硬化等功能[23],学术领域对黑米特性、营养成分等研究越来越深入和广泛。
目前,已有学者研究多种方法提取黑米样品中的花青素,将其应用于动物体内,以测试并分析其功能性成分的作用机制[24-25],也有将黑米与不同功能性食品复配制备新产品的研究[26-27],但尚未发现针对黑米中是否含有合成着色剂及其含量的研究。本实验以黑米为原材料,在本实验前处理过程中引入NaHCO3,综合考察产品加标回收率,类比国标方法中涉及到相关方法的加标回收率,从而验证辅助提取试剂及新方法的可行性。旨在寻找前处理方法操作简单、定量准确,同时适合不同种类粮油产品中合成着色剂测定的检测方法。
1 材料与方法
1.1 仪器、材料与试剂
1.1.1 仪器
LC-20AT 高效液相色谱仪配备紫外检测器,岛津国际贸易有限公司;LABORATORY MILL 3100(Perten)实验磨,瑞典波通仪器公司;PL602-L 电子天平,瑞士梅特勒-托利多(上海)有限公司;GL-20G-C 高速冷冻离心机,上海安亭科学仪器厂;Lab dancer 涡旋器,艾卡仪器设备有限公司;C300A 真空泵,德国WGIIENS;RV 10 Control 旋转蒸发仪,德国IKA公司;HY-5 回旋式振荡器,江苏省金坛市环宇科学仪器厂;XC-300C超声波清洗机,济宁鑫欣超声电子设备有限公司;COMFORT纯水/超纯水机,德国赛多利斯公司。
1.1.2 试剂与材料
市购3种黑米产品。
0.5 mg/mL国家标准物质亮蓝[GBW(E)100005a],中国计量科学研究院;甲醇(色谱级),赛默飞世尔科技(中国)有限公司;NaHCO3(分析纯),广东省化学试剂工程技术研究开发中心;甲酸(色谱纯)、NaCl(分析纯)、氨水(分析纯)、乙酸钠(优级纯)、乙酸铵(优级纯),天津市光复精细化工研究所;KCl(优级纯),成都市科龙化工试剂厂;Na2CO3(优级纯),山东西亚化学股份有限公司。
13 mm 0.22 μm聚醚砜针式滤器,上海安谱实验科技股份有限公司;Strata-X-AW 33 μm Polymeric Weak Anion固相萃取柱,60 mg/3 mL;Cleanert PWAX固相萃取柱,150 mg/6 mL;Cleanert JXA固相萃取柱,500 mg/6 mL;0.45 μm微孔过滤膜(水系);0.45 μm微孔过滤膜(有机系)。
乙酸铵溶液(0.02 mol/L):称取1.54 g 乙酸铵,加水至 1 L,溶解,经 0.45 μm 水系滤膜过滤。
实验过程中所用水均为去离子水。
1.2 实验方法
1.2.1 色谱条件
色谱柱:Inertsil ODS-SP C18(250 mm×4.6 mm,5 μm);检测波长629 nm,柱温35 ℃,流动相:V(甲醇)∶V(0.02 mol/L乙酸铵溶液)=45∶55,流速1.0 mL/min;进样体积10 μL,等浓度洗脱,分析时间20 min。
1.2.2 标准曲线点的配制
从亮蓝标准物质溶液中吸取1 mL至10 mL容量瓶中,用去离子水定容至刻度,得到50 μg/mL的中间储备液。再分别吸取适量中间储备液,去离子水定容,制成质量浓度0.1、0.5、1.0、2.0、5.0、10.0、15.0 μg/mL的系列标准溶液。
1.2.3 样品前处理
准确称取5.00 g(精确至0.01 g)粉碎细度达80~100目且混合均匀的样品,置于100 mL离心管中,加入0.52 g NaHCO3,再加入25 mL 体积分数40%甲醇水涡旋提取12 min,将提取的样品溶液离心5 min(4 000 r/min),转移上清液至100 mL比色管中。重复3次,保证样品中色素被充分提取出来。
1.2.4 样品净化
依次用3 mL甲醇、水及体积分数2%的甲酸水溶液活化固相萃取柱,再取1 mL提取液上样,之后用3 mL 2%甲酸水淋洗萃取柱,弃去滤液,将小柱抽干。然后用1 mL 体积分数25%氨水甲醇溶液进行洗脱,收集洗脱液。将收集的洗脱液于50 ℃旋转蒸发仪中旋蒸浓缩至干,再用1 mL去离子水复溶,涡旋混合1 min,待样品充分溶解后,过0.22 μm亲水性针式过滤器,待上机分析。
1.2.5 单因素考查及综合因素优化
通过单因素比对法,分别对提取方式、提取次数、辅助提取试剂种类、辅助提取剂(NaHCO3)添加量、提取试剂体积分数、固相萃取柱种类以及浓缩方式等7个因素进行考查,同时在单因素实验的基础上,选取NaHCO3添加量、甲醇水体积分数、涡旋时间及净化柱种类4个因素,采用Box-Behnken设计后续优化实验。以加标回收率为响应值,所有实验组中均添加2 μg/mL的亮蓝标样,采用Design-Expert 8.0.6分析软件得到二次回归方程和误差分析,确定优化工艺并对最终优化组实验进行验证。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取方式对加标回收率的影响
分别对比振荡30 min、涡旋10 min及超声10 min三种不同提取方式对检测结果的影响(图2)。试验发现,因黑米自身花青素色素干扰,在3种不同提取方式下,样品颜色差异并不明显,其中80 W功率下超声提取的样品,测得亮蓝加标回收率仅有20%左右,通过查阅文献[22,29]发现,利用超声波方式进行色素提取多适用于植物中天然色素的提取,同时超声功率在190 W以上时,才能更好地提取色素,本单位仪器功能无法满足,故弃去超声提取法。对比振荡提取和涡旋提取,2种方式测得亮蓝提取率在75%~90%,证明2种方法均可用于黑米中亮蓝色素的提取,但考虑实际情况,优先选择耗时较短的提取方式,故本实验选取的提取方式为涡旋混合10 min。
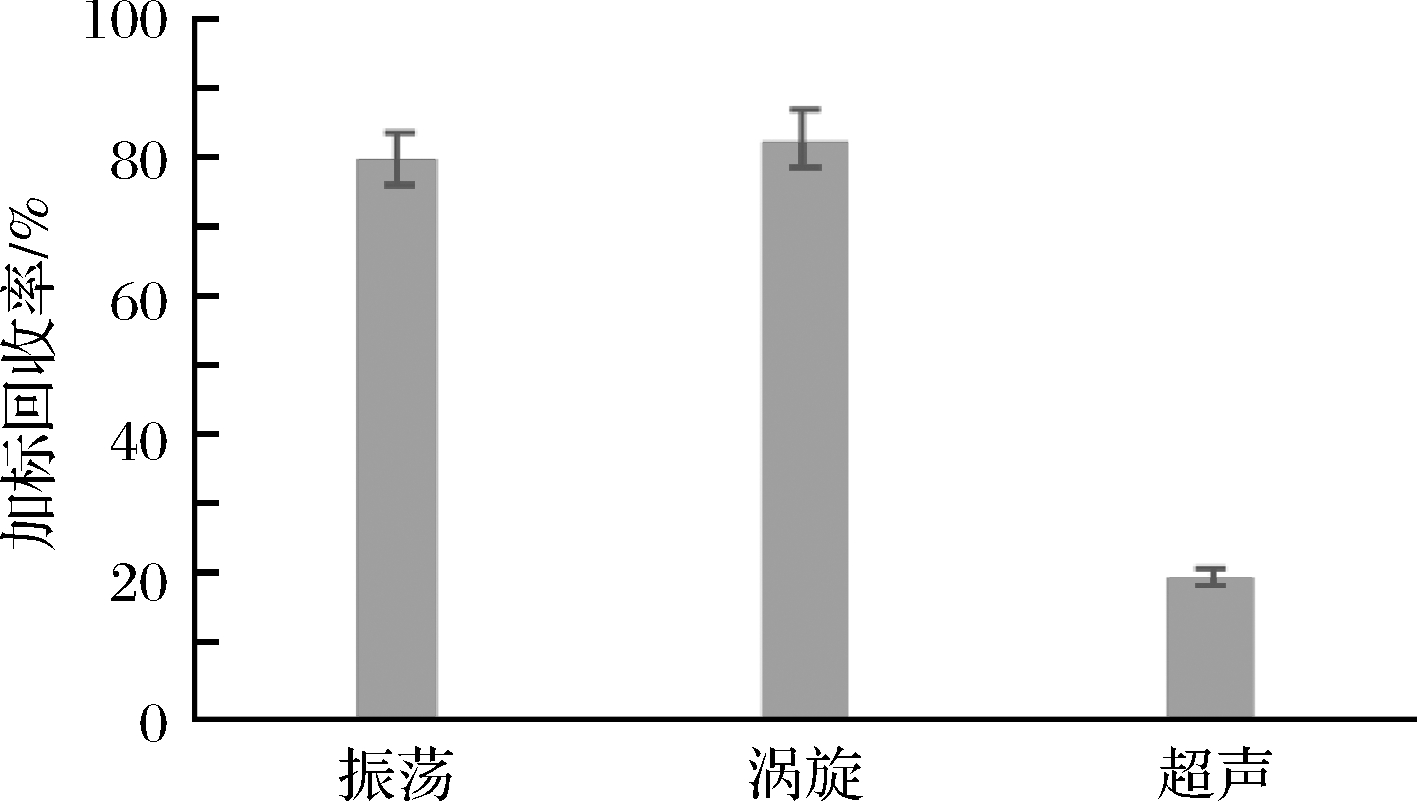
图2 提取方式对加标回收率的影响
Fig.2 Effect of extraction method on the recovery rate of standard addition
2.1.2 提取次数对加标回收率的影响
通过分别对比1次和3次、4次提取对实验中亮蓝色素提取率的影响,为降低干扰,同时以大米为基底进行视觉参考比对。试验发现,一次提取过程中,提取液颜色较浅,加标回收率在60%~65%,而3次提取时,提取液颜色较深,加标回收率在78%~82%。第4次提取时,提取液几乎无色,经测定,加标回收率与提取3次差异不大,见图3。因此,最佳提取次数为3次。
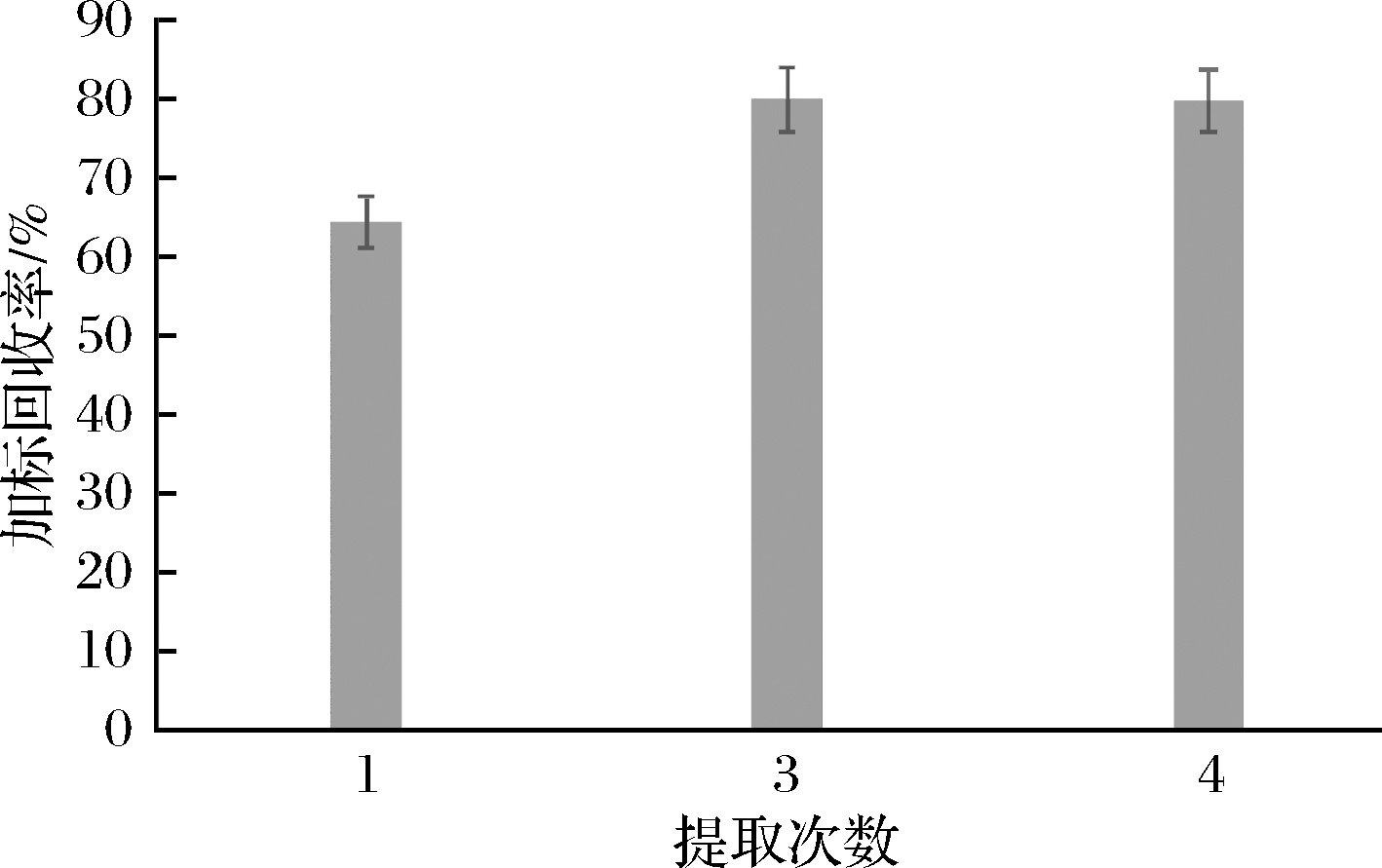
图3 提取次数对加标回收率的影响
Fig.3 Effect of extraction times on the recovery rate of standard addition
2.1.3 辅助提取试剂种类对加标回收率的影响
考察不同辅助提取试剂对亮蓝加标回收率的影响。称取10份5.00 g样品于离心管中,分别添加0.5 g NaHCO3、NaCl、KCl、Na2CO3和乙酸钠5种试剂,每个水平设置2个平行,再加入25 mL 40%甲醇水涡旋提取10 min,将提取的样品溶液4 000 r/min 离心5 min,转移上清液至100 mL比色管中。重复操作3次,按照1.2.4方法净化样品,上机分析对比不同种类的辅助提取试剂对加标回收率的影响。检测发现,添加有NaHCO3的提取溶液采用方法1.2.4净化时,无肉眼可见色素流失的情况存在,并且测试结果表明黑米中亮蓝的加标回收率明显比其他4种辅助试剂高,加标回收率在70%~88%,见图4。因此,实验中选取NaHCO3作为辅助提取试剂。
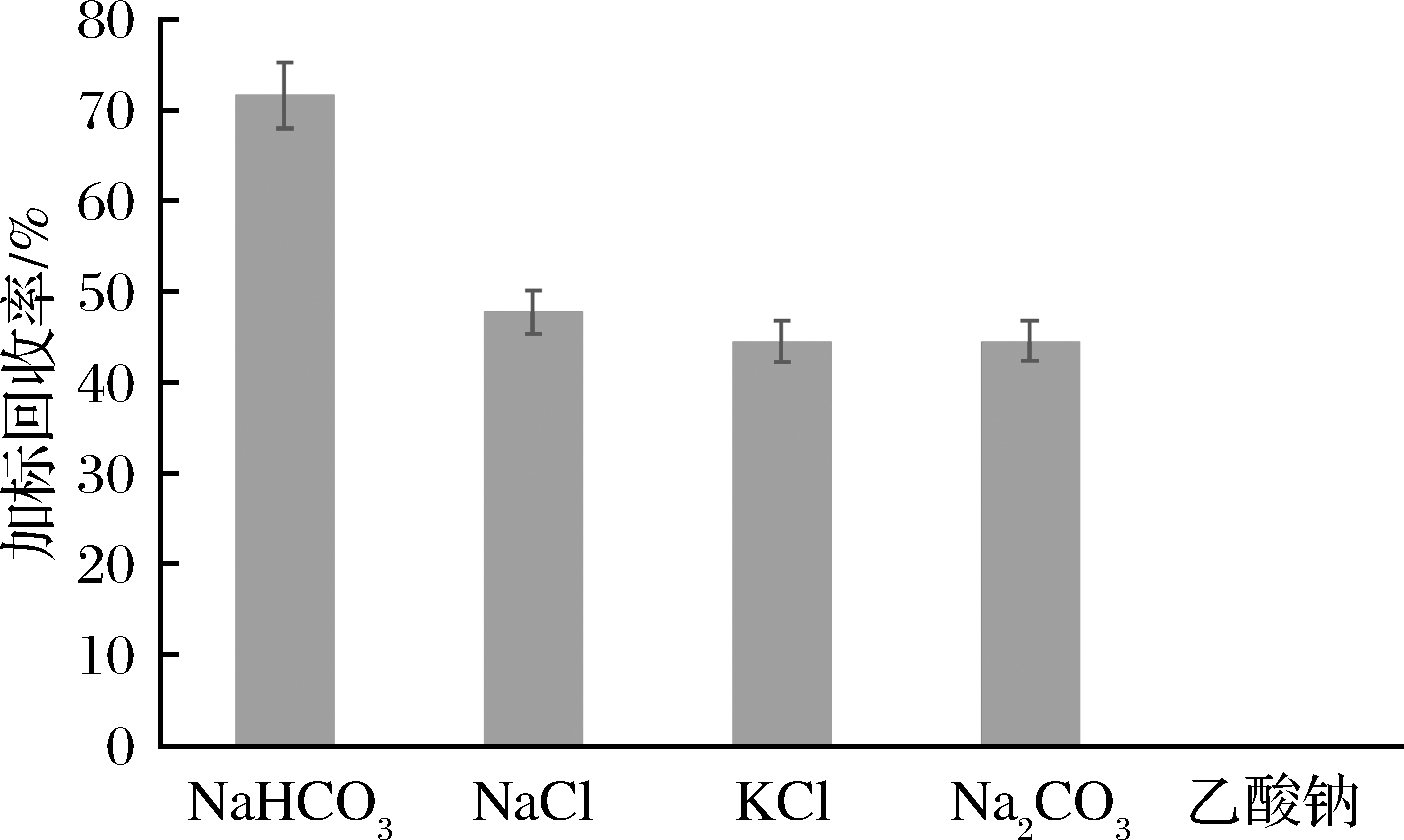
图4 辅助提取试剂种类对加标回收率的影响
Fig.4 Effect of different auxiliary extraction reagents on the recovery rate of standard addition
2.1.4 NaHCO3添加量对加标回收率的影响
考察NaHCO3不同添加量对亮蓝加标回收率的影响。称取10份5.00 g样品于离心管中,分别添加0.1、0.5、0.7、1.0、1.5 g NaHCO3,每个水平设置2个平行,再加入25 mL 40%甲醇水涡旋提取10 min,将提取的样品溶液离心5 min(4 000 r/min),转移上清液至100 mL比色管中。重复操作3次,按照1.2.4方法净化样品,上机测定对比不同添加量对试验结果的影响。检测发现当NaHCO3添加量为0.5 g时,黑米中亮蓝的加标回收率较其他水平略高,加标回收率在86%~88%,见图5。因此,本实验中NaHCO3添加量选取0.5 g。
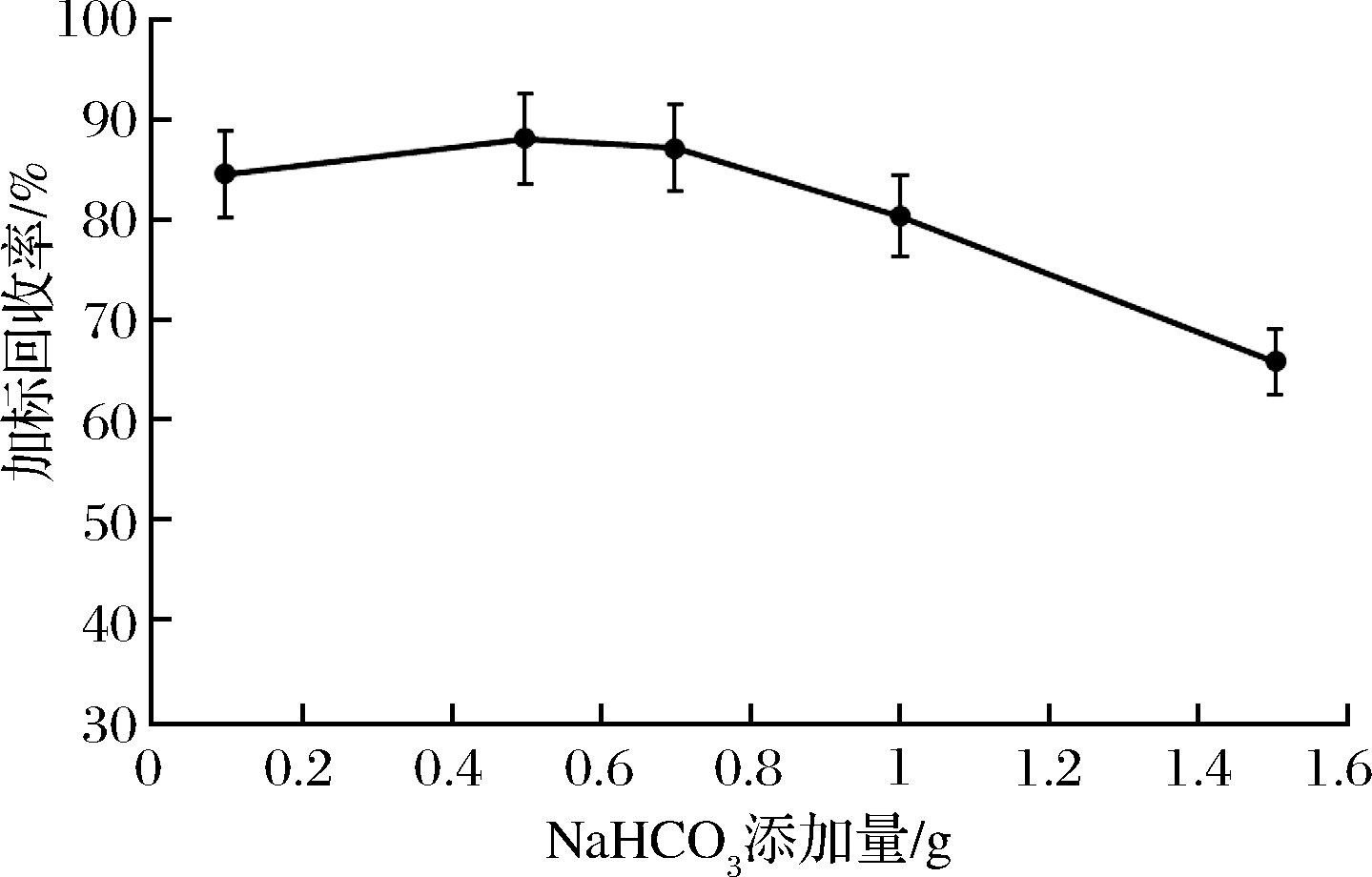
图5 NaHCO3添加量对加标回收率的影响
Fig.5 Effect of NaHCO3 on recovery rate of standard addition
2.1.5 提取试剂体积分数对加标回收率的影响
考察不同提取液体积分数对亮蓝加标回收率的影响。称取12份5.00 g样品及0.5 g NaHCO3于离心管中,分别添加35%、40%、45%、50%、55%、60%(体积分数)的甲醇水溶液,每个水平设置2个平行,然后涡旋提取10 min,将提取的样品溶液离心5 min (4 000 r/min),转移上清液至100 mL比色管中。重复操作3次,按照1.2.4方法净化样品,上机分析对比不同提取液体积分数对试验结果的影响。当提取液为体积分数40%甲醇水溶液时,黑米中亮蓝的加标回收率较其他水平略高,加标回收率在90%~93%,见图6。因此,选取40%甲醇水溶液作为提取液。
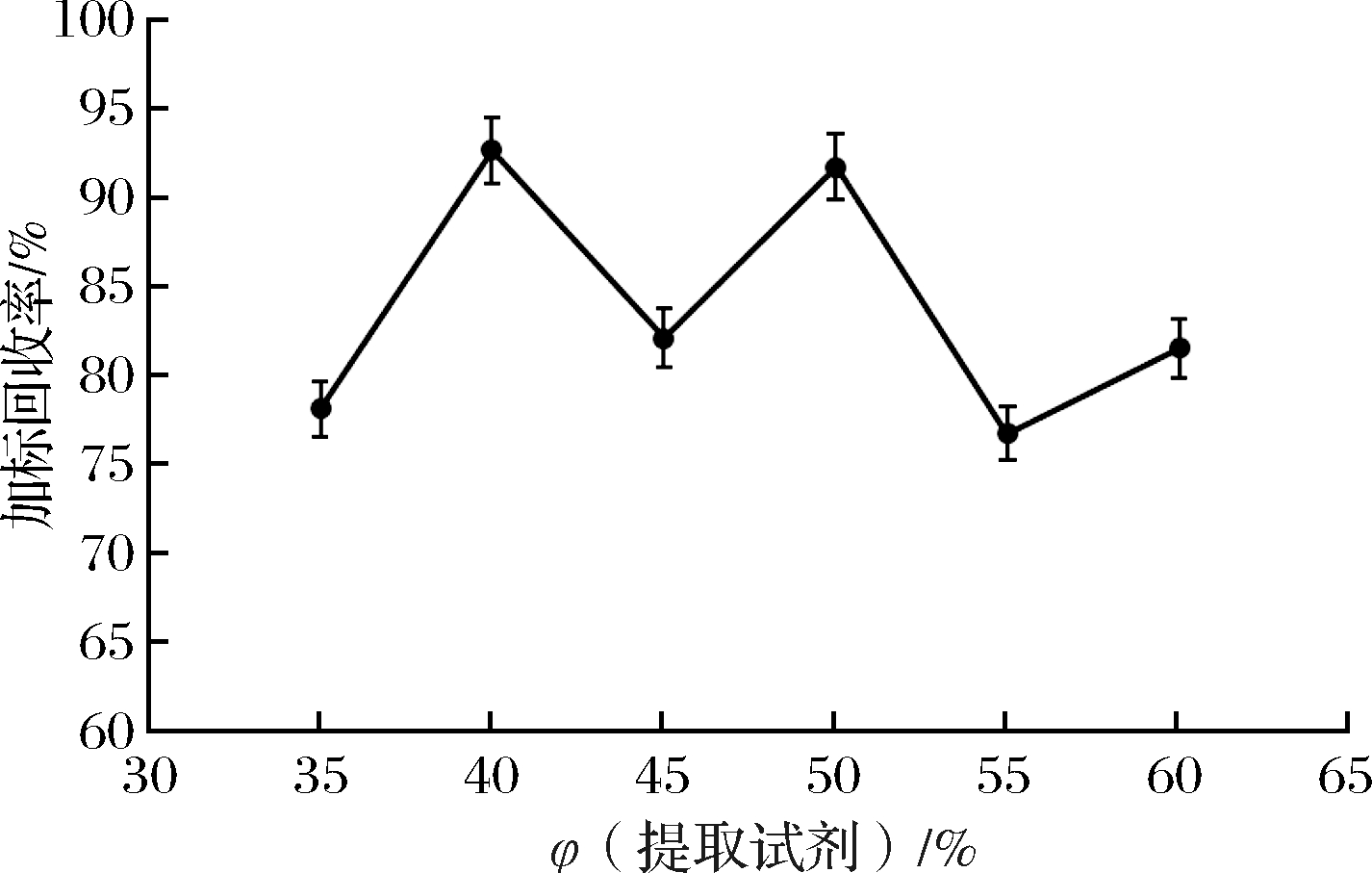
图6 提取试剂体积分数对加标回收率的影响
Fig.6 Effect of concentration of extraction reagent on recovery rate of standard addition
2.1.6 固相萃取柱的选择对加标回收率的影响
弱阴离子交换固相萃取柱和聚酰胺固相萃取柱均可用来净化食品中的合成着色剂,而亮蓝中含有苯磺酸结构,因此本研究选取Strata-X-AW和Cleanert PWAX两种弱阴离子交换固相萃取柱[30]和Cleanert JXA聚酰胺固相萃取柱进行样品净化试验。称取6份5.00 g样品及0.5 g NaHCO3于离心管中,加入25 mL 40%甲醇水涡旋提取10 min,将提取的样品溶液离心5 min(4 000 r/min),转移上清液至100 mL比色管中。重复操作3次,按照1.2.4方法净化样品,每组设置2个平行,考察3种净化柱对加标回收率的影响。结果表明:3种净化柱对加标回收率影响的顺序为Strata-X-AW>Cleanert JXA>Cleanert PWAX,其中Strata-X-AW固相萃取柱的加标回收率在80%~95%,而另外2种固相萃取柱净化后的样品加标回收率在61%~80%,虽然3种净化柱均可用于黑米中亮蓝的净化,但是Strata-X-AW固相萃取柱效果最佳(图7)。
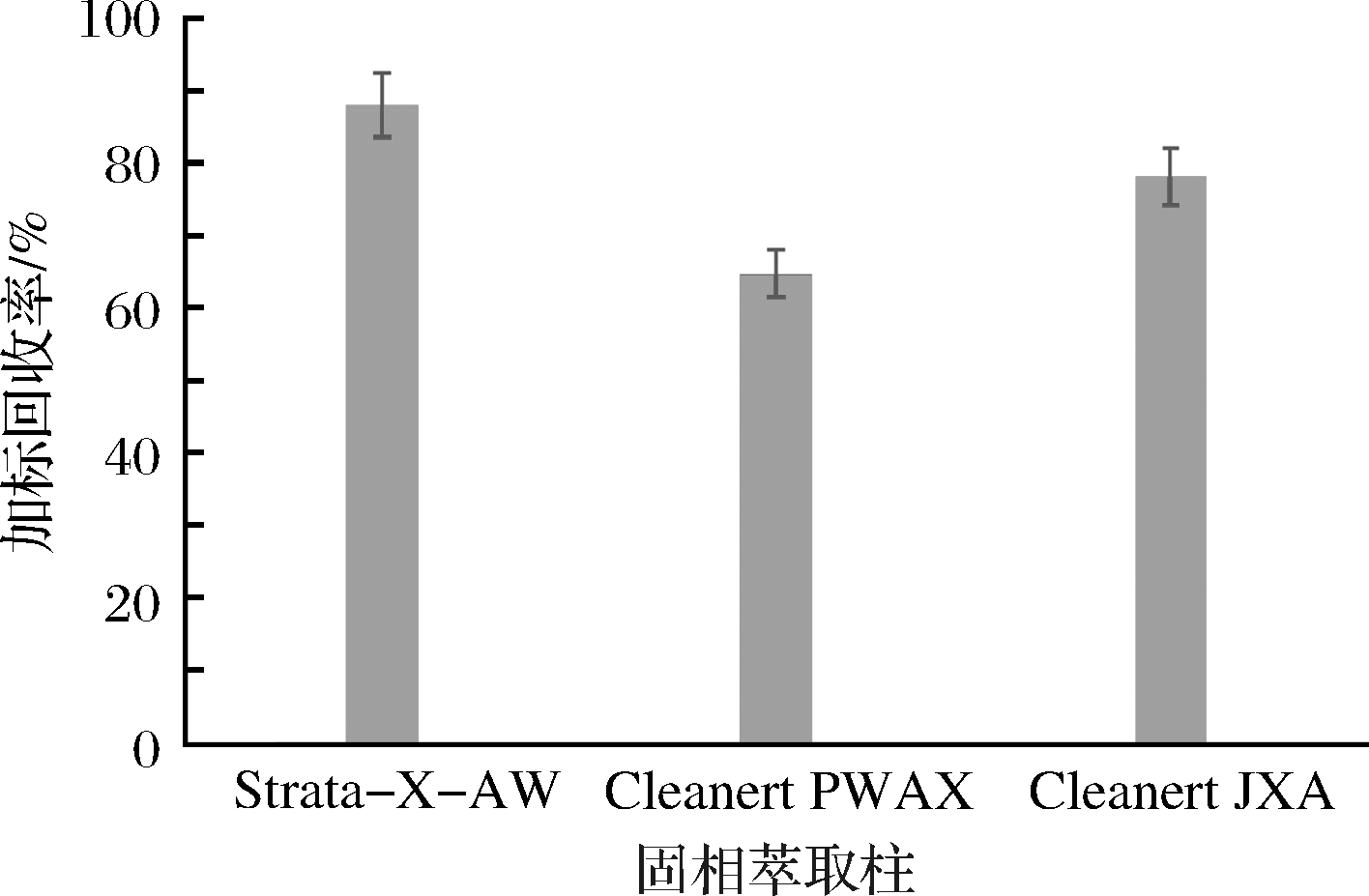
图7 固相萃取柱对加标回收率的影响
Fig.7 Effect of SPE column on recovery rate of standard addition
在净化过程中,针对是否需要平衡净化柱,对相关方式进行比对。结果发现,未加入2%甲酸水平衡的净化柱,在上样后弃去的样液中存在部分亮蓝颜色,同时加标回收率仅为10%~40%,证明未经甲酸水溶液平衡的固相萃取柱,无法将食品中提取的色素固定在净化柱中,因而在淋洗、洗脱等后续操作中会流失部分色素。而经甲酸水平衡的固相萃取柱,其加标回收率可达75%~92%。从净化柱结构来看,弱阴离子交换固相萃取柱在上样时为保证化合物离子最大化,应使样品溶液的pH高于化合物酸度系数至少2个pH单位,而洗脱时,洗脱溶液pH应大于化合物酸度系数至少2个pH单位。因此,选取在活化过程中加入弱有机酸水溶液——甲酸水来平衡固相萃取柱。
本实验中还尝试比对了样品过净化柱及未过净化柱对试验结果的影响。经仪器分析发现,未过净化柱直接检测的样品,其加标回收率为100%~110%,证明样品中亮蓝色素已被完全提取,但存在长时间测定时,仪器基线不稳,杂峰较多的问题。因此,本实验采取过净化柱处理。
2.1.7 浓缩方式对样品加标回收率的影响
分别考察旋转蒸发和氮气吹扫两种浓缩方式对样品加标回收率的影响。实验结果表明,旋转蒸发方式浓缩的样品加标回收率明显高于氮气吹扫浓缩的样品,并且样品平行性较好,同时可实现自动控制,便于试验操作。而氮气吹扫浓缩的样品,在烘干过程中,可能存在样品沾到小试管管壁上方而造成样品部分损失。同时,由于无法自动监控样品烘干情况,当样品烘干过度,再次利用去离子水溶解烘干后的样品时,样品无法完全溶解。因此,本实验中采用旋转蒸发方式浓缩样品。
综上所述,单因素实验结果表明:采取涡旋混合方式提取样品,提取次数为3次,NaHCO3添加量为0.5 g时,加标回收率好,同时发现NaHCO3添加量在0.1和0.5 g时加标回收率呈现缓慢上涨趋势,遂以NaHCO3添加量、甲醇水体积分数、涡旋时间、净化柱种类4个因素进行响应面优化实验。
2.2 响应面实验
2.2.1 建立二次回归方程及误差分析
对表1中的数据进行回归拟合得到二次回归方程。加标回收率=-586.789+85.742A+29.963B+1.964C+36.692D-0.453AB+0.898AC+2.208AD-0.054BC-0.290BD+1.435CD-80.542A2-0.354B2-0.147C2-9.400D2。
表1 响应面试验设计与结果
Table 1 Design and results of response surface test
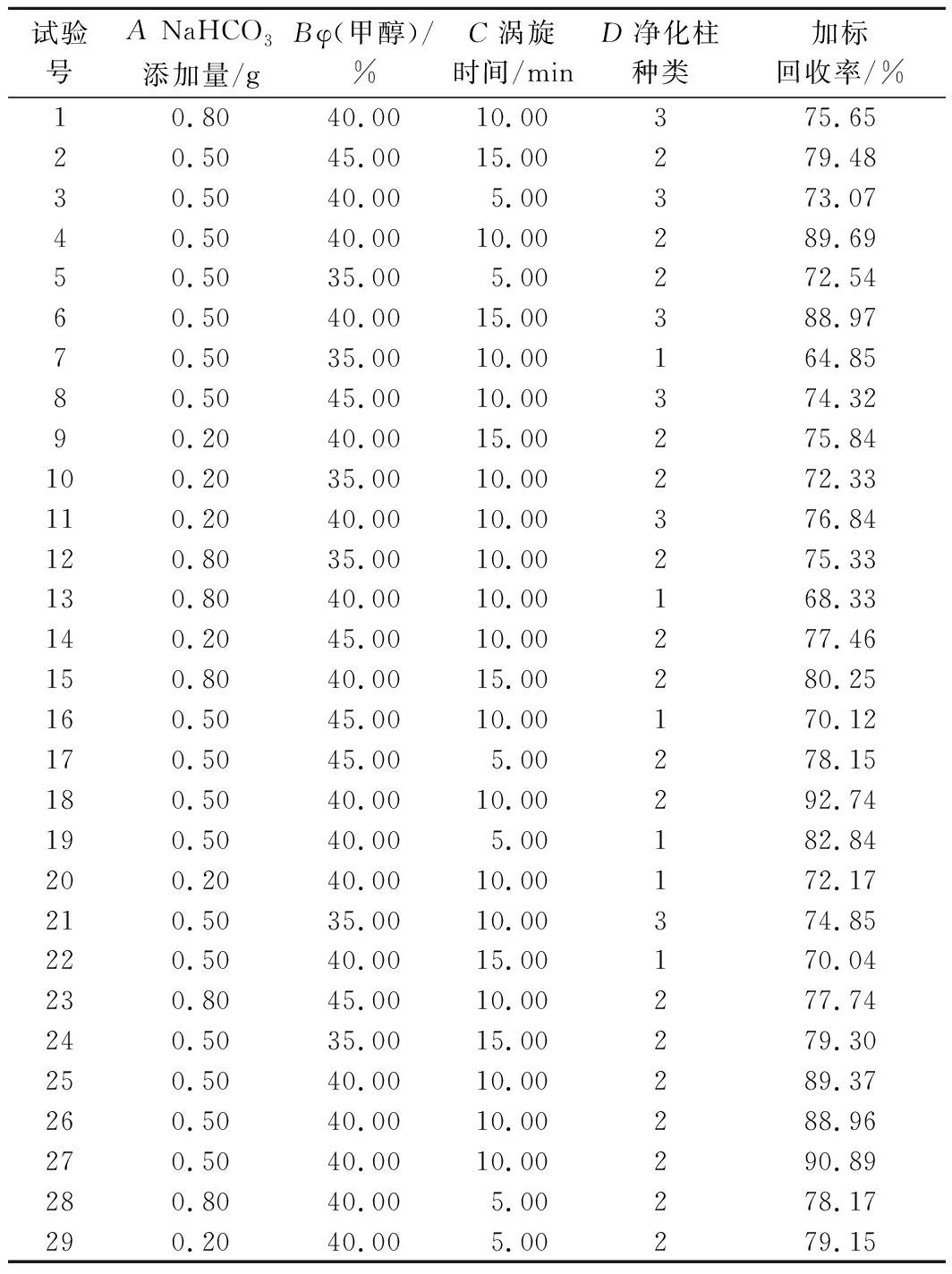
试验号A NaHCO3添加量/gBφ(甲醇)/%C涡旋时间/minD净化柱种类加标回收率/%10.8040.0010.00375.6520.5045.0015.00279.4830.5040.005.00373.0740.5040.0010.00289.6950.5035.005.00272.5460.5040.0015.00388.9770.5035.0010.00164.8580.5045.0010.00374.3290.2040.0015.00275.84100.2035.0010.00272.33110.2040.0010.00376.84120.8035.0010.00275.33130.8040.0010.00168.33140.2045.0010.00277.46150.8040.0015.00280.25160.5045.0010.00170.12170.5045.005.00278.15180.5040.0010.00292.74190.5040.005.00182.84200.2040.0010.00172.17210.5035.0010.00374.85220.5040.0015.00170.04230.8045.0010.00277.74240.5035.0015.00279.30250.5040.0010.00289.37260.5040.0010.00288.96270.5040.0010.00290.89280.8040.005.00278.17290.2040.005.00279.15
注:表中共有3种净化柱,分别以1(Cleanert PWAX)、2(Strata-X-AW)和3(Cleanert JXA)代表
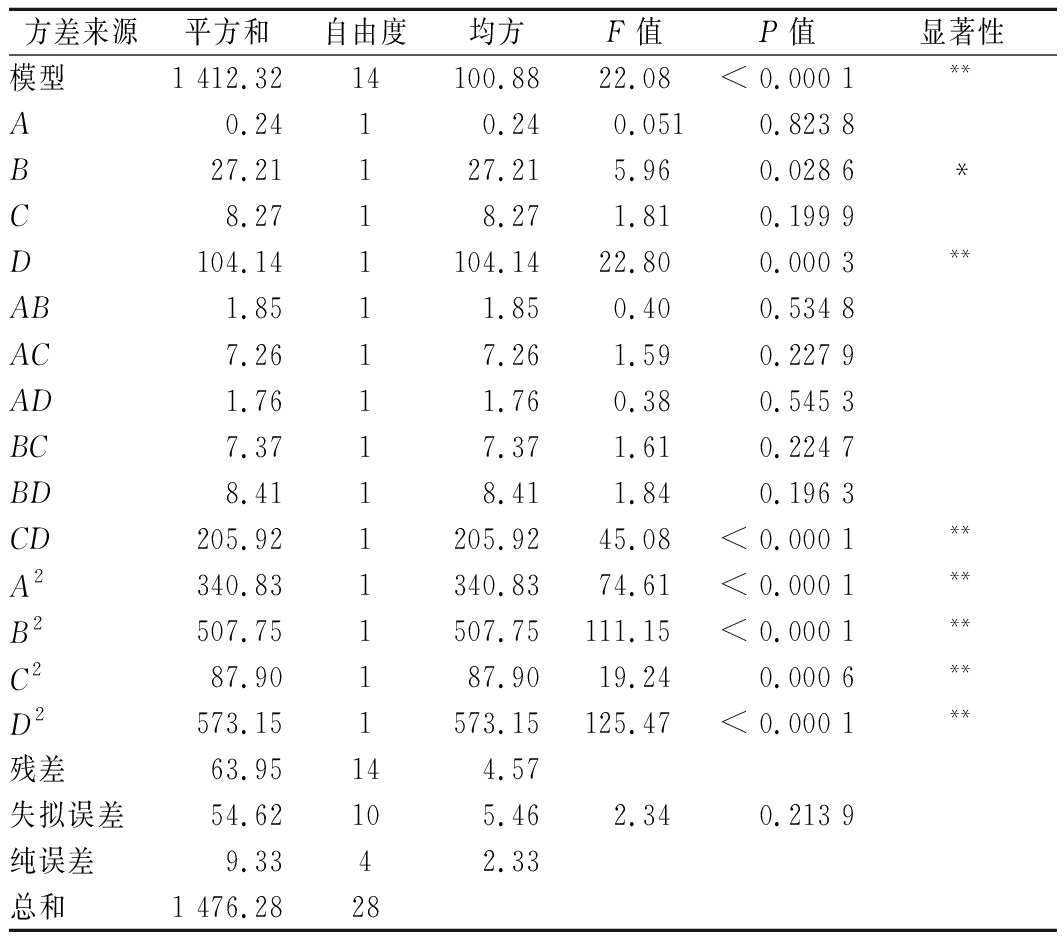
通过ANOVA进行回归方程误差分析,结果见表2。该模型回归显著,失拟项不显著,模型变异系数![]() 其中CV值与模型置信度呈现负相关,其数值越小置信度越好,而相关系数R2和
其中CV值与模型置信度呈现负相关,其数值越小置信度越好,而相关系数R2和![]() 越接近1,模型相关性则越好。本实验中数据说明该模型与实际试验拟合较好,自变量与响应值之间线性关系显著,可以用于黑米中亮蓝色素提取的预测。另外,所考察的4个因素中,D、CD、A2、B2、C2、D2对黑米中亮蓝色素提取的影响极显著;B因素影响显著;A、C、AB、AC、AD、BC、BD影响不显著,各因素影响从大到小依次为NaHCO3添加量、涡旋时间、甲醇水体积分数及净化柱种类。
越接近1,模型相关性则越好。本实验中数据说明该模型与实际试验拟合较好,自变量与响应值之间线性关系显著,可以用于黑米中亮蓝色素提取的预测。另外,所考察的4个因素中,D、CD、A2、B2、C2、D2对黑米中亮蓝色素提取的影响极显著;B因素影响显著;A、C、AB、AC、AD、BC、BD影响不显著,各因素影响从大到小依次为NaHCO3添加量、涡旋时间、甲醇水体积分数及净化柱种类。
2.2.2 优化组合验证试验
使用快速上升法优化得到的提取黑米中亮蓝的最佳方案为:NaHCO3 0.52 g,甲醇体积分数40.11%,涡旋时间12.17 min,净化柱种类为2.32,预估加标回收率为91.00%,但考虑实际情况,选取NaHCO3 0.52 g,甲醇水体积分数为40%,涡旋时间12 min,2号净化柱,对上述条件进行的验证,结果见表3。
表2 响应面误差分析结果
Table 2 Error analysis results of response surface
方差来源平方和自由度均方F值P值显著性模型1 412.3214100.8822.08< 0.000 1**A0.2410.240.0510.823 8B27.21127.215.960.028 6*C8.2718.271.810.199 9D104.141104.1422.800.000 3**AB1.8511.850.400.534 8AC7.2617.261.590.227 9AD1.7611.760.380.545 3BC7.3717.371.610.224 7BD8.4118.411.840.196 3CD205.921205.9245.08< 0.000 1**A2340.831340.8374.61< 0.000 1**B2507.751507.75111.15< 0.000 1**C287.90187.9019.240.000 6**D2573.151573.15125.47< 0.000 1**残差63.95144.57失拟误差54.62105.462.340.213 9纯误差9.3342.33总和1 476.2828
注:**表示极显著(P<0.01);*表示显著(0.01<P<0.05)
表3 最优组验证试验
Table 3 Validation test of optimal group

NaHCO3添加量/gφ(甲醇)/%涡旋时间/min净化柱种类加标回收率/%相对标准偏差/%0.524012291.811.63
由表3得出,最优组亮蓝提取加标回收率为91.81%,接近于响应面试验组中最高组回收率,与理论预测值相比,其相对误差约为0.81%。说明响应面优化后得出的回归方程有一定的实践指导意义。
2.3 标准曲线、方法检出限及精密度
合成着色剂亮蓝的标准品色谱图及黑米样品中加标后的亮蓝色谱图分别见图8和图9。选取标准曲线中间浓度点重复进样测定10次,对仪器稳定性进行验证。以质量浓度X为横坐标,对应的色谱峰面积Y为纵坐标,绘制标准曲线,建立线性回归方程。方法检出限依据3倍信噪比计算,方法定量限依据10倍信噪比计算。经测定可得,亮蓝的线性方程为Y=87 231.6X-451.536 2,相关系数R=0.999 99,最低检出浓度为0.02 mg/kg,定量限为0.05 mg/kg,方法精密度[23]为5.00%,标准方差为2.00%,相对标准偏差为1.63%。
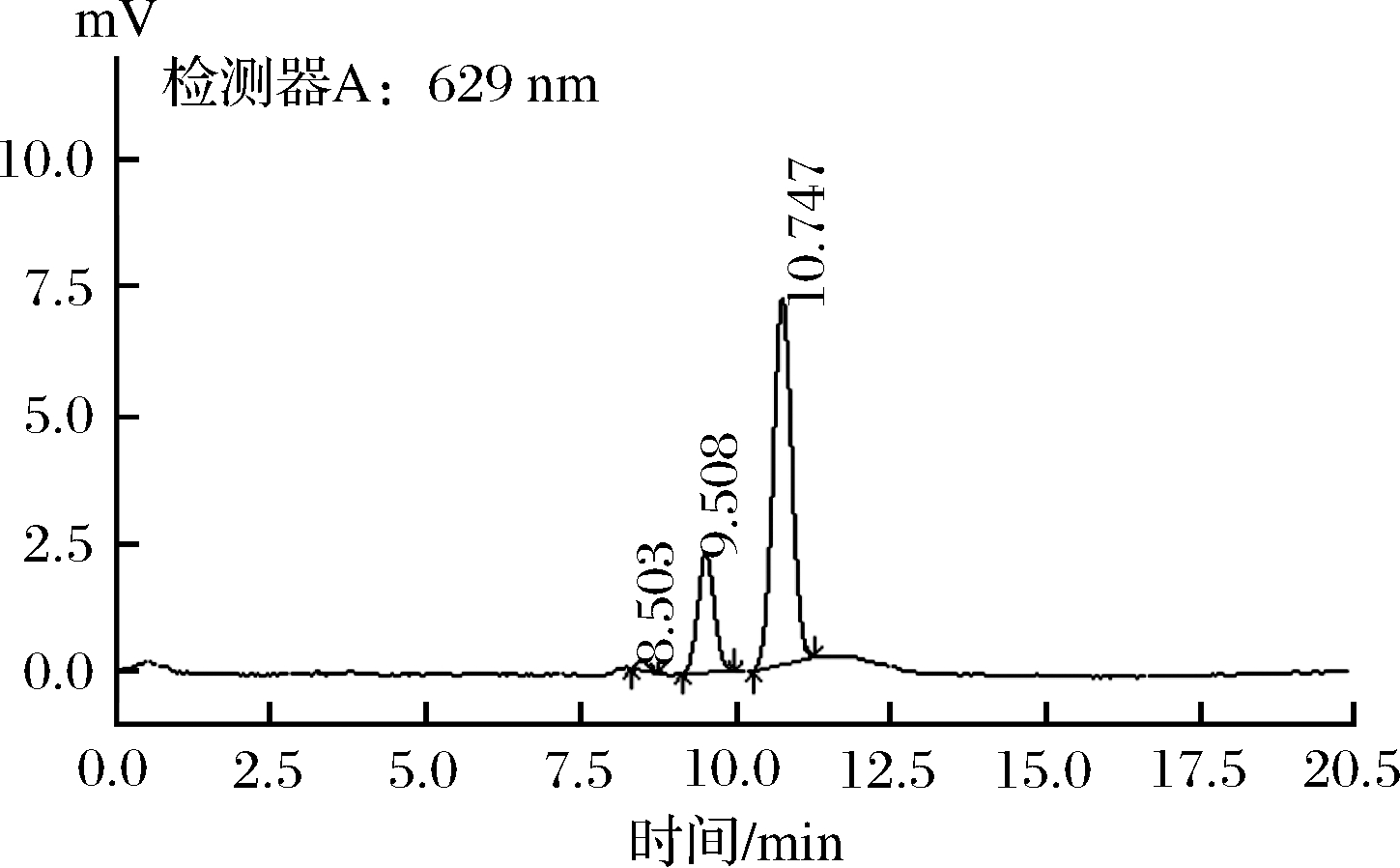
图8 合成着色剂亮蓝标准品色谱图
Fig.8 Chromatogram of synthetic colorant bright blue
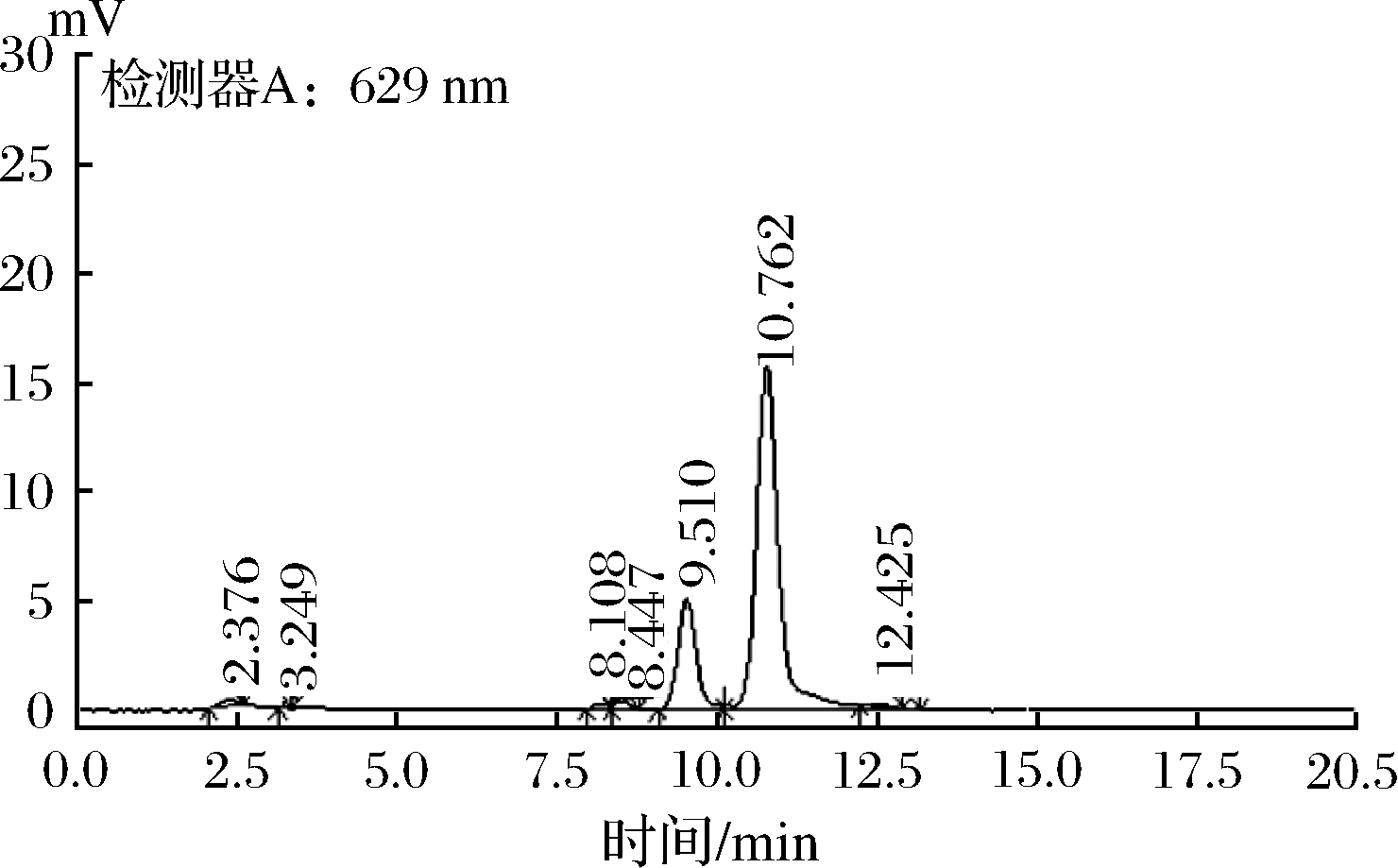
图9 黑米样品中加标后亮蓝色谱图
Fig.9 Bright blue spectrum in black rice samples
2.4 样品方法验证及加标回收率实验
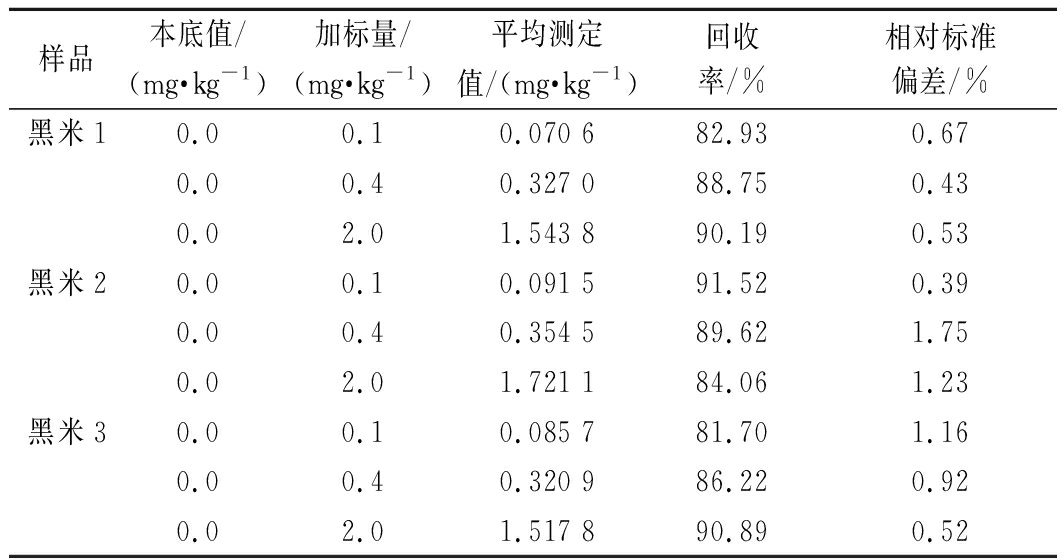
购买3种不同品牌的黑米样品,分别对样品中的亮蓝进行测定,同时验证其加标回收率,测定结果如表4所示。
表4 不同品牌黑米样品加标回收率和相对标准偏差
Table 4 Spike recovery and relative standard deviation of different black rice samples
样品本底值/(mg·kg-1)加标量/(mg·kg-1)平均测定值/(mg·kg-1)回收率/%相对标准偏差/%黑米10.0 0.1 0.070 6 82.93 0.670.0 0.4 0.327 0 88.75 0.430.0 2.0 1.543 8 90.19 0.53黑米20.0 0.1 0.091 5 91.52 0.390.0 0.4 0.354 5 89.62 1.750.0 2.0 1.721 1 84.06 1.23黑米30.0 0.1 0.085 7 81.70 1.160.0 0.4 0.320 9 86.22 0.920.0 2.0 1.517 8 90.89 0.52
3种不同市购黑米样品内部本身都不存在亮蓝色素,在不同浓度加标情况下测得回收率为81.70%~91.52%,相对标准偏差为0.39%~1.75%,证明了本实验方法可行性及稳定性。
3 结论
本文联合采用固相萃取及高效液相色谱法测定黑米中的着色剂亮蓝,通过对国标GB 5009.35—2016中前处理和测定方法的改进,简化了前处理的操作,使亮蓝色素得到更好地分离。目前对黑米样品中天然色素(花色苷)方面的研究较多,而产品中是否含有合成着色剂还未曾验证,本文随机购买市面上3种黑米产品,通过分析验证得出黑米类产品中不含着色剂亮蓝。无论是产品还是提取方法,均突显出本实验的创新性。本实验研究得出当NaHCO3添加量为0.52 g,体积分数40%甲醇水溶液作为提取液,涡旋12 min,重复3次提取时,能够将黑米中添加的亮蓝完全提取出来,同时采用经甲酸水平衡的Strata-X-AW固相萃取柱净化,后经旋转蒸发方式浓缩样品,得到样品加标回收率为81.70%~91.52%,相对标准偏差为0.39%~1.75%,为黑米中着色剂亮蓝的提取与测定提供了一种可靠、快速和便捷的分析方法。
[1] 李静娜,黄常刚,梁高道,等.固相萃取-高效液相色谱法测定食品中的靛蓝和亮蓝[J].卫生研究,2017,46(2):318-323.
LI J N,HUANG C G,LIANG G D,et al.Determination of indigo and brilliant blue in different types of food products by high performance liquid chromatography with solid phase extraction[J].Journal of Hygiene Research,2017,46(2):318-323.
[2] WALESKA DE A S B,BRUNO P L,ANA P S P.Simultaneous determination of synthetic colorants in yogurt by HPLC[J].Food Chemistry,2016,197:1 347-1 347.
[3] MINIOTI K S,SAKELLARIOU C F,THOMAIDIS N S.Determination of 13 synthetic food colorants in water-soluble foods by reversed-phase high-performance liquid chromatography coupled with diode-array detector[J].Analytica Chimica Acta,2007,583(1):103-110.
[4] 邓六爱,张念英,郭冰,等.HPLC法测定茶叶中的6种合成着色剂[J].农产品加工,2019(14):49-51;54.
DENG L A,ZHANG N Y,GUO B,et al.Simultaneous analysis of synthetic colorants in tea by HPLC[J].Farm Products Processing,2019(14):49-51;54.
[5] MUHAMMAD I K M,MANAF O,SUJITH A,et al.Polymer thin films for chromatographic separation of plant pigments[J].Materials Letters,2019,252:321-324.
[6] 张倩茹,佟玲,田冬,等.薄层色谱法分离菠菜中天然色素的研究[J].蚌埠学院学报,2017,6(6):67-70.
ZHANG Q R,TONG L,TIAN D,et al.Study of preparation natural pigments in spinach with thin layer chromatography[J].Journal of Bengbu University,2017,6(6):67-70.
[7] 李丹梅. 高效液相法同时测定饮料中5种合成着色剂[J].食品安全导刊,2018(27):129.
LI D M.Simultaneous determination of 5 synthetic colorants in beverages by HPLC[J].China Food Safety Magazine,2018(27):129.
[8] 吕志勇,岳虹,陈静,等.高效液相色谱法测定发酵乳中着色剂的含量[J].乳业科学与技术,2018,41(5):20-23.
LV Z Y,YUE H,CHEN J,et al.Determination of food colorants in fermented milk by high performance liquid chromatography[J].Journal of Dairy Science and Technology,2018,41(5):20-23.
[9] MATHIYALAGAN S,MANDAL B K,LING Y C.Determination of synthetic and natural colorants in selected green colored foodstuffs through reverse phase-high performance liquid chromatography[J].Food Chemistry,2019,278:381-387.
[10] ARRIZABALAGA L A,RODR GUEZ P,MEDINA M,et al.Simultaneous analysis of natural pigments and E-141i in olive oils by liquid chromatography-tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry,2019,411(21):5 577-5 591.
GUEZ P,MEDINA M,et al.Simultaneous analysis of natural pigments and E-141i in olive oils by liquid chromatography-tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry,2019,411(21):5 577-5 591.
[11] 曾凯,罗明标,唐俊,等.改进QuEChERS-液质联用法测定食品中6种非食用色素[J].现代化工,2017,37(11):198-201.
ZENG K,LUO M B,TANG J,et al.Simultaneous determination of six inedible pigments in food by improved QuEChERS-UPLC-MS/MS method[J].Modern Chemical Industry,2017,37(11):198-201.
[12] ADIL E.Interference-free determination of carmine in food samples using ultrasonic assisted cloud point extraction coupled with spectrophotometry[J].Cumhuriyet Science Journal,2019,40(2):305-316.
[13] MEILING W,MINGZHU C,MIN Z,et al.Sensitive determination of Amaranth in foods using graphene nanomeshes[J].Journal of Electroanalytical Chemistry,2018,809:117-124.
[14] WENSHENG H,MIAO Z,WEIBING H.N-methyl-2-pyrrolidone-exfoliated graphene nanosheets as sensitive determination platform for amaranth at the nanomolar level[J].Ionics,2017,23(1):241-246.
[15] 王乐,郑新华,尚贞海,等.SERS法快速检测食品中新红[J].食品科技,2018,43(3):310-314.
WANG L,ZHENG X H,SHANG Z H,et al.Rapid screening newred in food by SERS[J].Food Science and Technology,2018,43(3):310-314.
[16] YUN F X,TING C,YA H G,et al.Rapid SERS detection of acid orange II and brilliant blue in food by using Fe3O4@Au core-shell substrate[J].Food Chemistry,2019(270):173-180.
[17] AI Y J,LIANG P,WU Y X,et al.Rapid qualitative and quantitative determination of food colorants by both Raman spectra and Surface-enhanced Raman Scattering (SERS)[J].Food chemistry,2018,241:427-433.
[18] KATERINA S M,CHRISTINA F S,NIKOLAOS S T.Determination of 13 synthetic food colorants in water-soluble foods by reversed-phase high-performance liquid chromatography coupled with diode-array detector[J].Analytica Chimica Acta,2006,583(1):103-110.
[19] 马先红,许海侠,韩昕纯.黑米的营养保健价值及研究进展[J].食品工业,2018,39(3):264-267.
MA X H,XU H X,HAN X C.Nutritional health value and research progress of black rice[J].The Food Industry,2018,39(3):264-267.
[20] 刘长姣,熊湘炜,郑霞,等.HPLC法测定黑米矢车菊素-3-葡萄糖苷[J].中国食品添加剂,2017(9):210-215.
LIU C J,XIONG X W,ZHENG X,et al.Detection of cyanidin-3-glucoside in black rice by HPLC[J].China Food Additives,2017(9):210-215.
[21] 刘长姣,郑霞,熊湘炜,等.分光光度法测定黑米花青素方法的建立[J].粮食与油脂,2019,32(1):73-77.
LIU C J,ZHENG X,XIONG X W,et al.Detection of anthocyanin in black rice by spectrophotometry[J].Cereals & Oils,2019,32(1):73-77.
[22] 晏晓清,张艳芳,陈芩,等.超声提取-液相色谱法检测黑米中花青素[J].食品安全导刊,2019(21):75-76.
YAN X Q,ZHANG Y F,CHEN Q,et al.Extraction of anthocyanins from rice by ultrasonic chromatography[J].China Food Safety Magazine,2019(21):75-76.
[23] 王治博,宋顺宗,张子波.黑米花色苷通过激活Nrf2/HO-1信号通路保护四氯化碳所致急性肝损伤的机制[J].时珍国医国药,2019,30(5):1 097-1 100.
WANG Z B,SONG S Z,ZHANG Z B.AEBR protects against carbon tetrachloride-induced liver injury via Nrf2/HO-1 activation[J].Lishizhen Medicine and Materia Medica Research,2019,30(5):1 097-1 100.
[24] 李祥,张晓寒,韩英,等.黑米花青素延缓果蝇衰老作用研究[J].食品科学技术学报,2020,38(1):74-79.
LI X,ZHANG X H,HAN Y,et al.Delaying aging effect of black rice anthocyanin on drosophila melanogaster[J].Journal of Food Science and Technology,2020,38(1):74-79.
[25] 厉成玲,周东浩.黑米多酚对四氧嘧啶诱导糖尿病小鼠的影响[J].食品安全质量检测学报,2020,11(10):3 189-3 193.
LI C L,ZHOU D H.Effect of black rice polyphenols on alloxan induced diabetes in mice[J].Journal of Food Safety & Quality,2020,11(10):3 189-3 193.
[26] 郭玲玲,杨悦,周寅生.马齿苋黑米蛋糕的研制[J].江苏调味副食品,2017(4):4-6;10.
GUO L L,YANG Y,ZHOU Y S.The study on processing technology of purslane and black rice cake[J].Jiangsu Condiment and Subsidiary Food,2017(4):4-6;10.
[27] 刘世娟,范业文,刘崇万,等.黑米红豆复合饮料的研制[J].食品研究与开发,2018,39(1):95-99.
LIU S J,FAN Y W,LIU C W,et al.Research on black rice and adzuki bean compound beverage[J].Food Research and Development,2018,39(1):95-99.
[28] 中华人民共和国国家卫生和计划生育委员会.GB 5009.35—2016,食品中合成着色剂的测定[S].北京:中国标准出版社,2016.
State Health and Family Planning Commission of the People’s Republic of China.GB 5009.35—2016,Determination of synthetic colorants in food[S].Beijing:China Standard Press,2016.
[29] 周澍堃,曹雁平,黄正华.黑米色素在超声场中稳定性研究[J].中国食品添加剂,2015(3):71-76.
ZHOU S K,CAO Y P,HUANG Z H.Study on stability of the pigments from black rice under ultrasonic condition[J].China Food Additives,2015(3):71-76.
[30] 吴嘉彦,戴辉.食品中9种人工合成着色剂的检测[J].广东化工,2019,46(11):196-198.
WU J Y,DEI H.The Determination of nine synthetic colors in food[J].Guangdong Chemical Industry,2019,46(11):196-198.