展青霉素(patulin,PAT)是一种由青霉属、曲霉属和丝衣霉属等真菌代谢产生的天然毒物[1],其污染范围非常广,欧洲和亚洲的多个国家和地区均有食品污染的相关报道[2-3]。PAT的主要污染对象是水果、坚果、油料作物及其制品,尤其是苹果等果品及其制品等,其PAT污染是世界范围内重点控制的果品真菌毒素污染[4]。GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》明确规定,PAT在苹果、山楂及其制品中限量标准为50 μg/kg[5]。目前PAT主要采用色谱技术来进行定量检测,结果准确可靠,主要应用于实验室和质检部门。而PAT特殊的理化性质和较小的分子质量导致其目前尚无成熟的抗体,因此基于免疫技术的快检方法(酶联免疫法、免疫层析等)及产品研发相对其他真菌毒素差距较大,为PAT快检发展带来严峻挑战[6]。
适配体是一种人工合成的核酸,对目标物具有高特异性,同时具有结构稳定、制备成本低、便于化学修饰的特点,是抗体的良好替代物。目前,已成功筛选到PAT的适配体,在一定程度上缓解了PAT抗体缺乏的情况,利用适配体建立PAT的快速检测方法具有良好的发展前景[7-9]。ZnO纳米材料具有化学性质稳定、晶体形态多样、生物相容性好、电催化效应强等多重优势,在电化学检测方面得到了广泛的研究[10-11]。目前已有一些基于ZnO纳米材料构建生物传感器的报道,如王宝[12]使用水热反应合成ZnO纳米花材料,并将其喷涂于ITO电极表面构建左旋多巴电化学传感器,利用ZnO纳米花增大电化学反应面积,提高了左旋多巴传感器的检测性能;有学者在玻碳电极上组装了ZnO纳米棒,为酶提供了大量的结合位点,实现对靶标物邻苯二酚的高灵敏检测[13]。然而,利用刷状ZnO纳米材料构建电化学传感器报道较少[8]。
本研究通过制备刷状ZnO纳米材料,利用壳聚糖优异的分散性和成膜性,将氨基改性的ZnO纳米刷均匀滴涂在金电极表面以增大工作电极有效面积,利用酰胺反应将PAT的适配体固定在ZnO纳米刷表面,构建PAT电化学适配体传感体系,进行PAT的快速检测。
1 材料与方法
1.1 材料与试剂
PAT标准品、赭曲霉毒素A(ochratoxin A,OTA)标准品,新加坡Pribolab公司;Zn(NO3)2·6H2O、NaOH、正硅酸乙酯(tetraethyl orthosilicate, TEOS)、3-氨丙基三乙氧基硅烷(aminopropyltriethoxysilane, APTES)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide, EDC)、N-羟基琥珀酰亚胺(N-hydroxy succinimide, NHS)、壳聚糖(chitosan, CS),上海阿拉丁生化科技有限公司;AlCl3、K3[Fe(CN)6]、K4Fe(CN)6、KCl、牛血清白蛋白(bovine serum albumin,BSA)、果胶酶,上海麦克林生化科技有限公司;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;PAT适配体(序列[14]:5′-COOH-GGC CCG CCA ACC CGC ATC ATC TAC ACT GAT ATT TTA CCTT-3′)、PBS磷酸缓冲液,上海生工生物工程有限公司;所用试剂均为分析纯,试验用水为超纯水。
1.2 仪器与设备
反应釜,析牛科技有限公司;101-4-S电热恒温鼓风干燥箱,上海跃进医疗器械厂;SU8010高分辨场发射扫描电镜,日立(中国)有限公司;Spectrun100傅里叶变换红外光谱仪,美国PerkinElmer公司;X’Pert PRO MPD X射线衍射仪,荷兰帕纳科公司;CHI600E电化学工作站,三电极系统(参比电极:CHI150饱和甘汞电极;对电极:CHI115铂丝电极;工作电极:CHI101金盘电极),上海辰华仪器有限公司;氮吹仪,常州朗越仪器制造有限公司。
1.3 实验方法
1.3.1 ZnO纳米刷材料的合成
将5 mmol Zn(NO3)2·6H2O和5 mmol NaOH分别用10 mL超纯水溶解,之后将NaOH溶液缓慢滴加至Zn(NO3)2溶液中(不断搅拌),调节pH至13后,将溶液转入50 mL的反应釜中,100 ℃下反应2 h,离心,所得固体产物分别用乙醇和超纯水洗涤3次,放入烘箱60 ℃烘干,得到白色粉末状固体。将所得固体用X射线衍射仪和扫描电子显微镜进行表征。
1.3.2 ZnO纳米刷材料的改性
取20 mg ZnO纳米刷材料,分散波处理于20 mL正丙醇和40 mL乙醇的混合液中,超声波处理10 min。边搅拌边依次加入1.5 mL氨水(质量分数25%、320 μL TEOS、80 μL APTES,室温下搅拌反应8 h。将上述溶液8 000 r/min离心10 min,得到沉淀,随后用超纯水清洗该沉淀,并将其分散于PBS溶液中。改性后的材料进行红外光谱表征。
1.3.3 ZnO纳米刷材料对适配体的负载
取适量改性的ZnO纳米刷材料上清液,依次向其中加入等体积的0.4 mol/L EDC和0.1 mol/L NHS混合液,再加入不同浓度的适配体溶液,使得ZnO纳米材料的质量(mg)与适配体物质的量(μmol)之比呈现1∶2、1∶4、1∶6、1∶8、1∶10的梯度,37 ℃水浴中搅拌2 h,离心,测定上清液260 nm处的吸光度,通过朗伯-比尔定律公式(1)和差减法计算得到ZnO纳米材料上所负载的适配体量。
A=a×l×c
(1)
式中:a,吸光系数,L/(g·cm);l,光在样本中经过的距离(通常为比色皿的厚度),cm;c,溶液质量浓度,g/L
1.3.4 PAT电化学适配体传感器的构建与表征
配制5 mmol/L K3[Fe(CN)6]、5 mmol/L K4Fe(CN)6混合水溶液(含有0.1 mmol/L KCl)作为电解质支持液。金电极作为工作电极,甘汞电极作为参比电极,铂丝电极作为对电极,使用循环伏安法(cyclic voltammetry,CV)扫描,扫速为50 mV/s,当氧化峰和还原峰的电位差小于90 mV时,表明金电极抛光效果达到要求。将符合要求的金电极用超纯水冲洗,氮气吹干备用。
将1 mg ZnO纳米刷材料与1 mg壳聚糖分散在1 mL乙酸(体积分数1%)水溶液中,超声波处理30 min得到均匀的ZnO-CS分散液。将2 μL分散液垂直滴加在电极上,同时将等体积含0.4 mol/L EDC和0.1 mol/L NHS的溶液与适配体溶液混合,37 ℃保温30 min以活化适配体5′端修饰的羧基。之后在电极表面滴适配体溶液,37 ℃湿孵。在金电极表面滴加质量分数5% BSA 溶液。取一定浓度的PAT乙腈溶液,竖直滴加于金电极表面,室温下反应1 h。每一层修饰操作完毕后,对金电极进行CV扫描和电化学阻抗谱扫描(electrochemical impedance spectroscopy, EIS),扫描的频率范围设置为0.01 k~100 kHz。
1.3.5 对PAT适配体传感器性能的影响因素研究
将打磨好的金电极置于电解支持液中,进行差分脉冲伏安法(differential pulse voltammetry, DPV)扫描,扫描范围0~0.8 V,记录初始电流峰值I0,然后将不同体积ZnO-CS分散液滴加在金电极表面,37 ℃孵育,直到干燥,再次进行DPV扫描,记录电流峰值I1,计算ΔI1=I0-I1。之后用不同浓度适配体修饰电极,湿孵一段时间,超纯水冲洗电极,氮吹后进行DPV扫描,记录电流峰值I2,计算ΔI2=I0-I2。再将适配体用不同的修饰时间修饰电极,湿孵一段时间后用超纯水冲洗,氮吹后进行DPV扫描,记录电流峰值I3,计算ΔI3= I0-I3。最后滴加含质量分数5% BSA的PBS溶液5 μL,湿孵一段时间,用超纯水冲洗,氮吹,再次进行DPV扫描,记录电流峰值I4,计算ΔI4=I0-I4。
1.4 实际样品检测
取1.0 g组织捣碎机处理好的样品,加入超纯水至10 mL(处理好的山楂片样品直接加入10 mL超纯水),加入不同浓度的PAT毒素标准品溶液,涡旋混匀,室温下静置过夜。加入1 mg固体果胶酶,50 ℃水浴酶解3 h,加入10 mL乙酸乙酯,涡旋5 min,超声波处理10 min,分层后小心吸取有机层,氮气吹干,加入10 mL PBS溶液复溶,待测。
1.5 数据处理分析
相关实验数据,使用Microsoft Office Excel 2016进行统计,并计算平均值和标准偏差,使用SPSS 22.0对数据进行方差分析(ANOVA),使用Duncan’s 多重比较进行显著性分析,P<0.05表示差异显著。使用Origin 9进行绘图,标准偏差用对称误差棒表示,显著性分析结果用字母表示。
2 结果与分析
2.1 ZnO纳米材料的表征
2.1.1 ZnO纳米材料的形貌
合成的ZnO纳米材料扫描电镜图见图1-a。合成的ZnO纳米材料成簇生长,长度为10 μm左右,直径在300 nm以内。ZnO纳米材料表面粗糙,朝同一方向生成密集的片层结构,类似“刷状”,这可能是由于ZnO在pH 13的碱性条件下合成,OH-含量太高,导致中间产物[Zn(OH)4]2-大量生成并被过量吸附在ZnO晶体的正极面(轴向)上,[Zn(OH)4]2-来不及完全水解生成ZnO,从而影响到之后中间体在极性面的堆砌过程,只能堆砌在侧面(径向),最终形成刷状结构[15]。
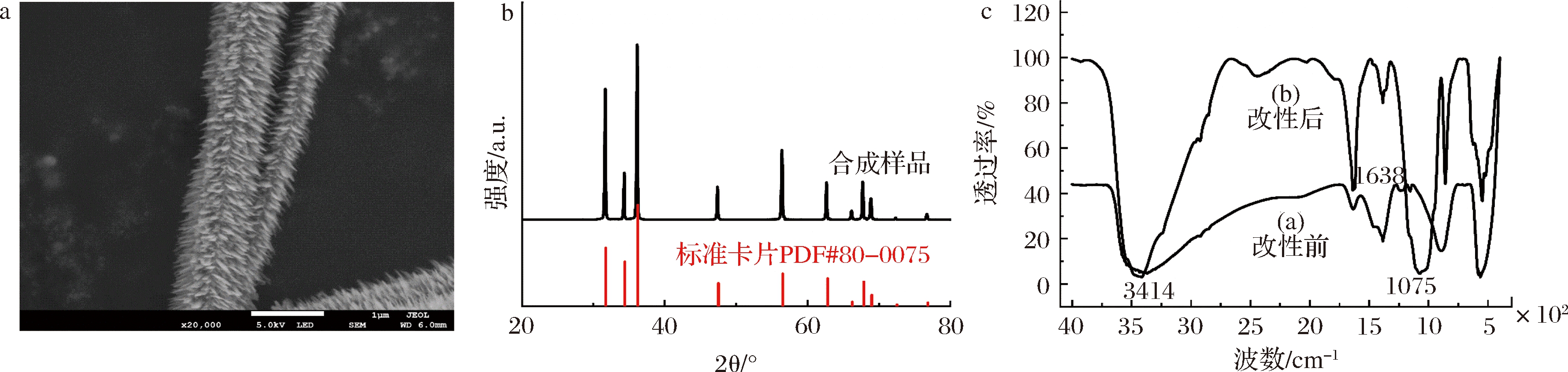
a-ZnO纳米材料的扫描电镜图;b-ZnO材料的X射线衍射谱;c-ZnO纳米刷修饰氨基前后的红外光谱图
图1 ZnO纳米材料的表征
Fig.1 Characterization of ZnO Nanomaterials
2.1.2 ZnO纳米材料的晶型
使用X射线衍射仪对合成材料进行表征,以研究其物相。结果如图1-b所示,X射线衍射图谱与标准卡片PDF#80-0075相一致,说明该物质是六方纤锌矿结构。此外,样品衍射峰形态尖锐,宽度较窄,无其他杂峰,表明所合成的ZnO材料纯度高,结晶性能较好。
2.1.3 ZnO纳米材料的红外光谱
利用硅烷试剂对ZnO纳米材料进行改性和氨基修饰。TEOS通过水解作用生成SiO2并包裹在ZnO表面,其表面具有硅羟基,之后APTES提供氨基进行修饰。改性前和改性后的ZnO纳米刷的红外光谱图见图1-c。改性后出现3个明显的吸收峰,3 414 cm-1处为N-H的伸缩振动峰,1 638 cm-1处为N-H的弯曲振动峰,1 075 cm-1处为Si-O-Si的不对称伸缩振动峰,表明氨基已经成功修饰在ZnO纳米刷材料表面[16]。此外,改性后新出现的位于2 500 cm-1附近的特征峰,为Si-H的伸缩振动峰;改性前后均存在1 400 cm-1附近的特征峰,可能与饱和烃基的变化有关,这可能是由于ZnO纳米材料中残留了清洗液无水乙醇,以及硅烷试剂水解生产的醇或硅醇。
2.2 电化学适配体传感器的构建原理
PAT电化学适配体传感器的构建如图2所示,壳聚糖具有良好的成膜能力和导电性,透水性高,附着力好,利用其优异的成膜性和稳定性将氨基修饰的ZnO纳米刷均匀滴涂在金电极表面[8]。
首先用EDC和NHS活化PAT适配体5′端的羧基,然后将适配体滴加于金电极表面,ZnO纳米材料表面的氨基和适配体5′端的羧基发生酰胺反应,将PAT适配体固定在电极表面。接着使用BSA作为封闭剂,占据电极表面剩余的位点。滴加待测液后,当存在靶标物质PAT时,会被适配体识别,二者特异性结合形成复合物,导致金电极表面的电子传递能力发生改变,通过测定靶标物质结合前后的电化学信号变化值,计算待测液中靶标物质的含量。
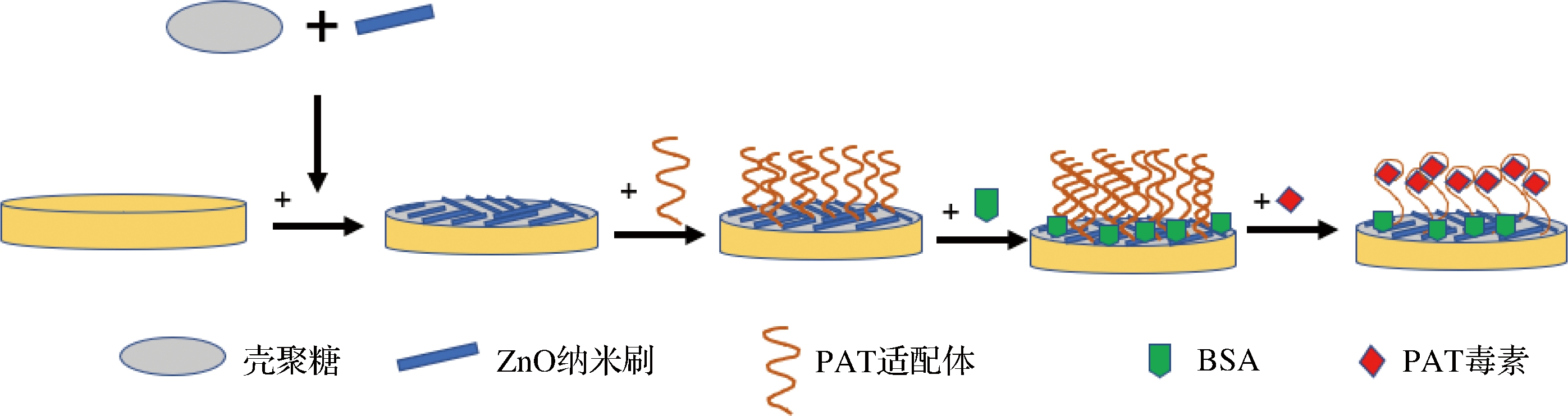
图2 电化学适配体传感器构建示意图
Fig.2 Construction diagram of electrochemical aptasensor
2.3 ZnO纳米材料对适配体的负载能力
如图3所示,实际添加的PAT适配体和ZnO纳米刷的比例(AptPAT:ZnO)从2增大至10的过程中,适配体在ZnO纳米刷上的负载量不断增长,表明随着PAT适配体添加量不断增多,结合在ZnO纳米刷表面的适配体数量显著增加;当AptPAT∶ZnO大于10时,负载量趋于平稳,表明结合在ZnO纳米刷表面的适配体数量达到饱和状态。此时,ZnO纳米刷对PAT适配体的负载量为0.076 nmol/mg。

图3 PAT适配体在ZnO纳米材料上的负载量
Fig.3 The number of patulin aptamers loaded on nanometer ZnO
注:不同字母表示差异显著(P<0.05)(下同)
2.4 电化学适配体传感器的构建及表征
利用CV及EIS对构建的PAT电化学适配体传感器进行表征(图4)。图4-a的曲线a显示的是修饰改性前的裸金电极,电阻小、电子传递效率高,因此氧化还原电流峰值最高;曲线b显现的是电阻增大,分析原因是ZnO纳米材料在晶体状态下导电性能较差,但壳聚糖本身带正电,对于电解支持液中的[Fe(CN)6]3-/4-探针有很好的吸附能力,有助于电子传递,二者共同修饰电极之后,ZnO纳米材料对电子传递的影响更占优势,因此氧化还原电流峰值降低[17];曲线c也显示氧化还原电流峰值降低,说明PAT适配体通过酰胺反应被固定在电极表面,由于DNA骨架本身带负电,当[Fe(CN)6]3-/4-探针分子靠近电极时会产生排斥作用,阻碍电子转移[18];曲线d显示氧化还原电流峰值进一步降低,原因是蛋白质BSA不导电,封闭电极上剩余的结合位点之后造成氧化还原电流峰值下降;当电极上的适配体与靶标物质PAT毒素结合生成复合物之后,会产生空间位阻,进一步阻碍电子传递,导致氧化还原电流峰值再次降低(曲线e)。上述结果表明,电极修饰过程中每一层物质都成功地修饰在电极表面上,并且检测过程中探针和靶标物质成功发生特异性结合。
采用EIS进一步验证和表征反应过程见图4-b,主要通过奈奎斯特曲线高频区半圆的直径反映电子转移阻抗(Ret),即电子转移能力的大小[19]。图4-b中的a、b、c、d、e五条曲线依次对应金电极表面的每一层修饰操作,可以看出随着修饰物在电极表面的层层组装,至最后的特异性结合过程,阻抗依次增大,与CV表征中实验结果具有一致性,进一步表明传感器的成功构建以及检测过程中特异性结合反应的发生。
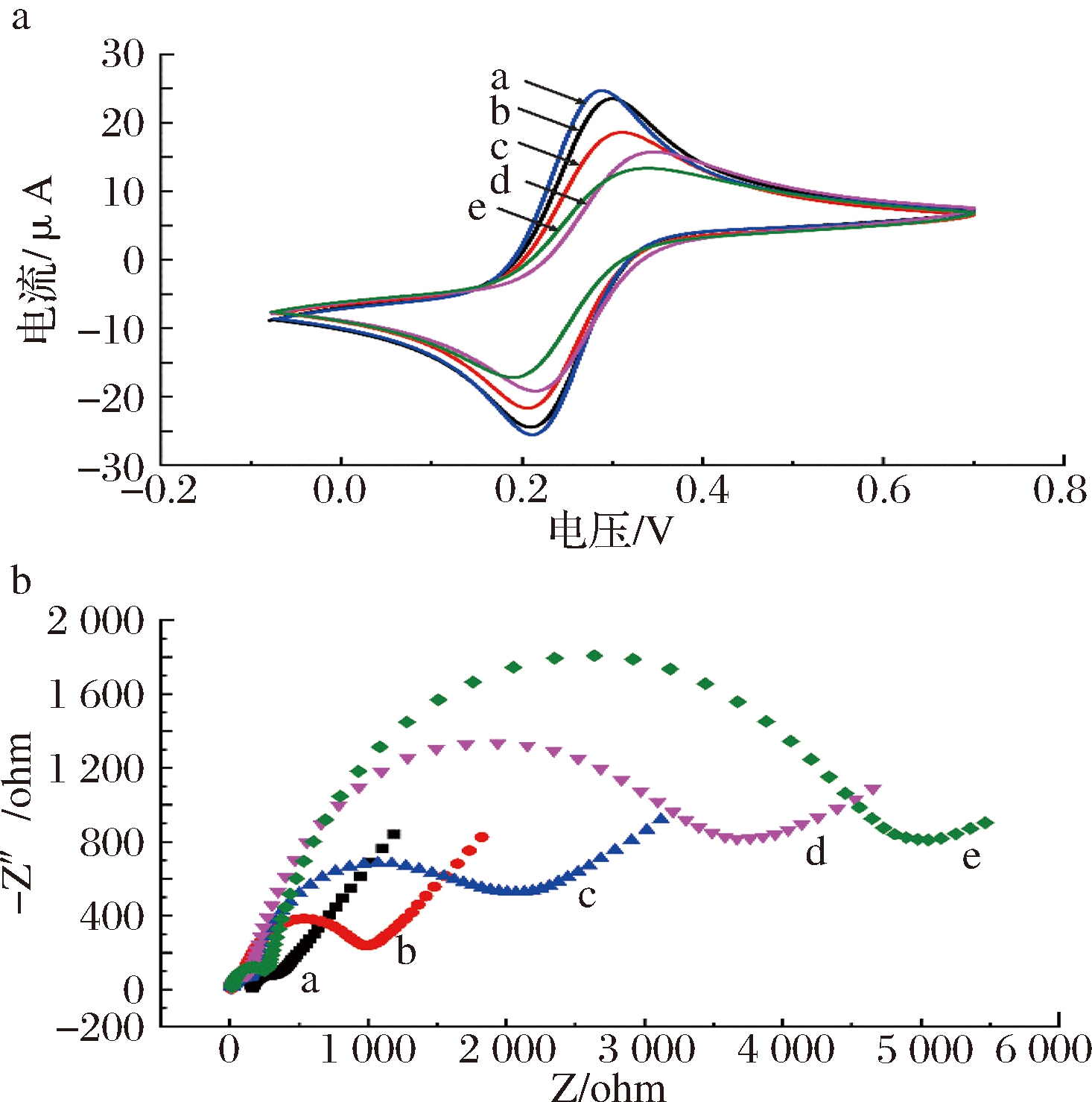
a-裸金电极;b-裸金电极/ZnO;c-裸金电极/ZnO/适配体;
d-裸金电极/ZnO/适配体/BSA;e-裸金电极
/ZnO/适配体/BSA/PAT
图4 电化学适配体传感器构建过程的CV(a)和EIS表征(b)
Fig.4 Cyclic voltammetric characterization (a) and
electrochemical impedance spectroscopy of constructing
electrochemical aptamer (b)sensor
2.5 传感器性能的影响因素
工作电极修饰条件对传感器性能的影响见图5,随着ZnO-CS分散液滴加量的增加,ΔI1呈现先减后增的趋势,这是由于ZnO不导电,而CS具有一定的导电性。当分散液体积为2 μL时,体系电流最大(图5-a),所以选择2 μL为ZnO-CS分散液的最适修饰体积。
图5-b显示,PAT适配体修饰浓度为2~8 μmol/L时,ΔI2随着修饰浓度的上升而增加,当修饰浓度大于8 μmol/L时,ΔI2基本不再变化,表明此时电极上结合的适配体已经达到饱和状态,因此选择8 μmol/L作为适配体最适合的修饰浓度。
图5-c研究了适配体最佳的修饰时间,在15~120 min内随着修饰时间的增长,ΔI3逐渐增大,至45 min后基本保持不变,说明了此时适配体在金电极表面的结合已经达到饱和状态,因此选择45 min作为修饰时间。
用5% BSA作为封闭剂研究非特异性吸附情况见图5-d,结果发现当封闭时间<45 min时,ΔI4随时间增加而增大,表明随修饰时间增加,结合在电极表面的BSA数量在逐步增加。当封闭时间>45 min时,ΔI4基本稳定,表明封闭达到饱和,因此,BSA封闭的最佳时长为45 min。
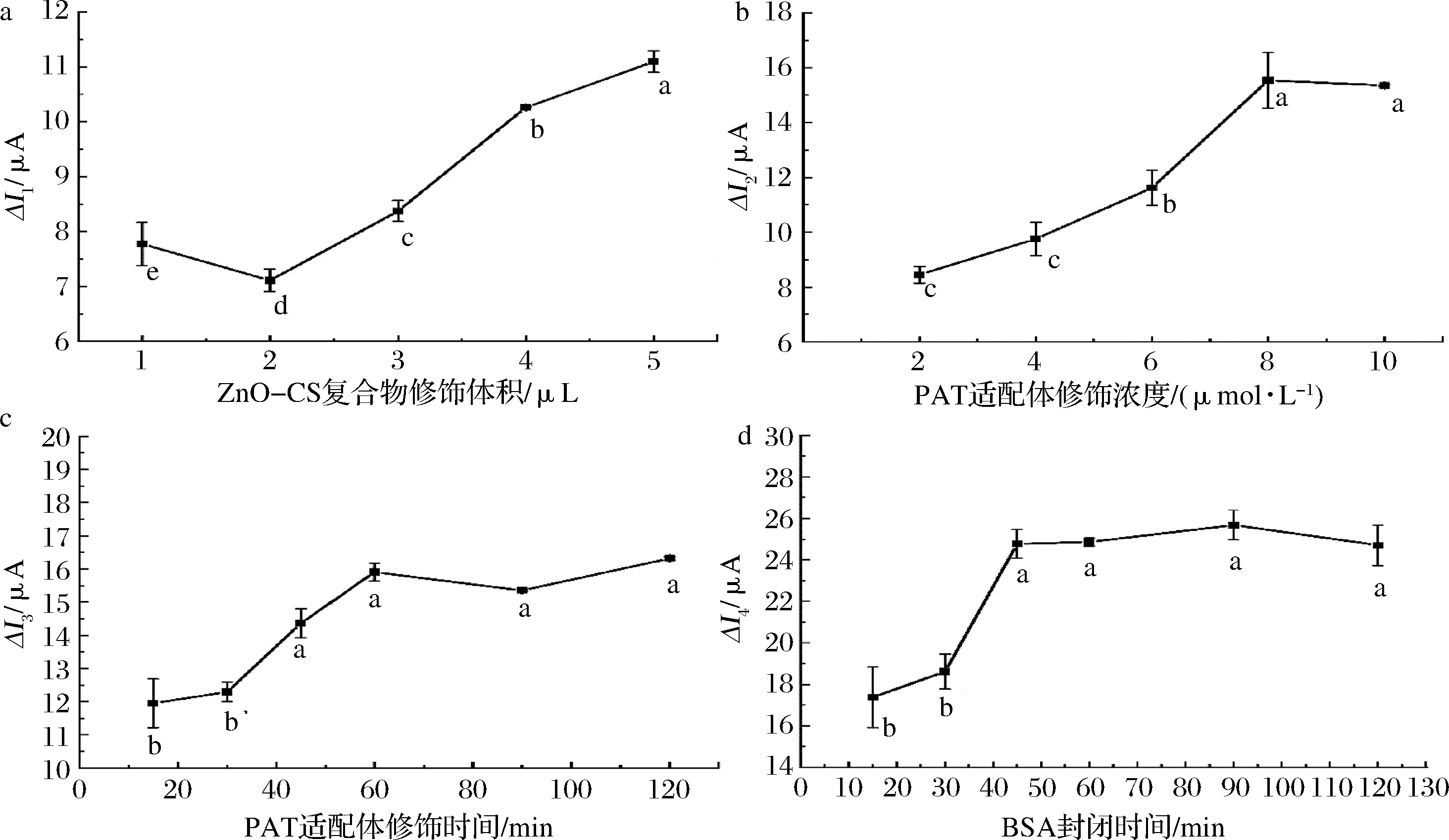
图5 不同修饰条件DPV电流峰值差的影响
Fig.5 Effect of different modification conditions on differences in peak value of DPV current
2.6 方法学评价
2.6.1 线性范围和检测限
图6-b所示,PAT质量浓度1×10-3~5×103μg/L时,随PAT浓度增加,ΔI逐渐增加,呈现典型S状,其中在0.5~1×103μg/L的范围内,PAT质量浓度的对数值与ΔI呈良好的线性关系,线性回归方程为y=3.10lgρ+37.34,相关系数r=0.99,最低检出限为0.15 μg/L。
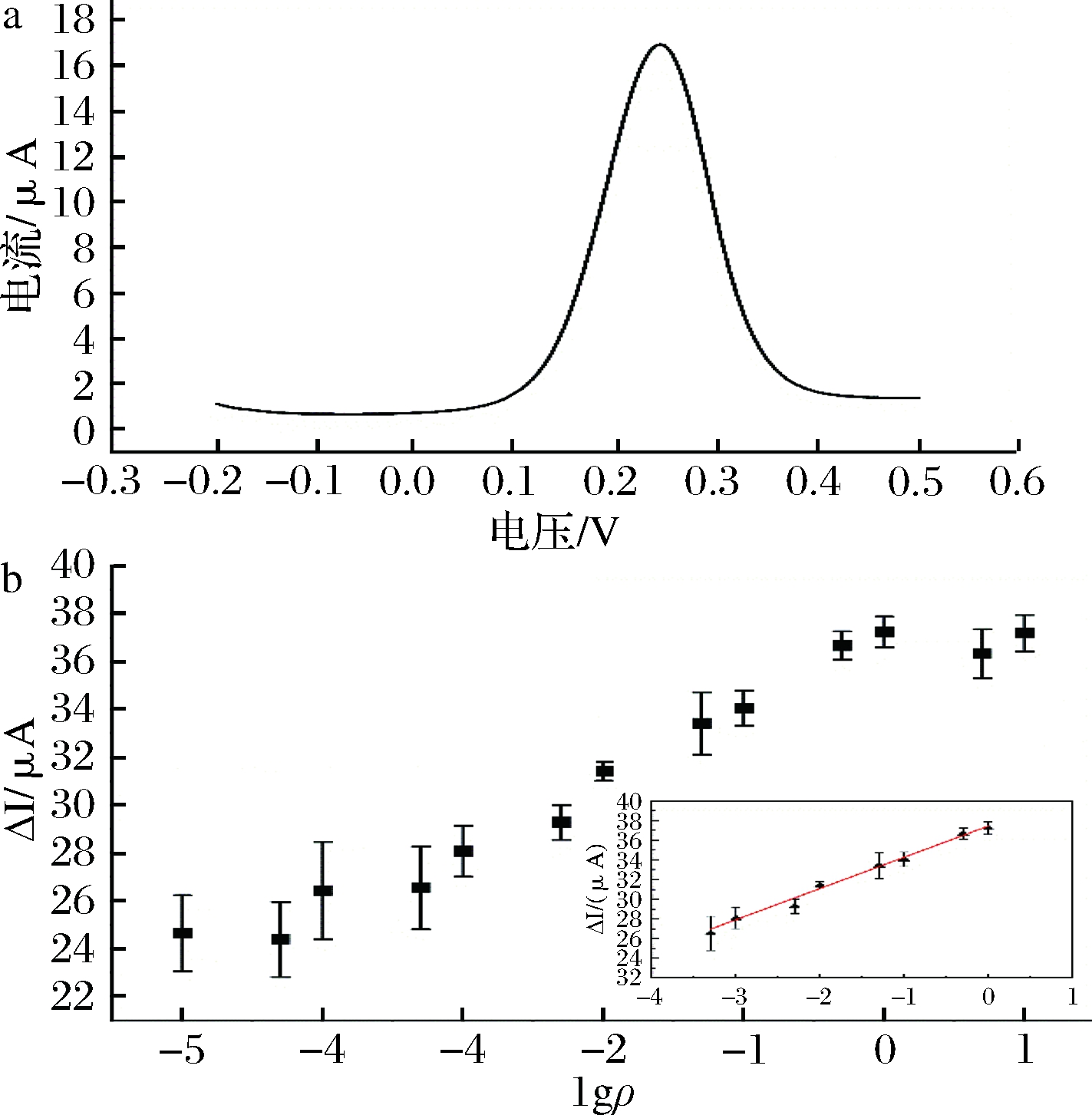
a-PAT标准品DPV曲线;
b- PAT标准品浓度与DPV电流峰值差的关系
图6 线性范围和检测限
Fig.6 Linearity range and detection limit
2.6.2 精密度和特异性
选取100、10、1 μg/L浓度梯度对该检测方法进行精密度研究,多次重复实验的检测结果如表1所示,相对标准偏差RSD(n=5)在2.51%~5.09%之间,均小于10%,表明该方法精密度良好。
表1 不同PAT浓度水平的相对标准偏差
Table 1 The relative standard deviation at different concentration levels
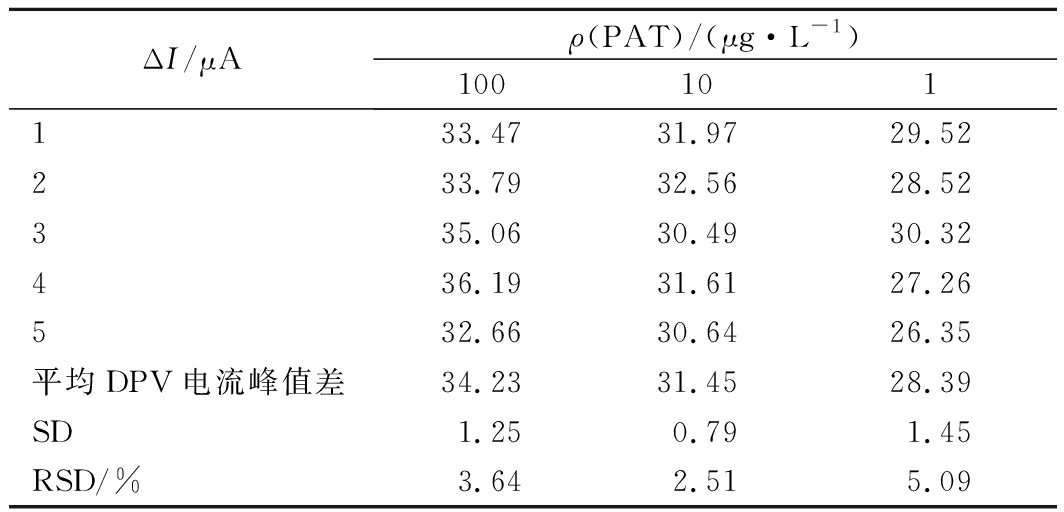
ΔI/μAρ(PAT)/(μg·L-1)100101133.47 31.97 29.52 233.79 32.56 28.52 335.06 30.49 30.32 436.19 31.61 27.26 532.66 30.64 26.35 平均DPV电流峰值差34.23 31.45 28.39 SD1.25 0.79 1.45 RSD/%3.64 2.51 5.09
选取果品常见污染毒素OTA(100 μg/L)作为干扰物质,对该电化学传感器的特异性进行研究,结果如图7所示。PAT和混合标准品(包括PAT)的峰值流变化显著,而OTA的峰值电流变化相对较小,说明PAT适配体的特异性在快检分析中可以接受,但由于目前筛选出的PAT适配体序列只有3条[20],适配体的筛选与性能改进有较大研究空间。
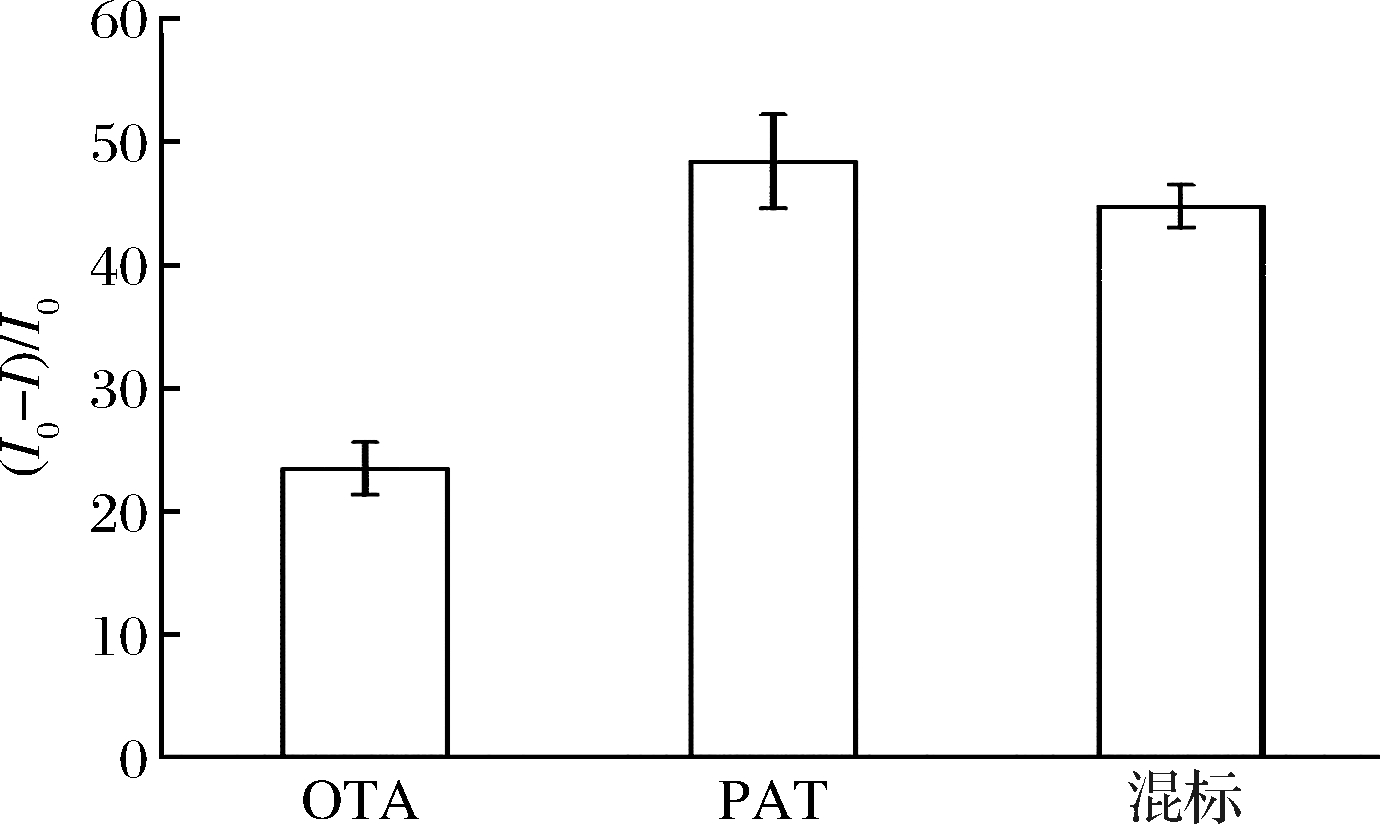
图7 基于PAT适配体的特异性研究
Fig.7 Specificity study based on PAT aptamers
2.6.3 实际样品检测
苹果、山楂及其制品是PAT的主要污染对象,因此本研究选择苹果汁和山楂片作为实际样品进行加标检测。加标样品的检测结果如表2所示,该方法在苹果汁中的加标回收率为94.75%~110.84%,在山楂片中的加标回收率为103.46%~108.34%,表明该方法的准确度良好。
表2 样品加标回收试验(n=3)
Table 2 Recovery test of PAT added to different samples
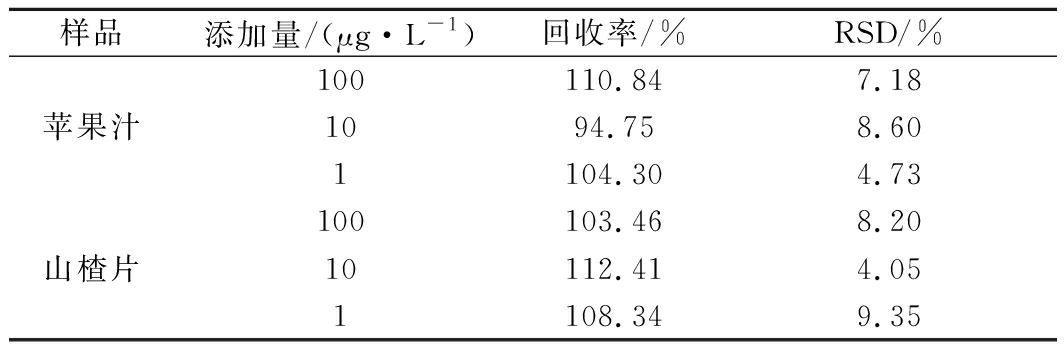
样品添加量/(μg·L-1)回收率/%RSD/%100110.847.18苹果汁1094.758.601104.304.73100103.468.20山楂片10112.414.051108.349.35
3 结论与讨论
本研究利用ZnO纳米刷增大传感电极上PAT适配体的负载量,从而提高传感器的灵敏度、扩大线性浓度范围,构建了果品中PAT高灵敏度检测的电化学适配体传感器,实现PAT高灵敏度(检出限为0.15 μg/L)、较高线性范围(0.5~1×103 μg/L)的快速检测(单样本检测时间为2 min),检测准确度较高(苹果汁和山楂片中的平均加标回收率为94.75%~110.84%)。与其他文献报道的PAT检测方法相比,线性范围平均宽2个数量级左右[4,14,21-22],最低检测限比高效液相色谱[21]、上转换荧光传感检测[22]等方法低1个数量级以上,与主流快检纳米金类[4]的方法以及本实验室开发的适配体荧光传感器[14]处于同一水平灵敏度,体现了该方法检测范围宽、灵敏度高的双重优势。在特异性识别方面,未来PAT适配体序列种类进一步筛选和性能改进将会大大促进PAT快速检测技术的发展。
[1] BENNETT J W,KLICH M.Mycotoxins[J].Clinical Microbiology Reviews, 2003,16(3):497-516.
[2] SPADARO D, CIAVORELLA A, FRATI S, et al.Incidence and level of patulin contamination in pure and mixed apple juices marketed in Italy[J].Food Control,2006,18(9):1 098-1 102.
[3] GUO Y D,ZHOU Z K,YUAN Y,H.et al.Survey of patulin in apple juice concentrates in Shaanxi (China) and its dietary intake[J].Food Control,2013,34(2):570-573.
[4] 段诺, 张维潇,吴世嘉,等.基于适配体识别-可视化检测棒曲霉毒素的方法[J].中国科学:化学,2016,46(3):268-273.
DUAN N,ZHANG W X,WU S J,et.al,A colorimetric method for Patulin detection based on aptamer and gold nanoparticles[J].Scientia Sinica(Chimica),2016,46(3):268-273.
[5] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 2761—2017 食品安全国家标准 食品中真菌毒素限量[S].北京:中国标准出版社,2017.
National health and family planning commission of the people’s republic of China,China food and drug administration.GB 2761—2017.National food safety standard maximum levels of mycotoxins in foods[S].Beijing:China Standards Press,2017.
[6] KHAN R,SHERAZI T A,CATANANTE G,et al.Switchable fluorescence sensor toward PAT via CA-MWCNTs quenched aptamer-tagged carboxyfluorescein[J].Food Chemistry,2020,312:126 048.
[7] ZHAD H R L Z,TORRES Y M R,LAI R Y,et al.A reagentless and reusable electrochemical aptamer-based sensor for rapid detection of Cd(II)[J].Journal of Electroanalytical Chemistry,2017,803:89-94.
[8] HE B S,DONG X Z.Aptamer based voltammetric patulin assay based on the use of ZnO nanorods[J].Microchimica Acta,2018,185(10):1-8.
[9] 刘微, 张景,李姝荟,等.基于交流电动作用的免疫传感器快速高灵敏检测花生油中的黄曲霉毒素B1[J].食品与发酵工业,2019,45(22):246-252.
LIU W,ZHANG J,LI S H,et al.Rapid and sensitive detection of Aflatoxin B1 in peanut oil by immunosensor based on AC electrokinet[J].Food and Fermentation Industries,2019,45(22):246-252.
[10] LONG W,FU L.Hydrothermal synthesis of ZnO flower-reduced graphene oxide composite for electrochemical determination of ascorbic acid[J].Fullerenes,Nanotubes,and Carbon Nanostructures,2017,25(7/12):404-409.
[11] QIN J Q,YUKIRD J,RODTHONGKUM N,et al.ZnO@graphene nanocomposite modified electrode for sensitive and simultaneous detection of Cd (II) and Pb (II)[J].Synthetic Metals,2018,245:251-259.
[12] 王宝.石墨烯/氧化锌纳米花复合材料的制备及电化学性能研究[D].哈尔滨:哈尔滨理工大学,2018.
WANG B.Fabrication and electrochemical properties of graphene/ZnO nanoflowers composite materials[D].Harbin:Harbin University of Science and Technology,2018.
[13] FU J P,PANG Z Y,YANG J,et al.Hydrothermal growth of Ag-doped ZnO nanoparticles on electrospun cellulose nanofibrous mats for catechol detection[J].Electroanalysis,2015,27(6):1 490-1 497.
[14] MA L,GUO T,PAN S L,et al.A fluorometric aptasensor for patulin based on the use of magnetized graphene oxide and DNase I-assisted target recycling amplification[J].Mikrochimica Acta:An International Journal for Physical and Chemical Methods of Analysis,2018,185(10):481-487.
[15] 张建交. 纳米氧化锌的水热合成及其气敏性能[D].哈尔滨:哈尔滨理工大学,2014.
ZHANG J J.Hydrothermal synthesis of nanometer ZnO and their gas sensing properties[D].Harbin:Harbin University of Science and Technology,2014.
[16] 郑现英. 基于多酚类自聚合构建的介孔二氧化硅复合纳米药物载体的研究[D].重庆:重庆大学,2017.
ZHENG X Y.Mesoporous silica composite nano-carriers based on Self-polymerization of polyphenols[D].Chongqing:Chongqing University.2017.
[17] 宋光捷, 武调弟,刘福鑫,等.壳聚糖/氮掺杂还原氧化石墨烯修饰电极对黄嘌呤的检测及尿酸抑制的研究[J].化学学报,2020,78(1):82-88.
SONG G J,WU T D,LIU F X,et,al.Electrochemical detection of xanthine and study for the inhibition of uric acid based on chitosan/Ni trogen doped reduced graphene oxide modified electrode[J].Acta Chimica Sinica,2020,78(1):82-88.
[18] 袁蓓. 基于电化学传感器的黄曲霉毒素B_1及赭曲霉毒素A检测方法研究[D].郑州:河南工业大学,2016.
YUAN B.Electrochemical biosensor for the detection of Aflatoxin B 1 and Ochratoxin A[D].Zhengzhou:Henan University of Technology,2016.
[19] 朱桦. 基于半导体纳米材料的标记型光电化学免疫传感[D].南京:南京大学,2016.
ZHU H.Labeled photoelectrochemical immunosensing based on semiconductor nanomaterials[D].Nanjing:Nanjing University,2016.
[20] 王嫦嫦, 马良,刘微,等.基于先进材料的适配体传感器在真菌毒素快速检测中的研究进展[J].食品科学,2020,41(3):305-313.
WANG C C,MA L,LIU W,et,al.Advances in aptasensors based on smart materials for rapid detection of mycotoxins[J].Food Science,2020,41(3):305-313.
[21] 李卫华, 杜利君,宋欢.高效液相色谱法测定浓缩苹果汁中棒曲霉毒素[J].食品科学,2007,28(8):408-410.
LI W H,DU L J,SONG H.Determination of patulin in apple juice concentrated by high performance liquid chromatography[J].Food Science,2007,28(8):408-410.
[22] 常洁. 展青霉毒素上转换荧光传感检测方法的研究[D].天津:天津科技大学,2015.
CHANG J.A Novel Upconversion Fluorescent sensor based on molecularly imprinted polymers for Patulin defection[D].Tianjin:Tianjin University of Science and Technology,2015.