随着食品供应链的全球化和复杂化,市场竞争日益激烈,食品欺诈问题日渐突出,其中肉制品掺假现象层出不穷。一些不法商贩在利益驱使下,为了获得不法利润,利用掺假等恶劣手段,将低价格肉类掺杂到高价肉中,以假乱真、以次充好扰乱市场秩序,侵犯消费者权益,甚至涉及到宗教信仰问题。这些现象在国内外常有发生[1-6]。肉类罐头食品因其品种繁多、口味较好、便携、储存时间长等特点而深受广大消费者的喜爱,但由于经过了斩拌、调味、高温加工等处理[7-9],普通消费者难以通过感官分辨掺假肉,执法部门在取证过程中同样缺乏简便有效的鉴别手段。目前我国对于生鲜肉类食品及一般热加工肉类食品的检测方法及标准趋于完善,但对于罐头食品这种深度热加工食品的动物源成分鉴别研究很少,因此建立一种快速、准确鉴定肉类罐头食品中动物源性成分的方法非常有必要[10-11]。
目前,常见的肉制品掺假鉴别方法主要有蛋白质鉴别酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)、等电聚焦(isoelectric focusing,IEF)、高效液相色谱(HPLC)和核酸检测法[12-17]。不同物种间核酸极强的特异性,使得核酸检测方法具有特异性强、灵敏度高、结果准确的特点。种属特异性PCR技术则是应用核酸在不同物种间具有极强的特异性这一特点,根据扩增的目的基因设计高特异性引物,扩增出物种特有的目的片段,此技术被广泛地应用于生鲜肉及加工肉制品[18-21]的动物源性成分掺假的鉴别。
本研究在国内首次以肉类罐头食品为研究对象,建立了适用于长时间高温加工食品中主要的5种动物源成分鉴别方法。针对肉类罐头食品经过长时间高温加工导致DNA片段化严重的实际情况,从线粒体DNA入手,根据不同物种之间线粒体DNA的差异,从数据库中筛选出猪、牛、羊、鸡、鸭5种常用肉类的特异性扩增引物,建立一种快速、准确的鉴别肉类罐头及其他经过长时间高温处理的食品中动物源成分的方法,并对我国市售肉类罐头产品进行了检测,初步调查了我国肉类罐头产品的动物源真实性情况,为其在动物源性食品真实性鉴别的标准化中的应用奠定了坚实的基础。
1 材料与方法
1.1 实验材料
新鲜猪肉、牛肉、羊肉、鸡肉、鸭肉,北京市超市和农贸市场;20个不同种类、不同加工工艺和不同源性成分的罐头样品,市售样品。
1.2 试剂
dNTP、10×PCR缓冲液、Taq DNA聚合酶、100 bp ladder DNA marker等, 北京全式金生物技术有限公司;异硫氰酸胍法裂解液[5 mol/L GuSCN、0.05 mol/L Tris-HCl(pH 8.0)、体积分数1.3% Triton-X 100,0.02 mol/L EDTA(pH 8.0)]、V(氯仿)∶V(异戊醇)=24∶1、TE缓冲液(0.01 mol/L Tris、0.001 mol/L EDTA,pH 8.0)、异丙醇、无水乙醇,上海生物工程有限公司。
1.3 主要仪器
冷冻离心机,美国Sigma公司;Tgradient PCR扩增仪,德国Biometra公司;DYY-8C型高压电泳仪,北京六一仪器厂;CV-1000型凝胶成像系统,法国VIBER LOURMAT公司;pHSJ-4A型实验pH计,上海科学仪器有限公司;TMS1500恒温混匀仪,北京莱普特科学仪器有限公司。
1.4 实验方法
1.4.1 引物
根据文献筛选猪、牛、羊、鸡、鸭线粒体DNA种属特异性引物,交由上海生工生物工程技术服务有限公司合成,各引物终浓度均为10 mol/L,引物序列见表1。
表1 种属特异性引物
Table 1 Species-specific primers

1.4.2 高温加工肉类模拟样品的制备
为确保检测方法对深加工食品检测的可行性,将鲜猪肉、鲜牛肉、鲜羊肉、鲜鸡肉、鲜鸭肉分别在灭菌锅中121 ℃高温处理30 min,模拟肉类高温加工过程。
1.4.3 DNA模板的提取
根据前期实验室对于肉类罐头食品中总DNA提取方法的研究,DNA模板选用异硫氰酸胍法进行提取[26]。
1.4.4 PCR扩增
PCR反应采用25 μL体系:10×PCR buffer 2.5 μL,dNTP(2.5 mmol/L)2 μL,20 pmol/μL引物各1 μL,模板DNA 1 μL,Taq DNA 聚合酶 0.3 μL(1.5 U),MgSO4(50 mmol/L)1 μL,双蒸水补足体积。扩增条件为:94 ℃ 3 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s, 35个循环,72 ℃ 5 min。扩增产物采用2%琼脂糖凝胶电泳检测。
1.4.5 引物特异性试验
分别以高温加工的猪肉、牛肉、羊肉、鸡肉、鸭肉5种高温加工肉类样品总DNA为扩增模板,使用种属特异性引物对上述各种DNA进行PCR扩增反应,同时设立以H2O为模板的空白对照,评价方法的特异性。
1.4.6 灵敏性试验
为了验证该方法的灵敏性,分别将高温加工的各种动物样品用高温加工的鸡肉进行混合稀释,分别制备出猪、牛、羊、鸡、鸭肉成分占5%、2.5%、1%(质量分数)的样品。将上述样品充分混匀,提取DNA,进行动物源性成分灵敏性检测。
1.4.7 市售罐头样品检测
将20个市售肉类罐头样品进行PCR扩增,扩增产物用2%的琼脂糖凝胶电泳检测,并将检测合格的PCR纯化产物送往上海生工生物科技有限公司进行测序,然后通过Chromas软件对其峰值图进行查看。
1.4.8 数据处理
运用美国国家生物技术信息中心(US National Center for Biotechnology Information, NCBI)的BLAST程序,把样品的PCR产物测序结果与GenBank数据库中所收录的基因片段进行比对,从而保证PCR扩增的正确性。
2 结果与分析
2.1 特异性试验结果
分别使用5种动物源性成分特异性引物对,以制备的猪、牛、羊、鸡、鸭5种高温加工肉类样品总DNA为模板,进行PCR扩增反应,琼脂糖凝胶电泳结果如图1所示。5种动物源性成分猪、牛、羊、鸡、鸭出现相符的目标条带,而其他动物基因组DNA及空白对照均无条带出现,也无非特异性条带,说明此方法具有较好的特异性。

a-猪引物的特异性;b-牛引物的特异性;c-羊引物的特异性;d-鸡引物的特异性;e-鸭引物的特异性
M-marker;1-猪肉(121 ℃ 30 min);2-牛肉(121 ℃ 30 min);3-羊肉(121 ℃ 30 min);4-鸡肉(121 ℃ 30 min);5-鸭肉(121 ℃ 30 min);6-空白对照
图1 特异性试验琼脂糖凝胶电泳图
Fig.1 Specific electrophoresis agarose gel electrophoresis
2.2 引物灵敏性试验结果
分别以猪、牛、羊、鸡、鸭肉占比为5%、2.5%、1%的样品提取的总DNA为扩增模板,使用种属特异性引物进行PCR扩增,琼脂糖凝胶电泳结果如图2所示。不同成分含量为1%的样品对应泳道仍有明显条带,对猪、牛、羊、鸭源性成分的检测灵敏度可达1%,对鸡源性成分的检测灵敏度为2.5%。说明5种动物源性成分检测灵敏度可达到1%。在实际市场中,1%廉价肉的掺杂对于商贩来说毫无利润,因此检测限足够低,完全满足检测要求。
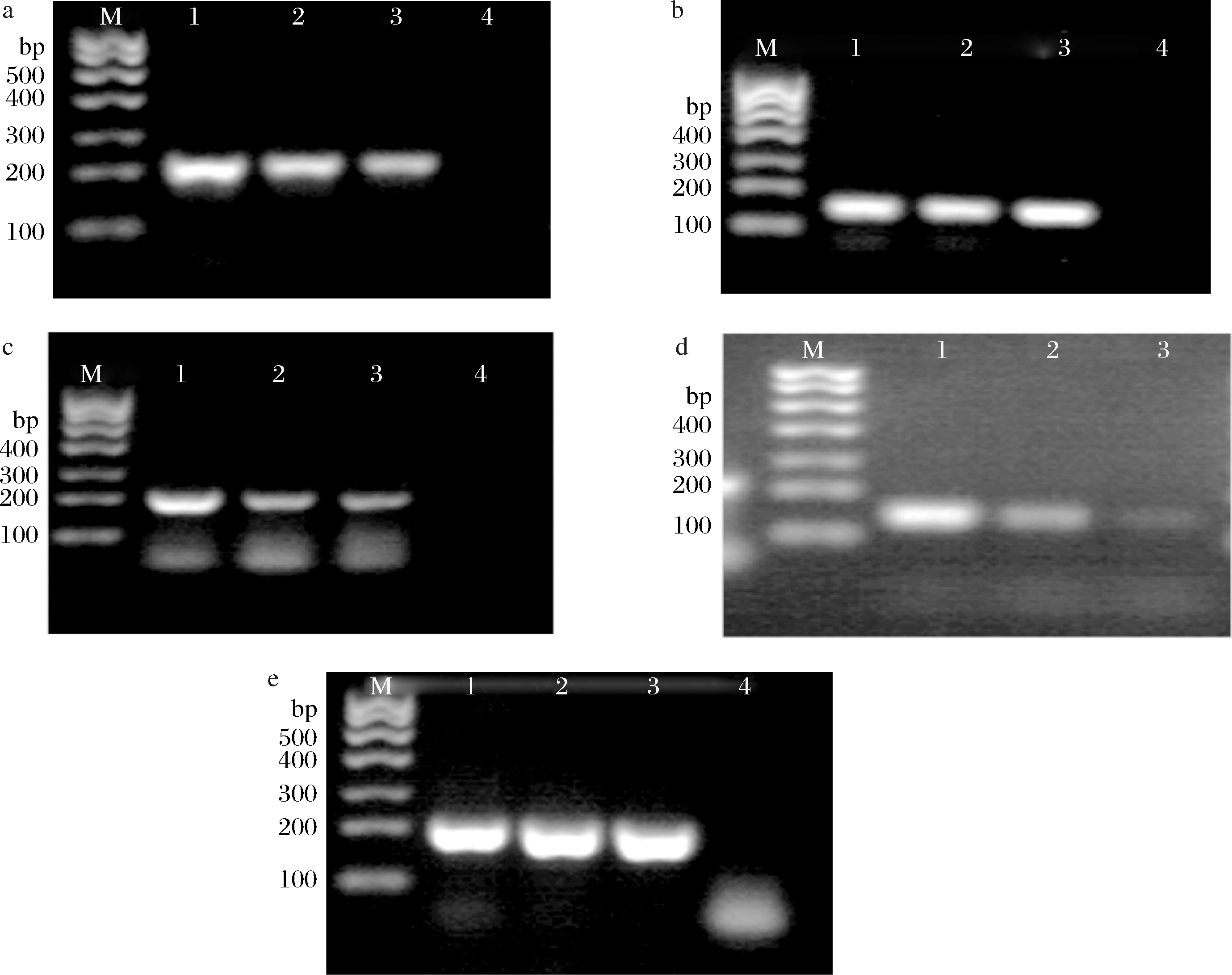
a-猪源性成分;b-牛源性成分;c-羊源性成分;d-鸡源性成分;e-鸭源性成分
M-marker;1-5%肉模拟罐头;2-2.5%肉模拟罐头;3-1%肉模拟罐头;4-空白对照(双蒸水)
图2 灵敏性试验琼脂糖凝胶电泳图
Fig.2 Agar gel electrophoresis of sensitivity test
2.3 市售罐头样品检测结果
以市售的罐头试样为检测对象,使用种属特异性引物对其DNA模板进行PCR扩增,PCR扩增结果如图3所示。所有样品均扩增出特异性条带,且条带清晰整齐,亮度较大,空白对照为阴性。将上述PCR产物进行测序,测序结果在NCBI上进行BLAST比对,比对结果见表2。通过对20个市售肉类罐头样品进行检测,发现除15#和16#猪肝午餐肉罐头和午餐肉罐头外,所有样品检测结果均与标签标注相一致,6.6% 的样品标签标注成分与检测结果不符。15#和16#除检测出标签标注成分外,还检测出鸡源性成分,使用其他方法对其进行检测,均检测出鸡源性成分,考虑可能是由于生产过程中的污染或食品中添加鸡精等导致。本方法适用于肉类罐头中猪、牛、羊、鸡、鸭5种动物源性成分的检测,且结果准确可靠,具有实际应用价值。

a-猪源性成分的检测;b-牛源性成分的检测;c-羊源性成分的检测;d-鸡源性成分的检测
e-鸭源性成分的检测
M-marker;1-阳性对照;2-空白对照;3-红烧猪肉罐头;4-清蒸猪肉罐头;5-午餐肉罐头(清淡味);6-干崩羊肉罐头;7-咸牛肉罐头;8-五香肉丁罐头;9-火腿猪肉罐头;10-午餐肉;11-午餐肉罐头;12-回锅肉罐头;13-红烧猪肉罐头;14-火锅午餐肉罐头;15-普云午;16-高金午餐肉;17-猪肝午餐
肉罐头;18-午餐肉罐头;19-精品红烧猪肉罐头;20-粉蒸肉罐头;21-火腿午餐肉罐头;22-云腿大片罐头
图3 市售肉类罐头样品琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of canned meat samples
表2 肉类罐头样品中动物源性成分检测结果
Table 2 Test results of animal derived components in canned meat samples

编号商品名称相似序列相似度/%鉴别结果标称原料检测结果1红烧猪肉罐头KJ746663.183Sus scrofa猪猪2清蒸猪肉罐头KY964306.185Sus scrofa猪猪3午餐肉罐头(清淡味)KJ746663.179Sus scrofa猪猪4干崩羊肉罐头LS992617.189Capra aegagrus山羊肉山羊5咸牛肉罐头MK058749.1MK028749.18996Bos taurusGallus牛肉、鸡骨泥牛、鸡
续表2
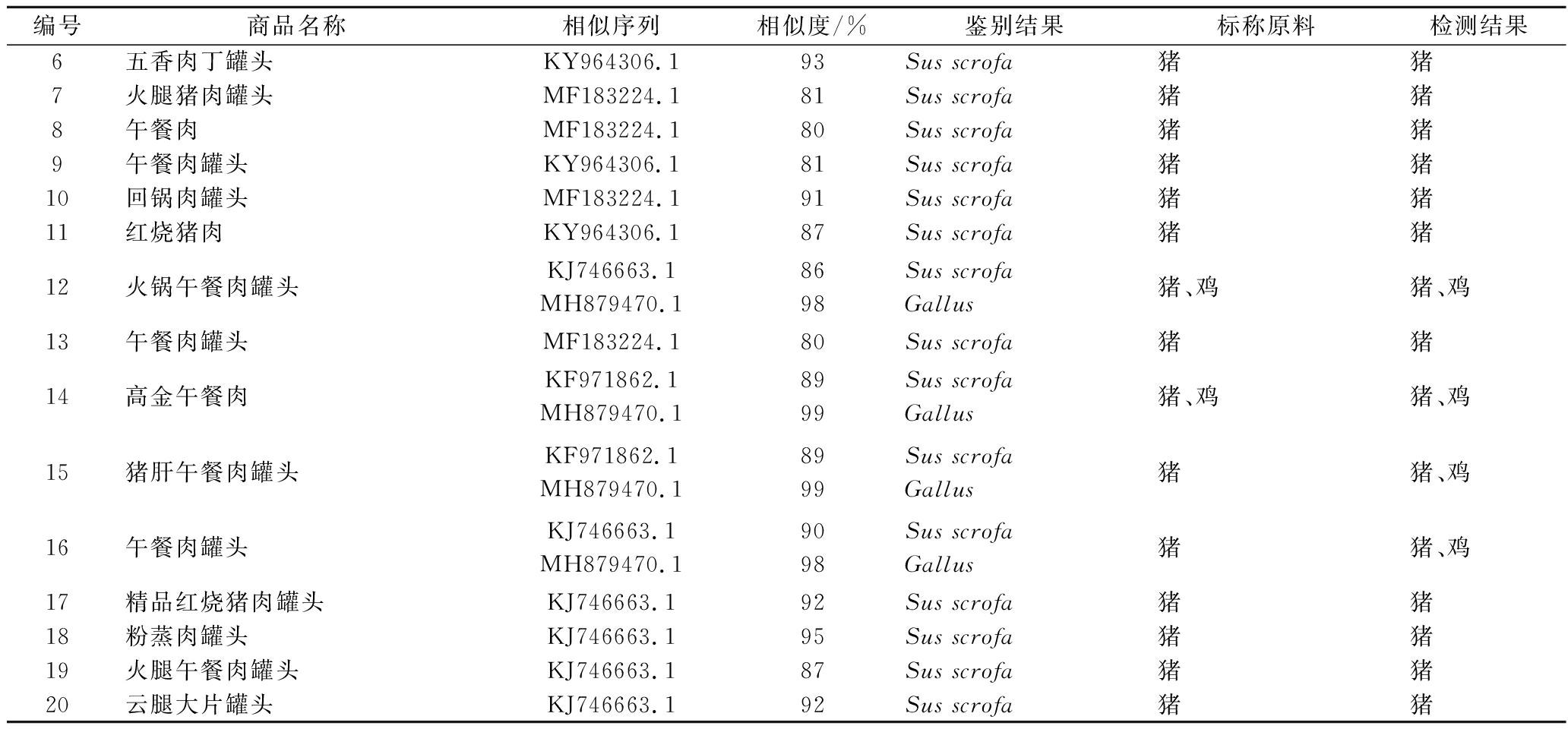
编号商品名称相似序列相似度/%鉴别结果标称原料检测结果6五香肉丁罐头KY964306.193Sus scrofa猪猪7火腿猪肉罐头MF183224.181Sus scrofa猪猪8午餐肉MF183224.180Sus scrofa猪猪9午餐肉罐头KY964306.181Sus scrofa猪猪10回锅肉罐头MF183224.191Sus scrofa猪猪11红烧猪肉KY964306.187Sus scrofa猪猪12火锅午餐肉罐头KJ746663.1MH879470.18698Sus scrofaGallus猪、鸡猪、鸡13午餐肉罐头MF183224.180Sus scrofa猪猪14高金午餐肉KF971862.1MH879470.18999Sus scrofaGallus猪、鸡猪、鸡15猪肝午餐肉罐头KF971862.1MH879470.18999Sus scrofaGallus猪猪、鸡16午餐肉罐头KJ746663.1MH879470.19098Sus scrofaGallus猪猪、鸡17精品红烧猪肉罐头KJ746663.192Sus scrofa猪猪18粉蒸肉罐头KJ746663.195Sus scrofa猪猪19火腿午餐肉罐头KJ746663.187Sus scrofa猪猪20云腿大片罐头KJ746663.192Sus scrofa猪猪
3 结论
本研究根据不同物种之间线粒体DNA的差异,从数据库中筛选出猪、牛、羊、鸡、鸭5种常用肉类的特异性扩增引物,建立了种属特异性PCR鉴别肉类罐头中猪、牛、羊、鸡、鸭成分的方法。结果表明,该方法使用的5种引物种属特异性良好,对猪、牛、羊、鸭源性成分的检测灵敏度可达1%,对鸡源性成分的检测灵敏度为2.5%,完全满足实际市场掺入量1%的要求,并成功应用于市售肉类罐头样品的掺假检测。该方法操作简便,检测成本低,结果准确可靠,具有实际应用价值,适用于高温高压加工的肉类罐头样品的掺假鉴别,可以作为肉类罐头市场监督和检验鉴别的可行性办法,为实现深加工肉类产品消费市场健康发展,维护消费者权益提供了科学的依据。
[1] BALLIN N Z,VOGENSEN F K,KARLSSON A H.Species determination-can we detect and quantify meat adulteration?[J].Meat Science,2009,83(2):165-174.
[2] WANG R F,MYERS M J,CAMPBELL W,et al.A rapid method for PCR detection of bovine materials in animal feedstuffs[J].Molecular & Cellular Probes,2000,14(1):1-5.
[3] 陈颖, 郁蕾,郭升阳.畜禽肉制品真伪鉴别技术研究进展[J].口岸卫生控制,2019,24(3):35-37;44.
CHEN Y,YV L,GUO S Y.Advances in identification techniques for adulteration of livestock and poultry products[J].Port Health Control,2019,24(3):35-37;44.
[4] 张驰, 邱皓璞,张筠.荧光定量PCR检测肉制品中鸭源性成分[J].食品科学,2013,34(18):154-157.
ZHANG C,QIU H P,ZHANG Y.A quantitative fluorescent PCR method for detection of duck—derived ingredients in meat products[J].Food Science,2013,34(18):154-157.
[5] 金萍, 丁洪流,李培,等.2013年苏州地区肉及其制品掺假情况调查[J].中国食品卫生杂志,2014,26(2):168-172.
JIN P,DING H L,LI P,et al.Analysis of meat products adulterated in Suzhou area in 2013[J].Chinese Journal of Food Hygiene,2014,26(2):168-172.
[6] 唐穗平, 张燕,黄景辉.广东省牛羊肉及其制品中掺杂掺假情况的调查分析[J].食品安全质量检测学报,2016,7(5):1 882-1 886.
TANG H P,ZHANG Y,HUANG J H.Analysis of beef and lamp products adulteration in Guangdong province[J].Journal of Food Safety and Quality,2016(5):1 882-1 886.
[7] 冯治平, 左勇,袁先玲.清真羊肉罐头生产工艺及品质影响研究[J].四川理工学院学报(自然科学版),2012,25(3):1-4.
FENG Z P,ZUO Y,YUAN X L,et al.Study on the technology and quality influence of halal mutton canned[J].Journal of Sichuan University of Science & Engineering(Natural Science Edition),2012,25(3):1-4.
[8] 蒋海鹏. 罐头食品主要加工工艺进展研究[J].科技与企业,2014(7):361-361.
JIANG H P.Research on the main processing technology of canned food[J].Technology and Enterprise,2014(7):361-361.
[9] 吴小兰. 传统肉类罐头的生产工艺[J].新农村,2008(3):26.
WU X L.Production technology of traditional canned meat[J].Xin Nongcun,2008(3):26.
[10] 张春江, 杨君娜,乔晓玲.我国肉与肉制品标准现状分析与发展建议[J].农业工程技术(农产品加工业),2010(9):27-32.
ZHANG C J,YANG J N,QIAO X L.Current situation analysis and development suggestions of meat and meat products standards in China[J].Agriculture Engineering Technology(Agricultural Product Processing Industry),2010(9):27-32.
[11] 孟楠, 樊振江.肉及肉制品动物源性成分鉴别技术研究进展[J].现代食品,2016(22):82-84.
MENG N,FAN Z J.Research progress on identification technology of animal derived components in meat and meat products[J].Modern Food,2016(22):82-84.
[12] 刘万臣, 唐晓敏,崔建华,等.应用等电聚焦电泳鉴别动物肉种类的研究[J].兽医大学学报,1993(2):177-178;157.
LIU W C,TANG X M,CUI J H,et al.Effects of chinese medical herb additives on the liveweight gain and meat texture of french table quails[J].Bulletin of Veterinary College of PLA,1993(2):177-178;157.
[13] TOOROP R M,MURCH S J,BALL R O.Development of a rapid and accurate method for separation and quantification of myofibrillar proteins in meat[J].Food Research International,1997,30(8):619-627.
[14] AYOB M K,RAGAB A A,ALLEN J C,et al.An improved rapid ELISA technique for detection of pork in meat products[J].Journal of the Science of Food and Agriculture,1989,49(1):103-116.
[15] 陈颖, 吴亚君.基因检测技术在食品物种鉴定中的应用[J].色谱,2011,29(7):594-600.
CHEN Y,WU Y J.Application of gene detection technology in food species identification[J].Chinese Journal of Chromatography,2011,29(7):594-600.
[16] BUNTJER J B,LAMINE A,HAAGSMA N,et al.Species identification by oligonucleotide hybridisation:The influence of processing of meat products[J].Journal of the Science of Food & Agriculture,1999,79(1):53-57.
[17] 王守云, 袁明美,封聪,等.肉类掺假鉴别技术研究进展[J].肉类研究,2017,31(4):56-61.
WANG S Y,YUAN M M,FENG C,et al.Recent advances in identification techniques for meat adulteration[J].Meat Research,2017,31(4):56-61.
[18] 张国利,郑明光,周志江,等.PCR鉴定牛肉方法的建立及初步应用[J].中国兽医学报,1996(2):179.
ZHANG G L,ZHENG M G,ZHOU Z J,et al.Identification of beef by the polymerase chain reaction[J].Chinese Journal of Veterinary Science,1996(2):179.
[19] 刘帅帅, 李宏,罗世芝,等.PCR技术在肉类掺假检验中的应用进展[J].食品安全质量检测学报,2011,2(6):280-284.
LIU S S,LI H,LUO S Z,et al.Progress in meat adulteration identification using PCR method[J].Journal of Food Safety and Quality,2011,2(6):280-284.
[20] 王金斌, 李文,白蓝,等.基于核酸分子学方法的肉类成分鉴别技术研究进展[J].食品科学,2017(11):318-327.
WANG J B,LI W,BAI L,et al.A review of current DNA—based methodologies for meat authentication[J].Food Science,2017(11):318-327.
[21] MANE B G,MENDIRATTA S K,TIWARI A K.Beef specific polymerase chain reaction assay for authentication of meat and meat products[J].Food Control,2012,28(2):246-249.
[22] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 21101—2007 动物源性饲料中猪源性成分定性检测方法PCR方法[S].北京:中国标准出版社,2008.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB/T 21101—2007 Qualitative detection of pig derived ingredients in animal derived feed by PCR[S].Beijing:China Standards Press,2008.
[23] 陈颖, 钱增敏,徐宝梁,等.保健品中牛羊源性成分的PCR检测[J].食品科学,2004(10):215-218.
CHEN Y,QIAN Z M,XV B L,et al.Species-specific PCR for identification of horse and donkey materials in feedstuff[J].Food Science,2004(10):215-218.
[24] HOU B,MENG X R,ZHANG L Y,et al.Development of a sensitive and specific multiplex PCR method for the simultaneous detection of chicken,duck and goose DNA in meat products[J].Meat Science,2015,101:90-94.
[25] 中华人民共和国国家质量监督检验检疫局. SN/T 2978—2011 动物源性产品中鸡源性成分PCR检测方法[S].北京:中国标准出版社,2012.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.SN/T 2978—2011 PCR detection of chicken derived components in animal derived products[S].Beijing:China Standards Press,2012.
[26] 杨彤晖, 孟镇,钟其顶,等.猪肉类罐头食品中总DNA提取方法的比较[J].食品与发酵工业,2015,41(4):62-67.
YANG T H,MENG Z,ZHONG Q D,et al.Comparison of DNA extraction methods for canned pork[J].Food and Fermentation Industries,2015,41(4):62-67.