单核细胞增生李斯特氏菌(Listeria monocytogenes)是一种能够引起人类、家畜共患病的食源性致病菌,具有较强的致病性并广泛分布于人类生存环境中,如土壤、植物、水、乳制品、肉制品、蔬菜制品等。免疫力低下人群(婴幼儿、孕妇、中老年人)容易接触并感染,进而引起呕吐、脑膜炎、孕妇流产、败血病等症状,致死率高达30%[1-3]。单核细胞增生李斯特氏菌在较低的温度下也能正常生长,从而增加了感染食品的机会,其危害对于冷冻食品而言较为突出[4-5]。单增李斯特菌可形成生物膜,在食品加工设施表面定居,也能在强酸强碱环境中生存。此外,土壤中的单增李斯特菌是一种腐生菌,以腐烂的有机物为食,同时也增加了果蔬污染的风险[6]。
目前,我国食品中单核细胞增生李斯特氏菌的检测主要采用分离和培养方法,并结合相关的显色介质,但存在操作复杂,实验周期长等问题[7]。近年来,基于抗体的免疫学方法[8-9]、PCR[10-11]、LAMP[12-13]和分析MIC模式的VITEK2系统[14]方法等已经建立,但都具有局限性。抗体、ELISA试剂盒和RT-PCR试剂昂贵,缺乏成本效益,而VITEK2系统既复杂又耗时。因此,迫切需要开发更简单、快速的方法用于单增李斯特菌的检测。
核酸适配体是在体外合成得到的一小段DNA或RNA链。近年来,许多目标物的适配体通过指数富集配体系统进化技术在体外进行多轮筛选、扩增、富集得到[15-16],是一个相对稳定、分子质量小的化合物,易于修饰,可在体外无限合成,具有高特异性和强亲和力等优点。基于该优点,核酸适配体得到了快速发展,在食品检测中应用广泛,如沙门氏菌[17]、黄曲霉毒素[18]、重金属离子[19]和瘦肉精[20]等的检测。本文根据适配体的高度特异性,利用适配体与目标物、纳米金(gold nanoperticle,AuNPS)的相互作用及纳米酶催化过氧化氢氧化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)发生颜色反应,建立单增李斯特菌快速检测方法,并对方法的准确度、精密度进行评定,为单增李斯特菌快速测定提供新思路。
1 材料与方法
1.1 材料与试剂
猪肉样品,当地超市;TMB,郑州莱宝实验器材科技有限公司;过氧化氢(H2O2)、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、氯金酸,国药集团化学试剂有限公司;所用实验试剂均为分析纯,实验用水为二次蒸馏水。单增李斯特菌序列:5′-ATCCATGGGGCGGAGATGAGGGGGAGGAG-GGCGGGTACCCGG-3′[21]
1.2 仪器与设备
BlueStar B紫外-可见分光光度计,北京莱伯泰科仪器股份有限公司;AE224电子分析天平,上海舜宇恒平科学仪器有限公司;ULUP-I-10T超纯水仪,四川优普超纯科技有限公司。
1.3 AuNPS的合成
采用氧化还原反应,利用柠檬酸盐还原氯金酸的方法制备AuNPS[22-23]。向250 mL的三口烧瓶中加入98 mL超纯水和1 mL 10 g/L氯金酸溶液,于集热式恒温加热磁力搅拌器上,设置温度为120 ℃,加热至沸腾后,向圆底烧瓶中迅速加入1 mL 10 g/L柠檬酸钠溶液,观察溶液颜色由淡黄色到灰黑色至紫红色最后变为酒红色,继续搅拌,保持溶液沸腾15 min。停止加热,继续搅拌冷却至室温,将制备的AuNPs溶液于4 ℃冰箱贮存备用。
1.4 单增李斯特菌的检测过程
向反应体系中先加入30 μL 1.0 μmol/L单增李斯特菌适配体和20 μL不同浓度的菌液充分混合15 min,然后加入50 μL的AuNPs溶液,充分混合振荡15 min后,加入20 μL 50 μg/mL的CTAB溶液,继续振荡15 min,随后分别加入60 μL具有还原性的模拟酶底物TMB 和20 μL体积分数为30%的H2O2溶液,在37 ℃培养箱中充分反应45 min后,肉眼观察颜色变化并对其在450~750 nm范围内进行吸光度扫描,记录其在最大吸收波长650 nm处的吸光值,并计算各个L.monocytogenes浓度下吸光度的差值(ΔA=A0-ALM,A0为溶液中不添加L.monocytogenes时的吸光度值,ALM为溶液中添加LM时的吸光度值)。
1.5 实际样品测定
为验证该检测体系在食品中应用的可行性,称取25 g猪肉样品,配制3个连续稀释度(2.6×102、2.6×103和2.6×104 CFU/mL)的单增李斯特菌菌液,吸取1 mL加入至猪肉样品中拍打均匀,放入盛有225 mL的无菌生理盐水的均质袋中,用均质机拍打1~2 min,混匀。根据已建立的检测方法,加入反应体系中进行检测,同时倒平板涂布,至37 ℃培养箱培养18~24 h,验证平板培养计数结果,计算回收率。
2 结果与分析
2.1 紫外吸收光谱表征
利用紫外-可见分光光度计对比色法检测L.monocytogenes的可行性进行考察。在反应体系中不添加H2O2和TMB,研究AuNPS在反应过程中的分散状态,结果如图1-a所示。对比曲线a、c可知,测定体系中无CTAB时,AuNPs颗粒具有较强的表面等离子共振特性,在溶液中呈现分散状态,呈红色,520 nm处有吸收峰,证明单增李斯特菌的存在不影响溶液状态的变化;当加入CTAB后,吸收峰从520 nm移至740 nm(曲线b),颜色呈浅蓝色,证明此时AuNPs颗粒发生了聚集;加入适配体后溶液颜色变为红色,在520 nm处重新出现吸收峰(曲线d),说明此时AuNPs颗粒重新呈现分散状态;而加入L.monocytogenes后,740 nm又重新出现了吸收峰(曲线e),颜色又变为浅蓝色,这说明AuNPs颗粒又发生了聚集。在反应体系中加入H2O2和TMB,研究单增李斯特菌浓度与反应体系颜色变化的关系,如图1-b所示,AuNPs可催化H2O2氧化TMB出现蓝色,在650 nm处有吸收峰(曲线a),对比曲线a和b可以看出单增李斯特菌适配体可以增强AuNPs催化能力,催化溶液显示深蓝色。对比曲线a和c可看出CTAB可诱导AuNPs发生聚集,在650 nm处吸光度降低,溶液呈现浅蓝色。对比曲线d和e发现,当反应体系存在L.monocytogenes时,溶液颜色变浅,吸光度值下降,这是由于L.monocytogenes与适配体特异性结合,AuNPS失去了适配体的“保护”作用,催化能力降低。此外,在无TMB(曲线f)或无AuNPs(曲线g)情况下,均不产生催化反应,溶液呈无色,实验结果与上述结论一致。
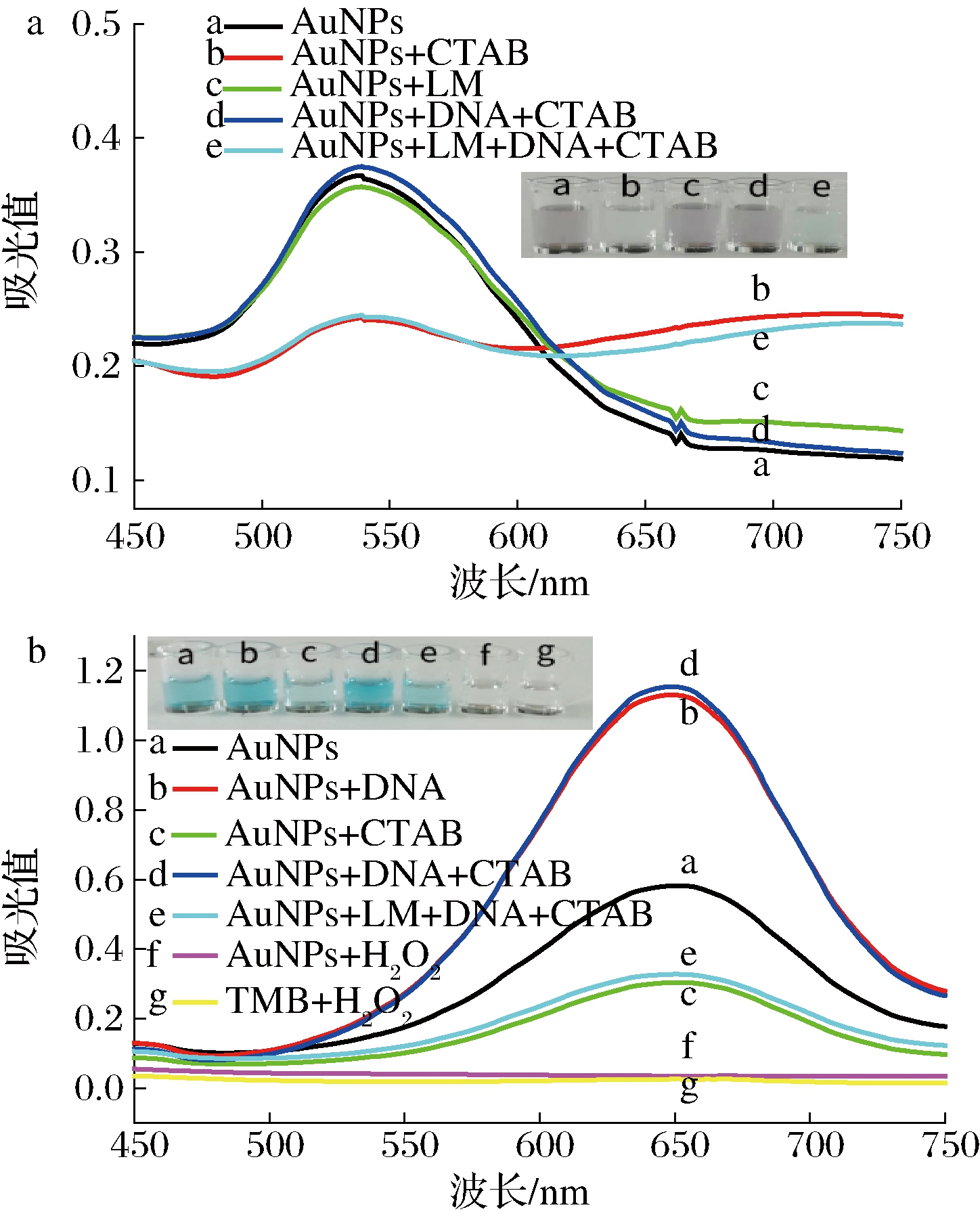
a-不添加H2O2和TMB的反应体系;b-添加H2O2和TMB的反应体系
图1 不同条件下反应溶液的吸收光图谱
Fig.1 The absorption spectra of the reaction solution under different conditions
2.2 实验条件优化
为了提高准确度和灵敏度,在单增李斯特菌浓度为1.47×104 CFU/mL时对实验条件进行优化。本实验对溶液中单增李斯特菌适配体浓度、CTAB质量浓度、TMB用量、H2O2用量和反应时间进行优化,探讨不同条件下吸光度差值的变化,寻求最佳实验条件。
当DNA适配体浓度过低时,DNA适配体不能完全阻止CTAB对AuNPs模拟酶活性的团聚作用,而当DNA适配体浓度过高时,DNA适配体会与L.monocytogenes特异性结合,未结合完的DNA适配体会与CTAB作用,从而减小了CTAB对AuNPs的团聚作用,故本实验选择1.0 μmol/L为最佳的DNA适配体浓度(图2-a)。由图2-b可知,CTAB最佳质量浓度为50 μg/mL,这可能是由于CTAB质量浓度过低时,其对AuNPs的团聚作用较小,而过高时,适配体的加入不足以改变CTAB对AuNPs的作用力,使检测体系的灵敏度下降。TMB和H2O2用量直接影响反应体系的氧化程度,从而导致吸光度值的变化,影响测定灵敏度。根据实验结果(图2-b、图2-d),选择TMB和H2O2的最佳用量分别为为60 μL和20 μL。如图2-e所示,随着反应时间的增加,吸光度差值呈现先增后降的趋势,故本实验选择45 min为最佳反应时间。

a-适配体浓度;b-CTAB质量浓度;c-TMB用量;d-H2O2用量;e-反应时间
图2 实验条件的优化
Fig.2 Optimization of experimental conditions
2.3 线性范围与检出限
随着单增李斯特菌浓度的不断增高,最大吸收值不断降低,溶液颜色依次变浅;以最大吸收波长处吸光度变化值为纵坐标,L.monocytogenes浓度对数为横坐标,绘制相关性曲线,如图3所示,线性方程为y=0.032 1x+0.024 8,R2=0.996 3,检出限约为5 CFU/mL。与传统培养法相比,该可视化检测体系对单增李斯特菌有较灵敏的检出限,检测时间为1.5 h,在检测时间和操作程序方面有绝对优势。与GRADY等[24]基于 RT-PCR 建立的单增李斯特菌检测方法相比,检出时间更短,而且不依赖昂贵的仪器,就可实现可视化检测。与LIU[25]开发的基于表面增强拉曼散射结合重组酶聚合酶扩增检测单增李斯特菌的方法相比,检测时间更短,检出限更低,而且不需要繁琐的操作步骤。
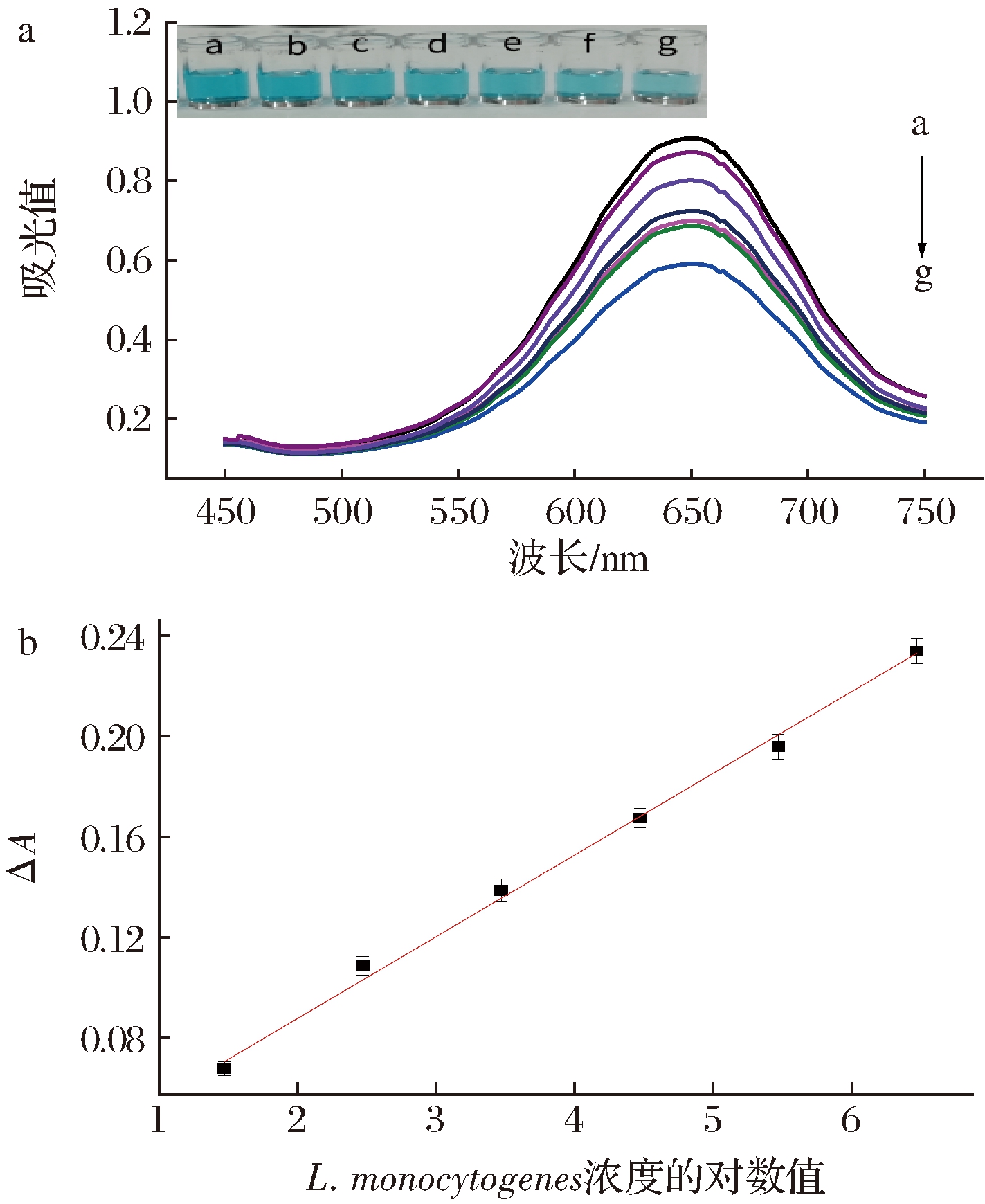
a-光谱图;b-校准曲线
图3 不同浓度的L.monocytogenes吸收光谱图和校准曲线
Fig.3 The absorption spectra of L.monocytogenes with different concentrations and the calibration curve
2.4 特异性研究
为了验证可视化检测L.monocytogenes的特异性,在最佳条件下,将不同浓度的L.monocytogenes菌液分别替换成浓度为1.47×103 CFU/mL的金黄色葡萄球菌菌液Staphylococcus aureus、沙门氏菌菌液Salmonella、福氏志贺菌菌液Shigella flexneri、大肠杆菌菌液Escherichia coli和枯草芽孢杆菌菌液Bacillus subtilis进行特异性实验。由图4可知,当L.monocytogenes存在时,适配体会与其特异性结合,溶液的吸光度值明显低于其他5种菌在反应体系溶液中的吸光度值,表明所建立的方法特异性较好。
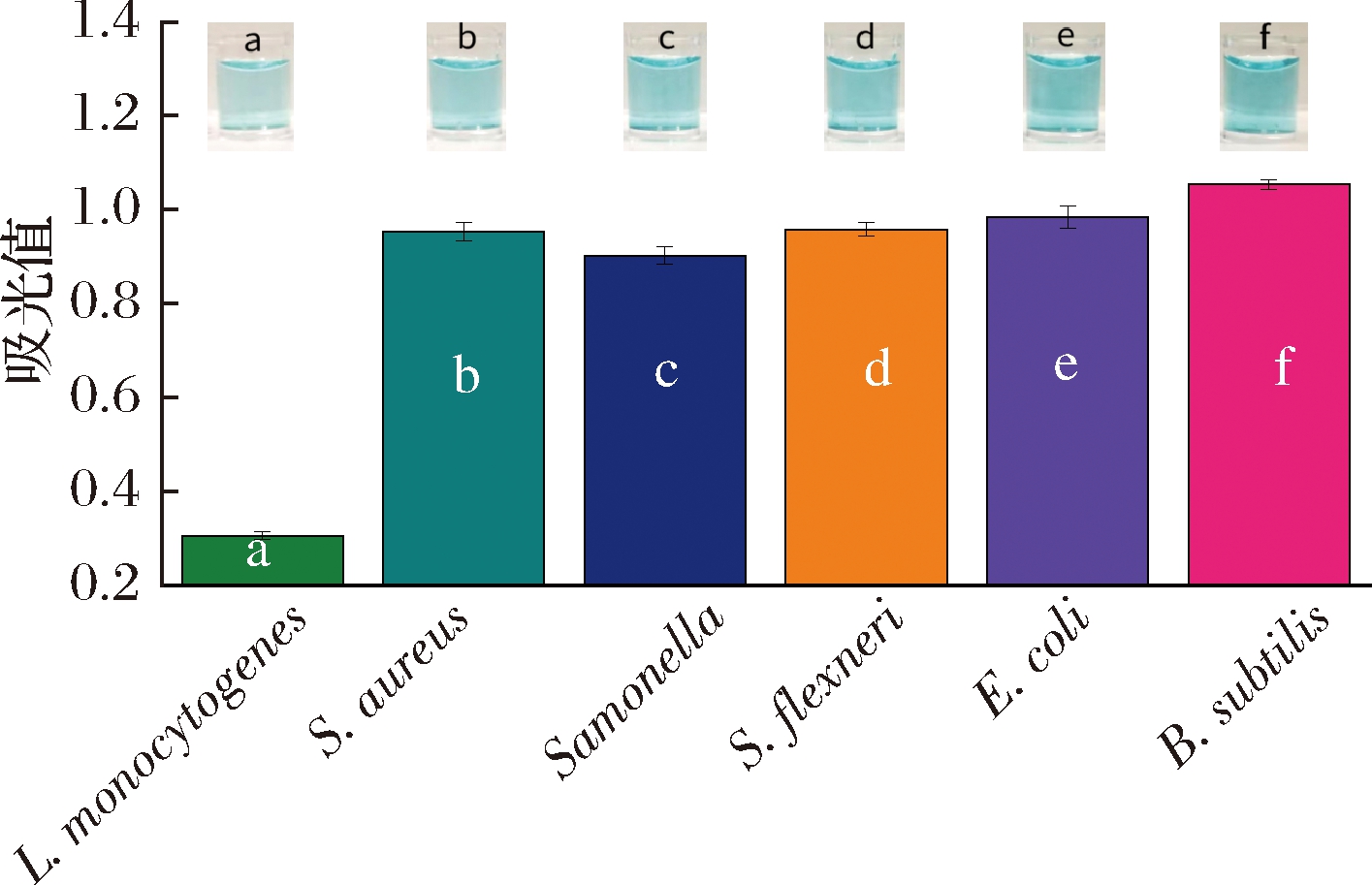
图4 可视化检测L.monocytogenes的特异性分析
Fig.4 Visualization specificity analysis of L.monocytogenes
2.5 实际样品检测
为验证该检测体系在食品中应用的可行性,本实验选取猪肉样品进行验证,结果如表1所示,样品回收率为93.5%~105.4%,由此表明所建方法可以实现对单增李斯特菌进行准确、快速测定。
表1 猪肉样品中单增李斯特菌的检测
Table 1 Detection of L.monocytogenes in pork samples

样品添加量/(CFU·25 g-1)回收量/(CFU·25 g-1)回收率/%RSD/%Pork12.6×1042.67×104102.72.2Pork22.6×1032.74×103105.44.8Pork32.6×1022.43×10293.57.0
3 结论
本实验以金纳米粒子作为比色探针,以核酸适配体为生物识别元件,构建了一种灵敏度高、特异性强的可视化快速检测方法。在最佳实验条件下,建立了可视化检测L.monocytogenes的快速定量标准曲线,线性方程为y=0.032 1x+0.024 8(R2=0.996 3),检出限约为5 CFU/mL。加标回收率为93.5%~105.4%,标准偏差小于10%。所建方法操作简单,可在2 h内根据溶液颜色变化实现对单增李斯特菌的快速检测,结果准确可靠。
[1] 杨爱华. 单增李斯特菌两种快速检测方法的建立及其试剂盒的研制[D].长春:吉林大学,2017.
YANG A H.Establishment of two rapid detection methods of Listeria monocytogenes and development of the kits[D].Changchun:Jilin University,2017.
[2] SHAKUNTALA I,DAS S,GHATAK S,et al.Prevalence,characterization,and genetic diversity of Listeria monocytogenes isolated from foods of animal origin in North East India[J].Food Biotechnology,2019,33(3):237-250.
[3] MARIA F A,TIZIANA C,YLENIA P.Chronic intramammary infection by Listeria monocytogenes in a clinically healthy goat-a case report[J].BMC Veterinary Research,2019,15(1):229.
[4] TIENUNGOON S,RATKOWSKY D A,MCMEEKIN T A.Growth limits of Listeria monocytogenes as a function of temperature,pH,NaCl,and lactic acid[J].Applied and Environmental Microbiology,2000,66:4 979-4 987.
[5] RASHMI K,SHINDE S V,KHAN W A,et al.The occurrence of Listeria monocytogenes in goats,farm environment and invertebrates[J].Biological Rhythm Research,2019:1-10.
[6] CONGCONG M,DAFENG S,QING G,et al.Reverse transcription loop-ediated isothermal amplification assays allow the rapid detection of Listeria monocytogenes in freshfruits and vegetables[J].Journal of Food Safety,2019,39(4).DOI:10.1111/jfs.12658.
[7] 王力均. 基于免疫磁分离和核酸适配子技术快速检测食源性致病菌的研究[D].南昌:南昌大学,2016.
WANG L J.Research on rapid detection of foodborne pathogen based on immunomagnetic separation and aptamer technology[D].Nanchang:Nanchang University,2016.
[8] AIPING L,QING X,LI S,et al.A sandwich-type ELISA for the detection of Listeria monocytogenes,using the well-oriented single chain Fv antibody fragment[J].Food Control,2017,79:156-161.
[9] AIPING L,LI S,ZHENGHAI Z,et al.A minireview of the methods for Listeria monocytogenes detection[J].Food Analytical Methods,2017,11(5):1-9.
[10] 邵美丽, 董鑫,赵燕丽,等.单增李斯特菌和金黄色葡萄球菌双重荧光定量PCR检测方法建立[J].食品科学,2013,34(16):176-179.
SHAO M,DONG X,ZHAO Y,et al.A duplex fluorescence quantitative PCR assay for detecting Listeria monocytogenes and Staphylococcus aureus[J].Food Science,2013,34(16):176-179.
[11] RAWOOL B D,DOIJAD P S,POHARKAR V K,et al.A multiplex PCR for detection of Listeria monocytogenes and its lineages[J].Journal of Microbiological Methods,2016,130:144-147.
[12] 姜侃, 吕沁风,汪新,等.三重LAMP法检测食品中沙门氏菌、单增李特菌和金黄色葡萄球菌[J].食品科学,2013,34(24):182-187.
JIANG K,LYU Q,WANG X,et al.Development of multiplex LAMP method for the detection of Salmonella spp.,Staphylococcus aureus and Listeria monocytogenes in foods[J].Food Science,2013,34(24):182-187.
[13] LIU Z,YAO C,WANG Y,et al.A G-quadruplex DNAzyme-based LAMP biosensing platform for a novel colorimetric detection of Listeria monocytogenes[J].Analytical Methods,2018,10(8).
[14] DE LAPPE N,LEE C,O’CONNOR J,et al.Misidentification of Listeria monocytogenes by the Vitek 2 system[J].Journal of clinical microbiology,2014,52(9):3 494-3 495.
[15] NGUYEN V T,LEE B H,KIM S H,et al.Aptamer-aptamer linkage based aptasensor for highly enhanced detection of small molecules[J].Biotechnology Journal,2016,11(6):843-849.
[16] KHALIL A,NOOR M D,MOHAMMAD R,et al.A novel colorimetric aptasensor for ultrasensitive detection of cocaine based on the formation of three-way junction pockets on the surfaces of gold nanoparticles[J].Analytica Chimica Acta,2018,1020:110-115.
[17] DWIVEDI H P,SMILEY R D,JAYKUS L A.Selection of DNA aptamers for capture and detection of Salmonella Typhimurium using a whole-cell SELEX approach in conjunction with cell sorting[J].Applied Microbiology & Biotechnology,2013,97(8):3 677-3 686.
[18] 梁瑶. 黄曲霉毒素核酸适配体的结构优化、表征及应用[D].无锡:江南大学,2019.
LIANG Y.Structural optimization,characterization and application of aflatoxins aptamer[D].Wuxi:Jiangnan University,2019.
[19] 刘媛. 重金属离子快速检测的电化学传感器研究[D].株洲:湖南工业大学,2018.
LIU Y.Studies on electrochemical sensors for rapid detection of heavy metalions[D].Zhuzhou:Hunan University of Technology,2018.
[20] DUAN N,GONG W,WU S,et al.Selection and application of ssDNA aptamers against clenbuterol hydrochloride based on ssDNA library immobilized SELEX[J].Journal of Agricultural and Food Chemistry,2017,65(8):1 771-1 777.
[21] OHK S H,KOO O K,SEN T,et al.Antibody-aptamer functionalized fibre-optic biosensor for specific detection of Listeria monocytogenes from food[J].Journal of Applied Microbiology,2010,109:808-817.
[22] 陈镇. 纳米金比色传感器检测重金属离子研究[D].重庆:重庆医科大学,2016.
CHEN Z.Study on functionalized gold nanoparticles for detection of heavy metal ions(CR3+and CD2+)in aqueous solutions[D].Chongqing:Chongqing Medical University,2016.
[23] 舒江南. 新型纳米发光体的化学发光与电化学发光及其在生物分析中的应用[D].合肥:中国科学技术大学,2018.
SHU J N.Chemiluminescence of novel nanoluminophores and their application in bioassays[D].Hefei:University of Science and Technology of China,2018.
[24] GRADY J O’,SEDANO-BALB S S,MAHER M,et al.Rapid real-time PCR detection of Listeria monocytogenes in enriched food samples based on the ssrA gene,a novel diagnostic target[J].Food Microbiology,2008,25(1):75-84.
S S,MAHER M,et al.Rapid real-time PCR detection of Listeria monocytogenes in enriched food samples based on the ssrA gene,a novel diagnostic target[J].Food Microbiology,2008,25(1):75-84.
[25] LIU H B,DU X J.SERS-based lateral flow strip biosensor for simultaneous detection of Listeria monocytogenes and Salmonella enterica serotype enteritidis[J].Journal of Agricultural & Food Chemistry,2017,65(47):10 290-10 299.