稀少糖是指一类在自然界中鲜有发现,仅能通过人工合成获得的单糖、寡糖或糖醇,例如海藻糖、D-阿洛酮糖、D-塔格糖等[1-3]。稀少糖普遍具有人体益生元的功效,如控制血糖浓度、改善肠道菌群关系、不导致龋齿等[4]。因此,稀少糖能够广泛应用于制作功能性饮料、保健食品、原料药等产品[5]。随着生活水平的不断提升,稀少糖类产品在世界范围内受到了愈来愈多的关注。日韩、欧洲等地均推出了以稀少糖为主要活性成分的食品与保健品商品,消费者反响热烈。然而,现有的稀少糖产品生产成本较高,在发展中国家难以大规模普及,降低这类产品的生产成本具有重要意义。生物工程技术是制备稀少糖的关键技术,利用酶催化或微生物细胞工厂生产稀少糖具有转化率高、副产物少、绿色环保等优势[6]。L-木酮糖(L-xylulose,C5H10O5,分子量150.13,CAS:527-50-4)是一种L-型戊酮糖单糖,它是肝脏中葡糖醛酸代谢途径的中间体,用于合成D-葡糖醛酸和L-抗坏血酸;也是真菌中L-阿拉伯糖代谢途径的中间体之一[4]。L-木酮糖也是近来研究的新型稀少糖之一,是糖苷酶的天然抑制剂,因此L-木酮糖能够控制血糖,这表明其可能是潜在的降血糖产品[7-8]。此外,糖的构型多是以D-型为主,天然的L-型单糖极少;除L-阿拉伯糖外在自然界中难以寻觅,因此非常珍贵。L-型单糖适用于制作核苷类似物药物,例如L-木酮糖可进一步转化为L-木糖(L-xylose),可用于合成抗乙肝病毒化合物Clevudine(L-FMAU)等药物,也可以用于制备药物中间体——L-型核苷酸[9-17]。然而传统有机化学法合成L-木酮糖或其衍生物的难度较大、得率很低,因此使用生物催化如酶催化法是最优的工艺路线[18-19],常见的包括木糖醇转化为L-木酮糖或L-阿拉伯糖醇转化为L-木酮糖、利用微生物细胞工厂合成L-木酮糖等几种方法,下面分别给予综述。
1 利用木糖醇制备L-木酮糖
利用依赖于NAD+的木糖醇脱氢酶(xylitol dehydrogenase,XDH)能够将木糖醇直接氧化为L-木酮糖,研究表明多种芽孢杆菌具有合成此类脱氢酶的能力。1985年,DOTEN等[20]发现1株噬夏孢欧文氏菌Erwinia uredovora突变株能够将木糖醇氧化为L-木酮糖,研究表明该菌株能够合成木糖醇-4-脱氢酶,但不能合成L-木酮糖激酶,因此可以将木糖醇转化为L-木酮糖且后者不会被微生物消耗。张玉宝等[21]分离筛选了1株产L-木酮糖的芽孢杆菌ZN-14,该菌株以20 g/L木糖醇为底物,在37 ℃、pH 9.0条件下催化24 h的转化率为26.62%,进一步16S rDNA基因序列鉴定表明该菌株属于巨大芽孢杆菌(Bacillus megaterium),能够发酵木糖、乳糖、蔗糖、木糖醇、甘露糖醇、山梨糖醇等碳源,但关键酶的性质未得到研究。POONPERM等[22]用苍白芽孢杆菌Bacillus pallidus Y25全细胞催化了2%浓度的木糖醇,在50 ℃条件下的转化率达到85%。进一步纯化该菌株体内的木糖醇脱氢酶,酶学性质表征结果表明它的最适反应温度为40 ℃、最适pH为10,需要辅酶NAD+,对D-苏糖醇、木糖醇、D-艾杜糖醇均有活性。然而,该酶催化高浓度木糖醇时转化率下降明显,因此存在一定的缺陷。同一课题组的TAKATA等[23]克隆了B.pallidus的木糖醇脱氢酶编码基因,全长759 bp,对应253个氨基酸残基。将该基因连接到pQE60质粒后在大肠杆菌表达并纯化,纯化的重组酶大小28 kDa,最适反应温度55 ℃、最适pH 11.0,在40 ℃孵育1 h能够剩余66%的酶活力。反应动力学参数测定表明重组纯酶对木糖醇的Km值为2.06 mmol·L-1、kcat值为165 min-1。用表达有重组酶的静息细胞催化5%浓度木糖醇,反应24 h的转化率为35%。AARNIKUNNAS等[24]在大肠杆菌中克隆表达了内生细菌Pantoea ananatis来源的木糖醇-4-脱氢酶,该酶编码基因长度795 bp,其氨基酸序列与短链脱氢酶/还原酶家族有38~51%的相似度。该酶需要NAD+作为辅酶,催化活性随pH上升而显著提高,利用静息重组大肠杆菌细胞催化木糖醇可以获得大于80%的转化率,在转化液中未发现副产物D-木酮糖。USVALAMPI等[25]将P.ananatis来源的木糖醇脱氢酶表达于大肠杆菌BPT228菌株,并优化了重组菌株合成L-木酮糖的能力。结果表明,最适的反应温度44 ℃、pH为7.5~8.0、底物木糖醇质量浓度为250~350 g/L,但此时摩尔转化率较低,表明高底物浓度和高转化率还无法兼得。朱雯惠等[26]尝试了将P.ananatis来源木糖醇脱氢酶表达于枯草芽孢杆菌,由于该菌是食品级菌株,因此所生产L-木酮糖可用作保健品或食品甜味剂等。结果表明表达酶活力为5.183 U/L,在pH 10、45 ℃条件下对20 g/L木糖醇底物的转化率为17.74%;这证明了枯草芽孢杆菌也适用于L-木酮糖制备关键酶的表达。
2 利用L-阿拉伯糖醇制备L-木酮糖
研究表明,真菌中存在L-木酮糖相关代谢途径(图1),属于L-阿拉伯糖利用途径中的一环[4]。

图1 真菌中L-阿拉伯糖代谢途径及中间体L-木酮糖
Fig.1 The fungal pathway for L-arabinose utilization via L-xylulose
受此启发,韩国建国大学的LEE课题组系统研究了L-阿拉伯糖醇-4-脱氢酶(L-arabinitol-4-dehyrogenase,LAD),该酶可以催化L-阿拉伯糖醇为L-木酮糖。例如TIWARI等[27]克隆表达了红褐肉座菌Hypocrea jecorina来源的L-阿拉伯糖醇-4-脱氢酶(HjLAD)于大肠杆菌BL21(DE3)菌株,重组酶最适反应pH为9.5、最适反应温度25 ℃;酶反应动力学参数测定表明kcat值为4 200 min-1,而催化效率kcat/Km值为290 (mmol/L)-1·min-1。该酶催化仅2 h对L-阿拉伯糖醇的最高转化率达到86%,生产强度为2.2 g/L·h,但底物质量浓度较低为5 g/L。SINGH等[28]将L-阿拉伯糖醇-4-脱氢酶(HjLAD)以共价键的方式固定于二氧化硅纳米颗粒上得到固定化酶,其固定化效率达到94.7%。该固定化酶的热稳定性是游离酶的14.2倍,经过10轮催化反应可以保留94%的初始酶活力;催化L-阿拉伯糖醇为L-木酮糖的转化率达66%(底物质量浓度30 g/L,NAD+浓度20 mmol/L),生产强度为7.9 g/L·h。该研究表明固定化酶生产L-木酮糖在技术上可行,然而固定化酶体系也存在纯酶步骤繁琐、成本高昂等问题,因此使用固定化细胞操作简便且更为廉价。GAO等[29-30]在大肠杆菌中分别克隆和表达了HjLAD酶和SpNox酶(NADH氧化酶,Streptococcus pyogenes来源),并将2种大肠杆菌细胞固定化于海藻酸钙微球中。结果表明这种固定化重组细胞体系可以产生L-木酮糖,其中最优的固定化细胞加载质量浓度为3.75 g/L,最高底物转化率64%,反应7个批次后能够残留65%的酶活力。某些新型固定化材料也为L-木酮糖的制备提供了方法,如PATEL等[31]将HjLAD酶和SpNox酶制备成杂化纳米花无机-酶固定化体系,该体系需要使用纯酶、硫酸铜溶液、磷酸盐溶液来合成酶与Cu(PO4)2·3H2O共固定化的催化体系。由于杂化纳米花材料具有极高的比表面积,因此可以加速酶与底物的反应速率[32-33]。该固定化酶在外源添加低浓度NAD+(2 mmol/L)的条件下实现木糖醇到L-木酮糖的高转化率(90.1%),且使用5个批次后能够维持80%的酶活力;然而纯酶的获得较为繁琐,因此该体系的实际应用还需要进一步的优化研究。
3 微生物细胞工厂生产L-木酮糖
微生物细胞工厂(microbial cell factory,MCF)是近年来兴起的生物工程技术,该技术可以利用廉价碳源(葡萄糖、工业甘油、糖蜜、纤维素水解液等)来生产高附加值化工类产品,解决了酶催化反应需要酶纯化等复杂步骤的问题,有利于生产总成本的大幅降低[34]。大肠杆菌作为遗传背景清晰、分子生物学操作简便、发酵培养技术成熟的微生物宿主,是构建微生物细胞工厂的首选宿主。近年来多个课题组成功使用大肠杆菌细胞工厂来制备木糖衍生物或选择木糖作为出发底物,例如大肠杆菌合成木糖醇、木质酸、乙醇酸等产品[35-37]。HAN等[38]探索了大肠杆菌细胞工厂合成L-木酮糖的方法,即以葡萄糖或甘油为碳源,将外源木糖醇转化为L-木酮糖。具体方法是利用pZE12和pCS27质粒转化大肠杆菌MG1655菌株,共表达P.ananatis来源XDH酶和肺炎双球菌(Streptococcus pneumoniae)来源的NOX酶从而实现胞内辅酶循环,以甘油为碳源成功提高了L-木酮糖的产量;实现了木糖醇转化率65%,得率为0.89 g L-木酮糖/ g 木糖醇,L-木酮糖质量浓度14 g/L、总发酵时间80 h,初始甘油质量浓度12 g/L、木糖醇质量浓度22 g/L。研究还发现胞内L-木酮糖与木糖醇的比例与NAD+/NADH比例一致,补料碳源会导致该比例的下降影响L-木酮糖生成。此外敲除L-木酮糖胞内利用途径的关键酶L-木酮糖激酶基因lyxK以及过表达甘油通道蛋白基因glpF均不能实现L-木酮糖产量的进一步提高,这也表明大肠杆菌合成的L-木酮糖并不会被自身所利用。如何检测发酵液中木糖醇和L-木酮糖的浓度,避免发酵液中杂质的干扰是利用MCF体系容易遇到的问题。葛驰宇等[39]建立了C18柱(250 mm × 4.6 mm)测定发酵液中L-木酮糖和木糖醇含量的方法,使用柱温35 ℃、流动相为V(乙腈)∶V(水)=85∶15、流速0.8 mL/min,检测器为示差检测器,检测波长210 nm。该体系的检测结果不受发酵液中其他组份的干扰,木糖醇的浓度检测范围为0.5~30 g/L,最低检出限为0.18 g/L;L-木酮糖的质量浓度检测范围为0.3~30 g/L,最低检出限为0.15 g/L,满足了实际使用需求。
4 其他制备L-木酮糖的方法
多酶偶联催化近年来成为制备稀少糖的一条新途径,WEN等[40]研发了以L-阿拉伯糖为初始底物,通过AraA(L-阿拉伯糖异构酶)、DTE(D-塔格糖 3-差向异构酶)、RhaB(L-鼠李酮糖激酶)三个酶的依次催化作用(作者称为scheme 1的路线B)来获得L-木酮糖的工艺。首先由AraA酶将L-阿拉伯糖部分异构为L-核酮糖,再通过DTE酶差向异构为L-木酮糖,然而由于这2步反应均为双向可逆的异构反应,因此总转化率很低。作者将RhaB酶用来继续催化L-木酮糖,生成L-木酮糖-1-磷酸,最终再脱去磷酸根,这导致该反应路线变为了不可逆反应,使得反应持续朝着产物生成的方向移动。该路线最终以91%的高转化率得到L-木酮糖,产物纯度可达99%以上;但该方法的反应体系较小,规模化应用仍有待进一步研究。综上所述,将已发表的L-木酮糖生物制备方法总结于表1,L-木酮糖的合成路线则如图2所示。
表1 L-木酮糖的生物制备工艺
Table 1 Bio-production processes for L-xylulose

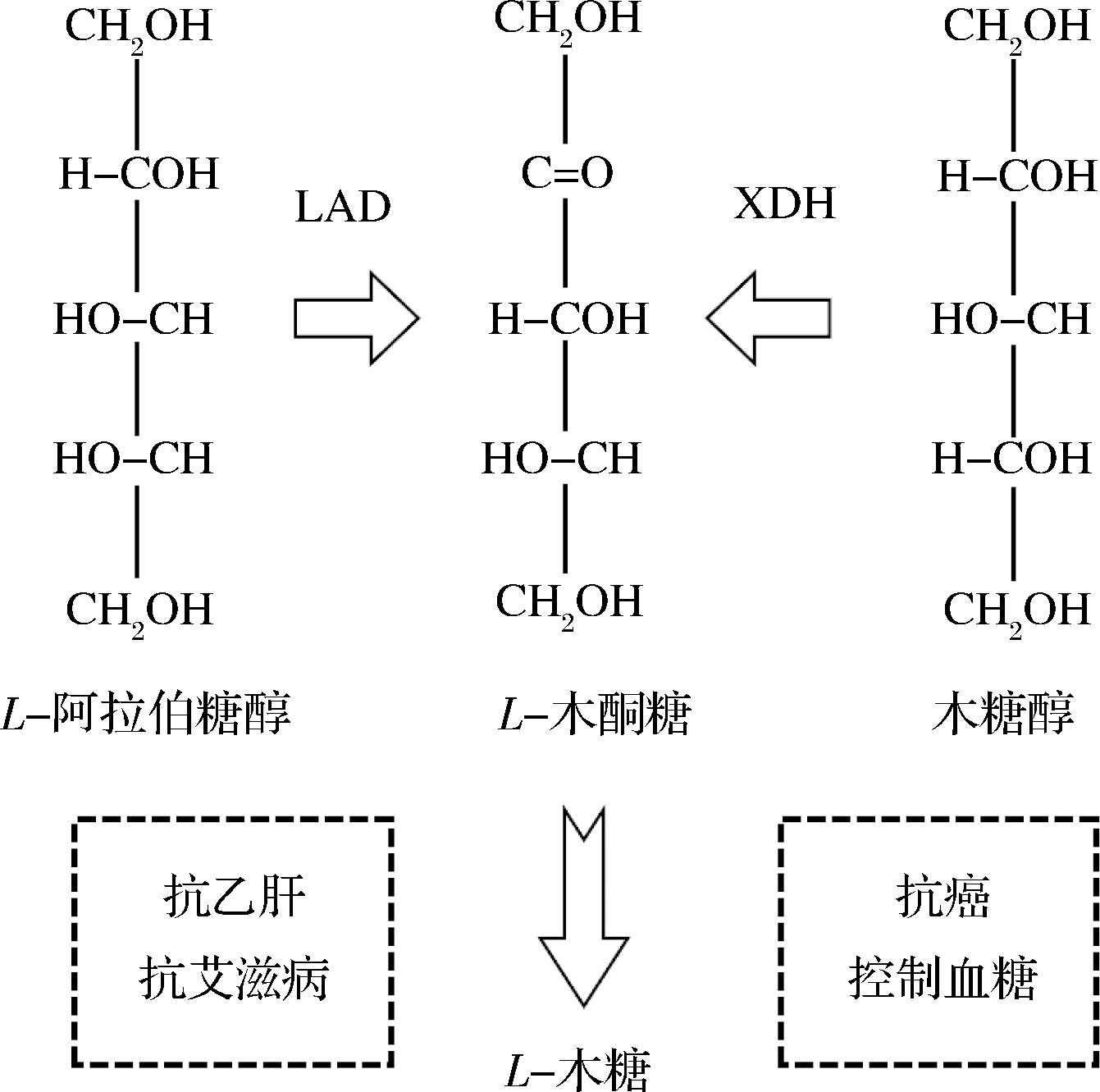
图2 L-木酮糖与木糖醇、L-阿拉伯糖醇的结构比较及其用途
Fig.2 Schematic diagram of structure comparison of L-xylulose,L-xylitol,and L-arabinol and the reported usage
5 关键酶催化机理
关键酶的催化机制研究为其改造与增产提供了可能性,然而L-木酮糖制备关键酶的催化机理研究较为缺乏;目前仅知TIWARI[42]利用分子建模和docking对接手段对红褐肉座菌(H.jecorina)来源L-阿拉伯糖醇-4-脱氢酶(LAD酶)与底物L-阿拉伯糖醇和辅因子NAD+的结合情况进行了研究,结果表明该酶活性中心内部含有一个四或五配位的锌离子,和L-阿拉伯糖醇都通过很强的氢键作用结合在活性中心,而NAD+则结合在一段富含甘氨酸的“GXGXXG”序列上。在催化过程中NAD+首先与酶结合,在底物结合后NAD+使得底物去质子化,进而在锌离子的帮助下采用氢转移机制将L-阿拉伯糖醇氧化为L-木酮糖。
6 展望
对于工业催化而言,产物浓度是极为重要的工艺参数,关系到下游分离提取的效率及总生产成本。已发表文献中涉及的L-木酮糖生产关键酶在催化高浓度底物时转化率较低,因此不适用于要求更低成本的产业化应用。由于L-木酮糖的生产关键酶均为依赖NAD+的氧化酶,故辅因子NAD+的再生尤为重要,构建关键酶利用辅因子的胞内循环为增强底物催化效率提供了可能性,这在已发表文献中获得了初步探索[29]。进一步的,挖掘酶活力更高、稳定性更好的关键酶有利于底物转化率和产物浓度的提升;而目前已知能够用于L-木酮糖生产的酶源极少,是一个显著的瓶颈问题。解决该问题的办法有赖于基因信息库挖掘、酶结构测定、酶工程改造、以及高通量筛选技术等[43-44]。尽管L-木酮糖的市场较小,但开发L-型稀少糖的技术仍有重要意义;尤其是在核苷酸类似物药物开发中可以用作合成中间体,这类技术还可以为其他种类的稀少糖生物合成提供有力借鉴。目前针对L-木酮糖的研究报道仍然较少,随着研发的不断深入,在不久的将来L-型稀少糖的产业化制备技术有望成为该领域的又一个经典案例。
[1] 曲茂华, 张凤英,何名芳,等.海藻糖生物合成及应用研究进展[J].食品工业科技,2014,35(16):358-362.
QU M H,ZHANG F Y,HE M F,et al.Research progress in trehalose biosynthesis and applications[J].Science and Technology of Food Industry,2014,35(16):358-362.
[2] 徐铮, 李贵祥,李莎,等.生物法生产D-塔格糖的研究进展[J].生物加工过程,2013,11(4):64-71.
XU Z,LI G X,LI S,et al.Research progress in biological production of D-tagatose[J].Chinese Journal of Bioprocess Engineering,2013,11(4):64-71.
[3] 黄擎宇, 徐铮,熊强,等.零热量甜味剂D-阿洛酮糖的研发进展[J].工业微生物,2020,50(3):57-63.
HUANG Q Y,XU Z,XIONG Q,et al.Progress in research and development of calorie-free sweetener D-allulose production[J].Industrial Microbiology,2020,50(3):57-63.
[4] ZHANG W,ZHANG T,JIANG B,et al.Enzymatic approaches to rare sugar production[J].Biotechnology Advances,2017,35(2):267-274.
[5] LI Z,GAO X D,CAI L.Synthesis of rare pentoses using microbial and enzymatic reactions[J].Current Organic Chemistry,2016,20(14):1 456-1 464.
[6] BEERENS K,DESMET T,SOETAERT W.Enzymes for the biocatalytic production of rare sugars[J].Journal of Industrial Microbiology & Biotechnology,2012,39(6):823-834.
[7] GOODWIN N C,MABON R,HARRISON B A,et al.Novel L-xylose derivatives as selective sodium-dependent glucose cotransporter 2 (SGLT2) inhibitors for the treatment of type 2 diabetes[J].Journal of Medicinal Chemistry,2009,52(20):6 201-6 204.
[8] MUNIRUZZAMAN S,PAN Y T,ZENG Y,et al.Inhibition of glycoprotein processing by L-fructose and L-xylulose[J].Glycobiology,1996,6(8):795-803.
[9] MATHÉ C,GOSSELIN G.L-nucleoside enantiomers as antivirals drugs:A mini-review[J].Antiviral Research,2006,71(2):276-281.
[10] USVALAMPI A,TURUNEN O,VALJAKKA J,et al.Production of L-xylose from L-xylulose using Escherichia coli L-fucose isomerase[J].Enzyme and Microbial Technology,2012,50(1):71-76.
[11] MOYROUD E,STRAZEWSKI P.L-Ribonucleosides from L-xylose[J].Tetrahedron,1999,55(5):1 277-1 284.
[12] GRANSTRÖM T B,TAKATA G,MORIMOTO K,et al.L-Xylose and L-lyxose production from xylitol using Alcaligenes 701B strain and immobilized L-rhamnose isomerase enzyme[J].Enzyme and Microbial Technology,2005,36(7):976-981.
[13] CHELAIN E,FLOCH O,CZERNECKI S.New synthesis of L-ribofuranose derivatives from L-xylose[J].Carbohydrate Chemistry,1995,14(8):1 251-1 256.
[14] KASIGANESAN H,WRIGHT G L,CHIACCHIO M A,et al.Novel L-adenosine analogs as cardioprotective agents[J].Bioorganic & Medicinal Chemistry,2009,17(14):5 347-5 352.
[15] CHU C K,BOUDINOT F D,PEEK S F,et al.Preclinical investigation of L-FMAU as an anti-hepatitis B virus agent[J].Antiviral Therapy,1998,3(Suppl 3):113-121.
[16] FORSMAN J J,LEINO R.L-Pentoses in biological and medicinal applications[J].Chemical Reviews,2011,111(5):3 334-3 357.
[17] CHELAIN E,FLOCH O,CZERNECKI S.New synthesis of L-ribofuranose derivatives from L-xylose[J].Carbohydrate Chemistry,1995,14(8):1 251-1 256.
[18] 李良智, 芮新生,万屹东.微生物及其酶法生产稀有L-戊糖[J].化工进展,2007(5):750-753.
LI L Z,RUI X S,WAN Y D.Production of rare L-pentoses using microorganisms and their enzymes[J].Chemical Industry and Engineering Progress,2007(5):750-753.
[19] DIMANT E,BANAY M.Preparation of L-xylose[J].The Journal of Organic Chemistry,1960,25(3):475-476.
[20] DOTEN R C,MORTLOCK R P.Production of D-and L-xylulose by mutants of Klebsiella pneumoniae and Erwinia uredovora [J].Applied and Environmental Microbiology,1985,49(1):158-162.
[21] 张玉宝, 赵祥颖,杨丽萍,等.一株产L-木酮糖菌株的分离筛选及鉴定[J].食品科学,2014,35(1):199-203.
ZHANG Y B,ZHAO X Y,YANG L P,et al.Isolation and identification of a novel L-xylulose-producing strain[J].Food Science,2014,35(1):199-203.
[22] POONPERM W,TAKATA G,MORIMOTO K,et al.Production of L-xylulose from xylitol by a newly isolated strain of Bacillus pallidus Y25 and characterization of its relevant enzyme xylitol dehydrogenase[J].Enzyme and Microbial Technology,2006,40(5):1 206-1 212.
[23] TAKATA G,POONPERM W,MORIMOTO K,et al.Cloning and overexpression of the xylitol dehydrogenase gene from Bacillus pallidus and its application to L-xylulose production[J].Bioscience,Biotechnology,and Biochemistry,2010,74(9):1 807-1 813.
[24] AARNIKUNNAS J S,PIHLAJANIEMI A,PALVA A,et al.Cloning and expression of a xylitol-4-dehydrogenase gene from Pantoea ananatis[J].Applied and Environmental Microbiology,2006,72(1):368-377.
[25] USVALAMPI A,KIVIHARJU K,LEISOLA M,et al.Factors affecting the production of L-xylulose by resting cells of recombinant Escherichia coli [J].Journal of Industrial Microbiology & Biotechnology,2009,36(10):1 323-1 330.
[26] 朱雯惠, 孟青,江波,等.重组枯草芽孢杆菌表达4-木糖醇脱氢酶的发酵和反应条件优化[J].食品与发酵工业,2019,45(9):21-28.
ZHU W H,MENG Q,JIANG B,et al.Optimized fermentation and reaction conditions to express xylitol-4-dehydrogenase in recombinant Bacillus subtilis,Food and Fermentation Industries,2019,45(9):21-28.
[27] TIWARI M K,SINGH R K,GAO H,et al.pH-rate profiles of L-arabinitol 4-dehydrogenase from Hypocrea jecorina and its application in L-xylulose production[J].Bioorganic & Medicinal Chemistry Letters,2014,24(1):173-176.
[28] SINGH R K,TIWARI M K,SINGH R,et al.Immobilization of L-arabinitol dehydrogenase on aldehyde-functionalized silicon oxide nanoparticles for L-xylulose production[J].Applied Microbiology and Biotechnology,2014,98(3):1 095-1 104.
[29] GAO H,KIM I W,CHOI J H,et al.Repeated production of L-xylulose by an immobilized whole-cell biocatalyst harboring L-arabinitol dehydrogenase coupled with an NAD+ regeneration system[J].Biochemical Engineering Journal,2015,96:23-28.
[30] GAO H,KIM T S,MARDINA P,et al.Rare sugar production by coupling of NADH oxidase and L-arabinitol dehydrogenase[J].RSC Advances,2016,6(71):66 609-66 616.
[31] PATEL S K,OTARI S V,KANG Y C,et al.Protein-inorganic hybrid system for efficient his-tagged enzymes immobilization and its application in L-xylulose production[J].RSC Advances,2017,7(6):3 488-3 494.
[32] XU Z,WANG R,LIU C,et al.A new L-arabinose isomerase with copper ion tolerance is suitable for creating protein-inorganic hybrid nanoflowers with enhanced enzyme activity and stability[J].RSC Advances,2016,6(37):30 791-30 794.
[33] GE J,LEI J,ZARE R N.Protein-inorganic hybrid nanoflowers[J].Nature Nanotechnology,2012,7(7):428-432.
[34] KO Y S,KIM J W,LEE J A,et al.Tools and strategies of systems metabolic engineering for the development of microbial cell factories for chemical production[J].Chemical Society Reviews,2020,49(14):4 615-4 636.
[35] ZHOU P,LI S,XU H,et al.Construction and co-expression of plasmid encoding xylitol dehydrogenase and a cofactor regeneration enzyme for the production of xylitol from D-arabitol[J].Enzyme and Microbial Technology,2012,51(2):119-124.
[36] LIU M,DING Y,XIAN M,et al.Metabolic engineering of a xylose pathway for biotechnological production of glycolate in Escherichia coli[J].Microbial Cell Factories,2018,17(1):51.
[37] CAO Y,XIAN M,ZOU H,et al.Metabolic engineering of Escherichia coli for the production of xylonate[J].PLoS One,2013,8(7):e67 305.
[38] HAN Q,EITEMAN M A.Coupling xylitol dehydrogenase with NADH oxidase improves L-xylulose production in Escherichia coli culture[J].Enzyme and Microbial Technology,2017,106:106-113.
[39] 葛驰宇, 蒋洁,翁旭,等.高效液相色谱法同时测定发酵液中木糖醇和L-木酮糖的含量[J].中国生化药物杂志,2016,36(6):191-193.
GE C Y,JIANG J,WENG X,et al.Simultaneous determination of xylitol and L-xylulose in fermentation broth with high performance liquid chromatography,Chinese Journal of Biochemical Pharmaceutics,2016,36(6):191-193.
[40] WEN L,HUANG K,WEI M,et al.Facile enzymatic synthesis of ketoses[J].Angewandte Chemie,2015,127(43):12 845-12 849.
[41] KHAN A R,TOKUNAGA H,YOSHIDA K,et al.Conversion of xylitol to L-xylulose by Alcaligenes sp.701B-cells[J].Journal of Fermentation and Bioengineering,1991,72(6):488-490.
[42] TIWARI M,LEE J K.Molecular modeling studies of L-arabinitol 4-dehydrogenase of Hypocrea jecorina:Its binding interactions with substrate and cofactor[J].Journal of Molecular Graphics and Modelling,2010,28(8):707-713.
[43] UCHIYAMA T,MIYAZAKI K.Functional metagenomics for enzyme discovery:challenges to efficient screening[J].Current Opinion in Biotechnology,2009,20(6):616-622.
[44] VERMA R,SCHWANEBERG U,ROCCATANO D.Computer-aided protein directed evolution:A review of web servers,databases and other computational tools for protein engineering[J].Computational and Structural Biotechnology Journal,2012,2(3):1-12.