日常生活中最常见的食用糖有白糖、红糖、冰糖,主要成分均为蔗糖。蔗糖甜味纯正、口感好、成本低,在食品行业中常被用作甜味剂。但是,过多摄入蔗糖会导致肥胖、血糖升高,尤其不适合糖尿病人食用。随着人们对饮食健康的日渐重视,亟需开发作为蔗糖替代品的新型碳水化合物。
稀有糖[1]是一类天然存在于自然界、含量稀少的糖,能够改善特殊人群的饮食健康,可作为蔗糖甜味剂的完美替代。按照碳原子数目分类,稀有糖主要有丁糖类、戊糖类、己糖类和庚糖类等,构象上又分为L型和D型,其中D型己酮糖——D-阿洛酮糖(D-psicose)因口感和生理作用突出而备受关注。
D-阿洛酮糖分子量为180.16,熔点为96 ℃,易溶于水,甜度约为蔗糖的70%,在结构上与D-果糖的C-3位存在差异。不同于传统甜味剂,当D-阿洛酮糖被摄入人体后,70%会通过尿液或粪便直接排出,产生的能量仅为等量蔗糖的0.3%[2],无消化负担,对人体不构成健康威胁。此外,D-阿洛酮糖还具有多种保健功能,效果最显著的是降血糖血脂作用,D-阿洛酮糖通过增强能量代谢,促进人体餐后脂肪氧化[3];其次为预防肥胖作用,D-阿洛酮糖可显著诱导胰高血糖素样肽-1受体释放,激活迷走神经传入信号,减少食物摄入,从而控制健康体重[4];另外还有清除自由基实现抗氧化[5]和神经保护[6]等作用。美国食品药品管理局已于2011年将D-阿洛酮糖批准为一般认为安全级别食品,但由于D-阿洛酮糖在自然界中含量极少,其高效制备成为大规模推广应用的瓶颈。本文主要阐述了国内外合成D-阿洛酮糖的研究进展,旨在拉动国内D-阿洛酮糖的研究浪潮,为其工艺技术革新提供新思路,从而推动天然甜味剂的功能探索与应用。
1 化学合成法
早期的D-阿洛酮糖化学合成法包括关环转换合成法[7]、选择性醇醛缩合合成法[8]等,后续开发的方法有催化加氢法、加成反应法、Ferrier重排法[9]等。例如,SOENGAS等[10]采用Kiliani ascension-acetonation反应,获得己酮糖总体产率为40%;方志杰等[11]先利用糖酸内酯与二碘甲烷反应得到1-脱氧碘代酮糖,再在碱性条件进行水解反应得到酮糖中间体,对羟基进行选择性保护及脱保护后合成D-阿洛酮糖。尽管化学合成法可以制备D-阿洛酮糖,但这些方法存在经济性差、环境污染严重、立体选择性不足等问题,不能够成为制备D-阿洛酮糖的主流方法。
2 生物转化法
生物转化法指利用机体内的一种或多种酶催化底物生成目标化合物的过程。与化学法相比,生物转化具有诸多优势:高区域选择性和立体选择性,能精确进行特定位置修饰;通常单步反应即可获得目的产物,避免了保护和脱保护步骤,适用于制备复杂的化合物;反应条件温和、活性高、使用剂量低,无需有毒试剂,环境相容性好。因此,利用自然界中大量存在的天然原料,以生物酶为催化剂制备D-阿洛酮糖,不仅有利于降低工业化生产成本,而且符合当下绿色环保的生产原则,为合成D-阿洛酮糖指明了方向。
2.1 生物酶的来源及性质
D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPE,EC 5.3.1.3)是一种典型的己酮糖3-差向异构酶,可以催化D-果糖的C-3位置的差向异构化制备D-阿洛酮糖(图1)。1993年,IZUMORI等[12]从Pseudomonas sp.ST-24中首次发现DPE,其除了催化D-果糖和D-阿洛酮糖间的转化,还能催化其他单糖间转化。2005年,KIM等[13]从Agrobacterium tumefaciens中分离得到DPE,该酶在中温50 ℃、弱碱性pH 8.0、底物质量浓度为700 g/L的条件下,转化率达到32.9%。此后,学者们陆续从Ruminococcus sp.[14]、Clostridium bolteae[15]、Arthrobacter globifoemis[16]等微生物中分离得到不同的DPE。随着越来越多微生物基因组数据的公布,目前National Center for Biotechnology Information(NCBI)数据库注释的DPE序列已有400余条,但是大部分序列的性质并未得到研究。截至目前,已明确性质及功能的DPE见表1,其中,除了Dorea sp. CAG317 DPE的最适pH为弱酸性,C.bolteae ATCC BAA613 DPE和Flavonifractor plautii DPE为中性外,其余均为嗜弱碱酶;金属离子可稳定DPE构象,其最适离子通常是Mn2+或Co2+;大多数酶在低于50 ℃的条件下具有较好的热稳定性。
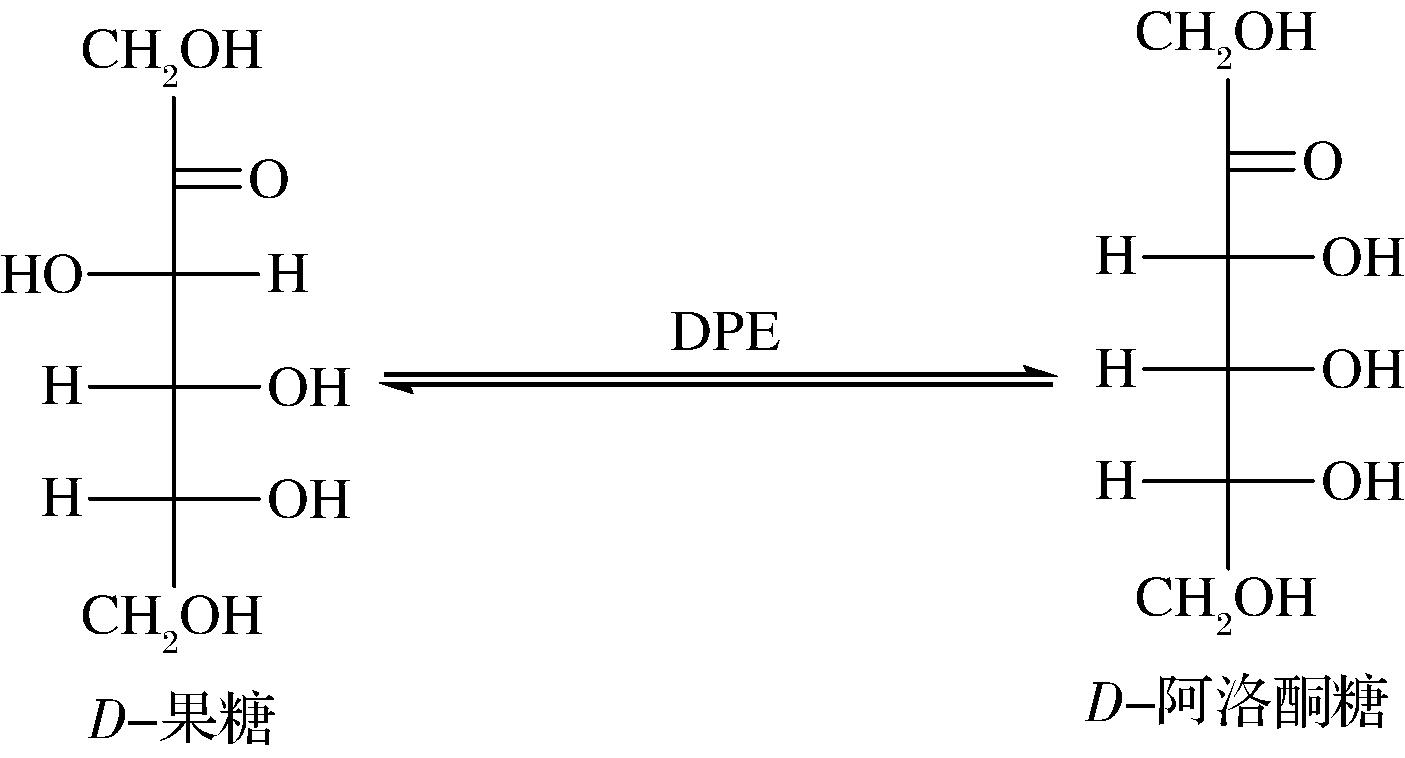
图1 DPE异构化D-果糖和D-阿洛酮糖
Fig.1 Epimerization of D-fructose and D-psicose using DPE
表1 不同微生物来源DPE及其酶学性质比较
Table 1 Summary of DPEs from different microorganisms and comparison of their properties
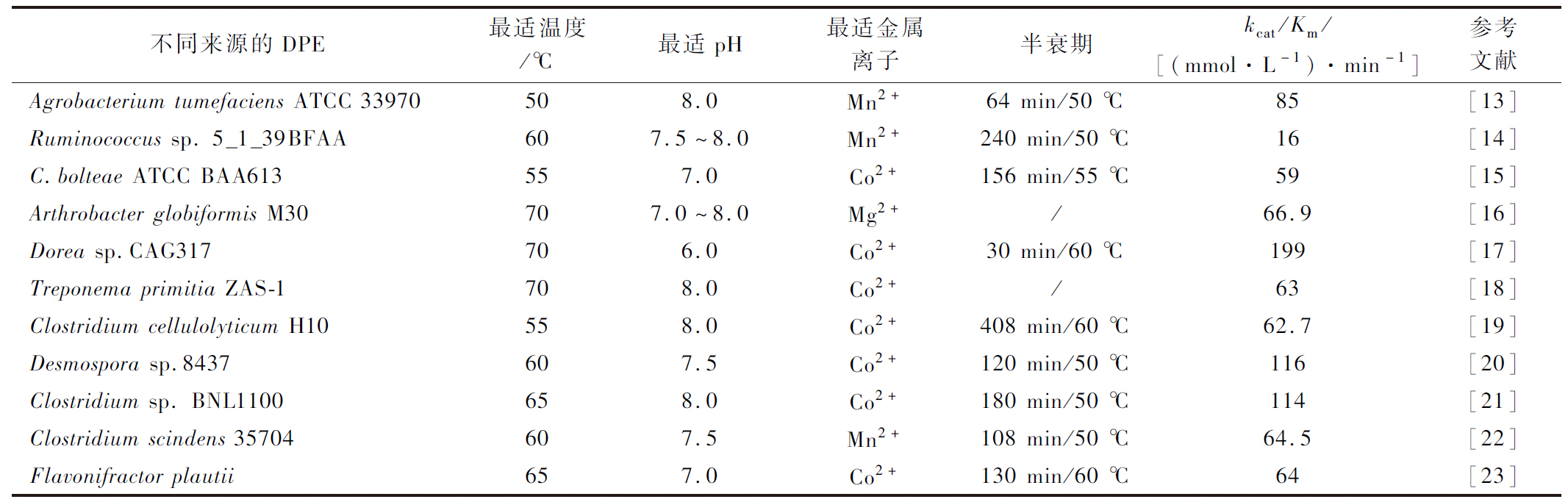
嗜热酶最适反应温度高、热稳定性好,高温下催化效率高、底物专一性强、不易受杂菌污染等优点,耐热性DPE成为当前酶源挖掘的研究热点。报道的D-阿洛酮糖中,Dorea sp.CAG317 DPE的最适温度高达70 ℃,催化活力与效率也高于同类酶,其报道的酶活力达到803.5 U/mg[17],高于嗜中温A.tumefaciens ATCC 33970 DPE在最适条件下的酶活力8.89 U/mg[13],为工业推广带来希望。
2.2 DPE的结构及催化机制解析
目前,A.tumefaciens DPE(PDB:2HK1)、C.cellulolyticum H10 DPE(PDB:3VNK)和A.globiformis M30 DPE(PDB:5ZFS)的晶体结构得到解析(图2)。晶体结构表明DPE为对称的多聚体结构,拓扑学角度上看,每个亚基都属于TIM-barrel fold,由8个重复的β-strand/α-helix组成,其中loop β6-α6参与催化过程。D-果糖以线性形式通过狭窄通道进入催化位点,在开链状态下实现异构化过程。A.tumefaciens DPE的催化机理称为氢化物转移反应[24](图3),在催化过程中,D-果糖C-3位于Glu150和Glu244中间,活性位点的氨基酸残基与D-果糖的C-1、C-2、C-3相互作用促进C-3去质子化,产生一个顺式烯二酸中间产物,中间体的氧阴离子O-2与金属离子和带正电荷的Arg215相稳定,随后,Glu150指导C-3重排,形成D-阿洛酮糖。在逆反应中,催化始于Glu150移除C-3位的质子,并遵循与正向反应基本相同的立体化学机制[25]。随着研究的不断深入,越来越多科研工作者成功解析到DPE不同氨基酸位点的功能。KIM等[26]发现A.tumefaciens DPE与D-果糖O-6位结合的氨基酸残基位点Ile66被其他氨基酸替代后,底物亲和力随之上升或下降,表明Ile66也参与了底物识别。张黎丽等[27]通过序列比对筛选Ruminococcus sp.DPE底物结合的关键位点,Tyr6Ile的kcat/Km降低了99%以上,圆二色谱分析二级结构发现Tyr6与D-果糖的O-6形成氢键,并与Glu244位置相邻,Tyr6Ile打断了氢键并且消除了芳香环的疏水作用,证实Tyr6是影响底物结合与催化能力的保守位点。上述实例表明,与果糖O-6位点结合的DPE氨基酸残基通常影响DPE催化底物的能力。
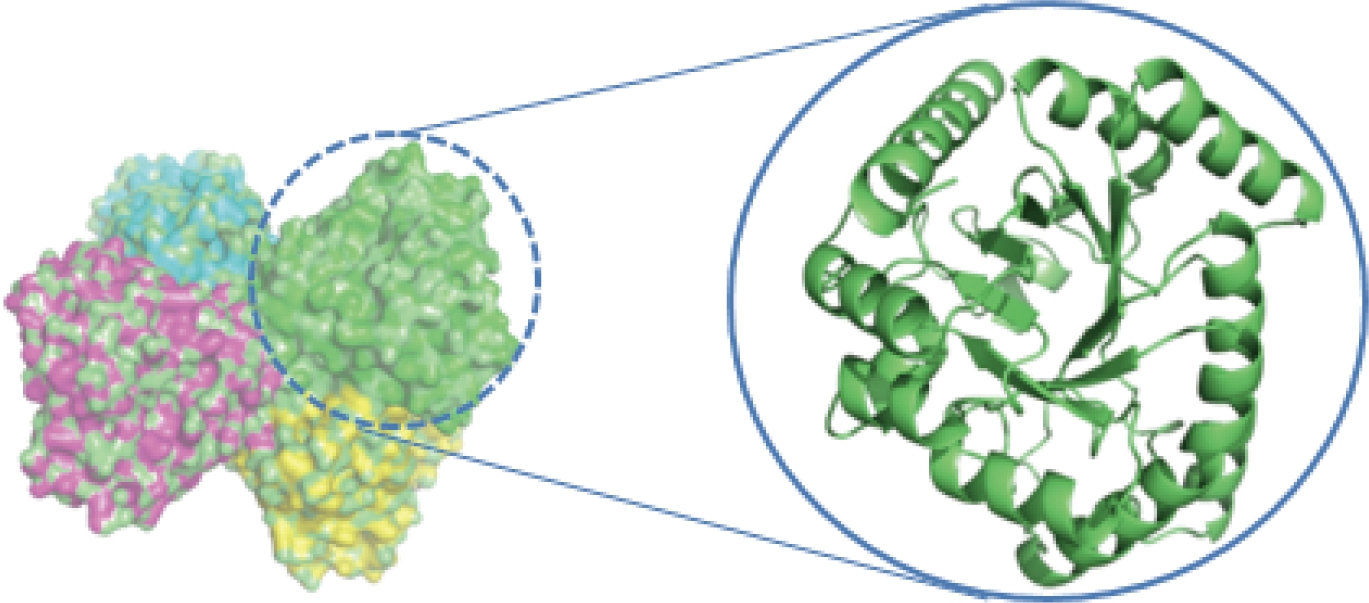
图2 DPE的晶体结构
Fig.2 Crystal structure of DPE
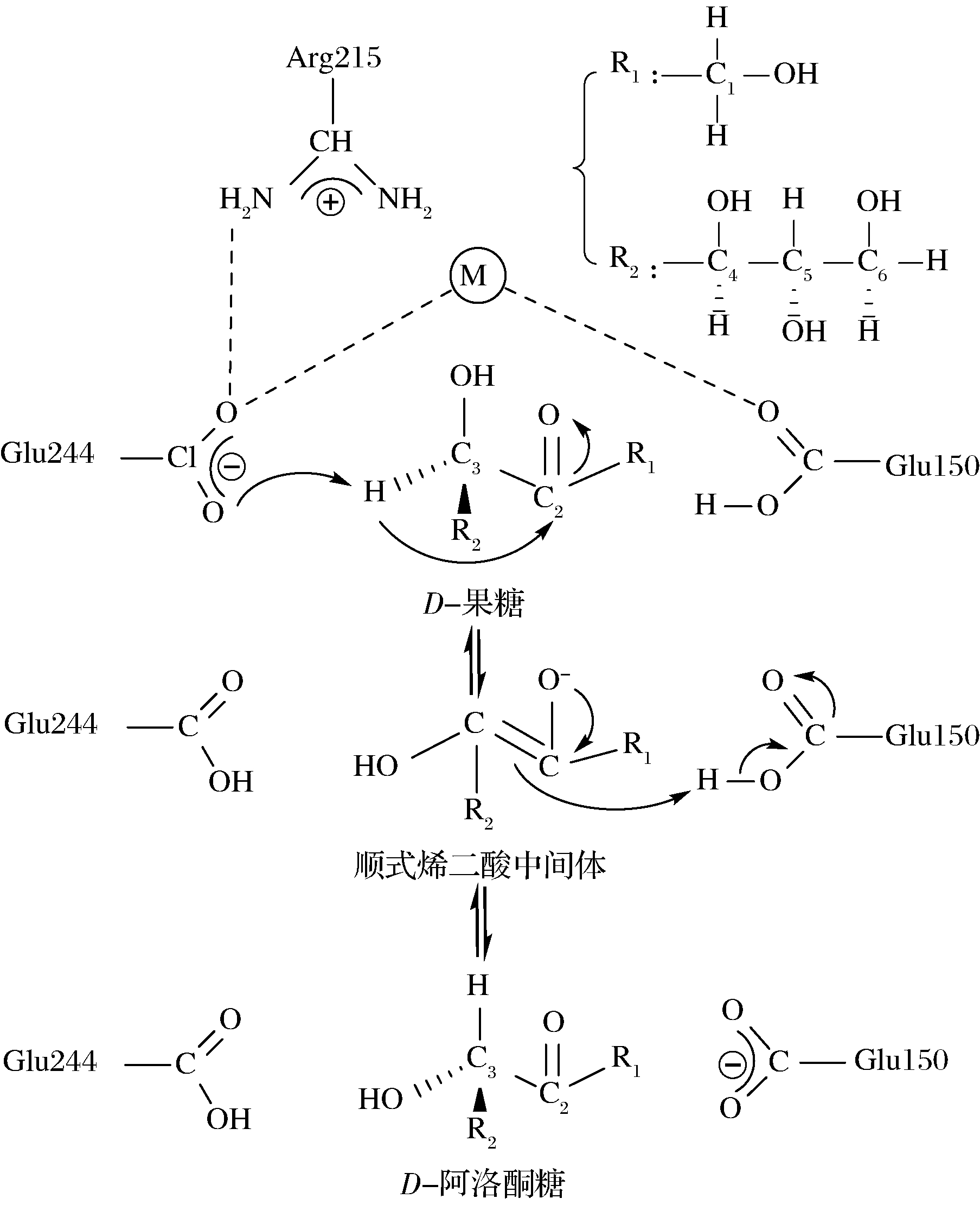
图3 A.tumefaciens DPE催化机理
Fig.3 Catalytic mechanism of A.tumefaciens DPE[25]
2.3 DPE的分子改造
2.3.1 提高DPE催化效率
天然DPE热稳定性较差、催化效率有待提高,需要采用蛋白质工程技术开展分子改造。当前分子改造策略主要包括理性设计和定向进化,理性设计利用分子建模和分子对接技术,在掌握蛋白结构和功能关系的基础上,找到底物与酶分子的结合位点或底物通道区域,分析底物与酶分子间的相互作用力和空间位阻,从这2方面入手对酶分子进行改造。定向进化则是在人为体系内对酶分子做大量随机突变,需要借助于高通量筛选方法获得正向突变体。2种方法适用条件不同,需根据实际情况选择或组合使用。ZHU等[28]对Staphylococcus aureus DPE做同源建模,并与底物分子对接,发现Val105位点存在空间位阻,构建的Val105Ala突变体对D-果糖的相对活性提高了68%。ZHU等[29]对C.bolteae DPE进行自适应分子动力学模拟和蛋白质结构网分析,构建Tyr68Ile/Gly109Pro突变体,使Phe248和Trp114的苯环与底物延展方向平行,形成稳定的开放通道,降低了底物和酶的结合自由能,从而促进酶促反应进行。
2.3.2 提高DPE热稳定性
对于吸热反应,升高温度可使反应物活化分子数增多,增强分子间有效碰撞[30]。鉴于此,糖异构化过程常采用升高温度的方法来提高反应速率加快产物生成。但是,过高的反应温度会加速非酶促褐变,生成副产物,综合考虑,糖异构化的反应温度设置于60~75 ℃为宜。目前多数报道的DPE在60~75 ℃下进行生物转化反应时,热稳定性仍达不到理想状态。因此,提升DPE的热稳定性成为当务之急。CHOI等[31]采用易错PCR随机突变的方法构建A.tumefaciens DPE突变体Ile33Leu/Ser213Cys,最适温度达到75 ℃,50 ℃下酶半衰期提高了29.9倍。ZHANG等[32]以定点突变方法构建C.bolteae DPE突变体Tyr68Ile/Gly109Pro,其Km从游离酶的59.8 mmol/L降低至49.1 mmol/L,55 ℃下酶的半衰期从游离酶的156 min提高到260 min,酶的底物亲和力也同时提高。ZHANG等[33]根据Dorea sp.CAG317 DPE多聚界面区域定位突变位点,构建Phe154Tyr/Glu191Asp/Ile193F突变体,差示扫描量热法测试发现其Tm比野生型提高17.54 ℃。MAO等[34]依据B-factor选点构建Rhodopirellula baltica DPE Leu144Phe突变体,测定突变体50%残余酶活力时发现,突变体能承受的热孵育温度较原始酶提高了22 ℃,结构分析发现是因为突变体形成了新的疏水键。总之,虽然在DPE的热稳定性提高方面取得一定进展,但仍未满足工业化所需的最佳水平,可继续通过在多聚体表面构建新的链间氢键,增强芳香族堆积相互作用,构建新的二硫键等方式提高DPE的高温热稳定性。
2.4 多酶偶联催化法制备D-阿洛酮糖
微生物体内多酶体系在催化过程中表现出高效率和高度协调性,为构建多酶反应体系优化生物催化过程提供了借鉴。根据多酶偶联体系所用酶的来源不同,可以分为自偶联反应和种间偶联反应2类[35]。自偶联反应体系是指利用同一微生物体内的多个酶实现酶反应的偶联,或是把不同来源的酶重组表达在同一菌株中实现细胞内的反应偶联。种间偶联反应体系是指在异种微生物之间构建多个酶反应的偶联。MEN等[36]首次将葡萄糖异构酶和Ruminococcus sp.5_1_39BFAA DPE偶联于Escherichia coli BL21(DE3)中,搭建DPE自偶联反应体系,添加1 mmol/L Mg2+提高葡萄糖异构酶活性,以F42高果糖浆为底物制备得到135 g/L D-阿洛酮糖,反应混合产物可投入饮料作为甜味剂使用,可改善传统高果糖浆对人体带来的腹部脂肪堆积负担。高雅慧等[37]利用磷酸甘油氧化酶、过氧化氢酶、磷酸酶YqaB和L-1-磷酸鼠李树胶糖醛缩酶实现种间偶联反应,以经济底物3-磷酸甘油作为前体降低了反应成本,采用“一锅四酶法”一步反应同时得D-山梨糖和D-阿洛酮糖,2种单糖的总产率达到36%。韩文佳等[38]采用种间偶联方式,在反应体系中同时加入不同宿主表达的DPE和L-鼠李糖异构酶,共同参与反应催化D-果糖生成D-阿洛酮糖和D-阿洛糖,两者加酶量的比例为1∶10,于60 ℃、pH 9.0下反应10 h,两者产量分别达到5.12和2.04 g/L,将果糖转化为含有功能性稀有糖的高附加值混合糖液。采用多酶偶联时需要综合考虑几种酶的性质,选取相对合适的反应条件以实现多种产物同时生产效率最大化。
2.5 食品级表达系统构建
从安全角度考虑,选择食品级安全的菌株表达DPE具有重要意义。谷氨酸棒杆菌(Corynebacterium glutamicum)、枯草芽孢杆菌(Bacillus subtilis)分别经欧盟食品安全局和美国食品药品管理局认证为食品级宿主菌,不含内毒素,具有培养条件相对简单、生长迅速、能高效分泌目的蛋白等特点,是用于食品酶表达的优良宿主。贾敏等[39]将C.bolteae DPE转入B.subtilis WB800感受态细胞,实现DPE首次在食品级宿主B.subtilis中表达,为拓宽D-阿洛酮糖的表达系统奠定了基础。HE等[40]先构建丙氨酸消旋酶缺陷型宿主B.subtilis 1A751,再采用3个重复P43启动子增强C.scindens ATCC 35704 DPE表达,以300 g/L果糖为底物,8 g/L冻干酶粉催化反应1 h,转化率达到20%;随后把C.scindens ATCC 35704 DPE的C端与锚定蛋白CotZ融合,表达于B.subtilis WB800表面,30 g/L孢子可将500 g/L果糖生物转化制备85 g/L D-阿洛酮糖。CHEN等[41]利用木糖诱导启动子PxylA调控Ruminococcus sp.5_1_39BFAA DPE在B.subtilis 1A751中表达,获得最佳表达水平,7.5 L发酵罐中分批发酵可得2.6 g/L DPE,而且发现该DPE可自发分泌到胞外,提高了体系中可溶性DPE的含量。YANG等[42]在C.glutamicum中同时表达Paenibacillus senegalensis DPE、C.cellulolyticum DPE和Ruminococcus sp. DPE,实现同工酶盒式反应,D-阿洛酮糖时空产量达到353 g/(L·h),与表达单个DPE相比,催化效率提高了16.4倍。综上所述,采用食品级表达宿主生产的DPE具有可靠的食品安全性,还可以获得较高的蛋白表达量。其中,B.subtilis表达系统是实现制备D-阿洛酮糖的首选表达系统。
2.6 固定化技术连续制备D-阿洛酮糖
固定化酶指通过物理或化学的方法将水溶性的酶结合或包埋在一定的固定化载体上,从而形成一种不溶性的、可重复使用的酶制剂。固定化酶具有催化活性稳定和便于储存的特点,可通过离心、过滤等简单操作从反应体系中分离,有利于连续催化。LIM等[43]将A.tumefaciens DPE固定在Duolite A568 beads上,以700 g/L D-果糖为底物,最终底物转化率为29.6%,向转化体系中加入硼酸,能够形成D-阿洛酮糖与硼酸的复合物,从反应中移除了产物,促使异构化正向进行,最终D-阿洛酮糖产量提高至441 g/L。YOSHIHARA等[44]把A.globiformis M30 DPE固定到IRA 96SBHG离子交换树脂上,每升固定化酶能制备215 kg D-阿洛酮糖,是当前获得D-阿洛酮糖的最高产量。TSENG等[45]将C.cellulolyticum DPE和油脂素N端融合,再将融合蛋白重构于人造油体中实现固定化,连续转化5批次,固定化酶仍保留50%以上初始酶活。LI等[46]利用阴离子交换树脂D301制备固定化Ruminococcus sp.5_1_39BFAA DPE,分批反应10批次后,仍维持在70%以上初始酶活力。孙帆等[47]用硅藻土-海藻酸钠对重组C.cellulolyticum H10 DPE细胞进行固定化,连续反应7个批次,仍保持81%初始酶活力。PATEL等[48]将Agrobacterium tumefaciens DPE的N端和酵母Smt3蛋白融合,形成Smt3-DPE复合体固定至Fe3O4磁性纳米颗粒上,连续10次异构化D-果糖,仍旧维持90%的初始酶活力,是目前为止操作稳定性最高的固定化方法。需要指出的是,与固定化转氨酶制备西他列汀[49]及固定化葡萄糖异构酶制备高果糖浆[50]相比,当前DPE固定化技术还处于实验室研究水平,开发高效、经济的DPE固定化方法仍将是今后的重要研究方向。
3 研究展望
随着对D-阿洛酮糖生理功能研究和临床试验探索的逐步深入,研究人员不断发现其在降血糖降血脂、抗氧化和神经保护等方面的极大潜力,因此制备食品安全级D-阿洛酮糖具有巨大市场应用价值。当前研究着重在酶的筛选与挖掘,表达体系建立、酶性能提升及强化异构化过程等方面开展研究。建立高底物浓度、高转化率、高生产强度的D-阿洛酮糖生物转化技术平台,实现技术创新仍需继续开展如下研究:(1)以第二代测序技术构建微生物基因组数据库,从中筛选更广阔的嗜热DPE;(2)采用蛋白质工程技术改造酶分子结构,提高DPE催化能力和应用稳定性,使其适应复杂物化环境,提升工业应用潜能;(3)开发食品级宿主,实现DPE在食品级宿主中的异源表达,建立符合食品安全的生物合成技术平台;(4)建立高强度发酵技术,强化生物催化体系、创制工业化固定化技术,实现生物制备及转化工艺的全方位立体性技术提升,使D-阿洛酮糖生物转化达到事半功倍的效果。开展上述技术研发对于填补国内功能性糖自主生产的空白具有深远影响。
[1] GRANSTRÖM T B,TAKATA G,TOKUDA M,et al.Izumoring:A novel and complete strategy for bioproduction of rare sugars[J].Journal of Bioscience and Bioengineering,2004,97(2):89-94.
[2] CHATTOPADHYAY S,RAYCHAUDHURI U,CHAKRABORTY R.Artificial sweeteners-A review[J].Journal of Food Science and Technology,2014,51(4):611-621.
[3] KIMURA T,KANASAKI A,HAYASHI N,et al.D-allulose enhances postprandial fat oxidation in healthy humans[J].Nutrition,2017,43-44:16-20.
[4] IWASAKI Y,SENDO M,DEZAKI K,et al.GLP-1 release and vagal afferent activation mediate the beneficial metabolic and chronotherapeutic effects of D-allulose[J].Nature Communications,2018,9:113.
[5] SUNA S,YAMAGUCHI F,KIMURA S,et al.Preventive effect of D-psicose,one of rare ketohexoses,on di-(2-ethylhexyl) phthalate (DEHP)-induced testicular injury in rat[J].Toxicology Letters,2007,173(2):107-117.
[6] TAKATA M K,YAMAGUCHI F,NAKANOSE K,et al.Neuroprotective effect of D-psicose on 6-hydroxydopamine-induced apoptosis in rat pheochromocytoma (PC12) cells[J].Journal of Bioscience and Bioengineering,2005,100(5):511-516.
[7] ANDREANA P R,MCLELLAN J S,CHEN Y,et al.Synthesis of 2,6-dideoxysugars via ring-closing olefinic metathesis[J].Organic Letters,2002,4(22):3 875-3 878.
[8] NORTHRUP A B,MACMILLAN D W C.Two-step synthesis of carbohydrates by selective aldol reactions[J].Cheminform,2004,5691:1 752-1 754.
[9] DONER L W.Isomerization of D-fructose by base:Liquid-chromatographic evaluation and the isolation of D-psicose[J].Carbohydrate Research,1979,70(2):209-216.
[10] SOENGAS R,IZUMORI K,SIMONE M I,et al.Kiliani reactions on ketoses:Branched carbohydrate building blocks from D-tagatose and D-psicose[J].Tetrahedron Letters,2005,46(34):5 755-5 759.
[11] 方志杰, 李松,程杰,等.一种由糖酸内酯出发合成稀有己酮糖和庚酮糖的方法:中国,200910031931.7[P].2009-07-03.
FANG Z J,LI S,CHENG J,et al.A method for the synthesis of rare hexoses and heptanoses from glycoacid lactones:China,200910031931.7[P].2009-07-03.
[12] IZUMORI K,KHAN A R,OKAYA H,et al.A new enzyme,D-ketohexose 3-Epimerase,from Pseudomonas sp.ST-24[J].Bioscience Biotechnology and Biochemistry,1993,57(6):1 037-1 039.
[13] KIM H J,HYUN E K,KIM Y S,et al.Characterization of an Agrobacterium tumefaciens D-psicose 3-Epimerase that converts D-fructose to D-psicose[J].Applied and Environmental Microbiology,2006,72(2):981-985.
[14] ZHU Y M,MEN Y,BAI W,et al.Overexpression of D-psicose 3-epimerase from Ruminococcus sp.in Escherichia coli and its potential application in D-psicose production[J].Biotechnology Letters,2012,34(10):1 901-1 906.
[15] JIA M,MU W M,CHU F F,et al.A D-psicose 3-epimerase with neutral pH optimum from Clostridium bolteae for D-psicose production:Cloning,expression,purification,and characterization[J].Applied Microbiology and Biotechnology,2014,98(2):717-725.
[16] YOSHIHARA A,KOZAKAI T,SHINTANI T,et al.Purification and characterization of D-allulose 3-epimerase derived from Arthrobacter globiformis M30,a GRAS microorganism[J].Journal of Bioscience and Bioengineering,2017,123(2):170-176.
[17] ZHANG W L,LI H,ZHANG T,et al.Characterization of a D-psicose 3-epimerase from Dorea sp.CAG317 with an acidic pH optimum and a high specific activity[J].Journal of Molecular Catalysis B:Enzymatic,2015,120:68-74.
[18] ZHANG W L,ZHANG T,JIANG B,et al.Biochemical characterization of a D-psicose 3-epimerase from Treponema primitia ZAS-1 and its application on enzymatic production of D-psicose[J].Journal of the Science of Food and Agriculture,2016,96(1):49-56.
[19] MU W M,CHU F F,XING Q C,et al.Cloning,expression,and characterization of a D-psicose 3-Epimerase from Clostridium cellulolyticum H10[J].Journal of Agricultural and Food Chemistry,2011,59(14):7 785-7 792.
[20] ZHANG W L,FANG D,ZHANG T,et al.Characterization of a metal-dependent D-psicose 3-epimerase from a novel strain,Desmospora sp.8437[J].Journal of Agricultural and Food Chemistry,2013,61(47):11 468-11 476.
[21] MU W M,ZHANG W L,FANG D,et al.Characterization of a D-psicose-producing enzyme,D-psicose 3-epimerase,from Clostridium sp.[J].Biotechnology Letters,2013,35(9):1 481-1 486.
[22] ZHANG W L,FANG D,XING Q C,et al.Characterization of a novel metal-dependent D-psicose 3-epimerase from Clostridium scindens 35704[J].PLoS ONE,2013,8(4):e62 987.
[23] PARK C,KIM T,HONG S,et al.D-allulose production from D-fructose by permeabilized recombinant cells of Corynebacterium glutamicum cells expressing D-allulose 3-epimerase Flavonifractor plautii[J].PLoS One,2016,11(7):e160 044.
[24] KIM K,KIM H,OH D,et al.Crystal structure of D-psicose 3-epimerase from Agrobacterium tumefaciens and its complex with true substrate D-fructose:A pivotal role of metal in catalysis,an active site for the non-phosphorylated substrate,and its conformational changes[J].Journal of Molecular Biology,2006,361(5):920-931.
[25] QI Z L,ZHU Z L,WANG J W,et al.Biochemical analysis and the preliminary crystallographic characterization of D-tagatose 3-epimerase from Rhodobacter sphaeroides[J].Microbial Cell Factories,2017,16(1):193.
[26] KIM H,LIM B,YEOM S,et al.Roles of Ile66 and Ala107 of D-psicose 3-epimerase from Agrobacterium tumefaciens in binding O6 of its substrate,D-fructose[J].Biotechnology Letters,2010,32(1):113-118.
[27] 张黎丽,朱玥明,门燕,等.来源于瘤胃菌Ruminococcus sp.的D-阿洛酮糖3-差向异构酶的底物结合位点分析[J].微生物学通报,2014,41(5):811-817.
ZHANG L L,ZHU Y M,MEN Y,et al.Substrate-binding site of D-psicose 3-epimerase from Ruminococcus sp.[J].Microbiology China,2014,41(5):811-817.
[28] ZHU Z L,GAO D K,LI C,et al.Redesign of a novel D-allulose 3-epimerase from Staphylococcus aureus for thermostability and efficient biocatalytic production of D-allulose[J].Microbial Cell Factories,2019,18(1):59.
[29] ZHU J X,LI Y,WANG J Z,et al.Adaptive steered molecular dynamics combined with protein structure networks revealing the mechanism of Y68I/G109P mutations that enhance the catalytic activity of D-psicose 3-epimerase from Clostridium bolteae[J].Frontiers in Chemistry,2018,6:437.
[30] TOLMAN R C.The temperature coefficient of photochemical reaction rate[J].Journal of the American Chemical Society,1923,45(10):2 285-2 296.
[31] CHOI J,JU Y,YEOM S,et al.Improvement in the thermostability of D-psicose 3-epimerase from Agrobacterium tumefaciens by random and site-directed mutagenesis[J].Applied and Environmental Microbiology,2011,77(20):7 316-7 320.
[32] ZHANG W L,JIA M,YU S H,et al.Improving the thermostability and catalytic efficiency of the d-psicose 3-epimerase from Clostridium bolteae ATCC BAA-613 using site-directed mutagenesis[J].Journal of Agricultural and Food Chemistry,2016,64(17):3 386-3 393.
[33] ZHANG W L,ZHANG Y M,HUANG J W,et al.Thermostability improvement of the D-allulose 3-epimerase from Dorea sp.CAG317 by site-directed mutagenesis at the interface regions[J].Journal of Agricultural and Food Chemistry,2018,66(22):5 593-5 601.
[34] MAO S H,CHENG X T,ZHU Z L,et al.Engineering a thermostable version of D-allulose 3-epimerase from Rhodopirellula baltica via site-directed mutagenesis based on B-factors analysis[J].Enzyme and Microbial Technology,2020,132:109 441.
[35] 谢雪原, 周华,高震,等.多酶偶联反应体系的研究和应用[J].化工进展,2004,23(8):864-868.
XIE X Y,ZHOU H,GAO Z,et al.Study and application of coupled multienzyme reaction system[J].Chemical Industry and Engineering Progress,2004,23(8):864-868.
[36] MEN Y,ZHU Y M,ZENG Y,et al.Co-expression of D-glucose isomerase and D-psicose 3-epimerase:Development of an efficient one-step production of D-psicose[J].Enzyme and Microbial Technology,2014,64-65:1-5.
[37] 高雅慧, 金则成,钱超,等.基于RhaD醛缩酶的“一锅四酶法”合成D-山梨糖和D-阿洛酮糖[J].食品工业科技,2013,34(21):210-214.
GAO Y H,JIN Z C,QIAN C,et al.One pot four enzyme synthesis of D-sorbose and D-psicose based on aldolase RhaD[J].Science and Technology of Food Industry,2013,34(21):210-214.
[38] 韩文佳, 朱玥明,柏玮,等.双酶偶联转化果糖制备含有稀少糖的混合糖液[J].生物工程学报,2014,30(1):90-97.
HAN W J,ZHU Y M,BO W et al.Production of sugar syrup containing rare sugar using dual-enzyme coupled reaction system[J].Chinese Journal of Biotechnology,2014,30(1):90-97.
[39] 贾敏, 沐万孟,张涛,等.D-阿洛酮糖3-差向异构酶基因在枯草芽孢杆菌中的表达[J].食品与生物技术学报,2014,33(11):1 129-1 135.
JIA M,MU W M,ZHANG T,et al.Expression of D-psicose 3-epimerase in Bacillus subtilis[J].Journal of Food Science and Biotechnology,2014,33(11):1 129-1 135.
[40] HE W W,JIANG B,MU W M,et al.Production of D-allulose with D-psicose 3-epimerase expressed and displayed on the surface of Bacillus subtilis spores[J].Journal of Agricultural and Food Chemistry,2016,64(38):7 201-7207
[41] CHEN J Q,ZHAO L Q,FU G,et al.A novel strategy for protein production using non-classical secretion pathway in Bacillus subtilis[J].Microbial Cell Factories,2016,15(1):1-16.
[42] YANG J G,TIAN C Y,ZHANG T,et al.Development of food-grade expression system for D-allulose 3-epimerase preparation with tandem isoenzyme genes in Corynebacterium glutamicum and its application in conversion of cane molasses to D-allulose[J].Biotechnology and Bioengineering,2019,116(4):745-756.
[43] LIM B,KIM H,OH D.A stable immobilized D-psicose 3-epimerase for the production of D-psicose in the presence of borate[J].Process Biochemistry,2009,44(8):822-828.
[44] YOSHIHARA A,KOZAKAI T,SHINTANI T,et al.Purification and characterization of D-allulose 3-epimerase derived from Arthrobacter globiformis M30,a GRAS microorganism[J].Journal of Bioscience and Bioengineering,2017,123(2):170-176.
[45] TSENG C,LIAO C,SUN Y,et al.Immobilization of Clostridium cellulolyticum D-psicose 3-epimerase on artificial oil bodies[J].Journal of Agricultural and Food Chemistry,2014,62(28):6 771-6 776.
[46] LI C,LIN J Q,GUO Q Q,et al.D-psicose 3-epimerase secretory overexpression,immobilization,and D-psicose biotransformation,separation and crystallization[J].Journal of Chemical Technology & Biotechnology,2018,93(2):350-357.
[47] 孙帆, 宿玲恰,张康,等.D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的高效表达及固定化细胞研究[J].中国生物工程杂志,2018,38(7):83-88.
SUN F,SU L Q,ZHANG K,et al.D-psicose 3-epimerase gene overexpression in Bacillus subtilis and immobilization of cells[J].China Biotechnology,2018,38(7):83-88.
[48] NARAYAN PATEL S,SINGH V,SHARMA M,et al.Development of a thermo-stable and recyclable magnetic nanobiocatalyst for bioprocessing of fruit processing residues and D-allulose synthesis[J].Bioresource Technology,2018,247:633-639.
[49] ZHANG X J,FAN H H,LIU N,et al.A novel self-sufficient biocatalyst based on transaminase and pyridoxal 5′-phosphate covalent co-immobilization and its application in continuous biosynthesis of sitagliptin[J].Enzyme and Microbial Technology,2019,130:109 362.
[50] 金利群, 郭东京,廖承军.固定化葡萄糖异构酶的研究进展[J].发酵科技通讯,2015,44(3):47-51.
JIN L Q,GUO D J,LIAO C J.Progress in immobilized glucose isomerase[J].Bulletin of Fermentation Science and Technology,2015,44(3):47-51.