食品用酶制剂是指从生物中提取且有催化活性的蛋白质,具有加速食品生产过程和改善食品品质的作用[1-2]。近年来,随着食品加工行业的发展,食品用酶制剂以其安全无毒、反应条件温和、具有专一性等优点,常用于对食品加工过程进行工艺优化,以改善食品风味、色泽、营养品质,提高产率,延长货架期等[2-7]。常用的食品酶制剂有淀粉酶、木瓜蛋白酶、脂肪酶、葡萄糖氧化酶(glucose oxidase,GOD)、己糖氧化酶(hexose oxidase,HOX)等[4,8-9]。
近几年,GOD和HOX因具有杀菌、脱氧、去除葡萄糖的作用逐渐得到了广泛的研究和应用,常用于啤酒、牛奶保鲜、蛋白脱糖、面粉改良、纺织品漂白,检测血糖浓度和抑制病原微生物等[6,10-14]。HOX具有广泛的底物特异性,在面包烘焙、乳制品酸化、动物饲料添加剂等方面都具有良好的应用价值[15-18]。
HOX是从红藻类物种中提取的一种能够催化六碳糖氧化为相应内酯的酶,具有较宽底物谱。除葡萄糖外,HOX还可利用其他单糖和二糖进行除氧和酸化,如D-半乳糖,麦芽糖等,从而作为天然的抗氧化剂、防腐剂、保鲜剂和酸化剂用于食品。本文主要介绍了HOX的分离纯化方法和酶学性质,并对生产方法和在食品方面的应用进行了详细介绍,以期为HOX的工业化生产和应用提供参考。
1 HOX的发现
1969年,IKAWA等[19]在新英格兰海岸发现2种红藻Chondrus crispus和Euthora cristata能够抑制蛋白核小球藻(Chlorella pyrenoidosa)的生长,进一步研究表明,该抑制行为是由于蛋白核小球藻生长环境中的葡萄糖被氧化而释放出的H2O2所致,后经过分离鉴定表明,这2种红藻中存在的HOX催化了这一氧化反应。后来,BEAN等[20]从Iridophycus flaccidum中也提取了HOX,两者性质较为相似,均可利用多种底物,包括D-葡萄糖、D-半乳糖、麦芽糖、乳糖和纤维二糖等。这种广泛的底物特异性使HOX与GOD存在显著差异,后者只能特异地催化D-葡萄糖的氧化[21]。
目前已被表征的HOX主要来源于红藻类物种,包括C.crispus、I.flaccidum和E.cristata。另外,OGASAWARA等[22]从Ptilophora subcostata中也分离到了HOX。
2 HOX的分离纯化
目前,常用的HOX分离纯化方法包括以下几个步骤:粗酶液的浓缩、盐析、脱盐和层析。分离纯化过程中通常会将几种方法结合使用以获得高纯度的蛋白。
SULLIVAN等[23]采用盐析、离子交换层析和凝胶过滤结合的方法首次从C.crispus中纯化得到HOX。将经过初步处理的HOX粗酶液用DEAE-纤维素色谱纯化,通过含有NaCl的磷酸缓冲液洗脱后以水透析,随后又采用葡聚糖凝胶G-200进一步纯化。其中,采用了胃蛋白酶-胰蛋白酶处理DEAE-纤维素色谱纯化后的酶,这一过程对于去除HOX中的藻红蛋白至关重要,且酶活力并未因此受到影响,最终比酶活力为4 095 U/mg [23]。
采用上述离子交换层析和凝胶过滤结合的方法,虽然纯化出的HOX纯度较高,但操作繁琐、耗时、收率低。SAVARY等[24]优化了分离纯化的方法,采用灌注层析法。多孔灌注色谱的介质基于苯乙烯-二乙烯基苯共聚物,可实现较高的颗粒内对流传输流量,在高流动相速度下分离蛋白质而不降低分辨率和容量,具有流速快和分辨率高的优点[25]。研究中首先采用Poros DEAE色谱,对粗酶液进行纯化和浓缩,有效去除了残留的藻胆蛋白和角叉菜胶。随后将洗脱的酶液通过Poros HP2疏水相互作用色谱,并用35%的饱和硫酸铵洗脱。通过Poros HQ阴离子交换色谱分离到两个HOX活性峰,其中第1个峰在200 mmol/L磷酸钠时洗脱,包含约67%的回收活性。与SULLIVAN等[23]采用的DEAE-纤维素色谱相比,Poros HQ/H柱具有与之相当的样品装载量,但流速相较前者可提高10倍。
BEAN等[20]尝试通过有机溶剂沉淀法和无机盐沉淀法提取I.flaccidum中的HOX。首先在经过预处理的红藻提取物中加入氯化钡,使之与硫酸盐形成硫酸钡沉淀而析出。随后在低温条件下加入预冷的甲醇溶液使HOX沉淀析出。有机溶剂沉淀法的优点在于沉淀不用脱盐,操作较为方便[26]。但操作需要在低温下进行以防止蛋白变性。经甲醇沉淀的HOX显示出较好的稳定性,在-10 ℃条件下存放7个月后还能保留90%的活性。随后,又采用了硫酸铵分级沉淀法进一步纯化HOX。经过以上两步纯化,最终HOX的比酶活力为1 060 U/mg。
3 HOX的酶学性质
不同来源的HOX性质有所不同,如表1所示。I.flaccidum来源的HOX显示出不包含黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)的特性,最适反应温度为30 ℃,最适pH为5.0,大于7.5时逐渐失活[20]。但C.crispus来源的HOX性质还存在争论,例如是否含有FAD、Cu等[20,22-24,27-33]。
表1 HOX的性质
Table 1 Properties of hexose oxidase

注:最适作用温度25~30 ℃;NE,native enzyme(天然酶);RE,recombinant enzyme(重组酶);“\”,文献中未提到;*,该数值表示抗菌活性
C.crispus来源的HOX受到二乙基二硫代氨基甲酸钠强烈抑制,在10-4 mol/L的浓度下就能使其失活。另外,氰化物、羟胺、叠氮化物、乙酸盐和丙酮酸也能抑制其活性[32]。对于来自I.flaccidum的HOX,氯化汞、醋酸铅、硝酸银在10-3mol/L的浓度下就能完全抑制其活性。苯甲酸钠、醋酸钠也有微弱的抑制作用[20]。
HOX能够在氧气存在的条件下将D-葡萄糖和其他几种己糖氧化成各自的内酯,同时消耗O2生成H2O2。随后内酯自发水解为相应的醛酸。以D-葡萄糖为例,HOX利用分子氧为电子受体,催化D-葡萄糖C-1上的羟基,生成δ-D-葡萄糖酸内酯,随后缓慢水解为D-葡萄糖酸(gluconic acid,GA)[34]。
HOX催化葡萄糖和半乳糖氧化的反应如下:
D-葡萄糖+O2→δ-D-葡萄糖酸内酯+H2O2
D-半乳糖+O2→γ-D-半乳糖酸内酯+H2O2
KERSCHENSTEINER[29]通过物理化学研究和动力学测定,提出了HOX与葡萄糖反应机理的2种可能性。第1种,酶中的Cu以还原态的形式成对存在。氧分子与其结合,形成过氧根离子和2个Cu2+,随后两者结合形成络合物![]() 同时,认为该酶促反应机制为乒乓反应。底物葡萄糖的添加将铜离子二聚体还原为成对的亚铜离子。葡萄糖被氧化失去电子,δ-D-葡萄糖酸内酯形成。第2种反应机理认为,酶中的Cu2+是相互独立的,该过程涉及电子的逐步转移。HOX中的Cu可以解释为电子从葡萄糖到O2穿梭的通道。Cu可以串联工作也可作为单独的中心,转移一对电子。总之,HOX中Cu的状态与酶的作用机理密切相关[29]。
同时,认为该酶促反应机制为乒乓反应。底物葡萄糖的添加将铜离子二聚体还原为成对的亚铜离子。葡萄糖被氧化失去电子,δ-D-葡萄糖酸内酯形成。第2种反应机理认为,酶中的Cu2+是相互独立的,该过程涉及电子的逐步转移。HOX中的Cu可以解释为电子从葡萄糖到O2穿梭的通道。Cu可以串联工作也可作为单独的中心,转移一对电子。总之,HOX中Cu的状态与酶的作用机理密切相关[29]。
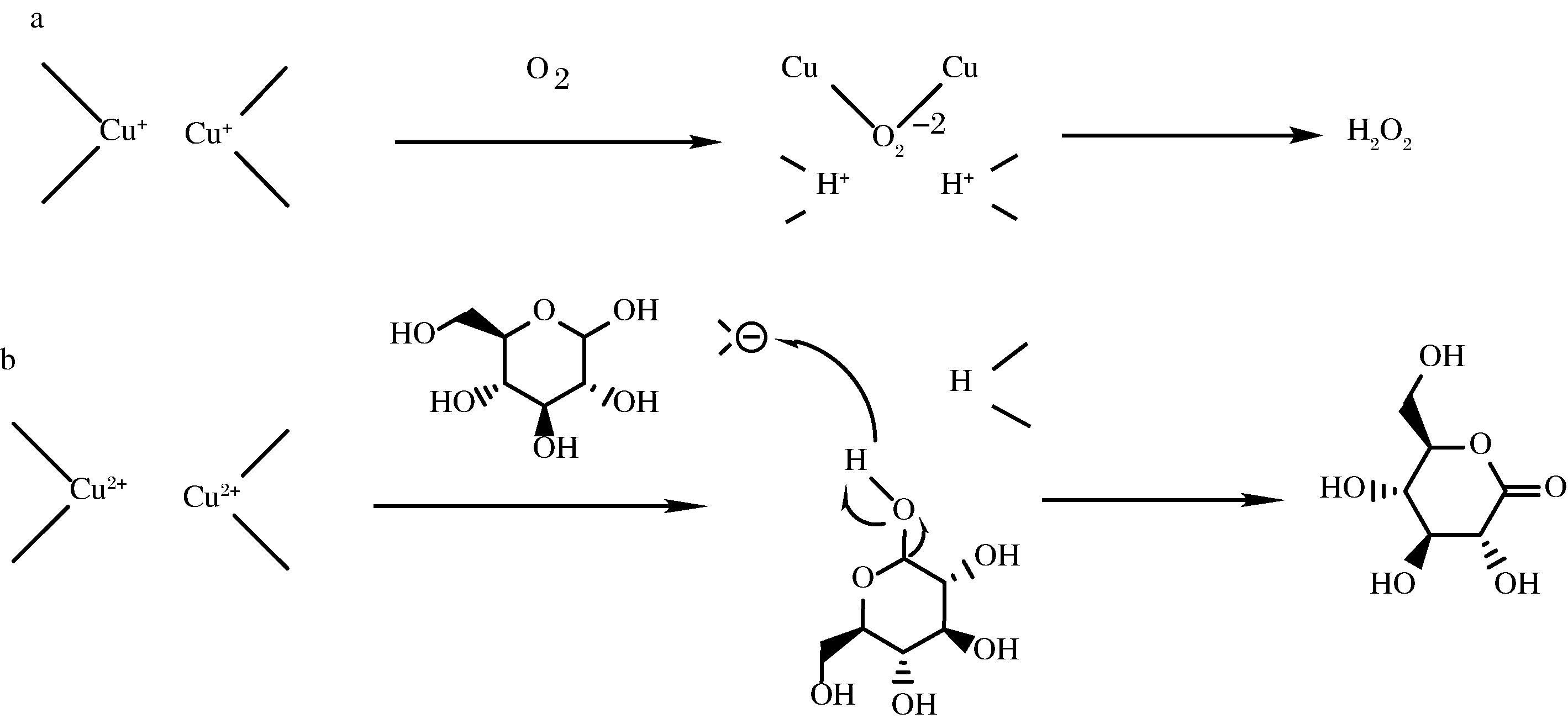
a-H2O2形成过程;b-δ-D-葡萄糖酸内酯形成过程
图1 KERSCHENSTEINER推测的HOX的作用机制
Fig.1 Proposed mechanism of HOX by KERSCHENSTEINER
4 HOX的异源表达
天然来源的HOX可从海藻物种中分离提取[20,23-24,27,28,30,35]。但由于藻类中HOX的含量很低,直接提取的生产成本偏高。随着分子生物学技术的发展,基因的克隆与表达成为提高HOX产量和活性的重要手段。C.crispus来源的HOX基因已被克隆,并分别在大肠杆菌(Escherichia.coli)、酿酒酵母(Saccharomyces cerevisiae)、毕赤酵母(Pichia pastoris)和多形汉逊酵母(Hansenula polymorpha)中表达。
WOLFF等[32]从C.crispus中成功分离并测定了HOX的编码基因序列,将其克隆至大肠杆菌宿主细胞进行表达,最终在SDS-PAGE中观察到分子质量为62 kDa的蛋白质条带,与计算预测的单体HOX分子质量一致,但是并未在细胞中检测到HOX活性。结果表明大肠杆菌表达出了大量无酶活性的HOX多肽。
毕赤酵母具有翻译后加工修饰的能力,用于表达真核生物来源的蛋白质,且分泌蛋白的能力较强。因此HANSEN等[27]尝试通过毕赤酵母表达系统表达重组HOX,首先将HOX基因克隆至诱导型胞内表达载体pPIC3,并转化至毕赤酵母KM71菌株进行整合表达,结果表明重组酶与天然酶的比活性、酶学性质相似。为了提高HOX的表达水平,WOLFF等[32]通过紫外诱变重组毕赤酵母表达菌株,最终产量达到250 mg/L,同时,为优化HOX的分泌,又将来自酿酒酵母的转化酶和α-交配因子信号肽序列分别与HOX基因进行融合,却未能在胞外检测到酶活性。然而表达不含有信号肽序列的重组HOX,却在培养基中检测到活性,即HOX采用不依赖信号肽的胞外分泌表达。目前,HOX在酵母菌中的分泌机制尚未阐明。
另外,STOUGAARD等[36]尝试采用自主复制型质粒pYES2在酿酒酵母PAP1500菌株中表达,并成功获得了有活性的HOX。OLEMPSKA等[34]则报道了在多形汉逊酵母中表达HOX的方法,构建了一个基于大肠杆菌pBR322质粒的整合型表达载体,并电转化至RB11宿主菌株。随后对重组菌株进行紫外诱变进一步提高了其活性,最终比酶活力达到100 U/mg。
5 应用
HOX具有广泛的底物特异性,利用糖类物质进行除氧及抑制好氧菌生长,可作为抗氧化剂、酸化剂、面粉改良剂,在食品、畜牧养殖等方面具有广泛的应用。
5.1 乳制品的酸化剂
HOX能够氧化包括葡萄糖、半乳糖和果糖在内的多种己糖,最后产生的内酯自发水解为相应的醛酸,可作为乳制品的酸化剂。在不含葡萄糖或葡萄糖含量非常低的产品中,HOX比GOD使用更为有效、方便,因为后者只能特异性氧化葡萄糖。例如在乳制品中,大量存在的乳糖和半乳糖则几乎不会被GOD氧化。因此GOD只能在含有葡萄糖或同时加入了乳糖酶的乳制品中使用[37]。即便如此,GOD也只能利用乳糖分解产物的50%作为其底物。相反,HOX对葡萄糖、半乳糖、乳糖都具有氧化作用。因此HOX是乳制品中有效的酸化剂。
5.2 面粉制品的改良剂
HOX可作为改良剂添加至面粉或面团中,以克服面包弹性差、易塌陷等质量问题。常用的面团改良剂分为2类,一类是化学类氧化剂,如溴酸钾、抗坏血酸等[38-39],另一类是氧化还原酶,如HOX、GOD、漆酶等[16-40]。一般认为,在面团中添加氧化剂可增强蛋白质分子间和分子内共价键的形成,如二硫键、谷氨酰赖氨酸交联键等,从而促进面筋蛋白之间形成较好的蛋白质网络空间结构,提高面团稳定性、强度,增大面团体积等[17]。长期以来被广泛使用的溴酸钾由于具有毒性且易爆已相继被许多国家禁用。随后一些改进措施是在面粉或生面团中添加GOD。这种氧化还原酶通过巯基基团的氧化交联,酪氨酸残基的交联或氨基酸残基之间的酰基转移反应促进多肽链之间共价键的形成[16]。但谷物面粉中葡萄糖含量较低,GOD的使用效果并不尽如人意。相反,具有广泛底物谱的HOX可以催化面团中由大量的β-淀粉酶分解淀粉生成的麦芽糖。因此相较GOD,HOX是作为生面团改进剂的更好选择。
GÜL等[41]研究发现,添加30 mg/kg的HOX能有效地增强面团中的面筋网络,改善面团流变性能,同时产生的H2O2能增大面包体积。POULSEN等[30]通过对比分别添加了GOD和HOX的面包发现,与同剂量GOD相比,HOX更有效地提高了面团强度和面包体积。并且HOX对葡萄糖的亲和性高于GOD对葡萄糖。ALMEIDA等[15]在面团中添加了3种酶——葡萄糖酯酶、半纤维素酶和HOX,烘焙后没有出现常见的面包塌陷、结皮脱落等现象,获得了令人满意的效果。
5.3 食品的降糖护色剂和保鲜剂
一些含有蛋白质和还原糖的食品,特别是烘焙食品,在常温或加热的条件下会发生美拉德反应,导致食品过度褐变、降低食物的营养价值。这一反应造成的影响可以通过添加HOX将还原糖氧化的方式来控制。SØE[35]的研究表明,在奶酪或淀粉中添加HOX,显著减少了烘焙后的食品的褐变面积,提高了食物品质,有效地预防或减轻了美拉德反应。
此外,HOX可去除食品中残留的O2,显著降低氧化作用,同时能抑制好氧菌生长,实现延长产品保鲜期和保质期的目的。所以,HOX可改进乳酪、黄油、果汁等食品的储存稳定性,可用于替代防腐剂。
5.4 作为新型抑菌剂等应用
近年来,伴随着饲料工业和酶制剂工业的快速发展,一种安全、无毒、无副作用的新型饲料添加剂——饲料酶制剂逐渐兴起。这种饲料酶制剂的使用能够强化饲料营养价值和质量稳定性、改善动物健康状况和畜产品品质,对缓解动物饲料资源紧张、保障食品安全及减轻环境污染等方面具有重要意义[3,42]。
将HOX加入到青贮饲料中,可通过己糖的氧化反应消耗饲料中的O2,建立抑制致病好氧微生物生长的厌氧环境[18]。HOX可作为抑菌剂添加至牙膏等牙齿保健品中,其原理与动物饲料添加剂相似。HOX还可作为分析试剂确定糖含量,或将其加入传感器中[18]。
6 总结
HOX是一种来源于藻类物种的氧化还原酶,具有安全、无毒、无副作用的优点。可作为一种新型的食品和饲料用酶,添加至面粉、乳制品及动物饲料中使用,起到杀菌、抗氧化的效果,对于改善食品风味、保证食品安全、促进动物健康等起到重要作用。HOX催化效率高、底物范围广,是一种潜力很大的生物催化剂。
目前已被发现的HOX来源菌种较少,天然物种中含量较低,且不适合大规模生产。应用基因工程技术已异源表达HOX,并通过菌株诱变在一定程度上提高了活性,但其表达水平仍较低,未见大规模发酵生产。随着HOX应用特性不断被开发,应进一步挖掘不同来源的HOX,并优化异源表达策略,提高食品级宿主的表达水平。此外,解析HOX的晶体结构,加强HOX催化特性的研究与改造,扩大酶的应用范围将会是未来的发展方向。
[1] 张义曼.食品酶制剂的生产及其应用[J].食品安全导刊,2017(3):70.
ZHANG Y M.Production and application of food enzyme preparation[J].China Food Safety Magazine,2017(3):70.
[2] COLLADOS A,CONVERSA V,FOMBELLIDA M,et al.Applying food enzymes in the kitchen[J].International Journal of Gastronomy and Food Science,2020,21:100 212.
[3] 陈坚,刘龙,堵国成.中国酶制剂产业的现状与未来展望[J].食品与生物技术学报,2012,31(1):1-7.
CHEN J,LIU L,DU G C.Current status and prospects of enzyme preparation industry in China[J].Journal of Food Science and Biotechnology,2012,31(1):1-7.
[4] 郭玉华,李钰金.食品用酶制剂及其在肉类工业中的应用[J].肉类研究,2011,25(6):41-46.
GUO Y H,LI Y J.A Review on food-grade enzyme preparations and their applications in meat industry[J].Meat Research,2011,25(6):41-46.
[5] 周海军,刘淑敏.酶制剂在焙烤食品中的应用[J].食品工程,2014(1):4-9.
ZHOU H J,LIU S M.Application of enzyme preparations in baking food[J].Food Engineering,2014(1):4-9.
[6] SINDHU R,BINOD P,BEEVI U S,et al.Applications of microbial enzymes in food industry[J].Food Technology and Biotechnology,2018,56(1):16-30.
[7] 王守伟,陈曦,曲超.食品生物制造的研究现状及展望[J].食品科学,2017,38(9):287-292.
WANG S W,CHEN X,QU C.Current status and future prospects of food biological manufacturing[J].Food Science,2017,38(9):287-292.
[8] 江正强,杨绍青.食品酶技术应用及展望[J].生物产业技术,2015(4):17-21.
JIANG Z Q,YANG S Q.Application and prospect of food enzyme technology[J].Biotechnology and Business,2015(4):17-21.
[9] 周贺.食品酶制剂复配研究用酶的制备[D].天津:天津科技大学,2014.
ZHOU H.The preparation of enzyme on the research of compounded enzyme for food industry[D].Tianjin:Tianjin University of Science and Technology,2014.
[10] KOUAME L P.Effects of wheat flour dough’s viscoelastic level by adding glucose oxidase on its dynamic shear properties whatever the strain modes[J].Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca Food Science and Technology,2014,71(1):32-37.
[11] 石义超.葡萄糖氧化酶基因在毕赤酵母中的高效表达研究[D].重庆:西南大学,2018.
SHI Y C.High-level expression of glucose oxidase in Pichia pastoris[D].Chongqing:Southwest University,2018.
[12] ASSAD F,SHAUKA A,NAHEED A,et al.Comparative performance evaluation of conventional bleaching and enzymatic bleaching with glucose oxidase on knitted cotton fabric[J].Journal of Cleaner Production,2013,42:167-171.
[13] 廖兆民,蔡俊,林建国.微生物葡萄糖氧化酶的研究进展[J].食品与发酵工业,2018,44(7):308-315.
LIAO Z M,CAI J,LIN J G.Research progress of microbial glucose oxidase[J].Food and Fermentation Industries,2018.44(7):308-315.
[14] VALENCIA P,ESPINOZA K,RAMIREZ C,et al.Technical feasibility of glucose oxidase as a prefermentation treatment for lowering the alcoholic degree of red wine[J].American Journal of Enology and Viticulture,2017,68(3):386-389.
[15] ALMEIDA E L,CHANG Y K.Effect of the addition of enzymes on the quality of frozen pre-baked French bread substituted with whole wheat flour[J].LWT-Food Science and Technology,2012,49(1):64-72.
[16] JOYE I J,LAGRAIN B,DELCOUR J A.Use of chemical redox agents and exogenous enzymes to modify the protein network during breadmaking—A review[J].Journal of Cereal Science,2009,50(1):11-21.
[17] MAIKWEKI N M.Evaluation of the effect of hexose oxidase on the bread baking properties of flour from three kenyan wheat varieties[J].International Journal of Science and Research,2014,3(1):15-19.
[18] STOUGAARD P,HANSEN O C.Recombinant hexose oxidase,a method of producing same and use of such enzyme:Denmark,US7727572B2[P].2010-06-01.
[19] IKAWA M,MA D S,MEEKER G B,et al.Use of Chlorella in mycotoxin and phycotoxin research[J].Journal of Agricultural and Food Chemistry,1969,17(3):425-429.
[20] BEAN R C,HASSID W Z.Carbohydrate oxidase from a red alga,Iridophycus flaccidum[J].Journal of Biological Chemistry,1956,218(1):425-436.
[21] BANKAR S B,BULE M V,SINGHAL R S,et al.Glucose oxidase—an overview[J].Biotechnology Advances,2009,27(4):489-501.
[22] OGASAWARA K,YAMADA K,HATSUGAI N,et al.Hexose oxidase-mediated hydrogen peroxide as a mechanism for the antibacterial activity in the red seaweed Ptilophora subcostata[J].PLOS One,2016,11(2).DOI:10.1371/journal.pone.0149084.
[23] SULLIVAN J D,IKAWA M.Purification and characterization of hexose oxidase from the red alga Chondrus crispus[J].Biochimica Et Biophysica Acta,1973,309(1):11-22.
[24] SAVARY B J,HICKS K B,O’CONNOR J V.Hexose oxidase from Chondrus crispus:improved purification using perfusion chromatography[J].Enzyme and Microbial Technology,2001,29(1):42-51.
[25] AFEYAN N B,FULTON S P,REGNIER F E.Perfusion chromatography:Recent developments and applications[M].New York:Springer,2001:221-231.
[26] BURGESS R R,DEUTSCHER M P.Guide to protein purification[M].2nd ed.Singapore:Elsevier Pte Ltd,2009.
[27] HANSEN O C,STOUGAARD P.Hexose oxidase from the red alga Chondrus crispus :purfication,molecular cloning and expression in Pichia pastoris[J].Journal of Biological Chemistry,1997,272(17):11 581-11 587.
[28] GROEN B W,DE VRIES S,DUINE J A.Characterization of hexose oxidase from the red seaweed Chondrus crispus[J].European Journal of Biochemistry,1997,244(3):858-861.
[29] KERSCHENSTEINER D A.The mechanism of action and the state of copper in hexose oxidase[D].New Hampshire:University of New Hampshire,1978.
[30] POULSEN C,HOSTRUP P B.Purification and characterization of a hexose oxidase with excellent strengthening effects in bread[J].Cereal Chemistry,1998,75(1):51-57.
[31] RAND T,QVIST K B,WALTER C P,et al.Characterization of the flavin association in hexose oxidase from Chondrus crispus[J].The FEBS Journal,2006,273(12):2 693-2 703.
[32] WOLFF A M,HANSEN O C,POULSEN U,et al.Optimization of the production of Chondrus crispus hexose oxidase in Pichia pastoris[J].Protein Expression and Purification,2001,22(2):189-199.
[33] SMITH J,OLEMPSKA-BEER Z.Hexose oxidase from Chondrus crispus expressed in Hansenula polymorpha[J].Chemical and Technical Assessment,2004.
[34] SØE J B,PETERSEN LARS W,SOEE JOERGEN B,et al.Method of reducing or preventing Maillard reactions in potato with hexose oxidase:United States,US6872412B2[P].2001-11-15.
[35] IKAWA M.Hexose oxidase from Chondrus crispus[J].Methods in Enzymology,1982,89:145-149.
[36] STOUGAARD P,HANSEN O C.Hexose oxidase-encoding DNAs and methods of use thereof:United States,US7745599B1[P].2010-06-29.
[37] RAND A G.Direct enzymatic conversion of lactose to acid:Glucose oxidase and hexose oxidase[J].Journal of Food Science,1972,37(5):698-701.
[38] YAMADA Y,PRESTON K R.Sponge-and-dough bread:Effects of oxidants on bread and oven rise properties of a Canadian red spring wheat patent flour[J].Cereal Chemistry,1994,71(3):297-300.
[39] TAO H,XIAO Y D,WU F F,et al.Optimization of additives and their combination to improve the quality of refrigerated dough[J].LWT-Food Science and Technology,2018,89:482-488.
[40] WANG X,PEI D D,TENG Y F,et al.Effects of enzymes to improve sensory quality of frozen dough bread and analysis on its mechanism[J].Journal of Food Science and Technology,2018,55(1):389-398.
[41] GÜL H,ÖZER M S,DIZLEK H.Improvement of the wheat and corn bran bread quality by using glucose oxidase and hexose oxidase[J].Journal of Food Quality,2009,32(2):209-223.
[42] 徐岩,穆晓清.食品及饲料添加剂的生物制造[J].生物产业技术,2016(5):32-37.
XU Y,MU X Q.Biological manufacturing of food and feed additives[J].Biotechnology and Business,2016(5):32-37.