α-L-鼠李糖苷酶(α-L-rhamnosidase,EC 3.2.1.40)是一类能从各种天然糖苷化合物中释放末端α-L-鼠李糖苷的糖苷水解酶[1]。在动物、植物和微生物中均有发现,具有广泛的底物特异性,能水解α-1、α-1,2、α-1,3、α-1,4和α-1,6连接的鼠李糖苷,少部分能水解2个鼠李糖苷连接的糖苷键[2]。α-L-鼠李糖苷酶一直被应用于各个领域[3]。如食品业中柑桔类果汁的去苦、饮料风味改善、药物中间体的生产及改性、增加酒的香气、生产鼠李糖和其他天然产物[3]。
糖基化在黄酮类化合物、萜类化合物、皂苷类化合物和酚酸等天然产物中是很普遍的自然现象,由于糖苷的种类、数量和连接位置的不同,许多天然糖苷化合物表现出不同的生物活性和溶解性,甚至在具有相同母核结构的化合物中也是如此[4-5]。天然产物的糖基化会影响其在食品和医药行业上的应用,例如橙皮苷和新橙皮苷具有相同的母核结构,两者的区别在于鼠李糖基和葡萄糖基的连接方式不一样,橙皮苷属于α-1,6连接,新橙皮苷属于α-1,2连接,由于鼠李糖基的连接方式不一样导致两者的溶解性存在较大差异,新橙皮苷在水中的溶解性远远大于橙皮苷,两者在鼠李糖苷酶的水解下生成橙皮素单葡萄糖苷,更易被小肠吸收,从而提高黄酮类化合物在人体的生物利用率[6]。生物酶法水解对含鼠李糖苷的天然化合物具有高效、专一、温和等特点,对天然化合物的生物转化具有巨大的应用潜力和开发前景。
目前,商业化来源的α-L-鼠李糖苷酶制剂一般来源于黑曲霉和青霉菌,原始菌株来源发酵得到的α-L-鼠李糖苷酶不易纯化,且含有葡萄糖苷酶、半乳糖糖苷酶等其他水解酶,在应用生产中容易产生副产物,不利于产物的纯化和生产。利用基因工程手段,将α-L-鼠李糖苷酶基因进行克隆得到基因重组菌,将其进行表达,分离纯化得到α-L-鼠李糖苷酶,能有效地将α-L-鼠李糖苷酶应用于生物转化生产中。本研究将来源于Aspergillus nidulans菌株的α-L-鼠李糖苷酶AnRhaE在毕赤酵母细胞中进行表达,得到纯度高,专一性好的鼠李糖苷酶AnRhaE,能有效地应用于工业生产中。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
克隆宿主大肠杆菌Top10、毕赤酵母KM71H和毕赤酵母GS115、表达载体pPIC9K均购买自Invitrogen公司,pPIC9K-AnRhaE为本研究构建保存。所用培养基为LB培养基、YPD培养基、BMGY培养基和BMMY培养基。
1.1.2 主要实验材料
限制性内切酶Sal Ⅰ、Not Ⅰ、EcoR Ⅰ、Lysis buffer、DNA Markers,宝日医生物技术有限公司;质粒提取试剂盒、凝胶回收试剂盒、2×PCR Master Mix、引物和其余实验用到试剂均为国产分析,生工生物工程(上海)股份有限公司。
1.1.3 主要仪器和设备
HCB-1300V型超净工作台,海尔;BIO-RAD MicroPulser 型电转仪、Biorad T-100型PCR仪,BIO-RAD公司;Agilent 1100型高效液相色谱仪,Agilent Technologies Inc.;ZQLY-300S型恒温摇床,上海知楚仪器有限公司;BPC-70型生化培养箱,上海一恒科学仪器有限公司;SZB-20型制冰机,上海析达仪器有限公司;LDZM-80KCS型灭菌锅,上海申安医疗器械厂;H1850R型高速冷冻离心机,湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 序列分析
由CAZy(http://www.cazy.org)数据库[7],获知8个已鉴定的3D结构的α-L-鼠李糖苷酶及其PDB和GenBank序列号。经GenBank序列号在NCBI(https://www.ncbi.nlm.nih.gov)中获知其氨基酸序列,利用Clustalx软件进行氨基酸多重序列比对,最后利用MEGA7软件基于Neighbor-joining制作鼠李糖苷酶分子进化树[8]。
1.2.2 基因克隆
根据AnRhaE在NCBI数据库中公布的GenBank序列信息,利用密码子偏好性在线分析网站对AnRhaE在毕赤酵母细胞中密码子的偏好性进行分析,对其DNA序列进行密码子优化,依据优化结果交由通用生物系统(安徽)有限公司进行合成AnRhaE基因,分别将合成的AnRhaE基因无缝克隆至pPIC9K载体上,转化至Top10大肠杆菌,经卡那霉素筛选候选克隆子,使用质粒提取试剂盒抽提质粒pPIC9K-AnRhaE。
以质粒pPIC9K-AnRhaE为模板,通用引物5′AOX-GACTGGTTCCAATTGACAAGC和3′AOX-GCAAATGGCATTCTGACATCC,反应条件是94 ℃下预变性1 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸3 min,30个循环;72 ℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳检测鉴定,将PCR鉴定正确的质粒送去生工生物(上海)有限公司测序,将测序正确的命名为Top10-pPIC9K-AnRhaE。
1.2.3 重组毕赤酵母的构建和异源表达
将测序正确的Top10-pPIC9K-AnRhaE菌在LB培养基中培养,利用质粒提取试剂盒提取质粒pPIC9K-AnRhaE,利用限制性内切酶Sal Ⅰ线性化pPIC9K-AnRhaE,经回收试剂盒回收后于-20 ℃保存备用。参照毕赤酵母表达操作手册制备毕赤酵母GS115感受态细胞和毕赤酵母KM71H感受态细胞,-80 ℃保存备用。将线性化的pPIC9K-AnRhaE质粒载体按照毕赤酵母表达操作手册的电转化方法分别转化进毕赤酵母GS115和毕赤酵母KM71H中。在含1 g/L G418的YPD培养基中培养2 d后,挑选单菌落使用Lysis Buffer裂解后进行PCR鉴定,分别以引物AnF-ATGTCGCTGTCAATTTCTGG和AnR-TCAACCGAGCGTACTCTCAAA进行PCR鉴定,反应条件是94 ℃下预变性10 min;98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸3 min,30个循环;72 ℃延伸7 min。将鉴定正确的阳性克隆命名为GS115-pPIC9K-AnRhaE和KM71H-pPIC9K-AnRhaE。
分别接种GS115-pPIC9K-AnRhaE和KM71H-pPIC9K-AnRhaE到YPD液体培养基30 ℃活化培养20 h,按照体积分数为1%的接种量接种于装有50 mL BMGY培养基中,30 ℃ 200 r/min培养OD600到2~6。室温条件下3 000×g离心5 min,收集菌体,用50 mL BMMY(pH 6.0)重悬菌体,28 ℃ 200 r/min诱导表达,每24 h向培养基中添加终体积分数为0.5%的甲醇,维持诱导条件。诱导表达5 d,4 ℃ 12 000×g离心收集菌体,上清液即为粗酶液。取样品进行SDS-PAGE,检测AnRhaE在毕赤酵母中的异源表达情况。
1.2.4 发酵罐的高密度培养
挑取GS115-pPIC9K-AnRhaE单菌落于YPD培养基中,30 ℃ 200 r/min培养24 h。将种子液按体积分数为1%的接种量接种至发酵培养基(40 g/L甘油,基础盐类,PTM盐类)中30 ℃培养,通气量4.4 L/min,初始转速800 r/min,用氨水调节培养基的pH为5左右[9]。当发酵20~30 h,甘油耗尽,溶氧值(dissolved oxygen,DO)下降为0后又回升时,设定DO值为30%,并设置补甘油与溶氧联动,当DO值大于30%时,进行补加甘油。甘油补料培养至湿菌体质量浓度达到200~300 g/L时停止,待甘油消耗完后饥饿0.5~1 h,DO上升后,设置补甲醇与溶氧联动,当DO值大于30%,进行补加含12 mL/L PTM的甲醇,调整转速为900 r/min,温度为28 ℃进行诱导培养,诱导至最佳时间后,停止发酵,离心收集AnRhaE酶液。
1.2.5 活性和底物分析
为检测AnRhaE在不同温度(30~75 ℃)和pH(3~10)下的活性。以柚苷为底物,分别加入反应缓冲液(pH 3~10),混匀;再加入AnRhaE酶液到混合后的溶液中,不同温度(30~75 ℃)下进行反应;反应结束后灭酶;结果用HPLC检测。
为检测AnRhaE对自然底物特异性,以柚苷二氢查耳酮、柚苷、芦丁、新橙皮苷、橙皮苷、朝藿定C、淫羊藿苷为底物,分别加入pH 5磷酸氢二钠-柠檬酸缓冲液,混匀;再加入AnRhaE酶液到混合后的溶液中,55 ℃恒温反应;反应结束后灭酶;结果用HPLC检测(空白对照为缓冲液加底物)。
2 结果与分析
2.1 序列分析
检索CAZy数据库,AnRhaE属于GH78家族,具有861个氨基酸残基,预测理论分子质量为95.2 kDa,等电点pI值为4.76,具有11个糖基化位点,经SignalP 4.1预测无信号肽序列[10],包含4个超家族保守结构域。
AnRhaE(CCB96437.1)与6个GH78家族的α-L-鼠李糖苷酶的序列比对结果如下:与来源于Aspergillus terreus CCF 3059的AtRha(AFH54529.1)[11]序列相似性为69.16%;与来源于Streptomyces avermitilis MA-4680=NBRC 14893的SaRha78A(BAC68538.1)[12]序列相似为39.3%;与来源于Dictyoglomus thermophilum的DtRha(ACI19983.1)[13]序列相似性为31.24%;与来源于Bacillus sp.GL1的RhaB(BAB62315.1)[14]序列相似性为29.45%;与来源于Bacteroides thetaiotaomicron VPI-5482的BtRh78a(AAO76108.1)[15]序列相似性为23.94%;与来源于Klebsiella oxytoca KCTC 1686的KoRha(AEX05711.1)[16]序列相似性为18.22%。AnRhaE与2个GH106家族的α-L-鼠李糖苷酶的序列比对结果如下:与来源于Bacteroides thetaiotaomicron VPI-5482的BtRh106a(AAO76093.1)[17]序列相似性为23.02%;与来源于Novosphingobium sp. PP1Y的RhaP(CCA90848.1)[18]序列相似性为20.00%。根据序列比对结果,AnRhaE与AtRha相似高,可以进行同源建模,进而预测AnRhaE的3D结构和相关生物学功能。
与上述的6个GH78家族已知3D结构的α-L-鼠李糖苷酶进行多重序列比对,结果显示Trp111、Phe396、Arg397、Asp458、Trp468、Gly470、Asp471、Leu493、Asp577、Trp580、Leu703、Trp736、Glu737、Ser755、His758和Gly807的氨基酸残基高度保守。经过与AtRha(PDB:6 gsz)的3D结构比较分析[19],推测Trp215、Ser216和Asn370与底物结合口袋相关,Asp458、Arg462、Glu465、Asp471、Trp524、Tyr579、Trp578、Phe693、Met753和His758与底物结合方面起到重要作用,Glu464和Glu737在生物催化活性上发挥重要作用。AnRhaE与6个GH78家族和2个GH106家族已知3D结构的α-L-鼠李糖苷酶多重序列比对后构建系统发育进化树(图1),结果表明AnRhaE属于GH78家族,且与AtRha进化关系相近,属于一个进化分支,两者生物活性和结构比较接近。
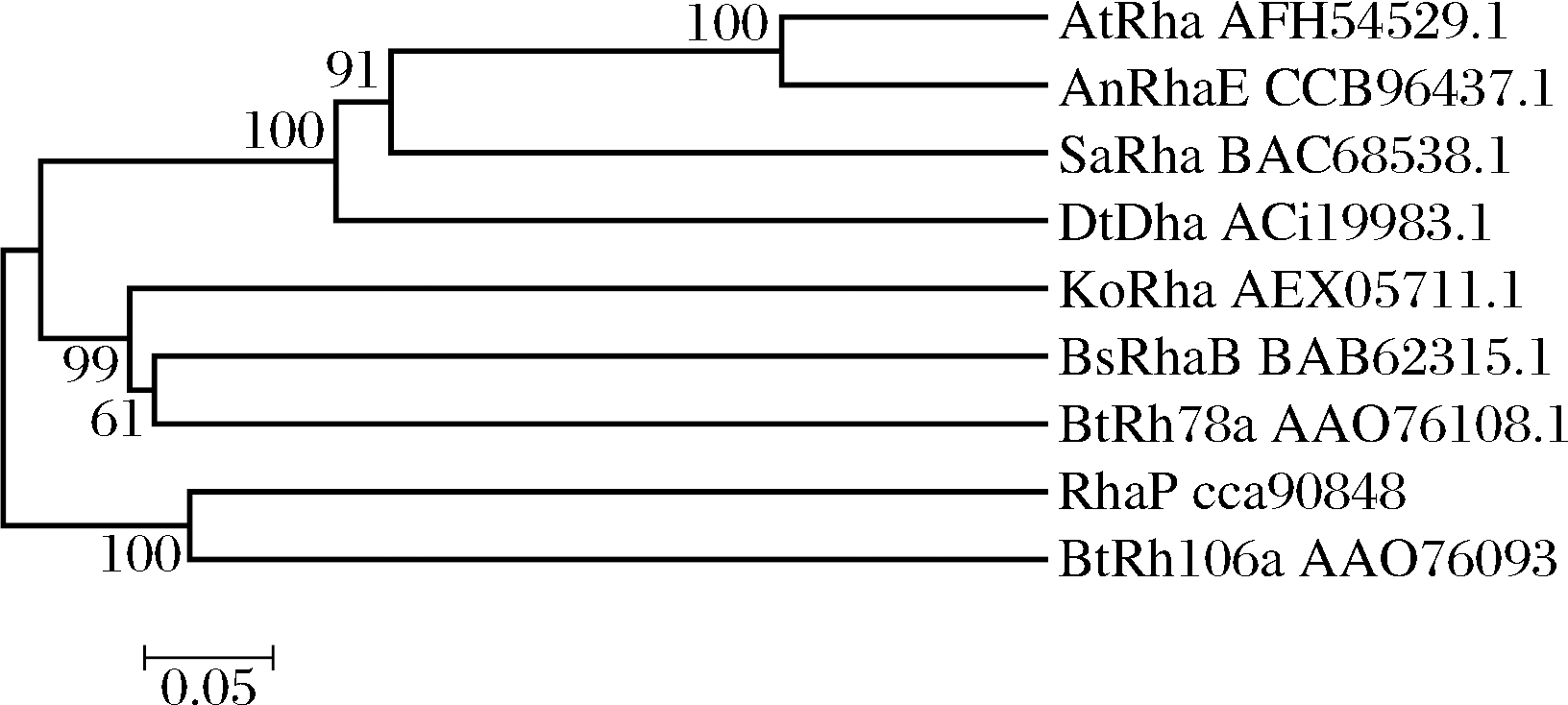
图1 AnRhaE系统发育进化树
Fig.1 Neighbour-Joining tree showing the phylogenetic relationships of AnRhaE
2.2 基因克隆
将合成的AnRhaE基因利用无缝克隆技术连入pPIC9K载体中,将连接后的重组质粒转化进大肠杆菌Top10中。图2-a是挑选阳性克隆培养后使用AOX引物进行菌液PCR鉴定的结果,可以得到约2 800 bp大小的片段。选取鉴定正确的阳性单克隆送去生工生物工程(上海)股份有限公司测序,比对后确认是正确克隆。对构建成功的重组菌命名为Top10-pPIC9K-AnRhaE,保留菌种,以备后续实验使用。培养Top10-pPIC9K-AnRhaE,提取质粒,如图2-b。

a-M-DNA Makers;1~6-阳性克隆PCR;b-M-DNA Makers;1-pPIC9K-AnRhaE质粒
图2 pPIC9K-AnRhaE克隆鉴定及质粒提取
Fig.2 PCR identification of clones and plasmid of pPIC9K-AnRhaE
2.3 重组表达毕赤酵母菌构建及表达
将质粒pPIC9K-AnRhaE经Sal I线性化后,电转化至毕赤酵母GS115和KM71H中。经含G418抗生素的YPD平板生长2~3 d后,挑选单菌落用裂解液进行裂解后,分别以AnF和AnR为引物进行菌落PCR鉴定,得到的阳性重组表达菌株分别命名为GS115-pPIC9K-AnRhaE和KM71H-pPIC9K-AnRhaE。
图3为重组毕赤酵母菌液PCR鉴定结果。图3-a结果显示GS115-pPIC9K-AnRhaE阳性菌株在在2 600 bp左右出现目的基因条带,结果表明AnRhaE基因实现与毕赤酵母GS115基因组成功整合。图3-b结果显示KM71H-pPIC9K-AnRhaE阳性菌株在2 600 bp左右出现目的基因条带,结果表明AnRhaE基因实现与毕赤酵母KM71H基因组成功整合。

a-GS115-pPIC9K-AnRhaE PCR鉴定(M-DNA Makers;1~6-重组克隆子);b-KM71H-pPIC9K-AnRhaE PCR鉴定(M-DNA Makers;
1~4-重组克隆子PCR)
图3 pPIC9K-AnRhaE重组毕赤酵母鉴定
Fig.3 PCR identification of recombinant Pichia pastoris
将重组表达菌株GS115-pPIC9K-AnRhaE和KM71H-pPIC9K-AnRhaE进行培养,再经甲醇诱导表达后,分离得到酶液。取样品进行SDS-PAGE,检测AnRhaE在毕赤酵母中的异源表达情况,结果如图4所示。
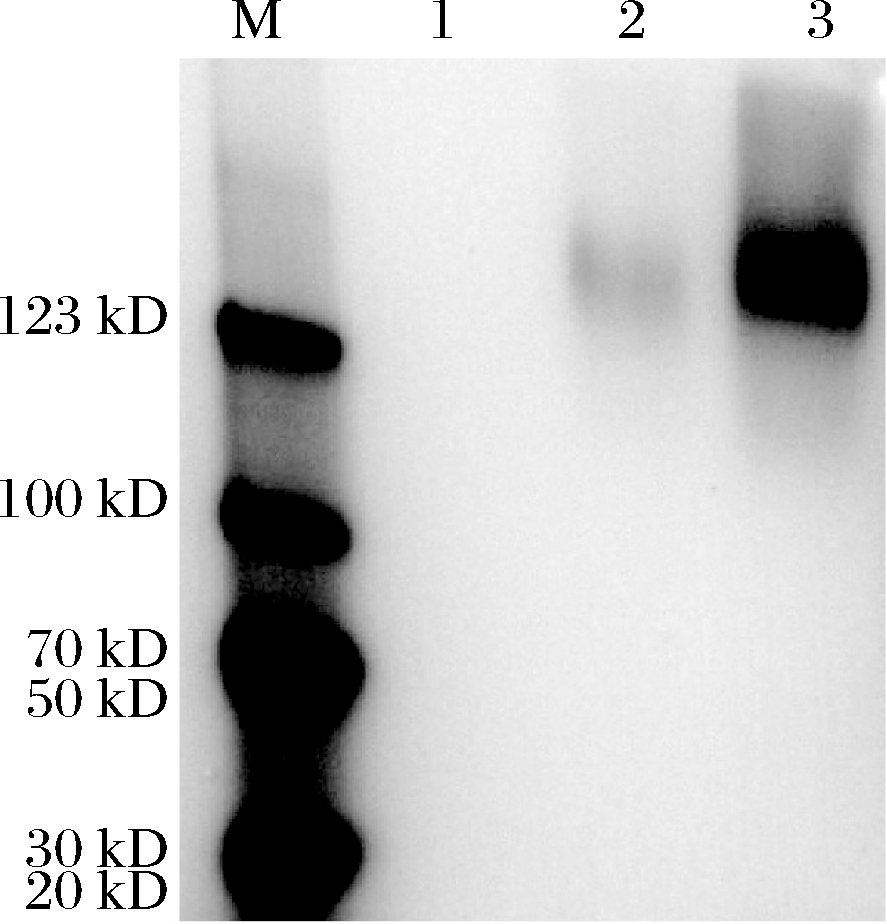
M-Mark;1-毕赤酵母空白对照;2-KM71H-pPIC9K-AnRhaE表达酶液;
3-GS115-pPIC9K-AnRhaE表达酶液
图4 重组毕赤酵母表达α-L-鼠李糖苷酶AnRhaE电泳图
Fig.4 SDS-PAGE for the expression of recombinant AnRhaE
由图4可知,重组毕赤酵母菌KM71H和GS115在130 kDa上有明显的条带,AnRhaE的理论分子质量为95.2 kDa,实际分子质量远远大于理论值,推测是由于AnRhaE具有较多糖基化位点,在毕赤酵母细胞中进行糖基化的缘故。重组毕赤酵母表达AnRhaE的条带单一,表达较好,其中GS115宿主菌表达量要高于KM71H,因此后续表达AnRhaE酶采用重组表达菌株GS115-pPIC9K-AnRhaE。
2.4 发酵罐的高密度培养
由图5可知,重组GS115-pPIC9K-AnRhaE毕赤酵母的高密度培养分为3个阶段:发酵前期(Ⅰ)、甘油补料培养(Ⅱ)和甲醇补料诱导培养(Ⅲ)。发酵前期在培养25 h后甘油耗尽,DO值下降为0后又回升至62%,湿菌体质量为114.5 g/L。进入甘油补料培养阶段继续增加生物量,甘油补料17 h后湿菌体质量浓度为279.5 g/L,停止甘油补料,饥饿处理0.5 h。进入甲醇补料后,重组菌开始诱导表达AnRhaE,甲醇补料103 h后重组菌发酵趋于稳定,湿菌体质量浓度为359.5 g/L。发酵罐高密度培养相对于摇瓶培养,菌体密度更大,所生产的AnRhaE也更多,与摇瓶相比提升了约50倍。
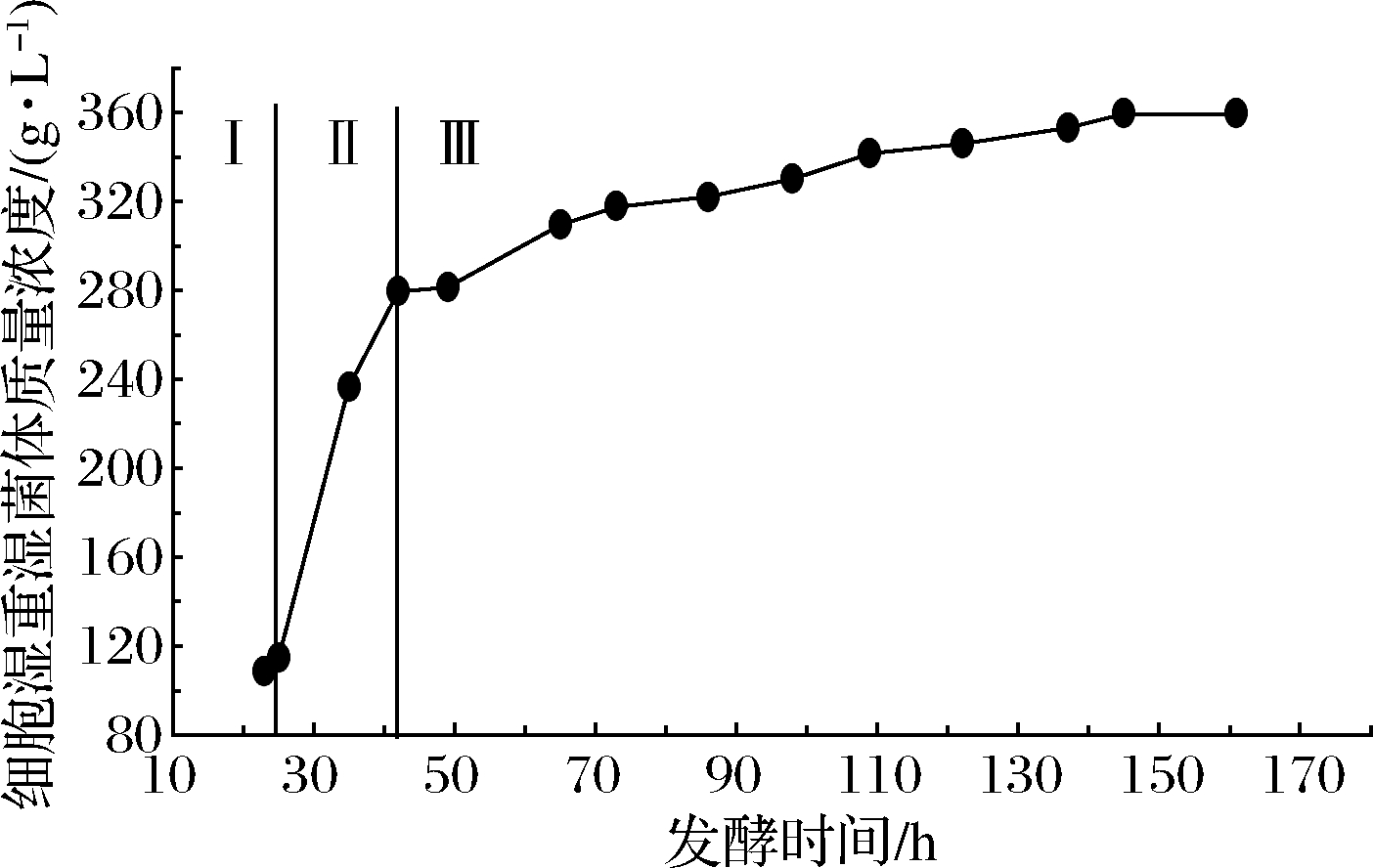
图5 重组毕赤酵母表达AnRhaE发酵曲线
Fig.5 Fermentation curve of recombinant P.pastoris expression of AnRhaE
2.5 活性分析
为检测AnRhaE在不同温度(30~75 ℃)和pH(3~10)下的活性,以柚苷为底物进行反应,反应后的溶液用HPLC检测。结果表明,温度为45~55 ℃时酶活力高,60 ℃时酶活力降低了一半,65 ℃下酶活力急剧下降,75 ℃基本无酶活力(图6-a)。pH 4.5~pH 8时的酶活性稳定,活性较高,pH 3时几乎无活性,pH 4时具有90%左右的活性,pH 9和pH 10时酶活降到一半以下,AnRhaE的最适pH为5(图6-b)。AnRhaE酶对pH的耐受范围较广,在弱酸性和弱碱性仍具有较高活性,可以较好的应用于工业生产中。
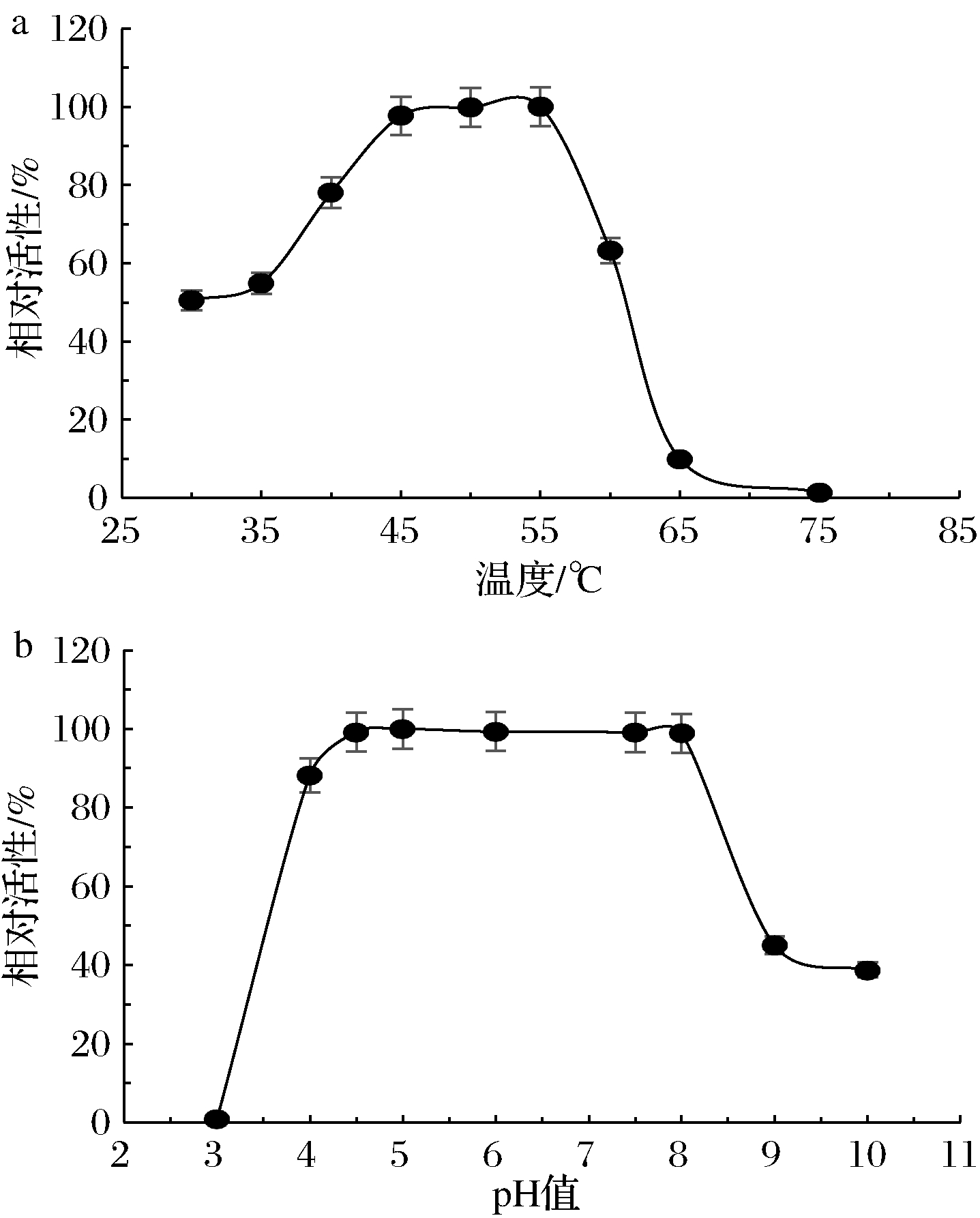
图6 温度和pH值对AnRhaE的影响
Fig.6 Effect of temperature and pH on AnRhaE
2.6 底物特异性分析
以柚苷二氢查耳酮、柚苷、芦丁、新橙皮苷、橙皮苷、朝藿定C、淫羊藿苷为底物,反应产物用HPLC进行检测,其结果如图7所示。结果显示,AnRhaE能将柚苷二氢查耳酮水解为三叶苷,将柚苷水解为普鲁宁,将芦丁水解为异槲皮素,将新橙皮苷水解为橙皮素单葡萄糖苷,将橙皮苷水解为橙皮素单葡萄糖苷,朝藿定C水解为淫羊藿苷,但是不能进一步水解淫羊藿苷。上述底物中属于α-1,2糖苷键连接的底物有柚苷二氢查耳酮、柚苷和新橙皮苷,属于α-1,6糖苷键连接的底物有芦丁和橙皮苷,而朝藿定C属于2个鼠李糖苷的连接,淫羊藿苷属于α-1糖苷键。根据这些结果,AnRhaE水解α-1,2、α-1,6和2个鼠李糖苷连接的底物,具有广泛的底物,在工业生产中具有较好的应用价值和前景。

图7 AnRhaE底物检测
Fig.7 Activities for different substrates
根据反应速度、底物与酶比和生成产物的量,AnRhaE对α-1,2糖苷键连接的底物具有较高的活性,而对α-1,6糖苷键连接的底物活性较差,特别是橙皮苷,只能水解部分生成橙皮素单葡萄糖苷,对朝藿定C的活性较好,能将朝藿定C完全水解生成淫羊藿苷。
3 讨论与结论
本研究以A.nidulans的α-L-鼠李糖苷酶AnRhaE为目标,对其氨基酸序列进行分析发现其具有861个氨基酸残基,有糖基化位点,无信号肽序列,有4个保守超家族结构域。序列比对发现AnRhaE与来源于A.terreus CCF 3059的AtRha相似性较高达到69.19%,序列比对结果显示有16个氨基酸残基高度保守,3D建模显示Trp215、Ser216和Asn370与底物结合口袋相关,Glu464和Glu737在生物催化活性上发挥重要作用。
通过密码子优化、分子克隆技术和电转化技术将AnRhaE重组于毕赤酵母GS115和KM71H中,成功构建重组表达菌株GS115-pPIC9K-AnRhaE和KM71H-pPIC9K-AnRhaE,经甲醇诱导发酵后分别得到AnRhaE酶,SDS-PAGE电泳显示AnRhaE在GS115的表达量高于KM71H,GS115更有利于生产AnRhaE酶。将GS115-pPIC9K-AnRhaE在5 L发酵罐中进行高密度发酵培养,最终湿菌体质量浓度达到359.5 g/L,AnRhaE酶与摇瓶相比增加了约50倍。AnRhaE酶在温度为45~55 ℃时酶活力高,最适温度为55 ℃;pH 4.5~pH 8时酶活性稳定,最适pH为5;AnRhaE酶对pH的耐受范围较广,在弱酸性和弱碱性仍具有较高活性,可以较好地应用于工业生产中。AnRhaE水解α-1,2、α-1,6和2个鼠李糖苷连接的底物,具有广泛的底物,包括柚苷二氢查耳酮、柚苷、芦丁、新橙皮苷、橙皮苷和朝藿定C等天然产物,但是AnRhaE对α-1,2糖苷键连接的底物具有较高的活性,而对α-1,6糖苷键连接的底物活性较差,对朝藿定C的活性较好,能将朝藿定C完全水解生成淫羊藿苷,因此AnRhaE酶在天然产物之间的转化具有较好的应用价值和前景。
[1] HUANG G L,LV M J,HU J C,et al.Glycosylation and activities of natural products[J].Mini Reviews in Medicinal Chemistry,2016,16(12):1 013-1 016.
[2] YADAV V,YADAV P K,YADAV S,et al.α-L-Rhamnosidase:A review[J].Process Biochemistry,2010,45(8):1 226-1 235.
[3] 王艳君, 刘同军,曹涛,等.α-L-鼠李糖苷酶的研究进展[J].中国酿造,2010(10):11-15
WANG Y J,LIU T J,CAO T,et al.Research progress of α-L-rhamnosidase[J].China Brewing,2010(10):11-15.
[4] WANG M Y,LI H,XU F X,et al.Diterpenoid lead stevioside and its hydrolysis products steviol and isosteviol:Biological activity and structural modification[J].European Journal of Medicinal Chemistry,2018,156:885-906.
[5] SZEJA W,GRYNKIEWICZ G,RUSIN A.Isoflavones,their glycosides and glycoconjugates.Synthesis and biological activity[J].Current Organic Chemistry,2017,21(3):218-235.
[6] KITTI N,PLUMB G W,BERRIN J G,et al.Deglycosylation by small intestinal epithelial cell β-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans[J].European Journal of Nutrition,2003,42(1):29-42.
[7] LOMBARD V,GOLACONDA R H,DRULA E,et al.The carbohydrate-active enzymes database (CAZy) in 2013[J].Nucleic Acids Research.2014,42:490-495.
[8] SUDHIR K,GLEN S,KOICHIRO T.MEGA7:Molecular evolutionary genetics analysis Version 7.0 for bigger datasets[J].Molecular Biology and Evolution,2016,33(7):1 870-1 874.
[9] DANIELA G,BARBORA F,PETR H,et al.Recombinant α-L-rhamnosidase from Aspergillus terreus in selective trimming of rutin[J].Process Biochemistry,2012,47(5):828-835.
[10] NIELSEN H.Predicting secretory proteins with Signal P[J].Methods in Molecular Biology,2017,1 611:59-73.
[11] LENKA W,PETR M,DANIELA G,et al.Preparatory production of quercetin-3-β-D-glucopyranoside using alkali-tolerant thermostable α-L-rhamnosidase from Aspergillus terreus[J].Bioresource Technology,2011,115:222-227.
[12] FUJIMOTO Z,JACKSON A,MICHIKAWA M,et al.The structure of a Streptomyces avermitilis α-L-rhamnosidase reveals a novel carbohydrate-binding module CBM67 within the six-domain arrangement[J].Journal of Biological Chemistry,2013,288(17):12 376-12 385.
[13] GUILLOTIN L,KIM H,TRAORE Y,et al.Biochemical characterization of the α-L-Rhamnosidase DtRha from Dictyoglomus thermophilum:Application to the selective derhamnosylation of natural flavonoids[J].Acs Omega,2019,4(1):1 916-1 922.
[14] CUI Z,MARUYAMA Y,MIKAMI B,et al.Crystallization and preliminary crystallographic analysis of the family GH78 α-L-rhamnosidase RhaB from Bacillus sp.GL1[J].Acta Crystallographica,2006,62(7):646-648.
[15] LI B,JI Y,LI Y,et al.Characterization of a glycoside hydrolase family 78 α-L-rhamnosidase from Bacteroides thetaiotaomicron VPI-5482 and identification of functional residues[J].Biotech,2018,8(2):120.
[16] ELLIS C O’N,CLARE E M S,MICHAEL J P,et al.Crystal structure of a novel two domain GH78 family α-rhamnosidase from Klebsiella oxytoca with rhamnose bound[J].Proteins,2015;83(9):1 742-1 749.
[17] NDEH D,ROGOWSKI A,CARTMELL A,et al.Complex pectin metabolism by gut bacteria reveals novel catalytic functions[J].Nature,2017,544(7 648):65-70
[18] TERRY B,DRIZA D V,IZZO V,et al.Crystal structures and directed evolution of the α-L-rhamnosidase RHA-P from Novosphingobium sp.PP1Y[J].The FASEB Journal,2020,34(S1):1.
[19] PACHL ![]() D,et al.Crystal structure of native α-L-rhamnosidase from Aspergillus terreus[J].Acta Crystallographica Section D Structural Biology,2018,74(11):1 078-1 084.
D,et al.Crystal structure of native α-L-rhamnosidase from Aspergillus terreus[J].Acta Crystallographica Section D Structural Biology,2018,74(11):1 078-1 084.
[20] 章如安, 杨晟,邱荣德,等.巴斯德毕赤酵母表达体系研究及进展[J].微生物学通报,2000,27(5):371-373.
ZHANG R A,YANG S,QIU R D,et al.Research and progress on the expression system of Pichia pastoris[J].Microbiology China,2000,27(5):371-373.