白藜芦醇是一种非黄酮类多酚化合物,具有抑制肿瘤、抗癌等多种生理活性[1-4]。采用溶剂法直接从植物中提取分离白藜芦醇,是目前天然白藜芦醇最主要的生产方法[5-6]。中药虎杖中白藜芦醇含量较低,但虎杖苷含量较高,质量分数可达2.55%,因而利用微生物或酶法转化虎杖苷是制备白藜芦醇的可行途径之一[7-8]。β-葡萄糖苷酶属于纤维素酶类,能水解结合于末端非还原性的β-D-葡萄糖键,同时释放出β-D-葡萄糖和相应的配基[9-10],在食品、医药和化妆品等领域中有重要的应用价值[11-12]。目前,国内外研究所用的β-葡萄糖苷酶主要来源于微生物[13-14],利用微生物制备的酶液可用于虎杖苷转化成白藜芦醇[15]。冯薇等[16]通过栀子苷平板初筛、虎杖苷摇瓶复筛,筛选得到1株能够分泌β-葡萄糖苷酶转化虎杖苷生成白藜芦醇的菌株沙福芽孢杆菌Bacillus safensis CGMCC13129,对底物虎杖苷的转化率可达90%以上;ZHOU等[17]从黑曲霉Aspergillus niger SK34.002中分离纯化了水解虎杖苷生成白藜芦醇的β-葡萄糖苷酶,并考察了其酶学性质;XUE等[18]对海栖热袍菌Thermotoga maritima中热稳定的β-葡萄糖苷酶水解虎杖苷生成白藜芦醇的性质进行了研究。
本课题组前期从虎杖中分离获得1株内生真菌Aspergillus aculeatus HZ001,其胞内提取物可水解虎杖苷生成白藜芦醇,本文探讨了该菌株产β-葡萄糖苷酶基本酶学性质,为后期该酶的分离纯化及应用奠定基础。
1 材料与方法
1.1 材料与试剂
虎杖内生真菌Aspergillus aculeatus HZ001,分离自虎杖根。
马铃薯葡萄糖(potato dextrose agar,PDA)培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL。
发酵培养基:NaNO3 2.0 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4 0.01 g,蔗糖30 g,蒸馏水1 000 mL。
1.2 主要试剂
水杨苷,上海阿拉丁生化科技股份有限公司;巯基乙醇,上海贤鼎生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、葡萄糖、琼脂、Na2HPO4、KH2PO4、MgSO4,汕头市西陇化工有限公司。所用试剂均为分析纯或生化试剂,所用水均为二次蒸馏水。
1.3 主要仪器
振荡培养箱(LRH-150-Z),珠江韶关市泰宏医疗器械有限公司;立式压力蒸汽灭菌器(BXM-30R),上海博讯实业有限公司医疗设备厂;超净工作台(CJ-1SFS),天津市泰斯特仪器有限公司;冷冻离心机(DL-5-B),德国sigma;数显恒温水浴锅(HH-S2),金坛市医疗仪器厂;可见分光光度计(VIS-722ON),北京瑞利分析仪器有限公司。
1.4 实验方法
1.4.1 孢子悬液的制备
将试管斜面保存的菌株HZ001经PDA培养基平板活化后,接种到平板产孢培养基,于30 ℃恒温培养箱中培养4 d,待孢子形成后,用无菌水制成106~107 CFU/mL的孢子悬液。
1.4.2 摇瓶培养
取5 mL孢子悬浮液接种到灭菌冷却后的100 mL液体发酵培养基中,在30 ℃,150 r/min的条件下振荡培养4 d。
1.4.3 粗酶液的制备
培养完毕,将发酵液抽滤、水洗后,收集湿菌体加入液氮冷冻研磨后,加入4倍体积的0.02 mol/L的磷酸盐缓冲液(pH6.5),用玻璃匀浆器研磨成匀浆[18],4 ℃,10 000 r/min冷冻离心10 min,收集上清液采用质量浓度为662 g/L的(NH4)2SO4溶液盐析后,4 ℃,10 000 r/min 离心10 min,收集沉淀,用蒸馏水复溶,充分溶解后4 ℃,10 000 r/mnin 离心10 min,取上清液,透析除盐后,定容得粗酶液。
1.4.4 β-葡萄糖苷酶酶学性质的研究
1.4.4.1 最适催化温度和热稳定性的测定
以质量浓度为5.0 g/L水杨苷(溶于pH 4.8的醋酸缓冲液)为底物,分别于40、45、50、55、60、65和70 ℃反应1 h后测定酶活力。
稳定性的测定:取适量体积的粗酶液置于40、45、50、55、60、65和70 ℃水浴中保温10 h,每隔2 h取样,以未处理酶液的酶活力为100%,测定相对酶活力。
1.4.4.2 最适pH 值及pH稳定性
分别配制pH为3.2、3.6、4.0、4.4、4.8、5.2、5.6和6.0的醋酸-醋酸钠缓冲液,在最适催化温度下测定不同pH的酶活力,考察不同pH对β-葡萄糖苷酶催化反应的影响。
稳定性的测定:将粗酶液用醋酸-醋酸钠缓冲液调节pH值后,在最适催化温度下保存不同时间,以未处理酶液的酶活力为100%,测定相对酶活力。
1.4.4.3 不同金属离子对β-葡萄糖苷酶活力的影响
取适量粗酶液分别加入CaCl2、MgSO4、FeSO4和CoSO4溶液,使金属离子终浓度为 1.0 mmol /L,在最适温度和最适pH条件下,以不加金属离子的酶活力为100%,测定相对酶活力。
1.4.4.4 其他抑制剂对β-葡萄糖苷酶酶活力的影响
分别在酶反应液中加入巯基乙醇、SDS、DMSO和EDTA等常见酶抑制剂,使各抑制剂的最终浓度均为1.0 mmol/L,在最适温度和最适pH条件下,以不加抑制剂的酶活力为100%,测定相对酶活力,考察不同抑制剂对β-葡萄糖苷酶活性的影响。
1.4.4.5 酶催化动力学模型的建立
在最适催化条件下,采用不同浓度的底物溶液进行酶催化反应,测定反应初速度V,绘制V-[S]曲线,构建动力学模型,计算最大反应速率Vmax和米氏常数。
1.4.5 蛋白质含量和β-葡萄糖苷酶酶活力的测定
蛋白质含量采用考马斯亮蓝G-250法[19],β-葡萄糖苷酶酶活力的测定参照韩萍萍等[20]的方法。β-葡萄糖苷酶酶活为单位定义为:在最适温度和最适pH条件下,1 min分解底物水杨苷生成1 μmol葡萄糖所需的酶蛋白量(mg)为1个酶活力单位(U)。酶活力单位以U/mg表示。
2 结果与分析
2.1 最适反应温度和热稳定性
不同温度下虎杖内生真菌HZ001所产葡萄糖糖苷酶酶活力变化如图1所示。在温度低于60 ℃时,酶活力随着温度的升高而上升;反应温度为60 ℃时,酶活力达最大值,为134.3 U/mg;随着温度的继续升高,酶活力下降,在反应温度为70 ℃时,该酶丧失大部分活性。
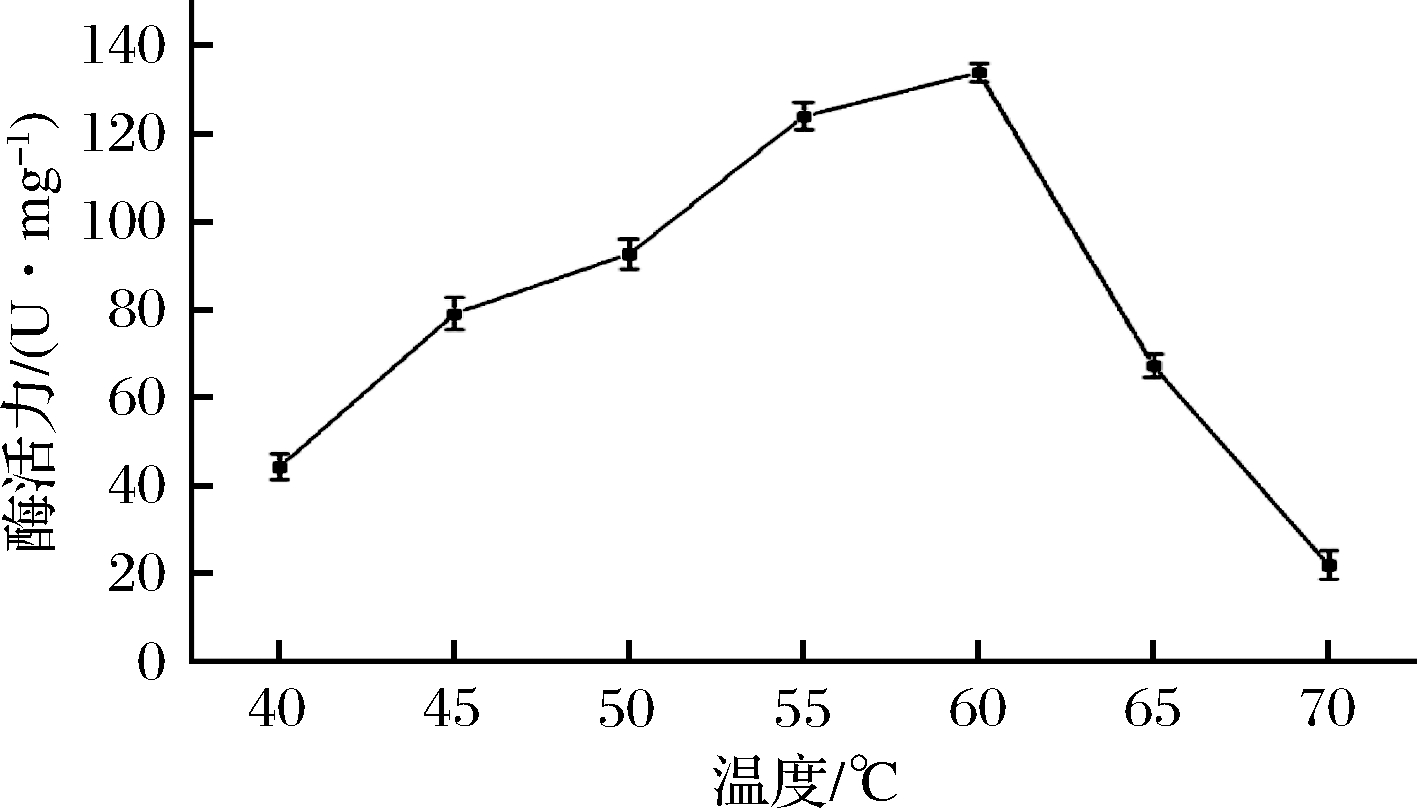
图1 温度对虎杖内生真菌A.aculeatus HZ001 β-葡萄糖苷酶活性的影响
Fig.1 Effect of temperature on the activity of β-glucosidase produced by the endophytic fungi A.aculeatus HZ001 from Polygonum cuspidatum
虎杖内生真菌HZ001所产β-葡萄糖苷酶的热稳定性,其结果如图2所示。当温度低于60 ℃时,β-葡萄糖苷酶稳定性较好;当温度超过60 ℃时,β-葡萄糖苷酶稳定性下降;当70 ℃保存6 h时,其酶活力基本完全丧失。

图2 虎杖内生真菌A.aculeatus HZ001 β-葡萄糖苷酶的热稳定性
Fig.2 Thermal stability of β-glucosidase produced by the endophytic fungi A.aculeatus HZ001 from Polygonum cuspidatum
2.2 最适反应pH和pH稳定性
pH 会影响酶的构象,还会影响酶与底物的解离状态,从而影响酶的活性和稳定性。由图3可知,在pH为4.8条件下,酶活力最高,为133.6 U/mg,在pH低于4.8条件下,随着pH值的增加,酶活力逐渐上升;而当pH值高于4.8时,酶活力随着pH值的升高而显著降低。
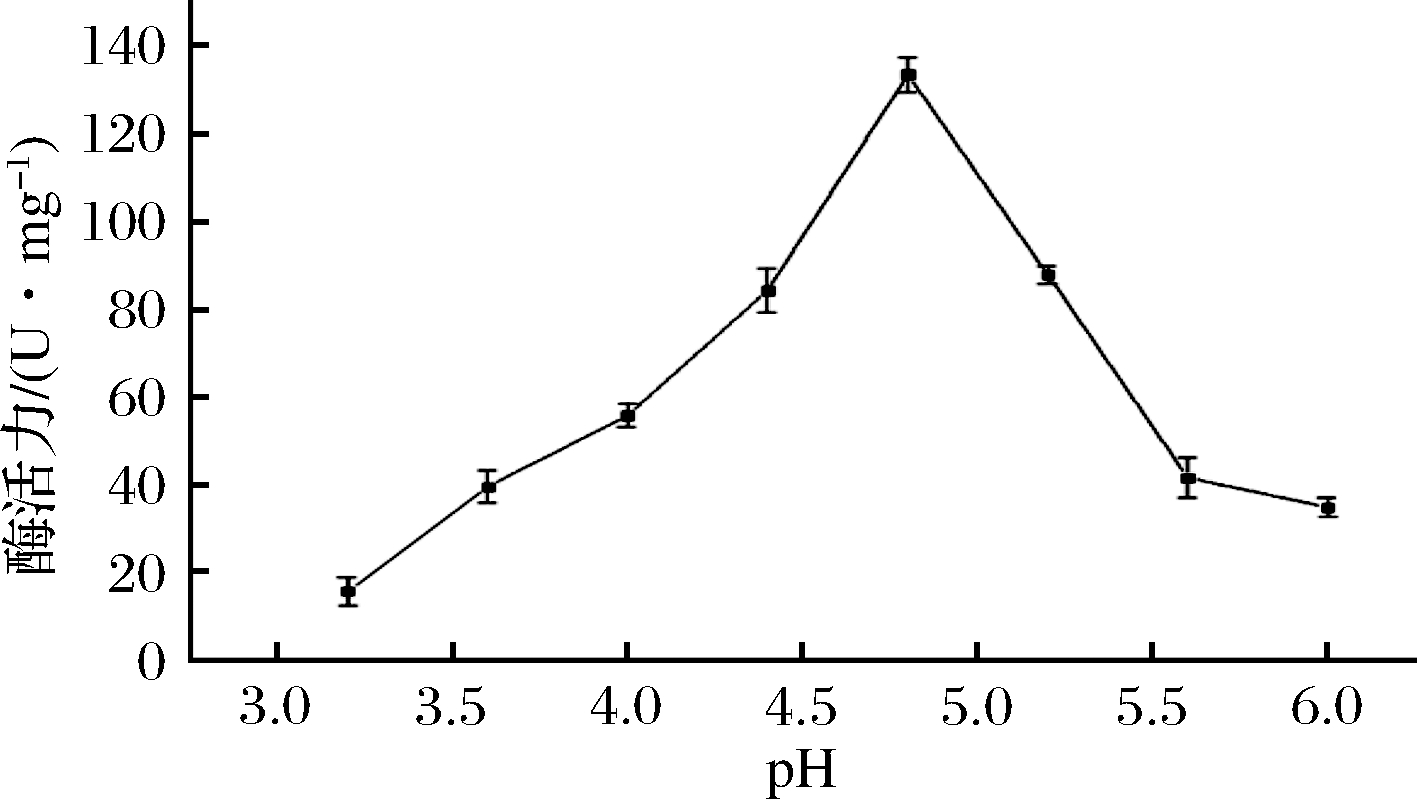
图3 pH对虎杖内生真菌A.aculeatus HZ001 β-葡萄糖苷酶活性的影响
Fig.3 Effect of pH on the activity of β-glucosidase produced by the endophytic fungi A.aculeatus HZ001 from Polygonum cuspidatum
虎杖内生真菌HZ001所产β-葡萄糖苷酶在不同pH下的稳定性如图4所示。该酶在pH为3.6~4.0时有较高的残留酶活力,此条件下相对酶活力随着保温时间的增加而逐渐趋于平缓,相对酶活力维持在80%左右;当pH值不断升高时,随着保温时间的增加,相对酶活力逐渐降低,β-葡萄糖苷酶酶活力逐渐丧失。
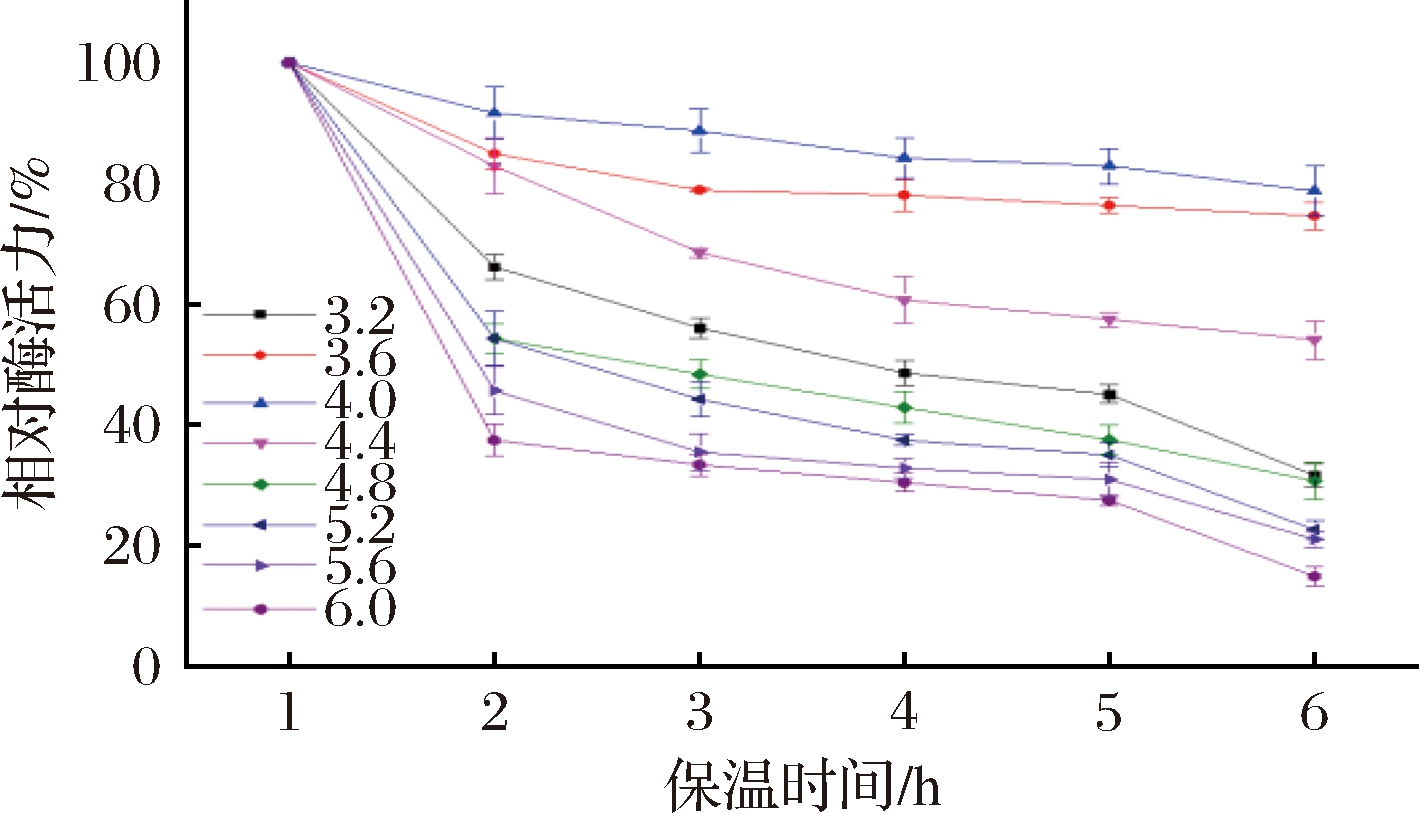
图4 虎杖内生真菌A.aculeatus HZ001 β-葡萄糖苷酶的热稳定性
Fig.4 Thermal stability of β-glucosidase produced by the endophytic fungi A.aculeatus HZ001 from Polygonum cuspidatum
2.3 金属离子对β-葡萄糖苷酶活力的影响
在最适条件下,金属离子对虎杖内生真菌HZ001所产β-葡萄糖苷酶酶活力的影响如表1所示。当体系中金属离子浓度为1.0 mmol/L 时,Fe2+对β-葡萄糖苷酶具有一定的激活作用,相对酶活力达120.36%;而Co2+、Ca2+和Mg2+对该酶有一定的抑制作用,其中Co2+的抑制作用最明显,在反应液中加入该离子后,相对酶活力仅为19.65%。
表1 金属离子对虎杖内生真菌A.aculeatus HZ001 β-葡萄糖苷酶活性的影响
Table 1 Effect of metal ions on the activity of β-glucosidase produced by the endophytic fungi A.aculeatus HZ001 from Polygonum cuspidatum

金属离子/(mmol·L-1)相对酶活力/%Co2+19.65±6.54Fe2+120.36±10.76Ca2+38.36±8.72Mg2+39.46±9.21
2.4 抑制剂对β-葡萄糖苷酶活力的影响
在最优条件下,常见酶抑制剂对虎杖内生真菌HZ001所产β-葡萄糖苷酶酶活的影响如图5所示。其中,EDTA、DMSO、巯基乙醇和SDS等4种抑制剂对该酶都有一定的抑制作用,因 EDTA与该酶催化所需的金属离子发生络合作用,加入EDTA后,β-葡萄糖苷酶的相对酶活力最低,仅10%左右。
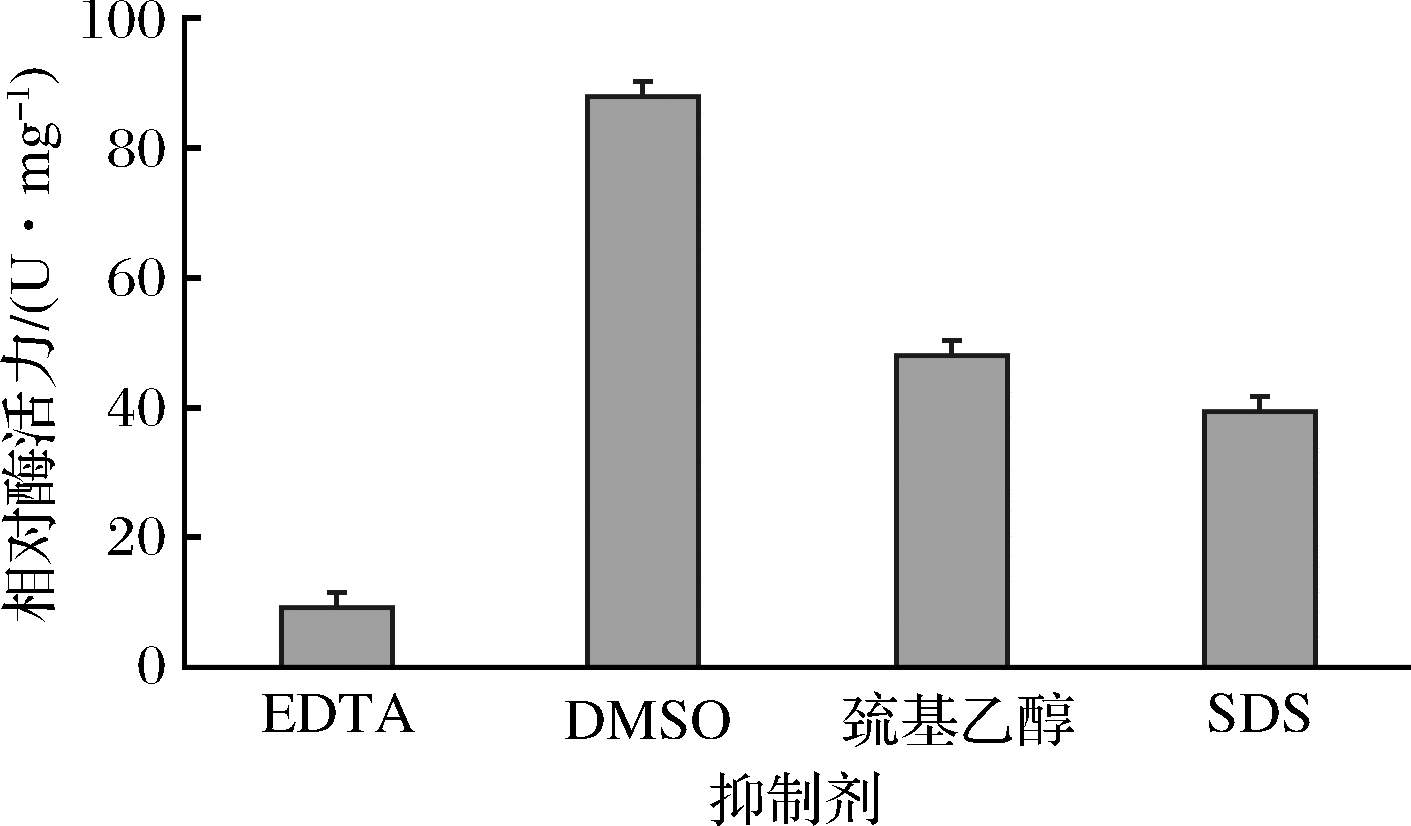
图5 抑制剂对虎杖内生真菌Aspergillus aculeatus HZ001 β-葡萄糖苷酶活性的影响
Fig.5 Effect of inhibitors on the activity of β-glucosidase
produced by the endophytic fungi A.aculeatus HZ001 from Polygonum cuspidatum
2.5 β-葡萄糖苷酶动力学分析
酶的动力学参数是酶学中的一个重要指标,是作为评估酶与底物亲和力的重要参考。通过考察不同底物浓度对虎杖内生真菌HZ001所产β-葡萄糖苷酶催化反应速度的影响,以底物浓度[S]的倒数为横坐标,初速度V的倒数为纵坐标作Lineweaver-Burk双倒数图,得到一条直线,其回归方程为 y=4.332 1x+1.684 8(R2=0.991 4),该直线在X轴的截距为1/Km的绝对值,在Y轴的截距为1/Vmax,据此计算出米氏常数Km值为2.571 mmol/L,Vmax值为0.594 μmol/(mL·h)。
3 结论
本文以虎杖内生真菌A.aculeatus HZ001所产β-葡萄糖苷酶为目标,考察了温度、pH、金属离子和其他抑制剂等对该β-葡萄糖苷酶酶活力及稳定性的影响。该酶最适温度为60 ℃、最适pH 4.8,在低于60 ℃、pH 3.6~4.0条件下较稳定。在选取的4种金属离子中,Fe2+可以促进该酶催化,相对酶活力达到了120.36%;而Co2+等离子明显抑制该酶催化,相对酶活仅有19.65%。巯基乙醇、SDS、DMSO、EDTA等4种抑制剂均对该酶有抑制作用,其中EDTA的抑制作用最明显,在该抑制剂作用下相对酶活力仅有10%左右。以水杨苷为底物时,该酶催化反应的米氏常数Km值为2.571 mmol/L,Vmax值为0.594 μmol/(mL·h)。
[1] 陈旭, 李风录,邢晓艺,等.白藜芦醇的药理活性研究进展[J].药学研究,2020,39(5):284-288.
CHEN X,LI F L,XING X Y,et al.Research progress on pharmacological activity of resveratrol[J].Journal of Pharmaceutical Research,2020,39(5):284-288.
[2] 孙治刚, 李志娜,李敏.白藜芦醇的药理作用研究进展[J].淮海工学院学报(自然科学版),2017,26(2):40-43.
SUN Z G,LI Z N,LI M.Research progress on pharmacological effects of resveratrol[J].Journal of Huaihai Institute of Technology(Natural Science Edition),2017,26(2):40-43.
[3] PARK E J,PEZZUTO J M.The pharmacology of resveratrol in animals and humans[J].Biochimica Et Biophysica Acta,2015,1852(6):1 071-1 113.
[4] MOHAMED E,CHEN Y,WANG X J,et al.Resveratrol:An overview of its anti-cancer mechanisms[J].Life Sciences,2018,207:340-349.
[5] 张颖, 刘义梅.虎杖中白藜芦醇提取工艺研究进展[J].食品安全质量检测学报,2019,10(7):1 884-1 889.
ZHANG Y,LIU Y M.Research progress on the extraction process of resveratrol from Polygonum cuspidatum[J].Journal of Food Safety & Quality,2019,10(7):1 884-1 889.
[6] AL BALKHI M H,MOHAMMAD M A,TISSERANT L P,et al.Development of a liquid-liquid extraction method of resveratrol from cell culture media using solubility parameters[J].Separation & Purification Technology,2016,170:138-145.
[7] XU Z,TIAN J,GAN L,et al.Discovery of the endophytic fungi from Polygonum cuspidatum and biotransformation of resveratrol to pterostillbene by the endophyte Penicillium sp.F5[J].Applied Biochemistry and Microbiology,2020,56(3):313-320.
[8] MEI Y Z,LIU R X,WANG D P,et al.Biocatalysis and biotransformation of resveratrol in microorganisms[J].Biotechnology Letters,2015,37(1):9-18.
[9] 周林芳, 江波,张涛,等.糖苷水解酶第3家族β-葡萄糖苷酶的研究进展[J].食品工业科技,2017,38(14):340-345.
ZHOU L F,JIANG B,ZHANG T,et al.Research progress of β-glucosidases of glycoside hydrolase family 3[J].Science and Technology of Food Industry,2017,38(14):340-345.
[10] 刘震, 朱秋享,石贤爱,等.β-葡萄糖苷酶体外分子改造研究进展[J].福州大学学报(自然科学版),2015(4):565-571.
LIU Z,ZHU Q X,SHI X A,et al.Development in molecular modification of β-glucosidase in vitro[J].Journal of Fuzhou University (Natural Science Edition),2015(4):565-571.
[11] 张媛媛, 苏敏,朴春红,等.微生物来源的β-葡萄糖苷酶在食品工业中应用进展[J].食品工业科技,2019,40(16):329-335.
ZHANG Y Y,SU M,PIAO C H,et al.Progress on the β-glucosidase from microorganisms and its applications in food industry[J].Science and Technology of Food Industry,2019,40(16):329-335.
[12] SINGH G,VERMA A K,KUMAR V.Catalytic properties,functional attributes and industrial applications of β-glucosidases[J].3 Biotech,2016,6(1):1-14.
[13] AHMED A,NASIM F U H,BATOOL K,et al.Microbial β-glucosidase:Sources,production and applications[J].Journal of Applied & Environmental Microbiology,2017,5(1):31-46.
[14] 常治帅, 兰辉,包亚莉,等.微生物产β-葡萄糖苷酶研究进展[J].微生物前沿,2018,7(2):79-86.
CHANG Z S,LAN H,BAO Y L,et al.Progress of β-glucosidase from microorganisms[J].Advances in Microbiology,2018,7(2):79-86.
[15] 周林芳. 酶法提取虎杖中白藜芦醇及白藜芦醇酯的合成研究[D].无锡:江南大学,2019.
ZHOU L F.Study on enzymatic extraction of resveratrol from Polygonum cuspidatum and synthesis of resveratrol esters[D].Wuxi:Jiangnan University,2019.
[16] 冯薇, 胡小妍,马明娜,等.产β-葡萄糖苷酶细菌的筛选及转化白藜芦醇的研究[J].生物技术通报,2017,33(11):130-135.
FENG W,HU X Y,MA M N,et al.The screening of β-glycosidase-producing strain and the transforming of resveratrol[J].Biotechnology Bulletin,2017,33(11):130-135.
[17] ZHOU L,LI S,ZHANG T,et al.Properties of a novel polydatin-β-D-glucosidase from Aspergillus niger SK34.002 and its application in enzymatic preparation of resveratrol[J].Journal of the Science of Food & Agriculture,2016,96(7):2 588-2 595.
[18] XUE Y,ZHANG Z,HOU J,et al.Resveratrol and arctigenin production from polydatin and arctiin respectively by a thermostable β-glucosidase from Thermotoga maritima[J].Journal of Carbohydrate Chemistry,2018,37(7-8):414-430.
[19] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[20] 韩萍萍, 祝旭君,陈虹.微生物转化虎杖苷生成白藜芦醇的研究[J].浙江树人大学学报(自然科学版),2012,12(1):25-28.
HAN P P,ZHU X J,XHEN H.Study on the biotransformation from polydatin to resveratrol[J].Journal of Zhejiang Shuren University(Acta Scientiarum Naturalium),2012,12(1):25-28.