木聚糖是最常见的半纤维组分,在自然界中含量丰富,是第二可再生多糖资源,仅次于纤维素[1-2]。木聚糖酶是一类可将木聚糖降解成木糖和低聚糖的木糖苷键水解酶[2],在食品、造纸、饲料、饮料、生物转化等领域具有重要价值[3-7]。木聚糖酶分布广泛,反刍动物瘤胃微生物、真菌、细菌、放线菌、酵母、蜗牛之类的甲壳动物、陆地植物组织、海洋藻类以及各种无脊椎动物中都存在[8-9]。目前报道的木聚糖酶产生菌主要有短小芽孢杆菌(Bacillus pumilus)、环状芽孢杆菌(Bacillus circulans)、枯草芽孢杆菌(Bacillus subtilis)等细菌,以及木霉属(Trichoderma)、曲霉菌属(Aspergillus)、链霉菌属(Streptomyces)等真菌,且真菌木聚糖酶的活性普遍高于细菌木聚糖酶[8]。
木霉菌包括哈茨木霉(Trichoderma harzianum)、绿色木霉(Trichoderma viride)、侧耳木霉(Trichoderma pleuroticola)、深绿木霉(Trichoderma atroviride)和长枝木霉(Trichoderma longibrachiatum)等250余个种类,是一类重要的可再生资源,已成为国际上最具有学术和应用价值的资源微生物之一[10-11]。在工业领域,木霉菌部分种类可产纤维素酶、果胶酶、木聚糖酶和几丁质酶等多种酶类[11]。目前,有关木霉菌产纤维素酶的研究较多,而产木聚糖酶的研究报道较少。JAINA等[12]对1株深绿木霉产木聚糖酶活力进行研究发现,木聚糖酶活力较低,为5.8 IU/mL。龚爱姣[13]研究的绿色木霉产木聚糖酶活力可达40 216 IU/mL,比原始菌株产酶量高18%。魏瑛[14]以里氏木霉(Trichoderma reesei)为实验菌株,得到的木聚糖酶活力为228 U/mL,比原始菌株提高了近10倍。钱朋智等[15]鉴定的侧耳木霉菌株ZJ-03所产木聚糖酶活力在3 000 IU/g以上,且该木聚糖酶可产低聚木糖,占总糖含量的72%。KORKMAZ等[16]从地中海沿海沉积物分离出1株侧耳木霉菌株08ÇK001,可产木聚糖酶。哈茨木霉是木霉属中应用最广的1个菌种[9],作为生防制剂,在植物白绢病、幼苗枯病、疫霉病、马铃薯黑痣病等病害的防治上起到明显作用[17-19],还可产生多种活性次级代谢产物,能促进植物的生长[10]。
本研究采用平板水解圈法从平菇栽培污染菌包中筛选出1株高产木聚糖酶的菌株ZJ-01,结合形态学以及核糖体18S序列同源性分析对该菌株进行鉴定,并通过固态发酵法对菌株的产酶条件进行优化,以期为进一步研究该菌株产木聚糖酶用于生产低聚木糖的可行性奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 主要实验材料
玉米皮、玉米胚芽粕和玉米蛋白粉,齐齐哈尔龙江阜丰生物科技有限公司;玉米芯、玉米秸秆和玉米苞叶,山东禹城盛之源农业科技有限公司。
1.1.2 培养基
马铃薯琼脂葡萄糖培养基(potato dextrose agar medium,PDA):参照吴健等[19]的方法制备。
选择性培养基:木聚糖5 g,NaCl 0.5 g,KH2PO4 1 g,MgSO4 0.5 g,琼脂粉20 g,定容至1 L,pH值自然,高压灭菌备用。
初始发酵培养基:按4∶3(g∶mL)将玉米皮用水浸泡过夜;将水分60%的玉米胚芽粕粉与浸泡过夜的玉米皮按4∶1质量比混合,添加一定量KH2PO4,pH值自然,高压灭菌备用。
1.2 仪器和设备
BS-2F型恒温双层振荡培养箱,常州杰诺基仪器有限公司;5418型台式高速离心机,德国Eppendorf AG公司;2720型PCR仪,美国ABI;DYCP-32A型电泳仪,北京六一生物科技有限公司;DSX-280B不锈钢自动高压灭菌锅,上海申安医疗器械厂;HH.S11-1数显电热恒温水浴锅,上海博迅医疗生物仪器股份有限公司。
1.3 实验方法
1.3.1 菌株的分离纯化和形态学鉴定
从平菇污染菌包上挑取霉菌孢子,接种到PDA平板培养基上,并设空白对照,于28 ℃恒温培养箱中暗培养(倒置);培养4~5 d,待长出肉眼可识别的菌落后,用接种针挑取菌落边缘长势较好的菌丝至新的PDA培养基上,28 ℃培养;重复3~4 次后得到纯化菌株,编号为ZJ-01,接入斜面培养基并于 4 ℃保存备用。
将保存于冰箱的ZJ-01菌株活化,待菌落长满培养皿后,用5 mm打孔器取块接种于新的PDA培养基上,于28 ℃恒温暗培养5 d(倒置),每隔12 h观察菌落形态,记录菌丝的颜色变化。
1.3.2 菌株的分子生物学鉴定和系统发育树构建
菌株ZJ-01基因组DNA的提取:菌株ZJ-01 DNA采用Solarbio基因组DNA提取试剂盒进行。
PCR扩增:以ZJ-01 DNA为模板,进行18S-PCR扩增,所用引物为通用引物NS1(5′-GTAGTCATATGCTTGTCTC-3′)和NS8(5′-TCCGCAGCTTCACCTACGGA-3′)。PCR反应体系(20 μL):2×Master Mix 10.0 μL,DNA模板2.0 μL,NS1和NS8引物(10 mmol/L)各0.8 μL,加双蒸水补足。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火25 s,72 ℃延伸1 min,循环35次;72 ℃延伸5 min。扩增产物用1%琼脂糖凝胶电进行检测。扩增得到的PCR产物送至青岛科创质量检测有限公司进行测序。
序列分析及系统发育分析:将测得的序列与NCBI的GenBank数据库中的核苷酸序列进行Blast比对,随机选取相似性较高的序列,运用MEGA7.0软件进行聚类分析,采用邻近法(Neighbor-Joining,NJ)构建系统发育树,进行系统发育分析。
1.3.3 木霉产木聚糖酶的定性
用直径为0.5 mm的打孔器从纯化的木霉菌落平板培养基中取长势较好的菌落,接种至选择性培养基中央,于28 ℃恒温培养箱中暗培养5 d,每天观察菌落生长状况和水解圈生成情况。
1.3.4 木聚糖酶液的制备
待PDA平板上长满菌株ZJ-01孢子,用无菌水洗脱,转入装有玻璃珠的无菌水中,振荡,制成孢子悬液。待孢子悬液数目达到一定数量后,接种到初始发酵培养基中,28 ℃恒温发酵适当时间,定时振荡。发酵结束后,将质量分数0.9%的生理盐水和固态发酵物按6∶1的质量比混匀,浸提4 h,6层纱布过滤;滤液4 ℃离心10 min,所得上清液即为粗酶液。
1.3.5 木糖标准曲线
木糖标准曲线的制作参考方桢的方法并稍作修改[21],以吸光值为横坐标x,木糖浓度为纵坐标y。所得标准曲线为y=1.237 3x-0.007 4,R2=0.998 5。
1.3.6 木聚糖酶活力的测定
酶活力定义为:在40 ℃、pH 6.0条件下,1 min水解木聚糖生成1 μmol还原糖所需酶的量为1个酶活力单位,用U/g表示[22]。
采用3,5-二硝基水杨酸法(DNS)测定木聚糖酶的酶活。取1.0 mL适当稀释的酶液于A、B比色管中,分别加入1.5 mL 1.0% 的木聚糖溶液和蒸馏水(空白对照),45 ℃水浴反应30 min,加入1.5 mL DNS溶液后在沸水浴中煮沸5 min,迅速用冷水冷却至室温,加蒸馏水定容至25 mL,在540 nm处分别测定A管吸光值(AE)和B管吸光值(AB)。
参考GB/T 23847—2009方法[22],对木聚糖酶活力计算公式进行简化并稍作修改,按公式(1)计算:
木聚糖酶活力![]()
(1)
式中:r,通过OD540值(AE-AB)从标准曲线上查得与标准木糖溶液相对应的浓度,mg/mL;Df,稀释倍数;1 000;转化因子,1 mmoL=1 000 μmoL;6,生理盐水与固态发酵物的质量比,即水料比;150.14,木糖的摩尔质量,g/moL;t,酶解反应时间,min。
1.3.7 发酵条件的优化
1.3.7.1 最适氮源原料的筛选
保持初始发酵培养基其他成分不变,分别以玉米酒精酒糟、玉米胚芽粕和玉米蛋白粉为氮源原料,与浸泡过夜的玉米皮按4∶1比例混合制成固态培养基(含水量为60%),接种木霉菌株ZJ-01,28 ℃恒温发酵72 h,定时振荡,测定酶活,研究不同氮源原料对菌株ZJ-01发酵产酶的影响。
1.3.7.2 最适碳源原料的筛选
保持初始发酵培养基其他成分不变,分别以玉米皮、玉米芯、玉米秸秆、玉米苞叶为碳源原料,与筛选出的最适氮源原料按1∶4比例混合制成固态培养基(含水量为60%),接种木霉菌株ZJ-01,28 ℃恒温发酵72 h,定时振荡,测定酶活力,研究不同碳源原料对菌株ZJ-01发酵产酶的影响。
1.3.7.3 最适氮源和碳源原料质量比的筛选
将优化出的最适氮源和碳源原料,按2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2和9∶1的质量比混合制成固态培养基(含水量为60%),接种木霉菌株ZJ-01,28 ℃恒温发酵72 h,定时振荡,测定酶活力,研究不同氮源和碳源原料质量比对菌株ZJ-01发酵产酶的影响。
1.3.7.4 最适发酵时间的筛选
将菌株ZJ-01接种到最优培养基上,28 ℃恒温发酵24、48、60、72、84和96 h,定时振荡,测定酶活力,研究发酵时间对菌株ZJ-01发酵产酶的影响。
2 结果与分析
2.1 木霉的形态学鉴定
在28 ℃培养条件下,菌落生长迅速,菌落生长初期呈绒毛状,白色,有明显的同心圆环状产孢区(图1-a);随着菌丝的老熟,颜色由淡绿色变为暗绿色(图1-b)。本研究所得菌株形态与方圆[23]所描述的哈茨木霉的形态一致。因此,综合所观察的菌落的形态学特征,初步将菌株ZJ-01鉴定为哈茨木霉。
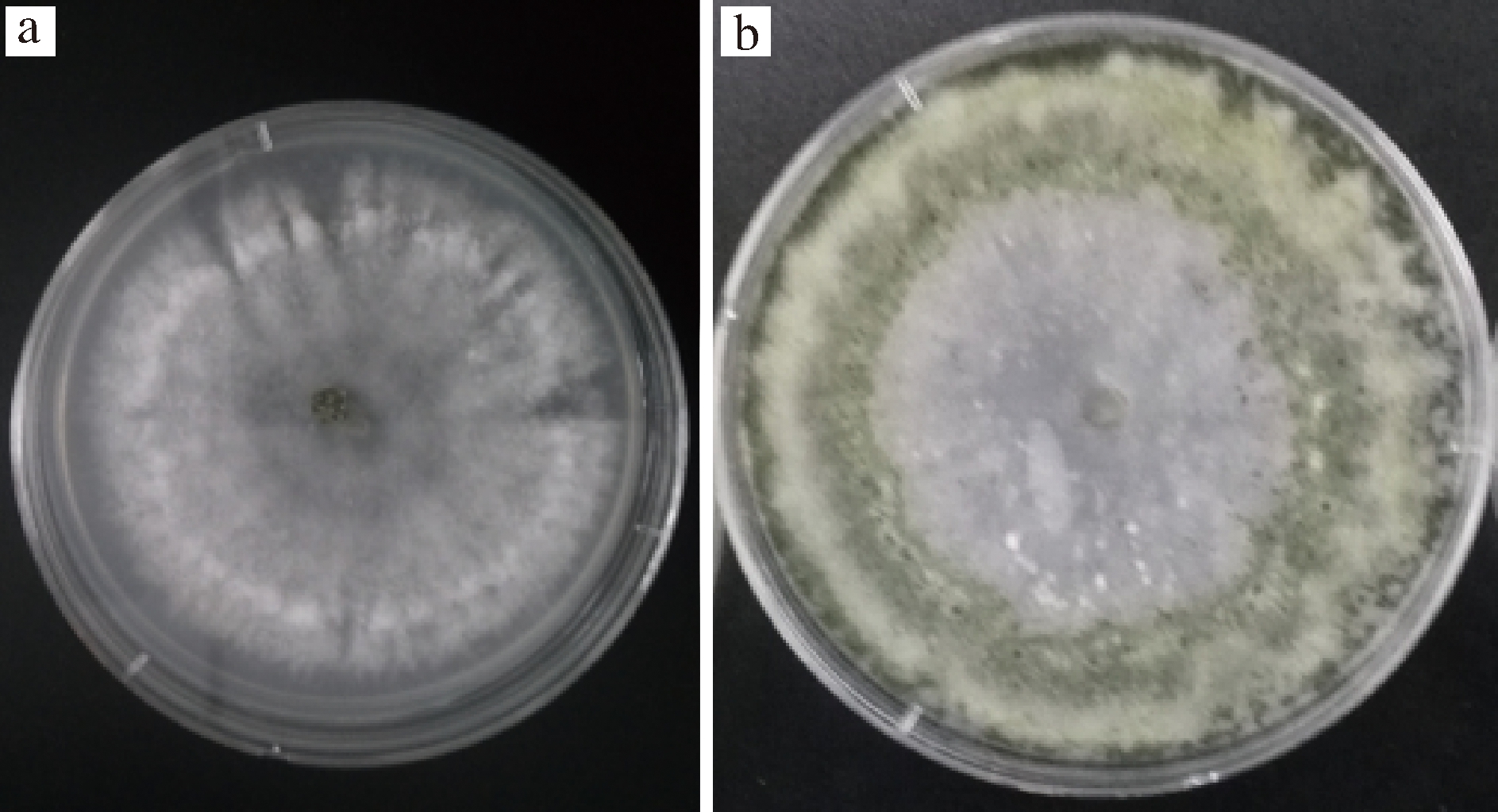
a-菌落生长初期;b-菌落生长后期
图1 菌株ZJ-01在PDA培养基上的形态
Fig.1 Morphology of strain ZJ-01 on PDA medium
2.2 木霉的分子生物学鉴定
提取菌株ZJ-01的总DNA,通过18S PCR产物测序及序列分析,利用NCBI进行Blast比对,发现ZJ-01的扩增序列与已知木霉属菌株18S序列一致性可达98%以上。构建进化树发现(图2),菌株ZJ-01与哈茨木霉位于同一分枝上,进一步证明菌株ZJ-01为哈茨木霉。

图2 菌株ZJ-01系统发育树
Fig.2 Phylogenetic tree of strain ZJ-01
2.3 木霉产木聚糖酶的定性
木聚糖酶是一种水解酶,将能产木聚糖酶的微生物在含有木聚糖的选择平板上培养可形成明显的透明水解圈[14,19]。透明圈法具有简单、直观和快速等优点,可用于定性木霉产木聚糖酶的研究[15]。经研究发现,在产木聚糖酶定性平板培养基上第3天即可出现较明显的水解圈,说明菌株ZJ-01可产木聚糖酶。
2.4 产酶条件的优化
2.4.1 氮源原料
本研究选用含有丰富蛋白质的玉米酒精酒糟、玉米胚芽粕和玉米蛋白粉3种物质作为氮源,从中优选适宜氮源。由图3可知,不同氮源对哈茨木霉产木聚糖酶活力的影响较大。在3种氮源中,玉米酒精酒糟为氮源的发酵培养基中所产木聚糖酶活力最高,可达3 307 U/g,其次是玉米胚芽粕,玉米蛋白粉相对最低,只有1 849 U/g。可能是由于玉米酒精酒糟中蛋白质含量比较丰富,可达24%以上,而玉米胚芽粕中蛋白质含量相对较低,只有17%左右。玉米蛋白粉虽然有很高的蛋白质含量(20%~70%),但加水后黏稠度大,溶氧效果差,会抑制微生物的生长,不利于木聚糖酶的合成。综上所述,选取玉米酒精酒糟作为最适发酵氮源。

图3 氮源原料对哈茨木霉产木聚糖酶活力的影响
Fig.3 Effect of nitrogen material on xylanase activity of T.harzianum
2.4.2 碳源原料
在微生物的生长代谢中,80%的碳源被用来维持细胞生命活动所需的能量。大多数真菌产生的木聚糖酶都是复合酶,也是诱导酶,半纤维素底物及类似物通常都是木聚糖酶的良好诱导物,而不同碳源诱导产木聚糖酶的水平存在差异性[8]。本研究选用价格低廉易得的玉米皮、玉米芯、玉米秸秆和玉米苞叶4种农副产品副产物为原料,以研究最适碳源。从图4可以看出,不同碳源原料对哈茨木霉产木聚糖酶活力影响顺序依次为:玉米皮>玉米苞叶>玉米芯>玉米秸秆。目前,固态发酵产木聚糖酶的碳源原料多为玉米芯和麸皮等[5,9],选用玉米皮作为碳源原料的研究相对较少[24]。
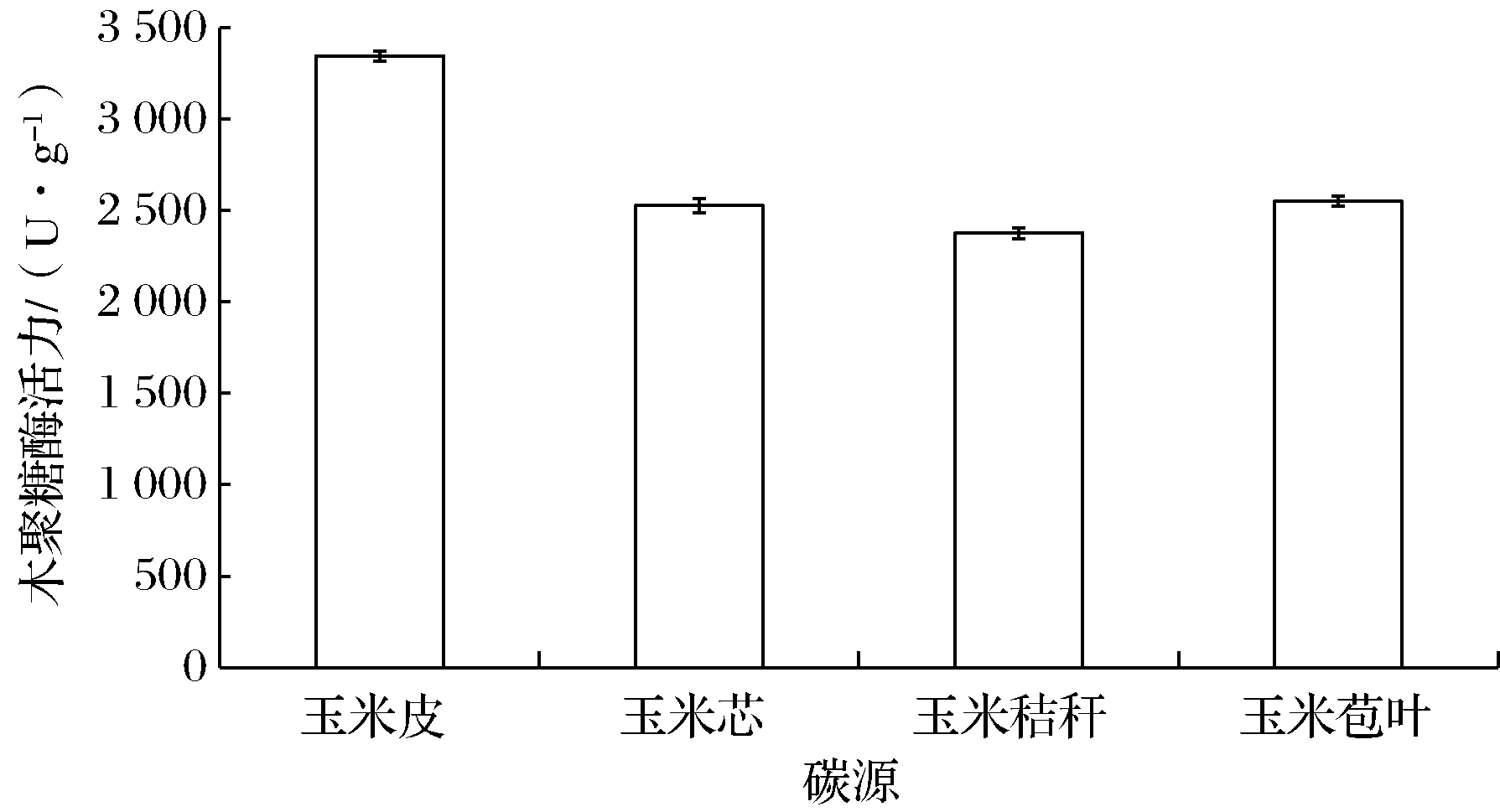
图4 碳源原料对哈茨木霉产木聚糖酶活力的影响
Fig.4 Effect of carbon material on xylanase activity of T.harzianum
本研究发现玉米皮的诱导能力明显高于其他碳源,可达到3 346 U/g。可能是因为玉米皮除了含有丰富的半纤维素,还含有较高量的蛋白质和矿物质等木霉所需的营养成分,更有利于木聚糖酶的合成,且比其他3种原料通透性更好,能提高微生物的产酶性能。该结果与宫晓等研究脉孢霉产木聚糖酶的研究结果一致[22]。因此,选用玉米皮作为培养基中的最适发酵碳源原料。
2.4.3 氮源原料和碳源原料质量比
适当的氮源和碳源配比有助于微生物的生长代谢和发酵分解。玉米酒精酒糟和玉米皮均含有微生物生长所需的多种营养成分,且玉米皮又可为微生物的生长提供一个蓬松的环境,两者的合理比例可诱导哈茨木霉高产木聚糖酶。调整玉米酒精酒糟和玉米皮的质量比分别为2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2和9∶1。由图5可知,随着氮源和碳源质量比的增加,木聚糖酶活力呈现先升高后降低的趋势。当氮源比例较高时,木聚糖酶活力较大,氮源和碳源质量比为8∶2时,活力最高,可达3 430 U/g,说明高比例的氮源为细胞的快速生长提供了可快速吸收的营养物质,对哈茨木霉的产酶能力有较大影响,而碳源的影响相对较低,但又不能缺少。本结果与魏桃英等的研究结论一致[25]。随着氮源含量的增加,培养基的蓬松性变差,容易结块成团,影响溶氧和散热,不利于菌体的生长和产酶,导致酶活力下降。确定适宜氮源和碳源质量比为8∶2。
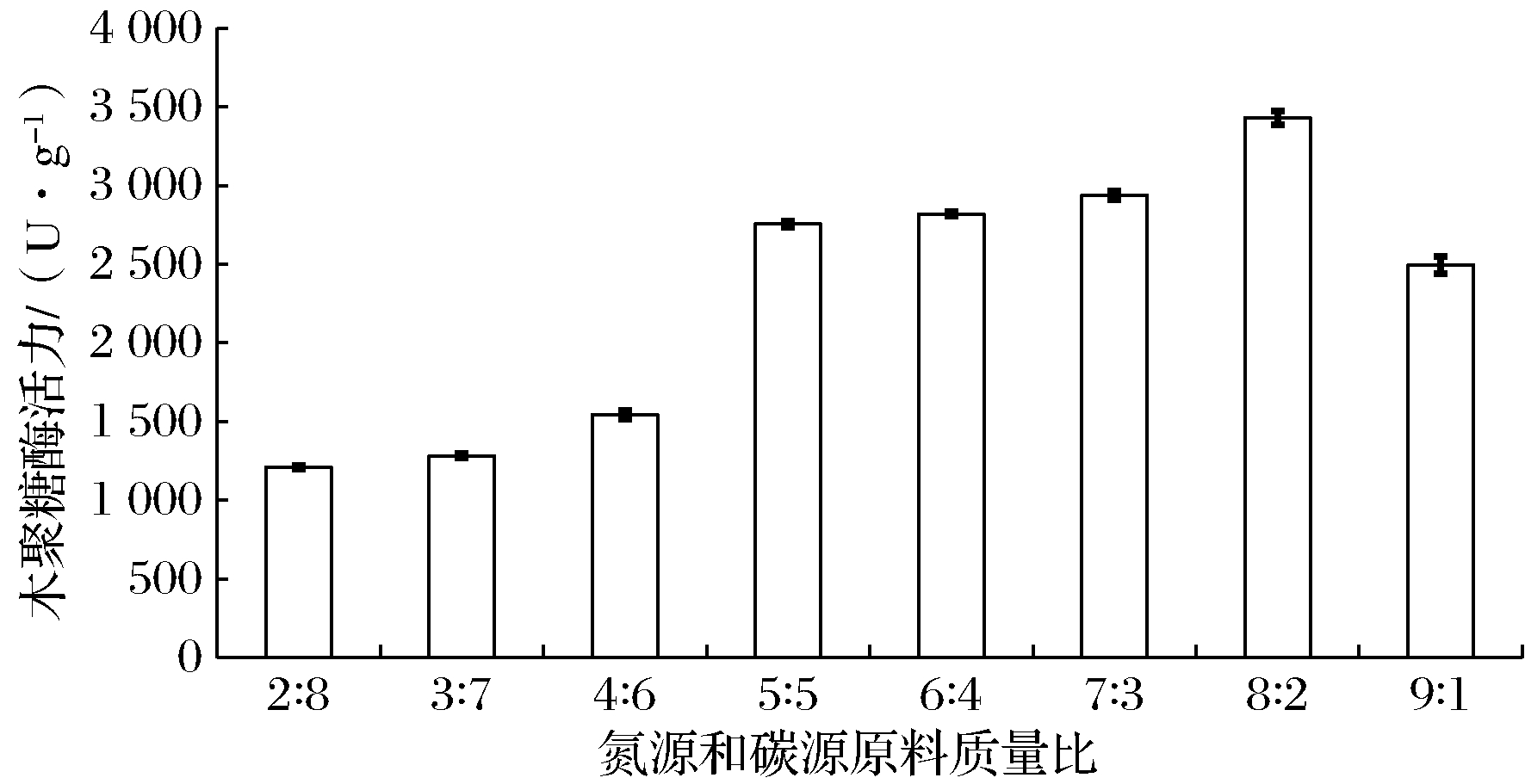
图5 氮源和碳源质量比对哈茨木霉产木聚糖酶活力的影响
Fig.5 Effect of mass ratio of nitrogen and carbon on xylanase activity of T.harzianum
2.4.4 发酵时间
分别选用24、48、60、72、84和96 h作为发酵时间,以确定适宜发酵时间。由图6可知,随着培养时间的增加,木聚糖酶活力呈现先升高后降低的趋势。发酵72 h时,木聚糖酶活力最高,达到3 574 U/g;之后,由于培养基的消耗和菌株生长的衰退,酶活力逐渐降低。同时,在整个培养过程中,接种后48 h左右可见白色菌丝,接入的孢子开始萌发;60 h左右培养基表面布有大量浅绿色孢子;72 h后整个培养基长满暗绿色孢子。由此确定最适发酵时间为72 h。此结果与权淑静等优化桔绿木霉产木聚糖酶固态发酵条件的研究结论一致[5]。
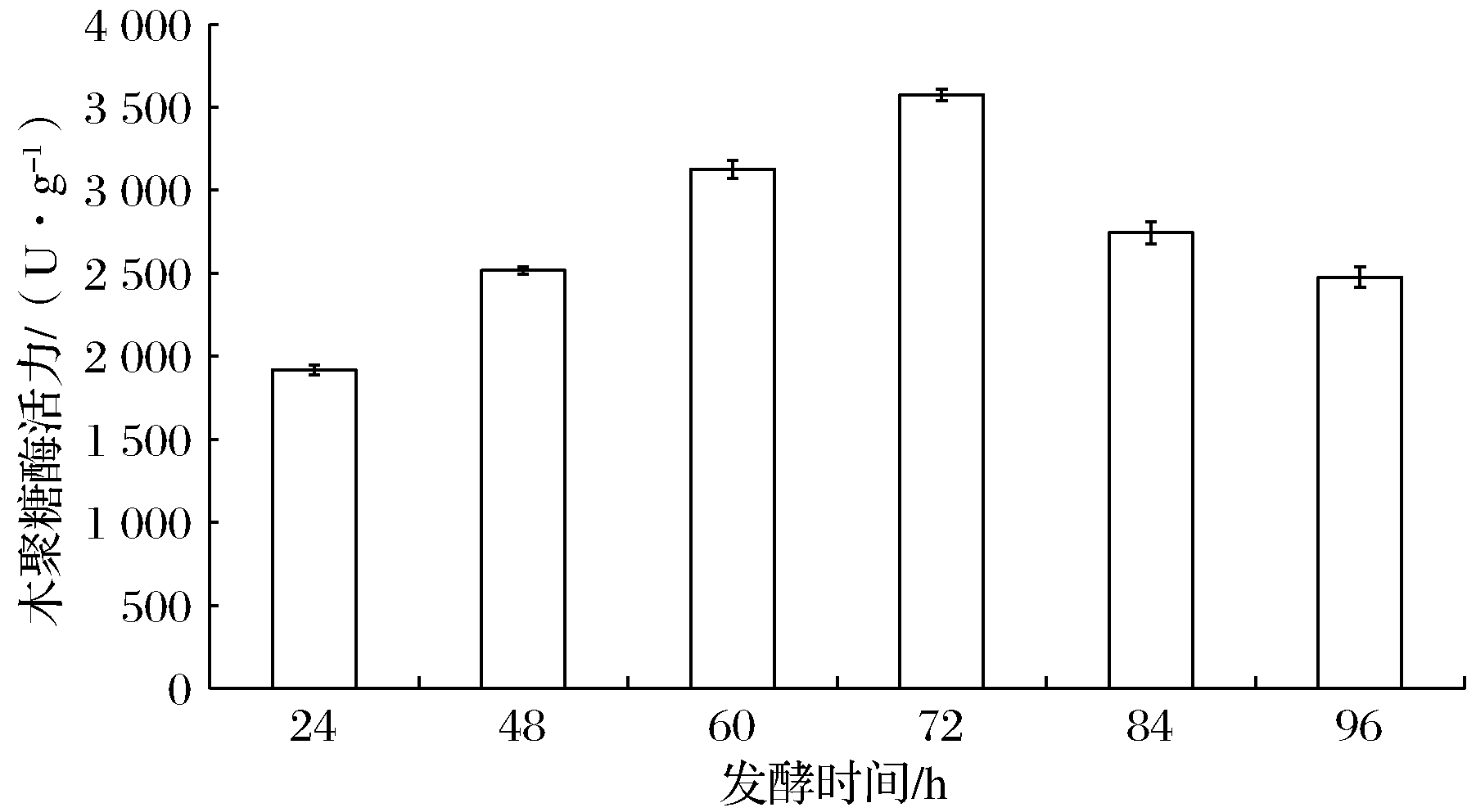
图6 发酵时间对哈茨木霉产木聚糖酶活力的影响
Fig.6 Effect of fermentation time on xylanase activity of T.harzianum
3 结论
本研究从平菇栽培污染菌包中分离的绿色霉菌菌株ZJ-01,可在PDA培养基上迅速生长,且形态特征与哈茨木霉特征相符。在此基础上,利用分子生物方法对其进行测序,所得序列与木霉属中的许多种类具有较高相似性,可达98%以上。系统进化树分析发现,ZJ-01与哈茨木霉亲缘关系较近,可聚为一类,因此将该菌株鉴定为哈茨木霉。通过单因素试验筛选,得到哈茨木霉ZJ-01固态发酵产木聚糖酶的适宜碳源为玉米皮,氮源为玉米酒精酒糟,氮源和碳源质量比为8∶2,发酵时间为72 h。在优化条件下,木聚糖酶活力为3 574 U/g。本研究的发酵培养基以玉米酒精酒糟和玉米皮为原料,成本低廉,具有应用潜力,可为进一步研究哈茨木霉产木聚糖酶用于生产低聚木糖奠定基础。
[1] 刘亚力,刘路宁,张敬泽,等.生防哈茨木霉菌株产木聚糖酶的条件研究[J].浙江大学学报(农业与生命科学版),2009,35(2):141-146.
LIU Y L,LIU L N,ZHANG J Z,et al.Effect of culture conditions on xylanase activity produced from biocontrol agent Trichoderma harzianum strains[J].Journal of Zhejiang Univerrsity (Agric.& Life Sci.),2009,35(2):141-146.
[2] 万红贵, 武振军,蔡恒,等.微生物发酵产木聚糖酶研究进展[J].中国生物工程杂志,2010,30(2):141-146.
WAN H G,WU Z J,CAI H,et al.Recent progress on the production of xylanase by microbial fermentation[J].China Biotechnology,2010,30(2):141-146.
[3] 倪大伟, 李瑞云,白爱枝,等.黑曲霉木聚糖酶的同源表达及其高产木聚糖酶发酵条件的优化[J].食品与发酵工业,2015,41(4):48-53.
NI D W,LI R Y,BAI A Z,et al.Homologous expression and fermentation properties for producing xylanase of a high-yield Aspergillus niger genetic engineering strain[J].Food and Fermentation Industries,2015,41(4):48-53.
[4] 郑虹, 李莉娟,童秋霞,等.一株高产木聚糖酶菌株的筛选鉴定及酶学特性研究[J].食品工业科技,2018,39(6):126-129.
ZHENG H,LI L J,TONG Q X,et al.Screening,identification and enzymatic properties of the high xylanase producing stain[J].Science and Technology of Food Industry,2018,39(6):126-129.
[5] 权淑静, 张永战,徐文涛,等.桔绿木霉产木聚糖酶固体发酵条件研究[J].河南科学,2018,36(2):165-169.
QUAN S J,ZHANG Y Z,XU W T,et al.Culture condition for production of xylanase by Trichoderma citrinoviride under solid state fermentation[J].Henan Science,2018,36(2):165-169.
[6] DE ALMEIDAl M N,GUIMARAES V M,BISCHOFF K M,et al.Cellulases and hemicellulases from endophytic acremonium species and its application on sugarcane bagasse hydrolysis[J].Applied Biochemistry and Biotechnology,2011,165(2):594-610.
[7] ADIGUZEL G,FAIZ O,SISECIOGLU M,et al.A novel endo-β 1,4-xylanase from Pediococcus acidilactici GC25:Purification,characterization and application in clarification of fruit juices[J].International Journal of Biological Macromolecules,2019,129(10):571-578.
[8] 单志琼. 半纤维素降解酶的克隆及鉴定[D].上海:复旦大学,2012.
SHAN Z Q.Cloning and identification of hemicellulose degrading enzymes[D].Shanghai:Fudan University,2012.
[9] 侯洁, 李琴,李秀婷,等.产木聚糖酶霉菌发酵条件优化及酶学性质研究[J].食品工业,2016,37(10):130-134.
HOU J,LI Q,LI X T,et al.Optimization of fermentation conditions for xylanase production by a mould and properties of the enzyme[J].Food Industry,2016,37(10):130-134.
[10] 陆洪省,张雪,高宇婷,等.哈茨木霉SKD-ZX-1的鉴定,发酵及其生防效果[J].生物技术通报,2020,36(2):1-10.
LU H S,ZHANG X,GAO Y T,et al.Identification,fermentation and biocontrol efficiency of Trichoderma harzianum SKD-ZX-1[J].Biotechnology Bulletin,2020,36(2):1-10.
[11] 秦文韬, 陈凯,庄文颖.木霉属5个中国新记录种及2种木霉在中国的新分布[J].菌物学报,2016,35(8):994-1 007.
QIN W T,CHEN K,ZHUANG W Y.Five Trichoderma species new to China and notes on two other widespread species[J].Mycosystema,2016,35(8):994-1 007.
[12] JAIN A,HAMMONDA R E,KERRIGAN J L,et al.Characterization of a Trichoderma atroviride strain isolated from switchgrass bales and its use to saccharify ammonia-pretreated switchgrass for biobutanol production[J].Biomass Bioenerg,2014,64:299-308.
[13] 龚爱姣. 绿色木霉高产木聚糖酶诱变菌株的筛选及发酵产酶中试条件研究[D].南阳:南阳师范学院,2018.
GONG A J.Screening and pilot conditions of high-yield xylanase mutagenized strains of Trichoderma viride[D].Nanyang:Nanyang Normal University,2018.
[14] 魏瑛. 里氏木霉发酵生产木聚糖酶的研究[D].无锡:江南大学,2008.
WEI Y.Research on fermentation of xylanase producing strain Trichoderma reesei[D].Wuxi:Jiangnan University,2008.
[15] 钱朋智, 张梅娟,刘晓兰,等.一株侧耳木霉的鉴定及其产木聚糖酶研究[J].食品科技,2020,45(3):13-17.
QIAN P Z,ZHANG M J,LIU X L,et al.Identification and xylanase production of Trichoderma pleuroticola strain[J].Food Science and Technology,2020,45(3):13-17.
[16] KORKMAZ M N,OZDEMIR S C,UZEL A.Xylanase production from marine derived Trichoderma pleuroticola 08ÇK001 strain isolated from Mediterranean coastal sediments[J].Journal of Basic Microbiology,2017,57(10):12-22.
[17] CHAVERRI P,BRANCOROCHA F,JAKLTISCH W,et al.Systematics of the Trichoderma harzianum species complex and the re-identification of commercial biocontrol strains[J].Mycologia,2015,107(3):558-590.
[18] HAMMAN G E.Myths and dogmas of biocontrol:changes in perceptions derived from research on Trichoderma harzianum T-22[J].Plant Disease,2000,84(4):377-393.
[19] 郭成瑾, 沈瑞清,张丽荣,等.哈茨木霉协同秸秆对马铃薯黑痣病及根际土壤微生态的影响[J].核农学报,2020,34(7):1 447-1 455.
GUO C J,SHEN R Q,ZHANG L R,et al.Effects on biological control against potato black scurf (Rhizoctonia solani) and rhizosphere soil micr-ecosystem of Trichoderma harzaianum applied toghter with straw[J].Journal of Nuclear Agricultural Sciences,2020,34(7):1 447-1 455.
[20] 吴健, 何伟,王建成,等.酿酒酵母与产香酵母发酵特性及其相互作用规律[J].食品与发酵工业,2020,46(20):78-87.
WU J,HE W,WANG J C,et al.Fermentation characteristics and interaction of Saccharomyces cerevisiae and aroma-producing yeast[J].Food and Fermentation Industries,2020,46(20):78-87.
[21] 方桢. 木聚糖酶高产菌株的选育及酶法制备药用微晶纤维素的初步研究[D].合肥:合肥工业大学,2019.
FANG Z.Breeding of high-yield xylanase producing strain and preparation of pharmaceutical microcrystalline cellulose by enzymatic method[D].Hefei:Hefei University of Technology,2019.
[22] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 23874—2009 饲料添加剂木聚糖酶酶活力的测定 分光光度法[S].北京:中国标准出版社,2009.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB/T 23874—2009 Determination of xylanase activity in feed additives Spectrophotometric method [S].Beijing:China Standards Press,2009.
[23] 方圆, 季世达,王玉成,等.新疆野苹果根围木霉分离鉴定及生防特性研究[J].西南林业科学,2019,48(6):111-119.
FANG Y,JI S D,WANG Y C,et al.Isolation,identification and biocontrol characteristics of Trichoderma from the rhizosphere soil of Malus sieversii[J].Journal of West China Forestry Science,2019,48(6):111-119.
[24] 宫晓, 郑喜群,刘晓兰,等.脉孢霉固体发酵产木聚糖酶的条件研究[J].粮食与饲料工业,2015(6):51-55.
GONG X,ZHENG X Q,LIU X L,et al.The solid state fermentation conditions of xylanase production by Neurospora sitophila[J].Cereal & Feed Industry,2015(6):51-55.
[25] 魏桃英, 胡普信,汪钊,等.黑曲霉产木聚糖酶固体发酵工艺优化[J].食品工业,2015,36(1):33-36.
WEI T Y,HU P X,WANG Z,et al.Solid fermentation technology of xylanase-producing Aspergillus niger[J].Food Industry,2015,36(1):33-36.