食用蛋白改善代谢综合症的作用越来越受到世界各国食品及营养学家的关注。目前,已通过采用合适的蛋白酶水解食用蛋白获得了大量的生物活性肽,包括血管紧张素转换酶(angiotensin I-converting enzyme,ACE)抑制肽、降血脂肽、抗动脉粥样硬化肽等,其中降血压肽的研究最为广泛和深入。
化学合成类西药广泛应用于高血压的预防与治疗。尽管这些降压药物的降压效果明显,但仍存在诸多不良反应。来源于动植物及微生物的ACE抑制肽,由于其具有降血压效果明显、对正常血压无影响、无副作用等优点,已成为目前抗高血压药物研究的热点之一[1]。
陈倩倩等[2]对大米蛋白的4种蛋白(清蛋白、球蛋白、醇蛋白、谷蛋白)进行酶解后,发现其具有ACE抑制活性。WANG等[3]用蛋白酶酶解提取大豆蛋白肽,用碱性蛋白酶制备的肽表现出ACE抑制活性和抗氧化活性。杨敏[4]采用中性蛋白酶酶解鲽鱼鱼皮制备的胶原蛋白肽具有ACE抑制活性,其抑制率为52.48%,动物实验结果表明其对SHR大鼠有降血压效果。
目前对动植物蛋白肽的ACE抑制活性研究较多,但鲜有不同蛋白肽间对比的研究。本文研究了大米蛋白肽的酶解制备工艺,并对该大米蛋白肽与市售的大豆蛋白肽和鱼胶原蛋白肽进行理化指标、分子质量分布和ACE抑制活性进行了研究与对比,可为3种蛋白肽的应用提供更多的基础数据支持。将该大米蛋白肽的工艺进行放大与生产,测定不同批次大米蛋白肽的ACE抑制活性,研究放大生产产品的稳定性,为大米蛋白肽的工业化生产提供基础数据。
1 材料与方法
1.1 实验材料
大米蛋白,无锡金农生物科技有限公司;大豆蛋白肽、鱼胶原蛋白肽、碱性蛋白酶、中性蛋白酶、蛋白酶A、蛋白酶B,市售;ACE、马尿酰-组氨酰-亮氨酸,上海生工生物工程有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-6100紫外分光光度计,上海美谱达仪器有限公司;高效液相色谱仪,美国沃特世公司;FE28 pH计,梅特勒-托利多仪器(上海)有限公司;HYP-320消化炉、KDN103F定氮仪,上海纤检仪器有限公司。
1.3 实验方法
1.3.1 大米蛋白酶解优化实验
大米蛋白100 g加水,料液比1∶9(g∶mL),升至50 ℃,调至酶最适pH,以2 000 U/(g蛋白质)加入蛋白酶,50 ℃反应5 h,升温至90 ℃保温10 min灭酶,4 000 r/min离心5 min,得上清液,浓缩后进行喷雾干燥,得到大米蛋白肽粉。
1.3.2 大米蛋白肽粉的放大与生产
大米蛋白500 kg,料液比1∶9(g∶mL)调浆,升温至50 ℃,调至最适pH,以2 000 U/(g蛋白质)加入复合蛋白酶,50 ℃反应5 h,蒸汽喷射物料升温至90 ℃,保温10 min进行灭酶,卧螺分离得到上清液,过膜分离设备,经降膜式蒸发器浓缩后进行喷雾干燥,得到大米蛋白肽粉。
1.3.3 蛋白回收率测定
根据GB 5009.5—2016[5]的凯氏定氮法测定其粗蛋白含量,蛋白回收率计算如公式(1)所示:
蛋白回收率![]()
(1)
1.3.4 感官评价
本实验从对苦味、鲜味、咸味敏感的专业人员中筛选10名感官评价员(5名男性,5名女性)组成感官评价小组。味道评分采用5分制(0表示没有味道,3表示味道适中,5表示味道强烈)。将2 g大米蛋白肽粉溶解在100 mL水中,感官评价人员每次进行感官评价后,立即用清水漱口,以平均值作为最终感官评价得分[6]。
1.3.5 分子质量分布的测定
按照GB/T 22729—2008《海洋鱼低聚肽》的附录A[7]测定分子质量分布。
1.3.6 肽含量的测定
按照GB/T 22492—2008 《大豆肽粉》的附录B[8]测定肽含量。
1.3.7 游离氨基酸的检测
按照GB/T 22729—2008 《海洋鱼低聚肽》的游离氨基酸含量的测定方法[7]测定。
1.3.8 ACE抑制率的测定
参考文献[9-10]的方法测定ACE抑制率。
1.3.9 ACE抑制肽的结构初探
将大米蛋白肽送至生工生物工程(上海)股份有限公司,采用液相质谱-色谱联用进行氨基酸序列的测定。
2 结果与分析
2.1 大米蛋白的单酶水解
采用碱性蛋白酶、中性蛋白酶、蛋白酶A、蛋白酶B分别对大米蛋白进行酶解,蛋白回收率与感官评价得分见图1与图2。
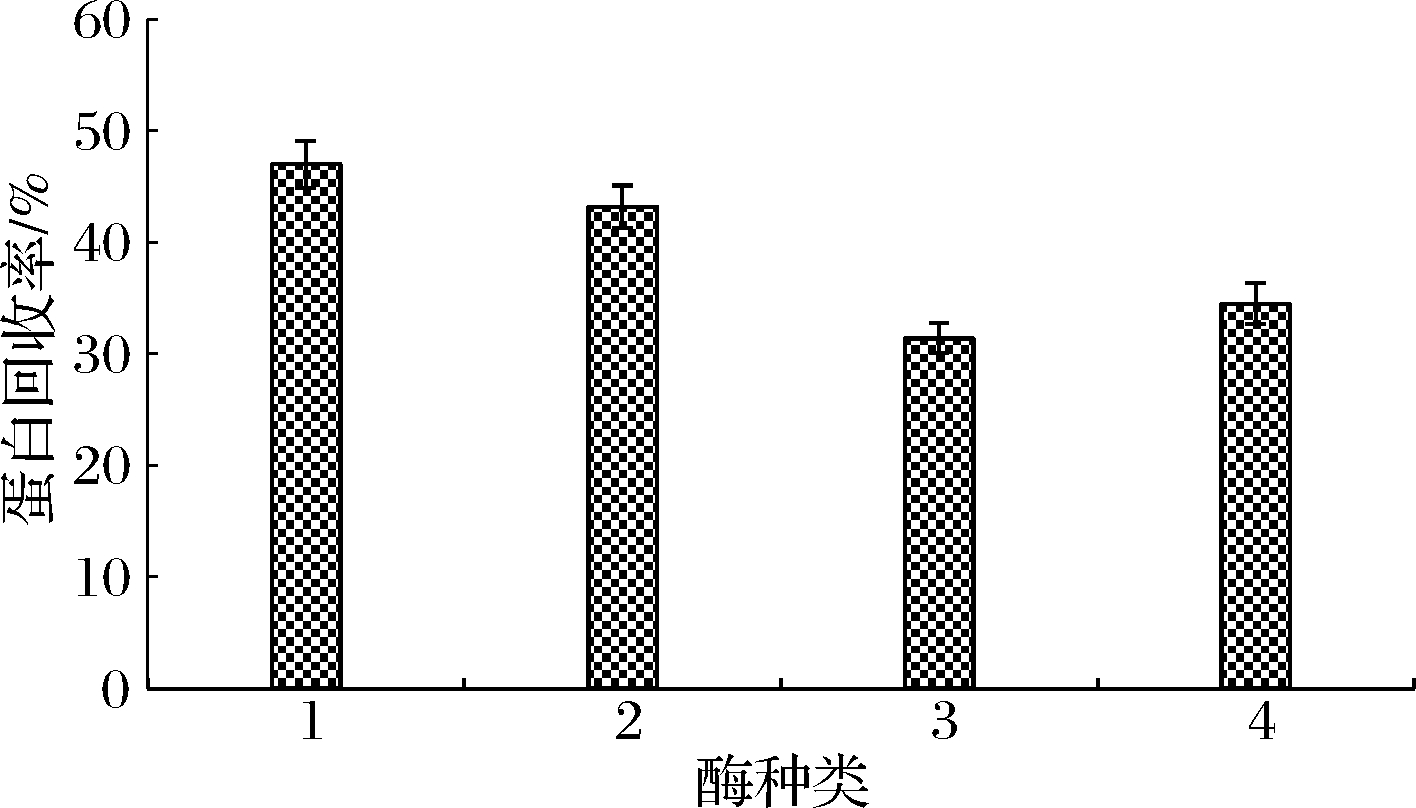
1-碱性蛋白酶;2-中性蛋白酶;3-蛋白酶A;4-蛋白酶B(下同)
图1 大米蛋白的单酶水解的蛋白回收率
Fig.1 The protein recovery of rice protein hydrolyzed by single enzyme
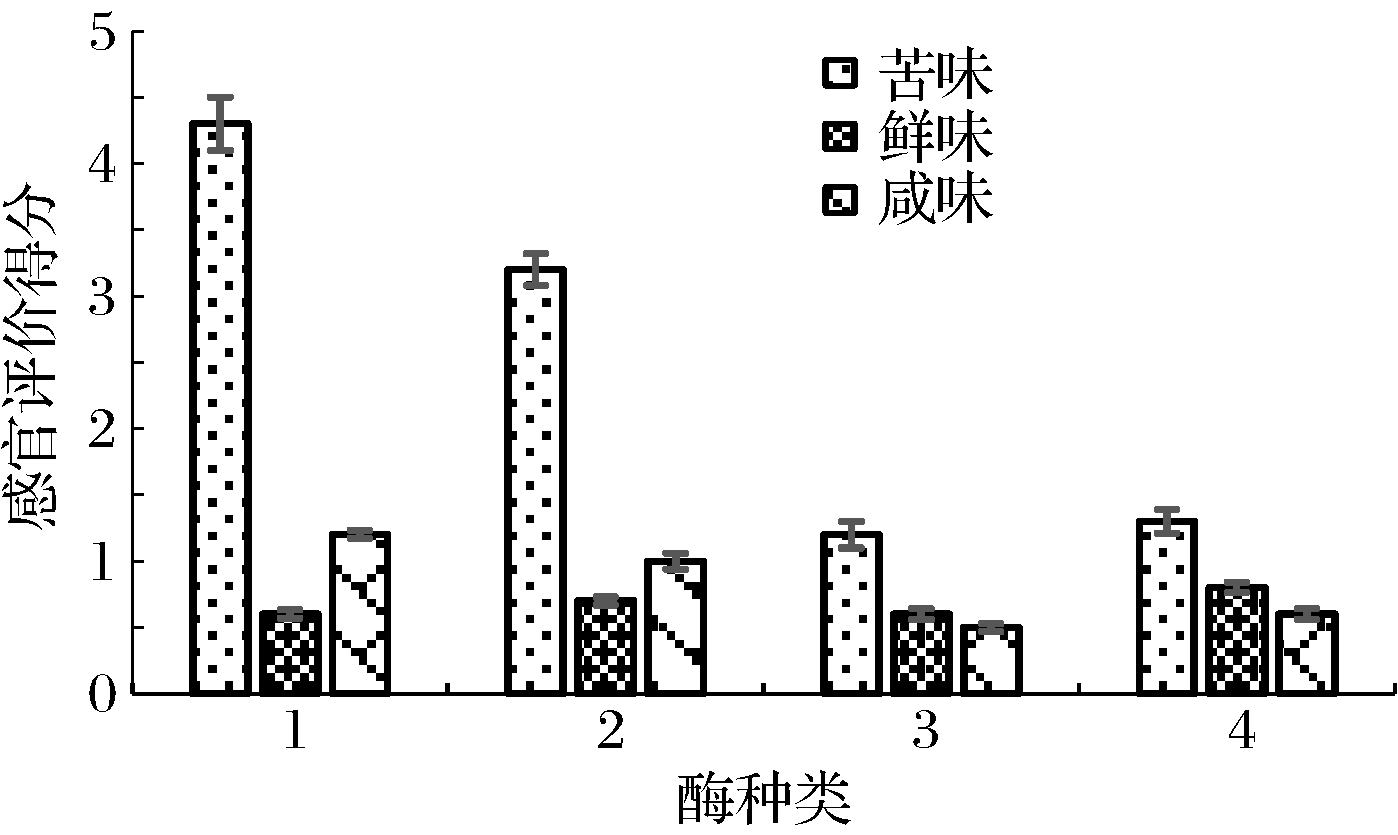
图2 大米蛋白的单酶水解感官评价
Fig.2 Sensory evaluation of single enzyme hydrolysis of rice protein
由图1、图2可知,利用碱性蛋白酶与中性蛋白酶水解大米蛋白,蛋白回收率较高,分别为47.0%和43.2%,但其感官评价中的苦味评分也较高,分别为4.3和3.2分,这与林洋等[11]酶解制备大豆小肽的结果一致。这可能是由于碱性蛋白酶与中性蛋白酶主要水解疏水性氨基酸的羧基以及亮氨酸、苯丙氨酸的氨基,同时由于大米蛋白中谷蛋白占比高达80%,其大量疏水基团暴露,产生苦味较重的小分子肽结构。蛋白酶A主要水解赖氨酸、精氨酸、苯丙氨酸的羧基,蛋白酶B主要水解赖氨酸、精氨酸、苯丙氨酸与酪氨酸的羧基,这2种蛋白酶产生相对较少的疏水性基团,苦味产生较少[12]。经过4种单酶酶解后,大米蛋白的鲜味基本一致,咸味略有差异。
2.2 大米蛋白的双酶水解
由前文可知,碱性蛋白酶与中性蛋白酶水解得到的大米蛋白肽收率高、苦味高,而蛋白酶A与蛋白酶B水解得到的大米蛋白肽口感明显柔和很多,故将碱性蛋白酶和中性蛋白酶与蛋白酶A和蛋白酶B酶进行1∶1复配,优化酶解结果[13]。
由图3、图4可知,采用复合酶对大米蛋白进行复合酶解,碱性蛋白酶与蛋白酶B复合酶解后,蛋白回收率最高,达到43.9%,同时苦味评分明显下降,为2.2,鲜味、咸味的评分没有明显的变化。

1-碱性蛋白酶+蛋白酶A;2-碱性蛋白酶+蛋白酶B;3-中性
蛋白酶+蛋白酶A;4-中性蛋白酶+蛋白酶B(下同)
图3 大米蛋白的双酶水解的蛋白回收率
Fig.3 The protein recovery of double enzymatic hydrolysis of rice protein
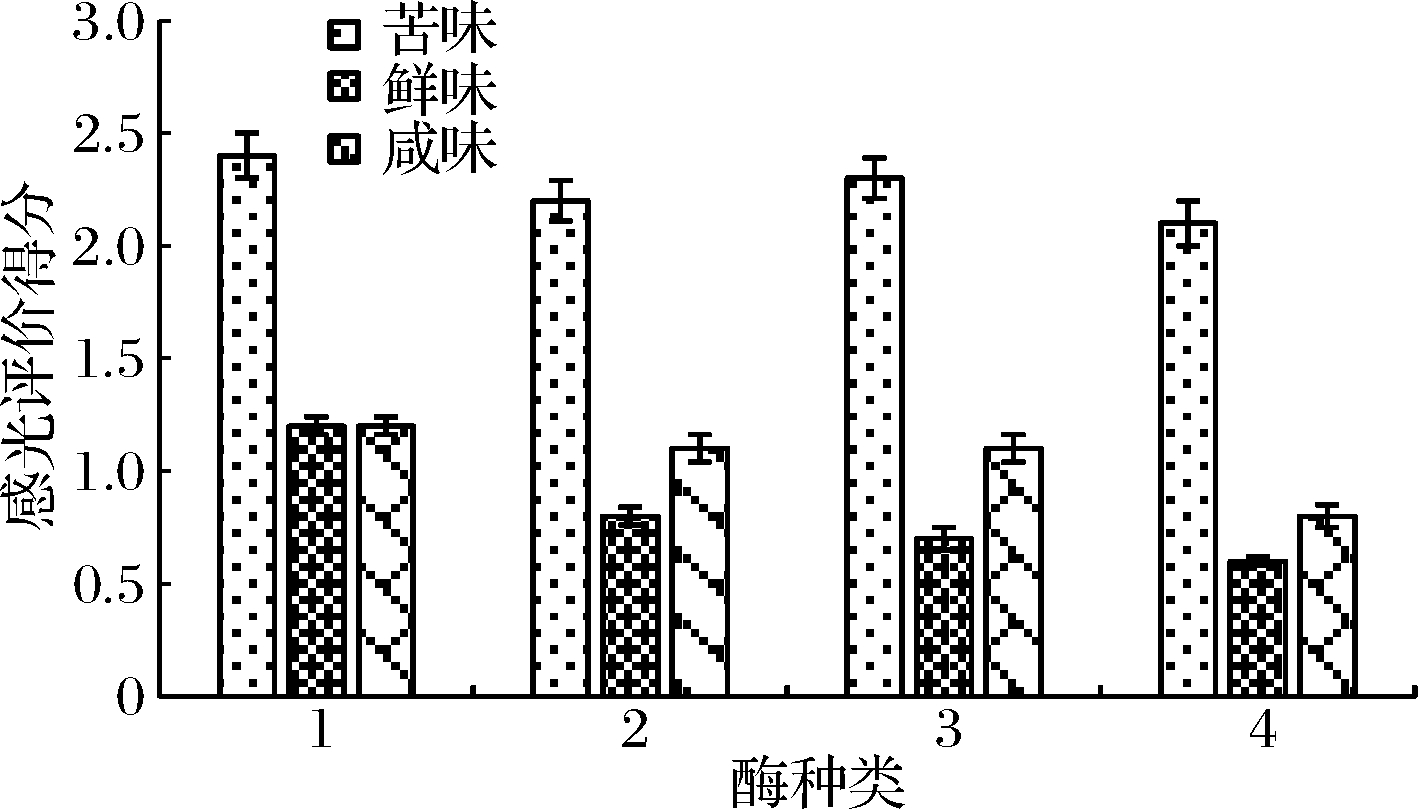
图4 大米蛋白的双酶水解的感官评价
Fig.4 Sensory evaluation of double enzymatic hydrolysis of rice protein
4种复合酶制备大米蛋白肽的分子质量分布见表1,碱性蛋白酶与蛋白酶B复合酶水解的肽分子最小,分子质量<1 000 Da的总和与分子质量<2 000 Da的总和均最高,这也与其酶解后蛋白回收率最高相对应。
表1 双酶水解的分子质量分布 单位:%
Table 1 Molecular weight distribution of double enzymatic hydrolysis of rice protein
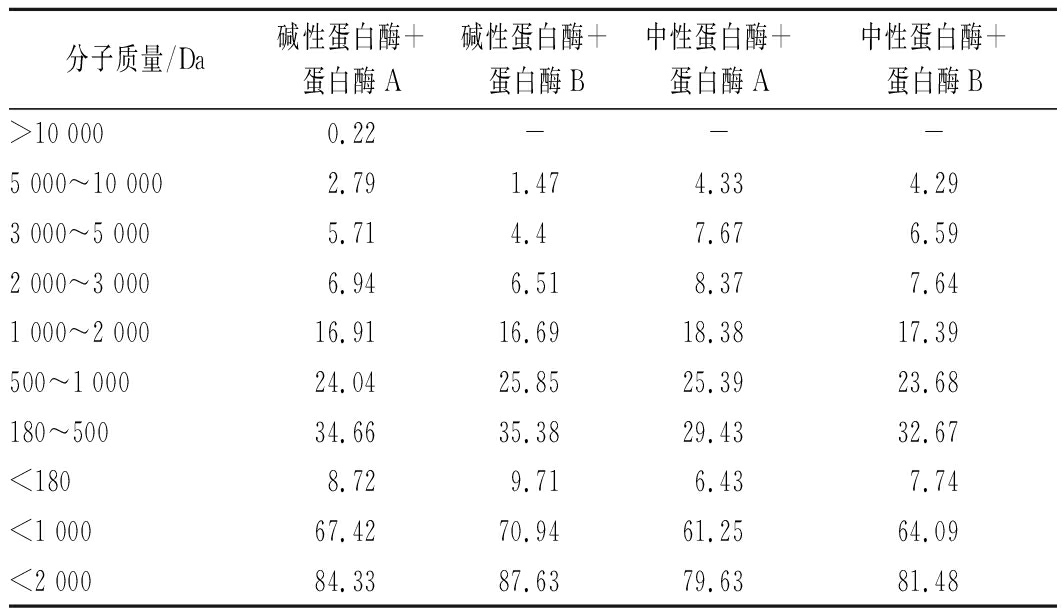
分子质量/Da碱性蛋白酶+蛋白酶A碱性蛋白酶+蛋白酶B中性蛋白酶+蛋白酶A中性蛋白酶+蛋白酶B>10 0000.22---5 000~10 0002.791.474.334.293 000~5 0005.714.47.676.592 000~3 0006.946.518.377.641 000~2 00016.9116.6918.3817.39500~1 00024.0425.8525.3923.68180~50034.6635.3829.4332.67<1808.729.716.437.74<1 00067.4270.9461.2564.09<2 00084.3387.6379.6381.48
4种复合酶制备大米蛋白肽的肽含量和游离氨基酸含量结果见表2,碱性蛋白酶与蛋白酶B复合酶水解的肽含量最高,中性蛋白酶与蛋白酶B复合酶水解的肽含量最低,这与酶解后蛋白回收率相一致。4种复合酶水解后,游离氨基酸的含量相差不大且均较低,这表明4种酶组合均产生较少的游离氨基酸,水解后主要以肽的形式存在。
表2 双酶水解的肽含量与游离氨基酸含量 单位:%
Table 2 Content of peptide and free amino acid of double enzymatic hydrolysis of rice protein

含量碱性蛋白酶+蛋白酶A碱性蛋白酶+蛋白酶B中性蛋白酶+蛋白酶A中性蛋白酶+蛋白酶B肽78.3±0.5280.3±0.6177.8±0.3975.7±0.47游离氨基酸1.46±0.051.31±0.061.26±0.061.27±0.07
综合考虑蛋白回收率、感官评分、分子质量分布、肽含量及游离氨基酸的研究结果,为获得较高的蛋白回收率与肽含量、口感较好、分子质量较小的大米蛋白肽,选取碱性蛋白酶加蛋白酶B复合酶进行酶解。
2.3 三种蛋白肽的理化指标
采用上述酶解工艺对大米蛋白肽进行放大生产,制备得到大米蛋白肽粉。同时采购市售的大豆蛋白肽、鱼胶原蛋白肽,对这3种蛋白肽的水分、蛋白质、脂肪含量等指标进行检测,结果如表3所示。
表3 三种蛋白肽的理化指标 单位:%
Table 3 Physiochemical indexes of three protein peptides
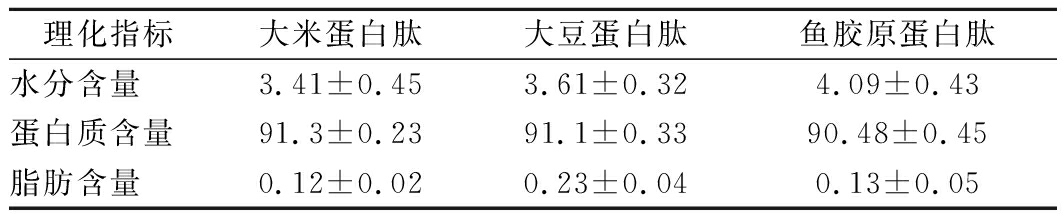
理化指标大米蛋白肽大豆蛋白肽鱼胶原蛋白肽水分含量3.41±0.453.61±0.324.09±0.43蛋白质含量91.3±0.2391.1±0.3390.48±0.45脂肪含量0.12±0.020.23±0.040.13±0.05
从表3可知,这3种蛋白肽的水分含量均<5%,蛋白质含量均>90%,脂肪含量均<1%,跟目前市面常见肽的指标一致。
2.4 三种蛋白肽的分子质量分布
对3种肽进行分子质量分布分析,结果见表4。大豆蛋白肽的分子质量分布最小,其分子质量<1 000 Da的总和最高,为73.14%,大米蛋白肽次之,而鱼胶原蛋白肽的分子质量分布最大。
表4 三种蛋白肽的分子质量分布 单位:%
Table 4 Molecular weight distribution of three protein peptides
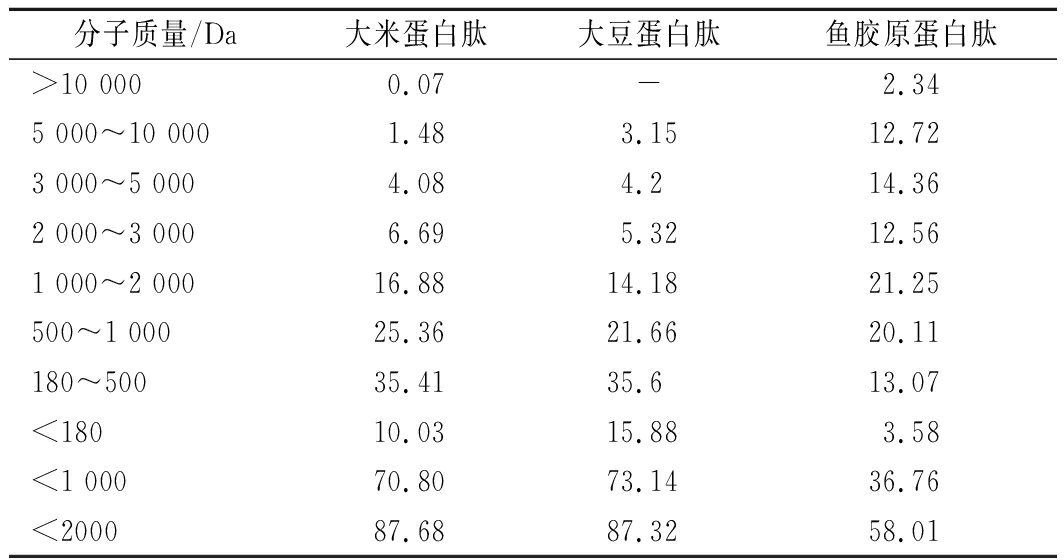
分子质量/Da大米蛋白肽大豆蛋白肽鱼胶原蛋白肽>10 0000.07-2.345 000~10 0001.483.1512.723 000~5 0004.084.214.362 000~3 0006.695.3212.561 000~2 00016.8814.1821.25500~1 00025.3621.6620.11180~50035.4135.613.07<18010.0315.883.58<1 00070.8073.1436.76<200087.6887.3258.01
分子质量<2 000 Da的总和,大米蛋白肽最高,大豆蛋白肽与之接近,鱼胶原蛋白肽最低。整体来看,大豆蛋白肽和大米蛋白肽的分子质量分布比较接近,而鱼胶原蛋白肽的分子质量分布均较高。
2.5 三种蛋白肽的ACE抑制活性对比
ACE在激肽释放酶-激肽系统中能使舒缓激肽失活,使激肽释放酶-激肽系统处于抑制状态,导致血管收缩占优势,血压升高。因此抑制ACE的活性是治疗高血压的重要途径之一[14]。3种蛋白肽的ACE抑制活性曲线见图5。
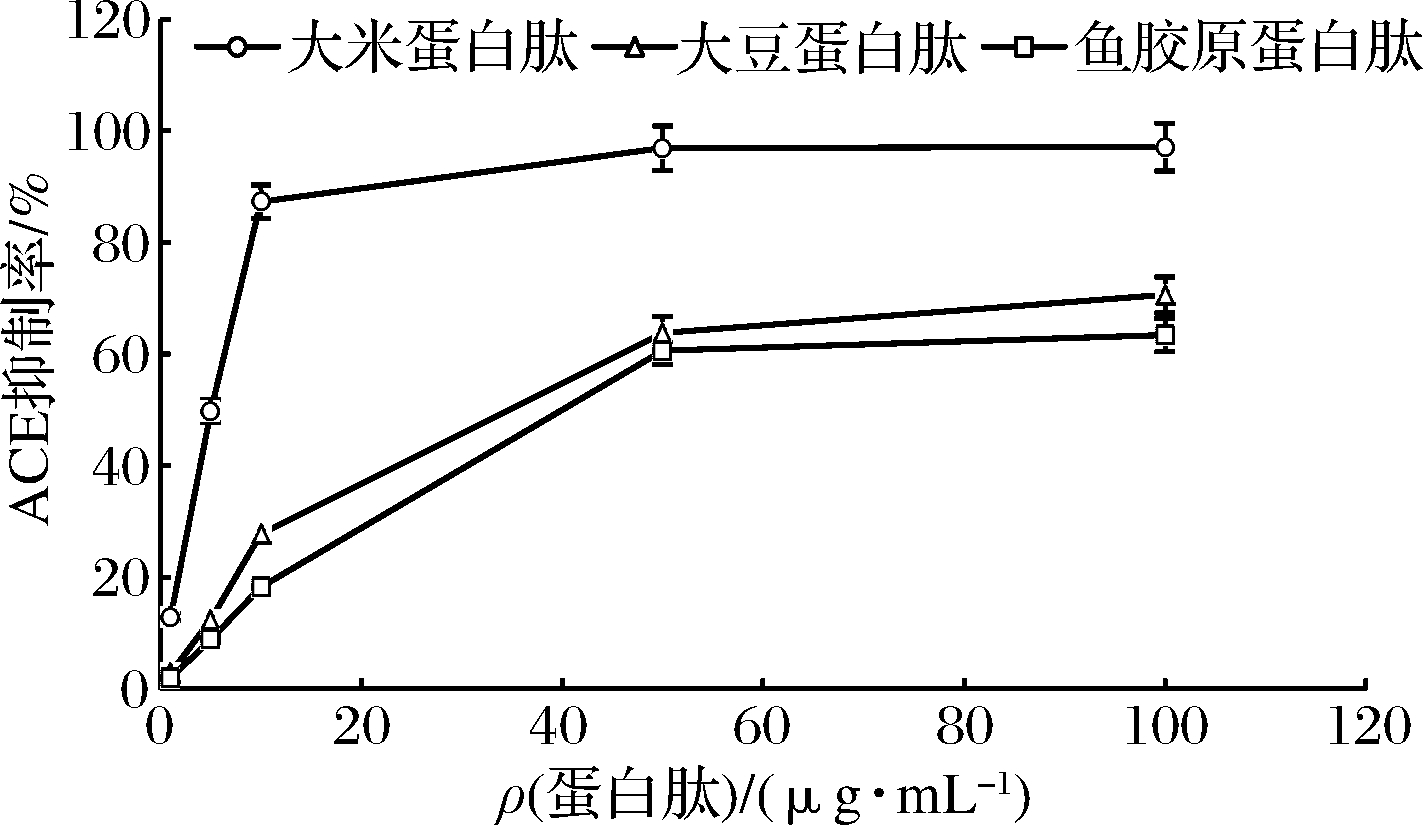
图5 三种蛋白肽的ACE抑制曲线
Fig.5 ACE inhibition curves of three protein peptides
如图5所示,3种蛋白肽对ACE的抑制活性均随质量浓度的增加而提高。大米蛋白肽在10 μg/mL时,其ACE抑制抑制活性达到87.33%,大豆蛋白肽和鱼胶原蛋白肽分别为27.80%和18.18%,这可能与蛋白来源有关。研究发现从酒糟或大米蛋白中酶解可获得具有较高ACE抑制活性的降血压活性肽,YOSHIYUKI等[15]水解酒糟大米蛋白,分离出9种具有ACE抑制活性的肽,包括Arg-Tyr与Ile-Tyr-Pro-Arg-Tyr。CHEN等[16]采用碱性蛋白酶水解大米蛋白,得到Val-Asn-Pro和Val-Trp-Pro两个ACE抑制活性肽段,其IC50分别为6.4 μmol/L和4.5 μmol/L。谯飞[17]将大米蛋白经过乳酸菌2-18、胃蛋白酶和菠萝蛋白酶水解后,肽的ACE抑制率达到(91.95±6.45)%,得到的活性片段为Val-Val-Phe-Phe-Ala-Ala-Ala-Leu。WANG等[18]以纳豆菌固态发酵豆粕,发酵产物经分离纯化,ACE抑制活性为84.1%,IC50值为0.022 mg/mL。刘文颖等[19]制备大豆低聚肽,得到4种ACE抑制肽段,分别为:Leu-Val-Arg,IC50=51.75 μmol/L;Leu-Tyr,IC50=305.76 μmol/L;Asp-Tyr-Arg,IC50=1 082.95 μmol/L;Asp-Phe,IC50=1 106.04 μmol/L。对5种食源性低聚肽进行ACE抑制活性对比发现,大豆低聚肽比海洋胶原低聚肽的ACE抑制活性高[20]。杨敏[4]将中性蛋白酶制备的鲽鱼鱼皮胶原蛋白肽进行分离纯化,分子质量为300~1 000 Da的寡肽组分的ACE抑制率最高,达72.67%,IC50值为1.72 mg/mL。
如表5所示,大米蛋白肽、大豆蛋白肽、鱼胶原蛋白肽的IC50分别为4.97、23.01和35.14 μg/mL,与其ACE抑制活性成反比,与上述的部分研究趋势一致,但IC50浓度不完全一致,这可能与检测方法或产品生产制备方法不完全一致有关。大米蛋白肽的ACE抑制活性最高,这可能是由于大米蛋白含有较多的ACE抑制活性片段,经过一系列的酶解反应与处理后,能获得更多具有ACE抑制活性的大米蛋白肽结构片段。周亚丽[21]测定的阳性对照品卡托普利IC50为1.48 ng/mL,与其相比,这3种食源性蛋白肽的ACE抑制活性较低,但是这3种蛋白肽均来自天然的动植物蛋白质,具有较高的安全性,作用温和,可以减少或避免化学合成药物对人体产生的不良反应,满足人体健康需要,可长期食用。
表5 ACE抑制率拟合曲线
Table 5 ACE inhibition rate fitting curve

2.6 大米蛋白肽中ACE抑制肽段的结构初探
对大米蛋白肽进行结构分析,结果见表6。
表6 大米蛋白肽的结构分析
Table 6 Structural analysis of rice protein peptide

序号序列分子质量/Da1Cys-Gly-Lys3062Arg-Leu-Lys4153Ser-Leu-Ser-Phe4524Val-Lys-Phe-Leu-Ala576
如表6所示,获得2条三肽序列、1条四肽序列和1条五肽序列,分子质量在180~500 Da和500~1 000 Da之间,处于大米蛋白肽中分子质量分布最大的范围内。GUO等[22]研究发现ACE抑制肽C端有带正电的氨基酸如赖氨酸(Lys)时,具有较高的ACE抑制活性;ZHOU等[23]研究发现N端为支链氨基酸,C端含有Tyr、Trp、Phe或Pro的肽的ACE抑制活性更高,这与本文的研究结果相符合。
2.7 不同批次生产的大米蛋白肽的ACE抑制活性稳定性
对该大米蛋白肽的工艺进行中试和工厂放大生产后,取工厂连续生产的3个不同批次的大米蛋白肽样品进行ACE抑制活性的检测,研究该产品的ACE抑制活性稳定性,结果见表7。
表7 不同批次生产的大米蛋白肽的ACE抑制活性
Table 7 ACE inhibitory activities of rice protein peptides produced in different batches
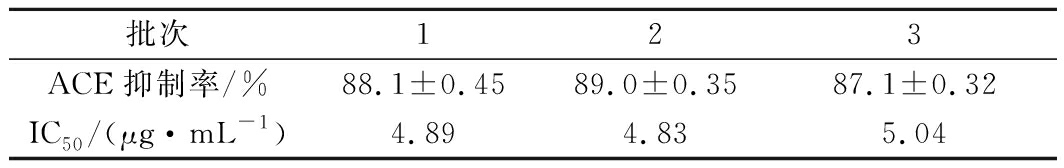
批次123ACE抑制率/%88.1±0.4589.0±0.3587.1±0.32IC50/(μg·mL-1)4.894.835.04
注:ACE抑制率是大米蛋白肽浓度为10 μg/mL时的检测结果
表7中,不同批次的大米蛋白肽的ACE抑制活性波动不大,ACE抑制率与IC50值基本保持稳定。这说明大米蛋白肽经过放大生产后,ACE抑制活性的稳定性较好,产品的稳定性较好,这也验证了前期的实验设计与工艺研究是合理的,可以实现工业化生产。
3 结论
优化大米蛋白肽的单酶水解与双酶酶解工艺,确定采用碱性蛋白酶加B酶复合酶解,制备的大米蛋白肽蛋白回收率较高,感官评价高、主要为分子质量较小(<2 000 Da)的低聚肽。将研制的大米蛋白肽与市售大豆蛋白肽、鱼胶原蛋白肽进行对比,3种蛋白肽的水分含量、蛋白质含量、脂肪含量基本一致。通过对比分析,大米蛋白肽与大豆蛋白肽中分子质量<2 000 Da的蛋白肽总和均大于80%,而鱼胶原蛋白肽仅有58.01%。以分子质量<1 000 Da的总和对比看,大豆蛋白肽与大米蛋白肽几乎是鱼胶原蛋白肽的2倍。对比3种蛋白肽均有ACE抑制活性,大米蛋白肽的效果最好,IC50最低,为4.97 μg/mL,仅为大豆蛋白肽IC50的21.6%,为鱼胶原蛋白肽IC50的14.1%。对大米蛋白肽的结构进行初步研究,得到4条肽段序列,与现有的ACE抑制肽构效关系研究相符合。经过放大多批次生产后,大米蛋白肽的ACE抑制活性稳定,产品稳定性较好,表明该工艺可以放大实现工业化生产。
[1] 饶胜其,降血压活性肽的筛选及其前体多肽的设计、克隆表达与活性鉴定[D].无锡:江南大学,2011.
RAO S Q, Screening of antihypertensive peptide and design, cloning,expression and activity identification of its precursor polypeptide[D].Wuxi:Jiangnan University,2011.
[2] 陈倩倩,佟立涛,钟葵,等,大米蛋白酶解物的ACE抑制活性研究[J].现代食品科技,2015,31(3):91-96.
CHEN Q Q,TONG L T,ZHONG K,et al,Angiotensin-converting enzyme inhibition by rice protein hydrolysate[J].Modern Food Science and Technology,2015,31(3):91-96.
[3] WANG R C,ZHAO H X,PAN X X,et al,Preparation of bioactive peptides with antidiabetic,antihypertensive,and antioxidant activities and identification of alpha-glucosidase inhibitory peptides from soy protein[J].Food Science & Nutrition,2019,7(5):1 848-1 856.
[4] 杨敏.鲽(Paralichthys olivaceus)鱼皮胶原蛋白肽的制备及ACE活性研究[D].大连:大连海洋大学,2018.
YANG M.Research of preparation of flounder (Paralichthys olivaceus)skin collagen peptide and ACE activity[D].Dalian:Dalian Ocean University,2018.
[5] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB/T 5009.5—2016 食品中蛋白质的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission of the People’s Republic of China,China Food and Drug Administration.GB/T 5009.5—2016 Determination of protein in food [S].Beijing:China Standards Press,2016.
[6] 陈瑞霞,孙思远,相悦,等.以淘汰蛋鸡为原料利用蛋白酶解技术制备咸味增强肽[J].食品与发酵工业,2020,46(1):166-171.
CHEN R X,SUN S Y,XIANG Y,et al.Optimization of enzymatic hydrolysis for rejected hen protein for salt-enhanced peptides preparation[J].Food And Fermentation Industries,2020,46(1):166-171.
[7] 中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会.GB/T 22729—2008 海洋鱼低聚肽[S].北京:中国标准出版社,2008.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.China National Standardization Administration Committee.GB/T 22729—2008 Oligopeptides powder of marine fish [S].Beijing:China Standards Press,2008.
[8] 中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会.GB/T 22492—2008 大豆肽粉[S].北京:中国标准出版社,2008.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration Committee.GB/T 22492—2008 Soy peptides powder [S].Beijing:China Standards Press,2008.
[9] CUSHMAN D,CHEUNG H.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J].Biochemical pharmacology,1971,20(7):1 637-1 648.
[10] 虢力为,酶解米渣制备ACE抑制肽的工艺研究[D].长沙:湖南农业大学,2012.
GUO L W,The study of using rice residues to produce ACE peptide[D].Changsha:Hunan Agricultural University,2012.
[11] 林洋,刘再胜,汲全柱,等,酶解法制备大豆小肽的工艺研究[J].大豆科学,2016,35(5):824-829.
LIN Y,LIU Z S,JI Q Z,et al.Preparation process of soybean small-peptide by enzymatic hydrolysis[J].Soybean Science,2016,35(5):824-829.
[12] 刘欣.食品酶学[M].北京:中国轻工业出版社,2006.
LIU X.Food enzymology[M].Beijing:China Light Industry Press,2006.
[13] 许腾,卢聪,范海茹,等.酶解法制备豆粕水解肽工艺优化[J].核农学报,2019,33(9):1 783-1 788.
XU T,LU C,FAN H R,et al.Optimizing enzymatic hydrolysis conditions for the preparation of hydrolyzed peptides from soybean meal[J].Journal of Nuclear Agricultural Sciences,2019,33(9):1 783-1 788.
[14] 刘焕.大米ACE抑制肽的研究[D].无锡:江南大学,2005.
LIU H.The study of rice protein inhibitory[D].Wuxi:Jiangnan University,2005.
[15] YOSHIYUKI I,TAKAHASHI T,YAMADA T,et al.Properties of TCA-insoluble peptides in Kimoto (traditional seed mash for sake brewing) and conditions for liberation of the peptides from rice protein[J].Journal of Bioscience and Bioengineering,1999,88(5):531-535.
[16] CHEN J,LIU S,YE R,et al,Angiotensin-I converting enzyme (ACE) inhibitory tripeptides from rice protein hydrolysate:Purification and characterization[J].Journal of Functional Foods,2013,5(4):1 684-1 692.
[17] 谯飞.大米蛋白ACE抑制肽制备及其膜高效分离技术的研究[D].哈尔滨:哈尔滨工业大学,2016.
QIAO F.The preparation of rice protein ACE inhibitory peptides and the research on its effective separation by membrane technology[D].Harbin:Harbin Institute of Technology,2016.
[18] WANG H,ZHANG S,SUN Y,et al,ACE-Inhibitory peptide isolated from fermented soybean meal as functional food[J].International Journal of Food Engineering,2013,9(1):1-7.
[19] 刘文颖,陈亮,谷瑞增,等.中试规模酶解制备的大豆低聚肽中抗氧化肽和ACE抑制肽的分离和鉴定(英文)[J].现代食品科技,2017,33(9):147-158.
LIU W Y,CHEN L,GU R Z,et al,Antioxidative peptides and angiotensin I-converting enzyme inhibitory peptides oobtained from soybean by protease treatment at pilot scale[J].Modern Food Science and Technology,2017,33(9):147-158.
[20] 刘文颖,林峰,陈亮,等.食源性低聚肽的血管紧张素转化酶(ACE)抑制作用[J].食品科技,2016,41(2):9-13.
LIU W Y,LIN F,CHEN L,et al,Angiotensin I-converting enzyme(ACE)inhibitory activity of food-origin oligopeptides[J].Food Science and Technology,2016,41(2):9-13.
[21] 周亚丽,魔芋ACE抑制肽分离纯化及体外降血压活性研究[D].西安:陕西科技大学,2017.
ZHOU Y L.Study on separation and purification of ACE inhibitory peptides from konjac and its antihypertensive activity in vitro[D].Xian:Shaanxi University of Science and Technology,2017.
[22] GUO Y,JIANG X,XIONG B,et al,Production and transepithelial transportation of angiotensin-I-converting enzyme (ACE)-inhibitory peptides from whey protein hydrolyzed by immobilized Lactobacillus helveticus proteinase[J].Journal of Dairy Science,2019,102(2):961-975.
[23] ZHOU M,DU K,JI P,et al,Molecular mechanism of the interactions between inhibitory tripeptides and angiotensin-converting enzyme[J].Biophysical Chemistry,2012,168-169:60-66.