我国是柚子生产大国,年生产量达300万t以上,柚皮约占全果质量的40%,其总产量超过120万t[1],大部分柚皮在加工和食用过程中只作为饲料或是废物丢弃[2],造成极大浪费,也易造成环境污染等问题。
目前,对柚皮的研究多集中在多糖、柚皮苷、膳食纤维等物质的提取以及利用方面。陈文娟等[3]采用碱浸提法对漳州血柚皮多糖进行提取工艺的优化,得出提取率为20.77%,通过猪油的抗氧化试验结果表明,血柚皮多糖能有效地清除掉猪油前6 d产生的自由基。刘袆帆等[4]优化超声波辅助浸提法提取金柚柚皮中的柚皮苷,并对其在体外水平及细胞水平的抗氧化能力进行分析,结果发现其提取率为(3.8±0.4)%,且能有效保护红细胞免受 AAPH 自由基的攻击,降低红细胞的溶血率。王强等[5]研究柚皮膳食纤维不同处理方式对高脂日粮大鼠抑制体质量和调节血脂等功能的影响,试验表明经挤压膨化后的超微粉碎柚皮膳食纤维可降低鼠血清中总胆固醇含量及动脉硬化指数,且高剂量柚皮膳食纤维具有良好的润肠通便和调节血脂作用。
植物源活性蛋白具有抗氧化、抗肿瘤、免疫调节等生物活性,而且对人体的毒副作用小,是一种潜在的保健食品和药物资源。王玉贤等[6]发现冬虫夏草蛋白提取物可显著促进正常巨噬细胞中TNF-α,IL-1,IL-12的分泌。此外,CHANG等[7]从茯苓中分离出具有免疫调节活性的蛋白PCP(3.6 kDa),可刺激巨噬细胞产生大量细胞因子,以提高免疫调节作用。柚子中含有的可溶性蛋白含量为11%以上,是一种良好的蛋白质资源,因此,本试验从柚皮中分级提取蛋白并对其结构特点和体外免疫活性进行系统研究,旨在提高柚皮的附加值,并为柚子精深加工以及柚皮研究提供理论基础。
1 材料与方法
1.1 材料与试剂
金柚购于广州市场;小鼠IL-6 ELISA试剂盒、小鼠TNF-α ELISA试剂盒,欣博生物科技有限公司;NO试剂盒,南京建成生物工程研究所;氨基酸标准品,美国Sigma公司;考马斯亮蓝G-250、牛血清白蛋白,上海伯奥生物;NaCl、NaOH、盐酸、无水乙醇均为国产分析纯。
1.2 仪器与设备
Infinite M1000 Pro 酶标仪,美国Thermo公司;Academic A10超纯水系统,Millipore公司;Vector33型傅里叶变换红外光谱仪,德国Bruck公司;PHS-3C型雷磁精密酸度计,上海精密科学仪器有限公司;5424R高速冷冻离心机,德国Eppendorf公司;Supra55扫描电镜,德国Zeiss公司;XY-FD-100F真空冷冻干燥机,上海欣渝仪器有限公司;1100型氨基酸自动分析仪,美国安捷伦公司。
1.3 实验方法
1.3.1 柚皮蛋白的提取
采用改良Osborne法[8]并略加修改。对柚皮中的清蛋白、球蛋白、醇溶蛋白和谷蛋白进行分级提取。
将柚皮放入烘箱中烘干后粉碎并过筛,取50 g柚皮粉于烧杯中,加入15倍去离子水(球蛋白、醇溶蛋白和谷蛋白分别加入12倍体积的20 g/L NaCl溶液、14倍体积体积分数为65%乙醇溶液和14倍体积的去离子水),调pH为11.0,50 ℃水浴1.5 h后离心,得到残渣用于测定残余蛋白含量,上清液用 0.1 mol/L HCl溶液调节 pH为7.0,50 ℃水浴0.5 h后离心,静置沉淀后离心分离,得到上清液和不溶物,将上清液调节至清蛋白等电点,静置沉淀,离心后得到的固形物用纯净水洗涤,冷冻干燥后得到清蛋白。球蛋白、醇溶蛋白和谷蛋白的提取方法同上。
1.3.2 蛋白提取率
采用考马斯亮蓝法测定蛋白质含量,并按公式(1)计算蛋白的提取率:
蛋白质提取率![]()
(1)
1.3.3 扫描电镜分析
参考SEILER[9]的方法对样品进行处理:将蛋白过100目筛,取筛下物用双面胶黏在样品座上;将样品座置于离子溅射仪中,在样品表面蒸镀1层10~20 nm厚的铂金膜,调节电镜至不同的放大倍数,观察并拍摄照片。
1.3.4 红外光谱分析
分别精密称取2 mg干燥柚皮蛋白与100 mg KBr 粉末混合,研磨均匀后压片处理。放入红外光谱仪中在400~4 000 cm-1之间扫描,用Nexus系统软件对采集图谱进行分析[10]。
1.3.5 氨基酸组成分析
参考LIU等[11]的方法测定柚皮蛋白的氨基酸组成并稍作修改,外标采用16个氨基酸标准品,并使用氨基酸分析仪对蛋白进行氨基酸组成分析。
1.3.6 柚皮中各蛋白的细胞免疫活性
1.3.6.1 RAW 264.7 细胞的培养
从液氮罐中取一株冻存的 RAW 264.7 细胞,快速放入37 ℃水浴锅中晃动使细胞在短时间内解冻。然后迅速转移到15 mL无菌离心管中,加入含9 mL体积分数10% 胎牛血清和质量浓度10 g/L双抗(链霉素与青霉素混合液)的DMEM培养基,1 200×g离心10 min。除去上清液,加入新鲜的培养基,吹打细胞混匀,倒入培养皿,在37 ℃,含体积分数5%的CO2的培养箱中培养,每天更换新鲜培养基[12]。
1.3.6.2 细胞存活率
取对数生长期的细胞按每孔1×105的密度接种到96孔板中,培养24 h 后,吸去上清液,按蛋白质量浓度 50、200和 800 μg/mL 加药,培养24 h,每孔加入10 μL MTS,放入培养箱中反应 1~4 h,使用酶标仪于570 nm波长处测量其吸光度值[13],细胞存活率按公式(2)计算:
细胞存活率![]()
(2)
1.3.6.3 NO和细胞因子的测定
细胞培养24 h 后收集上清液,1 000 r/min 离心 20 min,取上清液,按蛋白质量浓度250、500 和 800 μg/mL 加药,以10 μg/mL 脂多糖(lipopolysaccharide,LPS)作对照,采用酶联免疫分析法(ELISA)检测 IL-6和TNF-α含量。具体操作步骤分别参考Griess 和 ELISA 说明书[12]。
LPS溶液制备:向装有10 mg LPS粉末的管中加入适量的磷酸缓冲盐溶液,充分溶解后稀释到10 mL,0.22 μm微孔滤头过滤除菌,配成1 μg/mL LPS 作为阳性对照[14]。
1.3.8 数据分析
数据以平均值±标准差表示,重复试验3次,用Origin 8.0以及SPSS 17.0 软件对分析数据作图,采用邓肯多重分析法进行差异显著分析(P<0.05),并使用MeV软件中的层次聚类[15]对氨基酸含量进行聚类分析。
2 结果与分析
2.1 蛋白的提取率
用改良Osborne法分级提取柚皮蛋白后,清蛋白、球蛋白、醇溶蛋白和谷蛋白的提取率为(15.47±0.17)%、(4.20±0.09)%、(0.18±0.02)%和(0.04±0.01)%,柚皮中的粗蛋白含量为21.14%,由于实验测得的谷蛋白提取率太低,因此暂不考虑其结构与免疫活性的研究。黎婕[16]在沙田柚的柚皮和果肉中测得的可溶性蛋白含量分别为11%和6%,与本试验中金柚果皮的蛋白含量相差不大。清蛋白和球蛋白的提取率远大于其他2种蛋白的原因可能是清蛋白与球蛋白在强碱条件下易溶解,而醇溶蛋白则易溶于一定浓度的乙醇溶液,谷蛋白提取率低可能是由于其在柚皮中的含量较少或是蛋白分子间存在大量作用能力强的二硫键使得蛋白难以分离[17],因此,清蛋白、球蛋白与醇溶蛋白是柚皮中的主要蛋白。
2.2 扫描电镜
将实验所提取的清蛋白、球蛋白和醇溶蛋白样品镀膜后用扫描电子显微镜在100倍下观察显微结构,其表面形态如图1所示,清蛋白(图1-a)的空间结构为片状,表面光滑;球蛋白(图1-b)表面呈现许多褶皱,局部隆起,表面粗糙,局部有孔,呈山脊状,连接紧密;醇溶蛋白(图1-c)的空间结构为不规则片状,分子间有条状结构连接,表面有较多孔,分子基团之间相连紧密,表面光滑。结构决定物质的功能,3种蛋白表面形状的不同可能是影响蛋白的生物活性以及功能性质的因素之一[18]。

图1 柚皮清蛋白(a)、球蛋白(b)和醇溶蛋白(c)的扫描电镜图
Fig.1 Scanning electron micrographs of pomelo peel albumin (a), globulin (b) and prolamin (c)
2.3 红外光谱分析
3种蛋白的红外图谱如图2所示,清蛋白(图2-a)在3 285和2 929 cm-1的吸收峰,是由—OH振动引起的,2 360与1 623 cm-1归属N—H弯曲振动,1 136和1 176 cm-1为C—N伸缩振动,说明有脂肪胺的存在,1 011、984、888及802 cm-1归属C—H面外弯曲振动。球蛋白(图2-b)在1516 cm-1处有吸收峰,说明其存在N—H官能团,在3 345 cm-1的吸收峰是由—OH伸缩振动引起的,在2 934、1 623、1 338、1 294、1 205、1 176与819 cm-1为C—H伸缩振动,球蛋白在1 036 cm-1有吸收峰,说明有C—O的存在。醇溶蛋白(图2-c)在3 310、1 519 cm-1的吸收峰均是由N—H伸缩振动引起的,在2 932和1 418 cm-1的吸收峰表明有-OH的存在,在1 601 cm-1的吸收峰归属为C![]() O伸缩振动,1 338、1 136、1 092、1 009、887、819与637 cm-1处的吸收峰均是由C—H弯曲振动引起的。清蛋白、球蛋白和醇溶蛋白都在氨基Ⅰ键1 600~1 700 cm-1的范围内有振动,主要是肽键C
O伸缩振动,1 338、1 136、1 092、1 009、887、819与637 cm-1处的吸收峰均是由C—H弯曲振动引起的。清蛋白、球蛋白和醇溶蛋白都在氨基Ⅰ键1 600~1 700 cm-1的范围内有振动,主要是肽键C![]() O的伸缩振动引起的,醇溶蛋白在氨基Ⅱ键1 500~1 600 cm-1的范围内有振动,主要是氨基中的C
O的伸缩振动引起的,醇溶蛋白在氨基Ⅱ键1 500~1 600 cm-1的范围内有振动,主要是氨基中的C![]() O的伸缩振动和N—H的弯曲振动引起的。3种蛋白在构象中只有在N—H、—OH和—CH的官能团处的构象发生变化,虽与周耸励[19]发现4种米糠蛋白组分在C
O的伸缩振动和N—H的弯曲振动引起的。3种蛋白在构象中只有在N—H、—OH和—CH的官能团处的构象发生变化,虽与周耸励[19]发现4种米糠蛋白组分在C![]() O的伸缩振动无太大差异,只是在—OH和C—H的官能团处的构象发生变化的结果有一定差异,但这可能是由原料和提取方法的不同造成的。
O的伸缩振动无太大差异,只是在—OH和C—H的官能团处的构象发生变化的结果有一定差异,但这可能是由原料和提取方法的不同造成的。
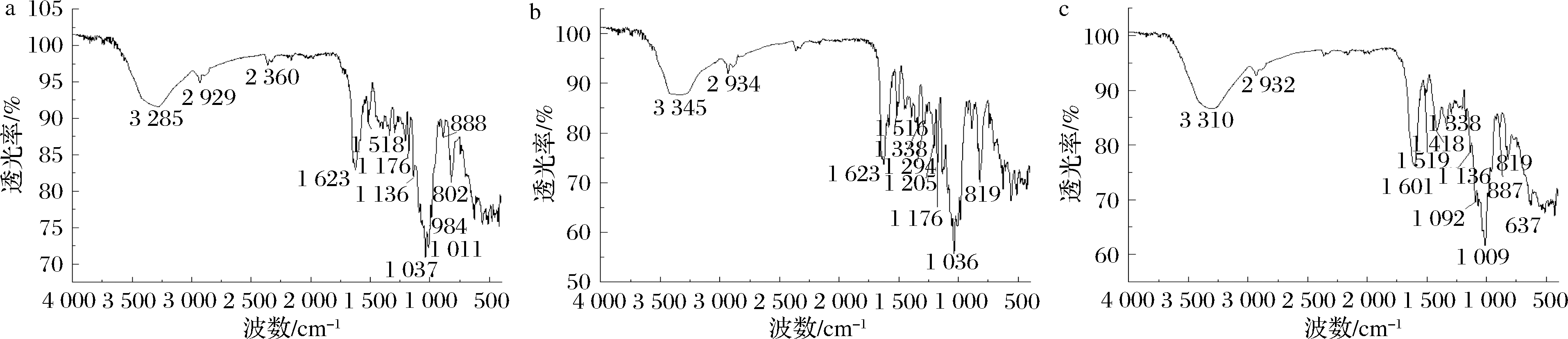
a-清蛋白;b-球蛋白;c-醇溶蛋白
图2 三种蛋白的红外扫描图
Fig.2 Infrared spectroscopic diagram of different proteins
2.4 氨基酸含量的聚类分析
柚皮中蛋白质氨基酸组分分析见表1。柚皮中清蛋白的必需氨基酸含量占比(essential amino acid/total amino acid,E/T)为13.21%,球蛋白的必需氨基酸含量占12.48%,醇溶蛋白的E/T值为15.13%。结果显示,柚皮含有丰富的甘氨酸(Gly)和丙氨酸(Ala),含量分别为125.49 g/100 g和50.48 g/100 g。甘氨酸属于甜味类氨基酸,甜度约为蔗糖的0.8倍,可在食品工业上充当甜味剂;丙氨酸也有特殊甜味、香味,与其他呈香味的物质混合使之显出更高级的香味,丙氨酸比蔗糖甜,甜度为甘氨酸的1.6倍,可广泛应用于食品行业中,而且在国外已被普遍用于营养强化和调味,而且丙氨酸是蛋白在脂类中溶解度高的疏水性氨基酸之一,能使蛋白中游离的氨基酸容易进入靶细胞从而发挥其生物活性[12]。
热图是最近几年被广泛应用的统计方法,可聚合大量数据,将结果以渐进色带直观展现出来,它的实质就是将有相似性质的对象用数学方法进行分类[20]。为进一步探究氨基酸组成与蛋白功能性质的关联性,对表1的氨基酸含量数据进行热图的聚类分析,结果见图3,颜色的深浅表示该蛋白中氨基酸的含量差别。从氨基酸含量来看,聚类比较明显,表明氨基酸含量存在较大的差异。聚类分析将16种氨基酸分为4类(图3-b、c),第一类(Gly和Ala)含量最高;第二类包含Glu、Arg、Asp、Pro,其中Glu与Arg含量较高,可能是影响蛋白功能特性的因素之一;第三类包含Met、Phe、Ile、His,这类氨基酸的含量最少;第四类包含Val、Tyr、Ser、Thr、Lys、Leu,此类氨基酸含量比第三类多。值得注意的是,如图3-a所示,球蛋白与清蛋白、醇溶蛋白的氨基酸总含量的差异较大,清蛋白与醇溶蛋白的氨基酸总含量相差不大,而除去第一类氨基酸后,球蛋白与清蛋白、醇溶蛋白的氨基酸总量差异较大,表明第一类氨基酸含量可能与蛋白的活性效果有关联。
表1 清蛋白、球蛋白和醇溶蛋白的氨基酸组成 单位:g/100 g
Table 1 Amino acid composition of albumin, globulin, prolamin
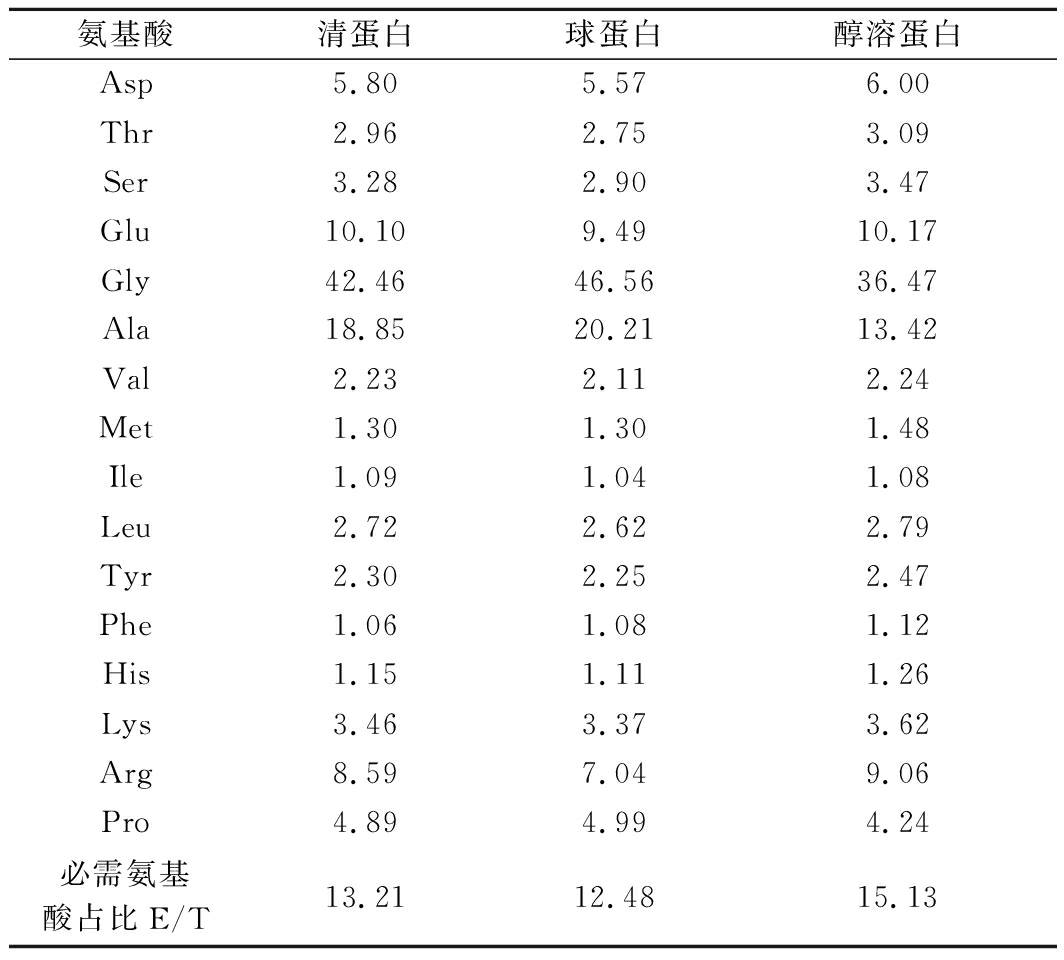
氨基酸清蛋白球蛋白醇溶蛋白Asp5.805.576.00Thr2.962.753.09Ser3.282.903.47Glu10.109.4910.17Gly42.4646.5636.47Ala18.8520.2113.42Val2.232.112.24Met1.301.301.48Ile1.091.041.08Leu2.722.622.79Tyr2.302.252.47Phe1.061.081.12His1.151.111.26Lys3.463.373.62Arg8.597.049.06Pro4.894.994.24必需氨基酸占比E/T13.2112.4815.13
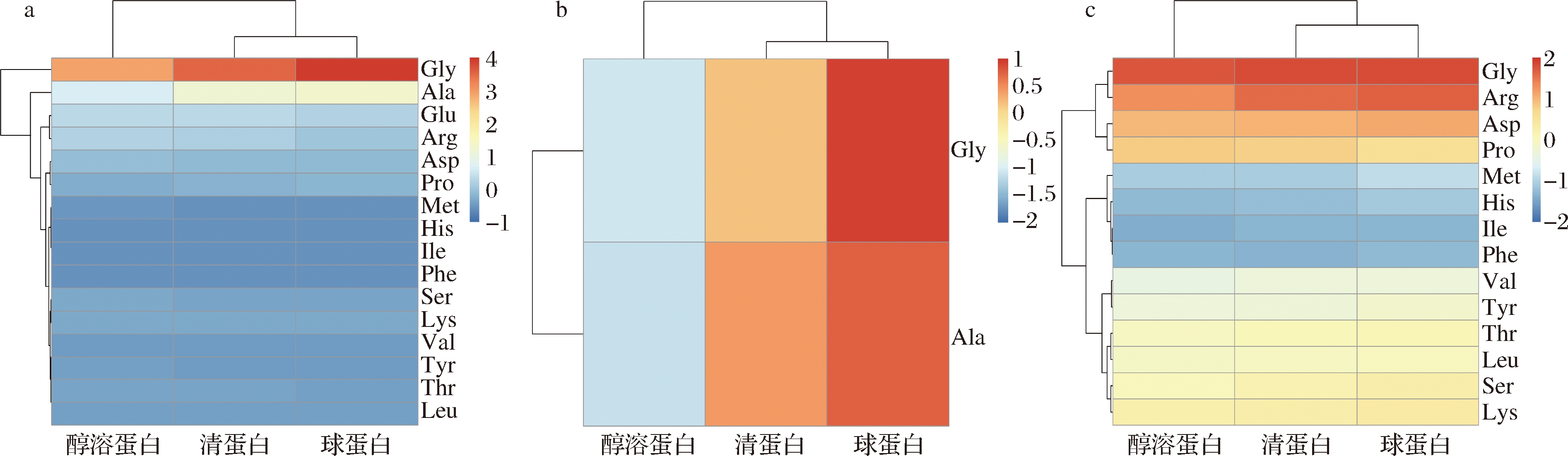
a-氨基酸含量的聚类分析图;b-第一类氨基酸的聚类分析图;c-第二、三、四类氨基酸的聚类分析图
图3 三种蛋白的氨基酸含量的聚类分析
Fig.3 Heatmap of amino acid composition
2.5 蛋白的细胞免疫活性
2.5.1 对RAW 264.7细胞存活率的影响
MTT法是通过脱氢酶的酶活反映细胞活力及数量,在细胞的增殖分化与代谢中有较多的应用[21]。图4-a可知,质量浓度为50~800 μg/mL的柚皮蛋白对小鼠巨噬细胞RAW 264.7 的存活率均在80%~110%之间,毒副作用较小,说明50~800 μg/mL的柚皮蛋白溶液可用于后续的免疫性评价试验。
2.5.2 三种蛋白对 RAW 264.7 细胞产NO能力的影响
由图4-b可知,3种蛋白与空白组均有显著差异,质量浓度为250 μg/mL,清蛋白能显著提高巨噬细胞产NO的能力(P<0.05);在500 μg/mL时,球蛋白与醇溶蛋白的促进能力均有增强,而清蛋白能显著提高RAW 264.7 细胞产NO的能力,浓度为92.71 μmol/L;质量浓度为800 μmol/L时,3种蛋白均能提高小鼠巨噬细胞产NO的能力,其中清蛋白的表现力最好,NO浓度为95.46 μmol/L。
2.5.3 三种蛋白对 RAW 264.7 细胞产细胞因子能力的影响
细胞因子是介导抗体免疫应答和炎症反应的物质,TNF-α是由巨噬细胞产生的能杀伤肿瘤细胞和促进B淋巴细胞增生的细胞因子,对肿瘤有抑制或直接溶解的作用[22]。
由图4-c可知,在刺激细胞分泌细胞因子TNF-α方面,与空白相比,3种蛋白均能显著提高RAW 264.7 细胞产TNF-α的能力(P<0.05),其中在50 μg/mL时,清蛋白的促进能力最佳;在200 μg/mL时,清蛋白与球蛋白均能提高刺激小鼠巨噬细胞分泌TNF-α的能力,其中球蛋白促进能力最强;在800 μg/mL时,清蛋白可刺激巨噬细胞产TNF-α的能力,球蛋白次之,TNF-α浓度分别为9 528.05和9 034.34 pg/mL。
由图4-d看出,在质量浓度50 μg/mL时,3种蛋白提高巨噬细胞产IL-6的能力均显著高于空白组;在200 μg/mL时,球蛋白刺激RAW 264.7细胞产生IL-6的能力显著高于清蛋白与醇溶蛋白;在800 μg/mL时,清蛋白能显著提高RAW 264.7细胞产生IL-6的能力,IL-6质量浓度为1 769.33 pg/mL。综上所述,清蛋白的免疫活性最强,球蛋白的活性次之。
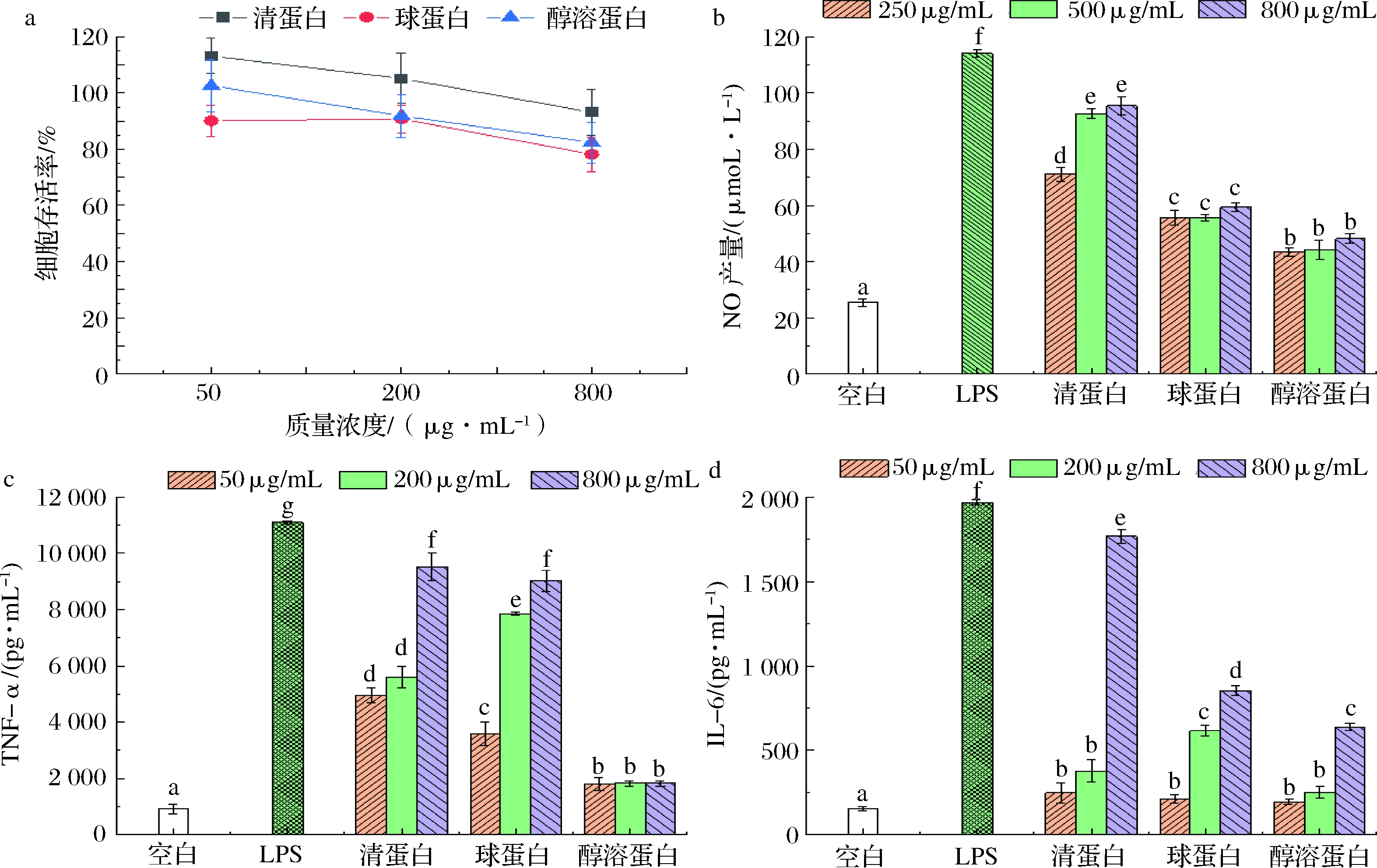
a-细胞存活率;b-NO产生量;c-TNF-α产生量;d-IL-6产生量
图4 清蛋白、球蛋白和醇溶蛋白的免疫活性
Fig.4 Immunomodulatory activities of albumin, globulin and prolamin
注:不同字母表示样品间具有显著性差异(P<0.05)
3 结论
采用改良Osborne法对柚皮蛋白进行提取,其中清蛋白、球蛋白、醇溶蛋白和谷蛋白含量分别为(15.47±0.17)%、(4.20±0.09)%、(0.18±0.02)%和 (0.04±0.01)%。通过结构分析,清蛋白表面结构为片状,球蛋白为紧密的孔状结构,醇溶蛋白表面为条状相连的片状,而且发现柚皮蛋白主要由甘氨酸(125.49 g/100 g)和丙氨酸(50.48 g/100 g)组成。由蛋白的免疫活性得知,清蛋白在800 μg/mL时刺激RAW 264.7 细胞产生NO的含量及细胞因子(TNF-α和IL-6)的能力最强,NO、TNF-α和IL-6的浓度分别为95.46 μmol/L,9 528.05 pg/mL和1 769.33 pg/mL。
综上所述,清蛋白含量最多,其必需氨基酸含量略低于醇溶蛋白,但细胞免疫活性最强,是一种良好的植物源免疫蛋白,在保健食品及医药领域可对其进行开发利用。
[1] 刘顺枝,江学斌,江月玲,等.柚类果实提取物生理功能及综合利用研究进展[J].食品科学,2012,33(13):280-286.
LIU S Z,JIANG X B,JIANG Y L,et al.Research advance in physiological function of fruit extract and comprehensive utilization of pomelo fruits[J].Food Science,2012,33(13):280-286.
[2] 林荣琴, 刘裕梅,林坤,等.梅县区石扇镇金柚特色农业产业集群的培育[J].嘉应学院学报,2018,36(8):85-91.
LIN R Q,LIU Y M,LIN K,et al.Cultivation of characteristic agricultural industrial clusters of Jinyou in Shishan town,Meixian district[J].Journal of Jiaying University,2018,36(8):85-91.
[3] 陈文娟, 陈建福.血柚皮多糖的碱法提取及其抗氧化活性研究[J].中央民族大学学报(自然科学版),2014,23(3):22-27;32.
CHEN W J,CHEN J F.Study on alkali extracting technology and anti-oxidant activity of polysaccharides from blood pummelo peel[J].Journal of Minzu University of China(Natural Sciences Edition),2014,23(3):22-27;32.
[4] 刘袆帆, 梁嘉熹,王琴.超声波辅助提取金柚柚皮中柚皮苷的工艺优化及其抗氧化能力研究[J].食品研究与开发,2019,40(13):156-163.
LIU H F,LIANG J X,WANG Q.Study on extraction of naringin from pomelo peel by ultrasound-assisted and its antioxidant ability[J].Food Research and Development,2019,40(13):156-163.
[5] 王强, 赵欣.柚皮膳食纤维对高脂日粮大鼠血脂调节的影响[J].食品科学,2013,34(15):277-280.
WANG Q,ZHAO X.Regulatory effect of dietary fiber from Citrus maxima peel on blood lipids in rats[J].Food Science,2013,34(15):277-280.
[6] 王玉贤, 王艺璇,陈蓉,等.冬虫夏草蛋白提取物抗A549肺癌细胞及免疫活性分析[J].中国实验方剂学杂志,2018,24(1):79-84.
WANG Y X,WANG Y X,CHEN R,et al.Effect of protein extracts of cordyceps on growth of A549 cells and immune activity of mouse peritoneal macrophages in vitro[J].Chinese Journal of Experimental Traditional Medical Formulae,2018,24(1):79-84.
[7] CHAGN H H,YEH C H,SHEU F.A novel immunomodulatory protein from Poria cocos induces toll-like receptor 4-dependent activation within mouse peritoneal macrophages[J].J Agric Food Chem,2009,57(14):6 129-6 139.
[8] 孙媛. 改良Osborne法分级分离四种小麦蛋白的研究[D].广州:华南理工大学,2015.
SUN Y.Modification of Osborne method for firactionation of four wheat bran proteins[D].Guangzhou:South China University of Technology,2015.
[9] SEILER H.Secondary electron emission in the scanning electron microscope[J].Journal of Applied Physics,1983,54(11):R1-R18.
[10] 于志鹏. 蛋清源活性肽的结构鉴定及生物活性研究[D].长春:吉林大学,2014.
XU Z P.Characterization and biological activity of bioactive peptides from egg white protein[D].Changchun:Jilin University,2014.
[11] LIU H F,WU H,WANG Q,et al.The variations,Including structures and attenuation to hemolysis,of peptide purified from dendrobium aphyllum during in vitro gastro-intestinal digestion and caco-2 uptake and transportation[J].Int J Pept Res Ther,2019,25(4):1 319-1 331.
[12] 武文佳. 小麦胚芽蛋白的免疫活性评价及球蛋白免疫活性肽的结构鉴定与机理研究[D].广州:华南理工大学,2017.
WU W J.Evaluation of immunomodulating activities in wheat germ protein,characterization and mechanism of immunomodulatory peptide in globulin[D].Guangzhou:South China University of Technology,2017.
[13] 王琴, 梁嘉熹,吴晖,等.基于Caco-2单层细胞模型的兜唇石斛多糖的转运机制研究[J].现代食品科技,2019,35(5):115.
WANG Q,LIANG J X,WU H,et al.The transport mechanism of polysaccharides from Dendrobium aphyllum studied using a caco-2 cell monolayer nodel[J].Modern Food Science and Technology,2019,35(5):115.
[14] 曹靖文, 黄占旺,吴少福,等.纳豆菌糖肽对RAW 264.7巨噬细胞的免疫调节作用[J].现代食品科技,2015,31(9):61-67.
CAO J W,HUANG Z W,WU S F,et al.Immunomodulatory effects of bacillus natto glycopeptides on RAW264.7 macrophages[J].Modern Food Science and Technology,2015,31(9):61-67.
[15] JOHNSON S C.Hierarchical clustering schemes[J].Psychometrika,1967,32(3):241-254.
[16] 黎婕. 柚子加工过程的褐变研究[D].广州:华南理工大学,2014.
LI J.Study on processing of pomelo browning[D].Guangzhou:South China University of Technology,2014.
[17] HAMADA J S.Characterization of protein fractions of rice bran to devise effective methods of protein solubilization[J].Cereal Chemistry,1997,74(5):662-668.
[18] 李婷, 彭宇宁,李强,等.4种花生蛋白的分级提取及其结构的扫描电镜观察[J].食品科学技术学报,2015,33(3):35-42.
LI T,PENG Y N,LI Q,et al.Study on extraction and structure of four kinds of peanut proteins[J].Journal of Food Science and Technology,2015,33(3):35-42.
[19] 周耸励.米糠蛋白的分级提取、结构及功能性质研究[D].沈阳:沈阳师范大学,2019.
ZHOU SL.Study on fractional extraction,structure and functional properties of rice bran protein[D].Shenyang:Shenyang Normal University,2019.
[20] 王颖, 田应金,蒋伟,等.基于热图和聚类分析的马铃薯矿质元素含量评价[J].分子植物育种,2019,17(19):6 483-6 488.
WANG Y,TIAN Y J,JIANG W,et al.Evaluation of potato mineral element content based on heatmap and cluster analysis[J].Molecular Plant Breeding,2019,17(19):6 483-6 488.
[21] 白生宾,陈红香,钟近洁,等.MTT法检测RAW264.7细胞活力及可能因素分析[J].中国现代医学杂志,2011,21(23):2 831-2 833.
BAI S B,CHEN H X,ZHONG J J,et al.RAW264.7 cell viability via MTT assay and possible factor analysis[J].China Journal of Modern Medicine,2011,21(23):2 831-2 833.
[22] 赖长华. 共轭亚油酸对断奶仔猪免疫应激的调控[D].北京:中国农业大学,2005.
LAI CH.Modulation of conjugated linoleic acid on immunological stress of weaned pigs[D].Beijing:China Agricultural University,2015.