酱油酿造工艺主要有低盐固态和高盐稀态两种[1-2]。高盐稀态酱油由于发酵周期较长,成品酱香醇厚,其产品品质优于低盐固态发酵酱油[3-5]。一般参与高盐稀态酱油酿造的微生物主要有米曲霉、酵母菌和乳酸菌3大类[6-8]。米曲霉最直接的作用就是在酱油发酵过程中分泌大量酶系,对原料中的蛋白质分解具有重要作用,我国目前酱油生产常用的菌株是沪酿3.042[9-10]。在酱醪发酵阶段,鲁氏接合酵母(Zygosaccharomyces rouxii)是主要的产醇酵母菌,球拟酵母(Torulopsis halophilus)[11-12]是主要的产酯酵母菌。将鲁氏接合酵母应用于酱油发酵过程中能增加酱油的醇香,对酱油风味的形成起着重要的作用。
鲁氏接合酵母具有较强的耐盐能力,是酱油发酵过程中醇类物质的主要代谢者,在代谢产生大量的高级醇、芳香杂醇类物质的同时,还能将糖类物质转化为多元醇和糖醇类物质[13-14]。HAUCK等[15]研究显示鲁氏接合酵母代谢产生的乙醇、高级醇等物质对酱油的风味起到至关重要的作用。
虽然鲁氏接合酵母作为传统菌种用于酱油发酵已有较长的历史,但对于鲁氏接合酵母自身的安全性研究却涉及较少,本研究通过探讨菌种在酱醪汁发酵中的代谢产物、胆盐羟化酶活性检测、溶血实验及耐药性实验对菌种本身的安全性进行初步探讨,从而为传统发酵菌株的安全性研究提供相关依据。
1 材料与方法
1.1 实验原料与培养基
氟康唑、两性霉素B、甲氧胺-吡啶、N-甲基-N-(三甲基硅烷)三氟乙酰胺(N-methyl-N-(trimethylsilyl)trifluoroacetamide,MSTFA)、甲醇、NaCl,北京索莱宝科技有限公司;牛黄脱氧胆酸钠,上海吉至生化科技有限公司;伏立康唑药敏纸片、酮康唑药敏纸片、酮康唑药敏纸片,北京普纳科技有限公司;制霉菌素药敏纸片、两性霉素B药敏纸片,杭州微生物试剂有限公司;所用培养基为酵母浸出粉胨葡萄糖(yeast extract peptone dextrase,YPD)液体培养基、YPD琼脂培养基和血琼脂平板培养基。
1.2 菌种来源
鲁氏接合酵母购自中国微生物菌种保藏中心,菌种编号为2.181,现由天津科技大学食品营养与安全国家重点实验室菌种保藏中心存放。
1.3 仪器设备
GCMS-QP 2010 Ultra气相色谱-质谱联用仪,日本岛津公司;MULTISKAN GO酶标仪,美瑞泰克科技(天津)有限公司。
1.4 实验方法
1.4.1 挥发性代谢物的测定分析
采用固相微萃取-气质联用的方法[16]。
1.4.2 非挥发性代谢物的测定分析
采用硅烷化-气质联用的方法[17]。
1.4.3 胆盐羟化酶活性实验
在100 mL YPD培养基中加入0.5 g牛黄脱氧胆酸钠,高压灭菌121℃,20min,倒入培养皿。鲁氏接合酵母接种在培养基上,30 ℃培养48 h,观察菌落周围是否存在白色沉淀。
1.4.4 溶血性实验
鲁氏接合酵母涂布在血平板培养基上,待吸收完全,30 ℃培养48 h,观察是否出现溶血现象。
1.4.5 耐药性实验
药敏实验:采用药敏纸片琼脂扩散法[18]进行测定。
最低抑菌浓度测定:参照美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standards,NCCLS)药敏实验方法[19-20]。
1.5 分析方法
利用SIMCA 14.1对数据进行分析;Origin作图分析。
2 结果与分析
2.1 鲁氏接合酵母代谢产物分析
2.1.1 挥发性代谢物的测定
鲁氏接合酵母是醇香型酵母,同时也能产生多种酯类、酸类物质,在酱油发酵中对于风味物质的形成有很大的贡献[21]。由图1可知醇类物质随着发酵时间的增加而明显增加。
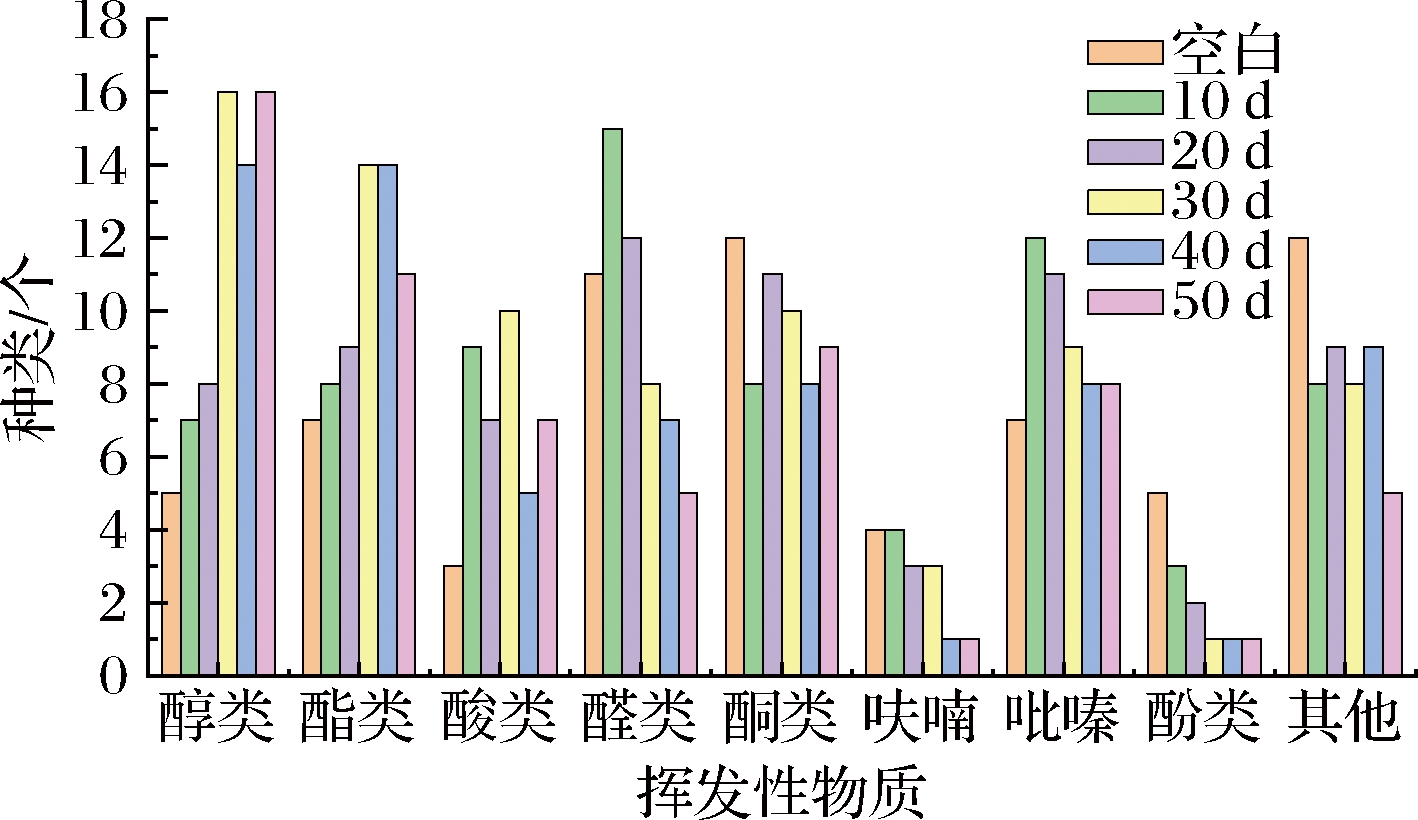
图1 不同时间点挥发性代谢物组成图
Fig.1 Composition of volatile metabolites at different time points
从物质种类的变化上可以看出,与空白对照相比较,在发酵过程中酯类物质逐渐增加,其中在发酵30 d左右增加最多,可能是由于乙醇的大量产生促进酯类物质生成。发酵30 d后,醇类和酯类物质成为主要挥发性物质,主要包括苯乙醇、乙酸乙酯、乙酸苯乙酯等,这些物质在酱油风味组成上具有重要地位[22-23];其他酮、醛类物质含量在发酵过程中逐渐减少。在挥发性代谢产物分析中未检测出有害代谢物,检测出的醇、酸、酯、呋喃、吡嗪等物质对酱油的风味起到至关重要的作用。
由图2可知,前20 d代谢物主要分布在第二象限,主要代谢物有二甲基吡嗪、苯乙醛、2,3-丁二酮等,后30 d主要分布在第一象限,主要代谢物有3-甲基-1-丁醇、乙酸异戊酯等,表明在发酵过程中不同时间段的代谢物有明显差异。
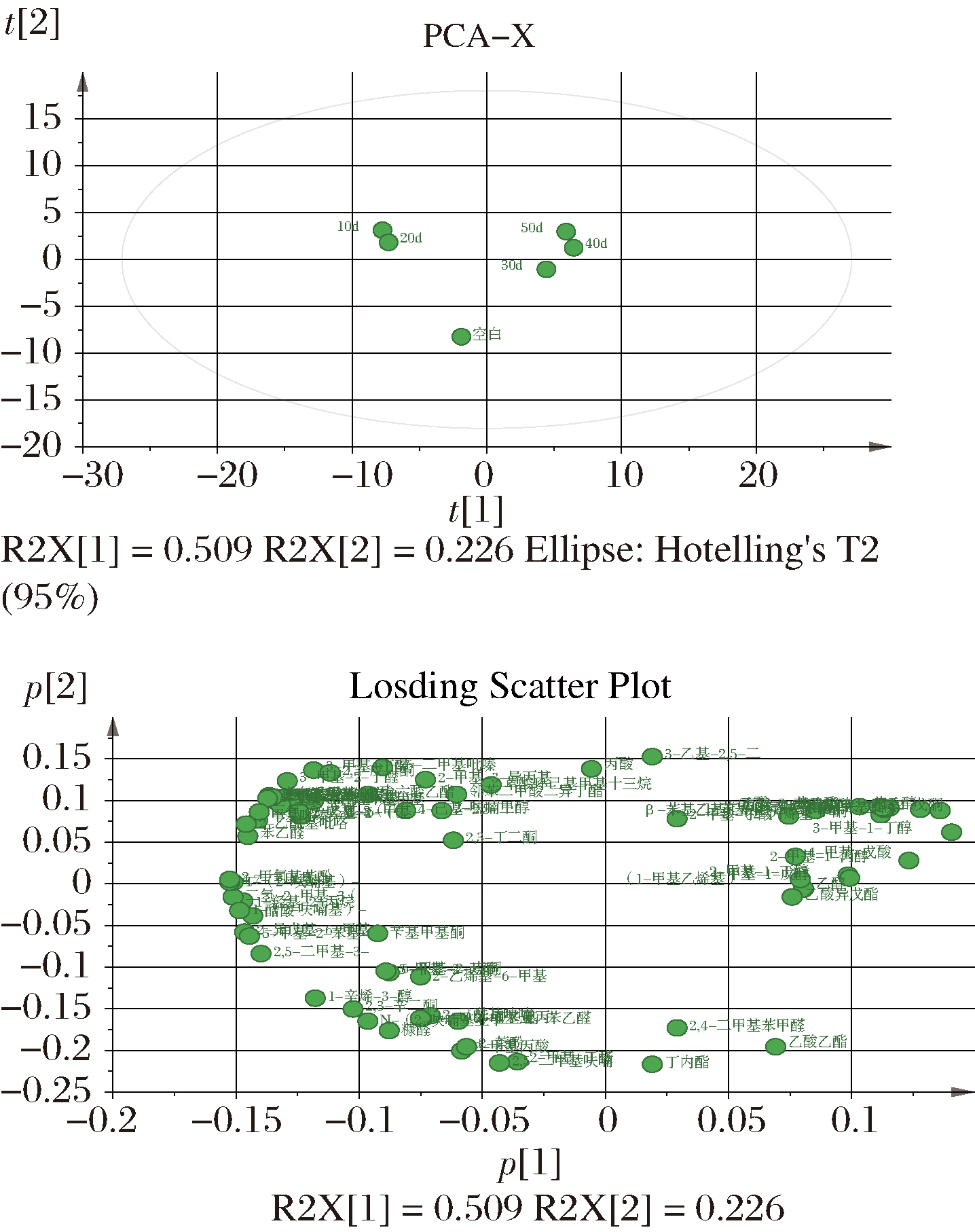
图2 不同时间段挥发性物质主成分分析
Fig.2 PCA analysis of volatile substances in different time periods
2.1.2 非挥发性代谢物分析
由图3可知,鲁氏接合酵母的非挥发性代谢物质有酸类、醇类、酯类、糖类等物质,在发酵前期,醇类、酸类物质逐渐增加,糖类物质逐渐被消耗,推测其糖类物质一部分被微生物利用,生成醇类、酸类,另一部分与氨基酸发生美拉德反应用于酱油的着色[14]。其他的一些杂环类化合物主要是烯烃、酰胺等物质,主要来源于酱醪中不饱和脂肪酸的降解以及美拉德反应的产物,虽然对酱油的风味影响较小,但其进一步分解的小分子物质是酱油复杂风味的来源[16]。
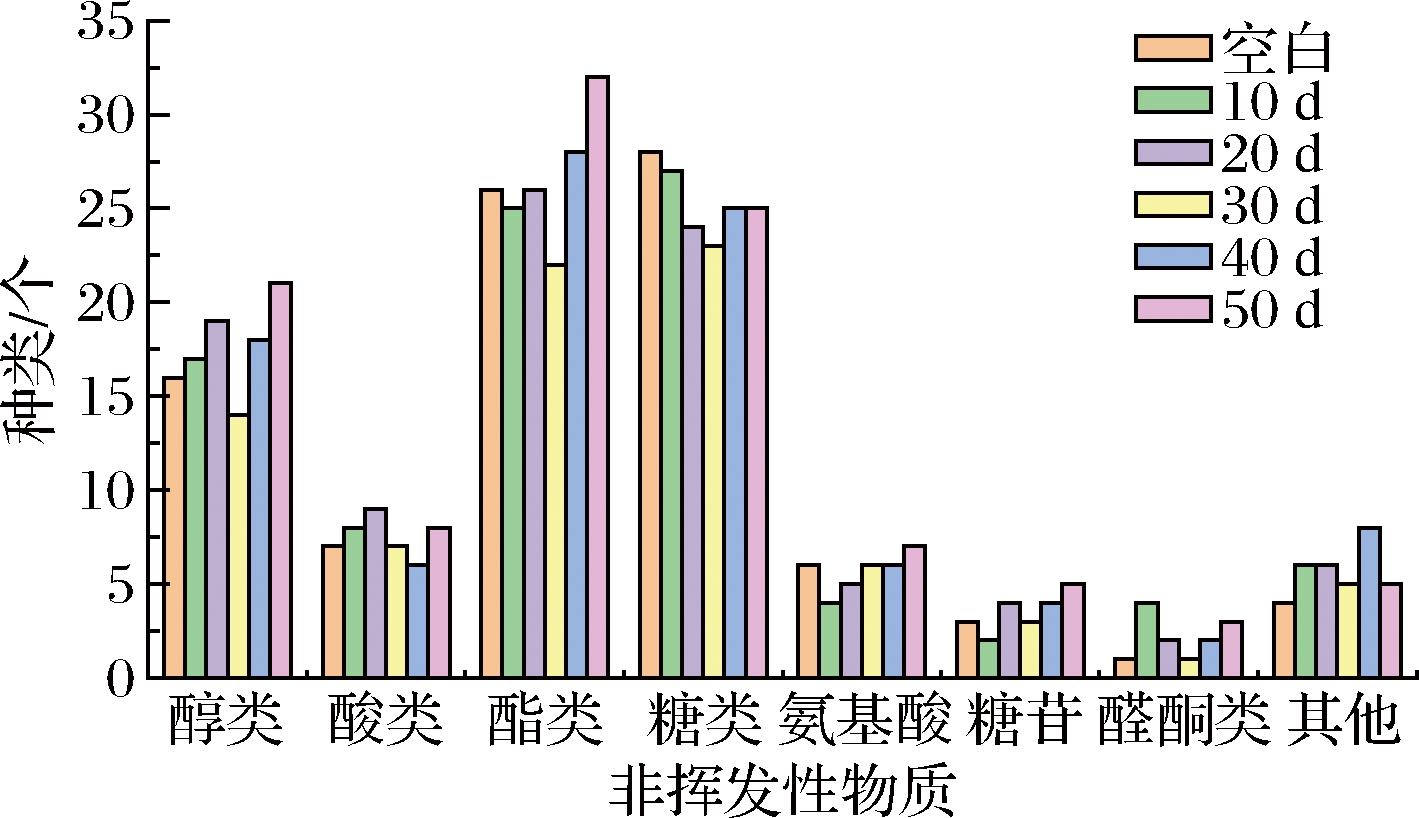
图3 不同时间点非挥发性代谢物组成图
Fig.3 Composition of non-volatile metabolites at different time points
由图4可知,不同时间段的非挥发代谢产物分布在不同象限,表明鲁氏接合酵母在酱醪汁中的代谢产物在不同时间段存在明显的差异。与空白对照相比,鲁氏酵母在酱汁发酵过程中会出现更多的中间代谢产物,样品中的非挥发性酸类物质除了氨基酸,还检测到其他酸类,包括多元酸、脂肪酸、糖酸、羟基酸等。在发酵过程中,最主要的非挥发性风味物质主要为糖类、酯类、醇类和其他酸类。

图4 不同时间段非挥发性物质主成分分析
Fig.4 Principal component analysis of volatile substances in different time periods
2.2 胆盐羟化酶活性检测
胆盐羟化酶能够水解介质中结合态的胆盐生成非结合态胆酸。微生物的代谢活动能影响胆汁池中初级和次级胆汁盐的比例,其直接作用就是通过胆盐羟化酶的活性来影响的,间接作用是通过影响胆汁盐的溶解度,所以对于肠道微生物要尽量使早期解离发生在大肠,避免肠肝循环发生紊乱,同时避免小肠的早期解离[24-25]。本实验以空白的YPD培养基作为阳性对照,实验结果如图5所示。在含有5 g/mL牛黄脱氧胆酸钠的YPD培养基上单菌落周围没有出现白色沉淀,说明鲁氏接合酵母不产生胆盐羟化酶。
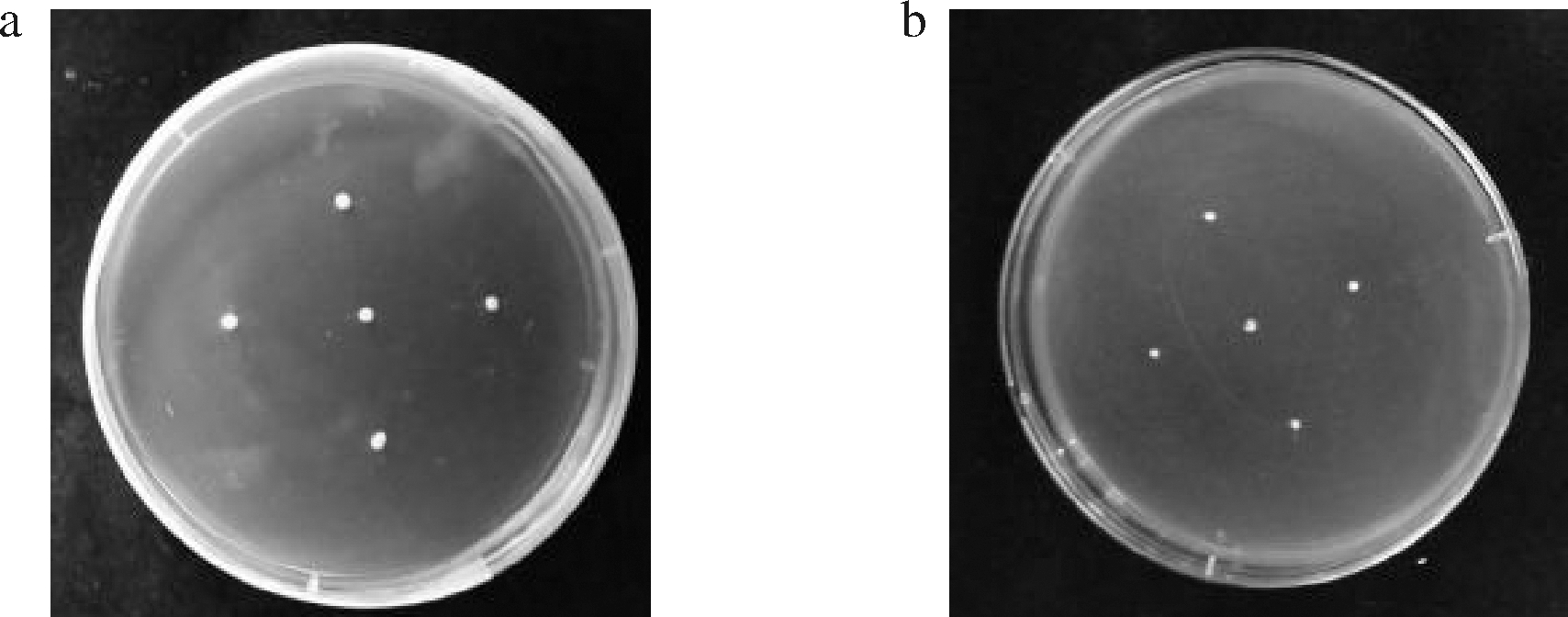
a-含5 g/mL牛黄脱氧胆酸钠的YPD培养单菌落; b-YPD培养单菌落
图5 含5 g/mL牛黄脱氧胆酸钠的YPD培养基、 空白YPD培养基
Fig.5 YPD medium containing 5 g/mL sodium bezoar deoxycholic acid and blank YPD medium
2.3 溶血实验
溶血是指红细胞破裂溶解现象,可由多种理化因素和毒素引起。如果发酵食品所用微生物具有溶血现象,会对人体造成一定危害。本实验以金黄色葡萄球菌作为阳性对照,由图6可知,鲁氏接合酵母在血琼脂平板培养基上正常生长且菌株周围的琼脂未显示绿色亦未出现透明圈,表明没有产生α、β溶血现象,说明鲁氏接合酵母不是溶血性菌株。
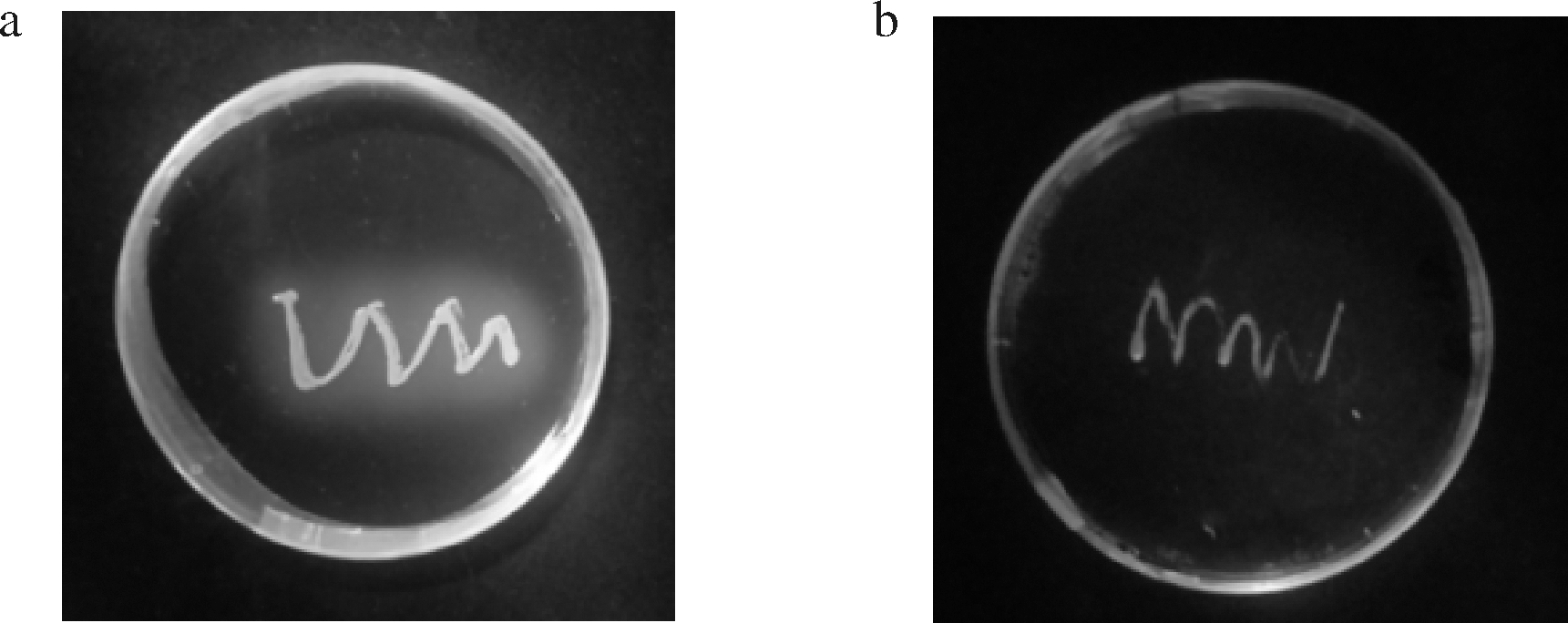
a-金黄色葡萄球菌血平板; b-鲁氏接合酵母血平板
图6 血平板实验
Fig.6 Blood plate test
2.4 耐药性实验
2.4.1 药敏实验
鲁氏接合酵母菌对5种常用抗生素的敏感性如表1所示。鲁氏接合酵母对伏立康唑、酮康唑、制霉菌素、两性霉素B四种基本抗生素敏感;对氟康唑存在剂量依赖性,但剂量依赖性并不代表菌株对药物具有抗性。
表1 鲁氏接合酵母药敏实验结果
Table 1 Results of Z.rouxii yeast drug sensitivity test

药物名称纸片扩散法敏感(S)中介(I)耐药(R)判读结果伏立康唑≥17 mm14~16 mm(DD)≤13 mmS氟康唑≥19 mm15~18 mm(DD)≤14 mmR酮康唑≥28 mm21~27 mm≤20 mmS两性霉素B≥26 mm15~25 mm≤14 mmI制霉菌素≥26 mm15~25 mm≤14 mmS
药敏实验简便,但受多种因素的影响只能用于初步筛选敏感菌,对于抑菌圈直径<14 mm的菌株应进一步用微量稀释法或Etest法测定其最低抑菌浓度(minimum inhibitory concentration,MIC)[26-27]。亦有文献指出酿酒酵母对氟康唑有一定剂量抗性,并进一步用酵母菌稀释法药物敏感实验测其MIC为2 μg/mL[28]。
2.4.2 确定最低抑菌浓度
酵母菌稀释法药物敏感实验结果在判读时依据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) M27-A3[29],唑类药物MIC值与阳性对照相比较应抑制80% 的真菌的生长,两性霉素B则需要达到100%的生长抑制,其中NCCLS药物耐药判断标准为两性霉素B的MIC>4 μg/mL、氟康唑的MIC>64 μg/mL。由图7可知,当两性霉素β和氟康唑质量浓度分别为2 μg/mL和8 μg/mL时,鲁氏接合酵母的抑制率分别达到100%和80%,其中氟康唑的质量浓度范围为0.031~8 μg/mL,两性霉素B为0.015~2 μg/mL。与酿酒酵母相比,鲁氏接合酵母虽然对氟康唑的MIC高于酿酒酵母,但都低于NCCLS药物耐药判断标准。
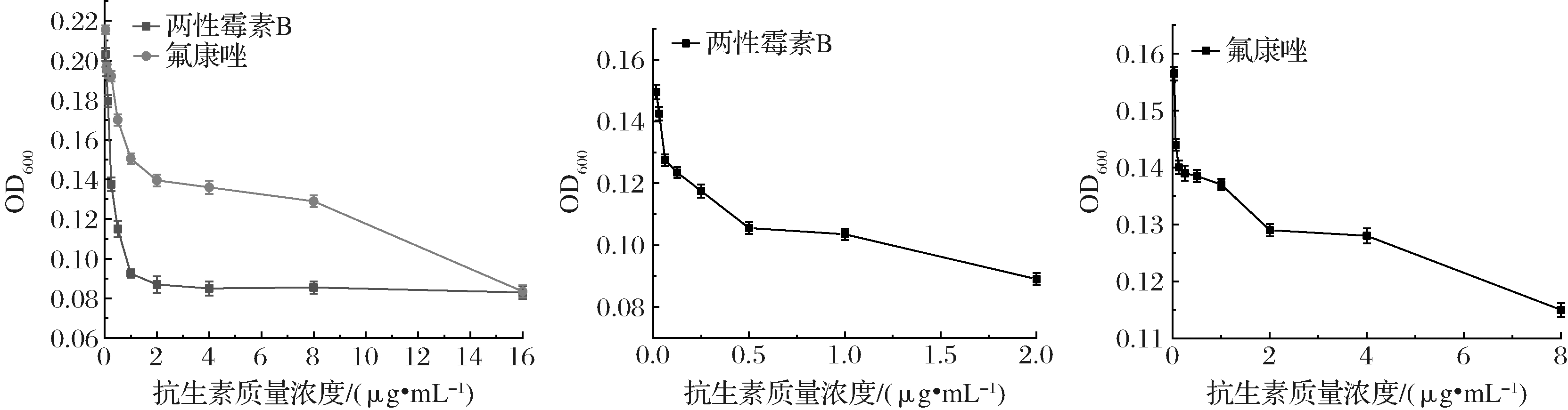
图7 发酵液在不同浓度抗生素下的吸光度值
Fig.7 Absorption of fermentation broth at different concentrations of antibiotics
3 结论
本实验对传统发酵酱油常用菌株鲁氏接合酵母的安全性进行了初步探究,通过代谢分析和指标分析,在代谢产物中未检测出有害代谢物,并显示鲁氏接合酵母是典型的醇香型酵母,能够代谢出大量的醇类物质,对酱油的风味成分起到至关重要的作用。在含有5%的胆盐羟化酶的YPD培养基上鲁氏接合酵母菌落周围未出现白色沉淀,说明鲁氏酵母不产生胆盐羟化酶;鲁氏酵母在血平板上正常生长且未发生溶血现象,说明鲁氏酵母不是溶血性菌株;初步确定了鲁氏酵母对伏立康唑、酮康唑、制霉菌素、两性霉素B四种基本抗生素敏感,对氟康唑具有剂量依赖性,同时进一步确定了两性霉素B对鲁氏酵母的MIC≤2 μg/mL,量控范围为0.015~2 μg/mL,氟康唑对鲁氏酵母的MIC≤8 μg/mL,量控范围为0.031~8 μg/mL。本研究为进一步探究鲁氏酵母的安全性奠定了基础,也为传统菌株的安全性提供了一定的理论依据。在后续实验中将进一步通过动物实验对其安全性进行探究,从而为其在传统发酵食品中的应用安全性提供更加科学全面的理论依据。
[1] 闫华娟,刘金福,王晓闻,等.小麦麸皮酶解液对低盐固态发酵酱油品质的影响[J].食品与发酵工业,2014,40(9):85-88.
YAN H,LIU J,WANG X,et al.Effect of enzymatic hydrolysate of wheat bran on the quality of soy sauce by solid-state fermentation with low salt[J]. Food and Fermentation Industry,2014,40(9):85-88.
[2] 彭东,蒋雪薇,陈幽,等.高盐稀态酱醪中耐盐生香酵母的筛选及生香特性研究[J]. 食品与发酵工业,2020,46(13):76-84.
PENG D,JIANG X,CHEN Y,et al. Screening and aroma-producing characteristics of salt-tolerant aro-ma-producing yeasts from high-salt liquid-state Moromi[J]. Food and Fermentation Industries,2020,46(13):76-84.
[3] ![]() A,KOWALSKA S,SZ
A,KOWALSKA S,SZ YK E.Studies of levels of biogenic amines in meat samples in relation to the content of additives[J].Food Additives & Contaminants:Part A,2016,33(1):27-40.
YK E.Studies of levels of biogenic amines in meat samples in relation to the content of additives[J].Food Additives & Contaminants:Part A,2016,33(1):27-40.
[4] GAO X L,LIU E M,ZHANG J K,et al.Effects of sonication during moromi fermentation on antioxidant activities of compounds in raw soy sauce[J].LWT,2019,116:108 605.
[5] GAO X L,ZHANG J K,LIU E M,et al.Enhancing the taste of raw soy sauce using low intensity ultrasound treatment during moromi fermentation[J].Food Chemistry,2019,298.DOI:10.1016/j.foodchem.2019.05.202.
[6] GUIDI LR,GLORIA M B A.Bioactive amines in soy sauce:Validation of method,occurrence and potential health effects[J].Food Chemistry,2012,133(2):323-328.
[7] 张海珍, 蒋予箭,陈敏.多菌种制曲与发酵在酿造酱油中的应用现状[J].中国酿造,2008,27(17):1-4.
ZHANG H Z,JIANG Y J,CHEN M.Application of multi-strain inoculation in koji-making and fermentation in soy sauce production[J].China Brewing,2008,27(17):1-4.
[8] 王远亮, 王传花,马骞,等.酱油发酵前期微生物变化及其主要香味物质分析[J].食品与机械,2009,25(4):31-34.
WANG Y L,WANG C,MA Q,et al.Analysis of microorganisms and main flavor substance in first stage of soy sauce fermentation[J].Food and Machinery,2009,25(4):31-34.
[9] 周斌,王静,周其洋,等. 米曲霉基因组与酶系表达研究进展[J]. 食品与发酵工业2018,44(6):293-299.
ZHOU B,WANG J,ZHOU Q Y,et al. Progress in research on Aspergillus oryzae genome and hydrolytic enzymes[J]. Food and Fermentation Industries,2018,44(6):293-299.
[10] 贾瑞博,胡荣康,周文斌,等. 米曲霉(Aspergillus oryzae FAFU) 淀粉酶的分离纯化及其酶学性质研究[J]. 食品与发酵工业,2016,42(11):71-76.
JIA R B,HU R K,ZHOU W B,et al. Isolation and purification of amylase from Aspergillus oryzae Fafu and study on its enzymatic properties[J].Food and Fermentation Industry,2016,42(11):71-76.
[11] VANDER S C,TRAMPER J,WIJFFELS R H.Enhancing and accelerating flavour formation by salt-tolerant yeasts in Japanese soy-sauce processes[J].Food Science and Technology,2001,12:322-327.
[12] KASHYAP P,SABU A,PANDEY A,et al.Extra-cellular L-glutaminase production by Zygosaccharomyces rouxii under solid-state fermentation[J].Process Biochemistry,2002,38(3):307-312.
[13] 刘佳乐,周朝晖,李铁桥,等. 酱油发酵过程强化嗜盐四联球菌对酱油品质的影响[J].食品与发酵工业,2020,46(17):99-106.
LIU J L,ZHOU Z H,LI T Q,et al. Effect of Tetragenococcus halophilus on soy sauce quality prepared by fermentation[J]. Food and Fermentation Industries,2020,46(17):99-106.
[14] 徐莹, 姜维,何晓霞.耐盐性鲁氏酵母的研究进展[J].中国酿造,2009(10):1-3.
XU Y,JIANG W,HE X X.Research progress on salt-tolerant Zygosaccharomyces rouxii[J].China Brewing,2009(10):1-3.
[15] HAUCK T,BRUHIMANN F,CHWABS W.Formation of 4-hydroxy-2,5-dimethyl-3[2H]-furanone by Zygosaccharomyces rouxii:Identification of an intermediate[J].Applied and Environmental Microbiology,2003,69(7):3 911-3 918.
[16] 丁莉莉, 王昊,王新宇,等.日本酱油与中国酱油在不同模拟条件下挥发性呈香物质分析[J].中国酿造,2019,38(6):144-151.
DING L L,WANG H,WANG X Y,et al.Analysis of volatile aroma substances of Japanese soy sauce and Chinese soy sauce under different simulated conditions[J].China Brewing,2019,38(6):144-151.
[17] 吴雅男. 酱油鲁氏接合酵母S、S3-2关键风味代谢物对比研究[D].天津:天津科技大学,2015.
WU Y N.Comparative study on the key flavor metabolite of Zygosaccharomyces rouxii for soy sauce[D].Tianjin:Tianjin University of Science and Technology,2015.
[18] 中华人民共和国上海出入境检验检疫局.SN/T 1944—2007动物及其制品中细菌耐药性的测定 纸片扩散法[S].北京:中国标准出版社,2007.
Shanghai Entry-Exit Inspection and Quarantine Bureau of People’s Republic of China.SN/T 1944—2007 Detection of antimicrobial resistance of the bacteria in animal and animal products Disk diffusion testing[S].Beijing:Standards Press of China,2007.
[19] 陈霁明,姚涌,汪学龙.抗真菌药敏试验ATBFUNGUS2微量稀释法、ROSCO纸片法和NCCLS纸片法的对比研究[J].热带病与寄生虫学,2008(1):5-7.
CHEN J M,YAO Y,WANG X L.Comparison of ATB Fungus2 microdilution method,ROSCO paper method and NCCLS paper method for antifungal susceptibility test[J].Tropical Diseases and Parasitology,2008(1):5-7.
[20] ARTHINGTON-SKAGGS B A,MOTLEY M,WARNOCK D W,et al. Comparative evaluation of PASCO and national committee for clinical laboratory standards M27-A broth microdilution methods for antifungal drug susceptibility testing of yeasts[J]. Journal of Clinical Microbiology,2000,38(6).
[21] 崔瑞迎, 郑佳,梁如,等.耐盐乳酸菌和酵母菌对高盐稀态发酵酱油品质的影响[J].食品工业科技,2013,34(6):197-201.
CUI R Y,ZHENG J,LIANG R,et al.Effect of halophilic LAB and yeasts on the quality of high-salt dilute-state soy sauce[J].Science and Technology of Food Industry,2013,34(6):197-201.
[22] 何天鹏, 赵镭,钟葵,等.气相色谱-嗅闻/质谱联用分析酵母菌发酵酱油中香气物质[J].食品工业科技,2020,41(16):259-265.
HE T P,ZHAO L,ZHONG K,et al.Analysis of aroma compounds in yeast-fermented soy sauce by GC-O/MS[J].Science and Technology of Food Industry,2020,41(16):259-265.
[23] YOUNG R S,JEONG D Y,BAIK S H.Monitoring of yeast communities and volatile flavor changes during traditional Korean soy sauce fermentation[J].Journal of Food Science,2015,80(9):M2 005-M2 014.
[24] SHI Y F,ZHAI M K,LI J L,et al. Evaluation of safety and probiotic properties of a strain of Enterococcus faecium isolated from chicken bile[J]. Journal of Food Science and Technology,2020,57(2).
[25] MILKAEL K.Safety of probiotics[J].Clinical and Translational Allergy,2011,1(S1).DOI:10.1186/2045-7022-1-S1-S9.
[26] 黄纯英,陆丽燕,肖建宁,等.三种酵母菌药敏试验检测氟康唑和伏立康唑结果的一致性[J].包头医学院学报,2016,32(8):23-25.
HUANG C Y,LU L Y,XIAO J N,et al. The consistency of fluconazole and voriconazole test results of three kinds of yeast drug sensitivity test[J]. Journal of Baotou Medical College,2016,32(8):23-25.
[27] 袁进霞.三种试验方法检测酵母菌对氟康唑的敏感性[J].检验医学与临床,2008,5(6):361-362.
YUAN J X.Three test methods to detect the sensitivity of yeast to fluconazole[J].Laboratory Medicine and Clinic,2008,5(6):361-362.
[28] ESPINEL I A.In vitro activity of the new triazole voriconazole (uk-109,496) against opportunistic filamentous and dimorphic fungi and common and emerging yeast pathogens[J].J Clin Microbiol,1998,36(1):198-202.
[29] ANA E I,EMILA C,TERESA P,et al.Comparison of micafungin MICs as determined by the Clinical and Laboratory Standards Institute broth microdilution method (M27-A3 document) and etest for Candida spp.isolates[J].Diagnostic Microbiology & Infectious Disease,2011,70(1):54-59.