当前我国肉类消费主要以猪肉消费为主,但是新鲜猪肉往往因为贮藏周期短等原因而造成大量浪费,在贮藏过程中新鲜猪肉会氧化变质或者滋生腐败菌,这些都会导致猪肉颜色变化、风味恶化、口感变差以及营养成分流失等[1]。因此肉及肉制品的保鲜成为研究者不断关注的话题。工业生产中肉及肉制品防腐保鲜主要依赖人工合成的抗氧化剂抑制肉的氧化变质,如二丁基羟基甲苯(dibutylated hydroxyl toluene, BHT)、丁基羟基茴香醚(butylated hydroxyl anisole, BHA)和亚硝酸盐等。由于合成抗氧化剂的毒性和致癌性导致对天然抗氧化剂的需求逐渐增加[2]。研究发现鳄梨、桑葚、石榴叶、荔枝皮等天然产物的提取物对猪肉及其制品有良好的护色效果,能够抑制脂质氧化、提升蛋白质氧化稳定性[3-6]。
洋葱外皮中黄酮类物质含量极为丰富,其成分主要是黄酮类、黄酮醇类和花色素类等,具有抗氧化、抗炎、杀菌、降血压等生理作用[7]。据报道400 μg/mL洋葱皮无水乙醇提取物ABTS阳离子自由基清除率高达93%以上,接近槲皮素清除自由基的能力[7]。LEE等[8]证明洋葱皮提取物具有潜在的抗菌和抗氧化作用,其抗氧化作用是BHT的2倍。对于洋葱皮提取物在肉及肉制品中的保鲜效果,LEE等[9]研究发现洋葱皮提取物能够抑制猪肉香肠脂质氧化,同时降低微生物数量。但是洋葱皮提取物对生鲜肉的抗氧化及护色作用却少见报道,本实验旨在探究洋葱皮提取物对生鲜猪肉的护色效果,以及对脂质氧化和蛋白质氧化的抑制作用,为洋葱皮提取物作为天然的抗氧化剂作出进一步研究探索。
1 材料与方法
1.1 材料与仪器
紫色洋葱皮,齐齐哈尔市浏园市场;2-硫代巴比妥酸(2-thiobarbituric acid,TBA)、盐酸胍,北京Coolaber科技有限公司;ABTS (2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐)、DPPH(1, 1-二苯基-2-三硝基苯肼),Sigma-Aldrich 化学试剂公司;没食子酸标准品、芦丁标准品、福林酚试剂、抗坏血酸、乙醇(分析纯),天津市科密欧化学试剂有限公司。
FW100 型高速万能粉碎机,天津市泰斯特仪器有限公司;FiveEasy Plus pH计,梅特勒-托利多仪器(上海)有限公司;CR-10 Plus色差计,柯盛行(杭州)仪器有限公司;UV-5100紫外可见分光光度计 METASH上海元析仪器有限公司。
1.2 实验方法
1.2.1 洋葱皮乙醇提取物(ethanol extract of onion skins, EEOS)的制备
取粉碎的紫色洋葱皮100 g,加入体积分数70%乙醇200 mL,在25 ℃下浸提2 h,然后将浸提液经6 000 r/min的离心处理,取上清液备用。离心后的沉渣再次经过浸提、离心处理,合并2次离心上清液。将合并后的提取液在旋转蒸发器中真空浓缩(50 ℃),再将浓缩液冷冻干燥即为EEOS(得率为10.28%,总酚含量42.12%),将EEOS储存于-20 ℃冰箱中备用。
1.2.2 EEOS总酚含量、DPPH和ABTS阳离子自由基清除性能测定
总酚含量采用福林酚法测定[10]。取0.15 mL用相应的提取溶剂稀释至质量浓度0.1 mg/mL的提取物样品溶液于10 mL离心管中,加入1.5 mL 10倍稀释(0.2 mol/L)的福林酚试剂,利用涡旋混匀器混匀,静置5 min。加入1.5 mL质量浓度为60 g/L的Na2CO3溶液,然后将此混合液在75 ℃下水浴10 min,随后立即冰浴终止反应,于725 nm波长处测定反应液的吸光值。以没食子酸作标准曲线(y=0.031x+0.013,R2=0.998),总酚含量以每克干提取物中没食子酸当量表示(mg GAE/g)。
DPPH自由基清除性能参考任曼妮等[10]的方法测定,稍作修改。将4 mL的DPPH甲醇溶液吸光度(1±0.02)与0.4 mL不同质量浓度(0.0125、0.025、0.05、0.10、0.2 mg/mL) 提取物样品溶液混合。将反应混合物在室温下摇匀,避光静置20 min, 在517 nm波长处测定吸光度值的变化。以甲醇代替提取物样品溶液作为空白对照,以不同质量浓度的VC (0.012 5、0.025、0.05、0.10、0.2 mg/mL)作为对照,样品对DPPH自由基的清除性能按公式(1)计算:
DPPH自由基清除能力![]()
(1)
通过对DPPH自由基清除性能与提取液浓度之间绘制的剂量效应曲线进行线性回归分析,结果以IC50表示。IC50是指DPPH自由基浓度减少50%所需要的提取物的质量浓度值(mg/mL),IC50值越低,自由基清除活性越高。
ABTS阳离子自由基清除性能参考任曼妮等[10]的方法测定,稍作修改。将ABTS溶解于20 mmol/L、pH 4.5的醋酸缓冲溶液中得到7 mmol/L的ABTS阳离子自由基贮液,与过硫酸钾溶液 (混合体系中终浓度为2.45 mmol/L) 混合,在室温下避光反应12~16 h,使溶液达到稳定的氧化态。测定前用20 mmol/L、pH 4.5的醋酸缓冲溶液按照适当的比例 (体积比1∶75) 稀释ABTS自由基贮液,使溶液在734 nm波长下的吸光值达到(0.7±0.02),以此得到ABTS阳离子自由基工作液,该工作液每次测定前现配。测定时反应体系包括3 mL的ABTS阳离子自由基工作液和200 μL不同质量浓度(0.0125、0.025、0.05、0.10 mg/mL) 提取物样品混合。室温避光静置6 min 后在734 nm波长下测吸光值,以甲醇代替提取物样品溶液作为空白对照,以不同质量浓度的VC(0.0125、0.025、0.05、0.10、0.2 mg/mL)作为阳性对照,样品对ABTS阳离子自由基的清除性能按公式(2)计算:
ABTS阳离子自由基清除能力![]()
(2)
通过对ABTS阳离子自由基清除性能与提取液浓度之间绘制的剂量效应曲线进行线性回归分析,结果以IC50表示。
1.2.3 浸渍液的配制
分别将0.5、1.0、1.5、2.0 g EEOS粉末溶于100 mL蒸馏水配制成5、10、15、20 g/L EEOS溶液;将0.5 g VC溶于100 mL蒸馏水配制成5 g/L VC溶液。
1.2.4 猪肉浸渍处理
猪肉选用当天屠宰胴体的背脊部分,市购;所用工具经体积分数75%酒精消毒处理,新鲜猪肉经紫外灯辐照灭菌后,在无菌条件下分割成20.00 g 方形肉块(长、宽、高分别为5、4、0.5 cm),然后分别浸渍于蒸馏水、(5、10、15、20 g/L)EEOS溶液和5 g/L VC溶液,2 min后取出,密封于塑料PE 3号自封袋中,置于4 ℃条件下冷藏。共5批样品,每个样品15组平行,分别在第1、3、6、9、12天进行测量,每个样品测量3次,取平均值。
1.2.5 pH测量
取5.00 g肉样,研磨成肉糜,与20 mL蒸馏水混合,在均质机中混合1 min,用pH计测量其pH值[9]。每个样品测量3次,取平均值。
1.2.6 色泽测定
使用色差仪测量肉样的L*(亮度值)、a*(正值代表红度值)[11]。每个样品测量3个不同的位点,取平均值。
1.2.7 高铁肌红蛋白(metmyoglobin,MetMb)含量测定
在何晓燕等[12]方法的基础上略加修改,以磷酸盐缓冲溶液为空白,在525、572、700 nm波长处测得吸光度值,MetMb含量按公式(3)计算:
(3)
式中:Aλ为波长λ nm处的吸光度。
1.2.8 硫代巴比妥酸反应物(thiobarbituric acid reactive substances, TBARS)含量测定
脂质氧化的测量参考ZENGIN等[13]的方法并加以修改。取10.00 g肉样,研磨成肉糜后加入40 mL体积分数10%三氯乙酸溶液,搅拌均匀,置于离心机中6 000 r/min离心5 min,过滤,滤液移至50 mL容量瓶中,用体积分数10%三氯乙酸定容,混匀,静置10 min后移取5 mL滤液,再加入5 mL TBA溶液,混合后置于95 ℃水浴锅水浴50 min,取出后冷水浴10 min。然后在波长532 nm处测得吸光度,结果表示为mg/kg,按公式(4)计算:
TBARS/(mg·kg-1)=A532×41.5
(4)
式中:A532 为溶液在532 nm 处的吸光度;41.5为每毫升含丙二醛的换算系数。
1.2.9 挥发性盐基氮(total volatile basic nitrogen, TVB-N)含量测定
肉样中TVB-N含量的测定参考BASIRI等[14]的方法,TVB-N值以每100 g牛肉中所含挥发性总碱氮的质量(mg)表示,按公式(5)计算:
(5)
式中:X1 为样品中挥发性盐基氮的含量,mg/100 g;V1为测定用样液消耗盐酸标准溶液体积,mL;V2为试剂空白消耗盐酸标准溶液体积,mL;c为盐酸标准溶液的浓度,mol/L;14为1 moI/L盐酸标准溶液1 mL相当氮的质量,mg;m为样品质量,g。
1.2.10 肉样中蛋白质提取
肌原纤维蛋白的提取参照贾娜等[15]的方法并略加修改,取10.00 g肉样研磨成肉糜,加入4 ℃,40 mmol/L磷酸盐缓冲溶液40 mL(pH 6.8),匀浆,6 000 r/min离心10 min,弃去上清液,重复上述步骤3次。沉淀加入4 ℃,0.1 mol/L NaCl溶液40 mL,匀浆,6 000 r/min离心10 min,弃去上清液,重复该过程2次,第3次加入4 ℃,0.1 mol/L NaCl溶液匀浆后,用2层纱布过滤,滤液经6 000 r/min离心,弃上清液,所得膏状物为肌原纤维蛋白,将提取的肌原纤维蛋白保存在4 ℃条件下待测。
1.2.11 蛋白质疏水性测定
蛋白质表面疏水性通过蛋白质与溴酚蓝的结合量来评价,参照梁慧等[16]的方法,在595 nm处测得吸光度,按公式(6)计算:
溴酚蓝结合量![]()
(6)
式中:A样品为样品组在波长为595 nm下的吸光值;A对照为对照组在波长为595 nm下的吸光值。
1.2.12 蛋白质羰基含量测定
蛋白质羰基含量的测定参照贾娜等[15]的方法并略加修改,用0.6 mol/L NaCl溶液溶解蛋白质,配制成10 mg/mL蛋白溶液。取3 mL蛋白溶液加入4 ℃体积分数20%三氯乙酸1 mL,6 000 r/min离心5 min,弃上清液。在沉淀中加入1 mL 0.2%的二硝基苯肼(用2 mol/L盐酸配制),避光振荡1 h后,加入4 ℃体积分数20%三氯乙酸0.5 mL,然后6 000 r/min离心5 min,取沉淀,沉淀用乙酸乙酯-乙醇溶液(体积比1∶1)洗涤3次,再用3 mL 6 mol/L盐酸胍溶液溶解沉淀,之后置于水浴锅中37 ℃水浴15 min。最后离心取上清液,在波长370 nm处测吸光值,同时做试剂空白实验。按公式(7)计算:
蛋白羰基含量![]()
(7)
式中:A样品为样品组在波长为370 nm下的吸光值;A对照为对照组在波长为370 nm下的吸光值;0.5为比色光径,cm;ρ为样本蛋白质浓度,mg/L。
1.3 数据处理
所有实验结果用平均值±标准差表示,使用软件SPSS 21.0系统中的Duncan’s进行差异显著性分析和相关性分析,P<0.05 表示差异显著。
2 结果与分析
2.1 EEOS总酚含量及自由基清除活性
洋葱皮中富含多酚类物质,特别是槲皮素和糖苷类成分是重要的天然抗氧化剂,可清除多种自由基,同时也具有抗菌活性,并对预防心血管疾病和某些癌症具有积极作用[8]。EEOS中总酚含量以及自由基清除活性见表1,并将其与VC做了对比。CEONG等[17]研究发现紫色洋葱皮乙醇提取物中的总酚含量为819 mg GAE/g,此结果与本研究相近。由IC50值可知,VC的DPPH和ABTS阳离子自由基清除能力显著高于EEOS(P<0.05)。一方面,EEOS中的多酚类物质的供氢能力弱于VC,此外,EEOS属于植物粗提物,其中含有一些杂质,这在一定程度上导致抗氧化活性下降。
表1 洋葱皮乙醇提取物的总酚含量和自由基清除活性
Table 1 Total phenol content and free radical scavenging activity of EEOS
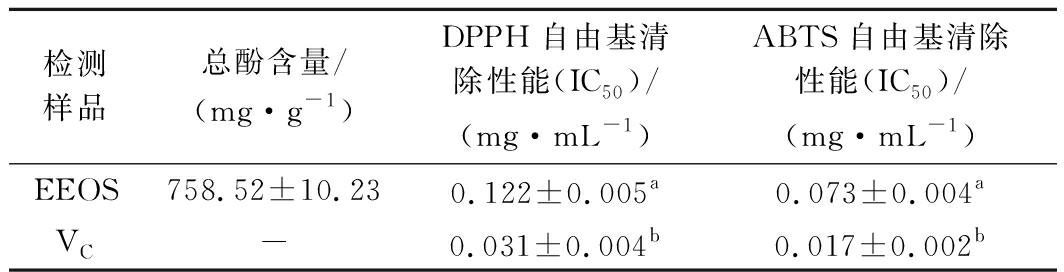
检测样品总酚含量/(mg·g-1)DPPH自由基清除性能(IC50)/(mg·mL-1)ABTS自由基清除性能(IC50)/(mg·mL-1)EEOS758.52±10.230.122±0.005a0.073±0.004aVC-0.031±0.004b0.017±0.002b
注:“-”表示空白,同列不同小写字母表示差异显著(P<0.05)(下同)
2.2 EEOS对生鲜猪肉pH值的影响
屠宰后猪肉中的肌糖原无氧酵解产生大量乳酸,
且三磷酸腺苷酶促三磷酸腺苷分解产生H3PO4,促使肉质pH值不断下降,但随着贮藏期延长,由于自身酶和微生物的影响,肉中的蛋白质和脂肪分解为小分子脱氨基物质NH3 和胺类化合物,会造成肉质pH值逐渐回升[18]。EEOS对生鲜猪肉pH值的影响见表2。贮藏期内,猪肉pH值先减小后增大,添加EEOS的各组pH值明显低于对照组(P<0.05)。贮藏12 d时,添加EEOS可降低猪肉pH值,与对照组相比,20 g/L EEOS处理组pH值减少8.4%。LEE等[9]用泡菜粉制备的乳化香肠pH值略低于其他处理。炮仗花提取物对牛肉汉堡pH值也会产生影响,贮藏期间pH值低于其他处理[19]。5 g/L VC处理组pH值低于对照组和10 g/L EEOS处理组,差异显著(P<0.05)。
表2 洋葱皮乙醇提取物对生鲜猪肉pH值的影响
Table 2 Effect of EEOS on pH value of fresh pork
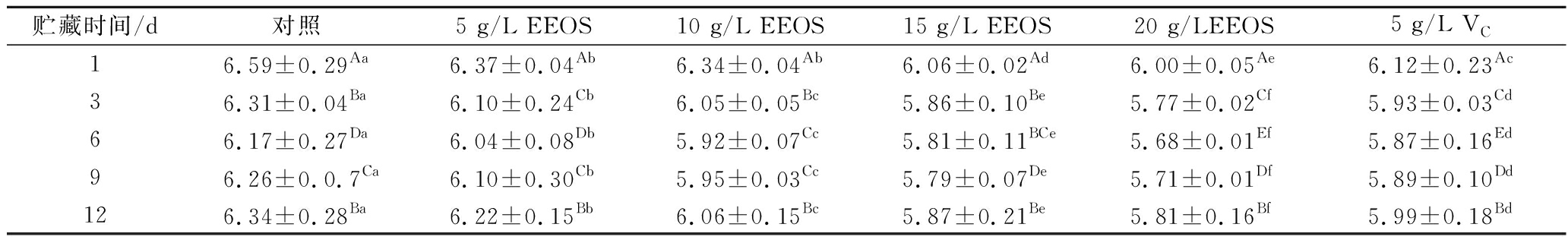
贮藏时间/d对照5 g/L EEOS10 g/L EEOS15 g/L EEOS20 g/LEEOS5 g/L VC16.59±0.29Aa6.37±0.04Ab6.34±0.04Ab6.06±0.02Ad6.00±0.05Ae6.12±0.23Ac36.31±0.04Ba6.10±0.24Cb6.05±0.05Bc5.86±0.10Be5.77±0.02Cf5.93±0.03Cd66.17±0.27Da6.04±0.08Db5.92±0.07Cc5.81±0.11BCe5.68±0.01Ef5.87±0.16Ed96.26±0.0.7Ca6.10±0.30Cb5.95±0.03Cc5.79±0.07De5.71±0.01Df5.89±0.10Dd126.34±0.28Ba6.22±0.15Bb6.06±0.15Bc5.87±0.21Be5.81±0.16Bf5.99±0.18Bd
注:同列不同大写字母代表差异显著(P<0.05);不同小写字母代表同一行内差异显著(P<0.05)
2.3 EEOS对生鲜猪肉色泽的影响
猪肉的色泽是评价猪肉新鲜程度一个重要指标,是消费者用以判断鲜肉货架期和可接受性的最常用标准,也是决定消费者购买欲最主要的外观因素。如图1-a所示,贮藏时间和EEOS添加剂量对生鲜猪肉L*值影响显著(P<0.05)。第1 天 时,对照组L*值最高为(33.6±0.5),随着贮藏天数的增加,L*值逐渐下降。研究者发现,经泡菜提取物处理的猪肉冷藏过程中L*值随着贮藏时间的延长而降低[20],但ZAHID等[1]研究发现与对照组相比,经抗氧化剂处理的肉饼在贮藏期内L*值没有显著变化。同时各处理L*值在贮藏后期趋于平缓,5、10、15、20 g/L EEOS处理的肉样L*值在贮藏12天 时与第1天相比分别下降6.8、6.4、6.2、4.8,明显低于空白对照组(10.8)和阳性对照组(8.6)。这可能是因为洋葱皮提取物本身的紫红色色素渗入肌肉表层造成肉样L*值降低。肖朝耿等[21]研究认为L*值逐渐变平缓和肉糜中甜菜红色素完全发色有关,红叶甜菜块根粉添加量越多 L*值越低。

图1 洋葱皮乙醇提取物对冷藏过程中猪肉色泽的影响
Fig.1 Effect of EEOS on color indexes of fresh pork during refrigerated storage
注:不同小写字母代表同一处理组不同冷藏时间差异显著
(P<0.05);不同大写字母代表同一冷藏时间不同处理组
差异显著(P<0.05)(下同)
随着贮藏时间增加,a*值逐渐减小,添加EEOS的各组a*值明显大于空白对照组(图1-b),而空白对照组与阳性对照组a*值差异不显著(P>0.05)。有报道显示添加牛至的羊肉汉堡a*值最高,随着贮藏时间的延长,a*值不断下降[22],该结果与本文研究结果相同。HAJRAWATI等[18]提出开心果青壳提取物不会影响肉饼的a*值。类似文献也表明添加了迷迭香和丁香提取物的熟猪肉饼,其颜色变化明显较慢,与工业抗氧化剂相比更能保护熟猪肉馅饼的红度值[2]。
2.4 EEOS对生鲜猪肉MetMb含量的影响
生猪屠宰后肌肉纤维中的肌红蛋白(myoglobin, Mb)和氧合肌红蛋白(oxymyoglobin, OxyMb)相对比率受MetMb含量的影响, 3种形态的肌红蛋白相互转化,导致肌肉中MetMb的积累,影响肉的感官颜色[23]。如图2所示,冷藏时间对生鲜肉中MetMb含量的影响显著(P<0.05),且EEOS处理组MetMb含量均低于空白对照组。这是由于脂质氧化过程中产生的自由作用在肌红蛋白血红素基上引起Fe2+的氧化,造成颜色损失[19]。而添加EEOS的各组MetMb含量明显降低,随着添加剂量的增大,抑制Fe2+氧化能力越强。第12天时, 20 g/L EEOS处理组抑制MetMb产生的能力是工业抗氧化剂VC的2倍。LEE等[20]研究发现泡菜提取物明显降低了猪肉中MetMb含量。研究者也注意到开心果青壳中的酚类物质在牛肉饼中的添加量超过750 mg/kg时,肌肉中OxyMb转化为MetMb的过程才会受到抑制,同时他们也提出了脂质氧化的一二级产物也可能促进MetMb的积累[24]。

图2 洋葱皮乙醇提取物对冷藏过程中猪肉MetMb含量的影响
Fig.2 Effect of EEOS on MetMb content of fresh pork during refrigerated storage
2.5 EEOS对生鲜猪肉TBARS含量的影响
TBARS是肌肉中脂肪氧化的主要指标。冷藏可以减缓脂肪氧化,但并不能完全阻止脂肪氧化的进行,脂肪氧化产生的自由基会促使二价铁被氧化成三价铁,导致Mb被氧化为MetMb[16]。EEOS在生鲜猪肉中对脂质氧化的抑制效果如图3所示,贮藏期内TBARS含量呈逐渐上升的趋势,这说明脂质二次氧化产物丙二醛含量不断增加,添加了EEOS和VC的各组TBARS含量均低于空白对照组。EEOS中富含丰富的酚类化合物是抑制脂质氧化的主要成分,酚类化合物可以通过螯合过渡金属离子,特别是铁和铜离子,抑制自由基的形成和自由基反应的传播[3]。LEE等[20]证明了贮藏时间会影响TBARS含量,添加了不同剂量的泡菜提取物均对猪肉脂质氧化产生抑制作用。第12天时,与空白对照组相比,20 g/L EEOS处理组TBARS含量下降53.1%,抑制效果明显。经EEOS处理的各组,质量浓度越大抑制脂质氧化的能力越强,当EEOS的质量浓度大于10 g/L时,其抗氧化效果优于工业抗氧化剂VC。该结论与肉样中肌红蛋白氧化抑制结果相同,可间接证明SADEGHINEJAD等[24]所发现的脂质氧化的一二级产物会促进MetMb的积累。类似的研究也表明,同对照组相比,羊肉中添加土豆皮提取物TBARS含量减少54%[25],石榴皮提取物可降低牛肉丸中63.0% 的TBARS含量[26],与本实验相似。
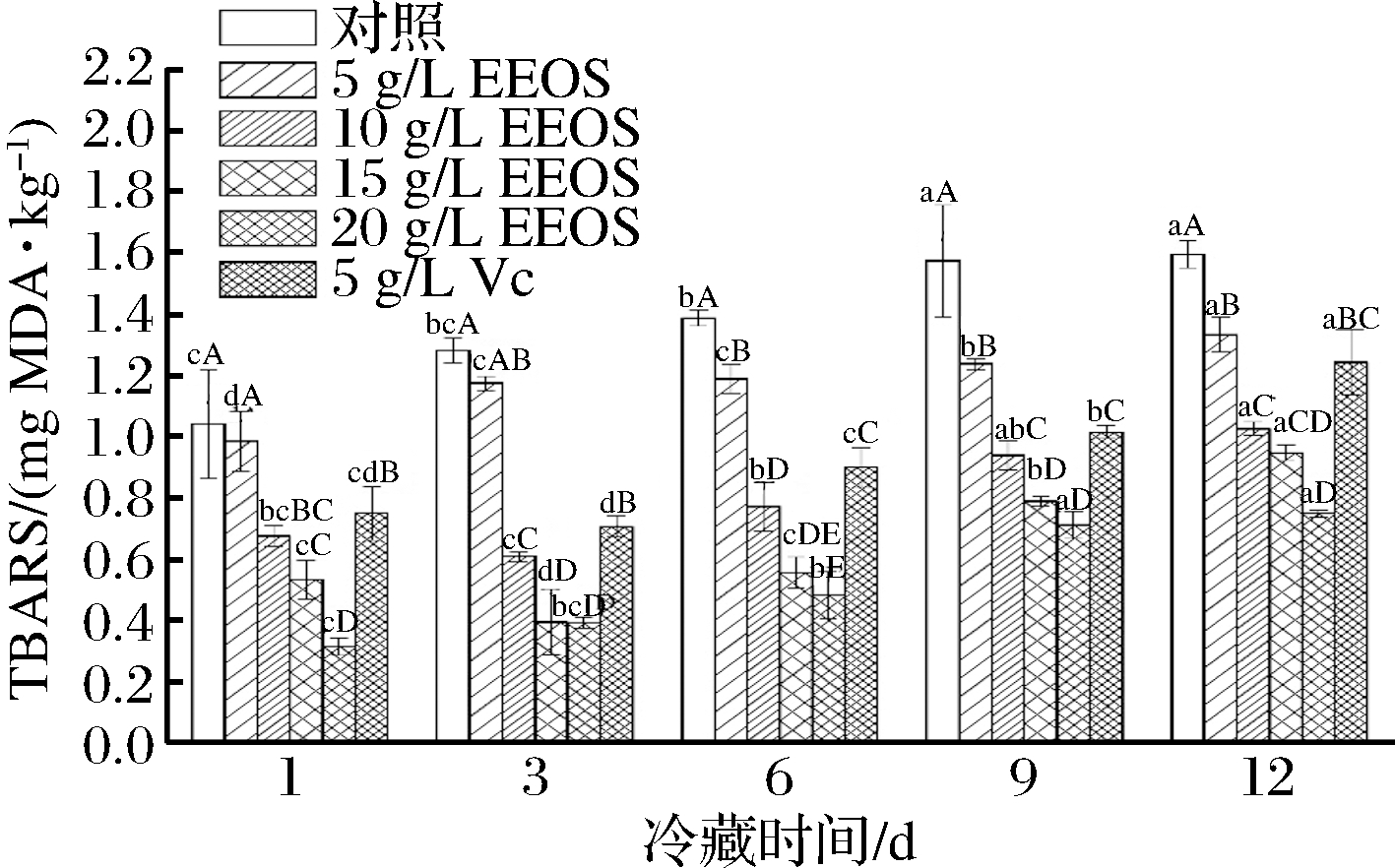
图3 洋葱皮乙醇提取物对冷藏过程中猪肉TBARS值的影响
Fig.3 Effect of EEOS on TBARS value of fresh pork during refrigerated storage
2.6 EEOS对生鲜猪肉蛋白质表面疏水性的影响
肌原纤维蛋白是影响肉的嫩度和保水性的重要结构蛋白[29]。本实验利用溴酚蓝分子可与肌原纤维蛋白上的疏水性位点结合这一原理判断蛋白质氧化程度。从图4可知,随着贮藏天数的增加,溴酚蓝结合量逐渐增大。这源于贮藏过程中蛋白质不断被氧化结构展开,暴露出更多的疏水性氨基酸残基使蛋白质表面疏水性增强,蛋白质聚集概率增大,最终导致蛋白质分子发生变性[30]。贮藏12 d时,经VC和EEOS处理的各组溴酚蓝结合量均低于空白对照组,其中20 g/L EEOS处理组溴酚蓝结合量下降显著(P<0.05),与空白对照组和阳性对照组相比分别减少61.8%和40.8%。EEOS富含多酚类物质,它能清除![]() 防止蛋白质氧化,这也可能与EEOS的抑菌作用有关,微生物生长减慢会减缓蛋白质分解以及变性,从而减缓蛋白质表面疏水性[16]。
防止蛋白质氧化,这也可能与EEOS的抑菌作用有关,微生物生长减慢会减缓蛋白质分解以及变性,从而减缓蛋白质表面疏水性[16]。
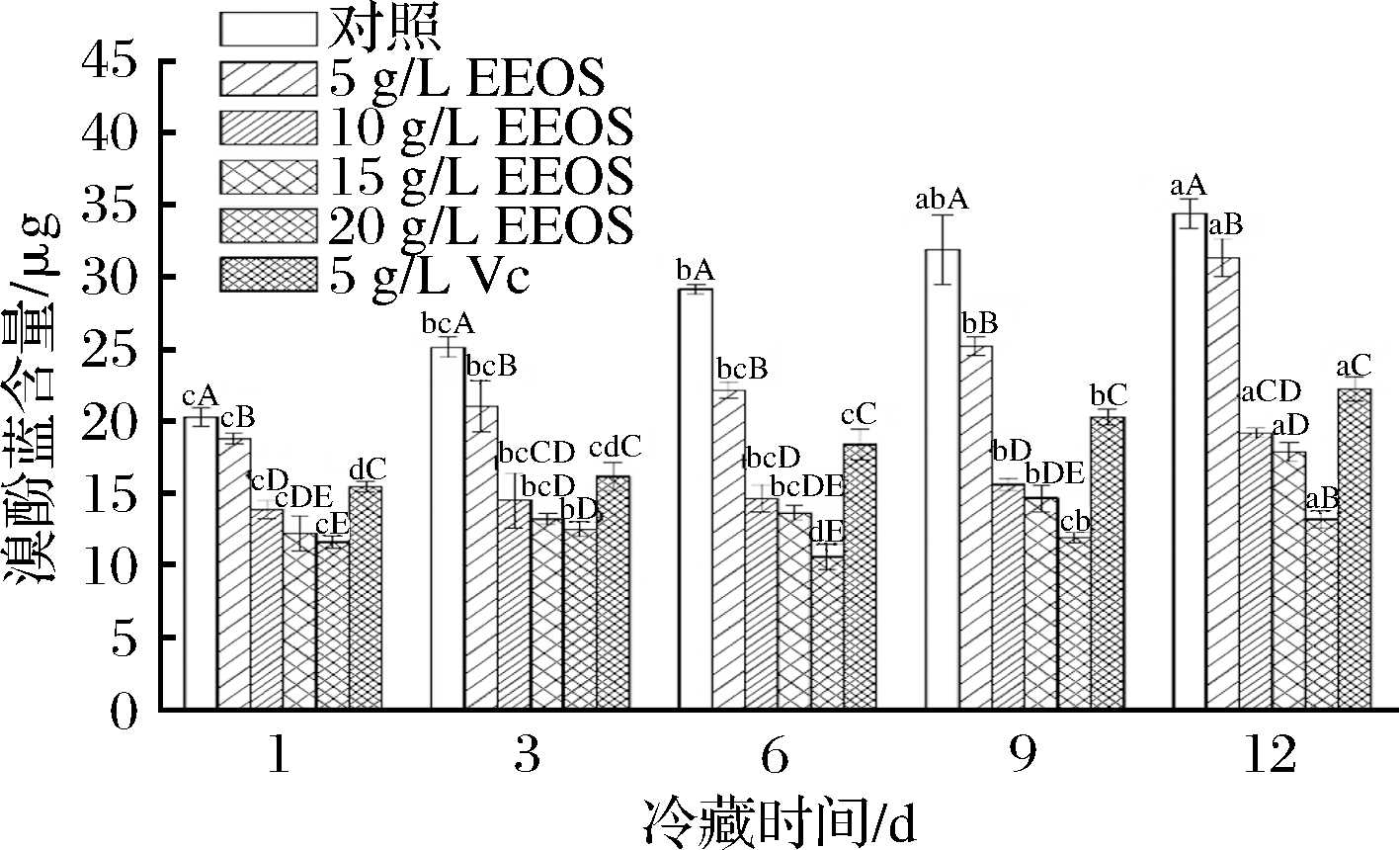
图4 洋葱皮乙醇提取物对冷藏过程中猪肉蛋白质表面疏水性的影响
Fig.4 Effect of EEOS on the protein surface hydrophobicity of fresh pork during refrigerated storage
2.7 EEOS对生鲜猪肉蛋白质羰基含量的影响
蛋白质羰基含量是判断肉中蛋白质氧化程度的重要指标,肌肉蛋白质氧化会使蛋白质羰基增加,从而导致某些氨基酸侧链(如赖氨酸、脯氨酸、精氨酸和组氨酸残基)的氧化降解[1]。由图5可知,随着贮藏时间的延长,蛋白质羰基含量逐渐增加,贮藏期内,各处理组羰基含量均低于空白对照组。第12天,空白对照组羰基含量达到最大值(43.53 nmol/mg),5 g/L VC处理组比其低6.8%,20 g/L EEOS处理组比其低29.2%。EEOS能有效抑制蛋白质氧化与其自由基清除能力和抑菌作用有关。经EEOS处理的3组(10、15、20 g/L)在第1~6天内,蛋白质羰基含量增长缓慢,随后则急剧上升。RODR GUEZ-CARPENA等[3]研究发现,猪肉饼在冷藏过程中蛋白质氧化产生的羰基化合物含量明显增加,而鳄梨提取物的添加在一定程度上能够抑制蛋白质的氧化。
GUEZ-CARPENA等[3]研究发现,猪肉饼在冷藏过程中蛋白质氧化产生的羰基化合物含量明显增加,而鳄梨提取物的添加在一定程度上能够抑制蛋白质的氧化。
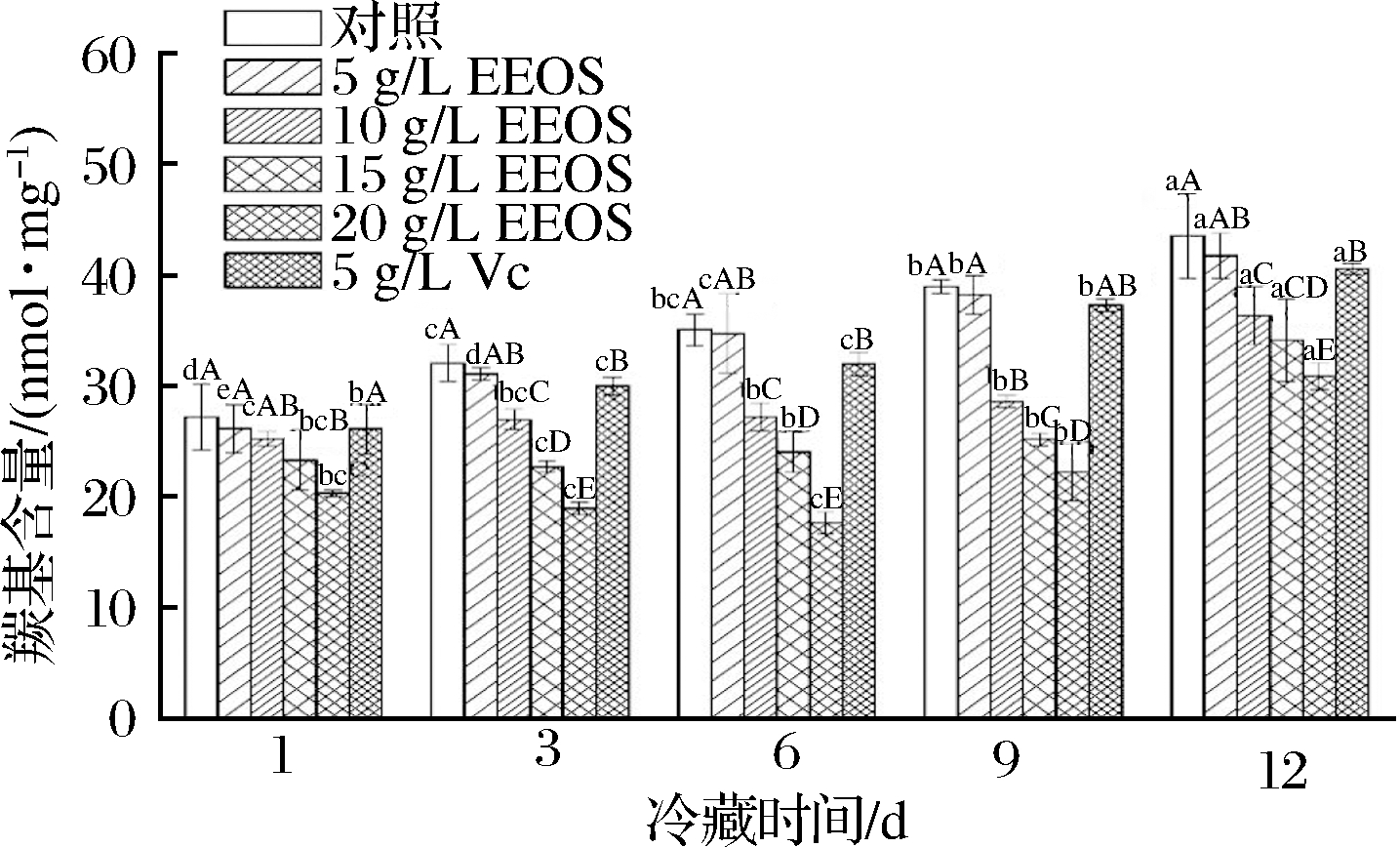
图5 洋葱皮乙醇提取物对冷藏过程中猪肉羰基含量的影响
Fig.5 Effect of EEOS on the carbonyl content of fresh pork during refrigerated storage
2.8 EEOS对生鲜猪肉TVB-N含量的影响
内源酶或腐败菌能将肉中蛋白质和其他含氮物质降解成氨、三甲胺和二甲胺等挥发性碱而形成TVB-N,因此TVB-N是评价鲜肉品质的重要指标之一[28]。TVB-N值与腐败菌群之间有显著的相关性,随着肉质中微生物侵染程度加深,TVB-N值会随之增加。国家标准规定:鲜肉TVB-N值≤20 mg/100 g。如图6所示,随着冷藏时间的延长,各处理组TVB-N 值均呈上升趋势。空白对照组在第6天达到 15.62 mg/100 g,第9天已达到26.37 mg/100 g,该值超过鲜肉的标准,而第9天时,仅15和20 g/L的EEOS 处理组TVB-N值均小于20 mg/100 g,生鲜肉维持在鲜肉范围内,而在第12天时,各处理组的TVB-N值均高于20 mg/100 g。EEOS的加入,可以延缓肉样腐败程度,延缓肉质中TVB-N的生成,且EEOS质量浓度为20 g/L时,抑制效果显著。LEE等[9]的研究结果也表明洋葱皮提取物对肉的腐败有抑制作用,这可能与EEOS的抗菌作用有关。此前,就有报道表明洋葱皮对蜡样芽孢杆菌、金黄色葡萄球菌、黄体微球菌和单核细胞增生李斯特菌等具有抑制作用[28]。

图6 洋葱皮乙醇提取物对冷藏过程中猪肉TVB-N含量的影响
Fig.6 Effect of EEOS on TVB-N content of fresh pork during refrigerated storage
3 结论
洋葱皮乙醇提取物富含多酚类成分,具有很强的抗氧化能力。本研究将猪肉切片在EEOS水溶液中浸渍处理后冷藏,主要是模拟在今后的生产中将EEOS处理液喷涂于猪肉表面,达到抑制表面肉质肌红蛋白氧化导致的色泽褐变、脂肪和蛋白氧化引起的风味劣变以及微生物浸染导致的货架期缩短等不利因素,从而达到提高猪肉新鲜度和延长肉质货架期的目的。EEOS的添加降低了猪肉切片高铁肌红蛋白含量,提高了肉质表面色泽,降低了脂肪和蛋白氧化的程度,减少 TBARS 值的增加和羰基化合物的生成,微生物侵染程度(TVB-N值)的增加也得到抑制,且高浓度EEOS浸渍的处理效果更加显著。综上所述,洋葱皮乙醇提取物作为天然抗氧化剂对猪肉的颜色改善、抑制脂质、蛋白质氧化以及微生物侵染程度具有很好的效果。
[1] ZAHID M A, SEO J K, RASHIDA P, et al.Comparison of butylated hydroxytoluene, ascorbic acid, and clove extract as antioxidants in fresh beef patties at refrigerated storage[J].Food Science of Animal Resources,2019,39(5):768-779.
[2] KARAKAYA M, BAYRAK E, ULUSOY K, et al.Use of natural antioxidants in meat and meat products[J].Journal of Food Science and Engineering,2011,1(1):1-10.
[3] RODR GUEZ-CARPENA J G, MORCUENDE D, ESTÉVEZ M.Avocado by-products as inhibitors of color deterioration and lipid and protein oxidation in raw porcine patties subjected to chilled storage[J].Meat Science,2011,89(2):166-173.
GUEZ-CARPENA J G, MORCUENDE D, ESTÉVEZ M.Avocado by-products as inhibitors of color deterioration and lipid and protein oxidation in raw porcine patties subjected to chilled storage[J].Meat Science,2011,89(2):166-173.
[4] CHENG J R, XU L, XIANG R, et al.Effects of mulberry polyphenols on oxidation stability of sarcoplasmic and myofibrillar proteins in dried minced pork slices during processing and storage[J].Meat Science,2020,160(C):107 973.
[5] TRAN T T T, TON N M N, NGUYEN T T, et al.Application of natural antioxidant extract from guava leaves (Psidium guajava L.) in fresh pork sausage[J].Meat Science,2020,165:108 106.
[6] DAS ARUN K, RAJKUMAR V, NANDA P K, et al.Antioxidant efficacy of litchi (Litchi chinensis Sonn.) pericarp extract in sheep meat nuggets[J].Antioxidants (Basel, Switzerland),2016,5(2):1-10.
[7] 刘世馨. 洋葱皮多酚、黄酮提取及其体外抗氧化等活性研究[D].北京:中国农业科学院,2018.
LIU S X.Study on extraction and antioxidant activity in vitro and others of polyphenols, flavonoids from onion skin[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[8] LEE K A,KIM K T,NAH S Y,et al.Antimicrobial and antioxidative effects of onion peel extracted by the subcritical water[J].Food Science and Biotechnology,2011,20(2):543-548.
[9] LEE S Y,KIM H W,HWANG K E,et al.Combined effect of kimchi powder and onion peel extract on quality characteristics of emulsion sausages prepared with irradiated pork[J].Korean Journal for Food Science of Animal Resources,2015,35(3):277-285.
[10] 任曼妮, 高增明,王存堂.不同溶剂提取对洋葱皮中多酚含量及抗氧化活性的影响[J].食品与发酵工业,2019,45(17):189-193.
REN M N,GAO Z M,WANG C T.Effects of extraction solvents on the phenolic contents and antioxidant activities of onion (Allium cepa L.) peels[J].Food and Fermentation Industries,2019,45(17):189-193.
[11] FRIEDRICH L,SIR I,DALMADI I,et al.Influence of various preservatives on the quality of minced beef under modified atmosphere at chilled storage[J].Meat Science,2007,79(2):332-343.
I,DALMADI I,et al.Influence of various preservatives on the quality of minced beef under modified atmosphere at chilled storage[J].Meat Science,2007,79(2):332-343.
[12] 何晓燕, 蒋其斌,夏天兰,等.不同浓度茶多酚对冷却肉的影响分析[J].食品工业科技,2010,31(6):81-83.
HE X Y,JIANG Q B,XIA T L,et al.Effects of tea polyphenols with different concentration on chilled pork[J].Science and Technology of Food Industry,2010,31(6):81-83.
[13] ZENGIN H,BAYASAL H A.Antioxidant and antimicrobial activities of thyme and clove essential oils and application in minced beef[J].Journal of Food Processing and Preservation,2015,39(6):1 261-1 271.
[14] BASIRI S,SHEKARFOROUSH S S,AMINLARI M,et al.The effect of pomegranate skin extract (PPE) on the polyphenol oxidase (PPO) and quality of pacific white shrimp (Litopenaeus vannamei) during refrigerated storage[J].LWT-Food Science and Technology,2015,60(2):1 025-1 033.
[15] 贾娜, 王乐田,邵俊花,等.芦丁对冷藏猪肉糜脂肪和蛋白氧化及品质特性的影响[J].食品与发酵工业,2016,42(10):105-111.
JIA N,WANG L T,SHAO J H,et al.Effect of rutin on lipid/protein oxidation and quality of minced pork during chilled storage[J].Food and Fermentation Industries,2016,42(10):105-111.
[16] 梁慧, 于立梅,陈秀兰,等.多酚对鸡肉氧化脂肪诱导蛋白质变性的影响[J].食品与发酵工业,2016,42(5):146-151.
LIANG H,YU L M,CHEN X L,et al.Effect of garcinia mangostana polyphenols on protein degeneration induced by chicken oxidation fat[J].Food and Fermentation Industries,2016,42(5):146-151.
[17] JEONG C H,HEO H J,CHOI S G,et al.Antioxidant and anticancer properties of methanolic extracts from different parts of white,yellow,and red onion[J].Food Science and Biotechnology,2009,18:108-112.
[18] HAJRAWATI,NURAINI H,ARIEF I I,et al.Lipid oxidation and antimicrobial activity of cooked beef patties as influenced by leaf extracts of “Cemba” (Albizia lebbeckoides[DC.] Benth)[J].Bulletin of Animal Science,2019,43(1):38-45.
[19] DE OLIVEIRA FERRERA N S,ROSSET M,LINA G,et al.Effect of adding Brosimum gaudichaudii and Pyrostegia venusta hydroalcoholic extracts on the oxidative stability of beef burgers[J].LWT-Food Science and Technology,2019,108:145-152.
[20] LEE M A,KIM T K,HWANG K E,et al.Kimchi extracts as inhibitors of colour deterioration and lipid oxidation in raw ground pork meat during refrigerated storage[J].Journal of the Science of Food and Agriculture,2019,99(6):2 735-2 742.
[21] 肖朝耿, 谭芦兰,朱培培,等.红叶甜菜在肉糜中的发色效果及其抗氧化作用[J].中国食品学报,2019,19(5):111-121.
XIAO C G,TAN L L,ZHU P P,et al.The coloring effect and antioxidant effect of red beet in minced pork[J].Journal of Chinese Institute of Food Science and Technology,2019,19(5):111-121.
[22] FERNANDES R P P,TRINDADE M A,TONIN F G,et al.Evaluation of oxidative stability of lamb burger with,Origanum vulgare,extract[J].Food Chemistry,2017,233:101-109.
[23] 王玮, 汤祥明,金邦荃.高铁肌红蛋白含量和高铁肌红蛋白还原酶活性与冷鲜肉肉色稳定性关系的研究[J].食品科学,2008(7):94-97.
WANG W,TANG X M,JIN B Q.Study on correlation of metmyoglobin content and metmyoglobin reductase activity with color stability of chilled pork[J].Food Science,2008(7):94-97.
[24] SADEGHINEJAD N,SARTESHNIZI R.A,GAVLIGHI H A,et al.Pistachio green hull extract as a natural antioxidant in beef patties:Effect on lipid and protein oxidation,color deterioration,and microbial stability during chilled storage[J].LWT-Food Science and Technology,2018,102:393-402.
[25] KANATT S R,CHANDER R,RADHAKRISHNA P,et al.Potato peel extract natural antioxidant for retarding lipid peroxidation in radiation processed lamb meat[J].Journal of Agricultural and Food Chemistry,2005,53(5):1 499-1 504.
[26] TURGUT S S,SOYER A,ISIKCI F.Effect of pomegranate skin extract on lipid and protein oxidation in beef meatballs during refrigerated storage[J].Meat Science,2016,116:126-132.
[27] KIM W J,LEE K A,KIM K T,et al.Antimicrobial effects of onion (Allium cepa L.) peel extracts produced via subcritical water extraction against Bacillus cereus strains as compared with ethanolic and hot water extraction[J].The Korean Society of Food Science and Technology,2011,20(4):1 101-1 106.
[28] SANTAS J,ALMAJANO M P,CARB R.Antimicrobial and antioxidant activity of crude onion (Allium cepa,L.) extracts[J].International Journal of Food Science & Technology,2010,45(2):403-409.
R.Antimicrobial and antioxidant activity of crude onion (Allium cepa,L.) extracts[J].International Journal of Food Science & Technology,2010,45(2):403-409.
[29] CHELH I,GATELLIER P,SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat science,2006,74(4):681-683.
[30] 曹云刚.植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D].无锡:江南大学,2016.
CAO Y G.Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins:mechanism and application[D].Wuxi:Jiangnan University,2016.