牛乳铁蛋白(bovine lactoferrin, Blf)是一种非血红素铁结合蛋白,由689个氨基酸组成的单一多肽链,分子质量为77 kDa,具有广谱的抗菌、抗真菌、抗病毒、抗肿瘤及参与免疫调节等多种生物学活性[1-5],在食品添加剂、饲料添加剂、医药行业中已有广泛的应用[6-9]。牛乳铁蛋白目前主要从牛乳中提取制得,生产成本高。重组微生物发酵生产牛乳铁蛋白是一种降低牛乳铁蛋白生产成本的极具潜力的方法。毕赤酵母易于高密度发酵培养,AOX1启动子强劲,且具有真核细胞翻译后折叠修饰、加工、糖基化等功能,是表达牛乳铁蛋白的优良宿主[10-16]。本实验室已经构建分泌表达牛乳铁蛋白功能片段(包括2个功能结构域的1~333氨基酸序列,bovine lactoferrin functional fragment, BlfFf)的重组毕赤酵母,但表达量有待提高[17]。增加基因拷贝数是提高重组蛋白表达的最有效手段之一,而核糖体rDNA非转录基因间隔区NTS(non-transcribed spacer)同源整合以及PTVA(posttransformational vector amplification)法是获得多拷贝重组菌株的常用手段[18-20]。HAC1基因编码的Hac1p蛋白是酵母内质网中未折叠蛋白响应(unfolded protein response, UPR)机制的激活因子,因而多拷贝HAC1基因也是提高表达量的有效方法[21-23]。因此本研究在先前工作基础上,进行HAC1等辅助表达基因的导入及多拷贝重组菌的构建及筛选,并借助流式细胞术检测酵母存活率[24-25],以研究基因多拷贝的影响和提高BlfFf表达量。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
宿主菌Pichia pastoris GS115,本实验室保藏菌株;BlfFfG01重组菌及质粒pPICZαA -P0547-Kex2-2A-HAC1由本实验室构建[17, 21];E.coli DH5α感受态细胞,唯地生物。
1.1.2 试剂
DNA限制性内切酶、DNA marker,TaKaRa公司;博来霉素(zeocin)、潮霉素B(hygromycin B)、质粒抽提试剂盒、酵母基因组提取试剂盒、四甲基联苯胺(tetramethylbenzidine,TMB)显色液,上海生工;分子量蛋白marker、牛血清白蛋白(bull serum albumin,BSA)、聚偏氟乙烯膜,索莱宝公司;Anti-6-His单克隆抗体、HRP标记的羊抗鼠IgG二抗,浩克生物公司;Anti-6-His-tag亲和层析柱(His-Trap HP),GE公司产品;His Tag ELISA Detection Kit试剂盒,南京金斯瑞公司;qPCR试剂SYRB Green Realtime PCR Master,诺韦赞生物公司。
1.1.3 培养基
LB、YPD、MD、BMGY与BMMY配方参照Invitrogen公司的《毕赤酵母表达操作手册》。高密度发酵BSM培养基参照Pichia Fermentation Guidelines (Version B,053002,Invitrogen)。
1.2 试验方法
1.2.1 BlfFfG系列菌株的构建
将提取的pPICZαA-P0547-Kex2-2A-HAC1重组质粒用pme Ι线性化后电转法转入BlfFfG01感受态细胞,涂含zeocin抗性的YPDS平板筛选转化子,筛得重组菌BlfFfG02。
以重组质粒pPIC9K-BlfFf为模板[17],PCR扩增PAOX1-BlfFf片段;以毕赤酵母GS115基因组为模板,PCR扩增核糖体rDNA非转录基因间隔区NTS的rDNA1、rDNA2片段;以质粒pPICZαA为模板,PCR扩增PTEF1-EM7启动子片段;以Streptomyces hygroscopicus基因组为模板,PCR扩增潮霉素抗性基因。由上述5个片段经过Overlap PCR融合而成rDNA-NTS-BlfFf克隆表达盒。各片段组成及摩尔比为rDNA1∶BlfFf∶PTEF1-EM7∶HyB∶rDNA2=1∶3∶5∶3∶1。将此表达盒转化BlfFfG02菌株,以潮霉素B抗性平板筛选得到BlfFfG03重组菌株。
PTVA法扩增BlfFf基因拷贝数:以BlfFfG03重组菌株为出发菌株,参照AW等[20]的方法,以潮霉素B抗性梯度离心管连续进行离心转接培养,最后稀释涂布到含6 mg/mL潮霉素B的YPD平板上培养,筛选到不同BlfFf基因拷贝数的菌株,并经摇瓶比较、筛选得到最高BlfFf表达量的重组毕赤酵母菌株BlfFfG10。
PTVA法扩增HAC1基因拷贝数:同上方法,以BlfFfG10为出菌株,以zeocin抗性梯度离心管连续进行离心转接培养,最后稀释涂布到含3 mg/mL zeocin的YPD平板上筛选到不同HAC1基因拷贝数的重组菌株。
BlfFfG系列菌株中的BlfFf和HAC1基因拷贝数通过荧光定量PCR方法测定[26]。
1.2.2 重组毕赤酵母的诱导表达
将GS115-pPIC9K及BlfFfG系列菌株单菌落接种于BMGY中,30 ℃、200 r/min摇床培养18 h(OD600≈2~6),离心收集菌体,用适量的BMMY培养基悬浮菌体,接种于BMMY使其初始OD600=1.0,于30 ℃、200 r/min继续培养96 h,每24 h添加100%(体积分数)甲醇,诱导体积分数为0.5%。诱导结束离心取上清液,-20 ℃保存备用。
1.2.3 表达产物的鉴定
取1 mL诱导96 h发酵上清液,以甲醇-氯仿法浓缩、沉淀蛋白,用40 μL去离子水溶解蛋白,加入SDS上样缓冲液后煮沸10 min,进行SDS-PAGE和Western Blot分析。转印后的膜用0.5%(体积分数)的BSA封闭1 h,加入Anti-6-His单克隆抗体孵育1 h,磷酸盐吐温缓冲液(phosphate buffered solution tween-20,PBST)漂洗3次,10 min/次,再以HRP标记的羊抗鼠IgG二抗孵育1 h,PBST漂洗3次后,用TMB显色。
1.2.4 牛乳铁蛋白功能片段的ELISA定量检测
牛乳铁蛋白功能片段定量测定按照南京金斯瑞公司His Tag ELISA Detection Kit试剂盒说明书操作。
1.2.5 流式细胞术分析酵母存活率
以流式细胞仪(FACSMelodyTM,美国BD公司)测定。取发酵末的毕赤酵母发酵液25 μL,加4 ℃预冷的PBS 1 mL,用振荡器振匀,离心去上清液,用PBS清洗2次菌体,再加1 mL PBS,用振荡器振匀,以20 kHz超声10 s以分散细胞。然后再加入PBS 0.5 mL和碘化丙锭(PI)50 μL(PI终质量浓度为50 μg/mL,PI母液1 mg/mL,用PBS溶解),避光振摇5 min。PI染色后的样品经适当稀释,在4 h内用流式细胞仪进行测定。数据采用FlowJo软件处理。
1.2.6 5 L罐高密度发酵
挑选摇瓶表达量最大的菌株用于高密度发酵,以10%接种量接入含3 L BSM培养基的5 L发酵罐,以自动控制流氨维持pH 5.0,全程发酵温度控制在30 ℃,调节转速与通气量控制溶氧在20%以上。当培养基中甘油消耗完后,溶氧快速上升(DO>60%),随即开始流加含有PTM1的50%甘油200 mL,流速50 mL/h。流加结束后饥饿30 min,流加含有PTM1的100%甲醇进行诱导,控制比生长速率在0.01 h-1左右,诱导后每12 h分别取样,测定目的蛋白含量与菌体湿重。
2 结果与分析
2.1 HAC1基因导入及BlfFf基因多拷贝重组菌株的构建
在已经构建得到的BlfFf基因单拷贝重组毕赤酵母BlfFfG01菌株基础上[17],将HAC1、Kex2(信号肽切割酶基因)基因按照已建立的方法[21]转入重组毕赤酵母BlfFfG01,筛选得到BlfFfG02号菌株。该菌株表达量相比BlfFfG01有所提高,但提高幅度不大。由于BlfFfG02菌株的BlfFf、HAC1基因均只有1拷贝,而拷贝数对于基因的高效表达具有显著影响,因此,利用核糖体rDNA的 NTS同源整合的方法结合PTVA技术来提高重组菌株中的基因拷贝数。将rDNA-NTS-BlfFf克隆表达盒整合到BlfFfG02号菌株的NTS区域,筛选获得BlfFfG03菌株。进一步以BlfFfG03菌株为出发菌株,利用PTVA技术扩增拷贝数,筛选到不同BlfFf基因拷贝数的菌株。各菌株基因拷贝数如表1所示。
表1 BlfFfG系列菌株中BlfFf基因和HAC1基因拷贝数
Table 1 Gene copies of BlfFf and HAC1 in BlfFfG series strains
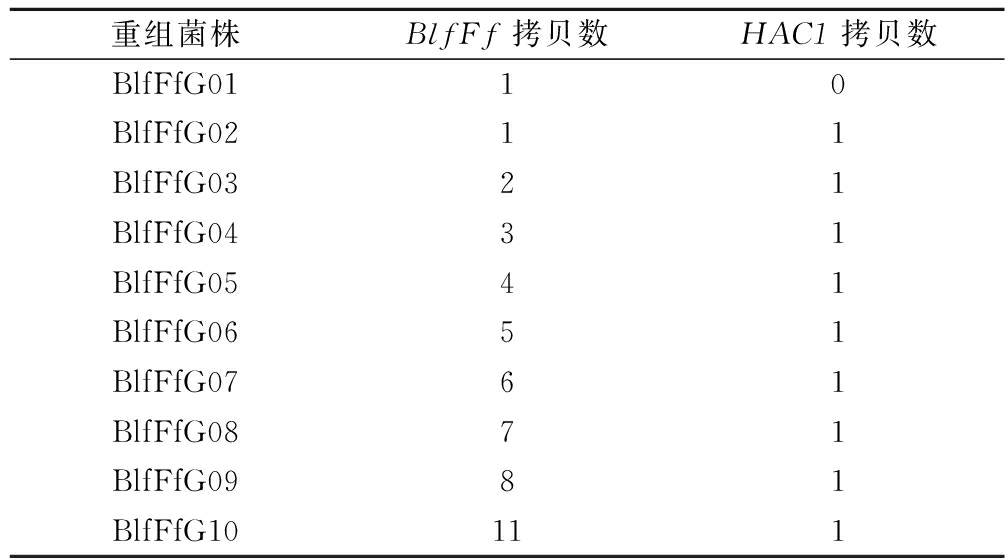
重组菌株BlfFf拷贝数HAC1拷贝数BlfFfG0110BlfFfG0211BlfFfG0321BlfFfG0431BlfFfG0541BlfFfG0651BlfFfG0761BlfFfG0871BlfFfG0981BlfFfG10111
2.2 BlfFf基因多拷贝重组菌株的蛋白表达比较
对BlfFfG01-10系列菌株进行摇瓶发酵,发酵上清进行SDS-PAGE和Western Blot分析,结果如图1所示。
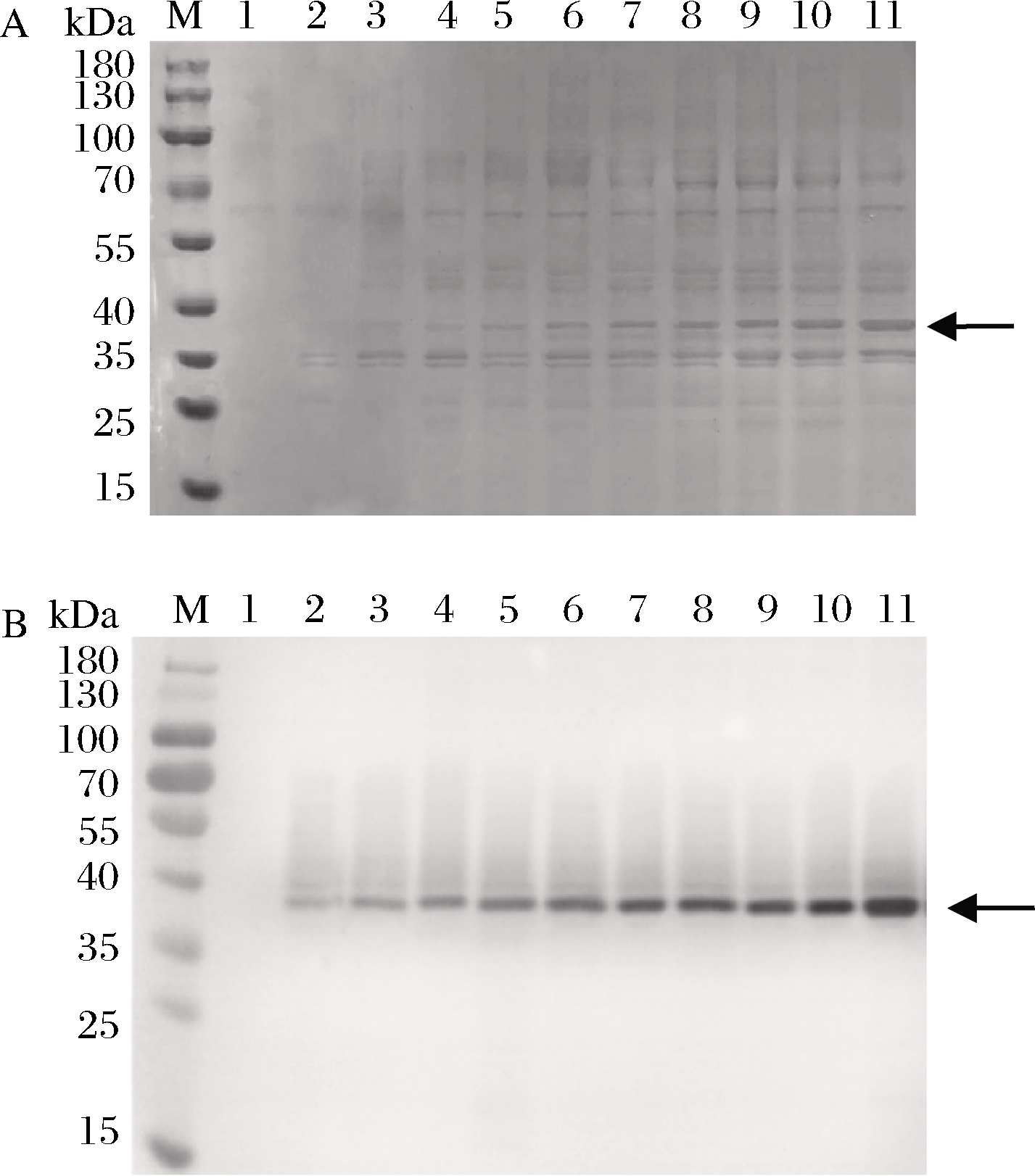
M-蛋白Marker;1-对照(GS115-pPIC9K)的诱导表达上清;2~11-BlfFfG01-10系列菌株的诱导表达上清A-SDS-PAGE分析;B-Western Blot分析
图1 不同BlfFf基因拷贝数菌株诱导表达上清的SDS-PAGE和Western Blot
Fig.1 Analysis of SDS-PAGE and Western Blot on expression products from the recombinant strains with different copies number of BlfFf gene
图1中,阴性对照GS115-pPIC9K菌株摇瓶发酵上清对应的37 kDa分子质量处未见特异性条带产生。结合图像条带灰度比较,由图1中泳道3~11中37 kDa处目的条带的颜色深浅变化尤其是Western Blot特异性显色趋势, 可以看出随着BlfFf基因拷贝数的增加,BlfFf蛋白表达量也随之增加,表明拷贝数对产量影响显著。泳道2和泳道3比较表明,HAC1基因的导入有助于BlfFf表达量的提高。在BlfFf基因高拷贝情况下,细胞内部蛋白翻译、折叠、修饰、分泌的压力会增加,可能引起UPR,这时候导入的单拷贝HAC1基因剂量可能不足以应对UPR。增强HAC1基因剂量有助于缓解细胞蛋白表达机器的压力。因此,对表达量最高的BlfFfG10号菌株进一步应用PTVA法处理以扩增HAC1基因的拷贝数。
2.3 HAC1基因多拷贝重组菌株的构建及BlfFf蛋白表达比较
运用PTVA法获得HAC1拷贝数分别为2、3、4的菌株,命名为BlfFfG11(BlfFf基因拷贝数11、HAC1基因拷贝数2)、BlfFfG12(BlfFf基因拷贝数11、HAC1基因拷贝数3)、BlfFfG13(BlfFf基因拷贝数11、HAC1基因拷贝数4)。对BlfFfG02、10-13系列菌株进行摇瓶发酵,取上清进行SDS-PAGE和Western Blot分析,结果见图2。
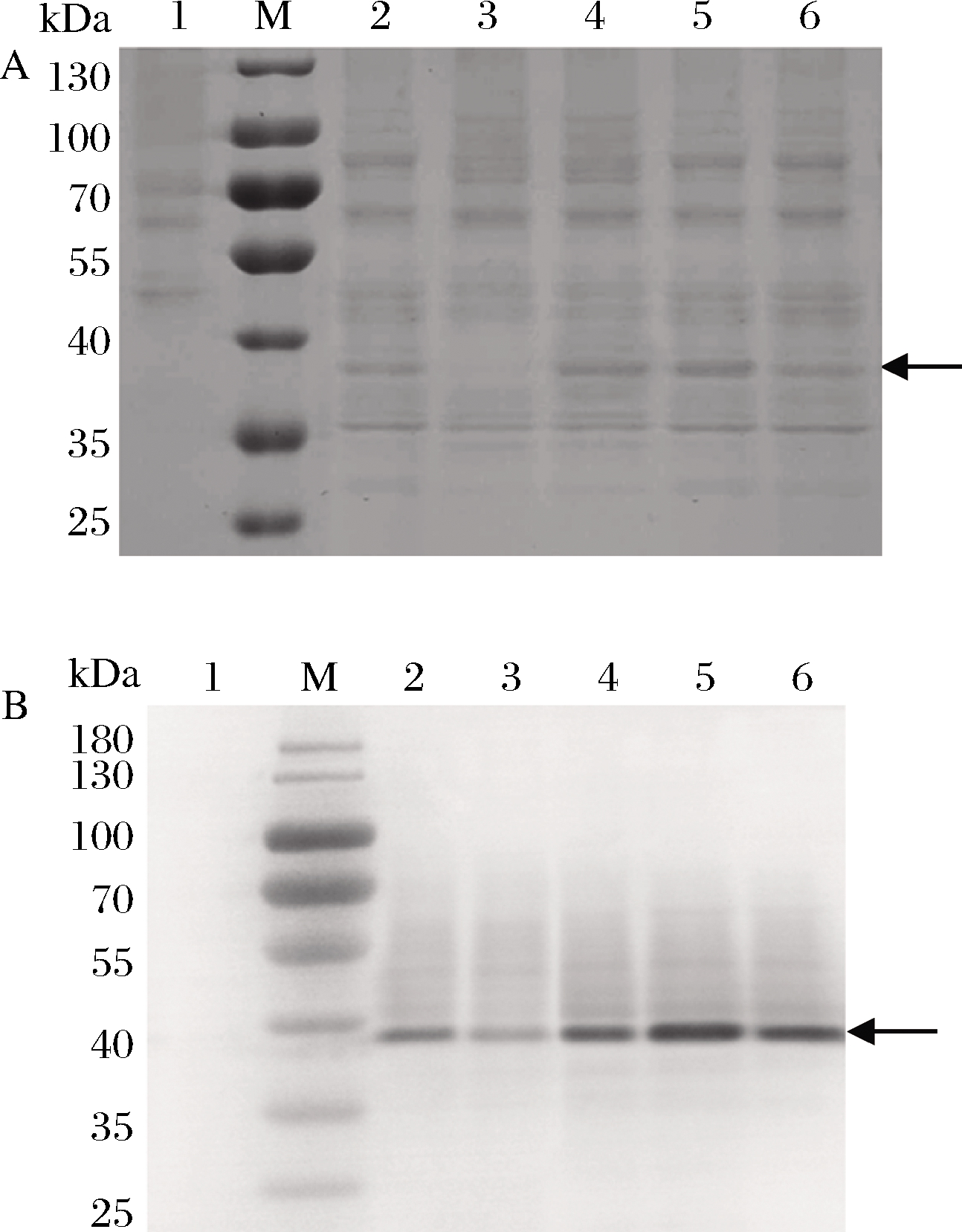
M-蛋白marker;1-对照(GS115-pPICZαA)的表达上清;2-BlfFfG10菌株的表达上清;3-BlfFfG02菌株的表达上清;4~6-BlfFfG11-13菌株的表达上清A-SDS-PAGE分析;B-Western Blot分析
图2 不同HAC1基因拷贝数菌株表达产物的SDS-PAGE和Western Blot
Fig.2 SDS-PAGE and Western Blot of expression products of different HAC1 gene copies number
2、4、5、6泳道条带的分析表明,HAC1基因拷贝数由1增加到3时,BlfFf的表达水平也随之提高,但当HAC1基因拷贝数为4时,BlfFf的表达水平反而下降了。这一结果表明,HAC1基因拷贝数过多,增加了新的限制表达因素。
2.4 基因拷贝数对重组菌株BlfFf的表达水平及细胞存活率的影响
为更准确地比较基因拷贝数的影响,对以上系列菌株的摇瓶发酵样品进行了BlfFf表达水平的ELISA检测(图3)以及应用流式细胞术检测了发酵末菌体的存活率(图4)。
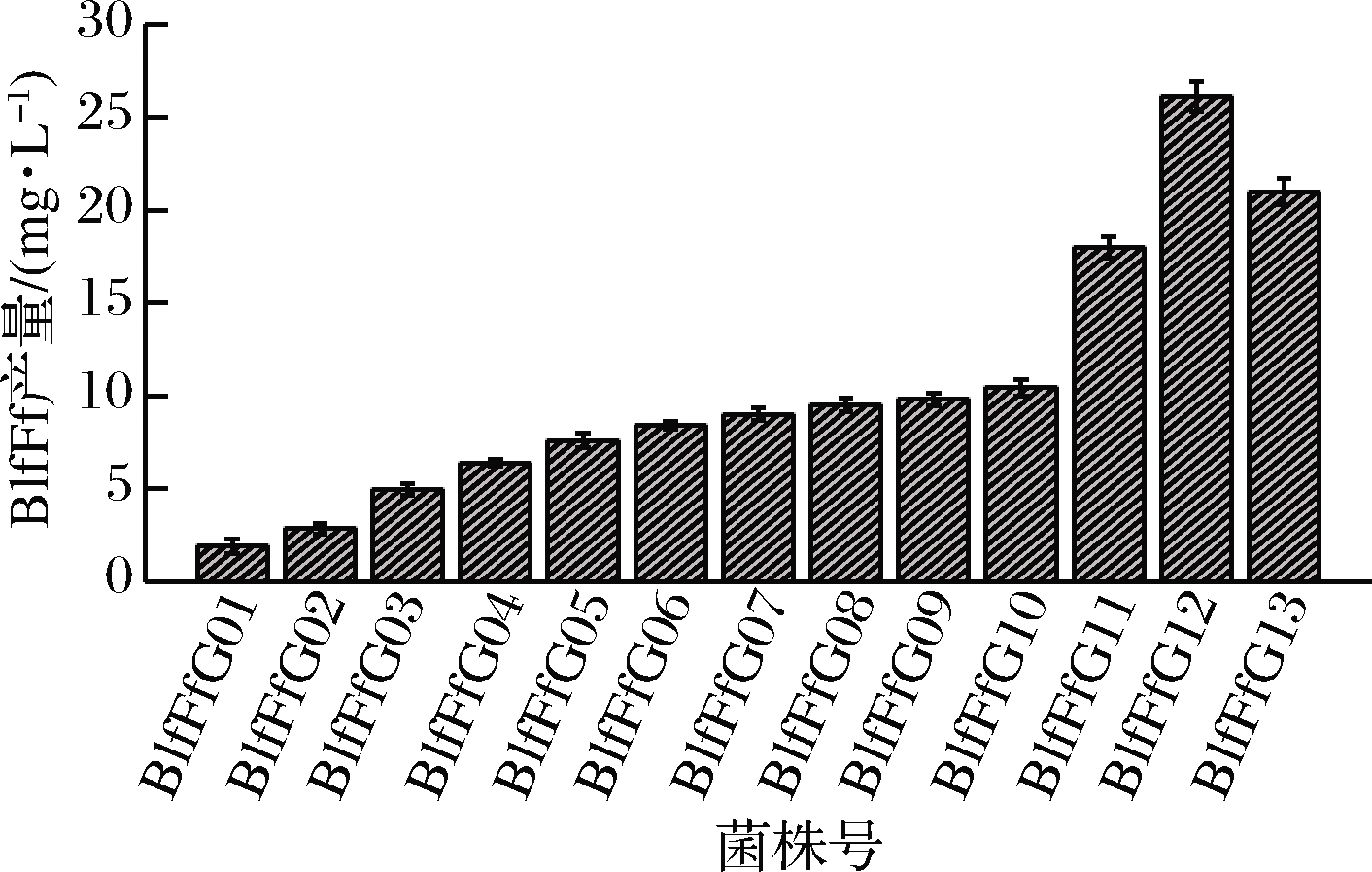
图3 BlfFfG系列菌株的重组蛋白产量比较
Fig.3 Comparison of recombinant protein production between BlfFfG series strains
图3中菌株BlfFfG03-10的重组蛋白产量比较表明,随着目的基因BlfFf拷贝数增加,重组蛋白产量增加,但并非线性递增。BlfFf基因拷贝数增加到6以后,表达量增加幅度越来越小,表明有其他影响重组蛋白表达的限制性因素存在。BlfFfG11与BlfFfG12的产量相比BlfFfG10分别提高了72%和150%,表明HAC1基因拷贝数的增加有力地解除了BlfFfG10菌株重组蛋白表达的部分限制性因素。推测是BlfFf基因11拷贝的BlfFfG10菌株增加的重组蛋白表达压力在胞内引发UPR,部分重组蛋白未正确折叠而被降解,而HAC1基因的增加,促使胞内重组蛋白表达机器功能得以加强而减少了未折叠蛋白的产生。BlfFfG13菌株相比BlfFfG12,重组蛋白表达量反而减少,推测原因是外源导入的HAC1基因启动子采用的是P0547甲醇诱导型启动子[21],与BlfFf基因的AOX1启动子存在着转录因子等功能物质利用的竞争关系,所以过多的HAC1基因拷贝数会负面影响BlfFf基因的诱导转录。
对于BlfFfG01-03、BlfFfG07、BlfFfG10和BlfFfG12菌株,诱导表达末期(发酵96 h)的细胞存活率如流式散点图所示(图4)。

A-BlfFfG01;B-BlfFfG02;C-BlfFfG03;D-BlfFfG07;E-BlfFfG10;F-BlfFfG12
图4 甲醇诱导96 h后细胞存活率的流式细胞仪检测
Fig.4 Flow cytometry detection of cell survival after 96 h of methanol induction
由图4-A与图4-B、图4-E和图4-F的分别对比分析可知,BlfFfG01的存活率为90.0%,导入HAC1基因后,BlfFfG02的存活率提高到92.8%;BlfFfG10存活率为50.5%,HAC1基因拷贝数增加到3后,BlfFfG12的存活率提高到56.5%。这一结果表明HAC1基因的导入对于酵母细胞存活率没有负面影响,有一定的降低死亡率效果。BlfFfG03、BlfFfG07、BlfFfG10的存活率分别为91%、82.1%、50.5%,表明随着BlfFf基因拷贝数增加,酵母细胞死亡率逐渐增加,存活率下降。因为BlfFf基因拷贝数增加,BlfFf蛋白表达量也增加,所以细胞存活率与BlfFf蛋白表达量负相关。造成这一结果的原因可能是BlfFf蛋白的抑菌特性以及高拷贝基因条件下的诱导影响了甲醇代谢。
2.5 BlfFfG12菌株的5 L罐发酵
BlfFfG12菌株在5 L罐进行高密度发酵,整个发酵过程的菌体湿重及BlfFf产量曲线如图5所示。发酵培养120 h后,BlfFfG12的菌体湿重达403.8 g/L、BlfFf产量为120.7 mg/L。在发酵末期,BlfFf产量呈下降趋势,推测这一现象与细胞死亡率不断增加有关。发酵末期的酵母细胞死亡率达30%,破碎细胞释放出的蛋白酶降解了部分BlfFf蛋白。因此,发酵96 h是最适发酵停止时间,此时BlfFf蛋白表达量为133.4 mg/L。
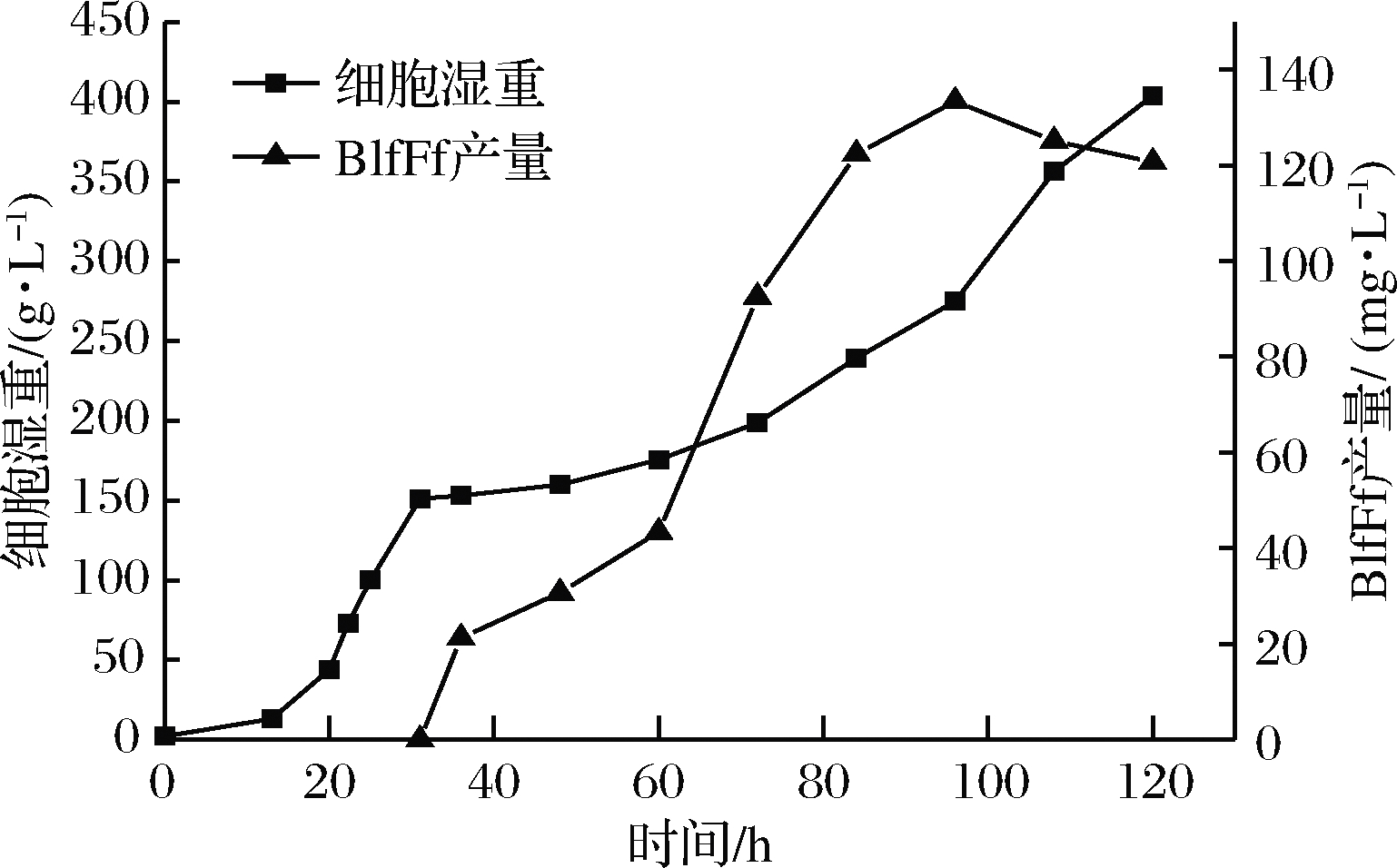
图5 BlfFfG12菌株高密度发酵过程中菌体湿重及BlfFf蛋白产量变化曲线
Fig.5 Time course of cell wet weight and BlfFf production during high-cell-density fermentation by BlfFfG12
3 结论
为了增强重组蛋白分泌表达效率,将HAC1、Kex2基因导入重组毕赤酵母BlfFfG01并利用核糖体rDNA的NTS区域同源整合的方法结合PTVA技术来扩增重组菌株中的BlfFf基因拷贝数。SDS-PAGE、Western Blot和ELISA分析表明,BlfFf产量随着基因拷贝数的增加而增加,但并非线性递增。BlfFf基因拷贝数增加到6以后,表达量增加幅度越来越小,表明有其他影响重组蛋白表达的限制性因素存在。进一步以BlfFf基因11拷贝、HAC1基因1拷贝的BlfFfG10为出发菌株扩增重组菌株中的HAC1基因拷贝数。HAC1基因拷贝数为3的BlfFfG12菌株产量相比BlfFfG10提高了150%,表明HAC1拷贝数增加强化了重组蛋白分泌表达效率。但更高的HAC1基因拷贝数反而降低了重组蛋白产量,有可能和HAC1基因的甲醇诱导型启动子有关,改用组成型启动子后扩增HAC1拷贝数有可能进一步提高产量。
流式细胞术分析发酵末期的酵母细胞存活率,结果表明随着BlfFf基因拷贝数增加,重组菌株存活率下降。摇瓶培养中BlfFfG10菌株发酵末存活率仅为50.5%,原因有待进一步探讨。HAC1基因拷贝数增加可一定程度上提高重组菌株的存活率。通过发酵工艺优化等措施提高高拷贝重组毕赤酵母的存活率,有望进一步提高BlfFf产量。筛选得到产量最高的BlfFfG12菌株,在5 L罐进行高密度发酵96 h,BlfFf蛋白表达量达133.4 mg/L,具备工业化生产应用的潜力。
[1] ELLIS R E, GREATHOUSE D.Characterization of transmembrane peptide-anchored lactoferricin in mixed lipids[J].Biophysical Journal, 2009, 96(3):609.
[2] 朱艳萍, 滕达, 田子罡, 等.乳铁蛋白分子结构及其抗菌机制[J].生物技术通报, 2010(6):37-42.
ZHU Y P, TENG D, TIAN Z G, et al.Molecular structure and antibacterial mechanism of lactoferrin[J].Biotechnology Bulletin, 2010(6):37-42.
[3] 杨鹏华, 倪凤娥.常乳中牛乳铁蛋白的纯化及抗菌活性研究[J].安徽农业科学, 2009, 37(16):7 351-7 352.
YANG P H, NI F E.Purification and antibacterial activity of bovine lactoferrin from cows′ milk[J].Journal of Anhui Agricultural Sciences, 2009, 37(16):7 351-7 352.
[4] WANG X, WANG X M, HAO Y, et al.Research and development on lactoferrin and its derivatives in China from 2011-2015[J].Biochemistry and Cell Biology, 2017, 95(1):162-170.
[5] BLANCA I F, NORBERTO V G, TANIA S C, et al.High-level expression of recombinant bovine lactoferrin in Pichia pastoris with antimicrobial activity[J].International Journal of Molecular Sciences, 2016, 17(6):902.
[6] 郭爱珍,吕自力,钟浩, 等.牛乳铁蛋白肽及其衍生肽生物活性与研究进展[J].中国乳品工业, 2016, 44(5):22-27.
GUO A Z, LYU Z L, ZHONG H, et al.Biological activity and research progress of bovine lactoferricin and derived peptide[J].China Dairy Industry, 2016, 44(5):22-27.
[7] 姚望, 张莉, 马宁.乳铁蛋白对牙龈卟啉单胞菌生长抑制作用研究[J].口腔医学研究, 2012, 28(1):24-31.
YAO W,ZHANG L,MA N.Inhibitory effect of lactoferrin on the growth of Porphyromonas gingivalis[J].Journal of Oral Science Research, 2012, 28(1):24-31.
[8] 罗娟, 成国祥, 袁渝萍, 等.重组人乳铁蛋白对幽门螺杆菌抑菌作用的实验研究[J].重庆医学, 2016, 45(10):1 302-1 305.
LUO J,CHENG G X,YUAN Y P, et al.Experimental study on bacteriostatic effect of recombinant human lactoferrin on Helicobacter pylor[J].Chonqing Medicine, 2016, 45(10):1 302-1 305.
[9] 唐慧娴,张振海,赵志英,等.乳铁蛋白作为药物载体的研究进展[J].药学学报, 2015, 50 (6):675-681.
TANG H X, ZHANG Z H, ZHAO Z Y, et al.Research progress of lactoferrin as drug carriers[J].Acta Pharmaceutica Sinica, 2015, 50 (6):675-681.
[10] 马银鹏, 王玉文, 党阿丽, 等.毕赤酵母表达系统研究 进展[J].黑龙江科学, 2013, 4(9):27-31.
MA Y P, WANG Y W, DANG A L, et al.Advances of Pichia pastoris expression system[J].Heilongjiang Science, 2013, 4(9):27-31.
[11] 江鹏,汤斌. 蚓激酶基因在毕赤酵母中的表达及其发酵条件优化[J].食品与发酵工业,2018,44(10):79-83.
JIANG P, TANG B, et al.The expression of lumbrokinase gene in Pichia pastoris and the optimization of high density fermentation conditions[J].Food and Fermentation Industries,2018,44(10):79-83.
[12] 王鑫,金鹏,宋鹏,等.黑曲霉酸性蛋白酶 EXPA 的克隆表达与酶学性质解析[J].食品与发酵工业, 2019, 45(3):40-46.
WANG X, JIN P, SONG P, et al.Cloning,expression and biochemical characterization of a novel acid protease EXPA from Aspergillus niger[J].Food and Fermentation Industries, 2019, 45(3):40-46.
[13] BARRIG N J M, VALERO F, MONTESINOS J L.A macrokinetic model-based comparative meta-analysis of recombinant protein production by Pichia pastoris under AOX1 promoter[J].Biotechnology and Bioengineering, 2015, 112(6):1 132-1 145.
[14] CHAHARDOOLI M, NIAZI A, ARAM F, et al.Expression of recombinant arabian camel lactoferricin-related peptide in Pichia pastoris and its antimicrobial identification[J].Journal of the Science of Food and Agriculture, 2016,96(2):569-575.
[15] YEN C C.Expression of lactoferrin in Pichia pastoris induction by glucose in a modified g1 promoter system and its antimicrobial and antitumor activities[J].Respirology, 2017, 22(S3):129-130.
[16] LI J B, ZHU W Z, LUO M R, et al.Molecular cloning, expression and purification of lactoferrin from tibetan sheep mammary gland using a yeast expression system[J].Protein Expression and Purification, 2015, 109:35-39.
[17] 魏春, 任郑, 吴涛, 等.重组牛乳铁蛋白功能片段在毕赤酵母中的表达及高密度发酵[J].食品与发酵工业, 2019, 45(11):29-33.
WEI C, REN Z, WU T, et al.Recombinant bovine lactoferrin functional fragment expressed in Pichia pastoris and high-cell-density fermentation[J].Food and Fermentation Industries, 2019, 45(11):29-33.
[18] HOHENBLUM H, GASSER B, MAURER M, et al.Effects of gene dosage, promoters, and substrates on unfolded protein stress of recombinant Pichia pastoris[J].Biotechnology and Bioengineering, 2004, 85(4):367-375.
[19] YAMADA R, OGURA K, KIMOTO Y, et al.Toward the construction of a technology platform for chemicals production from methanol:d-lactic acid production from methanol by an engineered yeast Pichia pastoris[J].World Journal of Microbiology and Biotechnology, 2019, 35(2):37.
[20] AW R, POLIZZI K M.Liquid PTVA:A faster and cheaper alternative for generating multi-copy clones in Pichia pastoris[J].Microbial Cell Factories, 2016, 15(1):29.
[21] SUN J, JIANG J, ZHAI X Y, et al.Coexpression of Kex2 endoproteinase and Hac1 transcription factor to improve the secretory expression of bovine lactoferrin in Pichia pastoris[J]. Biotechnology and bioprocess engineering.2019, 24(6):934-941.
[22] HUANG M M, GAO Y Y, ZHOU X S, et al.Regulating unfolded protein response activator HAC1p for production of thermostable raw-starch hydrolyzing a-amylase in Pichia pastoris[J].Bioprocess Biosyst Eng, 2017, 40(3):341-350.
[23] 顾磊, 张娟, 堵国成, 等.共表达HAC1 基因对重组毕赤酵母分泌表达葡萄糖氧化酶的影响[J].食品与生物技术学报, 2016, 35(2):113-122.
GU L, ZHANG J, DU G C, et al.Effects of co-expression of HAC1 on glucose oxidase production in recombinant Pichia pastoris[J].Journal of Food Science and Biotechnology, 2016, 35(2):113-122.
[24] HYKA P, ZULLIG T, RUTH C, et al.Combined use of fluorescent dyes and flow cytometry to quantify the physiological state of Pichia pastoris during the production of heterologous proteins in high-cell-density fed-batch cultures[J].Applied and Environmental Microbiology, 2010, 76(13):4 486-4 496.
[25] HOHENBLUM H, BORTH N, MATTANOVICH D.Assessing viability and cell-associated product of recombinant protein producing Pichia pastoris with flow cytometry[J].Journal of Biotechnology, 2003, 102(3):281-290.
[26] 宣姚吉, 周祥山, 张元兴.实时荧光定量PCR检测毕赤酵母基因组中外源基因拷贝数[J].中国生物制品学杂志, 2009, 22 (12):1 236-1 239;1 243.
XUAN Y J, ZHOU X S, ZHANG Y X, et al.Determination of copy number of foreign gene in genome of Pichia pastoris by real-time fluorescent quantitative PCR[J].Chinese Journal of Biologicals, 2009, 22 (12):1 236-1 239;1 243.