近年来,随着生活水平不断提高,对鸡、鸭等家禽需求日益增加,我国家禽养殖产业得到迅猛发展,2018年,我国禽蛋产量位居世界第一(3 128万t),禽肉产量位居世界第二(1 994万t)[1]。而羽毛占活禽总质量的5%~7%,据此推算,我国羽毛年产量超过100万t。目前,家禽羽毛中除少量绒羽可制作羽绒制品外,大部分并未得到利用,常会被填埋或焚烧[2],不仅引起严重的环境污染,还会造成蛋白质资源的巨大浪费,甚至会传播鸡新城疫、气囊炎等疾病[3]。羽毛中粗蛋白(主要为角蛋白)含量可达85%以上,且氨基酸组成比较齐全,是一种潜在天然氨基酸来源的生物资源[4]。但羽毛中主要是富含二硫键、结构稳定的角蛋白,不容易被常见蛋白酶降解,需要经过处理后才能被应用[5]。传统是采用物理或化学方法如高温高压、强酸强碱和挤压膨化等方式处理羽毛,不仅工艺复杂、能耗高、环境污染严重,而且会对所产生的氨基酸造成破坏[6]。而采用可分泌角蛋白酶的微生物对羽毛进行降解,不仅反应条件温和、降解效果好,而且对氨基酸的破坏较小,降解产物可在饲料、肥料、医药等行业广泛应用[7-9]。因此,利用微生物法降解羽毛,不仅可充分利用废弃蛋白资源,而且对环境保护也具有积极意义。
目前已经筛选出真菌、放线菌、细菌等30多种可降解羽毛的微生物[5,10],与真菌和放线菌相比,细菌类如地衣芽孢杆菌(Bacillus licheniformis)[11]、短小芽孢杆菌(Bacillus pumilus)[12]、枯草芽孢杆菌(Bacillus subtilis)[13]、粘金黄杆菌(Caldicoprobacter guelmensis)[14]等具有生长快、产酶活性高、工业应用安全等优点,成为目前角蛋白酶来源的主要产生菌。但仍存在角蛋白酶活力低、羽毛降解效果差、发酵周期长等问题,是限制废弃羽毛微生物工业化的瓶颈之一。除菌株本身产酶能力对角蛋白酶酶活起着决定作用外,培养基的组成及培养条件等外部环境因素也影响着微生物潜力的释放。RAMNAI等[15]采用Plackett-Burman(PB)试验及响应面优化方法对B.licheniformis RG1产角蛋白酶的条件进行了优化,酶活提高3.5倍。冀勇良等[16]采用单因素结合响应面优化方法对B.pumilus ZW-36产角蛋白酶的发酵条件进行优化,优化后角蛋白酶酶活达到57.14 U/mL,较优化前(38.27 U/mL)酶活提高了49.3%。蒋彪等[17]采用响应面法对Bacillus sp.CJPE209产角蛋白酶条件优化后酶活可达503.5 U/mL,较优化前提高20%以上。
本研究以实验室前期筛选得到的1株海洋来源高效降解羽毛的拟蕈状芽孢杆菌(Bacillus paramycoides)Gxun-30为产酶菌株,通过单因素及响应面优化方法对发酵培养基及发酵条件进行优化,提高了该菌株产角蛋白酶的能力,为后期利用该菌株降解废弃羽毛角蛋白资源奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种
拟蕈状芽孢杆菌(B.paramycoides Gxun-30)[8]筛选自广西北海某海鸭养殖场。
1.1.2 羽毛
收集家禽市场的鸡、鸭等羽毛,分别用自来水、蒸馏水洗净后,70 ℃烘箱烘干至衡重,羽毛无需粉碎,较长羽毛剪成2 cm左右小段,备用。
1.1.3 试剂
蛋白胨、酵母抽提物,英国OXOID公司;琼脂粉为西班牙进口分装;干酪素、福林酚,生物工程(上海)股份有限公司,均为分析纯。
1.1.4 培养基
种子培养基(g/L):酵母粉5,蛋白胨10,NaCl 5,pH 7.2。
初始发酵培养基(g/L):羽毛10,NaCl 5,K2HPO4 1.4,MgSO4 0.1,KH2PO40.7,pH 7.0。
1.2 实验方法
1.2.1 角蛋白酶活测定
(1)粗酶液的制备:粗酶液为发酵液12 000 r/min、离心10 min后得到的上清液。
(2)角蛋白酶酶活测定:参照文献[8]的方法进行。
1.2.2 单因素实验分析
(1)羽毛含量对菌株产角蛋白酶的影响
以初始发酵培养基为基础,分别称取0、10、15、20、25 g/L羽毛,其他培养基成分不变,装液量为50 mL/250 mL三角瓶,接种量为1%,35 ℃,200 r/min条件下培养60 h,每组设3个平行,结果取平均值,测定不同羽毛浓度下的粗酶液酶活,以确定最适羽毛添加浓度(若无特殊说明,其他条件相同)。
(2)碳源及浓度对菌株产角蛋白酶的影响
分别添加10 g/L不同碳源,根据酶活大小确定最适碳源,再对浓度进行优化,从而确定最适浓度。
(3)氮源及浓度对菌株产角蛋白酶的影响
分别添加2 g/L有机氮源(牛肉膏、酵母粉、玉米浆、蛋白胨、酪蛋白)和无机氮源(硫酸铵、硝酸铵),根际酶活大小确定最适氮源,再对氮源浓度进行优化。
(4)无机盐及浓度对菌株产角蛋白酶的影响
分别添加0.1 g/L不同无机盐,根据酶活大小确定菌株产酶的最佳无机盐,再对浓度进行优化。
(5)发酵初始pH值及接种量对菌株产角蛋白酶的影响
将发酵初始pH值分别调为6.0、6.5、7.0、7.5、8.0、8.5,接种量分别为0.5%、1%、2%、3%、4%、5%、6%,根据酶活大小确定菌株产酶的最佳初始pH值和最佳接种量。
(6)发酵时间和温度对菌株产角蛋白酶的影响
发酵时间分别设为12、24、36、48、60 h,发酵温度分别设为30、32.5、35、37.5、40 ℃,根据酶活大小确定菌株产酶最佳发酵时间和温度。
1.2.3 Packett-Burman 试验分析
根据前期单因素试验结果,利用Design-Expert 8.0.6软件选用N=13的PB试验设计,对8个试验因子进行研究,每个因子取-1、+1水平,以角蛋白酶酶活的均值Y(U/mL)为响应值,从中确定出相对较显著的影响因子,以便进行下一步响应面试验[19]。各个因子及水平见表1。
表1 Plackett-Burman试验设计参数和水平
Table 1 Six Plackett-Burman designed experimental parameters and levels

水平玉米浆(X1)/(g·L-1)果糖(X2)/(g·L-1)接种量(X3)/%氯化钙(X4)/(g·L-1)pH(X5)羽毛(X6)/(g·L-1)时间(X7)/h温度(X8)/℃-142.510.055.5104033167.530.156.5205637
1.2.4 最陡爬坡试验分析
依据影响角蛋白酶酶活显著因素的效应值大小来决定最陡爬坡试验的步长,根据酶活大小找到爬坡试验的拐点,为下一步响应面优化(Box-Behnken法)提供中心点数据。
1.2.5 Box-Behnken 试验分析
根据PB试验和最陡爬坡试验结果,采用3因素3水平的Box-Behnken优化试验来确定B.paramycoides Gxun-30产角蛋白酶的最佳培养基组成,用软件对酶活试验结果进行处理和分析,并对获得最佳产酶条件进行发酵验证[20]。
1.2.6 数据处理及分析
采用Design-Expert 8.0.6.1和SPSS 13.0进行试验设计及数据分析,Origin 8.0软件制图。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 羽毛浓度对B.paramycoides Gxun-30产角蛋白酶的影响
羽毛浓度对菌株产角蛋白酶影响如图1所示,当不添加羽毛时,无法检测到角蛋白酶酶活,可能由于羽毛除了为菌株生长所需营养外,还可诱导菌株分泌角蛋白酶。这与目前文献报道结果类似:产角蛋白酶大多数菌株往往需要角蛋白类底物诱导,才能诱导酶的产生和胞外分泌[21]。当羽毛质量浓度低于15 g/L时,酶活随着羽毛浓度升高而逐渐增加,当羽毛质量浓度为15 g/L时,酶活达到最高为227.38 U/mL;但当羽毛质量浓度高于15 g /L时,酶活反而减少,可能是羽毛含量过高时,发酵液的黏稠度较大,影响了发酵体系中氧的供应,进而影响菌株生长和角蛋白酶分泌[12]。因此,羽毛最适添加量为 15 g/L。
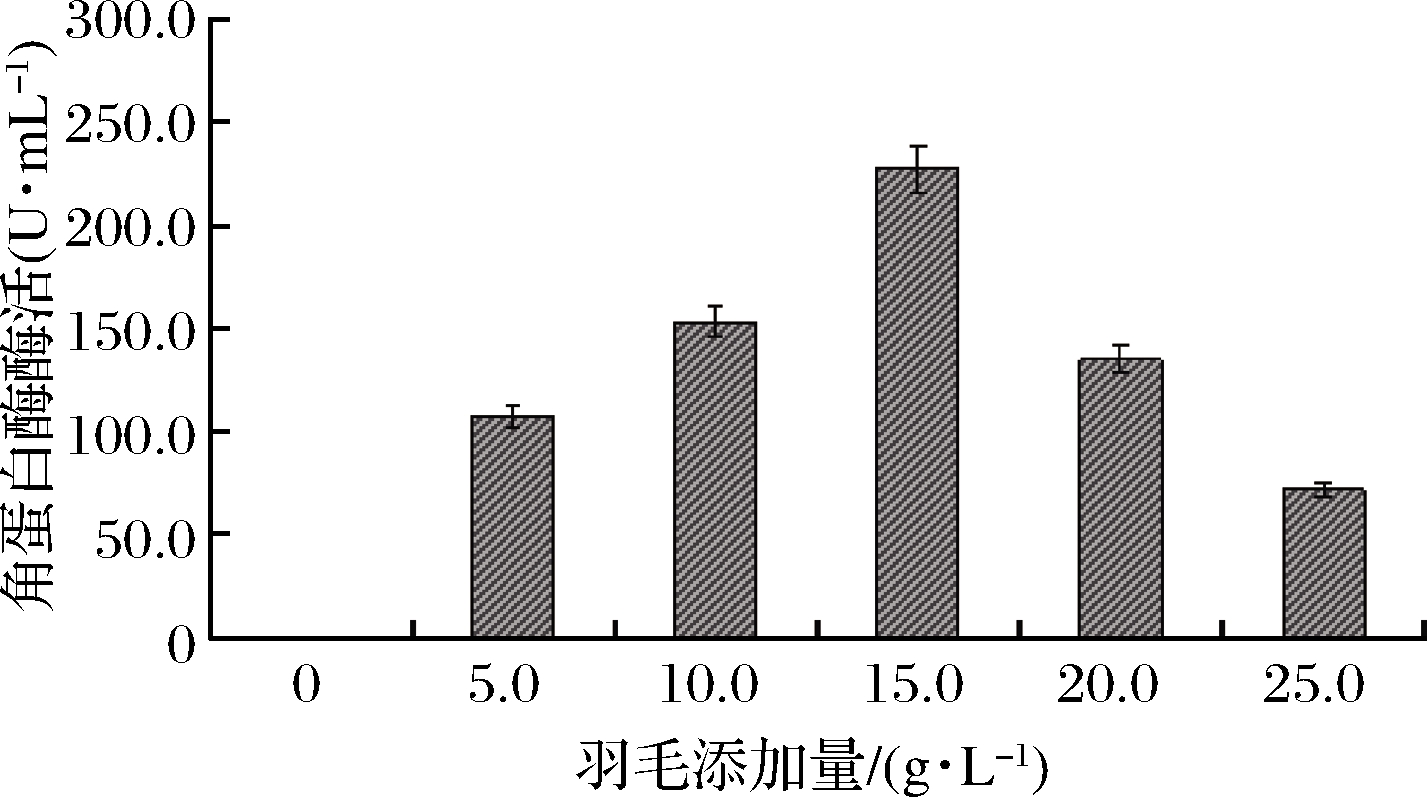
图1 羽毛添加量对B.paramycoides Gxun-30菌株产角蛋白酶的影响
Fig.1 Effect of different feather contents on keratinase production of strain B.paramycoides Gxun-30
当发酵培养基中羽毛为唯一碳、氮源时,菌株需要先分泌角蛋白酶降解羽毛后,才能获得生长所需营养,但在生长初期,培养基内菌株分泌角蛋白酶较低,羽毛降解产物较少,导致营养相对缺乏,菌体无法快速积累,最终无法达到较高的产酶水平[15]。
2.1.2 外加碳源对B.paramycoides Gxun-30产角蛋白酶的影响
碳源为微生物生长代谢提供碳骨架和能量,其种类及浓度对微生物生长代谢至关重要。由图2可知,不同碳源对B.paramycoides Gxun-30产酶的影响不同,蔗糖和可溶性淀粉对菌株产酶有阻遏作用,而果糖、麦芽糖和葡萄糖对产酶有激活作用,特别是添加果糖时,酶活可达335.72 U/mL,远高于对照酶活154.36 U/mL。因此,B.paramycoides Gxun-30产角蛋白酶最适碳源为果糖。进一步对果糖最适添加浓度进行优化,当添加量为10 g/L时,酶活最高为336.85 U/mL。

a-不同碳源;b-不同果糖添加量
图2 碳源及浓度对B.paramycoides Gxun-30产角蛋白酶的影响
Fig.2 Effect of carbon source species and concentration on keratinase production of strain B.paramycoides Gxun-30
2.1.3 外加氮源对角蛋白酶酶活的影响
氮源是微生物蛋白质、核酸以及含氮代谢产物合成的重要营养物质,对微生物生长及代谢具有重要影响。由图3可知,无机氮源(硫酸铵和硝酸铵)对产酶均产生抑制;而牛肉膏、酵母粉、玉米浆、蛋白胨等有机氮源对菌株产酶有激活作用,当玉米浆为氮源时,酶活最高为323.45 U/mL。进一步对玉米浆的最适浓度进行了优化,当添加4.0 g/L时,酶活最高为460.90 U/mL;但浓度增高时,酶活反而迅速降低,可能是由于过高的氮源抑制了菌株诱导角蛋白酶产生[12]。因此,玉米浆最适添加量为4.0 g/L。
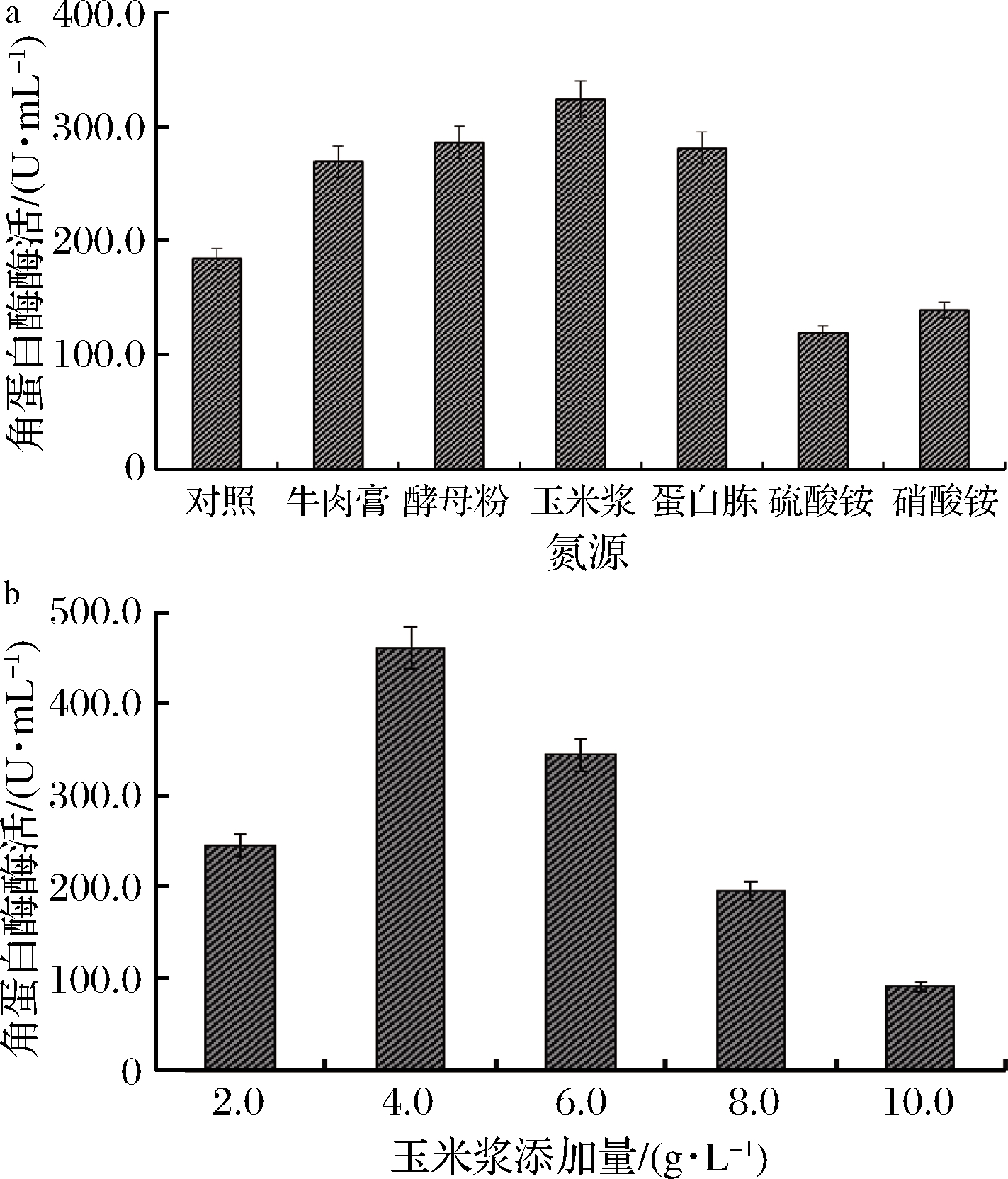
a-不同氮源;b-不同玉米浆添加量
图3 氮源及浓度对B.paramycoides Gxun-30产角蛋白酶的影响
Fig.3 Effect of nitrogen source species and concentration on keratinase production of strain B.paramycoides Gxun-30
2.1.4 无机盐对菌株产酶的影响
无机盐除对微生物细胞膜渗透压有调节作用外,其所含金属离子往往是蛋白酶的辅助因子,对维持酶的催化活性有重要作用。由图4可知,硫酸锰和硫酸锌对菌株产酶活性略有抑制;而硫酸铜和硫酸亚铁对菌株产酶有强烈抑制;而氯化钙、硫酸镁及氯化钠有显著促进作用,特别是添加氯化钙时,酶活达468.60 U/mL,较对照提高了近4倍。可能是Ca2+、Mg2+和Na+能直接参与酶活性中心的构成或是酶的激活剂,进而提高了发酵液中酶的活性[23]。氯化钙最适添加质量浓度为0.15 g/L。

a-不同无机盐;b-不同氯化钙添加量
图4 无机盐及浓度对B.paramycoides Gxun-30产角蛋白酶的影响
Fig.4 Effects of inorganic salts and concentration on keratinase production of strain B.paramycoides Gxun-30
2.1.5 接种量及初始pH值对菌株产酶的影响
由图5可知,接种量对菌株产酶有较大影响,当接种量为2%时,酶活达到最大474.37 U/mL。接种量过低,菌体延滞期增加,进而影响酶的合成;而接种量过高时,菌体迅速进入对数生长,前期营养消耗过快,而稳定期蛋白酶合成时营养供应不足,从而影响酶的合成[19]。当初始pH值低于6.5时,酶活随pH值升高而增加, pH值为6.5时,酶活达到最大为469.24 U/mL;但当pH值高于7.0时,酶活随pH值的升高而迅速下降。这说明B.paramycoides Gxun-30在弱酸性条件下有利于菌株生长和酶的诱导;而菌株自身代谢相关的酶活性在碱性条件下受到抑制。因此,该菌株产酶最适初始pH值为6.5~7.0,与多数细菌类产角蛋白的最适pH为弱碱性的报道不同[22]。
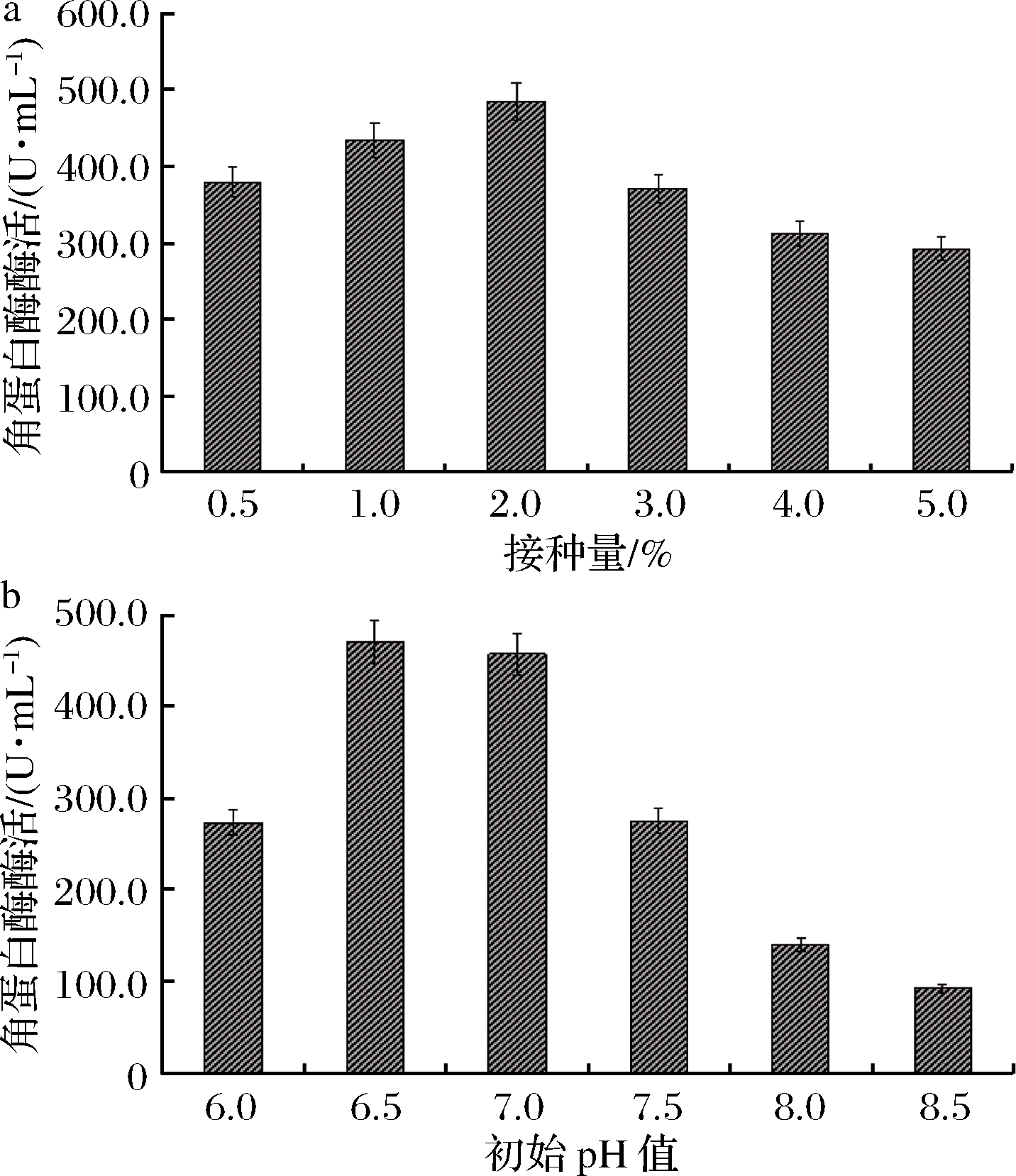
a-接种量;b-初始pH值
图5 接种量及初始pH对B.paramycoides Gxun-30产角蛋白酶的影响
Fig.5 Effect of inocation amount and initial pH on keratinase productionof strain B.paramycoides Gxun-30
2.1.6 发酵温度和时间对产酶活性的影响
由图6可知,最适发酵时间为48 h,酶活475.00 U/mL;最适发酵温度35~37.5 ℃,酶活达773.57 U/mL。
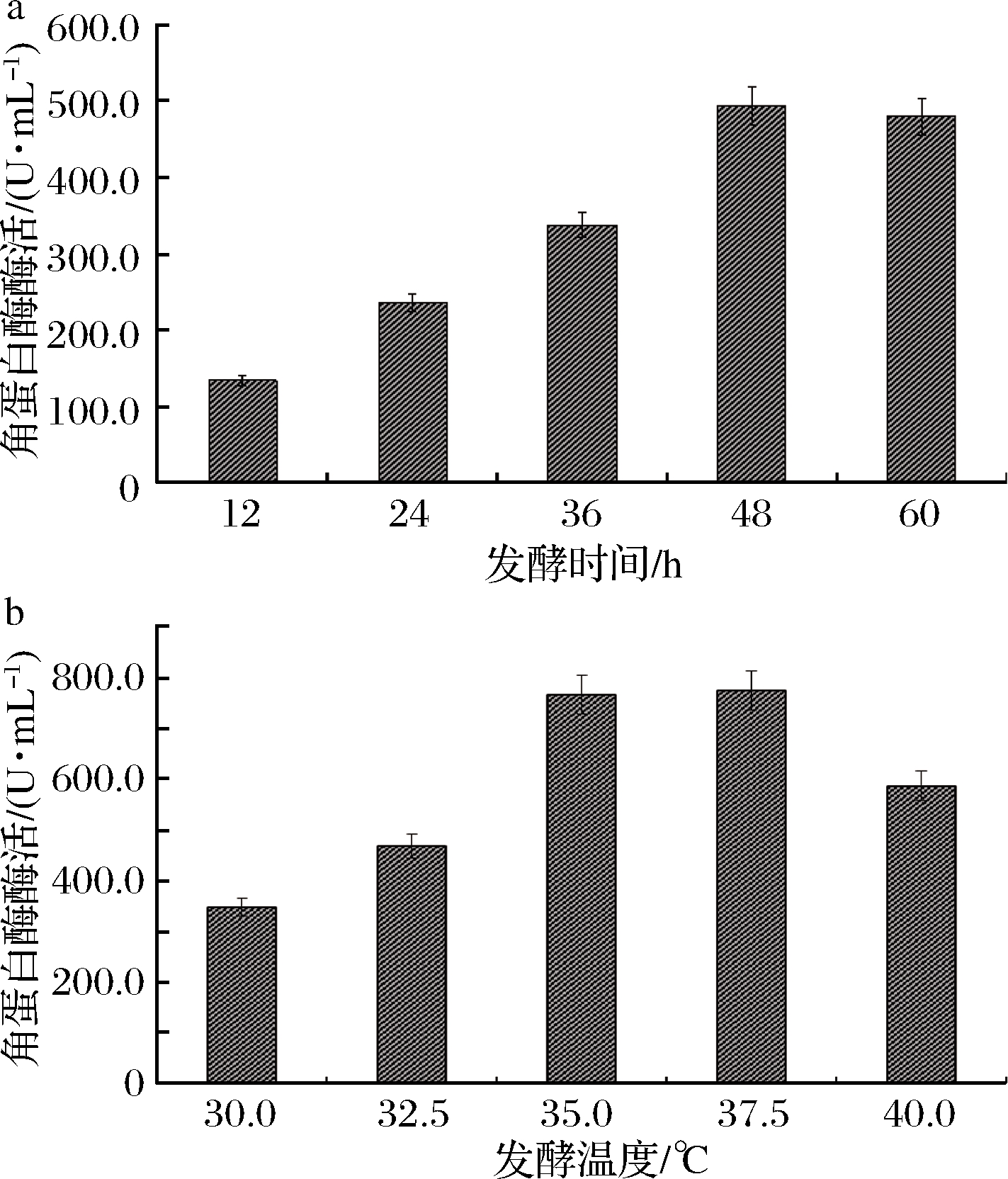
a-发酵时间;b-发酵温度
图6 发酵时间和温度对B.paramycoides Gxun-30产角蛋白酶的影响
Fig.6 Effect of fermentation time and temperature on keratinase production of strain B.paramycoides Gxun-30
2.2 Packett-Burman试验
PB试验设计及结果见表2,利用Design-Expert软件对表2数据进行分析,可得到模型回归方程:Y=446.45+113.41X1-18.94X2+1.70X3+66.50X4+24.19X5-64.59X6-0.02X7-3.33X8。该模型的R2为0.967 3,P值为0.032,表明模型的拟合度较好。对表2结果进行统计分析见表3。各个影响因子的显著性排序为:X1>X4>X6>X5>X2>X3>X8>X7,其中因素X1、X4、X6的P值<0.05,表明这3个因素即玉米浆、氯化钙、羽毛含量是影响菌株分泌角蛋白酶的重要因素[20],需进行下一步的最陡爬坡实验。
表2 Plackett-Burman试验设计和结果
Table 2 Plackett-Burman experimental design and results
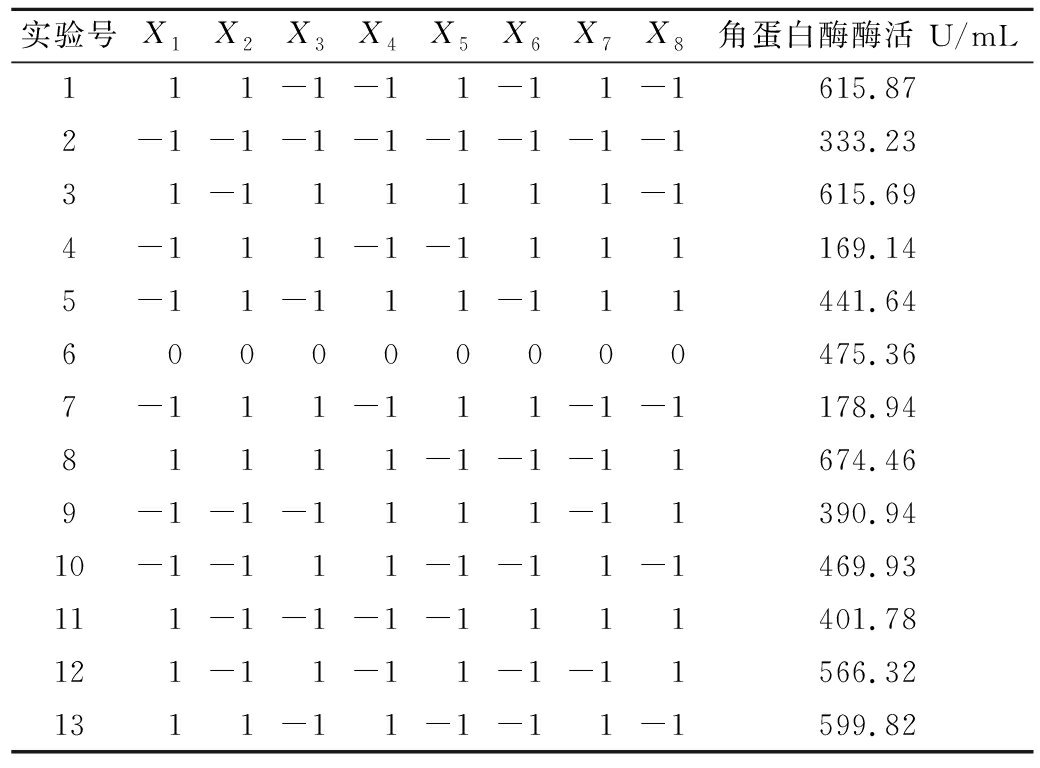
实验号X1X2X3X4X5X6X7X8角蛋白酶酶活 U/mL111-1-11-11-1615.872-1-1-1-1-1-1-1-1333.2331-111111-1615.694-111-1-1111169.145-11-111-111441.64600000000475.367-111-111-1-1178.9481111-1-1-11674.469-1-1-1111-11390.9410-1-111-1-11-1469.93111-1-1-1-1111401.78121-11-11-1-11566.321311-11-1-11-1599.82
表3 Plackett-Burman试验设计分析
Table 3 The analysis of Plackett-Burman
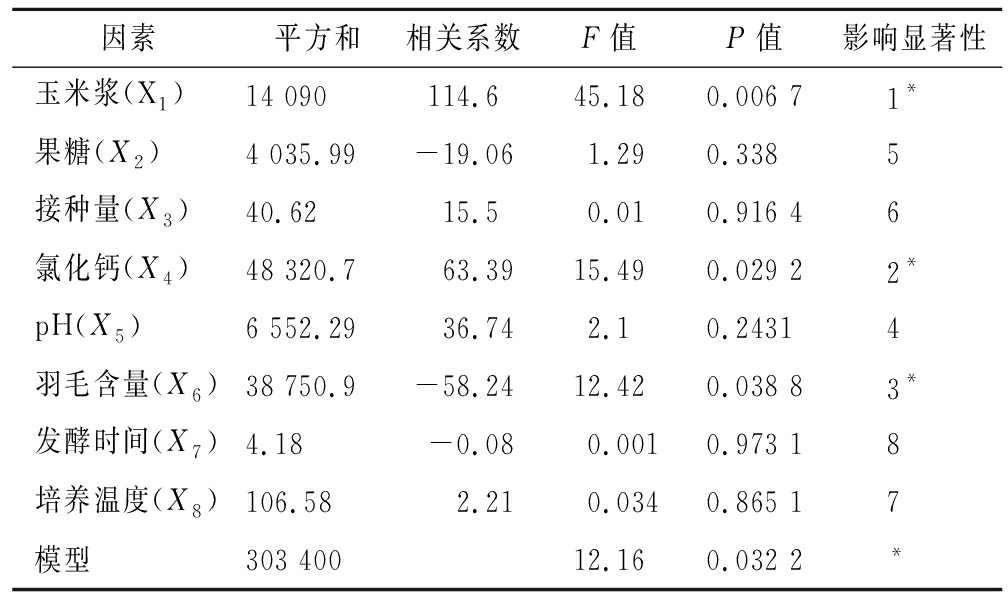
因素平方和相关系数F值P值影响显著性玉米浆(X1)14 090114.645.180.006 71*果糖(X2)4 035.99-19.061.290.3385接种量(X3)40.6215.50.010.916 46氯化钙(X4)48 320.763.3915.490.029 22*pH(X5)6 552.2936.742.10.24314羽毛含量(X6)38 750.9-58.2412.420.038 83*发酵时间(X7)4.18-0.080.0010.973 18培养温度(X8)106.582.210.0340.865 17模型303 40012.160.032 2*
2.3 最陡爬坡试验
根据PB试验结果玉米浆、氯化钙、羽毛浓度为菌株产酶显著影响因素,其中玉米浆及氯化钙为正影响,羽毛浓度为负影响,最陡爬坡试验时要逐步升高玉米浆及氯化钙的浓度,逐渐降低羽毛浓度,其他5个不显著的影响因子维持较低浓度水平。试验设计及结果如表4所示,酶活最大值出现在试验的第4组,故以此点各因子浓度做为Box-Bohnkon试验中心点。
表4 最陡爬坡试验设计及结果
Table 4 Results of the steepest climb experiment
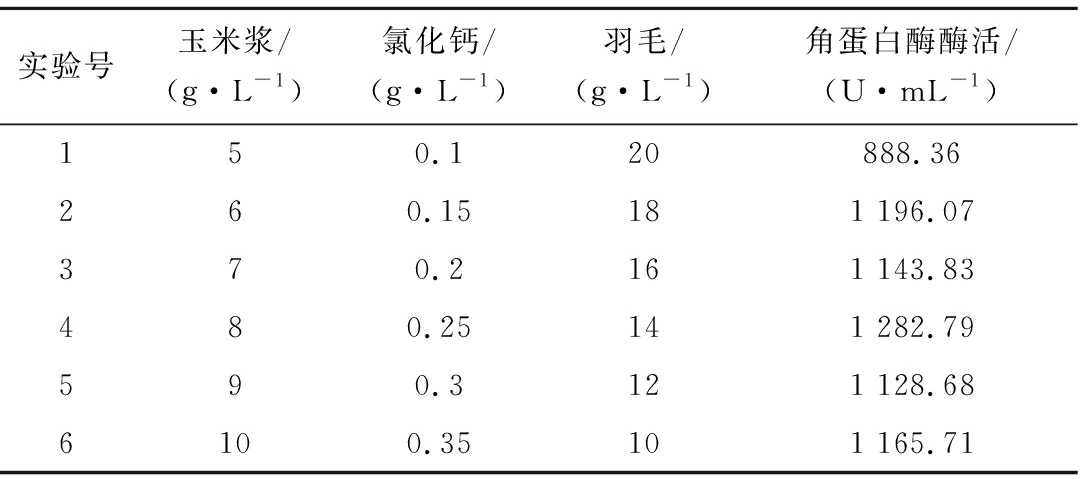
实验号玉米浆/(g·L-1)氯化钙/(g·L-1)羽毛/(g·L-1)角蛋白酶酶活/(U·mL-1)150.120888.36260.15181 196.07370.2161 143.83480.25141 282.79590.3121 128.686100.35101 165.71
2.4 响应面(Box-Bohnkon)优化试验
运用Design-Expert 8.0.6 软件的Box-Bohnkon的中心组合设计原理,设计响应面各个因素水平如表5所示,设计了3因素3水平共13个试验点,可分成两类:一类是零点(试验点4)为区域中心点;一类是析因点,共12组,每组3个平行,试验安排及结果见表6。
表5 响应面分析实验参数水平
Table 5 Factors and levers of response surface central composite design
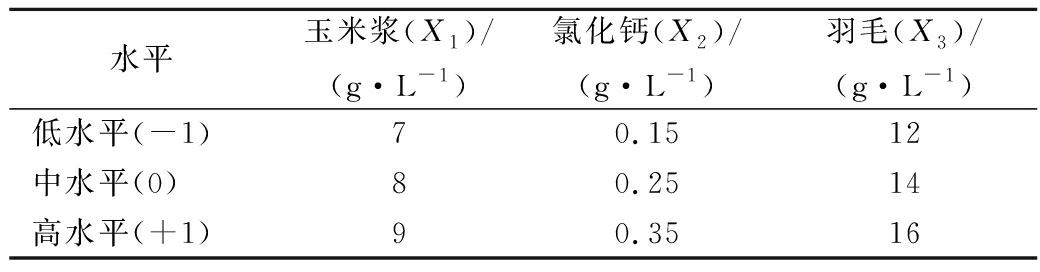
水平玉米浆(X1)/(g·L-1)氯化钙(X2)/(g·L-1)羽毛(X3)/(g·L-1)低水平(-1)70.1512中水平(0)80.2514高水平(+1)90.3516
根据表6结果,以酶活(Y值)为响应值,对试验的酶活结果进行回归分析,得到方程:![]() 决定系数R2=0.990 9,说明预测值与试验值具有高度相关性,该回归方程可代替真试验点进行结果分析[20]。
决定系数R2=0.990 9,说明预测值与试验值具有高度相关性,该回归方程可代替真试验点进行结果分析[20]。
表6 Box-Bohnkon 试验设计表和结果
Table 6 Experimental design of Box-Bohnkon andcorresponding results
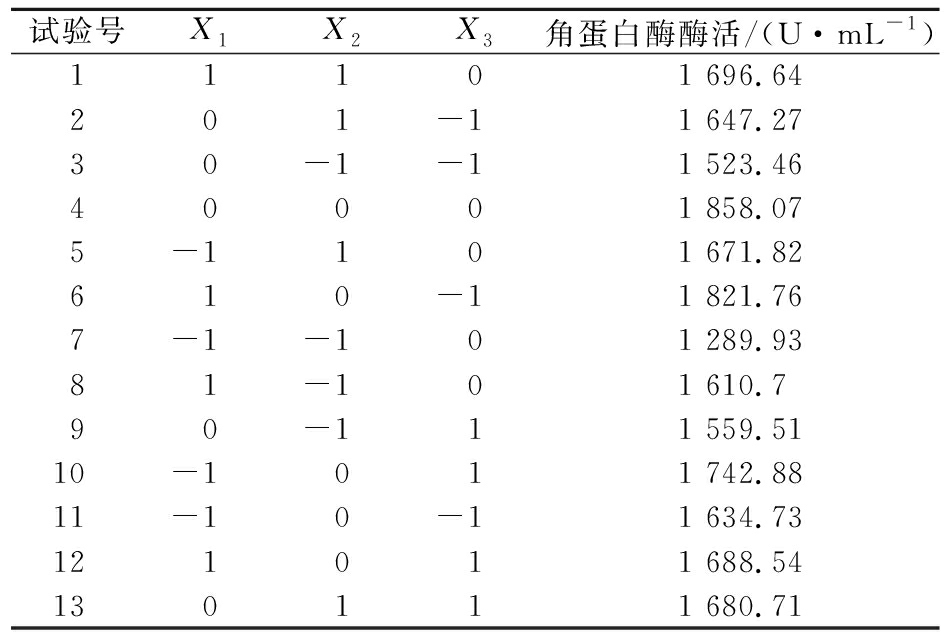
试验号X1X2X3角蛋白酶酶活/(U·mL-1)11101 696.64201-11 647.2730-1-11 523.4640001 858.075-1101 671.82610-11 821.767-1-101 289.9381-101 610.790-111 559.5110-1011 742.8811-10-11 634.73121011 688.54130111 680.71
表7方差分析结果表明,P<0.002,远小于 0.05,说明模型是重要的,一次项、二次项及交互项对响应值的影响是十分显著的,试验因子与响应值之间不是线性关系[19]。响应曲面图如图7所示,回归模型存在最大稳定点,最佳点为X1=0.17、X2=0.15、X3=-0.21时,Y值(角蛋白酶酶活)达到最大预测值(1 874.6 U/mL),即玉米浆8.17 g/L,氯化钙0.27 g/L,羽毛13.58 g/L,该点角蛋白酶活预测值为1 874.6 U/mL。
表7 Box-Bohnkon 试验方差分析结果
Table 7 Analysis of variance of Box-Bohnkon experiment
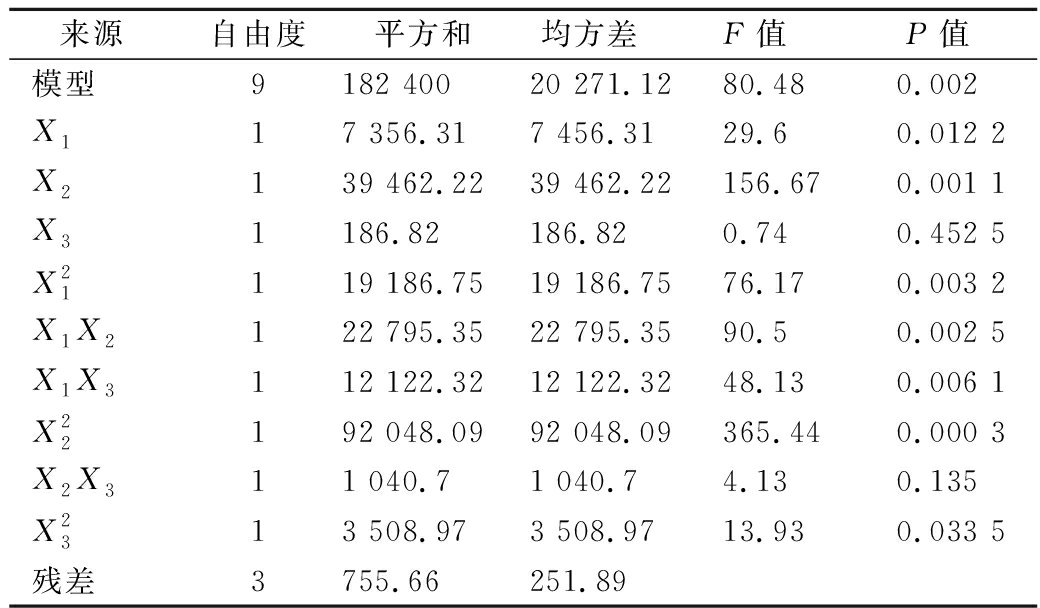
来源自由度平方和均方差F值P值模型9182 40020 271.1280.480.002X117 356.317 456.3129.60.012 2X2139 462.2239 462.22156.670.001 1X31186.82186.820.740.452 5X21119 186.7519 186.7576.170.003 2X1X2122 795.3522 795.3590.50.002 5X1X3112 122.3212 122.3248.130.006 1X22192 048.0992 048.09365.440.000 3X2X311 040.71 040.74.130.135X2313 508.973 508.9713.930.033 5残差3755.66251.89

图7 各因素对产酶影响的响应曲面图
Fig.7 Response surface for the factors on protease production
2.5 模型验证试验
为了检验模型预测的准确性,按照优化得到培养基配方,接种后每隔4 h取样,测定生物量及角蛋白酶酶活,结果如图8所示。菌体接种4 h后进入对数生长期,24~32 h时进入稳定期,随后生物量缓慢下降;角蛋白酶酶活在16~48 h快速升高,48 h达到最大为1 810.98 U/mL,与模型的预测值1 866.47 U/mL非常接近,说明建立的模型准确性较好。这说明该菌株羽毛降解速度较快,与前期研究2 d可将未粉碎羽毛几乎完全降解[8]的结果相一致。该菌株酶活及产酶速度优于目前文献报道蜡样芽孢杆菌(Bacillus cereus)发酵48 h,酶活132.50 U/mL[23];枯草芽孢杆菌(B.subtilis)发酵48 h,酶活166.08 U/mL[24];地衣芽孢杆菌(B.licheniformis)发酵48 h,酶活72.20 U/mL[25],具有良好的工业化应用潜力。
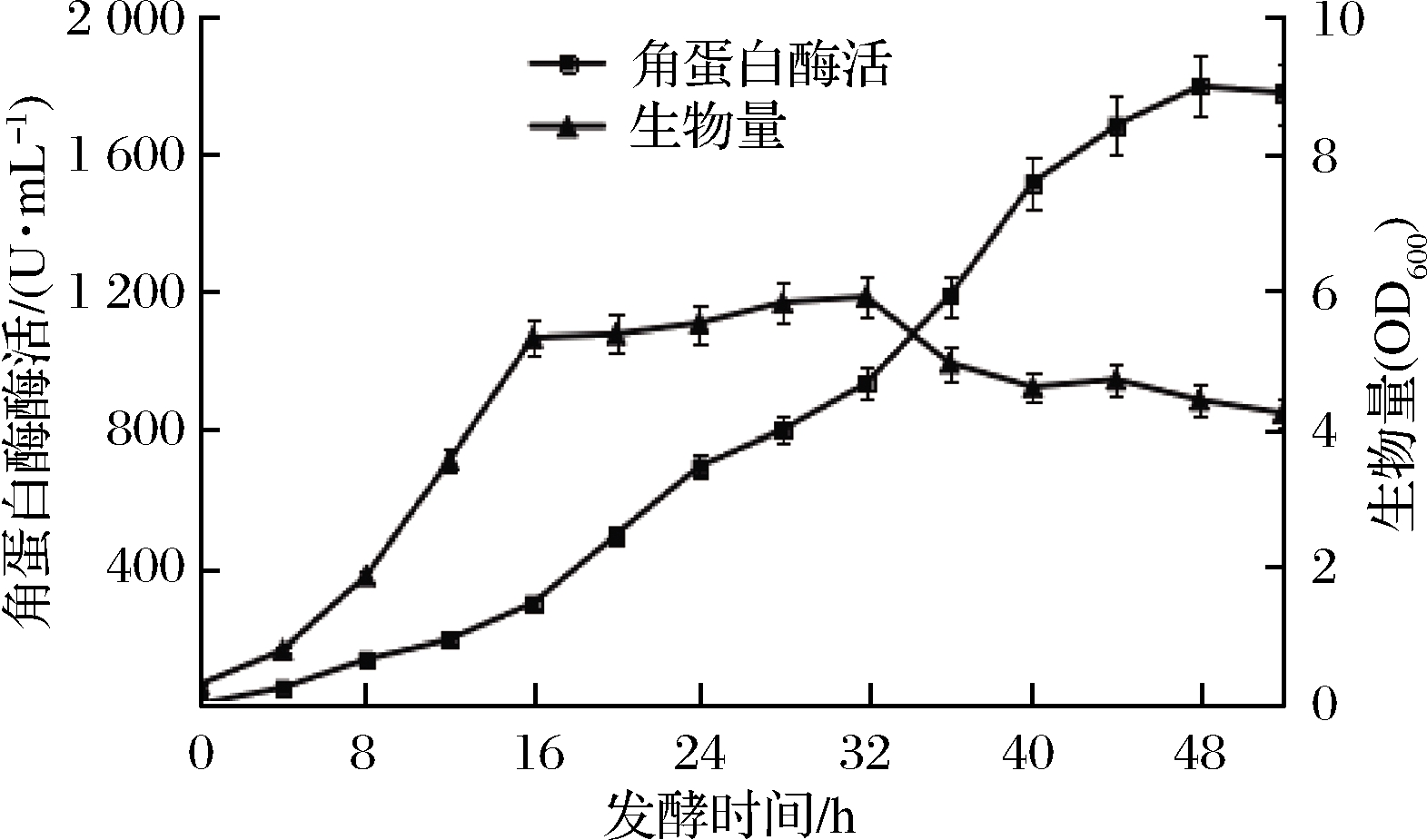
图8 菌株B.paramycoides Gxun-30降解羽毛过程中生长及产角蛋白酶活曲线
Fig.8 The process of degradation of feather growth and keratinase production curve of strain B.paramycoides Gxun-30
3 结论
本文分别通过单因素、PB、最陡爬坡和响应面优化方法对拟蕈状芽孢杆菌Gxun-30产角蛋白酶的发酵条件进行优化。得到该菌株最佳产酶条件为玉米浆8.17 g/L,氯化钙0.27 g/L,羽毛含量13.58 g/L,果糖10 g/L、初始pH 6.5、接种量 2.0%、发酵时间 48 h 时,酶活力模型预测值为1 866.47 U/mL,实测值达到1 810.98 U/mL,较优化前酶活227.38 U/mL提高了7.96倍。
[1] 张莹, 谷圣臣, 潘俊池, 等.基于ARIMA型的中国家禽出栏量预测[J].黑龙江八一农垦大学学报, 2020, 32(3):20-26.
ZHANG Y, GU S C, PAN J C, et al.Forecast of poultry production output in China with ARIMA model[J].Journal of Heilongjiang Bayi Agricultural University, 2020, 32(3):20-26.
[2] 柯野, 朱艳媚, 余国兴, 等.羽毛降解菌株Streptomyces sp.DJ产生的蛋白酶酶学性质[J].中山大学学报(自然科学版), 2017, 56(6):147-152.
KE Y, ZHU Y M, YU G X, et al.Characteristics of proteinases produced by a feather-degrading Streptomyces sp.DJ strian[J].Acta ScientiaRum Naturalium Universitatis Sunyatseni, 2017, 56(6):147-152.
[3] KALAIKUMARI S S, VENNILA T, MONIKA V, et al.Bioutilization of poultry feather for keratinase production and its application in leather industry[J].Journal of Cleaner Production, 2019, 208: 44-53.
[4] GRAZZIOTIN A, PIMENTEL F A, EVDE J, et al.Nutritional improvement of feather protein by treatment with microbial keratinase[J].Animal Feed Science and Technology.2006, 126(1):135-144.
[5] SHARMA S, GUPTA A.Sustainable management of keratin waste biomass:Applications and future perspectives[J].Brazilian Archives of Biology and Technology, 2016, 59:1-14.
[6] KSHETRI P, ROY S S, SHARMA S K, et al. Transforming chicken feather waste into feather protein hydrolysate using a newly isolated multifaceted keratinolytic bacterium Chryseobacterium sediminis RCM-SSR-7[J]. Waste and Biomass Valorization, 2019, 10(1): 1-11.
[7] ALAHYARIBEIK S, DAVOOD SHARIFI S, TABANDEH F, et al.Bioconversion of chicken feather wastes by keratinolytic bacteria[J].Process Safety and Environmental Protection, 2020, 135:171-178.
[8] 张妮, 张红岩, 杨梦莹, 等.一株海洋来源高效产角蛋白酶菌株的筛选、鉴定及其酶学性质研究[J].食品与发酵工业,2020,46(18):98-104.
ZHANG N, ZHANG H Y, YANG M Y, et al.Isolation and identification of a high efficient keratinase producing strain from marine environment and its enzymatic properties[J].Food and Fermentation Industries,2020,46(18):98-104.
[9] LI Q X.Progress in microbial degradation of feather waste[J].Frontiers in Microbiology, 2019, 10:2 717-2 732.
[10] ZHENG P, MAO X Z, ZHANG J, et al.Effective biodegradation of chicken feather waste by cocultivation of keratinase producing strains[J].Microbial Cell Factories, 18 (1):84.
[11] HAMICHE S, MECHRI S, KHELOUIA L, et al.Purification and biochemical characterization of two keratinases from Bacillus amyloliquefaciens S13 isolated from marine brown alga Zonaria tournefortii with potential keratin-biodegradation and hide-unhairing activities[J].International Journal of Biological Macromolecules, 2019, 122:758-769.
[12] RAMAKRISHNA R M, SATHI R K, RANJITA C Y, et al.Effective feather degradation and keratinase production by Bacillus pumilus GRK for its application as bio-detergent additive[J].Bioresoure Technology,2017, 243:254-263.
[13] MOUSAVI S, SALOUTI M, SHAPOURY R, et al.Optimization of keratinase production for feather degradation by Bacillus subtilis[J].Jundishapur Journal of Microbiology, 2013, 6(8):463-468.
[14] BOUACEM K, BOUANANEDARENFED A, LARIBIHABCHI H, et al.Biochemical characterization of a detergent stable serine alkaline protease from Caldicoprobacter guelmensis[J].International Journal of Biological Macromolecules, 2015, 81(1):299-307.
[15] RAMNANI P, GUPTA R.Optimization of medium composition for keratinase production on feather by Bacillus licheniformis RG1 using statistical methods involving response surfacemethodology[J].Applied Biochemistry and Biotechnology, 2004, 40(Pt2):191-196.
[16] 冀勇良, 朱传合, 刘丽英.短小芽孢杆菌产角蛋白酶液体发酵条件的优化[J].食品与发酵科技, 2014, 50(1):19-24.
JI Y L, ZHU C H, LIU L Y, et al.Optimization of liquid fermentation conditions of keratinase produced by Bacillus pumilus[J].Food and Fermentation Technology, 2014, 50(1):19-24
[17] 蒋彪, 王常高, 杜馨, 等.响应面法优化芽孢杆菌CJPE209产角蛋白酶发酵培养基的研究[J].中国酿造, 2017, 36(5):76-80.
JIANG B, WANG C G, DU X, et al.Optimization of fermentation medium for keratinase production from Bacillus sp.CJPE209 using response surface methodology[J].China Brewing, 2017, 36(5):76-80.
[18] YAMAMURA S, MORITA Y, HASAN Q, et al.Characterization of a new keratin-degrading bacterium isolated from deer fur[J].Journal of Bioscience and Bioengineering, 2002, 93(6):595-600.
[19] 卢超, 陈景鲜, 王国霞, 等.枯草芽孢杆菌L07产中性蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(16):,148-153.
LU C, CHEN J X, WANG G X, et al.Optimization of fermentation conditions for neutral protease produced by Bacillus subtilis L07[J].Food and Fermentation Industries,2020,46(16):,148-153.
[20] 申乃坤, 王青艳, 陆雁, 等.响应面法优化耐高温酵母生产高浓度乙醇[J].生物工程学报, 2010, 26(1):42-47.
SHEN N K, WANG Q Y, LU Y, et al.Enhancing ethanol production using thermophilic yeast by response surface methodology[J].Chinese Journal of Biotechnology, 2010, 26(1):42-47.
[21] TAMREIHAO K, MUKHERJEE S, KHUNJAMAYUM R, et al.Feather degradation by keratinolytic bacteria and biofertilizing potential for sustainable agricultural production[J].Journal of Basic Microbiology, 2019, 59(1):4-13.
[22] GUPTA R, RAMNANI P.Microbial keratinases and their prospective applications:An overview[J].Applied Microbiology and Biotechnology, 2006, 70(1):21-33.
[23] AROKIYARAJ S, VARGHESE R, AHMED B A, et al.Optimizing the fermentation conditions and enhanced production of keratinase from Bacillus cereus isolated from halophilic environment[J].Saudi Journal of Biological Sciences, 2019, 26(2):378-381.
[24] 朱耀霞, 马德源, 毕玉平, 等.枯草芽胞杆菌FJ-3-16产角蛋白酶条件优化及在生猪脱毛中的应用[J].农业生物技术学报, 2018, 26(2):346-356.
ZHU Y X, MA D Y, BI Y P, et al.Optimization of culture conditions for keratinase production by Bacillus subtilis FJ-3-16 and its application in pig (Sus scrofa) dehairing[J].Journal of Agricultural Biotechnology, 2018, 26(2):346-356.
[25] ABDEL-FATTAH A M, EL-GAMAL M S, ISMAIL S A, et al.Biodegradation of feather waste by keratinase produced from newly isolated Bacillus licheniformis ALW1[J].Journal of Genetic Engineering and Biotechnology, 2018, 16(2):311-318.