水稻秸秆是世界三大农作物秸秆之一,主要成分是木质纤维素,占比接近50%[1-2],拥有巨大的潜在价值。酶解糖化秸秆用于发酵工业生产已成为世界各国重点研发的热点之一。众多研究表明,纤维素酶的产酶条件和酶的作用条件不在一个范围内,因此发酵和产酶不能最大化进行一直是一个困扰木质纤维素资源化利用的难题。为了解决这个问题,工业上最常用的方法是纤维素酶直接糖化[3],但是糖化成本很高;其次是同步发酵糖化[4],其受制于微生物的限制,发酵产物单一,而且不能得到应用范围更广的可发酵糖。然而采用原位酶解方式可以有效解决这些问题[5],能更好的酶解纤维素产可发酵性糖,是实现纤维素资源有效利用的最新手段,受到广泛关注。
高效且低成本的降解技术是实现资源化利用水稻秸秆必需解决的难题。国内外已先后建成了多套纤维素生物转化试验装置,但由于技术积累不够,生产成本过高,无法真正实现工业化[3,6]。造成木质纤维素降解成本过高的主要技术瓶颈是水解过程的纤维素酶用量较高,酶解效率有待改进[7]。相关研究表明,液态原位酶解工艺可以降低天然木质纤维素糖化对预处理的要求,同时提高酶解效率与糖化率,克服直接发酵法中还原糖积累少的缺点[8]。原位酶解工艺在各研究领域都有所涉猎,且纤维素原位酶解已广泛应用于离子液体中,如MESBAH等[9]结合离子液体和纤维素酶En5H处理稻草,纤维素转化率提高28%。李强等[10]利用合成的离子液体[Meim]DMP原位酶解秸秆,结合秸秆预处理,最后酶解转化率提高了2.4倍。目前为止,国内外关于利用微生物发酵原位酶解糖化秸秆报道较少,水稻秸秆更是鲜有研究,近年来逐渐成为研究的一大热点。
发酵产酶和酶解在同一地点或容器内被称为原位酶解[10-11]。本研究以水稻秸秆为底物,里氏木霉为产酶微生物,通过研究液态发酵原位酶解糖化水稻秸秆,对发酵过程和酶解过程协同控制条件进行优化,从而提高水稻秸秆的糖化率。为天然木质纤维素的高效糖化研究提供一定参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
实验菌种:里氏木霉CICC 41027,中国工业微生物菌种保藏管理中心。
水稻秸秆段:采用预处理后的水稻秸秆段[12]。
粗酶液:实验前期产酶优化培养基培养的发酵液,离心取上清液为粗酶液,备用。
1.1.2 试剂及药品
无水葡萄糖、NaOH、Ca(OH)2、盐酸、亚硫酸钠、尿素、硫酸、一水柠檬酸、柠檬酸三钠、3,5-二硝基水杨酸、亚硝酸钠、苯酚、酒石酸钾钠、羧甲基纤维素钠等(分析纯),成都市科龙化工试剂厂。
柠檬酸缓冲液(0.05 mol/L,pH 4.8):取一水柠檬酸4.83 g,溶解于约750 mL去离子水中,边搅拌边加入柠檬酸三钠7.94 g,定容至1 000 mL,调节pH值至4.8后4 ℃储存备用。
10 g/L羧甲基纤维素钠溶液(carboxymethylcellulose sodium,CMC-Na):取1 g CMC-Na溶解于100 mL pH 4.8的柠檬酸缓冲液中,保存时间不超过3 d。
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂:称取DNS 3.15 g,加适量水45 ℃水浴搅拌溶解,然后再加入20 g NaOH溶液搅拌溶解,再依次加入酒石酸钾钠91 g、亚硝酸钠2.5 g、苯酚2.5 g,加热搅拌溶解后定容至1 000 mL,用滤纸过滤后,装入棕色瓶黑暗处放置7 d后可使用。
1.2 仪器与设备
QYC-2102摇床,上海沪奥明科学仪器有限公司;MJ-250恒温培养箱、TG-16医用离心机,四川蜀科仪器有限公司;V-1000可见分光光度计,翱艺仪器有限公司;HH-6D数显恒水浴锅,常州普天仪器制造有限公司;Whatman1号滤纸、抗腐蚀的滤袋。
1.3 培养基的制备
糖化培养基1(初始):水稻秸秆20 g、(NH4)2SO4 2 g、KH2PO4 3 g、MgSO4·7H2O 0.5 g、微量元素液10 mL、吐温-80 0.5 mL、H2O 1 000 mL、pH 6。
糖化培养基2:水稻秸秆30 g、(NH4)2SO4 2 g、KH2PO4 3 g、MgSO4·7H2O 0.5 g、微量元素液10 mL、吐温-80 0.5 mL、H2O 1 000 mL、pH 6。
微量元素液:CoCl2·6H2O 2 mg、MnSO4·H2O 2 mg、ZnSO4·7H2O 3.45 mg、FeSO4·7H2O 4 mg、H2O 1 000 mL。
CMC-Na种子培养基:CMC-Na 10 g、蛋白胨3 g、KH2PO4 1 g、MgSO4·7H2O 0.5 g、葡萄糖0.5 g、H2O 1 000 mL、pH自然。
发酵产酶培养基(优化后):预处理水稻秸秆15 g、(NH4)2SO42 g、MgSO4·7H2O0.5 g、KH2PO43 g、吐温-80 0.5 mL、FeSO4·7H2O 0.002 g、微量元素液10 mL、H2O 1000 mL、pH6~6.5(自然)。
1.4 实验方法
1.4.1 液态发酵原位酶解糖化工艺
液态发酵原位酶解糖化工艺如下:
秸秆培养基→接种→发酵产酶及破坏秸秆结构→调节pH→升温酶解→取样测还原糖
配制糖化培养基1,121 ℃灭菌,接种5%(体积分数)种子液,摇床恒温(26~32 ℃)培养一定时间,取出,用NaOH和稀盐酸溶液调节pH值,置于培养箱中恒温(40~60 ℃)一段时间,取样,6 000 r/min离心5 min,用DNS法测发酵液中的还原糖[13]。
秸秆比产糖量(g/g):单位秸秆产生的还原糖量,根据每瓶发酵液中的总还原糖和秸秆的添加量,算出每克秸秆最终的糖化率[12]。
1.4.2 液态发酵原位酶解过程随时间变化趋势
秸秆糖化培养基1,250 mL锥形瓶装液100 mL,初始pH 6,29 ℃,150 r/min,接种量5%,从发酵第2天开始每天取2瓶,取样测发酵液中的还原糖和滤纸酶活力(fliter paper actioity,FPA)酶活,然后将锥形瓶中剩余发酵液置于55 ℃摇床中保温6 h后,再次测发酵液中的还原糖和FPA及pH值。
1.4.3 酶解阶段条件控制
1.4.3.1 酶解阶段pH控制对产糖的影响
配制糖化培养基1,250 mL锥形瓶装100 mL若干瓶,初始pH 6,种子液接种量5%,150 r/min,29 ℃恒温培养,发酵48 h后,发酵液的pH值在3~3.5,用NaOH和盐酸溶液调节不同初始酶解pH值(3.2、3.6、4.0、4.4、4.8、5.2),将锥形瓶静置于50 ℃的培养箱中,酶解24 h,取样,6 000 r/min离心5 min,测还原糖,比较初始酶解pH对产糖的影响。
1.4.3.2 酶解阶段温度控制对产糖的影响
发酵条件不变,发酵48 h后,调节初始酶解pH 4.8,然后将锥形瓶置于不同温度(40、45、50、55、60、65 ℃)的培养箱中酶解24 h,分别在6、12、24 h取样,测还原糖。
1.4.3.3 酶解时间对产糖的影响
发酵条件不变,发酵48 h后,调节初始酶解pH 4.8,酶解温度50 ℃,不同酶解时间取样(0、2、6、12、24、36、48、72、84 h),测还原糖。
1.4.4 发酵培养基的优化
1.4.4.1 水稻秸秆的最佳添加量
原位酶解法糖化水稻秸秆,基础培养基中每升培养基中秸秆的装载量为20 g,实验通过不同的水稻秸秆添加量(10、20、30、40、50 g/L),比较每升培养基总还原糖产量和每克秸秆产糖量,确定较优的秸秆载量。
1.4.4.2 氮源的选择
在水稻秸秆30 g/L的基础上,选择不同的氮源2 g/L,其他条件相同,选择对于原位酶解法产糖的较优氮源。
1.4.5 发酵阶段的条件控制
1.4.5.1 发酵温度的优化
在确定发酵培养基为:水稻秸秆30 g、(NH4)2SO4 2 g、KH2PO4 3 g、MgSO4·7H2O 0.5 g、微量元素液10 mL、吐温-800.5 mL、H2O1 000 mL的情况下探究发酵温度对产糖的影响。设置发酵阶段的温度为24、26、28、29、30、32 ℃。
1.4.5.2 发酵pH的优化
在上述实验基础上探究发酵初始pH值对产糖的影响,设置初始pH值分别为4、5、6、6.5、7。
1.4.5.3 发酵时间的优化
在上述实验基础上探究发酵时间对产糖的影响,设置不同的发酵时间为24、36、48、60、72、84 h。
1.4.6 原位酶解补加酶液对糖化的影响
由于液态原位酶解糖化工艺中发酵阶段只有48 h,还未达到产纤维素酶高峰期,探究在进入酶解阶段前补加粗酶液(由实验前期得到的发酵产酶优化培养基培养的发酵液离心获得)能否进一步提升秸秆糖化的比产糖量。分别添加产酶优化后的粗酶液0、2.5、5、7.5、10 mL,测最终的比产糖量。
1.4.7 数据处理
每个样品固态发酵均做3次平行试验,采用Excel对试验数据初步处理,再用Design Expert 8.0处理数据,Origin 8.5作图,试验结果以“平均值±标准差”表示。数据采用ANOVA进行Duncan差异分析,以P<0.05为差异显著。
2 结果与分析
2.1 原位酶解产糖随发酵时间变化趋势
通过对发酵过程、酶解过程中还原糖、FPA、pH过程检测,了解发酵、酶解过程随时间的变化情况,对原位酶解发酵法糖化工艺进行初步探索。由图1和表1可知,首先在2~6 d时发酵液中本身的还原糖浓度很低,还原糖浓度最高时为发酵第2天,约为1.414 mg/mL。纤维素酶活随发酵时间的延长逐步增加,最高为第6天,约0.706 IU/mL,这与纤维素产酶的特点是相符的。通过对发酵液进行升温酶解,6 h后测其中的还原糖,发现发酵2~4 d的发酵液通过升温酶解后,还原糖含量明显增加,其中第2天发酵液中的还原糖含量由1.414 mg/mL上升至4.2 mg/mL,是未酶解前的3倍,而5~6 d酶解后还原糖变化不大。酶解6 h后相比于酶解前发酵液中的酶活都有所下降,特别是4~6 d。由表1可知,发酵液中的pH值随发酵时间降低,在发酵第6天仅有2.04。
表1 原位酶解产糖过程中各参数随发酵时间的变化
Table 1 Changes of various parameters with fermentation time during in situ enzymatic hydrolysis)
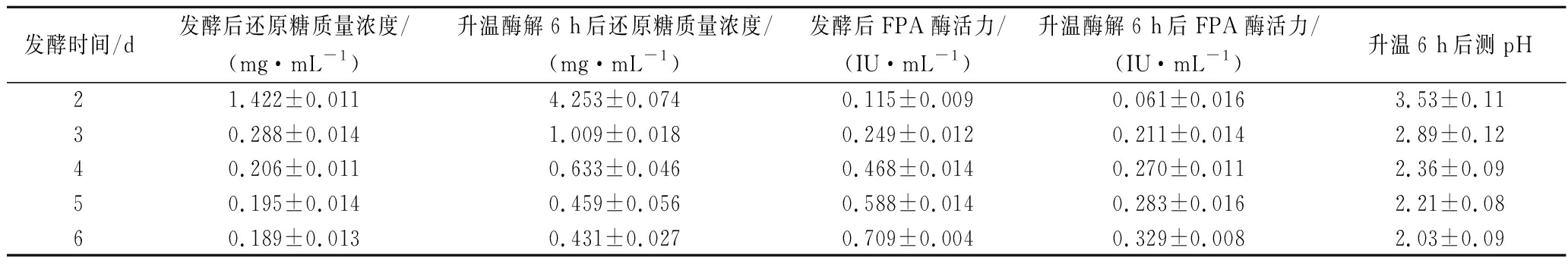
发酵时间/d发酵后还原糖质量浓度/(mg·mL-1)升温酶解6 h后还原糖质量浓度/(mg·mL-1)发酵后FPA酶活力/(IU·mL-1)升温酶解6 h后FPA酶活力/(IU·mL-1)升温6 h后测pH21.422±0.0114.253±0.0740.115±0.0090.061±0.0163.53±0.1130.288±0.0141.009±0.0180.249±0.0120.211±0.0142.89±0.1240.206±0.0110.633±0.0460.468±0.0140.270±0.0112.36±0.0950.195±0.0140.459±0.0560.588±0.0140.283±0.0162.21±0.0860.189±0.0130.431±0.0270.709±0.0040.329±0.0082.03±0.09
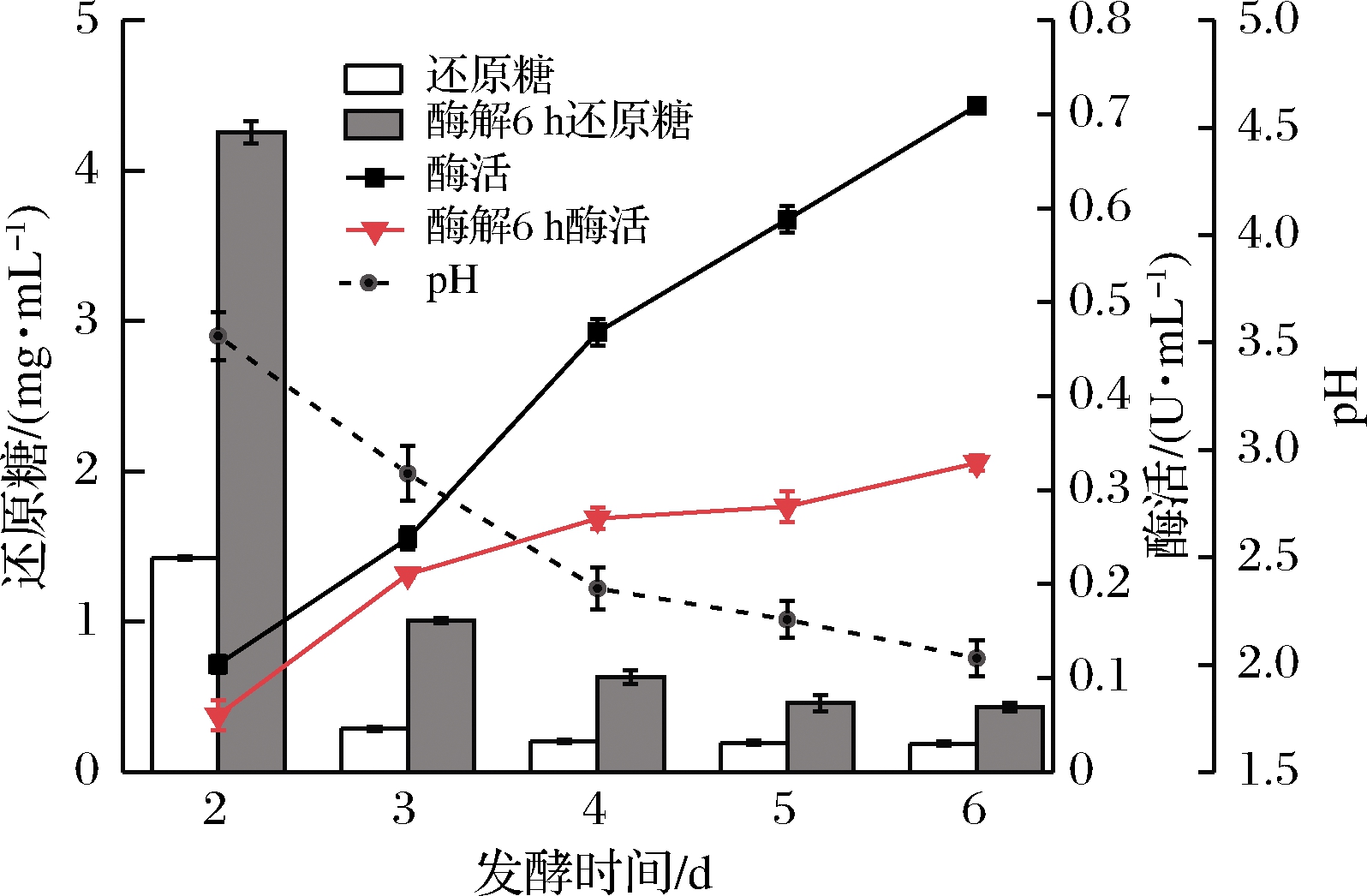
图1 不同发酵时间保温前后还原糖和酶活变化
Fig.1 Changes of reducing sugar and enzyme activity before and after holding at different fermentation time
对上述现象进行分析可知:(1)整个发酵过程中还原糖都很低,仅能满足微生物自身生长。纤维素酶是一种受多种调控机制共同作用的酶,在自然生长繁殖过程中,环境中的还原糖会通过某种机制反馈调节,抑制纤维素酶的合成和酶活,进而调控环境中还原糖的浓度[14]。想通过单纯的发酵是很难获得足够的还原糖的,必须通过某种方式改变或影响产纤维素酶微生物的自然调节机制,才能提高产酶量,提高还原糖的量;(2)酶活是随着发酵时间增加而增加的,但是发酵液中的还原糖并没有增加,酶解后的还原糖也没有随时间增加,反而随发酵时间增加而减小,其可能原因是,随着发酵时间增加微生物大量生长,底物被消耗,导致能糖化的秸秆减少,还原糖因此减少[15];(3)4~6 d的酶活比前3天有很大的提升,但是升温酶解后酶活降低得很多,4~6 d 的发酵液中的pH值低于2.5。在pH=2.5时还能保持50%的最大相对酶活力,而pH=2时仅有25%的最大相对酶活,说明里氏木霉所产的纤维素酶pH值低于2.5时其酶活会变得很低,同时在pH值低于2.5的高温条件下(40~65 ℃)其酶活力降低得很快,可能已经对其蛋白质结构造成了损害;(4)发酵液的pH随发酵时间降低,(NH4)2SO4是发酵培养基中氮源,同时也是生理酸性盐,微生物吸收![]() 后会使发酵液中的pH快速降低。
后会使发酵液中的pH快速降低。
根据研究和预实验发现,就整个过程而言,酶解条件控制对秸秆的糖化影响大于发酵过程,因此先将影响大的条件确定下来,再优化影响较小的,这样整个实验过程中的理论误差最小。同时发酵过程有前期实验做的产酶条件优化作参考,有一定指导意义,因此接下来实验将先研究不同的酶解条件对于水稻秸秆糖化的影响,后研究不同的发酵产酶条件对于糖化的影响。
2.2 酶解阶段的条件控制
pH是影响纤维素酶活的重要因素,对于糖化效率有很大的影响。将发酵48 h后的发酵液分别调节pH 3.2、3.6、4.0、4.4、4.8、5.2,然后升温50 ℃酶解24 h。如图2-a所示,每克秸秆的还原糖产量先随pH升高而增加然后减小,在pH=4.8时取得最大值,约0.406 g/g,同时pH 4.4时和pH 4.8相差不大,约0.396 g/g。最终选择pH 4.8为酶解阶段的最适pH。

图2 不同酶解条件对产糖的影响
Fig.2 Effect of different enzymatic hydrolysis conditions on sugar production
注:不同大、小写字母、希文字母表示差异显著(P<0.05)(下同)
纤维素酶的最适合成温度和最适酶解温度不同,找到最适酶解温度有助于提高糖化效率。结合已有的研究,同时考虑到高温会对蛋白质的结构有影响,因此实验设置为不同温度下,不同时间的酶解产糖。如图2-b,在酶解6 h时,产糖量最高的是温度为60 ℃时,而50、55、65 ℃时处于同一水平。当酶解至12 h时,产糖量最高的是温度为55 ℃时,依次为60、50 ℃。当酶解至24 h时,产糖量最高的是温度为50 ℃时,依次为45、55 ℃。根据实验结果可知,在短时间的酶解时,60 ℃和55 ℃的酶解效率更高,但随着酶解时间延长,温度对酶的损害作用逐渐体现出来,其综合正向促进作用开始小于负向的损害作用。温度40 ℃时酶的糖化效率不高。因此,若酶解时间超过24 h,应选择酶解温度为50 ℃或45 ℃,本研究选择50 ℃作为酶解阶段的发酵温度。
酶的催化通常会有动力学方程,酶解效率会受酶解条件和环境的影响,随着酶解过程的进行,底物减少、产物的反馈抑制、酶的损耗等都会影响到最终的产物,纤维素酶的酶解糖化过程也有这些现象。如图2-c,酶解时间越短,曲线的斜率越大,单位时间的糖化效率越快。在酶解的前12 h,底物充足,酶的活性高,反馈抑制弱,糖化的速度快,在12 h时产糖量约为0.282 g/g;在酶解至24 h时约为0.410 g/g,12 h增加了0.118 g/g;在酶解至36 h时约为0.474 g/g,12 h增加了0.074 g/g;最终酶解至72 h时约为0.567 g/g。随着酶解时间的延长,受制于发酵液中的底物和酶的限制,最终产糖量提升并不多。考虑到成本因素,暂选24 h作为后续研究的酶解时间。
2.3 发酵培养基的优化
2.3.1 水稻秸秆的最佳添加量
水稻秸秆段中有许多空隙和中空,平均体积大,密度小,且不溶于水,每升发酵液中的装载量较少。在不压实的状态下,每升发酵液能装40~50 g秸秆段,而且秸秆段装载过多,发酵一段时间后发酵液会成糊状,不利于发酵过程的进行。因此,通过比较每升发酵液中不同水稻秸秆段的添加量对单位秸秆的糖化率和每升发酵液中的总产糖量的影响,选择出合适的秸秆添加量。如图3所示,每克秸秆的产糖量随秸秆的添加量增加而减少,每升发酵液中的总产糖量随秸秆添加量增加而增加。根据原位酶解发酵产糖工艺,发酵阶段主要是产酶和进一步打破秸秆为下一步酶解提供基础,酶的产量与秸秆量在一定范围内呈负相关,每升发酵液中秸秆含量少,更利于纤维素酶的诱导合成,同时在酶解阶段单位质量秸秆会拥有更多的纤维素酶,而且发酵液中的总糖含量低,酶解的反馈抑制作用也会降低。因此,在一定范围内,每升发酵液中含有的秸秆越少其单位质量的糖化率反而更高。但是每升发酵液秸秆添加少,其总的产糖也必然少,即便糖化率高其研究价值也不大,在实际应用中需要平衡单位秸秆糖化率和每升发酵液中总产糖量的关系。要想得到客观可靠的结果,必须对整个生产过程的成本进行估算,建立一个成本模型和函数关系,最后才能得出最适的添加量,这其中涉及的问题较多且复杂。在30~35 g/L的秸秆添加量时,单位秸秆糖化率和每升发酵液的总糖量都能保持在一定水平,因此在缺少相关的数据和信息前,本研究只能简单的暂选30 g/L作为每升发酵液的秸秆添加量。

图3 秸秆的添加量对产糖的影响
Fig.3 Effect of added amount of straw on sugar production
2.3.2 氮源的选择和氮源含量
在微生物发酵过程中添加氮源主要是为了补充生长繁殖所必需的氮元素。如图4所示,以蛋白胨为氮源糖化率最高,为0.355 g/g,硫酸铵氮源的糖化率其次,为0.336 g/g,硝酸铵和麸皮糖化率分别为0.277、0.233 g/g,以尿素为氮源的糖化率最低,仅0.030 g/g。蛋白胨和硫酸铵都是里氏木霉的优质氮源,但考虑到蛋白胨和硫酸铵的成本差异,仍选择硫酸铵为原位发酵酶解法糖化工艺的氮源。
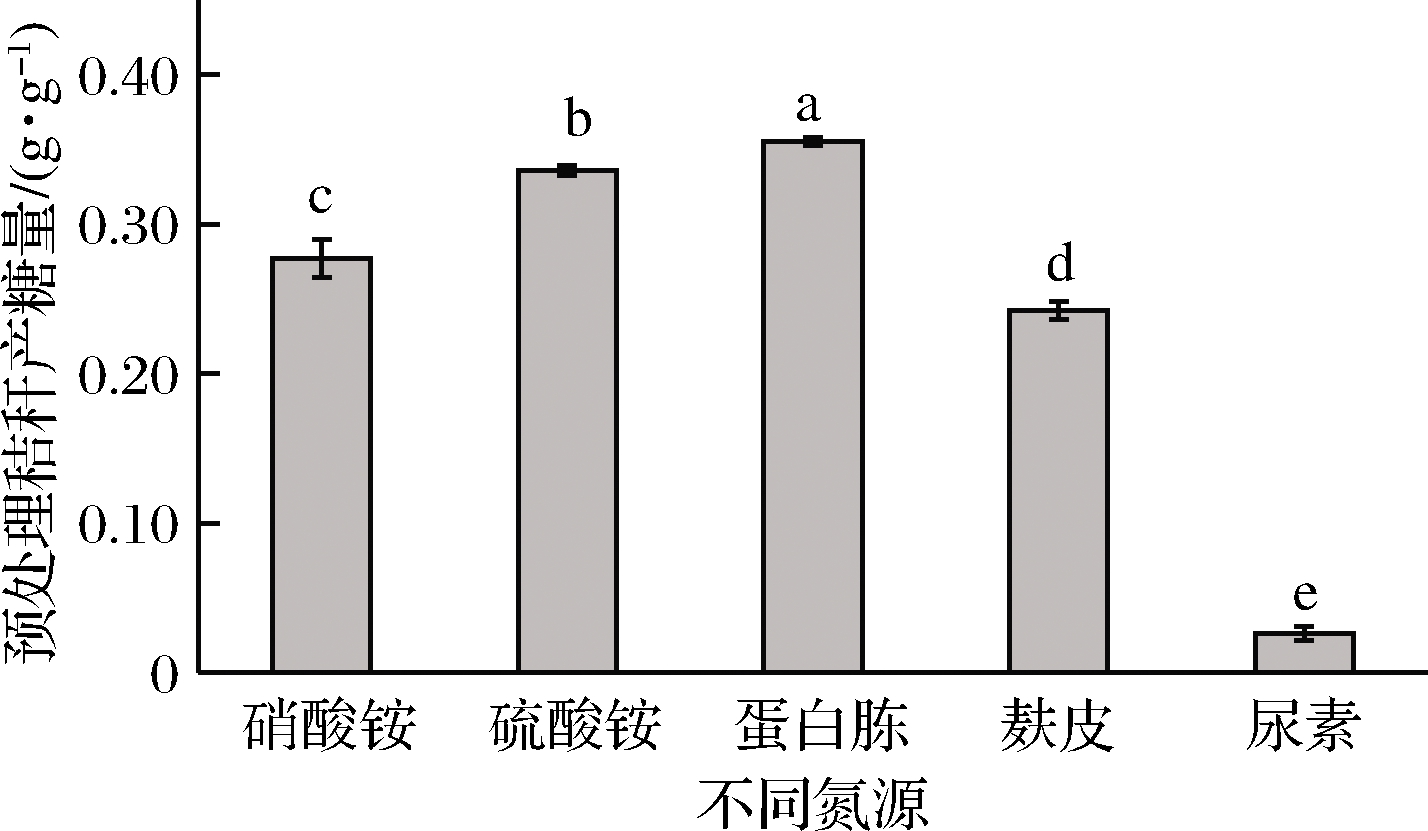
图4 不同氮源对产糖的影响
Fig.4 Effect of nitrogen source on sugar production
2.4 发酵阶段的条件控制
发酵阶段的主要目的是微生物的快速生长和产酶,温度过高和过低都不利于微生物的生长代谢。如图5-a所示,发酵阶段的温度在30 ℃时,最终的产糖量更高。但是根据邬敏辰等[16]的研究,在里氏木霉发酵产酶的温度优化中,先将发酵液在29 ℃的温度下发酵1~2 d,再降低到28 ℃发酵,最终发酵酶活更高。他认为温度高一点更有利于前期发酵微生物的生长繁殖,本研究的结果与其有相似之处。最终选择30 ℃作为发酵产酶阶段的发酵温度。
发酵阶段的pH对微生物的生长繁殖和代谢有重要影响。如图5-b所示,在原位酶解发酵法糖化中pH 6.5时有最大产糖量,但在pH 5时产糖量排在第2,初始pH 6、7分别排在第3和第5。由表1可知,在持续的产酶发酵过程中,发酵液的pH会随着时间降低,在发酵第3~6天时pH值已经低于3了,pH过低会对微生物的生长代谢带来不利影响,因此高初始pH可以减缓pH减低的速度,但同时pH过高不利于微生物前期的生长繁殖。由于发酵时间为2 d,发酵液中pH降低不明显,最终表现为初始pH 4~6.5对产糖量的影响并不大。可推测在里氏木霉的发酵产酶过程中,pH过高不利于微生物的生长和产酶。在一定范围内,pH过低虽然同样不利于微生物的生长,但对产酶有促进作用。由于刚配制的发酵液自然pH 6~7,且在初始pH 6.5时有最大产糖量,因此本研究选择pH 6.5作为发酵液的初始pH值。
发酵时间是发酵产酶阶段和酶解糖化阶段的重要分界点,对最终产糖量影响很大,是原位酶解糖化工艺中的关键因素。发酵阶段微生物快速生长,产纤维素酶对天然木质纤维素结构进行破坏;酶解阶段为纤维素酶提供适宜的酶解条件使其充分酶解糖化。发酵时间过长,大量的底物被消耗,酶解阶段可利用底物减少,秸秆的糖化率降低;发酵时间过短,微生物生长不足,产酶不足,秸秆破坏程度低,都会对酶解阶段造成影响,使秸秆糖化不充分,糖化率低。如图5-c所示,在发酵48 h时取得最大秸秆糖化率,约0.350 g/g。发酵24和36 h,发酵时间不足,糖化率低,超过48 h,微生物进一步生长代谢,底物消耗,糖化率降低。本研究选择48 h作为发酵阶段的发酵时间。
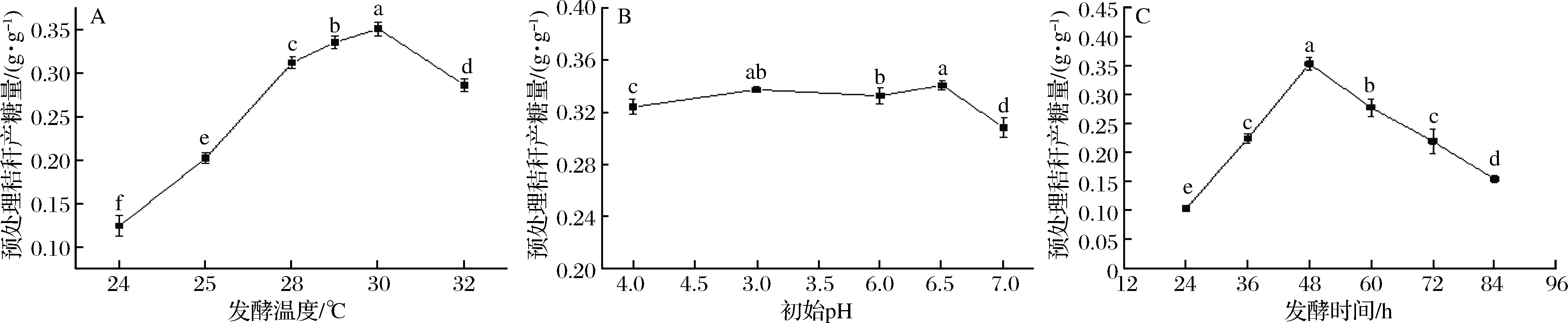
a-发酵温度;b-初始pH;c-发酵时间
图5 不同发酵条件对产糖的影响
Fig.5 Effect of different fermentation conditions on sugar production
2.5 原位酶解补加酶液对糖化的影响
在原位酶解发酵法糖化工艺中,发酵产酶阶段的主要目的是发酵产酶和利用微生物对秸秆的结构进一步破坏,但是由于里氏木霉的产酶特性,在发酵前两天并不是产酶最快的时间,发酵液中的纤维素酶含量并不高,通过外加少量粗酶液的方式,提高发酵液中的纤维素酶,进而提高比产糖量。研究表明,与商品酶相比,未加工的粗酶液有更高的酶解效率[17-18]。李勇昊[19]通过里氏木霉发酵产酶,将未经任何处理的纤维素粗酶液加入秸秆中进行酶解糖化,发现在50 ℃酶解温度下,里氏木霉的存在不仅不会影响糖化效率,而且自身被裂解释放出部分葡萄糖,提高了最终的糖浓度。如图6所示,液态原位酶解糖化工艺中不补加酶液的比产糖量为0.332 g/g,随着添加粗酶液其最终比产糖量有所提升,当每100 mL糖化液中粗酶液添加量超过5 mL时,其比产糖量在0.400 g/g附近不再显著提升。因此可以选择5 mL为较适的粗酶液添加量。
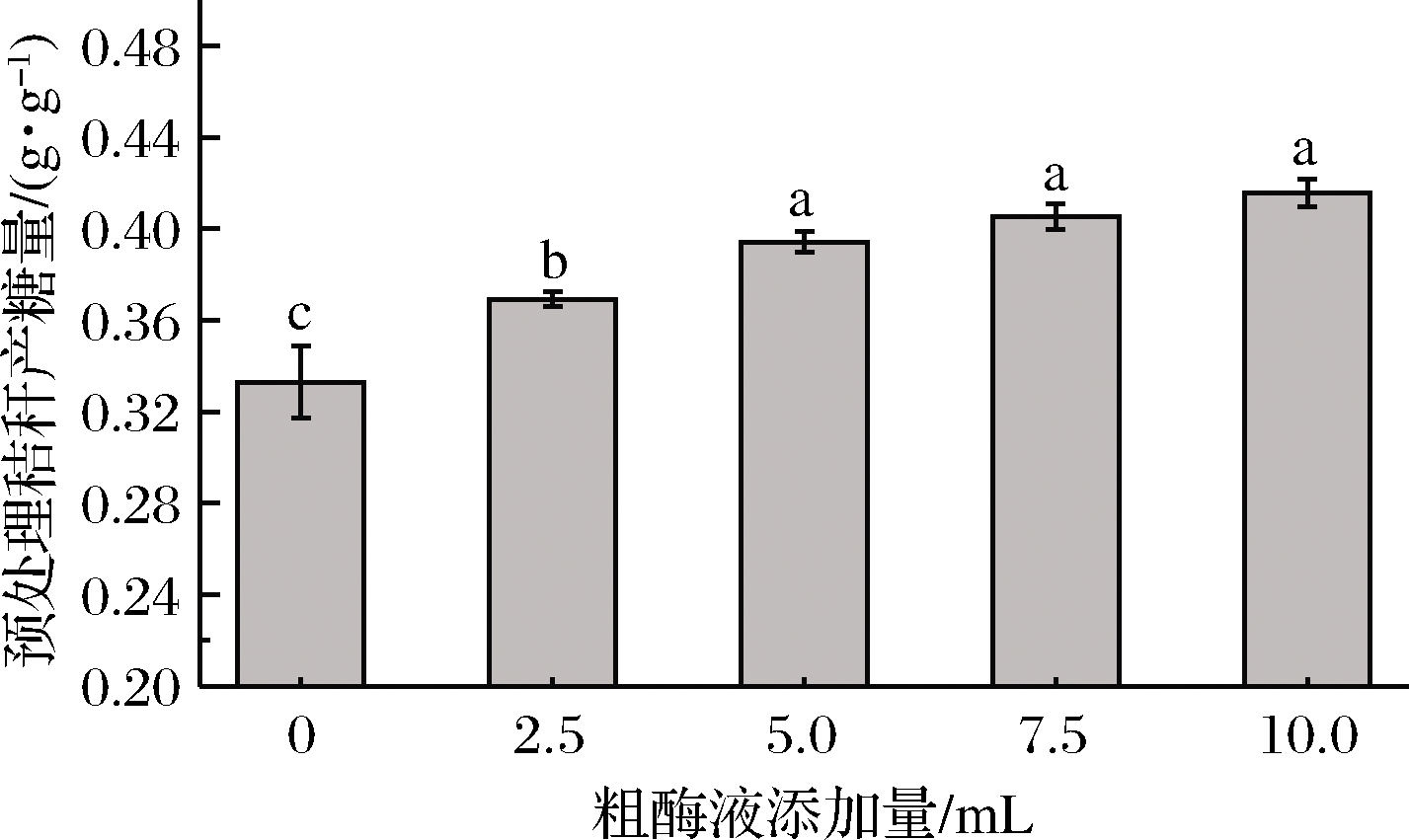
图6 补加酶液对比产糖量的影响
Fig.6 Effect of supplemented enzyme solution on sugar production
3 结论与讨论
基于里氏木霉产酶特性和酶解特性的差异性矛盾,对将产酶过程和酶解过程整合起来的液态原位酶解糖化工艺进行了探索。发现水稻秸秆的原位酶解发酵糖化将面临几个问题:(1)发酵产酶和微生物破坏秸秆结构与底物消耗之间的平衡关系;(2)纤维素酶的酶活力不能充分发挥;(3)底物在产糖以外的消耗等。根据原位酶解产糖面临的问题,实验主要围绕以下3个方向展开:
(1)首先,通过为酶解阶段的纤维素酶提供适宜的酶解条件,充分激发酶的活力,从而减少单位秸秆对纤维素酶活的需求,提高糖化效率,进而缩短发酵时间,减少底物的无效消耗。
(2)通过优化改良发酵培养基成分,使其在发酵阶段产酶效率提高的同时对酶解阶段的负效应降低。
(3)通过优化发酵阶段和糖化阶段的条件控制,找到发酵产酶和微生物破坏秸秆结构与底物消耗之间的平衡,从而提高糖化工艺的综合效能[20]。
实验初步发现在发酵过程中发酵液中的还原性糖积累很少,仅能满足微生物的生长所需,pH随发酵时间降低,FPA随发酵时间增加,在发酵2 d后通过升温、调节pH的方式可以有效提高发酵液中的还原糖积累。对水稻秸秆的液态原位酶解糖化工艺进行优化,在液态产酶培养基的基础上,确定了每升30 g秸秆的发酵培养基;发酵条件为发酵温度30 ℃,初始pH 6.5,发酵时间48 h;酶解条件为酶解pH 4.8,酶解温度50 ℃,酶解时间24 h,最终的比产糖量为0.350 g/g。同时发现发酵结束后补加少量酶液可以进一步提高比产糖量至0.400 g/g,约提升了20%。
目前鲜有关于分位原位酶解糖化工艺的研究报道。本研究主要探究了液态发酵原位酶解糖化工艺条件,以每克秸秆的产糖量为评价指标,得到较优的水稻原位酶解工艺。后续将继续对其固态原位酶解糖化工艺进行优化,为进一步应用于木质纤维素的糖化和生物炼制提供更多的理论参考。
[1] 李豪, 邹伟, 白光剑, 等.高产纤维素酶真菌的筛选及鉴定[J].食品与发酵工业, 2019, 45(6):54-58.
LI H, ZOU W, BAI G J, et al.Screening and identification of high-level cellulase-producing fungi[J].Food and Fermentation Industries, 2019, 45(6):54-58.
[2] NISHIMURA H, KAMIYA A, NAGATA T, et al.Direct evidence for α ether linkage between lignin and carbohydrates in wood cell walls[J].Scientific Reports, 2018, 8(1):6 538.
[3] 方诩, 秦玉琪, 李雪芝, 等.纤维素酶与木质纤维素生物降解转化的研究进展[J].生物工程学报, 2010, 26(7):864-869.
FANG X, QING Y Q, LI X Z, et al.Progress on cellulase and enzymatic hydrolysis of lignocellulosic biomass[J].Chinese Journal of Biotechnology, 2010, 26(7):864-869.
[4] 张艳. 纤维素酶系协同作用实验及重组酵母的同步糖化发酵[D].大连:辽宁师范大学, 2007.
ZHANG Y.Cellulase synergetic experiment and the SSF of recombinant yeast[D].Dalian:Liaoning Normal University, 2007.
[5] 王蒙. 离子液体提取的甘蔗渣纤维素酶解糖化的研究[D].武汉:华中农业大学, 2014.
WANG M.Research on enzymatic hydrolysis of sugarcane bagasse cellulose extracted from ionic liquids[D].Wuhan:Huazhong Agricultural University, 2014.
[6] KANEZA P, 杨林青, 孙付保, 等.甘蔗渣在添加剂和辅助酶作用下的浓醪酶解糖化[J].食品与发酵工业, 2019, 45(17):1-6.
KANEZA P, YANG L Q, SUN F B, et al.Thick-mash enzymatic hydrolysis of sugarcane bagasse with additives and accessory enzymes[J].Food and Fermentation Industries, 2019, 45(17):1-6.
[7] HIMMEL M E, DING S Y, JOHNSON D K, et al.Biomass recalcitrance:Engineering plants and enzymes for biofuels production[J].Science, 2007, 315:804-807.
[8] 刘航. 类芽孢杆菌sp.LLZ1β-葡萄糖苷酶在离子液体中的失活与强化研究[D].苏州:苏州科技大学, 2019.
LIU H.Inactivation and enhancement of Paenibacillus sp.LLZ1 β-glucosidase in ionic liquids[D].Suzhou:Suzhou University of Science and Technology, 2019.
[9] MESBAH N M, WIEGEL J.A halophilic, alkalithermostable, ionic liquid-tolerant cellulase and its application in in Situ saccharification of rice straw[J].BioEnergy Research, 2017, 10(2):583-591.
[10] 李强, 何玉财, 徐鑫, 等.离子液体系中原位酶解高效糖化玉米秸秆[J].化工进展, 2010, 29(5):958-962.
LI Q, HE Y C, XU L, et al.Efficient in situ enzymatic saccharification of corn stover in ionic liquid[J].Chemical Industry and Engineering Progress, 2010, 29(5):958-962.
[11] 杨威, 严立石, 刘航, 等.表面活性剂协同离子液体促进纤维素原位酶解[J].生物加工过程, 2019, 17(6):562-568.
YANG W, YAN L S, LIU H, et al.Synergistic effects of surfactants and ionic liquid on promoting in situ hydrolysis of cellulose[J].Chinese Journal of Bioprocess Engineering, 2019, 17(6):562-568.
[12] 白光剑, 马一凡, 邹伟.常压中温下水稻秸秆预处理及酶解研究[J].食品与发酵工业, 2019, 45(23):207-213.
BAI G J, MA Y F, ZOU W.Pretreatment and enzymatic hydrolysis of rice straw under normal pressure and moderate temperature[J].Food and Fermentation Industries, 2019, 45(23):207-213.
[13] GB 13005—2016, 用于生物燃料乙醇制备的纤维素酶活力测定方法[S].北京:国家能源局, 2016.
GB 13005—2016, Cellulase evaluation methods for biofuel ethanol preparation[S].Beijing:National Energy Administration, 2016.
[14] 赵国蕾. 里氏木霉碳源代谢阻遏与纤维素酶表达调控机制研究[D].济南:山东大学, 2015.
ZHAO G L.Investigation of the role of CCR in cellulase gene expression in Trichoderma reesei[D].Jinan:Shandong University, 2015.
[15] 令利军, 何楠, 白雪, 等.基于高通量测序的玉米秸秆自然发酵过程中细菌菌群结构特征[J].兰州大学学报(自然科学版), 2017, 53(4):526-533.
LING L J, HE N, BAI X, et al.Bacterial community in naturally fermentative maize straw by high-throughput sequencing[J].Journal of Lanzhou University(Nature Sciences), 2017, 53(4):526-533.
[16] 邬敏辰, 李江华.里氏木霉固体发酵生产纤维素酶的研究[J].江苏食品与发酵, 1998(2):3-5.
WU M C, LI J H.Research on cellulase production by solid fermentation of Trichoderma reesei[J].Jiangsu Food and Fermentation, 1998(2):3-5.
[17] DELABONA P D S, FARINAS C S, SILVA M R D, et al.Use of a new Trichoderma harzianum strain isolated from the amazon rainforest with pretreated sugar cane bagasse for on-site cellulase production[J].Bioresource Technology, 2012, 107:517-521.
[18] 沈丽君, 苏瑛杰, 于潇潇, 等.木质纤维素诱导里氏木霉产纤维素酶及酶解增效作用研究进展[J].吉林农业大学学报, 2019, 41(6):681-685.
SHEN L J, SU Y J, YU X X, et al.Advances in researches on cellulase production by lignocellulose and its synergism with enzymatic hydrolysis of Trichoderma reesei[J].Journal of Jilin Agricultural University, 2019, 41(6):681-685.
[19] 李勇昊. 利用可溶性诱导物批式流加发酵培养里氏木霉生产纤维素酶[D].大连:大连理工大学, 2017.
LI Y H.Cellulase overproduction by Trichoderma reesei through batch-feeding of biosynthesized soluble inducer[D].Dalian:Dalian University of Technology, 2017.
[20] 王建军. 纤维素酶在酿酒酵母中表达影响因素及其应用研究[D].天津:天津大学, 2016.
WANG J J.Study on cellulase expression in Saccharomyces cerevisiae:the influencing factors and its application[D].Tianjin:Tianjin University, 2016.