蜂蜜是蜜蜂从开花植物的花蜜、分泌物或蜜露中提取的天然产物,经过充分酿造而贮藏在胃中的天然甜物质[1]。蜂蜜又是一种药食同源的天然食品,它不仅能够促进组织生成、提高免疫力、润肺治哮喘,还具有保护胃黏膜、辅助治疗烧烫伤和润肠通便等功效[2]。中国作为养蜂大国,蜂蜜产量约占世界总产量的30%,也是最大的蜂蜜生产国和出口国[3]。
为延长蜂蜜保质期,降低黏度,延缓结晶,常对蜂蜜采用热处理方式加工[2,4]。然而加热易造成蜂蜜品质降低(如褐变、异味、营养损失)[5]、生物酶活性下降[4]。蜂蜜中的生物酶主要包括淀粉酶和蔗糖转化酶,这两种酶活性已作为蜂蜜新鲜度、品质重要指标[6]。同时,蜂蜜加热甚至产生有害物质,如5-羟甲基糠醛[5,7](5-hydroxymethylfurfural, 5-HMF)。根据国际标准,淀粉酶值和蔗糖转化酶值分别必须在8和10以上[8],5-HMF含量必须小于15 mg/kg[9]。因此,淀粉酶和蔗糖转化酶活力、5-HMF含量是评估蜂蜜的品质、过热处理和新鲜度的重要指标[10]。
近年来非热加工技术因其低温下可达到杀菌、延长食品保质期目的而在食品加工上逐渐得到重视。超高静压(high hydrostatic pressure, HHP)是非热加工技术中较热门的一种,指在常温或较低温度下,用100 MPa以上的压力(100~1 000 MPa)来处理食品,以达到杀菌、灭酶和改善食品功能特性的加工技术[11]。HHP对化合物的共价键无影响,可以更好地保持食品原有的风味、色泽和营养价值[12]。经HHP处理的麦卢卡蜂蜜[11]和墨西哥百花蜜[12],能有效灭活蜂蜜微生物并保持其品质。另外HHP也能防止或最小化5-HMF的产生[7]。有关HHP对蜂蜜中酶的影响研究结果表明,HHP处理并未显著造成麦卢卡蜂蜜[11]和克鲁特蜂蜜[13]的淀粉酶活性变化(P>0.05)。但HHP对蜂蜜中蔗糖转化酶的影响还未见报道。
蜂蜜中单糖含量在70%以上,主要是果糖和葡萄糖,蔗糖的成分相对较少,不超过5%[14]。单糖含量会影响二羰基化合物的产生。二羰基化合物是一类典型的美拉德反应中间产物,具有高度的活性,可降解为许多影响食品色香味的副产品[15-18]。因此,以二碳基化合物含量作为指标能更好评估蜂蜜品质[17],而有关HHP对其影响的研究还相当缺乏。
因此,本论文采用HHP不同压力(300、450、600 MPa)和时间(5、10、20 min)处理蜂蜜,探讨HHP对蜂蜜中的单糖含量、关键酶活性、5-HMF和二羰基化合物的影响,为蜂蜜的非热加工工艺提供指导,为拓展HHP在蜂蜜加工中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
荔枝蜂蜜,广州从化温泉国强峰唛养蜂场。
碘、碘化钾、氯化钠、醋酸钠、冰醋酸、可溶性淀粉、氢氧化钠、结晶酚、亚硫酸氢钠、酒石酸钾钠、磷酸二氢钾、磷酸氢二钠、甲酸、邻苯二胺、二亚乙基三胺五乙酸、碳酸钠、乙酸锌、石油醚(沸程30~60 ℃)、甲醇、Carrez试剂 Ⅰ 三水合亚铁氰化钾、Carrez试剂 Ⅱ ZnSO4·7H2O、磷酸钠均为分析纯;果糖、葡萄糖、蔗糖、麦芽糖、乳糖纯度均为99%;乙腈(色谱纯);5-HMF、3-脱氧葡萄糖醛酮(3-deoxyglucosone,3-DG)标品纯度为99.99%,以上均购于广州东巨实验仪器有限公司。
1.2 仪器与设备
HH-2 型数显恒温水浴锅,江苏金坛宏华仪器厂;AR2140 电子分析天平,美国奥豪斯公司;CQC-2L-600 MPa HHP设备,北京速原中天科技股份有限公司;EL104型电子分析天平,梅特勒-托利多仪器有限公司;SB-5200D75超声仪,宁波新芝超声设备有限公司;JB-2恒温磁力搅拌器,上海雷兹新经仪器公司;Sorvall ST 16R高速冷冻离心机,赛默飞世尔有限公司;LC-20AD高效液相色谱仪(配置四元泵、自动进样器、PDA检测器)、UV-1750紫外可见分光光度计,日本岛津公司;Waters Xevo TQD/PDA ACQUITY UPLC 液质联用仪,配置电喷雾离子化源(ESI 源)、Waters溶剂管理系统、Waters四元高压混合泵及前置真空泵、MasslynxV4.1数据系统,Waters公司。
1.3 蜂蜜HHP处理
取适量蜂蜜置于软性塑料热封袋内,采用真空封口机对其进行抽真空和封装处理后,分别置于高压300、450、600 MPa保压处理5、10、20 min,样品卸压后,从高压槽中取出,立即放于冰水浴中冷却后置于4 ℃条件下直到检测。以未处理的蜂蜜作为对照。
1.4 蜂蜜中果糖、葡萄糖和蔗糖的测定
采用高效液相色谱-示差折光检测法(HPLC-refractive index detector,HPLC-RID)对蜂蜜中的果糖、葡萄糖含量进行测定[19]。样品用水溶解,乙腈定容后,经0.45 μm滤膜过滤,液相色谱-示差折光检测器测定,外标法定量。
流动相为V(乙腈)∶V(水)=7∶3组成;流动相流速1.0 mL/min;柱温40 ℃;进样量20 μL;示差折光检测器条件:温度40 ℃;蒸发光散射检测器条件:飘移管温度80~90 ℃;氮气压力350 kPa;撞击器:关。分别制备1 000、500、400、200、100、40 μg/mL的果糖、葡萄糖和蔗糖标准溶液,经测定,标准果糖、葡萄糖和蔗糖的出峰时间分别为6.80、7.74、11.12 min(图1)。以峰面积为纵坐标,浓度为横坐标,得到标准曲线,对样品中单糖含量进行测定。

图1 果糖、葡萄糖和蔗糖的高效液相色谱-蒸发光散射色谱图
Fig.1 HPLC-RID results of standard fructose, glucose and sucrose
1.5 蜂蜜中关键酶活性的测定
1.5.1 淀粉酶活力的测定
根据中华人民共和国国家标准GB/T 18932.16—2003采用分光光度法测定[20]。将蜂蜜稀释液置于(40±0.2) ℃水浴中, 15 min后加入1%(质量浓度)淀粉溶液使其在淀粉酶的作用下水解, 并开始计时, 每隔5 min取一定量此溶液, 加入碘溶液使剩余的淀粉显色。用分光光度计测量光密度值,待光密度值降低到0.235所需时间来计算淀粉酶值。
蜂蜜的淀粉酶酶值是指1 g蜂蜜所含淀粉酶在一定条件下可转化1%淀粉溶液的体积,单位为mL/(g·h)。
1.5.2 蔗糖转化酶活力的测定
采用3,5-二硝基水杨酸比色法[21],将蜂蜜蔗糖混合液于45 ℃水浴锅中水浴1 h进行转化,分别取转化前和转化后的蜂蜜蔗糖混合溶液各1 mL移入25 mL容量瓶中,加入3,5-二硝基水杨酸溶液2 mL,沸水浴3 min显色,冷却后定容。用分光光度仪在520 nm处测定。
蔗糖转化酶酶值是指在1 g蜂蜜的作用下,在 1 h内能使蔗糖转化为单糖的质量,单位为mg/(g·h)。
1.6 蜂蜜中5-HMF的测定
5-HMF的测定采用高效液相色谱-二极管矩阵检测器方法测定[22]。HPLC条件:流动相:(A)水相0.1%甲酸水溶液和(B)有机相乙腈溶液,以V(A)∶V(B)=30∶70实行等度洗脱。流速1.0 mL/min;柱温40 ℃;进样量10 μL;检测器PDA;检测波长250 nm;色谱柱Waters XTerra RP-18(250×4.6 mm, 5 μm)。
制备质量浓度为120、100、23、10、4.8和0.96 mg/mL的5-HMF标准溶液,以5-HMF浓度为横坐标,对应峰面积为纵坐标,得到标准曲线(y=71 426x+604.29,R2=0.998 5),进行样品中5-HMF含量的测定。
1.7 蜂蜜中二羰基化合物的测定
首先对蜂蜜样品中的二羰基化合物采用超高压液相色谱飞行时间质谱进行分析和鉴定[23]。样品提取液经11 mmol/L二亚乙基三胺五乙酸水溶液(含20%邻苯二胺溶液)衍生后,采用高效液相色谱法显示只含有一种二羰基化合物(图2),经ESI一级全扫描质谱准分子离子峰[M+H]+显示分子量为235的物质(图3),确定该二羰基化合物为3-DG。最后配制5、2.5、1.25、0.62和0.31 mg/mL的3-DG标准溶液,经衍生后充分混匀静置2 h,过滤后进行HPLC的定量,以浓度为横坐标,峰面积为纵坐标,得到3-DG标准曲线(y=106x+681 268,R2=0.997 7),根据该标准曲线测定样品中3-DG含量。
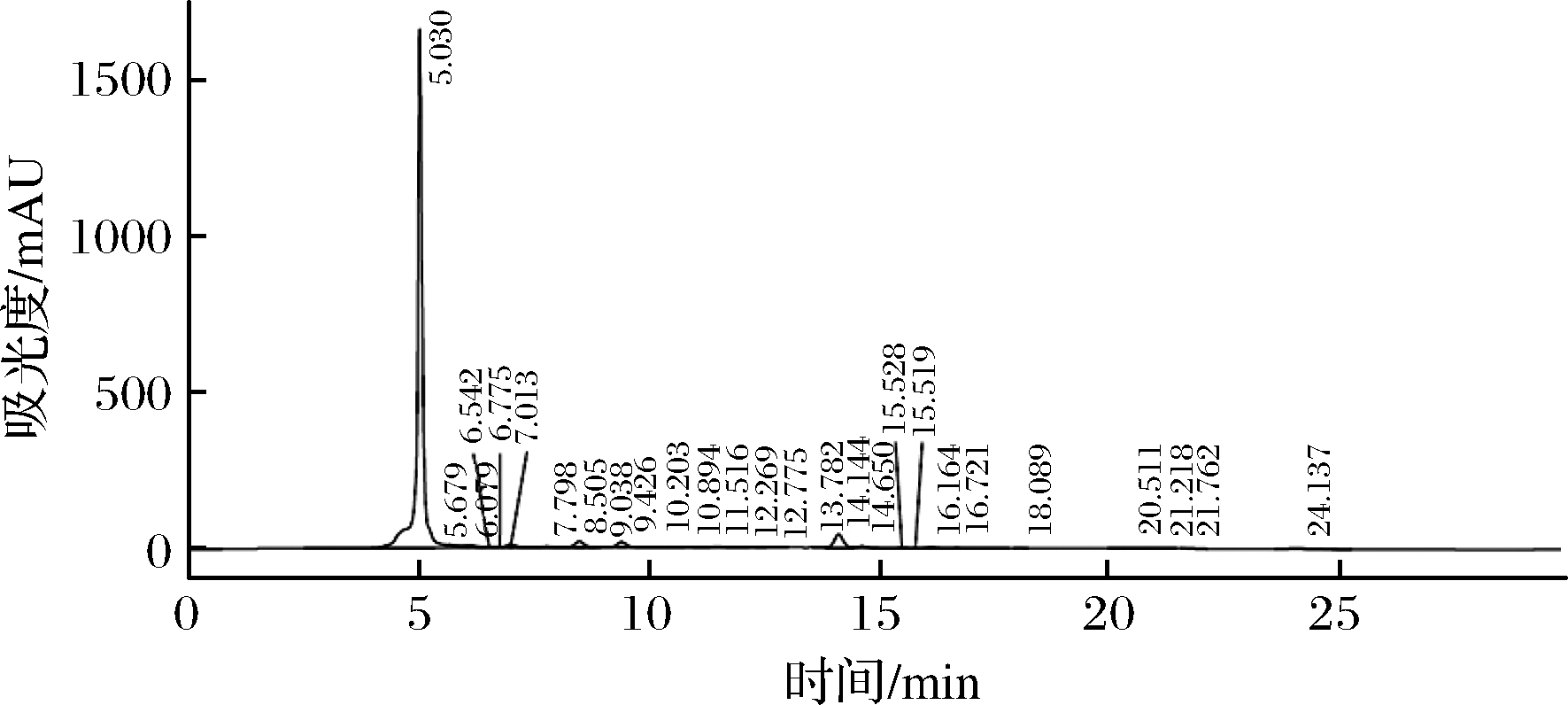
图2 蜂蜜中二碳基化合物衍生物高效液相色谱图
Fig.2 HPLC chromatogram of the dicarbonyl derivatives of honey
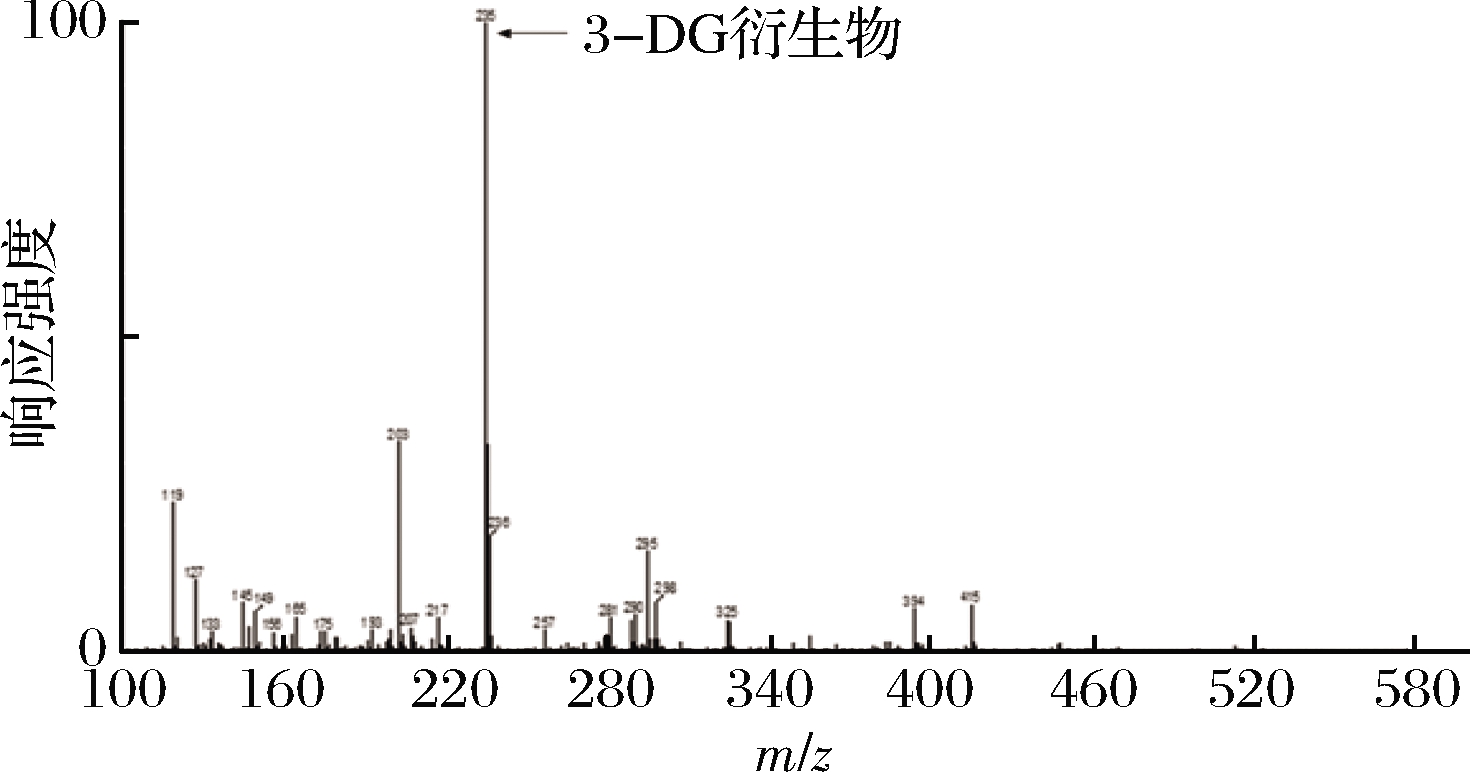
图3 二羰基化合物衍生物质谱图
Fig.3 The MS result of dicarbonyl compound
UPLC-TOF-MS质谱条件:流动相使用1%(体积分数)甲酸水溶液(A)和1%(体积分数)甲酸的甲醇溶液(B)的梯度混合物;流动相流速:1.0 mL/min;梯度混合物从30%B开始并在10 min内增加至60%B,然后在2 min内降至30%B,并且30%B保持3 min,色谱运行在15 min内完成;柱温40 ℃;进样量10 μL;检测器二极管阵列检测器;检测波长254 nm;色谱柱Waters XTerra RP-18;电喷雾离子源(ESI源),正离子模式,毛细管喷雾电压为3.5 kV,脱溶剂气温度为550 ℃。
1.8 数据分析
试验数据为3次重复试验的平均值,用Minitab 17.0软件进行Turkey多重差异显著性分析,P<0.05表示差异显著,采用Excel软件进行作图。
2 结果与分析
2.1 HHP对蜂蜜中果糖和葡萄糖含量的影响
本文荔枝蜂蜜的果糖质量分数约为(50.5±0.8)%(图4),高于枣花蜜、椴树蜜[24]和墨西哥的百花蜜[17]报道的21%~46%,但葡萄糖质量分数约为(37.1±0.9)%,与文献报道一致34%~46%[17,24]。蜂蜜中糖含量与蜂蜜来源和产地高度相关,还受天气、加工以及贮藏等因素影响,因此造成不同蜂蜜中糖含量的差异[25]。
蜂蜜经HHP处理后果糖、葡萄糖的含量见图4。HHP并未对蜂蜜中果糖和葡萄糖含量产生影响,证实了LEYVA-DANIEL等[12]的结果,600 MPa (2~15 min)处理未影响墨西哥百花蜜中单糖含量。果糖的含量是影响蜂蜜甜度与结晶的原因之一,生产上常用果糖与葡萄糖的比率(F/G)评价蜂蜜易结晶的程度,当F/G<1.11时结晶速率加快,>1.33时则结晶较缓慢[26]。本文所有样品的F/G在1.35~1.39,说明该蜂蜜结晶程度缓慢且HHP并未改变其结晶趋势。
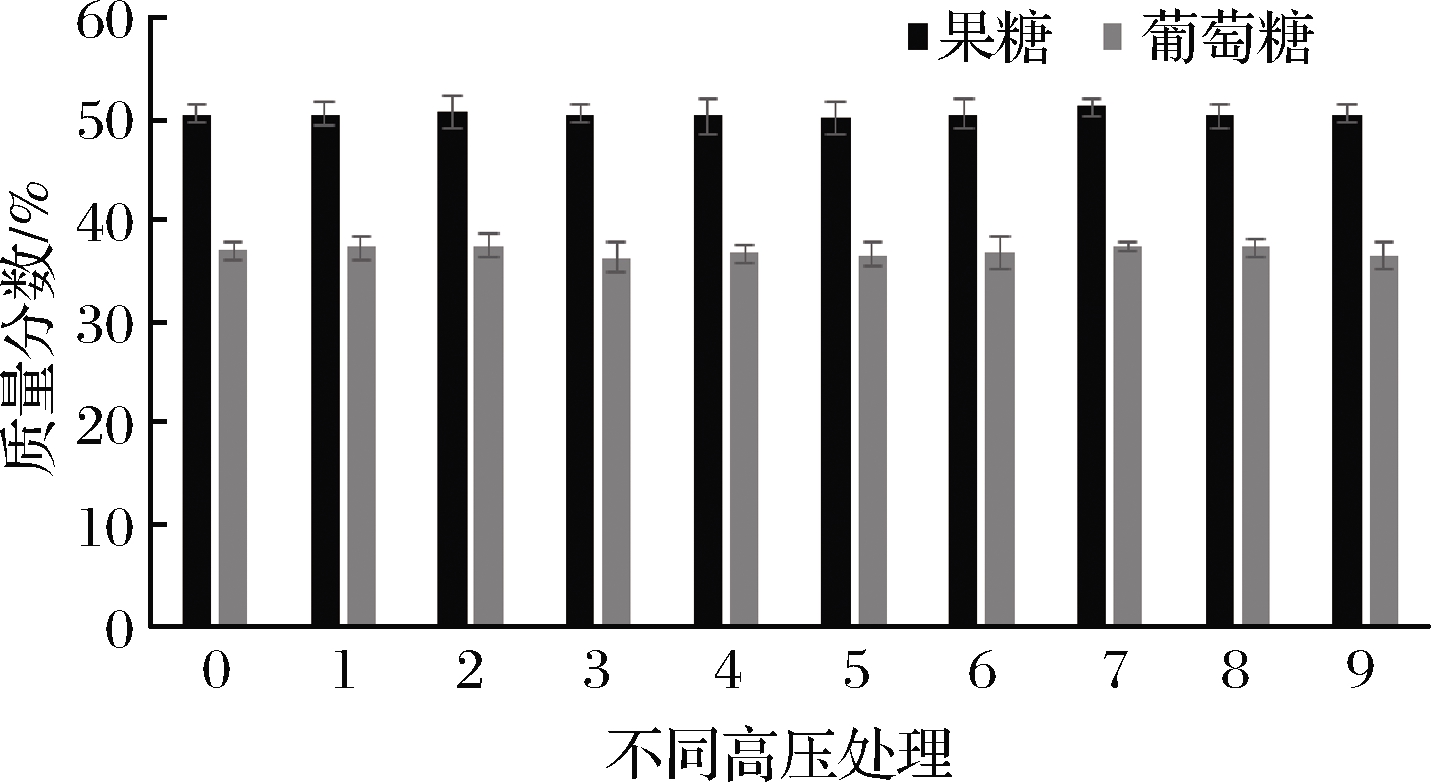
图4 HHP对蜂蜜中果糖和葡萄糖含量的影响
Fig.4 The effect of HHP on the content of fructose and glucose in honey
注:图中横坐标0~9分别表示对照、300 MPa-5 min、300 MPa-10 min、300 MPa-20 min、450 MPa-5 min、450 MPa-10 min、450 MPa-20 min、600 MPa-10 min、600 MPa-10 min、600 MPa-20 min(下同)
2.2 HHP对蜂蜜中淀粉酶和蔗糖转化酶酶活的影响
HHP不同压力、时间下对蜂蜜淀粉酶活性的影响见图5。结果表明,HHP处理造成了淀粉酶活性不同程度的下降。当压力300 MPa,保压时间5、10和20 min时,淀粉酶活性分别损失了11.6%、20.7%和25.3%。当时间为5 min,压力在300、450和600 MPa时,活性分别损失了11.6%、25.2%和30.5%。最高酶活损失(40.4%)出现在600 MPa-20 min,为17.1,仍远高于8,符合国标要求。
进一步对图5数据进行方差分析,在显著性水平α=0.05下,发现压力和时间对淀粉酶活性都具有显著性影响(P=0.000)。目前有关HHP对蜂蜜淀粉酶活性的影响还存在争议。墨西哥百花蜜经600 MPa处理,发现2~12 min内淀粉酶活性显著下降,然而当时间延长到15 min,其活力与对照未见显著差异[12]。麦卢卡蜂蜜经100~800 MPa处理15~120 min未见对其淀粉酶活性产生显著差异(P>0.05)[11]。克鲁特蜂蜜经200和600 MPa 处理后,发现600 MPa能提高淀粉酶活力,且压力和保压时间对酶活性影响均不显著(P>0.05)[13]。多项研究表明,食品中酶活受到HHP压力、时间以及食品种类影响,可能会使其增强或钝化[27],因此,有关HHP对蜂蜜中淀粉酶活的影响有待于开展更多的研究。
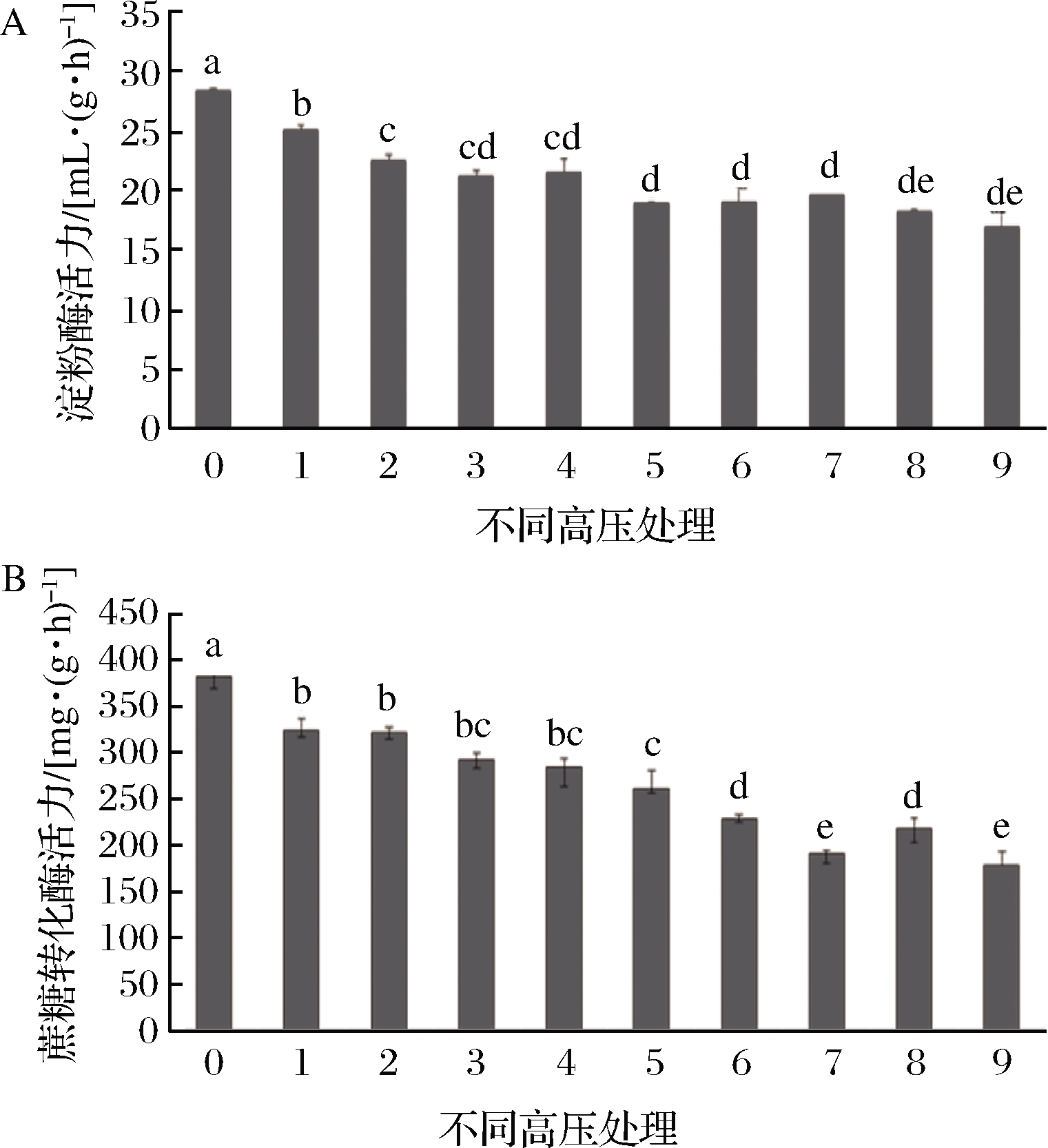
A-淀粉酶活力;B-蔗糖转化酶活力
图5 HHP处理对蜂蜜中淀粉酶和蔗糖转化酶活的影响
Fig.5 Effect of HHP on diastase and sucrose invertase activity in honey
注:不同小写字母表示差异显著(P<0.05)(下同)
HHP对蜂蜜中蔗糖转化酶活性的影响见图5。随着压力的增加和作用时间的延长,蔗糖转化酶的活力呈较缓和的下降趋势。在300 MPa,经5,10 和20 min处理,蜂蜜中的蔗糖转化酶活性分别损失了17.2%、16.7%和22.5%,处理时间未造成显著性差异;在450 MPa,经5、10和20 min 处理,蔗糖转化酶活性分别损失了26.1%、32.4%和40.1%。最大的蔗糖转化酶活力损失(56.3%)出现在600 MPa-20 min。进一步对蜂蜜中蔗糖转化酶活性随HHP压力和处理时间的变化进行方差分析,在显著性水平α=0.05下,2个因素(压力和时间)对蔗糖转化酶活都具有显著性影响(P=0.000)。
虽然目前有关HHP对蜂蜜中蔗糖转化酶的活性影响未见报道,但有研究指出,蔗糖转化酶的活性受到糖的种类和含量以及食品介质成分的影响。纯化的芒果蔗糖转化酶在120 g/L蔗糖溶液中经600 MPa(30 min, 50 ℃)处理后其活性仅保留26%,在6、60 g/L蔗糖溶液和6~120 g/L的海藻糖溶液中则完全失活。不同酯化度和浓度的果胶溶液对芒果蔗糖转化酶酶活性的影响也会产生差异[28]。另外酸性环境(pH 3~4)和牛血清白蛋白对纯化芒果蔗糖转化酶活性有保护作用[28]。因此,HHP对蜂蜜中蔗糖转化酶的影响也可能会受到蜂蜜品种、成分等影响,有待于进一步深入研究。
2.3 HHP对5-HMF的影响
将蜂蜜采用HHP处理后其5-HMF含量见图6。对照和HHP处理的蜂蜜5-HMF值在1.2 mg/kg左右,远小于标准规定的15 mg/kg,符合要求。经HHP处理后除450 MPa-20 min和600 MPa-5 min未造成显著变化,其余均有降低。该结果与文献报道的一致。在采用600 MPa (2~15 min)处理墨西哥百花蜜后,5-HMF 含量有一定下降,介于6.9~7.2 mg/kg[12]。用100~800 MPa处理麦卢卡蜂蜜15~120 min后5-HMF含量未显著变化[11]。虽然也有研究发现HHP使土耳其蜂蜜中5-HMF含量分别增加12%和11%,但对比传统加热方式其增加幅度变小[7]。说明HHP不会促使5-HMF生成甚至有抑制的作用,这可能与HHP对美拉德反应有抑制作用相关[29-30]。

图6 HHP对5-HMF含量的影响
Fig.6 The effect of HHP on 5-HMF content
2.4 HHP对二羰基化合物的影响
蜂蜜中二羰基化合物主要包括乙二醛(glyoxal,GO)、甲基乙二醛(methylglyoxal,MGO)、3-DG等几种[15,31]。经测定,本文蜂蜜对照样品中的二羰基化合物主要是3-DG,含量为251.2 mg/kg,这与文献结果一致[31-32]。3-DG是葡萄糖降解的初级产物,也是产生5-HMF的主要前体物质[33],其含量受到蜂蜜品种、产地、温度、贮藏时间等影响[34]。3-DG之后可继续分解为MGO和GO[31],GO和3-DG产生的“羰基胁迫”可能是药用蜂蜜的主要杀菌因子[35],MGO含量与麦卢卡蜂蜜的抗炎活性呈现很强的相关性[36]。因此,3-DG的含量与蜂蜜品质及其功能性密切相关。
经HHP处理后3-DG含量变化见图7,可见HHP显著增加了3-DG的浓度,增加幅度为22.3%~31.2%,其中450 MPa-20 min时最高(329.72 mg/kg)。虽然有关HHP对二羰基化合物的影响还未见报道,但有研究指出在100~800 MPa(15 min),随着压力增加,MGO含量呈线性增加,推测HHP可造成二羰基化合物的积累[11]。那么相对于传统加热方式易造成3-DG损失,HHP更有效地保证了蜂蜜的品质。

图7 HHP对蜂蜜中3-DG含量的影响
Fig.7 The effect of HHP on the content of 3-DG
3 结论
本文探讨了HHP对蜂蜜中关键品质指标的影响。结果表明,蜂蜜中果糖和葡萄糖质量分数分别为(50.5±0.8)%和(37.1±0.9)%,HHP未对其含量产生影响,F/G在1.35~1.39,说明该蜂蜜结晶程度缓慢且HHP并未改变其结晶趋势。HHP处理造成了蜂蜜中淀粉酶和蔗糖转化酶活性的下降,分别损失了17.1%~40.4%和17.2%~56.3%,压力和时间对2种酶活都具有显著性影响(P>0.05)。在最大的加压处理条件下(600 MPa,20 min),关键酶活性指标仍符合国际标准甚至处于较高水平。蜂蜜中5-HMF含量在(1.12±0.04)mg/kg,远低于国际标准规定的15 mg/kg,经HHP处理后除450 MPa-20 min和600 MPa-5 min未造成显著变化,其余均有降低。3-DG是本文蜂蜜中主要的二羰基化合物,HHP可显著增加其浓度,幅度为22.3%~31.2%。根据已报道的HHP对麦卡卢蜂蜜的灭菌结果,500 MPa(20 min)的处理对金黄色葡萄球菌的灭活作用显著,且灭活作用随压力、时间增加而增加[11]。综上所述,HHP以非热的形式加工处理在保存蜂蜜品质和新鲜度方面具有较大优势,且能有效灭菌,值得进一步研究和应用。
[1] GB 14963—2011 食品安全国家标准 蜂蜜[S].北京:中国标准出版社,2011.
GB 14963—2011 National food safety standard-honey[S].Beijing:China Standards Press,2011.
[2] LEYVA-DANIEL D E, ALAMILLA-BELTRAN L, VILLALOBOS-CASTILLEJOS F, et al.Microfluidization as a honey processing proposal to improve its functional quality[J].Food Engineering,2020, 274:1-7.
[3] 刁青云,代平礼,周军.2010-2017 年国际蜂蜜生产及贸易情况[J].蜜蜂杂志,2019, 39(12):51-55.
DIAO Q Y, DAI P L, ZHOU J.International honey production and trade in 2010-2017[J].Journal of Bee, 2019, 39(12):51-55.
[4] TURHAN I, TETIK N, KARHAN M, et al.Quality of honeys influenced by thermal treatment[J].LWT-Food Science and Technology, 2008,41:1 396-1 399.
[5] CHUA L S, ADNAN N A, ABDUL-RAHAMAN N L, et al.Effect of thermal treatment on the biochemical composition of tropical honey samples[J].International Food Research Journal,2014, 21(2):773-778.
[6] LICHTENBERG-KRAAG B.Evidence for correlation between invertase activity and sucrose content during the ripening process of honey[J].Journal of Apicultural Research, 2014, 53(3):364-373.
[7] ONUR I, MISRA N N, FRANCISCO J B, et al.Effects of ultrasound and high pressure on physicochemical properties and HMF formation in Turkish honey types[J].Journal of Food Engineering,2018, 219:129-136.
[8] Codex Alimentarius Commission.Revised standard for honey[S].Rome: Codex Standard,2001.
[9] Eurpean Commission.Council Directive 2001/110/EC relating to honey[S].Brussels:Offical Journal of the European, 2002,10:47-50.
[10] RAMIREZ CERVANTES M A,GONZALEZ NOVELO S A, SAURI DUCH E.Effect of the temporary thermic treatment of honey on variation of the quality of the same during storage[J].Apiacata,2000, 35:162-170.
[11] AL-HABSI N A, NIRANJAN K.Effect of high hydrostatic pressure on antimicrobial activity and quality of Manuka honey[J].Food Chemistry,2012, 135 (3):1 448-1 454.
[12] LEYVA-DANIEL D E, ESCOBEDO-AVELLANEDA Z, VILLALOBOS-CASTILLEJOS F, et al.Effect of high hydrostatic pressure applied to a Mexican honey to increase its microbiological and functional quality[J].Food and Bioproducts Processing,2017, 102:299-306.
[13] MUHAMMAD F R, FAUZIA N A M, SULAIMAN A, et al.Effect of high-pressure processing (HPP) on antioxidant, diastase activity and colour for kelulut (stingless bee) honey[J].Journal Teknologi (Sciences & Engineering),2019, 81(3):91-98.
[14] 武文洲.国内外蜂蜜加工工艺应用进展[J].现代食品, 2016, 15:67-68.
WU W Z.Application progress of honey technology in china and abroad[J].Modern Food, 2016, 15:67-68.
[15] WEIGEL K U, OPITZ T, HENLE T.Studies on the occurrence and formation of 1,2-dicarbonyls in honey[J].European Food Research and Technolgy,2004, 218:147-151.
[16] MARCEAU E, YAYLAYAN V A.Profiling of dicarbonyl content of commercial honeys from different botanical origins:Identification of 3,4-dideoxyglucoson-3-ene (3,4-DGE) and related compounds[J].Journal of Agricultural and Food Chemistry, 2009, 57:10 837-10 844.
[17] ARENA E, BALLISTRERI G, TOMASELLI F, et al.Survey of 1,2-dicarbonyl compounds in commercial honey of different floral origin[J].Food Science,2011, 76:1 203-1 210.
[18] RUIZ-MATUTE A I, CASTRO VAZQUEZ L, HERNANDEZ-HERNANDEZ O, et al.Identification and determination of 3-deoxyglucosone and glucosone in carbohydrate-rich foods[J].Science of Food and Agriculture,2015, 95:2 424-2 430.
[19] GB 5009.8—2016 食品安全国家标准中国人民共和国卫生部食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定[S].北京:中国标准出版社, 2011.
GB 5009.8—2016 Determination of fructose, glucose, sucrose, maltose and lactose in national food safety standard[S].Beijing:China Standards Press, 2011.
[20] GB/T 18932.16—2003 蜂蜜中淀粉酶值的测定方法分光光度法[S].北京:中国标准出版社,2005.
GB/T 18932.16—2003 Determination of amylase value in honey-Spectrophotometric method[S].Beijing:China Standard Press, 2005.
[21] 张忠义,陈辉,刘振林.蜂蜜中蔗糖转化酶测定方法探讨[J].食品科学,2002(11):116-118.
ZHANG Z Y, CHEN H, LIU Z L.Determination of sucrose invertase in honey[J].Food Science, 2002(11):116-118.
[22] HAMZALIOGLU A, GOKMEN V.Investigation and kinetic evaluation of the reactions of hydroxymethylfurfural with amino and thiol groups of amino acids[J].Food Chemistry, 2018,240:354-360.
[23] GONCUOGLU TAS N, GOKMEN V.Maillard reaction and caramelization during hazelnut roasting:A multi-response kinetic study[J].Food Chemistry, 2017,221:1 911-1 922.
[24] 张晓华.蜂蜜中糖类的高效液相色谱测定及其在蜂蜜品质控制中的应用研究[J].食品研究与开发,2019, 40(16):74-79.
ZHANG X H.Determination of sugars in honey by high performance liquid chromatography and its application in honey quality control[J].Food Research and Development,2019, 40(16):74-79.
[25] HURTADO-SANCHEZ M D C, ESPINOSA-MANSILLA A, DURAN-MERAS I.Influence of the presence of natural monosaccharides in the quantification of alpha-dicarbonyl compounds in high content sugar samples.A comparative study by ultra-high performance liquid chromatography-single quadrupole mass spectrometry using different derivatization reactions[J].Chromatogr.A,2015, 1 422:117-127.
[26] SMANALIEVA J, SENGE B.Analytical and rheological investigations into selected unifloral German honey[J].European Food Research and Technology,2009, 229:107-113.
[27] 张瑜,缪铭,江波,等.超高压加工对食品酶催化特性的影响[J].食品与发酵工业,2011, 37(3):130-135.
ZHANG Y, MIU M, JIANG B, et al.Effect of high pressure processing on the catalytic characteristics of food enzyme[J].Food and Fermentation Industries,2011, 37(3):130-135.
[28] LI R, WANG Y, LING J, et al.Effects of high pressure processing on activity and structure of soluble acid invertase in mango pulp, crude extract, purified form and model systems[J].Food Chemistry,2017, 231:96-104.
[29] KOWALSKI S.Changes of antioxidant activity and formation of 5-hydroxymethylfurfural in honey during thermal and microwave processing[J].Food Chemistry,2013, 141:1 378-1 382.
[30] KOMTHONG P, KATOH T, IGURA N, et al.Effect of high hydrostatic pressure combined with pH and temperature on glucose/fructoseleucine/ lysine/glutamate browning reactions[J].Journal of the Faculty of Agriculture Kyushu University,2003, 48:135-142.
[31] WEIGEL K U, OPITZ T, HENLE T.Studies on the occurrence and formation of 1,2-dicarbonyls in honey[J].European Food Research and Technology,2004, 218:147-151.
[32] ARENA E, BALLISTRERI G, TOMASELLI F, et al.Survey of 1,2-dicarbonyl compounds in commercial honey of different floral origin[J].Food Science,2011,76:1 203-1 210.
[33] BELITZ H D, GROSCH W, SCHIEBERLE P.Food Chemistry[M].4th ed.Heidelberg:Springer-Verlag,2009.
[34] MARSHALL S M, SCHNEIDER K R, CISNEROS K V, et al.Determination of antioxidant capacities, alpha-dicarbonyls, and phenolic phytochemicals in Florida varietal honeys using HPLC-DAD-ESI-MS[J].Journal of Agricultural and Food Chemistry,2014, 62:8 623-8 631.
[35] HENATSCH D, DEN HARTOG G J M, DUIJVESTIJN A M, et al.The contribution of α-dicarbonyl compound dependent radical formation to the antiseptic effect of honey[J].Journal of Functional Foods, 2018, 45:239-246.
[36] MAJTAN J, BOHOVA J, PROCHAZKA E, et al.Methylglyoxal may affect hydrogen peroxide accumulation in manuka honey through the inhibition of glucose oxidase[J].Journal of Medicinal Food, 2014, 17,290-293.