“曲为酒之骨”,酒曲在酿酒过程中发挥着重要作用,酒曲中具有不同功能的多种微生物将原料发酵成酒并使其具有独特风味[1-2]。微生物不能直接利用淀粉质原料进行发酵,酒曲中存在一类微生物,其产生的液化酶和糖化酶可将淀粉结构中的α-1,4糖苷键和α-1,6糖苷键切断,将淀粉转化为葡萄糖等可发酵糖,从而提高淀粉利用率[3-5],此过程称为糖化;这类微生物称之为糖化菌。酒曲中糖化菌种类众多,如霉菌、细菌和一些酵母等,多数以霉菌为主[6-10]。酒曲中常见的霉菌包括曲霉属(Aspergillus)[11]、根霉属(Rhizopus)[12-13]、毛霉属(Mucor)、犁头霉属(Absidia)[14]、青霉属(Penicillium)[15-16]等,其中曲霉属和根霉属菌种与其他菌种相比糖化能力尤为突出[17],在粮醅糖化过程中的作用十分显著,广泛应用于大多数酒曲中[18-19]。部分糖化菌对酿酒起糖化作用的同时也兼具其他作用,如改善酒的口感,增加香气物质等,对酿造酒的风味及风格的形成都具有积极作用[20-21]。
为获得在米酒酿造中淀粉糖化能力强的菌株,本研究采用孢子纯化法从9种不同来源的酒曲中初筛得到纯菌株,通过比较纯菌株所制酒曲的液化力和糖化力复筛得到糖化能力突出的菌株,并对其进行形态学和分子生物学鉴定,同时对菌株进行试饭试验、蛋白酶活力测定及发酵风味物质分析。
1 材料与方法
1.1 原料
酒曲:通过多种途径收集得到9种不同酒曲,详细信息见表1;籼米(市售)、麸皮(网购),无霉、无蛀保存完好。
表1 酒曲样品信息
Table 1 Information of the samples of Jiuqu

编号酒曲来源编号酒曲来源1融水重阳酒酒曲实验室保存6甜酒曲 市售 2圆酒曲 实验室保存7酿酒曲块 网购 3白酒曲 市售 8高产优质白酒曲市售 4香蜜甜酒曲 市售 9酿酒曲块 实验室保存5绿衣观音土酒曲网购
1.2 试剂
二氯甲烷、NaOH、CuSO4·5H2O、酒石酸钾钠、乳酸、乙酸、乙酸钠、葡萄糖、三氯乙酸、Na2CO3、KI,西陇科学股份有限公司;可溶性淀粉(酶制剂行业检测专用),湖州展望药业有限公司;福林酚试剂,福州文莱生物科技有限公司;L-酪氨酸、酪蛋白,合肥博美生物科技有限责任公司;碘,天津市科密欧化学试剂有限公司;乳酸钠,天津市光复精细化工研究所。
1.3 培养基
PDA培养基:去皮马铃薯200 g,切块沸水加热20 min,8层纱布过滤取滤液,20 g葡萄糖,15 g琼脂加热溶解,加水补足至1 000 mL,自然pH,高压蒸汽115 ℃灭菌20 min。
麸皮培养基:m(麸皮)∶m(水)=1∶0.8,每20 g麸皮分装至500 mL三角瓶,高压蒸汽121 ℃灭菌20 min,灭菌完毕振荡三角瓶,确保麸皮培养基疏松不结块。
米饭培养基:m(大米)∶m(水)=1∶3,每50 g米分装至500 mL三角瓶,高压蒸汽115 ℃灭菌20 min。
1.4 仪器与设备
UV-8000S紫外可见分光光度计,上海元析仪器有限公司;BX43生物显微镜,日本奥林巴斯有限公司;pHS-25CW台式酸度计,上海般特仪器制造有限公司;Tpersonal聚合链式反应仪,德国Biometra公司;DYY-6D电泳仪,济南东仪实验室设备有限公司;ZXSD-R1430生化培养箱,上海智城分析仪器制造有限公司;SW-CJ-TB标准净化工作台,苏州安泰空气技术有限公司;LS-B35L-I立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司;SBA生物传感分析仪,济南延和生物科技有限公司;TRACE 1300 ISQ QD 气相色谱质谱联用仪、HP5-MS色谱柱(30 m×0.25 mm×0.25 μm),赛默飞世尔科技有限公司。
1.5 试验方法
1.5.1 糖化菌的初筛
1.5.1.1 菌株的分离
称取5.0 g曲粉(块状需研磨)溶于45 mL无菌水中,振荡混匀2 min,静置取上层菌(孢子)悬液,以10倍系列稀释制备菌(孢子)悬液,分别取10-3、10-4、10-5、10-6、10-7菌(孢子)悬液100 μL,涂布于PDA平板培养基,30 ℃培养2~4 d,以点植法取具有典型糖化菌菌落特征的菌落孢子(曲霉、根霉),接种到新的PDA平板中培养,30 ℃培养2~4 d。
1.5.1.2 菌株的纯化
将1.5.1.1中分离的菌株,以点植法接种培养多代,直至肉眼观察所培养菌落无其他外观杂菌干扰,做到初步纯化。
使用解剖刀将菌落切割并移至50 mL无菌水中振荡,纱布过滤除菌丝取孢子悬液,以10倍系列稀释制备10-7、10-8、10-9孢子悬液,取100 μL孢子悬液涂布于PDA平板培养基,30 ℃培养,以一点为中心生长且不与其他菌落生长相连的单菌落视为纯菌落(即此菌落为1个孢子生长繁殖而成),每个平板生长的菌落控制在1~3个为宜,过多则菌落生长易相连难以纯化,此时需继续稀释孢子悬液,防止孢子飞散繁殖,在整个平板所有菌落产孢子前,以接种针挑取菌丝于PDA斜面培养基,培养至产孢子后4 ℃保存。
1.5.2 糖化菌的复筛
将已纯化的菌株制备孢子悬液,调整其浓度为1×107个/mL,按照1×107个/20g麸皮接种于麸皮培养基,均匀搅拌, 30 ℃培养3 d(每日扣瓶3次),40 ℃烘干10 h,制成糖化曲,4 ℃密封保存。
参考QB/T 4257—2011中方法测定麸曲的液化力、糖化力[22],进行3次平行测定。
1.5.3 形态学鉴定
将复筛得到的菌株以点植法接种于PDA平板中,30 ℃培养3 d,观察菌落形态特征,并通过显微镜观察其微观形态,参考《真菌鉴定手册》对其进行判断[23]。
1.5.4 分子生物学鉴定
1.5.4.1 DNA体外扩增
引物:ITS1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)、ITS4(5′-GGTCCGTGTTTCAAGACGG-3′)。
PCR反应体系:预混酶:25 μL;引物ITS1:2 μL;引物ITS4:2 μL;菌液:2 μL;ddH2O:19 μL。
扩增条件:预变性:94 ℃、5 min;变性:94 ℃、1 min;退火:55 ℃、1 min;延伸:72 ℃、1 min;30个循环;延伸:72 ℃、10 min;4 ℃保存。
1.5.4.2 测序及鉴定
取50 μL PCR扩增产物,通过1%琼脂糖凝胶电泳进行检测。选取电泳条带大小在600 bp左右的样品切胶回收,产物送至广州赛默飞世尔科技公司进行测序。将测序结果提交于美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库进行BLAST序列比对,使用Mega 5.0软件中邻接法构建系统发育树,并采用Bootstraping法评估其准确度。
1.5.5 糖化试饭试验
1.5.5.1 试饭
称取大米40 g,浸泡8 h,蒸米至熟而不烂,超净台内放凉,称重使米水质量比达到1∶1.5,若质量不足,均匀喷无菌水至米饭。以大米质量的0.3%拌曲,移至500 mL无菌三角瓶培养,透气膜包扎,30 ℃培养72 h,每隔12 h取糖化饭10 g,加水50 mL,高压蒸汽100 ℃灭菌10 min,迅速冷却,测定葡萄糖含量,进行3次平行测定。
1.5.5.2 米饭总糖测定
取米水质量比达到1∶1.5的米饭100 g打浆,添加0.1 mL液化酶,95 ℃液化2 h,降温至65 ℃,添加0.5 mL糖化酶糖化2 h,液化、糖化过程中加水,防止水分蒸干,糖化完毕充分过滤定容至1 000 mL,测定葡萄糖含量,进行3次平行测定。
1.5.6 蛋白酶活力测定
参考GB/T 23527—2009,测定复筛得到的菌株的酸性和中性蛋白酶活力[24],进行3次平行测定。
1.5.7 发酵风味物质分析
将筛选出的菌株制备孢子悬液,调整孢子悬液浓度为1×107个/mL,按照1×106个/g米接种到米饭培养基,30 ℃培养5 d,每日无菌条件下搅拌3次,11 000 r/min,4 ℃离心15 min,取30 mL上清液,分别加入30、20、10 mL二氯甲烷在摇床中(100 r/min)萃取1 h、30 min、10 min,分液漏斗取有机相,减压浓缩至5 mL,使用GC-MS测定风味物质。
气相色谱条件:40 ℃保持5 min,以5 ℃/min升至180 ℃保持5 min,再以5 ℃/min升至260 ℃保持2 min;进样口温度280 ℃;氦气流速1 mL/min;进样量1 μL;不分流进样。
质谱条件:离子源温度300 ℃;传输通道温度280 ℃;电离方式EI电离源;电子能量70 eV;质谱扫描范围40~600 amu。
1.5.8 数据统计分析
利用Origin、Excel对实验数据进行统计分析,分析结果以平均值±标准差表示。
2 结果与分析
2.1 糖化菌初筛
目前普遍采用点植法纯化霉菌,但此方法存在不足之处,霉菌具有蔓延生长和孢子易飞散的特点,点植时蘸取的孢子难以确定是由同一株菌繁殖产生,菌落相似的菌株更加难以分辨,不能达到纯化的目的。本研究首先采用点植法多代培养,排除与所需分离菌株外观不同的杂菌干扰,之后制取其孢子悬液涂布于培养基,以一点为中心生长且不与其他菌落生长相连的单菌落视为纯菌落,即由单孢子繁殖而来,在整个平板所有菌落产孢子前尽快以接种针挑取保藏,此方法虽较繁琐,但更加严谨。本研究以此方法从9种酒曲中初筛得到13株具有糖化菌特征的霉菌,初筛结果见表2。
表2 酒曲中菌株分离纯化结果
Table 2 Results of isolation and purification of strains from Jiuqu
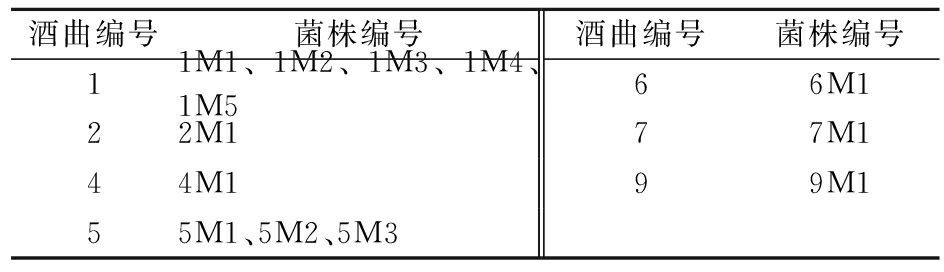
酒曲编号菌株编号酒曲编号菌株编号11M1、1M2、1M3、1M4、1M566M122M177M144M199M155M1、5M2、5M3
2.2 糖化菌复筛
2.2.1 液化力的测定
在酿酒过程中,液化酶可将淀粉质原料水解为糊精、麦芽三糖、直链麦芽低聚糖及葡萄糖等微生物所需营养物质,有利于发酵的进行,对酒风味的形成也起到一定的促进作用,因此液化力是衡量菌株糖化能力的指标之一。在35 ℃,pH 4.6的条件下,记录麸曲浸出液将淀粉完全液化的时间(以碘液检验),以1 g 绝干曲1 h能液化的淀粉毫克数表示液化力,结果如图1所示。菌株7M1、5M2、1M5、9M1、1M4、5M3均具有良好的液化力,液化力依次为(1 929±94.55)、(1 868±92.74)、(1 315±46.54)、(1 125±73.84)、(1 130±66.95)、(1 034±65.16) mg/(g·h),其他菌株液化力均小于1 000 mg/(g·h)。

图1 13株霉菌所制麸曲液化力
Fig.1 Liquefying power of Fuqu made by 13 molds
2.2.2 糖化力的测定
糖化酶能将淀粉全部转化为葡萄糖,也可以将淀粉液化产物转化为葡萄糖,解决了部分微生物对非葡萄糖碳源利用率低或不能利用的问题,提高了淀粉利用率,因此糖化力能直接反映菌株糖化能力。在35 ℃,pH 4.6的条件下,用菲林法测定麸曲浸出液将淀粉转化为葡萄糖的量,以1 g绝干曲1 h转化可溶性淀粉生成葡萄糖的毫克数表示糖化力,结果如图2所示。菌株5M2、1M5和7M1均具有较好的糖化力,糖化力依次为(1 556±15.56)、(1 252 ±63.78)、(1 054±21.11) mg/(g·h),其他菌株糖化力均小于1 000 mg/(g·h)。

图2 13株霉菌所制麸曲糖化力
Fig.2 Saccharifying power of Fuqu made by 13 molds
在酿酒中,糖化酶水解液化产物为葡萄糖相比于直接水解淀粉更容易且迅速,因此在生产中,液化力和糖化力突出的菌株常搭配使用,达到最终糖化的目的。综合分析,菌株1M5、5M2和7M1的液化力及糖化力均突出,具有单独使用的潜力。
2.3 糖化菌形态学鉴定
将菌株1M5、5M2和7M1接种在PDA培养基中,30 ℃培养3 d,观察菌落形态及显微形态,如图3所示。
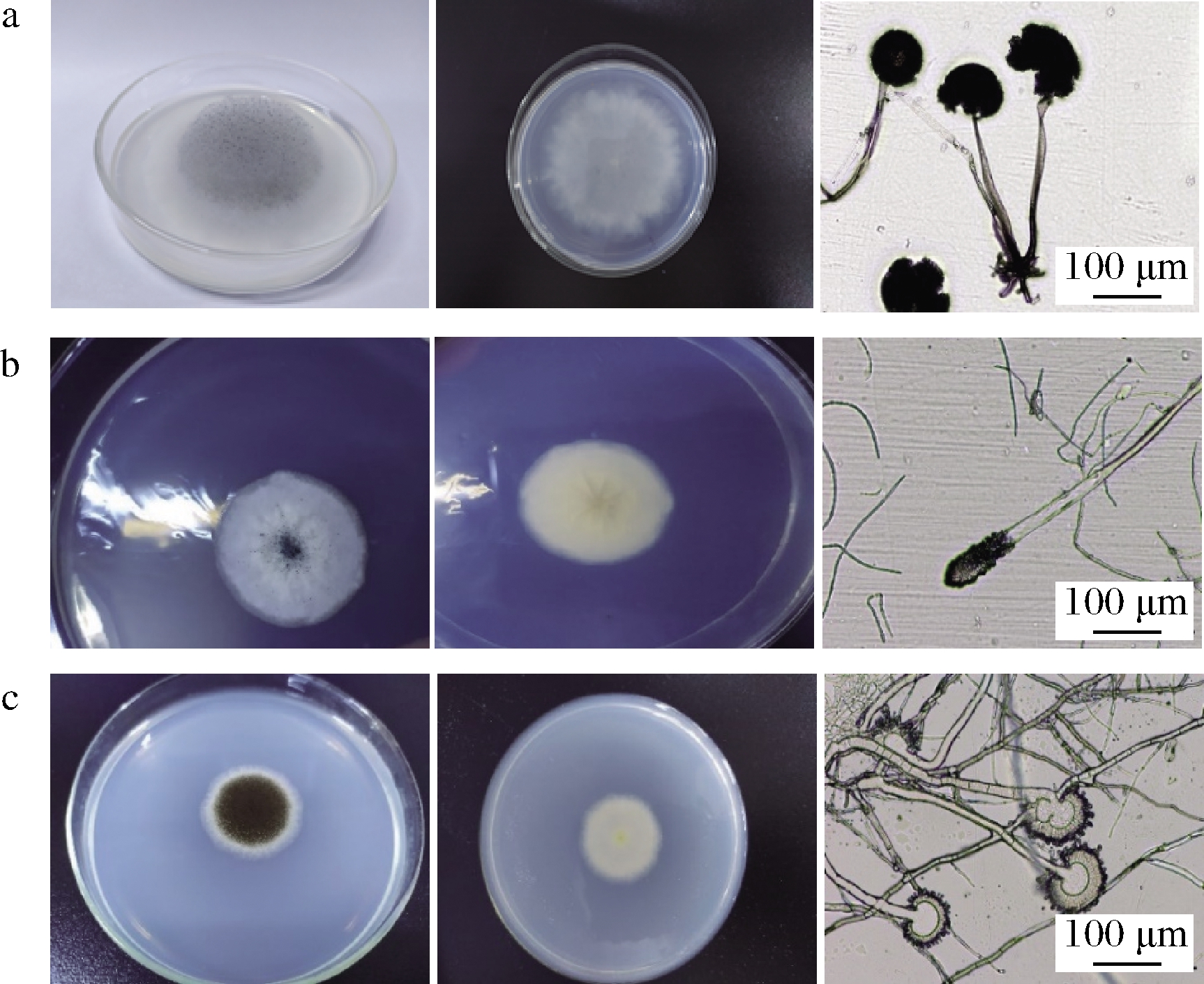
a-菌株1M5菌落正面、背面和显微形态;b-菌株5M2菌落正面、背面和显微形态;c-菌株7M1菌落正面、背面和显微形态
图3 菌株1M5、5M2和7M1菌落及显微形态
Fig.3 Morphological characteristics of strains 1M5, 5M2 and 7M1
菌株1M5菌落的正面及背面初为白色,后中心变为黑色并向边缘扩散,直径达6 cm,边缘不整齐,菌落疏松呈絮状,菌丝发达。显微观察,孢囊梗直立丛生,不分支与假根对生,直径达8~10 μm。孢子囊呈球形,直径35~50 μm,孢子近似球形,直径2.5~4 μm,符合根霉特征。
菌株5M2菌落正面初为白色,后中心变为墨绿色并向边缘扩散,背面呈淡黄色,有以接种点为中心放射状沟纹,直径达2.5 cm,边缘整齐,显微观察,孢囊梗直径达13~18 μm。孢子囊呈棒状,长直径达40~50 μm,孢子近似球形,直径3~4.5 μm,符合棒曲霉特征。
菌株7M1菌落正面初为白色,后中心变为黑色并向边缘扩散,背面呈淡黄色,直径达3 cm。显微观察,孢囊梗与基地部位可见足细胞,孢囊梗直径达13~18 μm。孢子囊呈球形,直径35~45 μm,双层小梗呈放射状排列,孢子近似球形,直径3~5 μm,符合黑曲霉特征。
2.4 糖化菌分子生物学鉴定
将菌株1M5,5M2和7M1的测序结果在NCBI进行BLAST比对,结合邻接法构建进化树,结果如图4和图5所示。

图4 采用邻接法构建菌株1M5与相关分类群的系统发育树
Fig.4 Neighbor-joining phylogenetic tree of strain 1M5 and related taxa constructed

图5 采用邻接法构建菌株5M2、7M1与相关分类群的系统发育树
Fig.5 Neighbor-joining phylogenetic tree of strains 5M2,7M1 and related taxa constructed
经BLAST比对,菌株1M5与Rhizopus microsporus CNM-CM—5165 (JX120681.1)、菌株5M2与Aspergillus clavatus HAk 2-M26 (KU052566.1)及菌株7M1与Aspergillus niger CMXY 25845 (MG991652.1)相似性均达到100%,在系统发育树中也分别聚于同一分支,自展值均达到100%。结合形态学鉴定结果,可以确定菌株1M5为根霉属的小孢根霉,菌株5M2为曲霉属的棒曲霉,菌株7M1为曲霉属的黑曲霉。
2.5 糖化菌糖化试饭效果
将小孢根霉1M5、棒曲霉5M2和黑曲霉7M1制成的麸曲,与实验室保存的重阳酒曲做对比,接种到米饭中,使用SBA生物传感分析仪测定米饭中葡萄糖含量,结果如图6所示。
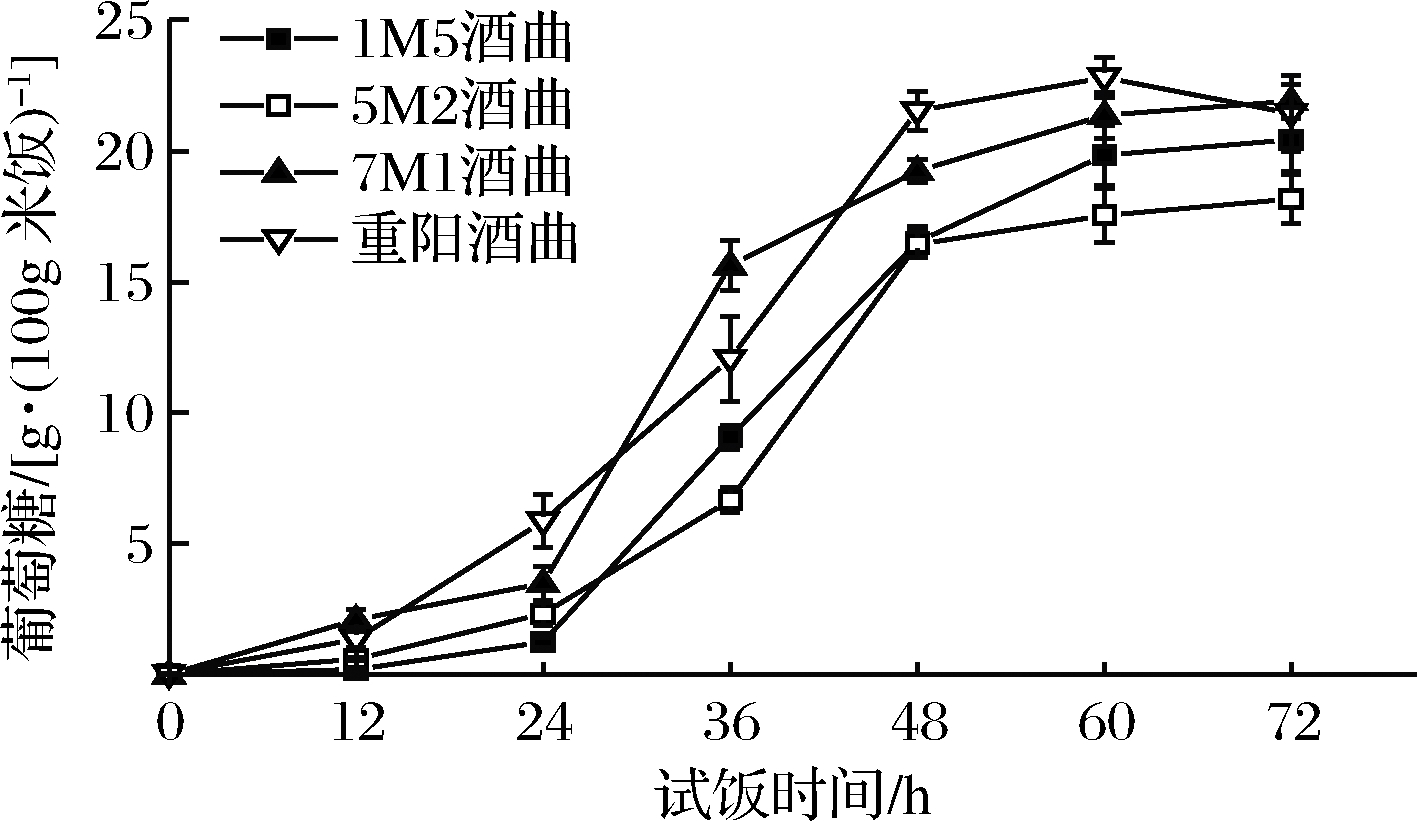
图6 小孢根霉1M5、棒曲霉5M2、黑曲霉7M1所制麸曲和重阳酒曲糖化米饭生成的葡萄糖含量
Fig.6 Glucose contents of rice saccharified by Chongyang Jiuqu and Fuqu made by strains Rhizopus microsporus 1M5, Aspergillus clavatus 5M2, Aspergillus niger 7M1
发酵0~24 h,自制酒曲中葡萄糖积累量增加缓慢,24~48 h,葡萄糖积累量快速增加;重阳酒曲中,12 h后葡萄糖开始大量积累,比自制酒曲更早进入葡萄糖积累快速增加阶段;自制酒曲48~72 h葡萄糖积累缓慢增加,重阳酒曲48~60 h,葡萄糖积累缓慢增加,60~72 h出现葡萄糖积累量下降的情况,自制酒曲60~72 h积累量仍在上升。可知若4种酒曲应用到酿酒中,使用重阳酒曲所需糖化培菌时间更短,但自制酒曲可通过加大酒曲用量提前进入葡萄糖大量积累阶段,并且缩短糖化时间。4种酒曲试饭葡萄糖积累量存在差异,小孢根霉7M1酒曲72 h试饭葡萄糖积累量最高、其次为重阳酒曲、棒曲霉1M5酒曲和黑曲霉5M2酒曲,每100 g米饭分别含(21.9±0.66)、(21.43±1.45)、(20.43±1.22)和(18.17±0.93) g葡萄糖。将未加入酒曲的米饭中添加液化酶、糖化酶使米饭全部糖化,测得100 g米饭含(32.67±1.01) g葡萄糖,通过计算,酒曲7M1、1M5和5M2的72 h试饭糖化率分别为67.04%、62.55%和55.61%,重阳酒曲为65.51%。重阳酒曲60 h葡萄糖积累量达到最大,最大糖化率为69.79%,之后积累量下降,但自制酒曲60 h后葡萄糖仍在积累,具有超越重阳酒曲最大糖化率的潜力。综上所述,筛选得到的小孢根霉1M5、棒曲霉5M2和黑曲霉7M1糖化能力良好,具有酿造米酒的潜力。
2.6 糖化菌蛋白酶活力测定
酿酒过程处于酸性和中性环境,原料中的蛋白质能够被酒曲中微生物分泌的酸性和中性蛋白酶水解,能够提供更多的碳源和氨基酸,促进微生物生长繁殖[25-27],改善营养价值,并且对产品风味的形成起到重要作用[28-29]。因此制作了L-酪氨酸标准曲线,并使用Folin-酚法测定了小孢根霉1M5、棒曲霉5M2和黑曲霉7M1所制麸曲的酸性和中性蛋白酶活力。1 g绝干曲粉,在40 ℃和一定pH值(pH 3:酸性;pH 7.5:中性)条件下,以1 min水解酪蛋白产生酪氨酸的微克数,表示蛋白酶活力,结果如表3所示。
在L-酪氨酸标准液浓度范围内(0~50 μg/mL)线性关系良好(R2=0.997 4,y=0.010 2x+0.003 3),符合检测要求。由表3可知,黑曲霉7M1酸性蛋白酶活力最大,其次为棒曲霉5M2和小孢根霉1M5。棒曲霉5M2中性蛋白酶活力最大,其次为小孢根霉1M5和黑曲霉7M1。综合考虑,菌株5M2酸性和中性蛋白酶活力均较高,对整个发酵过程而言,更具有优势,因此筛选出菌株5M2并使用GC-MS分析其风味成分。
表3 小孢根霉1M5、棒曲霉5M2和黑曲霉7M1所制麸曲的酸性及中性蛋白酶活力
Table 3 Acid and neutral protease activities of Fuqu made by strains Rhizopus microsporus 1M5, Aspergillus clavatus 5M2 and Aspergillus niger 7M1

菌株编号酸性蛋白酶活力/[μg·(g·min)-1]中性蛋白酶活力/[μg·(g·min)-1]1M5130±27.78997±108.615M2879±44.341 207±38.867M11 305±82.12651±25.44
2.7 棒曲霉5M2发酵风味物质测定
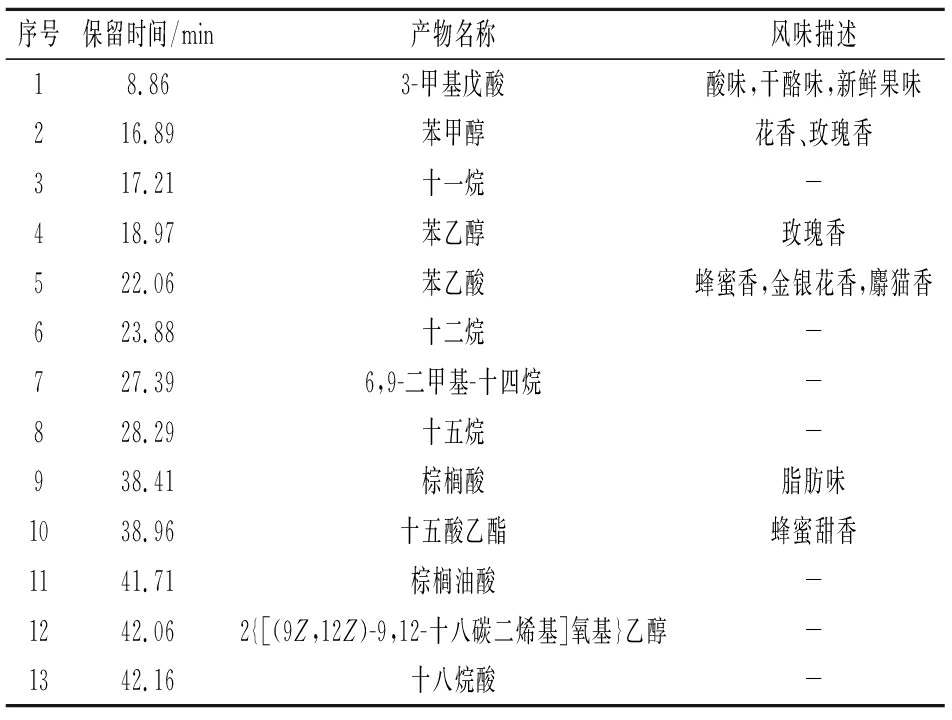
将棒曲霉5M2的孢子悬液接种到米饭培养基发酵,利用GC-MS对发酵代谢的风味物质进行测定。经过发酵后,培养基带有淡淡的花香和果香。棒曲霉5M2发酵产生的主要特征风味物质共13种,如表4所示。分为4大类:酸类、烷烃类、酯类、醇类。3-甲基戊酸、苯甲醇、苯乙醇、苯乙酸、十五酸乙酯都有令人愉悦的香味,其中苯乙醇是米香型酒中主体香气之一[30],烷烃类、醇类和酸类化合物可以作为风味物质的前体物质,对产品的口感也起到一定的促进作用。
表4 棒曲霉5M2发酵主要风味物质
Table 4 Main flavor compounds of Aspergillus clavatus 5M2
序号保留时间/min产物名称风味描述18.863-甲基戊酸酸味,干酪味,新鲜果味216.89苯甲醇花香、玫瑰香317.21十一烷-418.97苯乙醇玫瑰香522.06苯乙酸蜂蜜香,金银花香,麝猫香623.88十二烷-727.396,9-二甲基-十四烷-828.29十五烷-938.41棕榈酸脂肪味1038.96十五酸乙酯蜂蜜甜香1141.71棕榈油酸-1242.062{[(9Z,12Z)-9,12-十八碳二烯基]氧基}乙醇-1342.16十八烷酸-
注:“-”表示无风味描述
3 结论
(1)从酒曲中以孢子分离纯化法初筛得到13株具有糖化菌特征的霉菌,经复筛并鉴定得到糖化能力突出的小孢根霉1M5、棒曲霉5M2和黑曲霉7M1,其液化力分别为(1 315±46.54)、(1 868±92.74)、(1 929±94.55) mg/(g·h),糖化力分别为(1 252±63.78)、(1 556±15.56)、(1 054±21.11) mg/(g·h)。
(2)对小孢根霉1M5、棒曲霉5M2和黑曲霉7M1进行酸性及中性蛋白酶活力测定,结果表明菌株5M2分泌的蛋白酶更适用于发酵,其酸性及中性蛋白酶活力分别为(879±44.34)和(1 207±38.86) μg/(g·min),对其进行发酵风味物质分析,发酵产生的3-甲基戊酸、苯甲醇、苯乙醇、苯乙酸和十五酸乙酯都有令人愉悦的香味。
(3)小孢根霉1M5、棒曲霉5M2和黑曲霉7M1在米酒酿造中具有应用潜力。
[1] LIANG Z C, LIN X Z, HE Z G, et al.Dynamic changes of total acid and bacterial communities during the traditional fermentation of Hong Qu glutinous rice wine[J].Electronic Journal of Biotechnology, 2020, 43:23-31.
[2] LYU X C, WENG X, ZHANG W, et al.Microbial diversity of traditional fermentation starters for Hong Qu glutinous rice wine as determined by PCR-mediated DGGE[J].Food Control, 2012, 28(2):426-434.
[3] 贾瑞博, 胡荣康, 周文斌, 等.米曲霉(Aspergillus oryzae FAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业, 2016, 42(11):71-76.
JIA R B, HU R K, ZHOU W B, et al.Purification and characterization of amylase produced by Aspergillus oryzae FAFU from rice wine fermentation starter[J].Food and Fermentation Industries, 2016, 42(11):71-76.
[4] 苏小军, 熊兴耀, 谭兴和, 等.产生淀粉酶菌株的诱变选育及酶学性质研究[J].食品与机械, 2009,25(2):11-14.
SU X J, XIONG X Y, TAN X H, et al.Study on the mutation breeding of raw-starch-hydrolysing amylase-producing strain and the enzyme properties[J].Food & Machinery, 2009,25(2):11-14.
[5] 罗惠波, 谢军, 黄治国, 等.纯种根霉麸曲制曲工艺优化研究[J].四川理工学院学报(自然科学版), 2015, 28(5):7-11.
LUO H B, XIE J, HUANG Z G, et al.Research on optimization of purebred rhizopus bran koji making technics[J].Journal of Sichuan University of Science & Engineering(Natural Science Edition)[J].2015, 28(5):7-11.
[6] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang- flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[7] 曹文悦, 李灵灵, 高亚梅, 等.一株糖化真菌T6的分离筛选[J].黑龙江八一农垦大学学报, 2019, 31(2):59-64;71.
CAO W Y, LI L L, GAO Y M, et al.Isolation and screening of the saccharifying fungus[J].2019, 31(2):59-64;71.
[8] 杨勇. 方便甜酒酿的关键技术的研究[D].南昌:江西农业大学, 2012.
YANG Y.Study on the key production technology of instant sweet rice wine[D].Nanchang:Jiangxi Agricultural University, 2012.
[9] 龙婷, 余志晟, 汪强, 等.我国传统白酒酿造与工业酒精发酵的比较分析[J].中国酿造, 2018, 37(12):7-11.
LONG T, YU Z S, WANG Q, et al.Comparative analysis of traditional Baijiu brewing and industrial alcohol fermentation in China[J].China Brewing, 2018, 37(12):7-11.
[10] CHEN B, WU Q, XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J].International Journal of Food Microbiology, 2014, 179:80-84.
[11] ZHENG X W, YAN Z, HAN B, et al.Complex microbiota of a Chinese “Fen” liquor fermentation starter (Fen-Daqu), revealed by culture-dependent and culture-independent methods[J].Food Microbiology, 2012, 31(2):293-300.
[12] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[13] YAO L D, JU X, JAMES T Y, et al.Relationship between saccharifying capacity and isolation sources for strains of the Rhizopus arrhizus complex[J].Mycoscience, 2018, 59(5):409-414.
[14] 孙晓璐, 王明跃, 张源.白酒大曲产酯化酶犁头霉的分离鉴定及产酶条件优化[J].食品与机械, 2018, 34(10):40-44;123.
SUN X L, QANG Y M, ZHANG Y.Isolation and identification of high-yield esterase Absidiain Daqu and optimization of enzyme production conditions[J].Food & Machinery, 2018, 34(10):40-44;123.
[15] 刘双平, 谢雅茜, 江正强, 等.嗜热拟青霉糖化酶的性质及其在黄酒酿造中的应用[J].酿酒科技, 2019(6):23-29;34.
LIU S P, XIE Y Q, JIANG Z Q, et al.Properties of a glucoamylase (PtGA15) from paecilomyces thermophila and its application in Huangjiu production[J].Liquor-Making Science & Technology, 2019(6):23-29;34.
[16] 王和玉, 刘延峰, 张巧玲, 等.1株来源于茅台酒酿造过程宛氏拟青霉MTDF-01的全基因组测序及分析[J].食品科学, 2019, 40(24):185-192.
WANG H Y, LIU Y F, ZHANG Q L, et al.Whole-genome sequencing and analysis of paecilomyces variotii MTDF-01, isolated during maotai-flavor liquor brewing[J].Food Science, 2019, 40(24):185-192.
[17] 龙茜萍, 王晓丹, 谭静, 等.一株高产糖化酶菌株的筛选与鉴定[J].酿酒科技, 2013(8):7-9.
LONG X P, WANG X D, TAN J, et al.Screening and identification of a high-yield glucoamylase-producing strain[J].Liquor-Making Science & Technology, 2013(8):7-9.
[18] 谭映月, 胡萍, 谢和.我国白酒酿造微生物多样性的研究现状及展望[J].酿酒科技, 2011(11):100-105.
TAN Y Y, HU P, XIE H.Present research status and prospects of the diversity of liquor-making microbes in China[J].Liquor-Making Science & Technology, 2011(11):100-105.
[19] 王晓燕, 王蓉福, 张昊宇, 等.青稞酒曲中糖化菌的筛选鉴定及降低青稞淀粉工艺优化[J].食品与发酵工业, 2020, 46(5):160-165.
WANG X Y, WANG F R, ZHANG H Y, et al.Screening and identification of saccharifying strains in the highland barley koji and process optimization for degrading barley starch[J].Food and Fermentation Industries, 2020, 46(5):160-165.
[20] 程伟, 张杰, 潘天全, 等.安琪生香活性干酵母在固态小曲清香型白酒酿造生产中的应用[J].酿酒科技, 2018(7):83-88;91.
CHENG W, ZHANG J, PAN T Q, et al.Application of angel aroma-producing active dry yeast in the production of qingxiang Xiaoqu Baijiu by solid-state fermentation[J].Liquor-Making Science & Technology, 2018(7):83-88;91.
[21] 韩英, 赵恒山, 田宇敏, 等.基于风味和产酶性能的霉菌M_2的筛选及制曲工艺优化[J].酿酒科技, 2019(9):27-34.
HAN Y, ZHAO H S, TIAN Y M, et al.Screening of mold strain M2 based on flavor and enzyme-producing performance and optimization of its Daqu-making process[J].Liquor-Making Science & Technology, 2019(9):27-34.
[22] 中华人民共和国工业和信息化部. QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社, 2011.
Ministry of Industry and Information Technology of the People′s Republic of China.QB/T 4257—2011 General methods of analysis for Daqu[S].Beijing:China Standards Press, 2011.
[23] 魏景超. 真菌鉴定手册[M].上海:上海科学技术出版社, 1979.
WEI J C.Manual of Fungal Identification[M].Shanghai:Shanghai Scientific & Technical Publishers, 1979.
[24] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 23527—2009 蛋白酶制剂[S].北京:中国标准出版社, 2009.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 23527—2009 Protease preparations[S].Beijing:China Standards Press, 2009.
[25] 黄家驷, 刘盾, 陈玄阳, 等.浓香型高温酒曲中蛋白酶产生菌的筛选与鉴定[J].安徽农学通报, 2017, 23(21):29-31.
HUANG J S, LIU D, CHEN X Y, et al.Isolation and identification of protease-producing srains from luzhou-flavor liquor starter[J].Anhui Agricultural Science Bulletin, 2017, 23(21):29-31.
[26] 王鹏昊, 关统伟, 邓奥宇, 等.酒曲中高产蛋白酶和α-淀粉酶霉菌菌株的筛选与分子鉴定[J].酿酒科技, 2016(6):61-64;71.
WANG P H, GUAN T W, DENG A Y, et al.Screening and molecular identification of fungal strains with high-yield of protease and α-amylase[J].Liquor-Making Science & Technology, 2016(6):61-64;71.
[27] 梁香, 吴天祥, 敖锐, 等.黄酒优良糖化菌株的筛选及其酶活性能的研究[J].酿酒科技, 2015(3):12-15.
LIANG X, WU T X, AO R, et al.Screening of an excellent saccharifying mold strain for yellow rice wine and study of its enzyme activity[J].Liquor-Making Science & Technology, 2015(3):12-15.
[28] CHANCHAROONPONG C, HSIEH P H, SHEU S C.Enzyme production and growth of Aspergillus oryzae S.on soybean koji fermentation[J].APCBEE Procedia, 2012, 2:57-61.
[29] 耿晓杰, 张玉红, 薛洁, 等.西藏青稞小曲中优良微生物的筛选与鉴定[J].食品与发酵工业, 2019, 45(15):66-73.
GENG X J, ZHANG Y H, XUE J, et al.Screening and identification of excellent microorganisms in Tibetan highland barley Xiaoqu[J].Food and Fermentation Industries, 2019, 45(15):66-73.
[30] 吴轩德. 筛选多菌种发酵提升米酒特征香气物质含量的研究[D].广州:华南理工大学, 2018.
WU X D.Study on improving the content of characteristic aroma substances in rice wine by screening multi-strain fermentation[D].Guangzhou:South China University of Technology, 2018.