甘薯营养成分丰富,紫薯不同于传统的甘薯品种,还拥有含特殊保健功能的花青素、硒元素、花色苷等,因而具有抗氧化、缓解高血压和增强记忆力等多种功能。TANG等[1]对3种薯色紫薯进行成分测定分析,发现紫心紫薯由于富含花青素,其抗氧化能力远高于橘心和白心紫薯。
紫薯在传统加工领域如鲜食、饲料、方便小食品等方面应用广泛,但加工方法单一,附加值低。紫薯中活性成分丰富,将其酿醋,能最大限度增加经济效益。食醋的风味和营养价值是评价食醋品质是否优良的重要指标[2],而紫薯醋中的各种活性成分含量决定了紫薯醋的营养价值。目前对这些活性成分的研究主要集中在含量动态变化、品种差异、活性成分的提取、分离纯化、抗氧化作用等方面[3-4]。
紫薯花色苷是紫薯中最主要的活性成分,许多研究表明,其与体外抗氧化能力密切相关,且在一定浓度范围内,花色苷浓度与体外抗氧化能力成正相关,而紫薯花青素在复杂的发酵过程中,因发酵时间过长、温度较高等因素而损失[5-6]。本研究探究了在发酵紫薯醋的工艺流程中保存紫薯中活性物质的一种方法,提高了紫薯醋的营养价值,提升了紫薯的附加价值,对紫薯深加工产品具有一定理论指导意义。
1 试验材料
1.1 材料与试剂
渝紫7号,重庆市石柱县;紫薯酒,实验室自制;酿酒高活性干酵母,安琪酵母股份有限公司;巴氏醋杆菌巴氏亚种1.41,中国微生物菌种保藏管理中心。
3,5-二硝基水杨酸、石油醚、丙酮、碳酸钙、硫酸镁(分析纯),重庆川东化工有限公司;磷酸二氢钾(分析纯),成都市科龙化工试剂厂;DPPH(95%)、2,2-偶氮二(2-甲基丙基咪) 二盐酸盐[2,2′-Azobis(2-methylpropionamidine)dihydrochloride,AAPH]、荧光素钠(分析纯),阿拉丁试剂有限公司;抗坏血酸、β-胡萝卜素、没食子酸、芦丁(标准品)、福林酚试剂(分析纯),SOLARBIO生物科技有限公司。
1.2 仪器与设备
HWS-26 电热恒温水浴锅,上海齐欣科学仪器有限公司;HDL-4 离心机,金坛市鸿科仪器厂;(T)YAIBO 15/8 高压灭菌锅,上海宜川上岭仪表有限公司;QP2010气相色谱-质谱联用仪,日本岛津公司;UNICO 7200 分光光度计,上海巴玖实业有限公司;R502B 旋转蒸发仪,西安太康生物科技有限公司;UltraScan PRO 全自动色差仪,美国Hunter Lab公司;SYHERGY H1 多功能酶标仪,5BioTek有限公司;SHB-Ⅲ 循环水式多用真空泵,郑州长城科工贸有限公司。
1.3 试验方法
1.3.1 紫薯醋酿造工艺流程
1.3.1.1 紫薯醋酿造工艺流程
紫薯醋酿造工艺流程如下:

1.3.1.2 紫薯色素回添醋酿造工艺流程
紫薯色素回添醋酿造工艺流程如下

1.3.1.3 操作要点
(1)紫薯粉:鲜紫薯洗净,切成3 mm薄片,真空冷冻干燥24 h,粉碎后过80目筛得紫薯粉,装袋放于干燥器避光保存。
(2)微波辅助提取紫薯色素[7-8]:以10 g/L的柠檬酸溶液为提取剂,紫薯粉做原料,在微波功率为560 W,液料比为22.8 mL/g时作用4.6 min,反复3次,离心(3 500 r/min,10 min)后保留上清液。
(3)糖化液化:紫薯渣为原料,按0.5 mg/kg添加α-淀粉酶,45 ℃作用4 h。
(4)酒精发酵:酶解后的原料接种活化后的酵母菌,25 ℃下发酵。
(5)醋酸发酵:调整酒精发酵液的初始酒度为7.35%vol、装液量为28%、温度为30 ℃、发酵时间11 d。
1.3.2 基础指标测定
总糖采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)比色法;总酸采用GB/T 12456—2008中pH电位法;β-胡萝卜素采用比色法[9];VC采用GB 5009.86—2016 2,6-二氯靛酚滴定法;总酯采用GB/T 19777—2013地理标志产品 山西老陈醋中的连续电位滴定法;总酚测定采用Folin-Ciocalteu比色法[10];总黄酮采用SN/T 4592—2016 出口食品中总黄酮的测定。
1.3.3 色泽的测定
色差计法[11-12]。根据CIELAB色彩空间,测定紫薯醋的亮度值L*、红绿值a*和黄蓝值b*,同一样品取6个不同位置测定,取平均值,并按照公式(1)、公式(2)计算其彩度 C*和色调角H0。
(1)
(2)
1.3.4 花青素的测定
采用pH示差法[13]。总花青素含量按公式(3)和公式(4)计算。
总花青素含量![]()
(3)
A=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5
(4)
式(3)中:A为公式(4)计算所得;Mw为分子质量(449.2 g/mol),DF为稀释倍数,ε为矢车菊-3-葡萄糖苷的消光系数[26 900 L/(mol·cm)],l为光程(1.0 cm)。
1.3.5 抗氧化能力的测定
1.3.5.1 氧化自由基吸收能力
参照TEOW[14]的方法。AUC(area under curve)值和氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)值按公式(5)、公式(6)计算,结果以μmol/mL表示。
AUC=4×f0+f1+...fn-1+fn-f0-fn
(5)
(6)
式(5)中:AUC,荧光衰退面积;fn,第n个测定点的相对荧光强度。
1.3.5.2 DPPH自由基清除率
参照RUMBAOA[15]的方法。结果按公式(7)进行计算,以 μg/mL表示。
DPPH/(μg·mL-1)=x×DF
(7)
式(7)中:x,吸光度对应标准曲线上的质量浓度,μg/mL。
1.3.6 香气成分萃取与分析
1.3.6.1 同时蒸馏萃取法萃取紫薯醋挥发性成分
分别量取50 mL紫薯醋和50 mL二氯甲烷于2个500 mL圆底烧瓶,紫薯醋放置于样品端,油浴加热并保持溶液微沸。溶剂端于50 ℃水浴中回流2 h。回流结束后,加入3~5 g无水Na2SO4并放于-20 ℃冰箱过夜除水,取出快速过滤,然后旋蒸浓缩至5~6 mL,再氮吹至1 mL,置于-20 ℃条件下,以待GC-MS联机分析[16]。
1.3.6.2 气相色谱条件
色谱柱DB-5MS(30 m×0.25 mm,0.25 μm),进样口温度250 ℃;升温程序:45 ℃保持5 min,以3 ℃/min升至80 ℃,以7 ℃/min升至150 ℃,以6 ℃/min升至200 ℃,以1 ℃/min升至210 ℃,以7 ℃/min升至230 ℃;载气流量1.0 mL/min;不分流进样[17-18]。
1.3.6.3 质谱条件
电离方式:电子电离EI源;电子能源70 eV;灯丝发热电流0.25 mA;电子倍增器1 000 V;离子源温度250 ℃;接口温度250 ℃;质量扫描范围(m/z)40~450[17]。
1.3.6.4 挥发性成分的定性与定量分析
GC-MS检测所得化合物质谱图经质谱库(NIST05.LIB/NIST05 s.LIB)检索,结合检索结果相似性高低及保留指数法进行定性,采用2-辛醇为内标物,按照面积归一化法确定各香气组分的相对含量。
1.3.7 数据处理与分析
采用SPSS进行数据分析,Origin作图。
2 结果与分析
2.1 发酵时间对醋酸发酵的影响
由图1可知,在0~11 d的发酵期内,前7 d紫薯醋的总酸含量增加量较缓慢,7 d后增速显著加快,在第11天总酸含量达到5.68 g/100 mL,11 d后,总酸含量变化幅度小,考虑到时间成本,选取发酵时间为11 d。
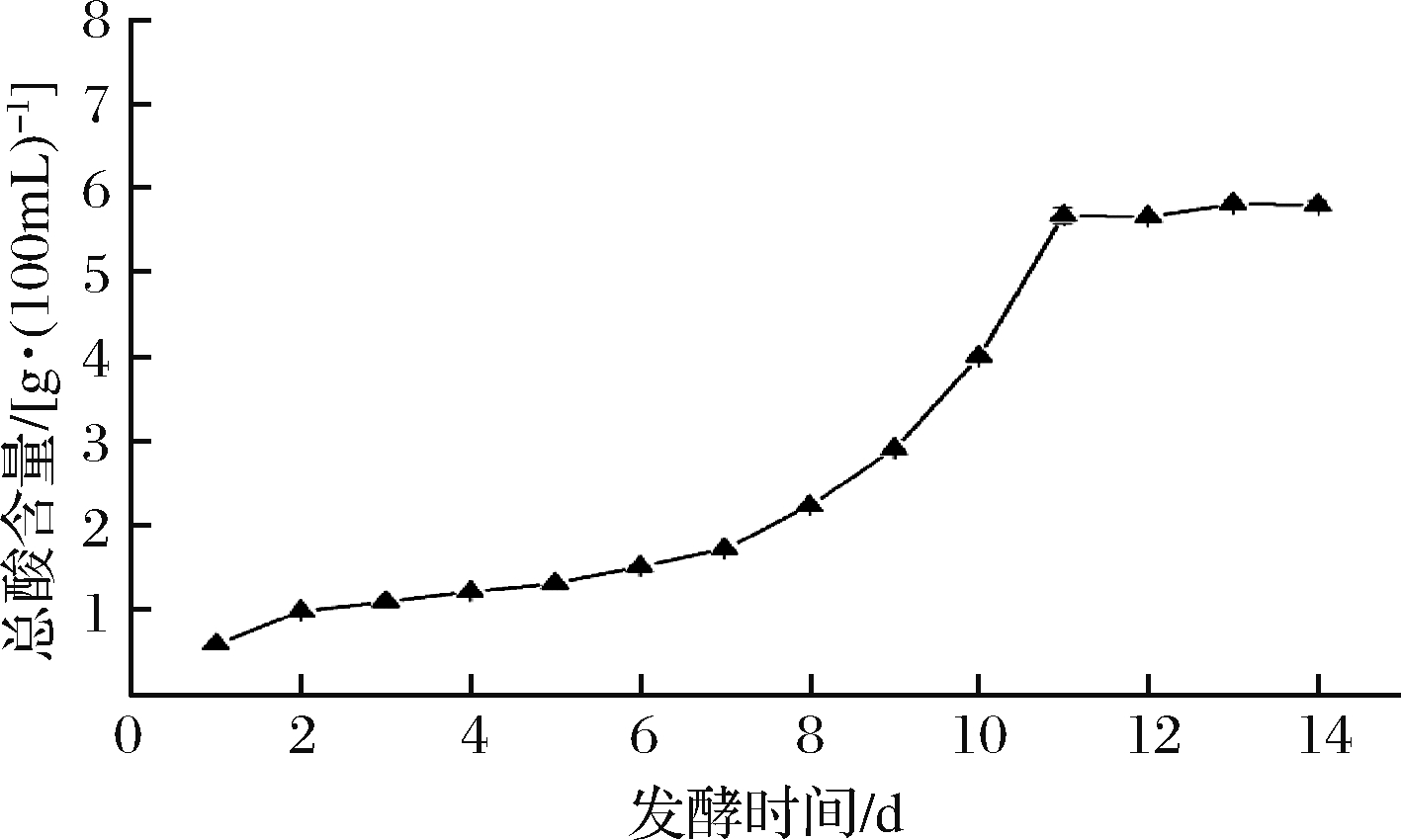
图1 发酵时间对紫薯醋总酸含量的影响
Fig.1 Effect of fermentation time on total acid of sweet potato vinegar
2.2 初始酒度对醋酸发酵的影响
由图2可知,可以观察到酒精度为7%vol时的初产酸量要显著高于9%vol和11%vol的初始产酸量,但4 d以后该趋势消失,但整体趋势都是随着发酵时间的延长,醋酸含量也缓慢增加。这可能是酒精度9%vol和11%vol,会对醋酸菌的生长有一定抑制作用,但同时醋酸菌也能利用一部分底物进行产酸,但产酸量低于酒精度7%vol。4 d以后,底物对醋酸菌的抑制作用减弱,酒精度为9%vol中的醋酸菌开始大量繁殖产酸,而11%vol组仍对醋酸菌有抑制作用。从总酸含量来看,初始酒度为9%vol的发酵效果较好,但考虑到发酵底物的节约,选择7%vol为最佳初始酒度。
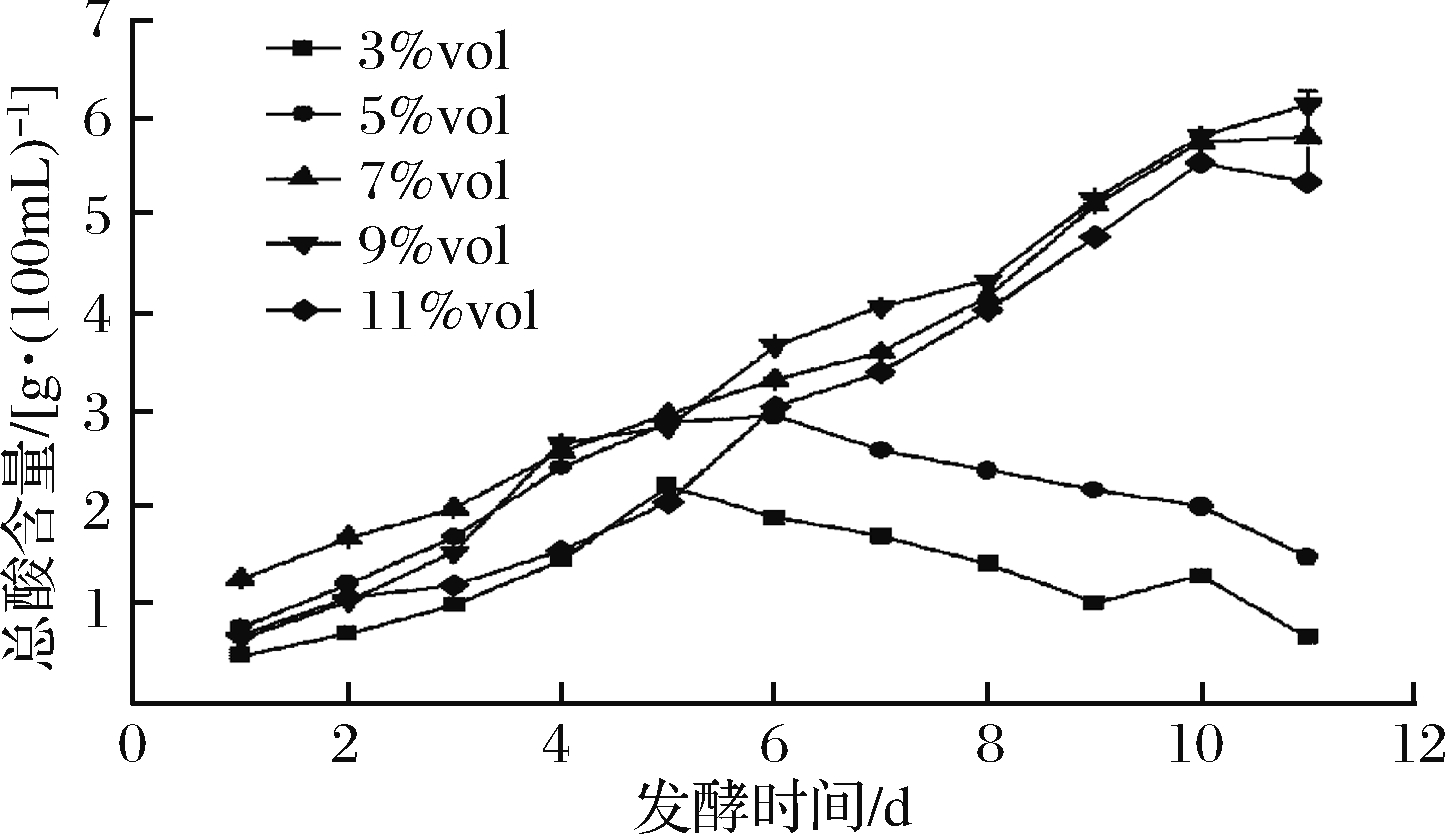
图2 酒精度对紫薯醋总酸含量的影响
Fig.2 Effect of initial alcohol content on total acid of sweet potato vinegar
2.3 装液量对醋酸发酵的影响
装液量对紫薯醋总酸含量影响如图3所示。除了装液量20%外,其他组在0~6 d,产酸量差别不大,6 d之后,装液量越少,产酸量增加比例越大,产酸越多,其中装液量为25%时,总酸含量最大可达6.48 g/100mL。而装液量过低(20%),虽然前期产酸量快,但发酵中期后,随着溶氧度以及发酵底物的损失,生成的醋酸进一步氧化为二氧化碳和水,造成醋酸含量最低。综合考虑,选取25%作为最佳装液量。
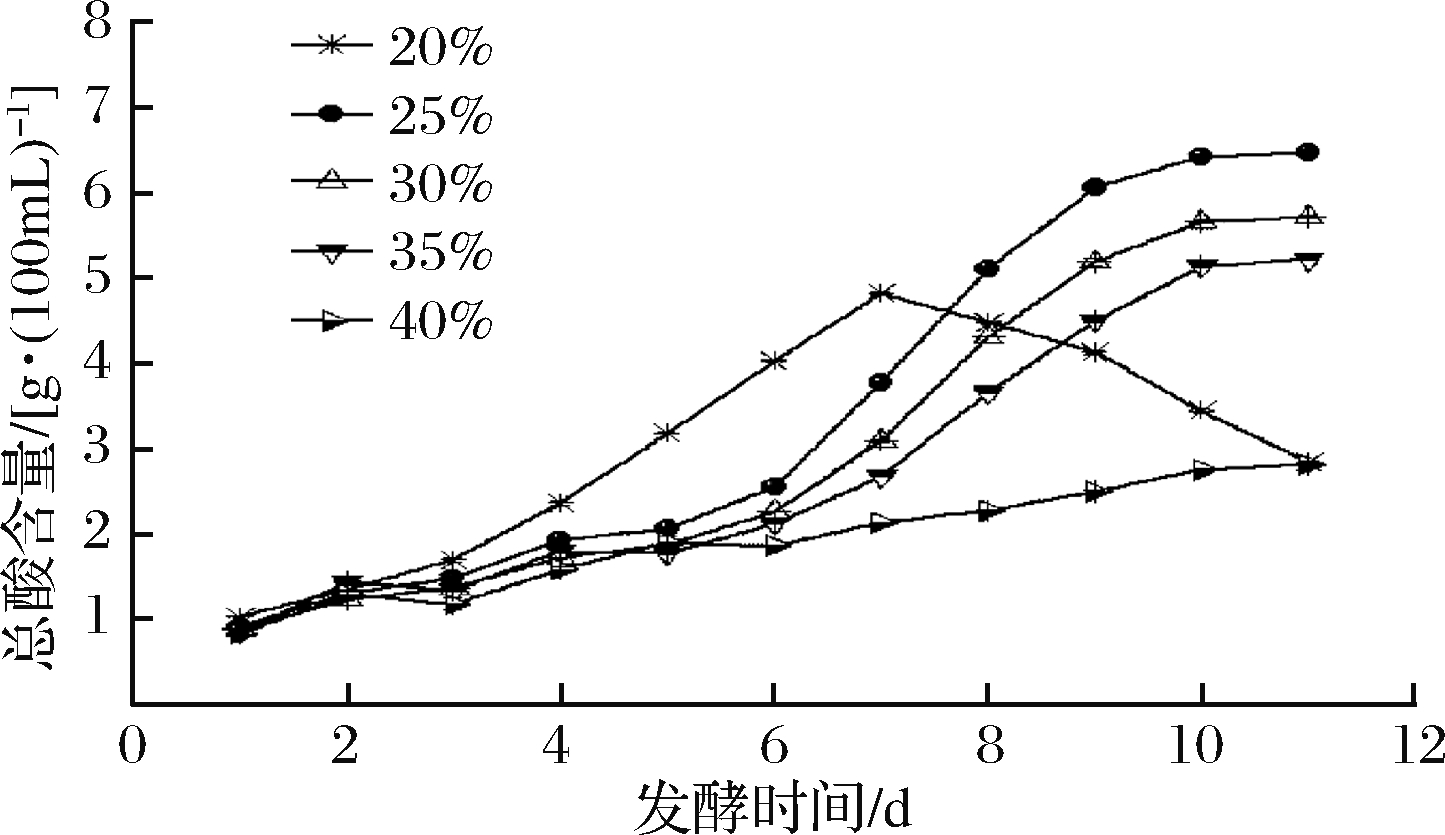
图3 装液量对紫薯醋总酸含量的影响
Fig.3 Effect of the liquid volume on total acid of sweet potato vinegar
2.4 响应面设计
基于单因素试验,采用Box-Benhnken 试验原理,将总酸度作为响应值,设计发酵时间(A)、初始酒度(B)、装液量(C)3因素3水平的中心组合试验,并通过试验得到响应面结果,响应面设计及结果见表2。
表2 响应面设计与结果
Table 2 Experimental design and result of response surface design
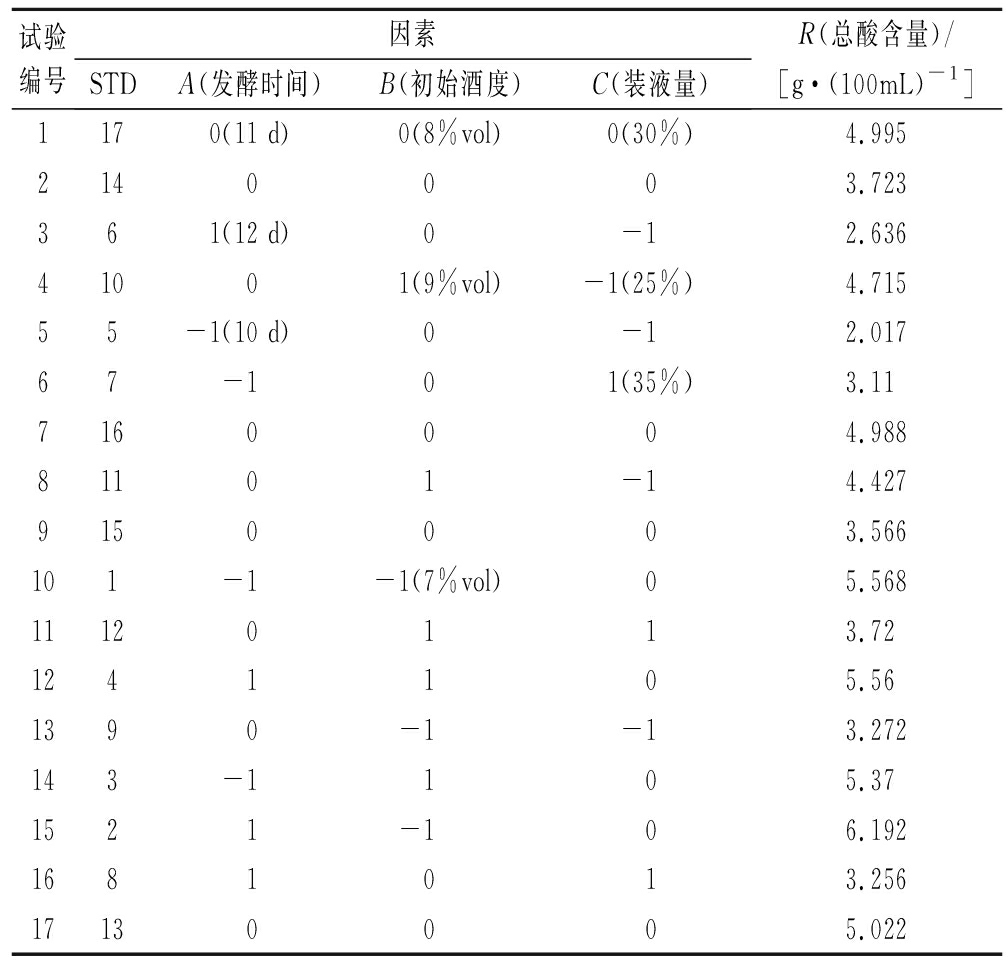
试验编号因素STDA(发酵时间)B(初始酒度)C(装液量)R(总酸含量)/[g·(100mL)-1 ]1170(11 d)0(8%vol)0(30%)4.9952140003.723361(12 d)0-12.63641001(9%vol)-1(25%)4.71555-1(10 d)0-12.01767-101(35%)3.117160004.98881101-14.4279150003.566101-1-1(7%vol)05.56811120113.721241105.561390-1-13.272143-1105.371521-106.1921681013.25617130005.022
2.4.1 回归模型的建立及显著性分析
总酸是醋品品质评价的重要指标,因此,本试验将总酸含量作为响应值,对发酵时间(A)、初始酒度(B)与装液量(C)3个因素进行响应面分析,优化紫薯醋酸发酵工艺。按表2进行回归分析,总酸含量(R)的回归方程如下:
R=-9.748 52+2.598 92A-18.025 30B+5.286 13C-0.108 50AB-0.023 650AC-0.107 50BC-0.032 525A2+1.246 23 B2-0.066 861C2。
根据方差分析结果(表3),模型P值为0.019 0,表明模型项显著;失拟项P值0.783 1不显著,表明在试验参数范围内,模型合理,可用来推测与分析紫薯醋酸发酵试验结果。方程决定系数R2(Adj)=0.872 9,变异系数<15%,表明响应值总酸含量的实际值与预测值之间具有良好一致性,模型可靠。
表3 回归方程方差分析表
Table 3 Analysis of variance for the regression equation
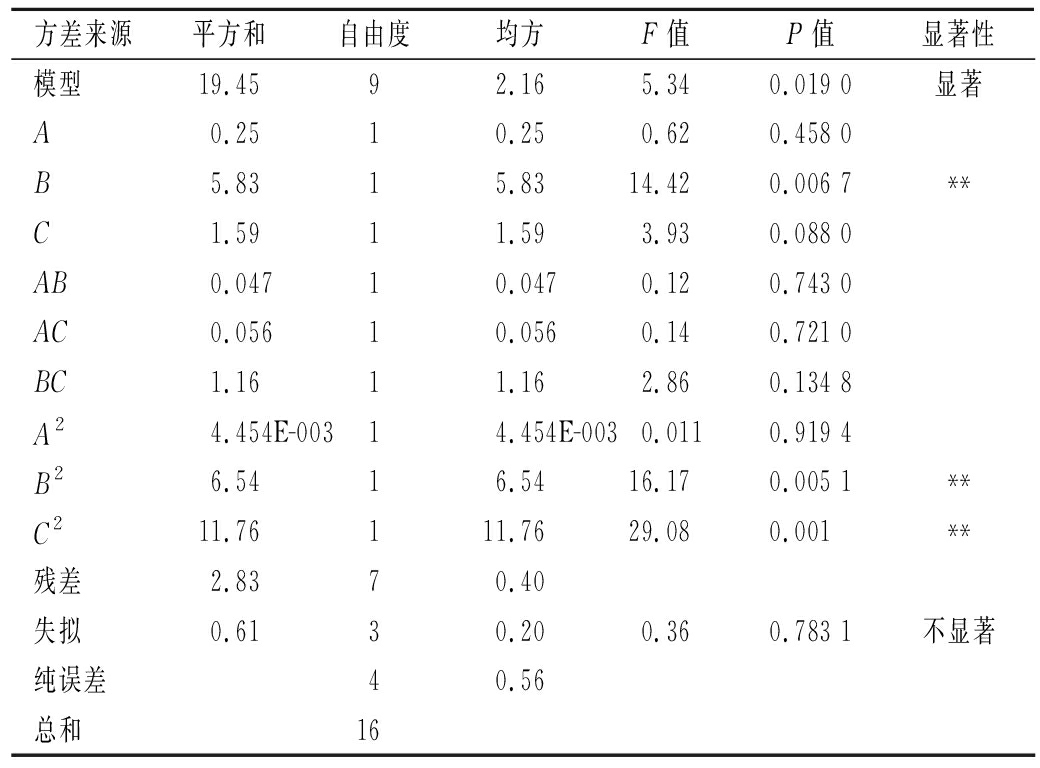
方差来源平方和自由度均方F值P值显著性模型19.4592.165.340.019 0显著A0.2510.250.620.458 0B5.8315.8314.420.006 7**C1.5911.593.930.088 0AB0.04710.0470.120.743 0AC0.05610.0560.140.721 0BC1.1611.162.860.134 8A24.454E-00314.454E-0030.0110.919 4B26.5416.5416.170.005 1**C211.76111.7629.080.001**残差2.8370.40失拟0.6130.200.360.783 1不显著纯误差40.56总和16
注:P<0.05(显著,*);P<0.01(极显著,**)
前文分析过,F值的因素其对响应值影响越显著。因此,3个因素对总酸含量的影响顺序为B(初始酒度)>C(装液量)>A(发酵时间),其中一次项B、平方项B2、C2对响应值影响极显著(P<0.01),其他因素组合对总酸含量无显著影响(P>0.05)。
2.4.2 验证试验
经响应面法优化,得紫薯醋酸发酵最优条件为发酵时间11.23 d,初始酒度7.35%vol,装液量27.66%vol,总酸含量7.064 g/100g。为更好操作,调整工艺条件为发酵时间11 d,初始酒度7.35%,装液量28%。经过3次重复性试验,总酸含量为6.92 g/100mL,与模型预测值相差较小,误差为±0.43%。该模型能够较好预测醋酸发酵条件与总酸含量的关系,模型可用。
2.5 指标测定结果分析
2.5.1 指标测定结果
指标测定结果见表4,除了总糖含量无显著差异外,2种紫薯醋的其他指标均差异显著(P<0.05)。紫薯色素回添醋的总酸、总酯、总多酚、总黄酮、花青素含量和抗氧化能力均强于紫薯醋。同时,提取色素后损失较多的营养成分为维生素。此外,紫薯醋的亮度值L*、红绿值a*和黄蓝值b*均大于紫薯色素回添醋且存在显著性差异(P<0.05),亮度值越大,醋品的颜色反而越浅,紫薯色素回添醋的颜色要深于紫薯醋。这是因为提取后的紫薯花青素回添到紫薯醋中后,其在酸性条件下稳定且呈深紫色[19]。
表4 两种紫薯醋品质指标
Table 4 Quality indicators of different purple sweet potato vinegar
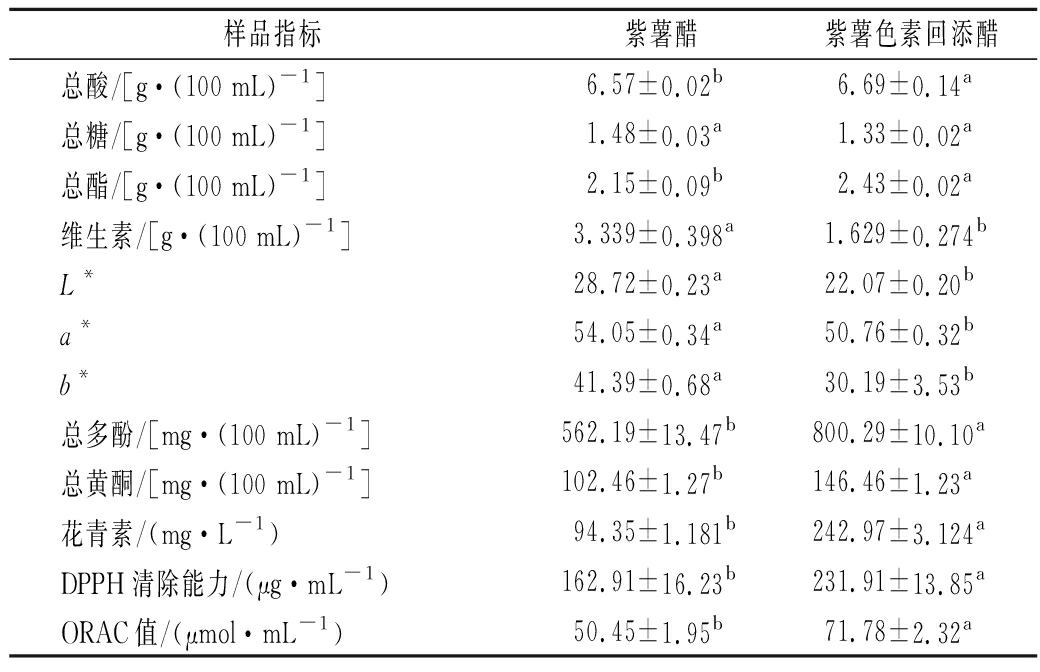
样品指标紫薯醋紫薯色素回添醋总酸/[g·(100 mL)-1 ]6.57±0.02b6.69±0.14a总糖/[g·(100 mL)-1 ]1.48±0.03a1.33±0.02a总酯/[g·(100 mL)-1 ]2.15±0.09b2.43±0.02a维生素/[g·(100 mL)-1 ]3.339±0.398a1.629±0.274bL*28.72±0.23a22.07±0.20ba*54.05±0.34a50.76±0.32bb*41.39±0.68a30.19±3.53b总多酚/[mg·(100 mL)-1 ]562.19±13.47b800.29±10.10a总黄酮/[mg·(100 mL)-1 ]102.46±1.27b146.46±1.23a花青素/(mg·L-1)94.35±1.181b242.97±3.124aDPPH清除能力/(μg·mL-1)162.91±16.23b231.91±13.85aORAC值/(μmol·mL-1)50.45±1.95b71.78±2.32a
注:字母不同表明组间差异显著(P<0.05),字母相同表明组间无显著差异(P>0.05)(下同)
2.5.2 活性成分损失对比
紫薯原料和2种紫薯醋中发酵前后活性成分含量及损失率见表5。由表5可知,未经发酵的紫薯原料中活性成分含量最高,其总多酚、总黄酮和花青素含量分别为2 303.06、281.74和346.22 mg/L,紫薯色素回添醋次之,紫薯醋最低且三者间具有显著性差异(P<0.05)。发酵使紫薯原料中的活性成分损失较大,对于直接发酵的紫薯醋来说,总多酚、总黄酮、花青素含量较原料分别损失75.59%、63.63%和72.75%,均超过50%,而采用先发酵再回添的发酵方式制得的紫薯色素回添醋较紫薯醋的总多酚、总黄酮、花青素损失率分别降低10.34%、15.61%和42.93%,其中,该发酵方式对花青素的保存尤其显著,这说明提取色素后再回添的方式有利于紫薯中活性成分的保存。
表5 紫薯原料与2种紫薯醋活性成分损失对比
Table 5 Active ingredient loss comparison of purple sweet potato and two kind of its vinegar
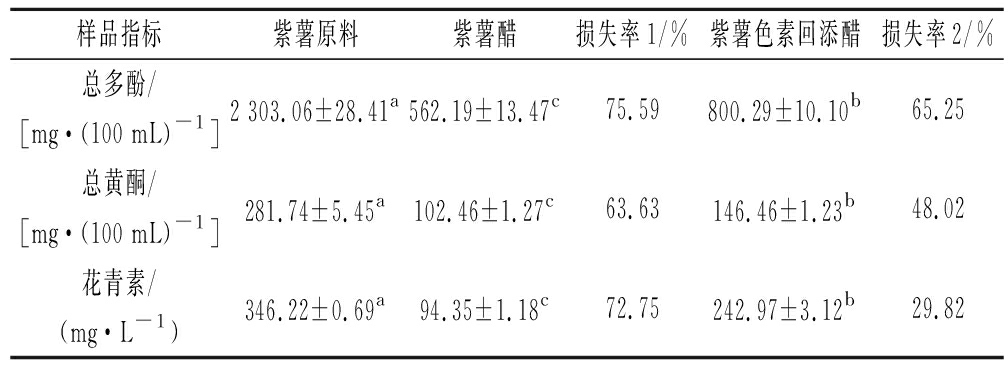
样品指标紫薯原料紫薯醋损失率1/%紫薯色素回添醋损失率2/%总多酚/[mg·(100 mL)-1 ]2 303.06±28.41a562.19±13.47c75.59800.29±10.10b65.25总黄酮/[mg·(100 mL)-1 ]281.74±5.45a102.46±1.27c63.63146.46±1.23b48.02花青素/(mg·L-1)346.22±0.69a94.35±1.18c72.75242.97±3.12b29.82
2.6 香气成分分析
采用GC-MS技术对2种紫薯醋浓缩物进行测定和分析,峰表对照数据库进行检索和解析,结合文献,分别鉴定出各浓缩液的挥发性香气成分及香气描述,2种紫薯醋共鉴定出114种挥发性香气成分,包含酸类18种,酯类37种,醇类18种,酚类3种,醛酮类17种,烷烃类14种,其他物质7种。但2种紫薯醋所鉴定出的挥发性香气成分的种类和含量具有较大差异,见图4。2种紫薯醋所鉴定出的相同组分一共有41种,包含有8种酸类,12种酯类,6种醇类和醛酮类,7种烷烃类,其他化合物2种。此外,紫薯醋和紫薯色素回添醋中分别鉴定出76种和82种挥发性香气成分,虽然2种紫薯醋鉴定出的化合物数量相差较小,但化合物种类有较大差异,紫薯醋中醛酮类和酚类物质较多,而紫薯色素回添醋中含有较多醇类和烷烃类物质。研究表明,紫薯醋中所含的主要香气成分有乙酸、乙酸乙酯、乳酸乙酯、苯甲醛、大马士酮等[17, 20]。
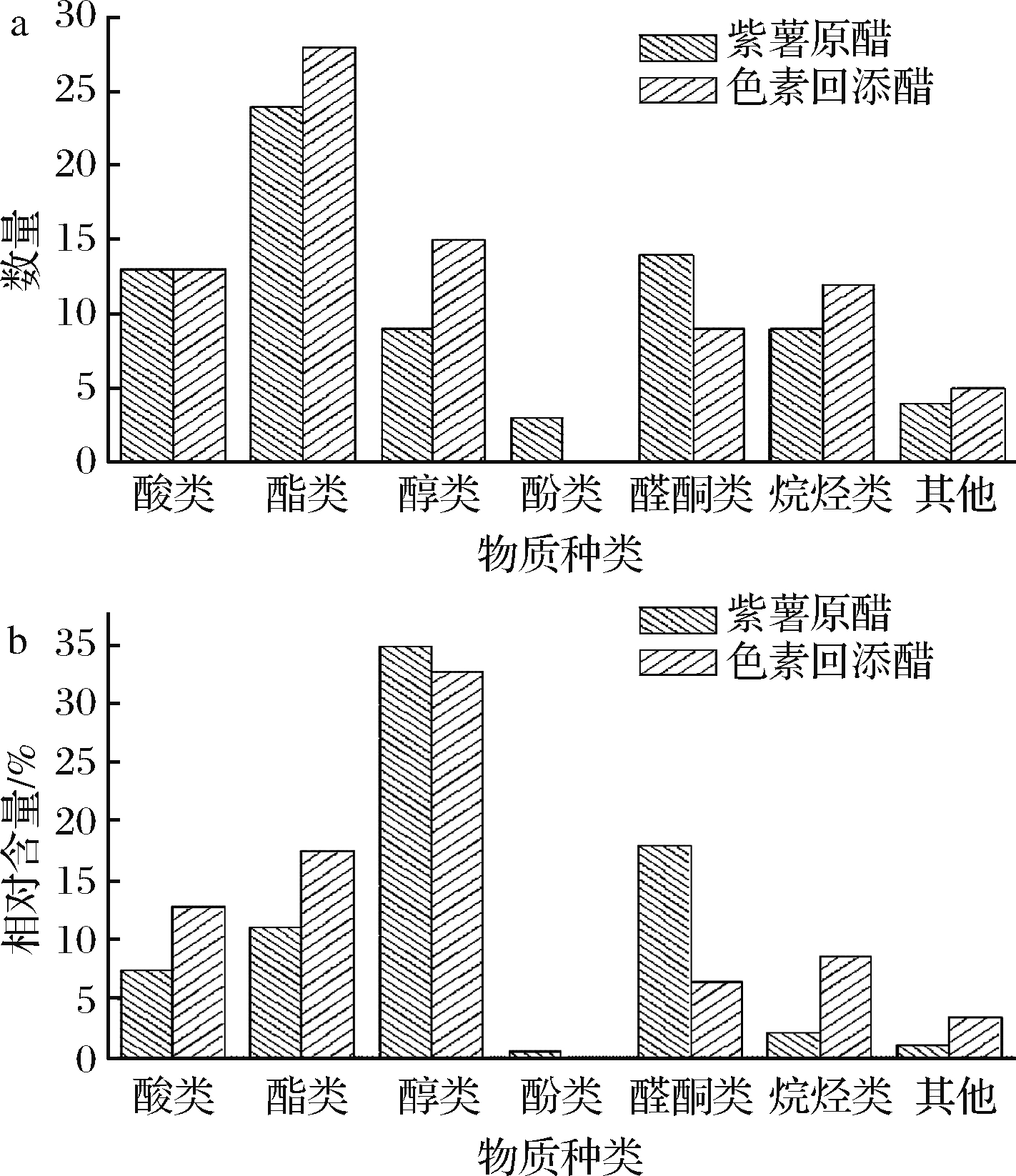
a-物质数量;b-相对含量
图4 两种紫薯醋萃取得到的物质数量和相对含量
Fig.4 The number and relative content of components extracted by two purple sweet potato vinegar
酸类物质大多由酯类降解生成,其中本文中含量较高的乙酸是醋酸发酵的结果,而2种紫薯醋中共有的酸类物质均有刺激性味道。但由于酸类物质香气阈值较高[21],因此不是主要的风味物质,而主要起调节作用。
许多酯类呈现鲜明的果香、花香,其产生途径包括酵母的酶促反应和有机酸与醇的酯化反应[22]。醋酸发酵原料紫薯酒中乙醇含量较高,同时在酵母菌、醋酸菌以及其他微生物的作用下,生成更多酸类、醇类物质,而这2种物质在发酵和陈酿期间发生酯化反应从而生成酯类物质,在2种紫薯醋中,分别有24种和28种酯类,其中共有的乙酯类化合物有8种,它们可能是乙醇与紫薯酒在发酵过程中生成的酸类物质反应的结果。
多数醇类具有花草香或者果香,本次2种紫薯醋检测出的主体醇类物质有苯乙醇(22.47%和13.53%)、正癸醇(1.7%和10.30%)、1-十一醇(0%和1.46%)。苯乙醇呈现愉快的玫瑰香,正癸醇具有甜花香,1-十一醇具有柠檬香气[23]。虽然醇类物质的风味阈值一般较高,但在赋予醋品醇香以及脂肪酸酯化方面可以起到积极作用[24]。但由于萃取方法为同时蒸馏萃取法,因对样品进行加热处理,大分子化合物可经Stretcher降解继续生成较小分子量的醛,进而还原为醇[25]。本次研究中所检测出的苯乙醇,很大可能就是经过该途径生成。
至于物质数量相对较少的烷烃类和其他类,两者相对含量仅占化合物总量的3.27%和12.01%,其中烷烃类对醋品风味基本没有贡献。此外,紫薯醋中还特有3种酚类物质,分别为愈创木酚(0.37%)、对乙烯基愈创木酚(0.17%)、丁香酚(0.02%),呈现出特殊芳香、强烈香辛料和发酵似香气以及浓郁石竹麝香[26],虽相对含量较低,但由于其香气阈值较低,对醋品香气贡献较大。
3 结论
采用响应面法优化醋酸发酵条件,并对这2种醋品进行指标测定及比较研究。优化后的紫薯醋酸发酵条件为发酵时间11 d、初始酒度7.35%vol、装液量28%,此条件下,总酸含量为6.92 g/100g。2种发酵方式同时在其最优条件下进行发酵。与紫薯醋相比,紫薯色素回添醋除总糖和维生素含量较低外,其总酸、总酯、总多酚、总黄酮、花青素含量和抗氧化能力均强于紫薯醋且具有显著性差异(P<0.05)。采用紫薯醋新发酵工艺可使总多酚、总黄酮、花青素的损失率较传统发酵工艺分别降低10.34%、15.61%和42.93%。挥发性成分分析显示2种紫薯醋中鉴定出的挥发性成分的化合物数量相差较小,种类却有较大差异。同时,紫薯花青素的提取过程会导致一些对醋品香气有贡献的化合物的损失。
[1] TANG Y, CAI W, XU B.Profiles of phenolics, carotenoids and antioxidative capacities of thermal processed white, yellow, orange and purple sweet potatoes grown in Guilin, China[J].Food Science and Human Wellness, 2015, 4(3):123-132.
[2] 胡凯弟, 赵爽, 彭杨.等.液态发酵麸醋工艺优化及其风味品质研究[J].食品与生物技术学报, 2017, 36(8):869-876.
HU K D, ZHAO S, PENG Y, et al.Optimizing production of liquid-state fermented bran vinegar and study on its quality of flavor[J].Journal of Food Science and Biotechnology, 2017, 36(8):869-876.
[3] 陆英. 紫锥菊、紫甘薯中活性成分高效制备技术及紫锥菊生物活性研究[D].长沙:湖南农业大学.2012.
LU Y.Studies on the efficient preparation of the active compounds from Echinacea purpurea (L.) Moench、purple sweet potato and biological activities of Echinacea purpurea[D].Changsha:Hunan Agricultural University, 2012.
[4] 罗霞, 魏巍, 余梦瑶.等.不同品种甘薯藤蔓部分活性成分含量的比较[J].食品科学, 2013, 34(10):238-240.
LUO X, WEI W, YU M Y, et al.Comparative analysis of chemical composition of sweet potato vines from different cultivars[J].Food Science, 2013, 34(10):238-240.
[5] 韩永斌. 紫甘薯花色苷提取工艺与组分分析及其稳定性和抗氧化性研究[D].南京:南京农业大学.2007.
HAN Y B.Extraction, compositoion analysis,stability and antioxidant activity of anthocya nins from purple sweet potato[D].Nanjing:Nanjing Agricultural University, 2007.
[6] 章萍萍. 紫薯花青素的提取、纯化及其抗氧化和益生元活性研究[D].合肥:合肥工业大学.2017.
ZHANG P P.Study on extraction, purification and activity of antioxidant and prebiotics of purple sweet potato anthocyanins[D].Hefei:Hefei University of Technology, 2017.
[7] 李颖畅. 蓝莓花色苷提取纯化及生理功能研究[D].沈阳:沈阳农业大学.2008.
LI Y C.Study on extraction,purification and functional characteristic of blueberry anthocyanins[D].Shenyang:Shenyang Agricultural University, 2008.
[8] 倪勤学, 高前欣, 霍艳荣.等.微波辅助提取紫马铃薯花色苷及其稳定性的研究[J].食品科技, 2011, 36(4):170-175.
NI Q X, GAO Q X, HUO Y R, et al.Microwave-assisted extraction and stability of anthocyanins from purple potato[J].Food Science and Technology, 2011, 36(4):170-175.
[9] 李坚, 滕葳, 柳琪.等.甘薯中胡萝卜素含量测定方法的探讨[J].莱阳农学院学报, 1991(2):154-157.
LI J, TENG W, LIU Q, et al.Determination of carotene in sweet potato[J].Journal of Layang Agricultural College, 1991(2):154-157.
[10] 向进乐, 李志西, 甘峰.等.枳椇果梗不同类型酚酸含量及抗氧化活性[J].食品与发酵工业, 2011, 37(8):106-111.
XIANG J L, LI Z X,CAN F,et al.Determination of four different phenolic acids of Hovenia acerba fruit and their antioxidant activities[J].Food and Fermentation Industries, 2011, 37(8):106-111.
[11] GONNET J F.Colour effects of co-pigmentation of anthocyanin revisited-3.A further description using CIELAB differences and assessment of matched colours using the CMC model[J].Food Chemistry, 2001, 75(4):473-485.
[12] 陈善敏, 黄平, 王振帅.等.基于主成分分析法的不同甘薯醋品质评价[J].食品与发酵工业, 2019, 45(17):240-246.
CHEN S M, HUANG M, WANG Z S, et al.Quality evaluation of different sweet potato vinegars based on principal component analysis[J].Food and Fermentation Industries, 2019, 45(17):240-246.
[13] DAI J, GUPTE A, GATES L.et al.A comprehensive study of anthocyanin-containing extracts from selected blackberry cultivars:Extraction methods, stability, anticancer properties and mechanisms[J].Food and Chemical Toxicology, 2009, 47(4):837-847.
[14] TEOW C C, TRUONG V D, MCFEETERS R F,et al.Antioxidant activities, phenolic and beta-carotene contents of sweet potato genotypes with varying flesh colours[J].Food Chemistry, 2007, 103(3):829-838.
[15] RUMBAOA R G O, CORNAGO D F, GERONIMO I M.Phenolic content and antioxidant capacity of Philippine sweet potato (Ipomoea batatas) varieties[J].Food Chemistry, 2009, 113(4):1 133-1 138.
[16] 王巧碧, 王丹, 赵欠.等.SDE和SPME法对鲊海椒发酵中香气组成的比较分析[J].食品科学, 2016, 37(4):108-114.
WANG Q B, WANG D, ZHAO Q, et al.Comparative analysis of aroma composition of Zhahaijiao, a traditional Chinese fermented chili product,during fermentation by SDE and SPME extraction[J].Food Science, 2016, 37(4):108-114.
[17] 乔羽, 王如福, 于迪.等.HS-SPME和GC-MS联用法对甘薯醋挥发性香气成分的分析[J].中国酿造, 2017, 36(7):178-181.
QIAO Y, WANG R F, YU D, et al.Analysis of volatile aroma components in sweet potato vinegar by HS-SPME and GC-MS[J].China Brewing, 2017, 36(7):178-181.
[18] 叶林林, 杨娟, 陈通.等.红提和糯米复合发酵葡萄酒工艺优化及香气成分分析[J].食品科学, 2019, 40(18):182-188.
YE L L, YANG J, CHEN T, et al.Wine made from a blend of red globe and glutinous rice:Optimization of fermentation process and analysis of aroma components[J].Food Science, 2019, 40(18):182-188.
[19] 石双妮, 孟岳成, 陈杰.紫薯花色苷分离纯化及主要成分的研究[J].食品科技, 2015, 40(2):254-258.
SHI S N, MENG Y C, CHEN J.Purification and structual determination of the anthocuanins in purple sweet potato[J].Food Science and Technology, 2015, 40(2):254-258.
[20] 刘明宇, 陈李敏, 王思丹.等.紫薯苦荞复合醋饮料的研制及其风味物质分析[J].食品与机械, 2016, 32(11):178-182.
LIU M Y, CHEN L M, WANG S D, et al.Development and flavor substances analysisi of purple sweet potota and bitter buckwheat combined vinegar beverage[J].Food and Machinery, 2016, 32(11):178-182.
[21] 穆晓静, 方冠宇, 蒋予箭.基于多元统计方法分析陈酿条件对浙江玫瑰醋香气成分的影响[J].食品科学, 2020, 41(14):262-270.
MU X J, FANG G Y, JIANG Y J.Effect of aging conditions on volatile flavor compounds of Zhejiang rosy vinegar evaluated by multivariate statistical analysis[J].Food Science, 2020, 41(14):262-270.
[22] 冉春霞, 阚建全.顶空固相微萃取-气质联用技术分析全豆腐乳中的挥发性成分[J].中国调味品, 2014, 39(12):105-109.
RAN C X, KAN J Q.Analysis of volatile components in whole-soybean sufu by HS-SPME-GC-MS[J].China Condiment, 2014, 39(12):105-109.
[23] 刘巍, 刘娜, 吕丽.固相微萃和同时蒸馏萃取分析酱油挥发性组分的比较[J].中国调味品, 2015, 40(12):114-117;122.
LIU W, LIU N, LYU L, et al.A comparison of solid-phase microxtration with simultaneous disitillation-extraction for the analysis of volatile compounds in soy sauce[J].China Condiment, 2015, 40(12):114-117;122.
[24] 祝霞, 刘琦, 赵丹丹.等.酿造条件对酿酒酵母发酵香气的影响[J].食品科学, 2019, 40(16):115-123.
ZHU X, LIU Q, ZHAO D D, et al.Effect of different winemaking conditions on fermentation aroma production by Saccharomyces cerevisiae[J].Food Science, 2019, 40(16):115-123.
[25] FERNADEZ-GARCIA E, CARBONELL M, GAYA P,et al.Evolution of the volatile components of ewes raw milk Zamorano cheese.Seasonal variation[J].Int Dairy J, 2004, 14(8):701-711.
[26] 杨玉波, 倪德让, 林琳.等.高粱蒸煮风味物质香气活力研究[J].食品与发酵工业, 2018, 44(5):222-226.
YANG Y B, NI D R, LIN L, et al.Odor activity study on the aroma compounds of steamed sorghum[J].Food and Fermentation Industries, 2018, 44(5):222-226.