果胶是联合国粮食及农业组织、世界卫生组织联合专家委员会公认的安全无毒的天然、无每日摄入量限制的食品添加剂[1]。它是一种普遍存在于高等植物的初生细胞壁和细胞中间片层的酸性杂多糖物质,其结构由α-1,4-糖苷键连接D-半乳糖醛酸残基组成的长链聚合物,多聚半乳糖醛酸链构成果胶的主链骨架,主链上连接的侧链由大量的中性糖(20余种)组成[2]。由于未改性果胶分子质量大,在肠道内难以消化,导致其生物学功能等在多方面的应用受到限制,而改性后的果胶分子质量较小,可以被小肠吸收而进入到血液中[3]。研究表明,改性果胶具有促进双歧杆菌增长[4-5],抑制食源性病菌繁殖[6],预防心功能障碍[7],抗癌[8-10]等多种功能,在天然食品防腐添加剂及功能食品的开发等领域具有广阔的应用前景。
近年来,大量研究者越来越重视果胶的构效关系,研究果胶降解方法及其降解产物的生物学活性成为了热点。目前,降解果胶的方法主要有化学改性法(酸碱法脱酯)、生物改性法(酶法脱酯)及物理改性法(高温、高压等处理),其中酶法改性果胶的产物分子质量较高,反应底物有专一性[11]。超声波和微波是近年来兴起的绿色环保的聚合物降解方法[12-15],但在国内关于超声波和微波辅助果胶酶降解果胶应用方面的报道还较少。因此,本研究将超声波和微波应用于果胶降解的酶解底物和酶解产物中,探究超声波时间、功率和微波时间、温度、功率对果胶酶促降解效果的影响,并运用现代分析技术,从果胶降解产物的分子质量及其分布、单糖组成测定、红外光谱和扫描电镜分析,探究不同降解方法对果胶分子结构产生的影响。
1 材料与方法
1.1 材料与试剂
柑橘果胶(≥99%)、果胶酶(40 U/mg),索莱宝生物科技有限公司;单糖标准品(≥98%),上海源叶生物科技有限公司;聚乙二醇(polyetyhlene glycol,PEG)标样组(≥99%),日本Tosoh(TSK 东曹)公司;1-苯基-3-甲基-5-吡唑酮(1-phenyl-3-methyl-5-pyraz-olone,PMP),上海阿拉丁生化科技股份有限公司;乙腈、甲醇(色谱级),成都市科龙化工试剂厂;KBr(色谱级),成都科隆化学品有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JY98-ⅢDN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;MAS-Ⅱ微波快速制样系统,新仪微波化学科技有限公司;HWS26电热恒温水浴锅,上海一恒科学仪器有限公司;UV—6100紫外分光光度计,上海元析仪器有限公司;Ultimate 3000液相色谱仪,美国赛默飞公司;LC20液相色谱仪,日本岛津公司;E-201-CpH计,上海仪电科学仪器有限公司;TF-HFD-4真空冷冻干燥机,上海田枫实业有限公司;YP-2压片机,上海山岳科学仪器有限公司;Spectrun100傅里叶红外光谱,美国Perkin Elmer公司;AVANCE III核磁共振谱仪,瑞士Bruker公司;Phenom Pro扫描电镜,荷兰Phenom World公司。
1.3 方法
1.3.1 半乳糖醛酸标准曲线的制作
根据廖祥兵等[16]优化的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定还原糖含量的方法。准确称取半乳糖醛酸标准品10 mg,去离子水溶解,定容至10 mL,配成1 mg/mL的半乳糖醛酸标准溶液。取8支10 mL具塞刻度管,依次加入0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL半乳糖醛酸标准溶液,用蒸馏水将各管补足至1 mL,加入2.0 mL的3,5-二硝基水杨酸,置于沸水浴中反应5 min,流水冷却,加去离子水稀释至10 mL,摇匀,在波长为540 nm下记录吸光值。以吸光值为纵坐标,半乳糖醛酸质量浓度为横坐标,绘制标准曲线得到方程:y=1.657 5x-0.153 8,R2=0.998 83。
1.3.2 果胶酶降解果胶
1.3.2.1 柑橘果胶酶解
用pH为4.0的柠檬酸-磷酸氢二钠缓冲液,分别配制质量浓度为2 mg/mL的柑橘果胶酶溶液和质量浓度为1 mg/mL的柑橘果胶溶液,置于4 ℃冰箱保存,备用。准确吸取900 μL柑橘果胶溶液于10 mL比色管中,预热,加入100 μL不同浓度梯度(0.016、0.032、0.04、0.048、0.056、0.064、0.08 U/mL)的果胶酶溶液,于不同温度(30、35、40、45、50、60 ℃)下保温不同时间(10、30、50、60、70、80、90、100 min)。反应结束后,立即浸入100 ℃沸水中水浴3 min以灭活果胶酶。
1.3.2.2 超声波联合酶解
采用单因素实验设计的方法,研究超声波输出功率(10%、20%、25%、30%、35%、40%、50%,总功率1 200 W)和超声波作用时间(10、20、25、30、35、40、50 min)2个因素对超声处理酶解底物和酶解产物效果的影响。实验所用超声波细胞粉碎仪功率1 200 W、频率20 kHz,占空比为1∶1(脉冲时间2 s、间歇时间2 s),处理的果胶溶液体积为30 mL,处理过程中,超声波探针插入样品液面下约1 cm处,温度探针没入样品溶液,样品温度设置为40 ℃。
1.3.2.3 微波联合酶解
采用单因素实验设计的方法,研究微波处理时间(15、20、25、30、35、40、45 min)、微波处理温度(40、60、70、80、90、100 ℃)、微波处理功率(400、500、600、700、800、900 W)3个因素对微波处理酶解底物和酶解产物效果的影响。采用MAS-Ⅱ微波快速制样系统,取配好的柑橘果胶溶液100 mL,加酶后,移入三口烧瓶中,连接冷凝水,放入磁力搅拌子,设置磁力搅拌速度200 r/min。
1.3.3 不同降解方法对果胶样品分子质量及其分布的影响
采用凝胶渗透色谱测定果胶的分子质量及其分布[17],果胶的分子质量以其重均分子质量(MW)表示,其多分散性系数为果胶的重均分子质量与数均分子质量的比值(=MW/MN)。
检测条件:色谱仪Shimadzu LC20,色谱柱为TSKgel GMPWXL水相凝胶色谱柱,柱温35 ℃,进样体积20 μL,流动相为0.1 mol/L NaNO3+0.06% NaN3水溶液,流速0.6 mL/min。
标准曲线的绘制:称取窄分布聚乙二醇标样组溶于超纯水,根据不同分子质量标品(2.0、146.0、903.0 kDa)在色谱图上保留时间与其对应的分子质量的对数做出标准曲线。样品的检测:准确称取果胶样品,溶于水,配制成0.2 mg/mL过0.45 μm水膜,待检测。
1.3.4 不同降解方法对果胶样品单糖组成的影响
采用高校液相色谱法测定果胶单糖的含量,方法参照YANG等[18],精密称取甘露糖(Man),核糖(Rib),氨基葡萄糖(Glus),氨基半乳糖(Gals),鼠李糖(Rha),葡萄糖醛酸(GluA),半乳糖醛酸(Gal A),葡萄糖(Glu),半乳糖(Gal),岩藻糖(Fuc),木糖(Xyl),阿拉伯糖(Ara)标准品适量,加水溶解稀释至1 mL中各含50 μg的混合标准溶液。精确吸取250 μL混合对照溶液到5 mL离心管中,加入0.6 mol/L的NaOH 250 μL以及0.4 mol/L的PMP-甲醇溶液500 μL,70 ℃反应1 h。冷水浴冷却10 min后,加入500 μL 0.3 mol/L的HCl中和,再加1 mL氯仿,漩涡1 min,3 000 r/min离心10 min,小心取上清,萃取3次。上清液用于高效液相色谱检测。
果胶样品的水解和衍生化:精密称取样品置于5 mL安剖瓶中,加入2 mL 2 mol/L三氟乙酸,封管,110 ℃条件下酸解8 h。取出,挥干三氟乙酸,加2.0 mL水复溶。取250 μL样品水解液,按照标准品衍生的方法进行衍生化。
色谱仪:Ultimate 3000,色谱柱:Xtimate C18 4.620 0 mm,5 μm,柱温:30 ℃,流速:1.0 mL/min,检测波长:250 nm,进样量:20 μL,流动相:0.05 mol/L磷酸二氢钾溶液(用氢氧化钠溶液调pH为6.70)-乙腈溶液,体积比83∶17。
1.3.5 不同降解方法对果胶样品红外光谱的影响
取样品与干燥的KBr混匀,研磨均匀,压片(压力30 MPa以上),制成透明或半透明的样品薄片。用美国PerkinElmer公司 Spectrun100傅里叶红外光谱仪进行扫描,扫描范围400~4 000 cm-1,分辨率4 cm-1,导出扫描结果,用Origin9.1作图并分析。
1.3.6 不同降解方法对果胶样品表观形态的影响
轻刮取少量果胶原料及冻干后的及降解样品,将它们均匀粘在导电胶上,喷金制样后置于扫描电子显微镜中,观察其结构形态。
1.3.7 数据处理与分析
数据处理采用SPSS 22.0,作图采用Origin 2017。
2 结果与分析
2.1 柑橘果胶酶解
随着酶浓度的增加,低聚半乳糖醛酸的生成量也逐渐增长(P<0.05)。当酶浓度低于1.0 mg/mL时,低聚半乳糖醛酸生成量随着酶浓度的增长显著增加,当酶浓度达到一定值(1.0 mg/mL)时,反应速度增长缓慢,考虑酶的成本,故酶添加量选择0.04 U/mL(图1-a)。酶解温度在30~35 ℃时,随着温度的升高,低聚半乳糖醛酸生成量显著提高,而在35~45 ℃时,低聚半乳糖醛酸的生成量随着温度的增加增长趋势变缓,当温度>45 ℃,低聚半乳糖醛酸的生成量急剧下降(图1-b)。在前60 min,随着反应时间的延长低聚半乳糖醛酸生成量迅速增加(P<0.05),当反应时间超过60 min以后,生成速率明显趋于缓慢(P>0.05)(图1-c)。因此,果胶酶解的最佳反应条件为:酶浓度0.04 U/mL,温度45 ℃,时间60 min。

a-酶浓度;b-酶解温度;c-反应时间
图1 酶浓度、酶解温度和反应时间对低聚半乳糖醛酸生成量的影响
Fig.1 The effect of enzyme concentration,reaction temperature and time on the yield of oligosalacuronic acid
2.2 超声波作用条件对酶促降解果胶的影响
在超声处理30 min时,超声功率对果胶降解效果的影响如图2-a所示。酶解底物在超声功率10%~30%时,低聚半乳糖醛酸生成量迅速增加,当超声功率再增加时,果胶酶促降解效率提高不大且有下降趋势;酶解产物在超声功率10%~40%时,低聚半乳糖醛酸的生成量从最低增加到最大,功率超过40%时,低聚半乳糖醛酸的生成量反而有下降趋势。在超声功率为30%时,超声时间对果胶降解效果的影响如图2-b所示。酶解底物在超声处理40 min时低聚半乳糖醛酸生成量达到最大,超过40 min时,生成量呈下降趋势;酶解产物在30 min时低聚半乳糖醛酸生成量达到最大,当超声时间超过30 min,超声降解效果不明显。
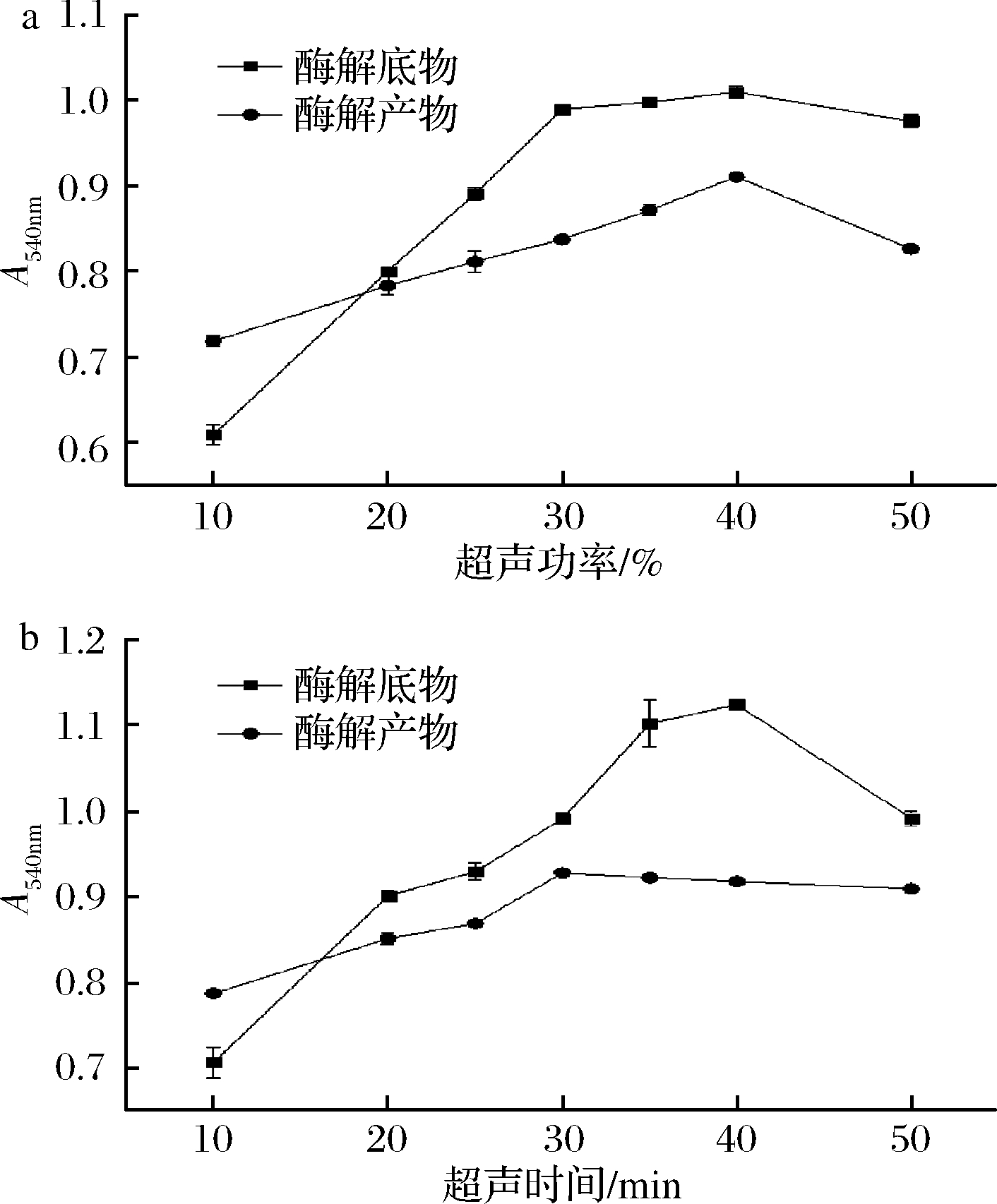
a-超声功率;b-超声时间
图2 超声功率和超声时间对酶降解底物和产物的影响
Fig.2 Effects of ultrasonic power and time on enzymatic degradation of substrates and products
因此,超声波处理果胶酶解底物选择超声功率30%,处理40 min为宜;处理果胶酶解产物选择超声功率40%,处理30 min效果较好。
2.3 微波作用条件对酶促降解果胶的影响
微波时间、微波温度及微波功率对果胶降解效果的影响见图3。在微波温度为70 ℃,功率为600 W的条件下,酶解底物在微波辐照时间为10~30 min时,低聚半乳糖醛酸生成量逐渐增加,超过30 min时低聚半乳糖醛酸生成量有下降趋势;酶解产物在微波处理前期,果胶降解效率不断提高,达到40 min后,持续增加微波辐照时间并不能有效地提高降解率(图3-a)。在微波辐照时间30 min,功率600 W的条件下,随着处理温度的提高(酶解底物),低聚半乳糖醛酸生成量逐步增加,但当温度超过100 ℃时,果胶溶液发生暴沸,不利于试验的进行;酶解产物在40~70 ℃时,低聚半乳糖醛酸生成量逐渐增加,当温度超过70 ℃之后,温度对酶促降解效率影响并不大(图3-b)。在微波处理时间30 min,温度100 ℃的条件下,酶解底物在微波处理功率为300~700 W时,低聚半乳糖醛酸生成量迅速增加,当微波功率超过700 W后,低聚半乳糖醛酸生成量呈下降趋势;果胶酶解产物经微波温度70 ℃,处理30 min时,微波功率在400~800 W时,低聚半乳糖醛酸的生成量逐渐增加到最大,当微波功率超过800 W之后,功率的增加并不能有效的提高果胶降解的效率(图3-c)。
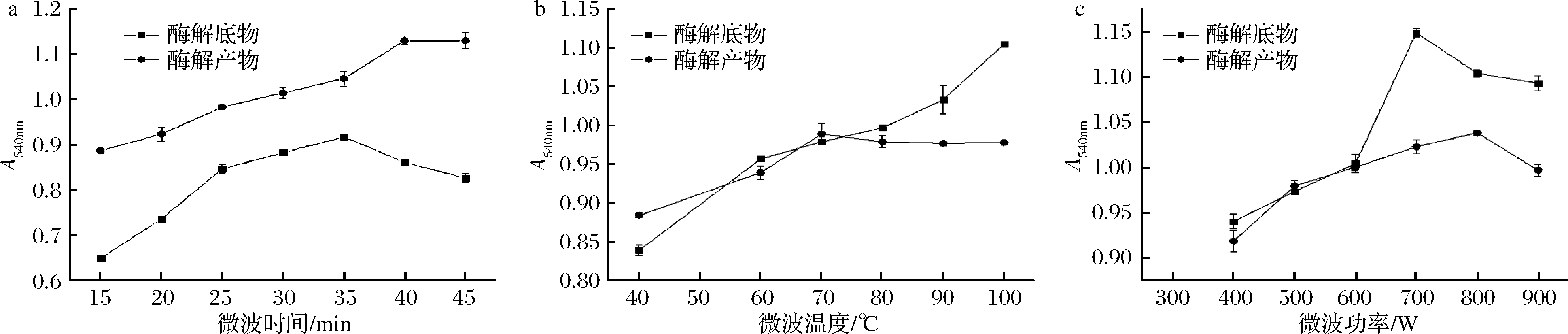
a-微波时间;b-微波温度;c-微波功率
图3 微波时间、温度与功率对酶降解底物和产物的影响
Fig.3 Effects of microwave time,temperature and power on enzymatic degradation of substrates and products
因此,微波处理果胶酶解底物选择在微波功率700 W,100 ℃下处理30 min为宜;微波处理果胶酶解产物选择在微波温度70 ℃,功率800 W条件下处理40 min为宜。
2.4 不同降解方法对果胶样品分子质量及其分布的影响
采用凝胶渗透色谱测定果胶样品分子质量,出峰时间越早,则表示保留时间越短,因此样品分子质量越大[19]。由图4可以看出,原果胶(CP)出峰时间最早,分子质量也最大,为283 kDa。而果胶酶解果胶(EP)、微波处理酶解底物(MEPⅠ)、微波处理酶解产物(MEPⅡ)、超声波处理酶解底物(UEPⅠ)、超声波处理酶解产物(UEPⅡ)的出峰时间和形状大体相同,其分子量之间没有显著性差异,但都比原果胶小,说明果胶酶、超声波和微波有都在一定程度上降解了果胶。

图4 不同降解方法制备的果胶的分子质量
Fig.4 Molecular weight of pectin prepared by different degradation methods
EP、MEP Ⅰ、MEP Ⅱ、UEP Ⅰ、UEP Ⅱ的分子质量及其分散性系数如表1所示。几种降解果胶的重均分子质量均比原果胶(283 kDa)低56.18%以上,表明果胶酶降解果胶具有显著的降解效果。EP(1.23)、MEP Ⅰ(1.22)、MEP Ⅱ(1.22)、UEP Ⅰ(1.23)、UEP Ⅱ(1.22)的多分散性系数比原果胶(4.26)明显降低,几种降解果胶之间没有明显差异(P>0.05),由此可知降解果胶的分子质量分布更窄,果胶分子分布更集中。
2.5 不同降解方法对果胶样品单糖组成的影响
单糖组成能反映果胶的结构特征,对其性质和生物活性有重要影响[20-21]。果胶原料及几种不同降解产物的单糖组成(以mol%的形式表示)如表1所示。
表1 不同降解果胶的单糖组成
Table 1 Monosaccharide composition of different degraded pectin
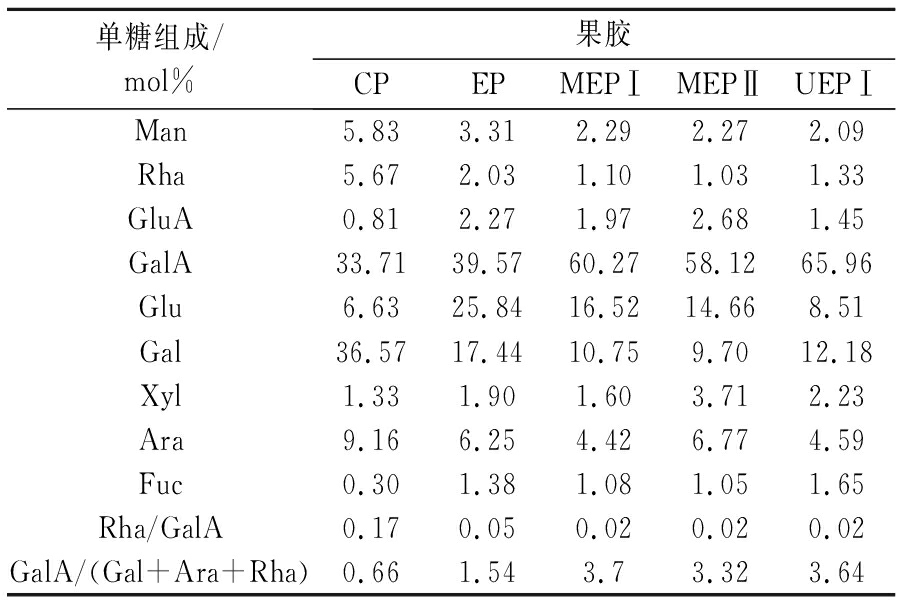
单糖组成/mol%果胶CPEPMEPⅠMEPⅡUEPⅠUEPⅡMan5.833.312.292.272.091.95Rha5.672.031.101.031.331.25GluA0.812.271.972.681.451.66GalA33.7139.5760.2758.1265.9663.75Glu6.6325.8416.5214.668.5111.12Gal36.5717.4410.759.7012.1811.30Xyl1.331.901.603.712.232.50Ara9.166.254.426.774.594.54Fuc0.301.381.081.051.651.92Rha/GalA0.170.050.020.020.020.02GalA/(Gal+Ara+Rha)0.661.543.73.323.643.73
果胶经酶解和超声、微波辅助酶解之后,其单糖类型未发生改变,但其含量发生了显著或不显著的变化。MEPⅠ、MEPⅡ、UEPⅠ、UEPⅡ与酶解果胶和原果胶相比,Gal、Ara和Rha含量明显下降,GalA含量明显上升,这与ZHANG等[22]超声处理30 min时GalA含量的变化一致。酶解果胶GalA含量由原果胶33.71%提高到39.57%,这是由于果胶酶能使HG区半乳糖醛酸主链间的糖苷键断裂[23]。MEPⅠ、MEP Ⅱ、UEP Ⅰ 及UEP Ⅱ 的GalA含量分别达到了60.27%、58.12%、65.96%和63.75%,相比酶解果胶39.57%分别提高了52.31%、46.88%、66.69%、61.11%。超声的空化机械作用导致果胶的降解,使其单糖的含量发生变化,半乳糖最不稳定,而半乳糖醛酸对高强度超声最有抵抗力[22]。微波的热效应主要是分子之间振动所产生的机械剪切作用,使糖苷键断裂,导致大分子果胶降解。综上,经超声、微波作用能明显的提高GalA的含量,且利用超声和微波处理酶解底物辅助果胶酶效果更好。
用Rha/GalA代表果胶主链的变化,GalA/ (Gal+Ara+Rha)表示中性糖侧链的变化[24]。相比于原果胶,几种降解果胶Rha/GalA明显降低,GalA/ (Gal+Ara+Rha)显著提高,表明酶促降解、微波辅助果胶酶降解和超声波辅助果胶酶降解对果胶主链降解效果明显,使果胶结构中鼠李糖半乳糖醛酸聚糖I型的含量增加,且果胶的侧链也发生了明显的降解,因此超声波和微波辅助酶解都能明显加强降解效果。根据有关文献[25]报道,这可能是由于果胶酶以未被酯化的多聚半乳糖醛酸作为底物,超声波作用下GalA上甲氧基的移除使果胶酶与底物的作用位点更多,亲和力更强,从而进一步促进果胶主链的降解程度。
2.6 不同降解方法对果胶样品红外光谱的影响
原果胶以及不同降解方法的红外光谱图见图5。柑橘果胶在3 430 cm-1处的吸收主要是由于羟基的伸缩引起的,在2 937 cm-1处的吸收主要是由于CH2基团的C—H伸缩引起的,1 748 cm-1处的吸收是归因于被酯化的羧基的C![]() O伸缩振动,在1 630 cm-1的吸收峰归因于游离羧基的C
O伸缩振动,在1 630 cm-1的吸收峰归因于游离羧基的C![]() O伸缩振动[24]。在4 000~1 800 cm-1,原果胶主要有2个峰在3 430 cm-1和2 937 cm-1,这2个峰是多糖的特征吸收峰。波数3 620~3 020 cm-1的宽峰代表的是半乳糖醛酸分子内羟基基团的吸收峰,由于分子内羟基形成的氢键而使吸收峰变宽[26]。与原果胶相比,几种降解果胶2 937 cm-1处C—H伸缩振动峰明显减弱;超声联合酶解果胶UEPⅠ和UEPⅡ的O—H伸缩振动吸收峰相比原果胶、酶解果胶、MEPⅠ和MEPⅡ也有略微减弱。在1 500~1 800 cm-1范围内有2个相对较强的吸收峰1 748 cm-1和1 630 cm-1,PAPPAS等[27]研究表明1 748 cm-1的平均吸收面积与1 748 cm-1和1 630 cm-1的平均面积之和的比值为果胶的酯化度,由图中可以看出,经改性的果胶在1 748 cm-1处的峰面积明显比原果胶的峰面积小,且在1 630 cm-1处的峰面积变化较小,因此表明改性果胶的酯化度较原果胶小。在400~1 500 cm-1为糖类的特征指纹区。900~1 200 cm-1对应糖苷键和吡喃环的骨架C—O和C—C振动,由图5可以发现,原果胶在1 010~1 150 cm-1这个区域有3个强吸收峰,分别是1 147,1 103 cm和1 014 cm-1,是阿拉伯半乳聚糖的特征峰[28]。EP、MEPⅠ、MEPⅡ、UEPⅠ、UEPⅡ在1 010~1 150 cm-1处的吸收峰减弱,说明这几种降解果胶在单糖组成上有差异。在920 cm-1处的吸收涉及D-吡喃葡萄糖基的吸收,而832 cm-1是α-D-吡喃甘露糖的吸收,可以看出来改性果胶在832 cm-1处的吸收峰不明显,这与单糖组成分析的结果一致。这一结果说明超声和微波可以在一定程度上打断果胶和非果胶之间的共价键,与SUN等[29]曾发现超声处理可以打断木质素和半纤维素之间的醚键结果一致。
O伸缩振动[24]。在4 000~1 800 cm-1,原果胶主要有2个峰在3 430 cm-1和2 937 cm-1,这2个峰是多糖的特征吸收峰。波数3 620~3 020 cm-1的宽峰代表的是半乳糖醛酸分子内羟基基团的吸收峰,由于分子内羟基形成的氢键而使吸收峰变宽[26]。与原果胶相比,几种降解果胶2 937 cm-1处C—H伸缩振动峰明显减弱;超声联合酶解果胶UEPⅠ和UEPⅡ的O—H伸缩振动吸收峰相比原果胶、酶解果胶、MEPⅠ和MEPⅡ也有略微减弱。在1 500~1 800 cm-1范围内有2个相对较强的吸收峰1 748 cm-1和1 630 cm-1,PAPPAS等[27]研究表明1 748 cm-1的平均吸收面积与1 748 cm-1和1 630 cm-1的平均面积之和的比值为果胶的酯化度,由图中可以看出,经改性的果胶在1 748 cm-1处的峰面积明显比原果胶的峰面积小,且在1 630 cm-1处的峰面积变化较小,因此表明改性果胶的酯化度较原果胶小。在400~1 500 cm-1为糖类的特征指纹区。900~1 200 cm-1对应糖苷键和吡喃环的骨架C—O和C—C振动,由图5可以发现,原果胶在1 010~1 150 cm-1这个区域有3个强吸收峰,分别是1 147,1 103 cm和1 014 cm-1,是阿拉伯半乳聚糖的特征峰[28]。EP、MEPⅠ、MEPⅡ、UEPⅠ、UEPⅡ在1 010~1 150 cm-1处的吸收峰减弱,说明这几种降解果胶在单糖组成上有差异。在920 cm-1处的吸收涉及D-吡喃葡萄糖基的吸收,而832 cm-1是α-D-吡喃甘露糖的吸收,可以看出来改性果胶在832 cm-1处的吸收峰不明显,这与单糖组成分析的结果一致。这一结果说明超声和微波可以在一定程度上打断果胶和非果胶之间的共价键,与SUN等[29]曾发现超声处理可以打断木质素和半纤维素之间的醚键结果一致。
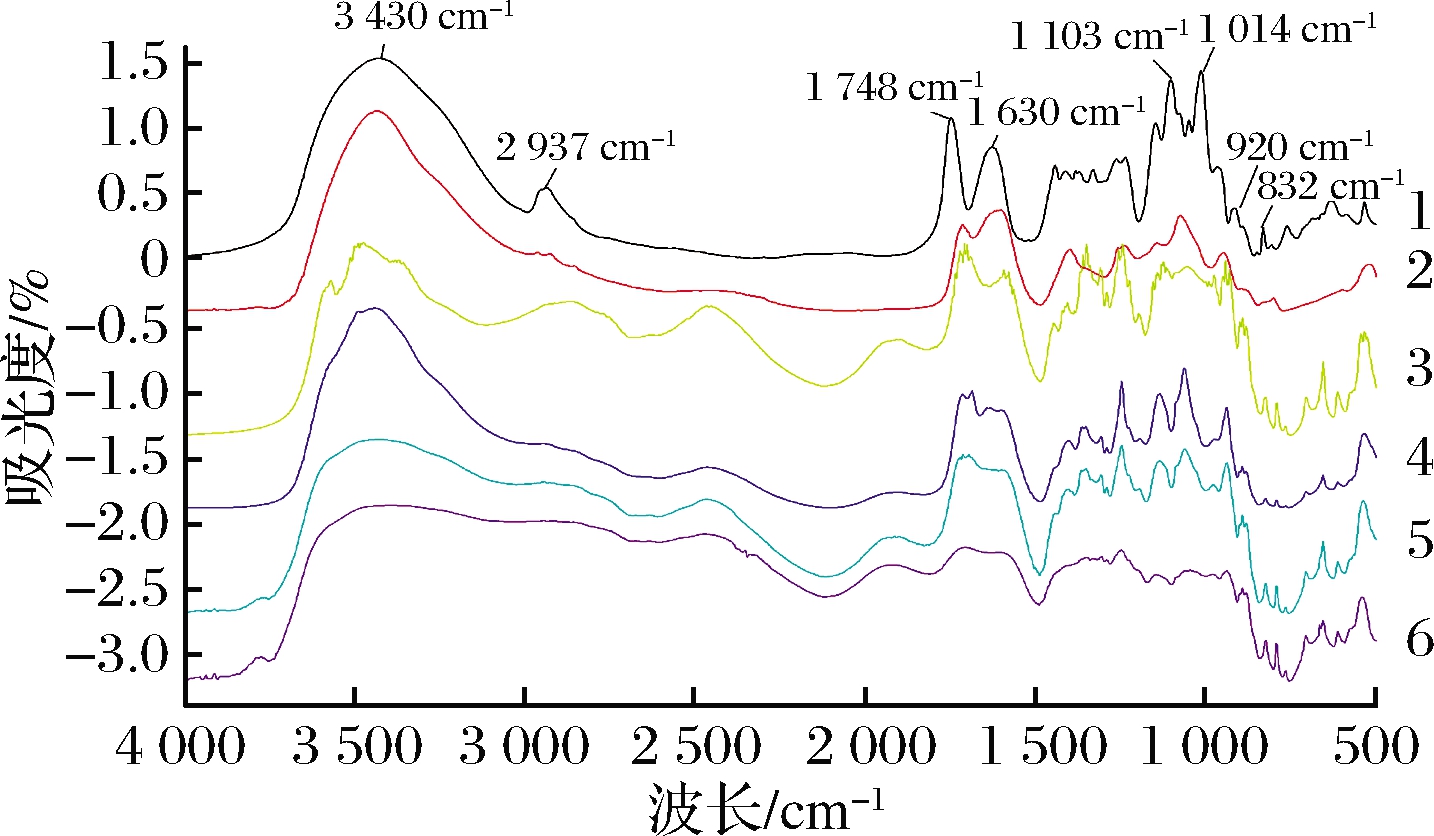
1-CP;2-EP;3-MEPⅠ;4-MEPⅡ;5-UEPⅠ;6-UEPⅡ
图5 不同方法降解果胶的红外光谱图
Fig.5 Infrared spectra of pectin degradation by different methods
2.7 不同降解方法对果胶样品表观形态的影响
图6为原果胶及不同方法制备的降解果胶样品冷冻干燥后的×1 000倍数下的扫描电镜图,从果胶样品的表面形态特征可以看出果胶酶、微波、超声都影响了果胶的微观结构。具有差异性的微观结构意味着微波和超声处理也许能破坏果胶分子之间的交联并重组了果胶分子间的网状结构[25]。如图6-a所示,原果胶表面结构呈不规则条状或块状,结构紧实表面粗糙。图6-b酶解果胶呈带孔径的片状,由于吸水聚集黏结成团状,在较大放大倍数(×1 000倍)下可以看到表面光滑,有少许细小孔洞。图6-e,图6-f为微波处理的果胶,其结构聚集成团状,且有些许孔径。而经过超声处理的果胶(图6-c,图6-d)与前几种果胶相比,在较大放大倍数(×1 000倍)下可以看到明显密且大的孔洞。分析表明,用不同方法降解的果胶可能表现出不同的形态。

a-CP;b-EP;C-UEPⅠ;d-UEPⅡ;e-MEPⅠ;f-MEPⅡ
图6 原果胶及不同降解果胶扫描电子显微镜图(×1 000图)
Fig.6 Sacnning electron microscopy of initial pectin and different degraded pectin
3 结论
采用超声波和微波辅助果胶酶制备改性柑橘果胶,同时对其改性工艺条件进行研究,以期增强果胶的功能性,扩展其应用范围。通过单因素试验得到几种降解方式的最佳工艺条件,果胶酶降解果胶:酶浓度0.04 U/mL,温度45 ℃,时间60 min;超声波处理果胶酶解底物:超声功率30%,处理40 min,超声波处理果胶酶解产物:超声功率40%,处理30 min;微波处理果胶酶解底物:微波功率700 W,100 ℃下处理30 min,微波处理果胶酶解产物:微波温度70 ℃,功率800 W条件下处理40 min。
酶解、超声辅助酶解以及微波辅助酶解均能有效降低果胶的分子质量,且降解果胶的分子质量分布更窄,果胶分子分布更集中。果胶经酶解和超声、微波辅助酶解不改变果胶的单糖类型,但经超声、微波作用能显著提高GalA的含量,MEP Ⅰ (60.27%)、MEP Ⅱ (58.12%)、UEP Ⅰ(65.96%)和UEP Ⅱ(63.75%)的GalA含量相比酶解果胶(39.57%)分别提高了52.31%、46.88%、66.69%、61.11%。相比于原果胶,几种降解果胶Rha/GalA明显降低,GalA/ (Gal+Ara+Rha)显著提高,说明酶促降解、微波辅助果胶酶降解和超声波辅助果胶酶降解都能使果胶主链和侧链发生不同程度的断裂。整体上,改性前后柑橘果胶的红外光谱吸收基团类型未发生,表明组成果胶的糖类型未变,这与单糖组成分析的结果一致。傅里叶红外光谱结果显示不同降解处理后的果胶都具有明显的特征峰,改性果胶的酯化度减小,且改变了果胶的单糖组成。从扫描电镜图可以看出果胶酶、微波、超声都影响了果胶的微观结构。
[1] 程一鑫. 超声波对高甲氧基果胶NMR转折点蔗糖浓度及其结构的影响[D].南昌:南昌大学, 2014.
CHENG Y X.Effect of ultrasonic on NMR transition point of sucrose concentration and structure of high methoxy pectin[D].Nanchang:Nanchang University, 2014.
[2] 李倩倩,付佳璇,赵玉梅,等.果胶降解与采后果实质地变化研究进展[J].中国食品学报, 2019, 19(9):298-307.
LI Q Q, FU J X, ZHAO Y M, et al.Progress on pectin and texture change of postharvest fruits[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(9):298-307.
[3] 张丽芬,吴倩,陈复生,等.改性果胶结构、功能及方法的研究进展[J].粮食与油脂, 2015, 28(1):1-5.
ZHANG L F, WU Q, CHEN F S, et al.Research on the structure,function and methods of modified pectin[J].Cereals and Oils, 2015, 28(1):1-5.
[4] CHEN J, LIANG R H, LIU W, et al.Pectic-oligosaccharides prepared by dynamic high-pressure microfluidization and their in vitro fermentation properties[J].Carbohydr Polym, 2013, 91(1):175-182.
[5] 杨蕾. 果胶及低聚糖的制备及其对双歧杆菌体外增殖作用的研究[D].芜湖:安徽工程大学, 2015.
YANG L.Reparation of pectins and pectin-oligosaccharides and its effect on Bifidobacterium in vitro[D].Wuhu:Anhui Polytechnic University, 2015.
[6] DI R, VAKKALANKA M S, ONUMPAI C, et al.Pectic oligosaccharide structure-function relationships:Prebiotics, inhibitors of Escherichia coli o157:h7 adhesion and reduction of shiga toxin cytotoxicity in ht29 cells[J].Food Chem, 2017, 227:245-254.
[7] XU G R, ZHANG C, YANG H X, et al.Modified citrus pectin ameliorates myocardial fibrosis and inflammation via suppressing galectin-3 and TLR4/MYD88/NF-кB signaling pathway[J].Biomed Pharmacother, 2020, 126:110 071.
[8] TAKEI TAKAYUKI, SATO MITSUNOBU, IJIMA HIROYUKI, et al.In situ gellable oxidized citrus pectin for localized delivery of anticancer drugs and prevention of homotypic cancer cell aggregation[J].Biomacromolecules, 2010, 11(12):3 525-3 530.
[9] YAN J, KATZ AARON.Pectasol-c modified citrus pectin induces apoptosis and inhibition of proliferation in human and mouse androgen-dependent and- independent prostate cancer cells[J].Integr Cancer Ther, 2010, 9(2):197-203.
[10] NANGIA-MAKKER PRATIMA, HOGAN VICTOR, HONJO YUICHIRO, et al.Inhibition of human cancer cell growth and metastasis in nude mice by oral intake of modified citrus pectin[J].J Natl Cancer Inst, 2002, 94(24):1 854-1 862.
[11] 魏子淏,杨伟,刘夫国,等.改性柑橘果胶研究进展[J].中国食品添加剂, 2014(3):194-200.
WEI Z H, YANG W, LIU F G, et al.Advances in modified citrus pectin[J].China Food Additives, 2014(3):194-200.
[12] 邱现创,赵宁,李晨,等.铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响[J].食品科学, 2018, 39(2):273-280.
QIU X C, ZHAO N, LI C, et al.Optimization of extraction of polysaccharide from Dendrobium officinale and its antioxidant effect on Drosophila melanogaster[J].Food Science, 2018, 39(2):273-280.
[13] RAHUL SESHADRI, JOCHEN WEISS, GREG J HULBERT, et al.Ultrasonic processing influences rheological and optical properties of high-methoxyl pectin dispersions[J].Food Hydrocolloids, 2003, 17(2):191-197.
[14] 万宇俊,殷军艺,聂少平,等.微波提取对胡萝卜中的多糖基本结构特征及固体形貌的影响[J].食品科学, 2017, 38(7):1-5.
WAN Y J, YIN J Y, NIE S P, et al.Impact of microwave extraction on structural characteristics and morphology of carrot (Daucus carota L.) polysaccharide[J].Food Science, 2017, 38(7):1-5.
[15] ![]()
![]() VELEBNY, VLASTA SASINKOV
VELEBNY, VLASTA SASINKOV , et al.Degradation of hyaluronan by ultrasonication in comparison to microwave and conventional heating[J].Carbohydrate Polymers, 2005, 61(4):420-426.
, et al.Degradation of hyaluronan by ultrasonication in comparison to microwave and conventional heating[J].Carbohydrate Polymers, 2005, 61(4):420-426.
[16] 廖祥兵,陈晓明,肖伟,等.DNS法定量测定还原糖的波长选择[J].中国农学通报, 2017, 33(15):144-149.
LIAO X B, CHEN X M, XIAO W, et al.The wavelength selection of reducing sugar quantitatively determined by DNS method[J].Chinese Agricultural Science Bulletin, 2017, 33(15):144-149.
[17] JONGBIN LIM, JIYOUNG YOO, SANGHOON KO, et al.Extraction and characterization of pectin from yuza (citrus junos) pomace:A comparison of conventional-chemical and combined physical-enzymatic extractions[J].Food Hydrocolloids, 2012, 29(1):160-165.
[18] YANG X B, ZHAO Y, WANG Q W, et al.Analysis of the monosaccharide components in angelica polysaccharides by high performance liquid chromatography[J].Analytical Sciences, 2005, 21(10):1 177-1 180.
[19] 赵文婷. 超高压辅助酶法制备低酯果胶及酶激活机理研究[D].北京:中国农业大学, 2016.
ZHAO W T.Preparation and characterization of low methoxyl pectin by high hydrostatic pressure-assisted enzymatic treatment and mechanism of pressure-induced activation[D].Beijing:China Agricultural University, 2016.
[20] WANG W J, MA X B, XU Y T, et al.Ultrasound-assisted heating extraction of pectin from grapefruit peel:Optimization and comparison with the conventional method[J].Food Chemistry, 2015, 178:106-114.
[21] MANEL MASMOUDI, SOUHAIL BESBES, FATMA ABBES, et al.Pectin extraction from lemon by-product with acidified date juice:Effect of extraction conditions on chemical composition of pectins[J].Food and Bioprocess Technology, 2012, 5(2):687-695.
[22] ZHANG L F, YE X Q, XUE SOPHIA JUN, et al.Effect of high-intensity ultrasound on the physicochemical properties and nanostructure of citrus pectin[J].J Sci Food Agric, 2013, 93(8):2 028-2 036.
[23] 陈颖. 改性果胶的制备及其结合半乳凝集素-3的结构特征[D].无锡:江南大学, 2016.
CHEN Y.Preparation of modified pectin and the structure characteristics of its binding to GAL-3[D].Wuxi:Jiangnan University, 2016.
[24] WANG W J, MA X B, JIANG P, et al.Characterization of pectin from grapefruit peel:A comparison of ultrasound-assisted and conventional heating extractions[J].Food Hydrocolloids, 2016, 61:730-739.
[25] 马晓彬. 果胶酶促降解中的超声波作用途径及机理研究[D].杭州:浙江大学, 2017.
MA X B.Research on function routes and mechanisms of ultrasound in the enzymatic degradation of pectin[D].Hangzhou:Zhejiang University, 2017.
[26] AMATJAN SAWUT, MAMATJAN YIMIT, WANFU SUN, et al.Photopolymerisation and characterization of maleylatedcellulose-g-poly(acrylic acid) superabsorbent polymer[J].Carbohydrate Polymers, 2014, 101:231-239.
[27] PAPPAS C S, MALOVIKOVA A, HROMADKOVA Z, et al.Determination of the degree of esterification of pectinates with decyl and benzyl ester groups by diffuse reflectance infrared Fourier transform spectroscopy (drifts) and curve-fitting deconvolution method[J].Carbohydrate Polymers, 2004, 56(4):465-469.
[28] KACUR KOV
KOV M, CAPEK P, SASINKOV
M, CAPEK P, SASINKOV V, et al.FT-IR study of plant cell wall model compounds:Pectic polysaccharides and hemicelluloses[J].Carbohydr Polym, 2000, 43(2):195-203.
V, et al.FT-IR study of plant cell wall model compounds:Pectic polysaccharides and hemicelluloses[J].Carbohydr Polym, 2000, 43(2):195-203.
[29] SUN J X, SUN R C, SUN X F, et al.Fractional and physico-chemical characterization of hemicelluloses from ultrasonic irradiated sugarcane bagasse[J].Carbohydr Res, 2003, 339(2):291-300.