柠檬是柑橘生产上广泛栽培的种类之一,除鲜食外,还可加工成柠檬汁、柠檬茶和柠檬果酱等[1],深受人们青睐。柠檬中富含类黄酮、酚酸与类柠檬苦素等多种生物活性成分[2],具有抗炎、抗氧化、抗癌及预防心血管疾病等生理功能[3-4]。因此,有必要对柠檬果实中主要生物活性成分进行系统深入地研究,以指导消费、医药和保健产品研发,为其资源化综合利用提供理论依据与技术支撑。
柑橘中生物活性成分通常基于高效液相色谱法、超高效液相色谱法(UPLC)、液相色谱-质谱法等手段分析,郑洁等[5]利用UPLC建立了同时测定柑桔中主要酚酸和类黄酮组成及含量的方法。张阿敏等[6]利用高效液相色谱-质谱法建立了测定赣南脐橙幼果中酚酸的检测方法。DUGRAND等[7]建立了基于超高效液相色谱-质谱法测定柑橘中香豆素和呋喃香豆素的分析方法,并应用于6种柑橘果皮中6种香豆素和21种呋喃香豆素的分离和定量。近年来,作为一种新型联用技术,超高效液相色谱-四极杆-飞行时间高分辨质谱(ultra-performance liquid chromatography-quadrupole-time-of-flight high-resolution mass spectrometry, UPLC-Q-TOF-HRMS)具有快速、高效与高灵敏等特点[8-10],可进行靶向物和非靶向物的高分辨率筛选,目前广泛应用于果蔬中农药残留筛查鉴定[11-12]、生物活性成分鉴定[3,13-14]以及果汁的真伪鉴别[15]。KE等[16]通过UPLC-QTOF-MS在7 min内分离鉴定了7种柑橘果皮中的10种多甲氧基类黄酮(polymethoxylated flavonoids, PMFs)。XING等[14]利用UPLC-QTOF-MS在12 min内分析和鉴定了14种宽皮柑橘和橙类果皮中的42种PMFs,其中8种PMFs在柑橘样品为首次报道,但该研究仅分析鉴定了PMFs。YANG等[17]建立了一种用于定性分析椪柑果皮中生物活性成分的UPLC-QTOF-MS方法,该方法在7 min内初步鉴定了椪柑果皮中的24种类黄酮及8种其他化合物。ZHAO等[18]基于UPLC-QTOF-MS建立了一种分离莽山橘中生物活性成分的分析方法,其中已初步鉴定出81种化合物(主要为类黄酮和柠檬苦素)。LEDESMA-ESCOBAR等[19]基于液相色谱-四极杆飞行时间质谱技术从柠檬提取物中初步鉴定出32种类黄酮、6种香豆素、5种酚酸、15种氨基酸和11种未分类化合物。以上研究大多集中于柑橘中的一类或两类生物活性成分(主要是类黄酮)的初步筛查鉴定,而针对柑橘中多类型生物活性成分的快速筛查与准确鉴定的方法研究较少。
目前基于UPLC-Q-TOF-HRMS技术对柑橘中生物活性成分的研究大多集中于宽皮柑橘和橙类,而对柠檬中生物活性成分的系统研究较少。以往的研究局限于柑橘中常见的类黄酮、酚酸等生物活性成分,尚缺乏多类型生物活性成分同时进行准确筛查鉴定的方法研究。因此,本研究基于柑橘中常见的生物活性成分标准品建立质谱数据库(包括46种类黄酮、29种香豆素、10种酚酸、7种生物碱和3种类柠檬苦素),同时利用UPLC-Q-TOF-HRMS技术,建立一种能够快速分离与鉴定多类型生物活性成分的方法。并对6种柠檬不同部位的生物活性成分进行筛查鉴定,为其功能食品的研究开发提供指导。
1 材料与方法
1.1 样品信息
6个柠檬品种(表1)于2019年11月采自中国农业科学院柑桔研究所国家果树种质资源(重庆)柑橘圃,在三棵长势一致果树上的不同果实着生方位(上、中、下、内、外部)均匀地采摘20~30个处于成熟期的柠檬果实。
表1 试验材料具体信息
Table 1 Specific information of the experimental materials
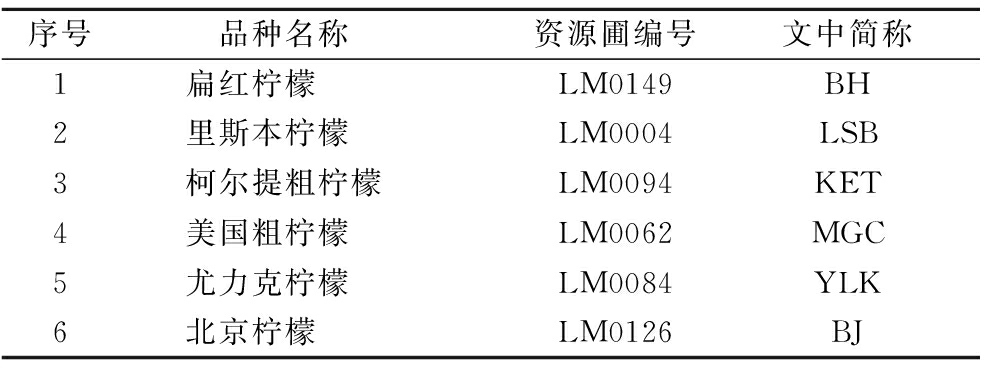
序号品种名称 资源圃编号文中简称 1扁红柠檬LM0149BH2里斯本柠檬LM0004LSB3柯尔提粗柠檬LM0094KET4美国粗柠檬LM0062MGC5尤力克柠檬LM0084YLK6北京柠檬LM0126BJ
1.2 试剂
甲醇、乙腈均为色谱纯,美国Sigma-Aldrich公司;甲酸为色谱纯,上海吉至生化科技有限公司;Milli-Q Advantage A10 超纯水器,美国Millpore公司。本试验共有95种标准品,具体信息如下:甜菜碱、东莨菪内酯、异补骨脂素、新北美圣草苷、5,7,3′,4′-四甲氧基黄酮、5-降甲基蜜桔黄素、甲基橙皮苷、地奥司明、香叶木素、香蒲新苷、异鼠李素-3-O-新橙皮糖苷、栀子黄素B、蔓荆子黄素、柠檬苦素和诺米林的纯度均为98.0%以上,成都克洛玛生物科技有限公司;异茴芹内酯、橙皮内酯水合物、橙皮内酯、水合氧化前胡素、氧化前胡素、异紫花前胡内酯、花椒毒醇、白当归素、珊瑚菜素、蛇床子素、8-氧甲基异欧前胡内酯、根皮苷、异槲皮苷、槲皮素、异橙黄酮、4′,5,7,8-四甲氧基黄酮、水仙苷、黄柏酮、没食子酸、D-(-)-奎宁酸(纯度均为98.0%以上),4′,5,6,7-四甲氧基黄酮(纯度95.0%)和3′,4,7,8-四甲氧基黄酮(纯度95.0%),上海源叶生物技术有限公司;辛弗林(纯度98.8%)、N-甲基酪胺(纯度99.5%)、5-牻牛儿醇基-7-甲氧基香豆素(纯度99.9%)、8-(牻)牛儿醇基补骨脂素(纯度98.5%)、香柠檬亭(纯度96.9%),美国ChromaDex;苯肾上腺素(纯度99.2%)、大麦芽碱(纯度97.5%)、酪胺(纯度98.5%)、橙皮油内酯(纯度98.5%),美国Sigma-Aldrich;章鱼胺(纯度99.3%),德国Dr.Ehrenstorfer GmbH;其他标准品信息参照ZHAO等[20]。
将购买的标准品分别用甲醇(上述购自上海源叶生物技术有限公司的标准品除黄柏酮外,其他均加入极少量的DMSO使其溶解)配制成2 mg/L标准品储备液,放置于低温下(-50 ℃)保存。使用甲醇将上述标准品配制成0.5 mg/L混合标准液备用。
1.3 仪器与设备
KQ5200DE超声波清洗仪,昆山市超声仪器有限公司;Milli-Q AdvantageA10超纯水系统,美国Millipore;3K15高速冷冻离心机,美国Sigma-Aldrich;PB3002-S/FACT分析天平(感量0.01 g),瑞士梅特勒-托利多公司;Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱,美国Waters;Nexera X2 UPLC,日本岛津公司;SCIEX X500R QTOF,美国AB SCIEX公司。
1.4 样品准备
样品取样参照相关标准GB/T 8210—2011,参照朱丽莎等[21]方法进行样品果皮、果肉与果汁的制备。
果皮、果肉与果汁前处理:取样品5 g置于离心管中,加入10 mL(果肉5 mL)甲醇,在室温条件下200 W超声30 min,10 000 r/min下离心5 min,上清液置于50 mL(果肉25 mL)容量瓶中,重复提取4次,最后用甲醇定容至50 mL(果肉25 mL)。提取液用0.22 μm 微孔有机滤膜过滤后上机检测。
1.5 液相条件
色谱柱为Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm),柱温40 ℃,流动相为0.1%(体积分数)甲酸水溶液(A)与乙腈(B),进样量为1.0 μL,流速为0.3 mL/min。采用梯度洗脱程序,正离子模式:0~0.2 min,10%~25%B;0.2%~4.5 min,25%~45%B;4.5~4.6 min,45%~65%B;4.6~8 min,65%~75%B;8~8.5 min,75%~95%B;8.5~10.4 min,95%B;10.4~10.5 min,95~10%B;10.5~13 min,10%B,负离子模式:0~0.2 min,10%~25%B;0.2~4 min,25%~40%B;4~4.1 min,40%~70%B;4.1~6 min,70%~77%B;6~6.1 min,77%~10%B;6.1~8 min,10%B。
1.6 质谱条件
AB SCIEX X500R QTOF高分辨四级杆串联飞行时间质谱仪的质谱数据是采用信息依赖扫描(information-dependent acquisition,IDA)模式在正、负2种离子模式下获得的。在正离子模式下,涡轮喷雾离子源参数:雾化气50.0 psi;燥气50.0 psi;气帘气35.0;离子源温度550.0 ℃。TOF-MS参数:扫描范围100~800 Da;离子源电压5 500.0 V;去簇电压(80±40)V;累积时间0.1 s。IDA参数:最大候选离子数10;触发二级碎裂扫描的离子强度阈值10 cps;动态背景扣除;质荷比误差范围50 mDa。TOF-MS-MS参数:扫描范围 50~800 Da;碰撞电压(40±20) V;累积时间0.05 s。在负离子模式下,离子源电压4 500.0 V;离子源温度450.0 ℃,其他参数与正离子模式相同。
1.7 数据分析
根据AB SCIEX OS与AB LibraryView 1.3.1软件结合进行生物活性成分筛查鉴定:首先基于每种生物活性成分的前体离子质量对柠檬提取物进行靶向筛查,对于符合的物质(前体离子质量偏差在±5 mg/L),再比较柠檬提取物与标准品混合溶液的提取离子流图中对应参照标准品的保留时间是否一致,若一致,最后再将其二级质谱碎片离子信息与本文构建的质谱数据库进行匹配,匹配成功即可确定柠檬提取样品中含有该种化合物。
2 结果与分析
2.1 生物活性成分质谱数据库的建立
本试验对每一种生物活性成分的标准品进行IDA模式扫描,并利用LibraryView 1.3.1软件构建了含有46种类黄酮、29种香豆素、10种酚酸、7种生物碱和3种类柠檬苦素在内的95种生物活性成分的质谱数据库,其包含了每种生物活性成分的分子式、结构式、CAS号、离子模式、碰撞能量、精确质量与二级质谱碎片离子谱图等信息(附表1,https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=CAPJLAST&filename=SPFX20201113001)。此数据库可根据靶向筛查目标物的变化来进行扩展应用,同时为非靶向生物活性成分的筛查技术奠定基础。
2.2 仪器参数与条件优化
2.2.1 质谱条件优化
本试验在正、负离子模式下分别对95种生物活性成分进行前体离子扫描,确定其最佳的离子模式。结果显示,负离子模式适用于酚酸、个别香豆素以及部分类黄酮,正离子模式适用于其他物质。
2.2.2 液相条件优化
多类型生物活性成分同时分析的关键点主要在于异构体的分离和色谱洗脱时间的缩短。本实验考察了0.01%甲酸水-甲醇、0.01%甲酸水-乙腈、0.1%甲酸水-甲醇和0.1%甲酸水-乙腈4种流动相体系对目标物的分离和离子化效率的影响。结果表明,在0.1%甲酸水-乙腈体系下,离子化和异构体的分离效果更好。
本试验目标化合物中包含22对同分异构体,它们具有相似的分子结构,甚至部分二级质谱的特征离子碎片也基本相同,如香蜂草苷和枸橘苷,分子式均为C18H34O14,前体离子质量为595.20 Da,且二级特征离子碎片也均为287.09、153.02、195.03、161.06,等度洗脱下两者很难完全分离,故需要采用色谱梯度洗脱并进行优化。优化结果见1.5,正离子模式下共有78种物质(包括19对同分异构体)在11 min内有效分离(图1-A),负离子模式下共有39种物质(包括6对同分异构体)在6 min内有效分离(图1-E)。其中5-羟基-7,3′,4′-三甲氧基黄酮与5-羟基-7,8,4′-三甲氧基黄酮、牡荆素与异牡荆素这两对同分异构体未能有效分离开,第一对同分异构体的二级碎片离子相差较大,因此可根据其二级碎片离子的差异性来进行区分。但第二对同分异构体的二级碎片离子相差不大,故无法准确将其区分,因此将此对异构体视为具有C21H20O10结构的化合物,命名为牡荆素与异牡荆素及其异构体。
2.3 柠檬样品中生物活性成分的筛查鉴定
6种柠檬样品的果皮、果肉与果汁提取物中生物活性成分的鉴定结果如附表1所示。从图1可以看出,扁红柠檬果皮、果肉与果汁提取物的提取基峰离子流图的不同峰位置的响应值相差较大,这说明在扁红柠檬不同部位中含量高的生物活性成分不尽相同。
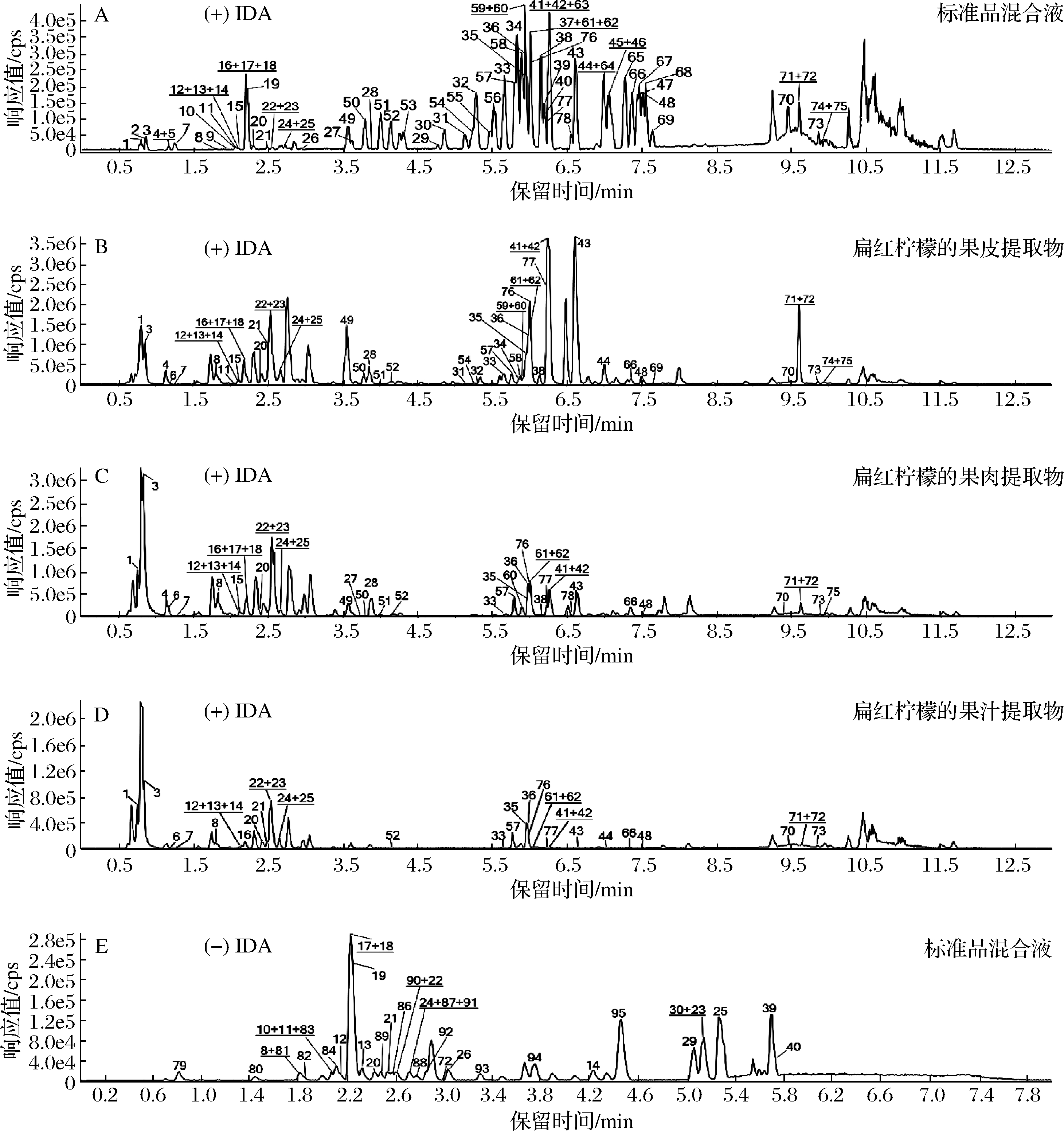
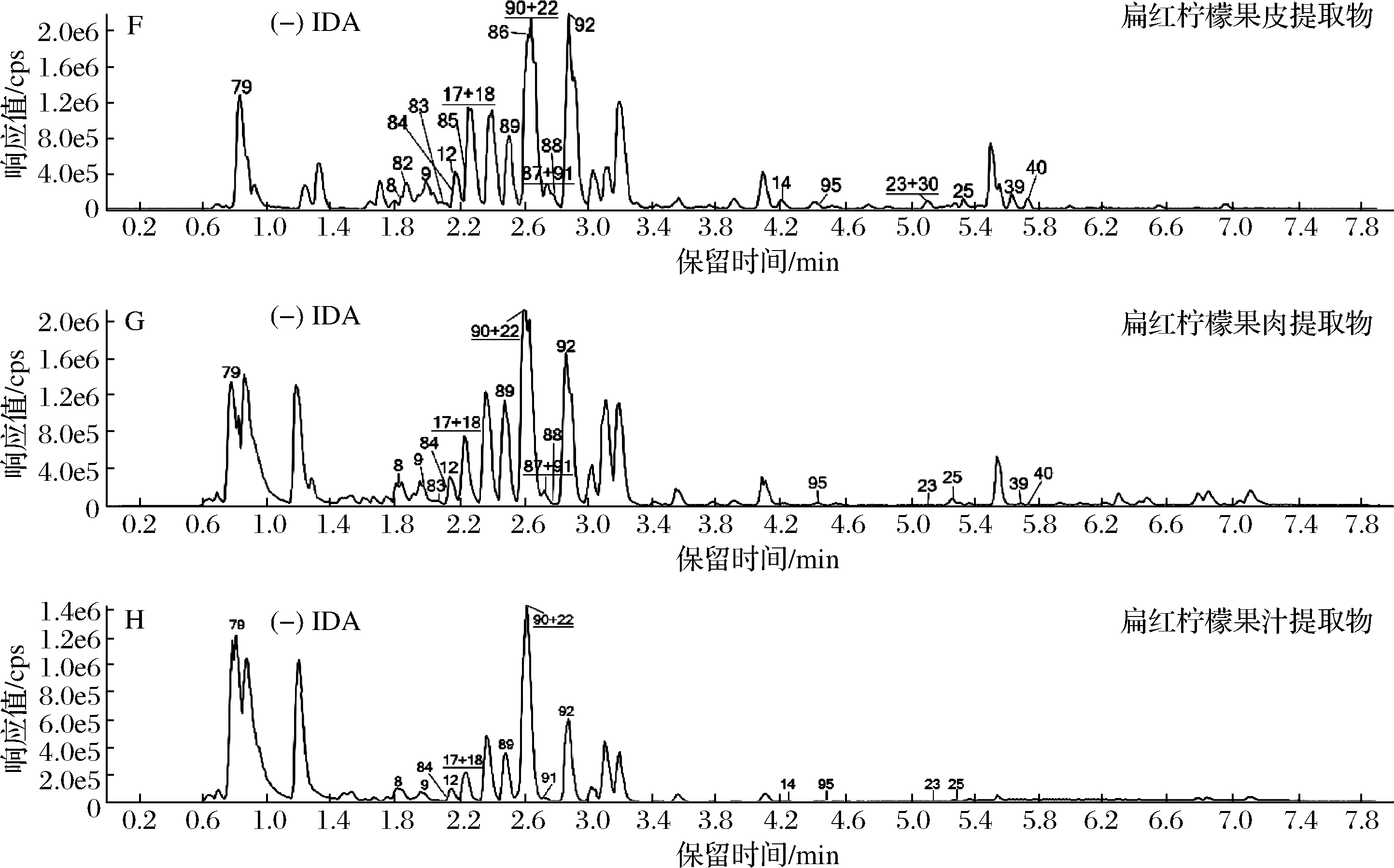
A~D:正离子模式;E~H:负离子模式
图1 标准品混合液和扁红柠檬在正、负离子模式下的提取基峰离子流图
Fig.1 Base peak chromatograms (BPC) of the mixed standards and Bianhongningmeng in positive and negative ion mode
2.3.1 类黄酮的筛查鉴定
类黄酮是柑橘类水果中最常见的一类生物活性成分[22]。现以化合物41为例来阐述类黄酮的鉴定过程。化合物41在6.27 min存在m/z 403.138 7[M+H]+的前体离子,其特征离子碎片如图2-A所示,分别有m/z 373.090 6[M+H-CH3]+与m/z 388.115 9[M+H-2CH3]+等碎片离子,基于与质谱数据库中参照标准品保留时间以及碎片离子的比对,化合物48被鉴定为川陈皮素。

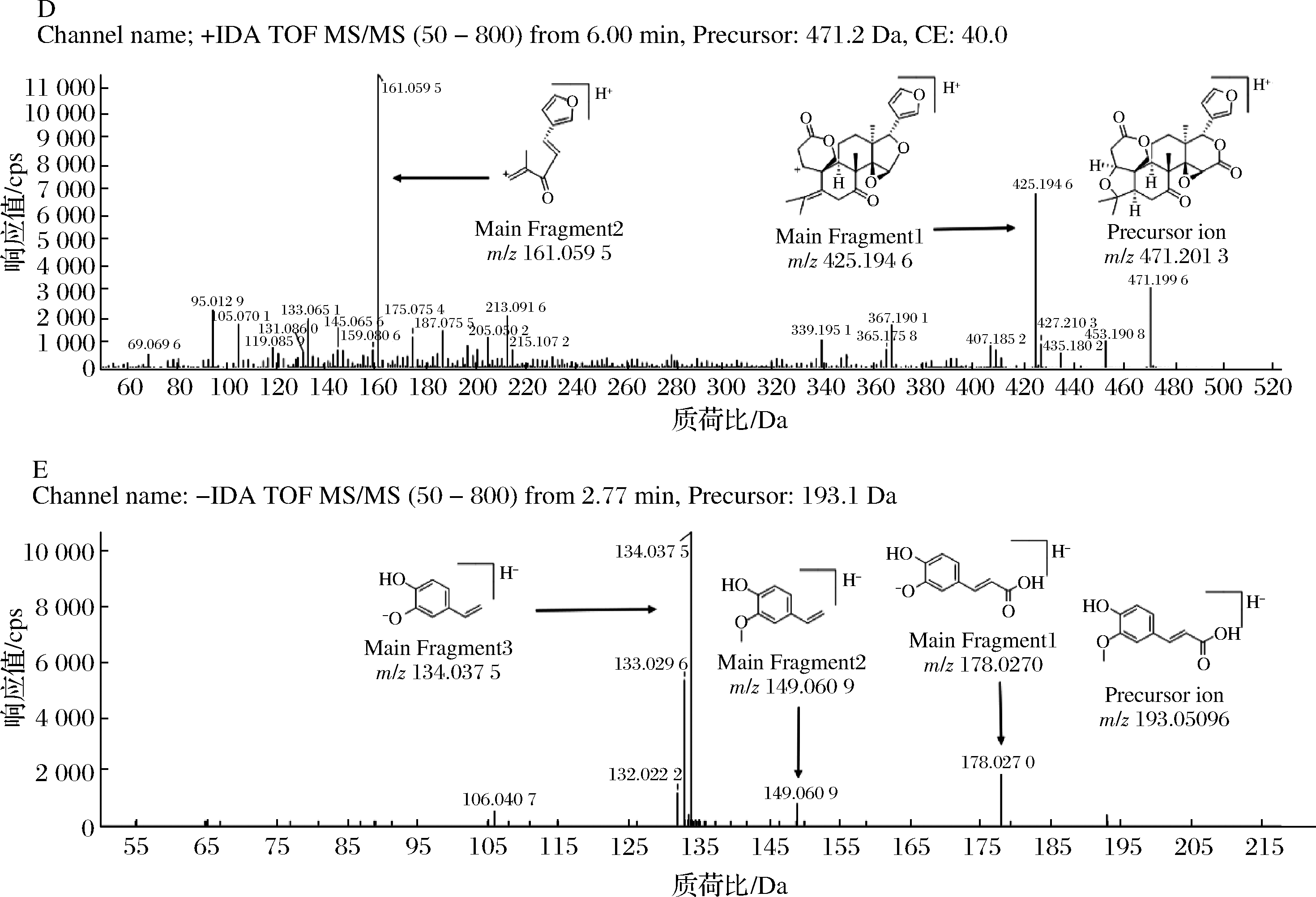
A-化合物41;B-化合物58;C-化合物3;D-化合物76;E-化合物88
图2 五个化合物的二级质谱图和碎片离子信息
Fig.2 Mass/mass spectrum and fragmentation ion information of 5 compounds
对于有相同m/z 373.128 2[M+H]+前体离子的异构体化合物33、36和43来讲,可根据其出峰先后顺序(图3),即保留时间的差异来区分,并与参照标准品比对来确定化合物33、36和43分别为异甜橙黄酮、甜橙黄酮和桔皮素。

图3 扁红柠檬果皮样品中提取的m/z 373.128 2[M+H]+的 XIC 离子流色谱图
Fig.3 Extracted ion chromatograms of XIC traces of m/z 373.128 2[M+H]+ in the peel extract of Bianhongningmeng
注:化合物33异甜橙黄酮在5.67 min出峰;化合物36甜橙黄酮在5.98 min出峰;化合物43桔皮素在6.63 min出峰
6种柠檬中筛查鉴定到的类黄酮数量排序如下:扁红柠檬(35种)>北京柠檬(33种)>美国粗柠檬(32种)>柯尔提粗柠檬(31种)>里斯本=尤力克(29种),对于不同部位筛查鉴定到的类黄酮数量呈以下规律:果皮≥果肉≥果汁。如附表1所示,橙皮苷、芦丁、川陈皮素、新西兰牡荆苷与牡荆素-2-O-鼠李糖苷等24种类黄酮在6种柠檬中均可检出,而香蒲新苷、新北美圣草苷、枸橘苷、金合欢素与新橙皮苷仅在扁红柠檬中检出,栎精-3,7,3′,4′-四甲醚和异鼠李素-3-O-新橙皮糖苷分别仅在北京柠檬果皮与尤力克柠檬果皮中检出,5-羟基-7,8,4′-三甲氧基黄酮仅在柯尔提粗柠檬、美国粗柠檬和北京柠檬3种中检出,5,6,7,3′,4′,5′-六甲氧基黄酮仅在扁红柠檬、尤力克和北京柠檬3种中检出。半齿泽兰素-5-甲基醚和5,7,3′,4′-四甲氧基黄酮在扁红柠檬、柯尔提粗柠檬、美国粗柠檬和北京柠檬4种中检出,香蜂草苷仅在里斯本、柯尔提粗柠檬、美国粗柠檬和北京柠檬4种中检出。柚皮苷在扁红柠檬、柯尔提粗柠檬、美国粗柠檬、里斯本与北京柠檬5种中检出,新地奥司明在扁红柠檬、柯尔提粗柠檬、美国粗柠檬、里斯本与尤力克柠檬5种中检出,甲基橙皮苷在柯尔提粗柠檬、美国粗柠檬、里斯本、尤力克和北京柠檬5种中检出,而柚皮苷在尤力克柠檬、新地奥司明在北京柠檬和甲基橙皮苷在扁红柠檬中均未检出。柠檬果实中的类黄酮主要以黄烷酮为主[23],柚皮素、橙皮苷及圣草次苷等黄烷酮在6种柠檬中均能检出,而有关柠檬中PMFs的研究较少,仅有少量文献报道[5, 24]在柠檬中鉴定出川陈皮素、桔皮素及甜橙黄酮等PMFs,其中川陈皮素、桔皮素、甜橙黄酮和4′,5,7,8-四甲氧基黄酮等PMFs在本试验柠檬样品中均能检出。
2.3.2 香豆素的筛查鉴定
香豆素是一种具有氧杂环基本结构的天然产物,试验表明,大多数香豆素的加合离子为[M+H]+,其主要通过丢失CH3(15 Da)、CO(28 Da)、2CO(56 Da)等基团来产生碎片离子[25]。如化合物58在 5.89 min时产生m/z 217.049 5[M+H]+的前体离子,其二级特征离子碎片分别为m/z 202.025 9[M+H-CH3]+、m/z 174.031 6[M+H-CH3-CO]+与m/z 146.036 8[M+H-CH3-2CO]+(图2-B)。化合物58与质谱数据库中佛手柑内酯标准品的保留时间和二级质谱碎片离子基本一致,即可确认其为佛手柑内酯。
从6种柠檬中筛查鉴定到的香豆素数量排序如下:尤力克(25种)>柯尔提粗柠檬=北京柠檬(23种)>里斯本(22种)>扁红柠檬(20种)>美国粗柠檬(15种),柠檬果皮、果肉与果汁中筛查到的香豆素数量呈依次递减趋势。附表1所示,橙皮内酯水合物、滨蒿内酯与佛手柑内酯等11种香豆素在6种柠檬中均检出,除异补骨脂素和花椒毒素外,其他27种香豆素在6种柠檬中均有检出。补骨脂素和6′,7′-环氧香柠檬亭仅在扁红柠檬果皮中检出,花椒毒醇仅在尤力克柠檬果皮中检出,欧前胡素仅在里斯本和尤力克柠檬两种中检出,8-氧甲基异欧前胡内酯仅在柯尔提粗柠檬、尤力克和北京柠檬3种中检出,异欧前胡素仅在柯尔提粗柠檬、里斯本、尤力克和北京柠檬4种中检出。异紫花前胡内酯在扁红柠檬、柯尔提粗柠檬、美国粗柠檬、尤力克和北京柠檬5种中检出,橙皮内酯、8-(牻)牛儿醇基补骨脂素、香柠檬亭、5-香叶氧基-7-甲氧基香豆素、东莨菪内酯与香柑醇在扁红柠檬、柯尔提粗柠檬、里斯本、尤力克和北京柠檬5种中均可检出,白当归素、氧化前胡素与珊瑚菜素在美国粗柠檬、柯尔提粗柠檬、里斯本、尤力克和北京柠檬5种中检出。
2.3.3 生物碱的筛查鉴定
生物碱是一类存在于芸香科柑橘属植物中的含氮化合物[26]。在本实验条件下,化合物3在0.87 min时被快速洗脱,存在m/z 168.101 9[M+H]+的前体离子,其特征碎片离子m/z 150.091 3[M+H-18]+ 由前体离子丢失H2O(18 Da)得到,在其基础上丢失—CH3(15 Da)得到碎片离子m/z 135.067 5[M+H-18-15]+,m/z 107.049 0[M+H-18-15-28]+与m/z 77.038 5[M+H-18-15-28-30]+均为其碎片离子(图2-C)。基于保留时间和碎片离子与质谱数据库中参照标准品的相似性,化合物3被确认为辛弗林。
从附表1可以看出,北京柠檬果皮中筛查鉴定到的生物碱最多,为辛弗林、苯肾上腺素、甜菜碱、章鱼胺、酪胺和N-甲基酪胺6种生物碱,但果肉与果汁中仅筛查到甜菜碱、章鱼胺、酪胺和N-甲基酪胺4种生物碱。扁红柠檬、柯尔提粗柠檬和美国粗柠檬的果皮、果肉与果汁中均可筛查鉴定甜菜碱、辛弗林、苯肾上腺素、N-甲基酪胺及大麦芽碱5种生物碱。里斯本与尤力克柠檬中筛查鉴定到的生物碱最少,果皮中为甜菜碱与N-甲基酪胺,果肉与果汁中仅鉴定到甜菜碱。
2.3.4 类柠檬苦素的筛查鉴定
类柠檬苦素主要以糖甙和甙元2种形态存在[27-28],是一类高度氧化的四环三萜类植物次生代谢物质[29],柠檬苦素、诺米林和黄柏酮是存在于柠檬中最主要的3种。现以化合物76为例,其在6.00 min时产生m/z 471.201 3[M+H]+前体离子,如图2-D所示,在m/z 161.059 5[M+H-310]+和m/z 425.194 6[M+H-46]+产生较强的二级特征碎片离子,其中m/z 425.194 6[M+H-46]+是由前体离子丢失CO(28 Da)和H2O(18 Da)得到。通过与质谱数据库中参照标准品的保留时间和碎片离子的比对,确认化合物76为柠檬苦素。结果表明,3种类柠檬苦素的碎片离子信息均与先前文献报道相符[30-31]。
6种柠檬的果皮、果肉与果汁中均可筛查鉴定到柠檬苦素和诺米林,黄柏酮仅在柯尔提粗柠檬的果皮以及扁红柠檬、柯尔提粗柠檬、美国粗柠檬、里斯本和尤力克柠檬的果肉中检出(附表1)。
2.3.5 酚酸的筛查鉴定
酚酸类化合物系指同一个苯环上有若干个羟基的芳香羧酸类化合物[32]。化合物88在2.77 min时产生m/z 193.050 6[M-H]-前体离子,如图2-E所示,其特征碎片离子分别为m/z 178.027 0[M-H-CH3]-、m/z 149.060 9[M-H-COOH]-与m/z 134.037 5[M-H-CH3-COOH]-,基于与质谱数据库中参照标准品的保留时间和碎片离子的比对,确认化合物88为阿魏酸。
从附表1可看出,D-(-)-奎宁酸、对羟基苯甲酸、咖啡酸、香草酸、对香豆酸与阿魏酸在6种柠檬中均可检出。绿原酸仅在扁红柠檬果皮中检出,原儿茶酸仅在柯尔提粗柠檬、美国粗柠檬、里斯本和北京柠檬4种中检出,芥子酸在扁红柠檬、美国粗柠檬、柯尔提粗柠檬、里斯本与尤力克柠檬5种中均可检出。
3 结论
本试验在6种柠檬中共检出40种类黄酮,27种香豆素,9种酚酸、7种生物碱和3种类柠檬苦素,而有5种类黄酮(7,8,3′,4′-四甲氧基黄酮、5-羟基-7,3′,4′-三甲氧基黄酮、斯皮诺素、根皮苷与根皮素)、2种香豆素(异补骨脂素与花椒毒素)与1种酚酸(没食子酸)在6种柠檬中均未检出。从6种柠檬样品的筛查结果(附表1)可以看出,其品种差异和组织差异明显。香蒲新苷、新北美圣草苷、枸橘苷、金合欢素(果皮与果肉)、新橙皮苷、补骨脂素(果皮)、6′,7′-环氧香柠檬亭(果皮)与绿原酸(果皮)仅在扁红柠檬中检出;异鼠李素-3-O-新橙皮糖苷与花椒毒醇仅在尤力克柠檬果皮中检出;章鱼胺、酪胺、栎精-3,7,3′,4′-四甲醚(果皮)仅在北京柠檬中检出。以上这些仅能在单个品种检测到的目标物,可视为区分其他5种柠檬的特征成分,为筛查不同品种柠檬差异代谢物、品种选育和功能食品开发提供参考。
基于本研究构建的柑橘生物活性成分质谱数据库,利用UPLC-QTOF-HRMS技术,建立了同时快速准确筛查鉴定93种多类型生物活性成分的新方法,并应用于实际柠檬样品检测分析。该方法具有良好的选择性,可准确鉴定21对同分异构体。质谱数据库中的生物活性成分有86种均能在6种柠檬样品中检出,且不同品种、不同部位的生物活性成分差异明显。该方法具有通用性,适用于柑橘类水果中生物活性成分的快速筛查鉴定。
[1] 涂勋良. 四川安岳8个柠檬品种果实主要有机组分分析研究[D].雅安:四川农业大学, 2016.
TU X L.Study on analysis of main organic components in fruits of eight Lemon (Citrus limon Lindl.) cultivars from Anyue county[D].Yaan:Sichuan Agricultural University, 2016.
[2] KHAN M K, HUMA Z E, DANGLES O.A comprehensive review on flavanones, the major citrus polyphenols[J].Journal of Food Composition and Analysis, 2014, 33(1):85-104.
[3] YU H, WANG C, DENG S T, et al.Optimization of ultrasonic-assisted extraction and UPLC-TOF/MS analysis of limonoids from lemon seed[J].LWT-Food Science and Technology, 2017, 84:135-142.
[4] GONZ LEZ-MOLINA E, DOM
LEZ-MOLINA E, DOM NGUEZ-PERLES R, MORENO D A, et al.Natural bioactive compounds of citrus limon for food and health[J].Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2):327-345.
NGUEZ-PERLES R, MORENO D A, et al.Natural bioactive compounds of citrus limon for food and health[J].Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2):327-345.
[5] 郑洁, 赵其阳, 张耀海, 等.超高效液相色谱法同时测定柑橘中主要酚酸和类黄酮物质[J].中国农业科学, 2014, 47(23):4 676-4 687.
ZHENG J, ZHAO Q Y, ZHANG Y H, et al Simultaneous determination of main flavonoids and phenolic acids in citrus fruit by ultra performance liquid chromatography[J].Scientia Agricultura Sinica, 2014, 47(23):4 676-4 687.
[6] 张阿敏, 祝爱艳.高效液相色谱-质谱检测赣南脐橙幼果中酚酸[J].食品科技, 2017, 42(9):280-283.
ZHANG A M, ZHU A Y.Determination of phenolic acids in Gannan navel orange young fruit by high performance liquid chromatography-mass spectrometry[J]. Food Science and Technology, 2017, 42(9):280-283.
[7] DUGRAND A, OLRY A, DUVAL T, et al.Coumarin and furanocoumarin quantitation in citrus peel via ultraperformance liquid chromatography coupled with mass spectrometry (UPLC-MS)[J]. Journal of Agricultural and Food Chemisty, 2013, 61(45):10 677-10 684.
[8] ZHOU J, YI H, ZHAO Z X, et al.Simultaneous qualitative and quantitative evaluation of Ilex kudingcha C.J.tseng by using UPLC and UHPLC-qTOF-MS/MS[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 155:15-26.
[9] YIN P Y, ZHAO X J, LI Q R, et al.Metabonomics study of intestinal fistulas based on ultraperformance liquid chromatography coupled with Q-TOF mass spectrometry (UPLC/Q-TOF MS)[J].Journal of Proteome Research, 2006, 5(9):2 135-2 143.
[10] LIANG X, ZHANG L, ZHANG X, et al.Qualitative and quantitative analysis of traditional Chinese medicine Niu Huang Jie Du Pill using ultra performance liquid chromatography coupled with tunable UV detector and rapid resolution liquid chromatography coupled with time-of-flight tandem mass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(3):565-571.
[11] WANG Z B, CAO Y Z, GE N, et al.Wide-scope screening of pesticides in fruits and vegetables using information-dependent acquisition employing UHPLC-QTOF-MS and automated MS/MS library searching[J].Analytical and Bioanalytical Chemisity, 2016, 408(27):7 795-7 810.
[12] WANG Z B, CHANG Q Y, KANG J, et al.Screening and identification strategy for 317 pesticides in fruits and vegetables by liquid chromatography-quadrupole time-of-flight high resolution mass spectrometry[J].Analytical Methods, 2015, 7(15):6 385-6 402.
[13] BAI Y, ZHENG Y, PANG W, et al.Identification and comparison of constituents of aurantii fructus and aurantii fructus immaturus by UFLC-DAD-Triple TOF-MS/MS[J].Molecules, 2018, 23(4):803.
[14] XING T T, ZHAO X J, ZHANG Y D, et al.Fast Separation and Sensitive Quantitation of Polymethoxylated Flavonoids in the Peels of Citrus Using UPLC-Q-TOF-MS[J].Journal of Agricultural and Food Chemisty, 2017, 65(12):2 615-2 627.
[15] DASENAKI M E, THOMAIDIS N S.Quality and authenticity control of fruit juices-a review[J].Molecules, 2019, 24(6):1-35.
[16] KE Z, YANG Y, TAN S, et al.Characterization of polymethoxylated flavonoids in the peels of chinese wild mandarin (Citrus reticulata Blanco) by UPLC-Q-TOF-MS/MS[J].Food Analytical Methods, 2016, 10(5):1 328-1 338.
[17] YANG Y, ZHAO X J, PAN Y, et al.Identification of the chemical compositions of Ponkan peel by ultra performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[J].Analytical Methods, 2016, 8(4):893-903.
[18] ZHAO X J, XING T T, LI Y F, et al.Efficient analysis of phytochemical constituents in the peel of Chinese wild citrus Mangshanju (Citrus reticulata Blanco) by ultra high performance liquid chromatography-quadrupole time-of-flight-mass spectrometry[J].Journal of Separation Science, 2018, 41(9):1 947-1 959.
[19] LEDESMA-ESCOBAR C A, PRIEGO-CAPOTE F, LUQUE DE CASTRO M D.Characterization of lemon (Citrus limon) polar extract by liquid chromatography-tandem mass spectrometry in high resolution mode[J].Journal of Mass Spectrometry, 2015, 50(11):1 196-1 205.
[20] ZHAO X J, GUO P M, PANG W H, et al.A rapid UHPLC-QqQ-MS/MS method for the simultaneous qualitation and quantitation of coumarins, furocoumarins, flavonoids, phenolic acids in pummelo fruits[J].Food Chemistry, 2020, 325:126 835.
[21] 朱丽莎, 张静, 张耀海, 等.不同品种甜橙类酚类物质检测及含量差异性研究[J].食品与发酵工业, 2019, 45(10):216-224.
ZHU L S, ZHANG J, ZHANG Y H, et al.Detection and content variation of phenols in different sweet oranges[J].Food and Fermentation Industries, 2019, 45(10):216-224.
[22] 邢天天. 基于UPLC-QTOF-MS的宽皮柑橘和橙果皮化学成分及代谢组学研究[D].重庆:西南大学, 2018.
XING T T.Study on Chemical compositions and metabonomics of the peels of mandarins and oranges by UPLC-QTOF-MS[D].Chongqing:Southwest University, 2018.
[23] PETERSON J J, BEECHER G R, BHAGWAT S A, et al.Flavanones in grapefruit, lemons, and limes:A compilation and review of the data from the analytical literature[J].Journal of Food Composition and Analysis, 2006, 19(Supplement):S74-S80.
[24] XI W P, LU J F, QUN J P, et al.Characterization of phenolic profile and antioxidant capacity of different fruit part from lemon (Citrus limon Burm.) cultivars[J].Journal of Food Science and Technology, 2017, 54(5):1 108-1 118.
[25] YANMEI Z, YIFAN F, XIA W, et al.Rapid identification of coumarins from fructus citri sarcodactylis by UPLC/Q-TOF-MS[J].Natural Product Research, 2015, 29(1):53-58.
[26] 刘伟, 袁洪燕, 张群, 等.柑橘类生物碱辛弗林的研究进展[J].湖南农业科学, 2016(9):101-106.
LIU W, YUAN H Y, ZHANG Q, et al.Research progress of citrus alkaloid synephrine[J].Hunan Agricultural Sciences, 2016(9):101-106.
[27] DA SILVA V P, OLIVEIRA R R, FIGUEIREDO M R.Isolation of limonoids from seeds of carapa guianensis Aublet (Meliaceae) by high-speed countercurrent chromatography[J].Phytochemical Analysis, 2009, 20(1):77-181.
[28] ROY A, SARAF S.Limonoids:Overview of significant bioactive triterpenes distributed in plants kingdom[J].Biological & Pharmaceutical Bulletin, 2006, 29(2):191-201.
[29] 晏敏, 周宇, 贺肖寒, 等.柑橘籽中柠檬苦素及类似物的生物活性研究进展[J].食品与发酵工业, 2018,44(2):290-296.
YAN M, ZHOU Y, HE X H, et al.Research progress on the bioactivity of limonin and its analogues in citrus[J].Food and Fermentation Industries, 2018,44(2):290-296.
[30] 赵希娟, 刘青桥, 邢天天.柑橘种子类柠檬苦素的分析及质谱裂解途径——基于UPLC-Q-TOF-MS的新方法[J].西南大学学报(自然科学版), 2018, 40(11):20-29.
ZHAO X J, LIU Q Q, XING T T.Analysis of limonoids in citrus seeds and their fragmentation pathways——A new method based on UPLC-Q-TOF-MS[J].Journal of Southwest University (Natural Science Edition), 2018, 40(11):20-29.
[31] REN W, LI Y, ZUO R, et al.Species-related difference between limonin and obacunone among five liver microsomes and zebrafish using ultra-high-performance liquid chromatography coupled with a LTQ-Orbitrap mass spectrometer[J].Rapid Communications in Mass Spectrometry, 2014, 28(21):2 292-2 300.
[32] 何雅静,张群琳,谷利伟,等.柑橘中酚酸类化合物及其生物活性与机理的研究进展[J].食品与发酵工业, 2020,46(15):301-306.
HE Y J, ZHANG Q L, GU L W, et al.Research progress on phenolic acids in citrus and their biological activities and mechanisms[J].Food and Fermentation Industries, 2020,46(15):301-306.