食用植物油是人体能量和脂肪酸摄入的重要来源,除此之外,植物油中还含有角鲨烯、植物甾醇、维生素E等多种微量成分,这些脂肪伴随物也是人们日常膳食中的重要组成部分[1-2]。早些年的油脂营养研究多着眼于油脂中脂肪酸组成,片面强调脂肪酸的作用,对油脂中微量脂肪伴随物的重要性认识存在不足[3]。近年来随着生活水平的提高,消费者逐渐开始关注植物油中这些有益微量成分的摄入,以达到健康饮食、膳食平衡的作用[4]。
角鲨烯是一种高不饱的天然萜类化合物,属于脂质不皂化物,具有提高体内超氧化物歧化酶活性、增强机体免疫能力,抗衰老、抗疲劳、抗肿瘤等多种生理机能[5]。植物甾醇是一类以环戊烷多氢菲为骨架的天然醇类化合物[6],具有降低胆固醇、抗癌、防治心血管疾病等功能,被誉为“生命的钥匙”[7]。植物油中最主要的植物甾醇主要是菜籽甾醇、菜油甾醇、豆甾醇和β-谷甾醇等。
植物油中角鲨烯和植物甾醇均属于脂质不皂化成分,目前文献报道植物油中角鲨烯或植物甾醇的测定方法主要有气相色谱法[8-12]、气相色谱-质谱联用法[13]、高效液相色谱法[14-15]、液相色谱-质谱联用法[16-17]等,而且这些已报道的文献中绝大部分还是采用经典的皂化-液液萃取作为前处理方法。而传统的液液萃取法存在操作步骤繁琐,耗时长,易燃易爆有毒试剂消耗多,而且容易乳化导致方法的重现性差。固相萃取(solid phase extraction,SPE)具有操作简便、快速、易于实现自动化、有机试剂用量少、绿色环保等优点,已成为分析领域重要的分析方法。而SPE方法用于植物油中不皂化物净化报道相对较少,本研究采用氢氧化钾-甲醇皂化油脂,用一种反相聚合物为填料的固相萃取小柱同时净化分离不皂化物中角鲨烯和植物甾醇组分,经气相色谱-质谱法检测,分别采用角鲨烷和5α-胆甾烷-3β-醇作为内标来定量分析,该方法操作简便,检测周期短,有机试剂用量少,方法重现性好,准确度高,适合于植物油中角鲨烯和4种植物甾醇含量测定方法推广使用。
1 材料与方法
1.1 仪器与试剂
Agilent 7890A-7000B气质联用仪,美国Agilent公司;固相萃取装置,美国Agilent公司;DC-12-DA氮吹仪,浙江省科学器材进出口有限责任公司;IKA MS3旋涡混合仪,德国IKA公司;Sartorius 万分之一电子天平,北京赛多利斯公司;Milli-Q Gradient 超纯水系统,美国Millipore公司。
角鲨烯标准品(CAS号:111-02-4,纯度≥99.0%),美国Sigma-Aldrich公司;角鲨烷内标(CAS号:111-01-3,纯度≥99.5%),德国Dr.Ehrenstorfer公司;5α-胆甾烷-3β-醇标准品(CAS号:80-97-7,纯度≥95.0%),美国Sigma-Aldrich公司;菜籽甾醇(CAS号:474-67-9,纯度≥98.0%),美国Sigma-Aldrich公司;菜油甾醇(CAS号:474-62-4,纯度≥98.0%),美国Sigma-Aldrich公司;豆甾醇(CAS号:83-48-7,纯度≥98.0%),美国Sigma-Aldrich公司;β-谷甾醇(CAS号:83-46-5,纯度≥98.0%),美国Sigma-Aldrich公司。
甲醇(色谱纯),德国Merck公司;KOH、丙酮、乙酸乙酯(分析纯),国药集团化学试剂有限公司;Oasis HLB固相萃取小柱(500 mg/6mL),美国Waters公司。
1.2 样品来源
花生油1、花生油2、大豆油1、菜籽油2、玉米油、芝麻油,均购自大型超市;花生油3、大豆油2、菜籽油1,均采用实验室小型榨油机现榨获得。
1.3 标准溶液配制
准确称取10 mg角鲨烯、10 mg角鲨烷标准品于10 mL容量瓶中,分别用正己烷定容至刻度,即配成1 000 μ g/mL的角鲨烯标准储备液和1 000 μg/mL的内标角鲨烷标准溶液。分别准确称取10 mg菜籽甾醇、菜油甾醇、豆甾醇、β-谷甾醇、5α-胆甾烷-3β-醇标准品于10 mL容量瓶,用乙酸乙酯定容至刻度,即配成1 000 μg/mL的菜籽甾醇、菜油甾醇、豆甾醇和β-谷甾醇标准储备液及1 000 μg/mL的内标5α-胆甾烷-3β-醇标准溶液。
1.4 样品前处理
分别准确移取25 μL角鲨烷和50 μL 5α-胆甾烷-3β-醇内标于10 mL比色管中,氮气将溶剂吹干,称取0.15 g(精确至0.000 1 g)油样于此比色管,加入2.5 mL 2 mol/L氢氧化钾-甲醇溶液,于70 ℃水浴皂化60 min。趁热取出后,用80%甲醇稀释至10 mL刻度。将HLB小柱(500 mg, 6 mL)装于固相萃取装置上,先加5 mL甲醇,再加5 mL 80%甲醇活化小柱,然后将皂化好的样品溶液上柱,再用5 mL 80%甲醇淋洗小柱,淋洗2次,完全抽干后,底部用10 mL离心管接收洗脱液,加7 mL乙酸乙酯洗脱样品,氮吹干,用1 mL乙酸乙酯复溶,过0.22 μm有机滤膜,用于GC-MS检测,内标法定量。
1.5 色谱及质谱条件
色谱条件:色谱柱:HP-5毛细管柱(30 m×0.25 mm×0.25 μm);载气:高纯氦气(纯度99.999%);柱流量:1.2 mL/min,不分流模式进样;进样口温度:300 ℃;程序升温:160 ℃保持1 min,以15 ℃/min升至280 ℃,保持5 min,然后以5 ℃/min升至300 ℃,最后保持7 min。进样量:1 μL。
质谱条件:电子轰击(EI)离子源,电离能量 70 eV,离子源温度 250 ℃,四级杆温度150 ℃,传输线温度 280 ℃,溶剂延迟 5 min,灯丝电流:100 μA。用全扫描模式对目标化合物进行定性分析,定量分析则采用选择离子监测模式,优化的参数如表1所示,5种目标化物和2种内标化合物的混合标准溶液总离子流图见图1。
表1 五种目标化合物和2种内标化合物的质谱参数
Table 1 MS spectrometry parameters for five target compounds and two internal standard compounds
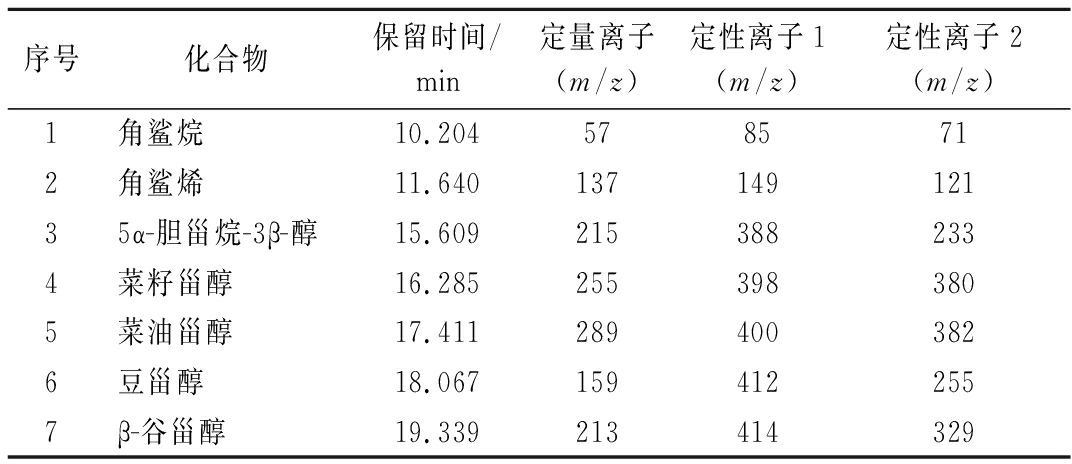
序号化合物保留时间/min定量离子(m/z)定性离子1(m/z)定性离子2(m/z)1角鲨烷10.2045785712角鲨烯11.64013714912135α-胆甾烷-3β-醇15.6092153882334菜籽甾醇16.2852553983805菜油甾醇17.4112894003826豆甾醇18.0671594122557β-谷甾醇19.339213414329
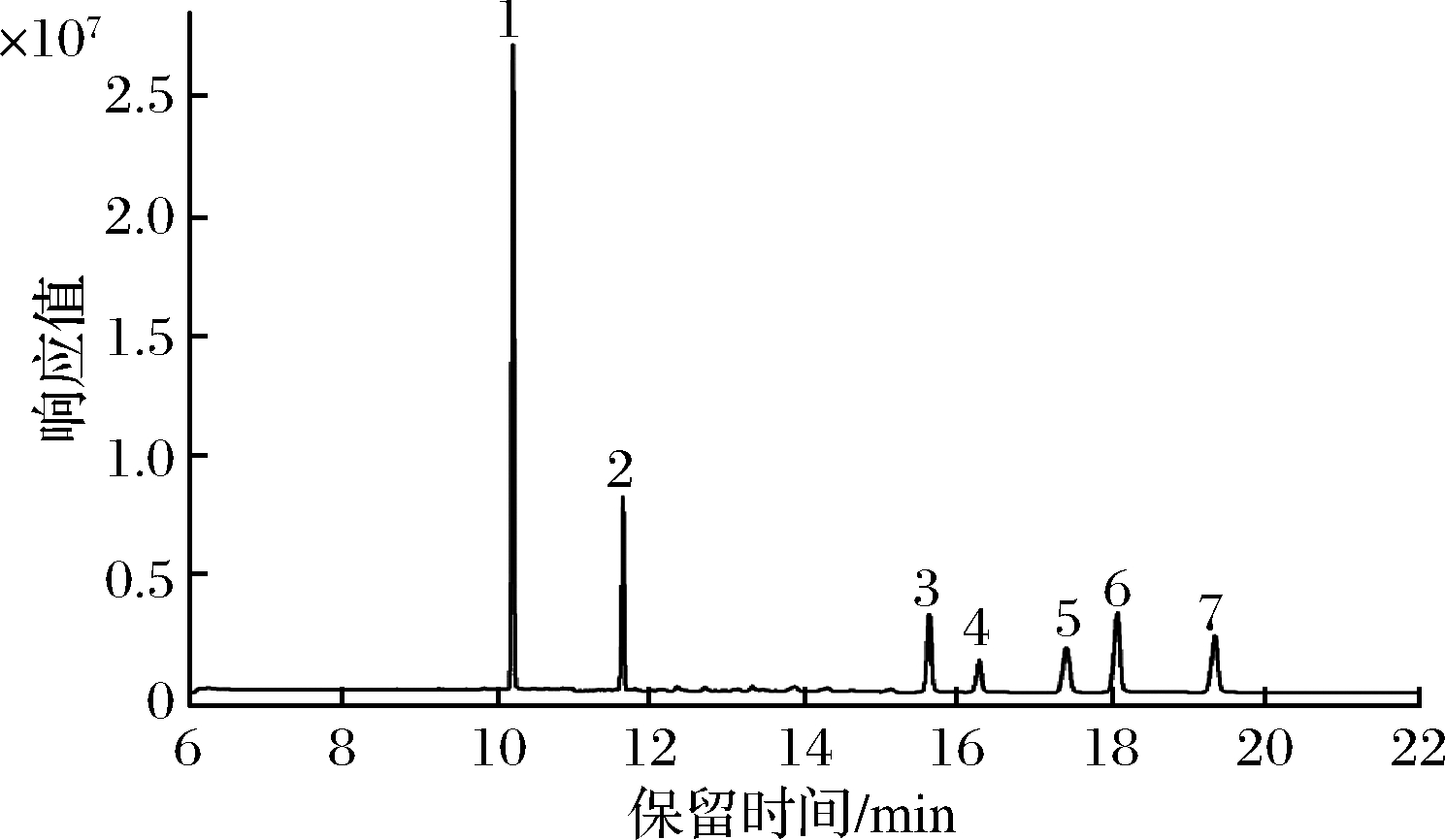
1-角鲨烷(内标);2-角鲨烯;3-5α-胆甾烷-3β-醇(内标);4-菜籽甾醇;5-菜油甾醇;6-豆甾醇;7-β-谷甾醇
图1 角鲨烯和4种植物甾醇的GC-MS色谱图
Fig.1 Gas chromatography-tandem mass spectrometric chromatograms of squalene and four phytosterols
2 结果与分析
2.1 皂化溶液的选择
植物油由皂化物与不皂化物两部分组成,由脂肪酸甘油三酯组成的皂化物部分通常占到整个油脂的98%以上。因此,当需测定植物油中角鲨烯、甾醇等不皂化成分时,通常会采用碱液使油脂中的脂肪酸甘油酯皂化为高级脂肪酸钠和甘油,再通过液液萃取或固相萃取分离去除甘油三酯的干扰。目前国标GB/T 25233—2010动植物油脂 甾醇组成和甾醇总量的测定 气相色谱法及绝大部分文献的皂化液通常采用氢氧化钾-乙醇溶液,而本实验采用氢氧化钾-甲醇溶液皂化,因为和乙醇相比,甲醇具有更强的极性,更低粘度,适合作为下一步反相固相萃取净化步骤中的溶剂。
2.2 固相萃取小柱的选择
角鲨烯和植物甾醇都属于弱极性化合物,适合用反相萃取分离。在优化固相萃取小柱种类时比较了普通C18和反相固相萃取小柱(HLB)2种小柱,实验结果表明,使用普通C18柱净化时,回收率明显偏低,且洗脱溶液混浊,而HLB小柱净化后,回收率为92%~102%且无混浊现象发生(图2)。由于本实验中,油脂皂化后存在大量的无机盐和皂类物质,且溶液碱性较强,具有较高的pH值,超出普通C18柱的pH 2.5~pH 8,导致回收率偏低,甚至填料塌陷而致溶液混浊,而聚合物为填料的反相固相萃取小柱(HLB)在pH 1~pH 14仍很稳定,因此适合选择HLB固相萃取小柱。样品净化前,首先将皂化物用10 mL 80%甲醇稀释,以降低样品的黏度,并将反相萃取柱的起始流动相中V(甲醇)∶V(水)调至最佳比例。样品过柱后,仍用10 mL 80%甲醇淋洗柱中的无机盐及皂类杂质,如果采用更高浓度的甲醇淋洗,则会增加目标化合物洗脱的风险。
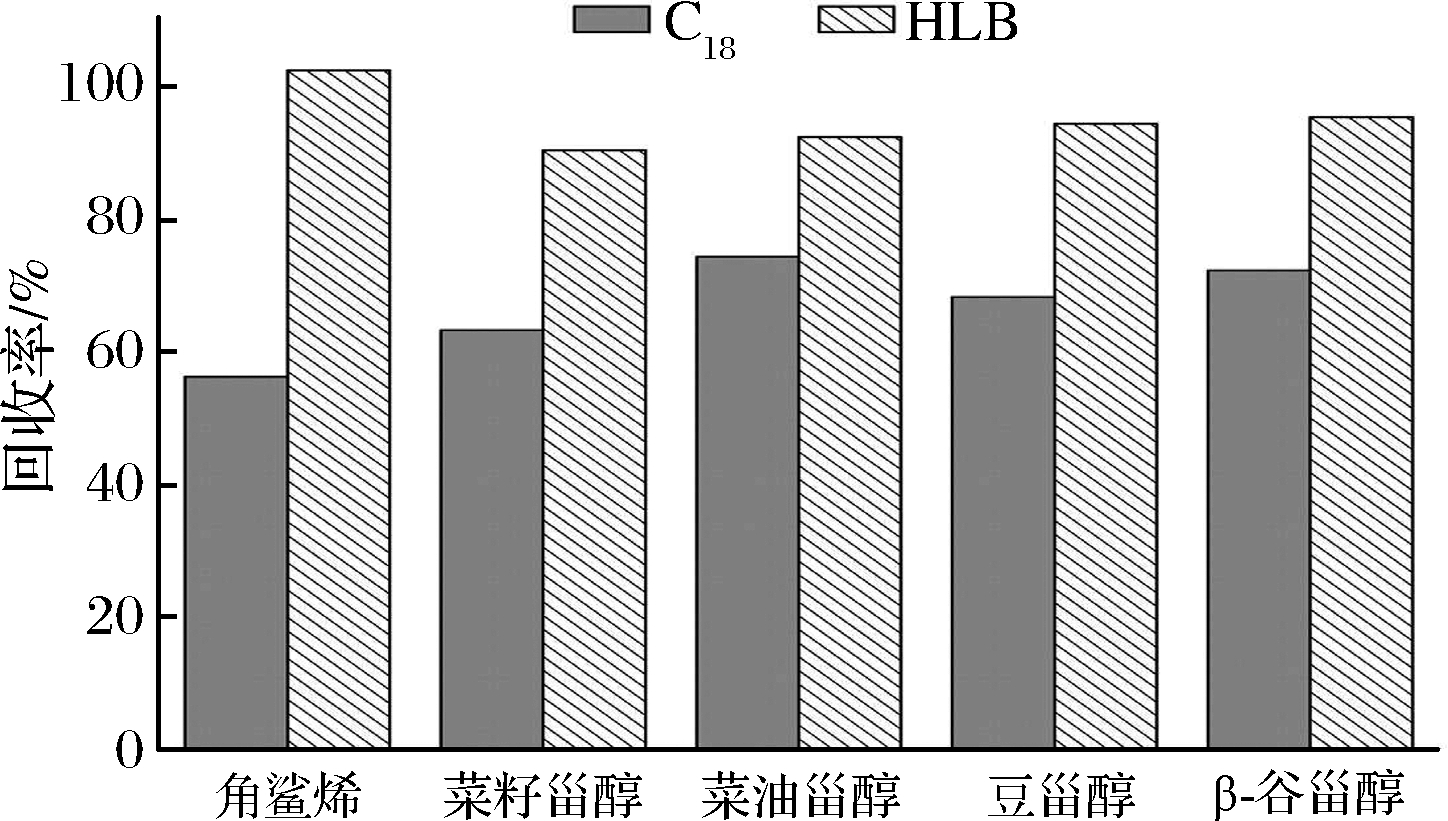
图2 两种固相萃取小柱比较
Fig.2 Effect of two SPE columns on purification efficiencies
2.3 柱容量的选择
比较了HLB(60 mg,3 mL)和HLB(500 mg,6 mL)2种不同容量柱的吸附效果。将1 000 μg/mL的角鲨烯和甾醇混合标液50 μL添加到0.15 g油茶籽油样品中,提取步骤同1.4,考察2种柱容量的加标回收率。结果显示,2种柱容量下,目标化合物的回收率96%~114%,均满足分析要求,但考虑到不同植物油中不皂化物成分及含量差异较大,为确保有足够的柱容量,最终选择500 mg柱容量的HLB小柱作为净化柱。
2.4 洗脱溶剂的选择
通过非极性作用力吸附在固相萃取小柱上的目标化合物,通常采用具有非极性作用的溶剂洗脱。比较了丙酮、乙酸乙酯及丙酮与乙酸乙酯混合液[V(丙酮)∶V(乙酸乙酯)=1∶1]3种洗脱剂的洗脱效果。将1 000 μg/mL的角鲨烯和甾醇混合标液50 μL添加到0.15 g油茶籽油样品中,提取步骤同1.4节,洗脱时分别采用以上3种溶剂洗脱,洗脱体积均为7 mL。结果表明,3种洗脱溶剂均适合于洗脱4种甾醇类化合物,回收率结果为100%~116%,而纯丙酮或添加丙酮的乙酸乙酯洗脱角鲨烯时,回收率明显偏高,纯乙酸乙酯洗脱角鲨烯回收率正常(图3),因此,最终选择乙酸乙酯作为洗脱溶剂。为了将目标化合物充分洗脱下来,同时做了洗脱溶剂体积实验,最终洗脱体积设定为7 mL。

图3 不同洗脱洗溶液脱效果的比较
Fig.3 Effect of different elution solutions on the elution efficiencies
2.5 线性范围、检出限及定量限
分别移取适量的角鲨烯、菜籽甾醇、菜油甾醇、豆甾醇及β-谷甾醇储备液至10 mL容量瓶,同时添加角鲨烷及5α-胆甾烷-3β-醇作为内标,用乙酸乙酯定容至刻度,得到系列标准工作溶液,其中角鲨烯和菜籽甾醇的质量浓度分别为5、10、20、40、80、100 μg/mL,菜油甾醇、豆甾醇和β-谷甾醇的质量浓度分别为10、20、40、80、160、200 μg/mL,内标角鲨烷的质量浓度为25 μg/mL,5α-胆甾烷-3β-醇的质量浓度为50 μg/mL,角鲨烯以角鲨烷为内标,4种甾醇以5α-胆甾烷-3β-醇为内标,分别以目标化合物与内标物的峰面积之比对浓度作图,得到各种目标化合物的内标曲线。结果显示,角鲨烯、菜籽甾醇在5~100 μg/mL,菜油甾醇、豆甾醇和β-谷甾醇在10~200 μg/mL质量浓度范围内标曲线具有良好的线性,相关系数r均大于0.998。以信噪比S/N=3和信噪比S/N=10计算检出限(LOD)和定量限(LOQ),结果见表2,检出限可达0.30 mg/kg,定量限可达1.13 mg/kg。
2.6 回收率与相对标准偏差
称取油茶籽油样品20份,其中2份做本底,其他18份分成3组(每组6份),分别按低、中、高3个水平添加50、250、500 mg/kg,分别添加25 μL 1 000 μg/mL角鲨烷和50 μL 1 000 μg/mL 5α-胆甾烷-3β-醇作内标,经净化后进行测定,计算方法的回收率和标对标准偏差(RSD),结果见表2。结果显示,在上述3个加标水平下该方法的回收率为91%~107%,RSD为1.2%~7.2%,均满足GB/T 27404—2008附录F[18]的要求。
表2 角鲨烯及4种甾醇的添加回收率、相对标准偏差(n=6)、回归方程、相关系数、检出限和定量限
Table 2 Recoveries, relative standard deviations, regression equations, correlation coefficients, limits of detection(LODs) and limits of quantification(LOQs) of squalene and four phytosterols
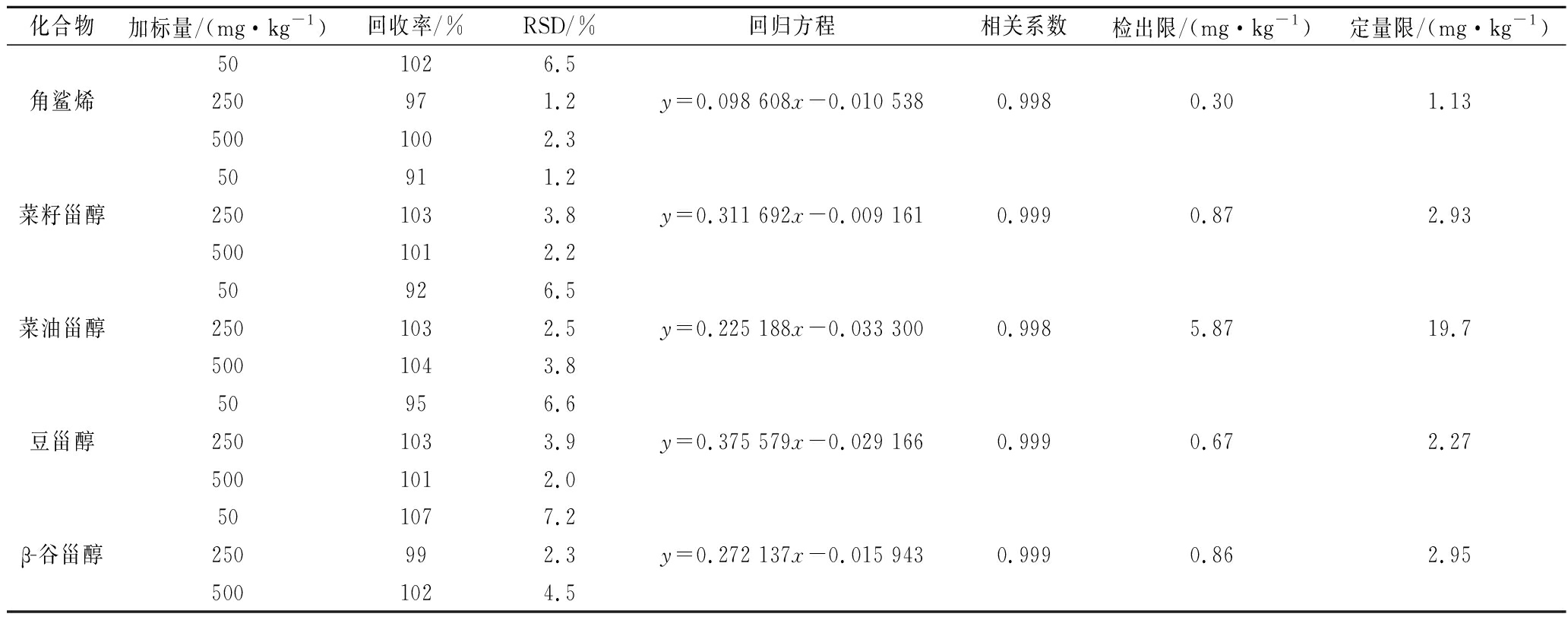
化合物加标量/(mg·kg-1)回收率/%RSD/%回归方程相关系数检出限/(mg·kg-1)定量限/(mg·kg-1)501026.5角鲨烯250971.2y=0.098 608x-0.010 5380.9980.301.135001002.350911.2菜籽甾醇2501033.8y=0.311 692x-0.009 1610.9990.872.935001012.250926.5菜油甾醇2501032.5y=0.225 188x-0.033 3000.9985.8719.75001043.850956.6豆甾醇2501033.9y=0.375 579x-0.029 1660.9990.672.275001012.0501077.2β-谷甾醇250992.3y=0.272 137x-0.015 9430.9990.862.955001024.5
2.7 实际样品的测定
应用建立的方法对5种常见食用植物油中角鲨烯和4种植物甾醇进行了分析,结果见表3。
表3 五种植物油样品中角鲨烯和4种植物甾醇的检测结果 单位:mg/kg
Table 3 Detection results of squalene and four phytosterols in five vegetable oils
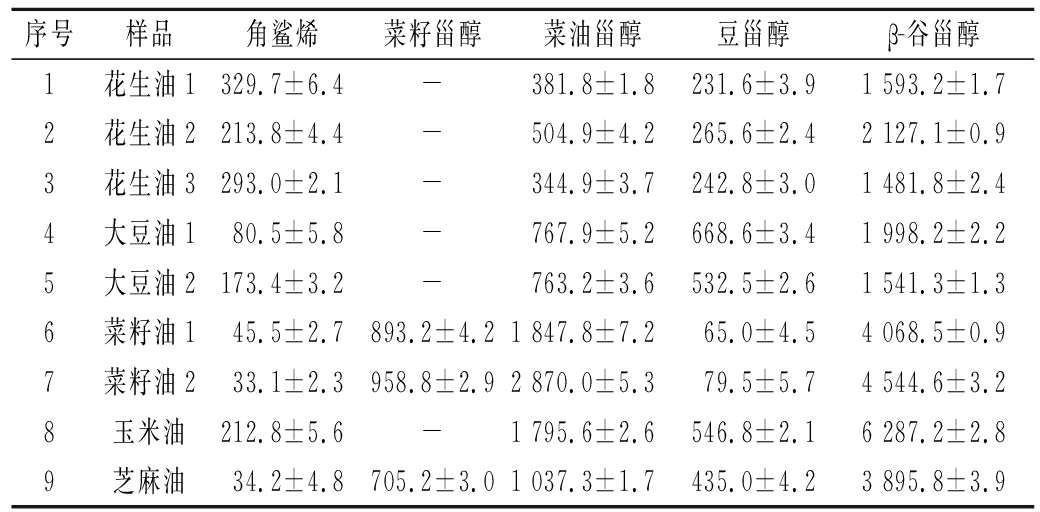
序号样品角鲨烯菜籽甾醇菜油甾醇豆甾醇β-谷甾醇1花生油1329.7±6.4-381.8±1.8231.6±3.91 593.2±1.72花生油2213.8±4.4-504.9±4.2265.6±2.42 127.1±0.93花生油3293.0±2.1-344.9±3.7242.8±3.01 481.8±2.44大豆油180.5±5.8-767.9±5.2668.6±3.41 998.2±2.25大豆油2173.4±3.2-763.2±3.6532.5±2.61 541.3±1.36菜籽油145.5±2.7893.2±4.21 847.8±7.265.0±4.54 068.5±0.97菜籽油233.1±2.3958.8±2.92 870.0±5.379.5±5.74 544.6±3.28玉米油212.8±5.6-1 795.6±2.6546.8±2.16 287.2±2.89芝麻油34.2±4.8705.2±3.01 037.3±1.7435.0±4.23 895.8±3.9
注:“-”表示未检测到或低于检出限
由表3可知,5种常见食用植物油均含有角鲨烯成分,但原料种类不同,角鲨烯含量差异较大。而对于4种植物甾醇成分,5种油中均含菜油甾醇、豆甾醇和β-谷甾醇,且β-谷甾醇为主要成分,占甾醇总量的50%以上,玉米油中β-谷甾醇最高。此外,仅菜籽油和芝麻油中含有菜籽甾醇成分,测定结果与文献报道一致[13, 19]。目前,5种常见食用植物油国家标准中,仅玉米油国家标准中把甾醇总量纳入了食用油等级和真假的判定中,而其他4种油均未把角鲨烯和甾醇组分纳入等级及真假评判中,故本文建议结合食用植物油国标中各项指标,把角鲨烯和甾醇组分一同纳入食用油的整体质量评估,这有利于鉴别食用油的优劣与真假。
3 结论
基于SPE和GC-MS技术,建立了一种简单、快速、灵敏的用于分析植物油中痕量角鲨烯和4种植物甾醇的方法。该方法前处理方法平均耗时8 min,平均消耗有机试剂30 mL,5种目标化合物在各自的线性范围内线性良好,相关系数r>0.998,检出限为0.30~5.87 mg/kg,定量限为1.13~19.7 mg/kg,在 50、250、500 mg/kg 3个添标水平下,方法的平均回收率为91%~107%,相对标准偏差小于7.2%。与传统样品前处理方法相比,所建立的新方法具有操作简单、省时省力、灵敏度高,稳定性好,有机溶剂消耗少等优点,适用于植物油中角鲨烯和4种植物甾醇的同时测定。同时,角鲨烯和植物甾醇作为植物油中微量活性成分,在各类植物油中分布差异较大,可作为植物油掺伪鉴定的依据。
[1] 孙佳,胡彦,丁友芳, 等.马鲁拉油与6种植物油理化性质、脂肪酸组成、营养物质比较[J].中国油脂, 2017, 42(2):38-41.
SUN J, HU Y, DING Y F, et al.Comparison of physicochemical properties, fatty acid compositions and nutrient contents between marula oil and six kinds of vegetable oils[J].China Oils and Fats, 2017, 42(2):38-41.
[2] 汪雪芳,杨瑞楠,薛莉, 等.28种功能性食用油脂肪酸组成研究[J].食品安全质量检测学报, 2017(11):256-263.
WANG X F, YANG R N, XUE L, et al.Determination of fatty acid composition of 28 kinds of functional vegetable oils[J]. Journal of Food Safety and Quality, 2017(11):256-263.
[3] 俞乐,黄健花,王兴国, 等.食用植物油中的有益微量伴随物[J].粮食科技与经济, 2018, 43(2):99-101.
YU L, HUANG J H, WANG X G, et al.Beneficial trace concomitants in edible vegetable oils[J].Grain Science and Technology and Economy, 2018, 43(2):99-101.
[4] 刘阳,王春立,曹培让, 等.7种食用植物油物性及氧化稳定性评价[J].中国油脂, 2017, 42 (10):63-68.
LIU Y, WANG C L, CAO P R, et al.Physicochemical properties and oxidative stability evaluation of seven kinds of edible vegetable oils[J].China Oils and Fats, 2017, 42 (10):63-68.
[5] 梁新华,郑彩霞,张风侠.甘草中角鲨烯高效液相色谱法测定[J].时珍国医国药, 2010, 21 (8):1 856-1 857.
LIANG X H, ZHENG C X, ZHANG F X.Extraction and HPLC analysis of the squalene in glycyrrhiza uralensis fisch[J].Lishizhen Medicine and Materia Medica Research, 2010, 21 (8):1 856-1 857.
[6] FATMA C,JABEUR H,LAZZEZ A, et al.Characterization and discrimination of oueslati virgin olive oils from adult and young trees in different ripening stages using sterols, pigments, and alcohols in tandem with chemometrics[J].Journal of Agricultural and Food Chemistry, 2017, 65 (17):3512‐3522.
[7] 贾硕,张帆,周寰, 等.食源性甾醇类化合物生物活性及应用[J].食品工业科技, 2019, 40 (8):316-322.
JIA S, ZHANG F, ZHOU H, et al.Biological activity and application of food-derived sterol components[J].Science and Technology of Food Industry, 2019, 40 (8):316-322.
[8] 张东生,薛雅琳,金青哲, 等.油茶籽油中角鲨烯含量的测定[J].中国油脂, 2013, 38 (11):85-88.
ZHANG D S, XUE Y L, JIN Q Z, et al.Determination of squalene in oil -tea camellia seed oil[J].China Oils and Fats, 2013, 38 (11):85-88.
[9] 钟冬莲,汤富彬,沈丹玉, 等.油茶籽油中角鲨烯含量的气相色谱法测定[J].分析试验室, 2011, 30 (11):104-106.
ZHONG D L, TANG F B, SHEN D Y, et al.Determination of squalene in camellia seed oil by gas chromatography[J].Chinese Journal of Analysis Laboratory, 2011, 30 (11):104-106.
[10] 鲍忠定,许荣年,张颂红.毛细管气相色谱法测定油中植物甾醇和胆固醇[J].分析化学, 2002, 30 (12):1 490-1 493.
BAO Z D, XU R N, ZHANG S H.Determination of phytosterol and cholesterol in oil by capillary gas chromatography[J].Chinese Journal of Analytical Chemistry, 2002, 30 (12):1 490-1 493.
[11] TOIVO J,PHILLIPS K,LAMPI A M, et al.Determination of sterols in foods:recovery of free, esterified, and glycosidic sterols[J].Journal of Food Composition and Analysis, 2001, 14 (6):631-643.
[12] 彭浩,陈文强,邓百万.气相色谱法测定食用菜籽油中植物甾醇的组成及含量[J].安徽农业科学, 2006, 34 (19):4 830-4 831.
PENG H, CHEN W Q, DENG B W.Analysis of the plant sterol component and content of edible rape oil with gas cheromatography[J].Journal of Anhui Agricultural Sciences, 2006, 34 (19):4 830-4 831.
[13] 杨春英,刘学铭,陈智毅, 等.气相色谱-质谱联用法测定14种食用植物油中的植物甾醇[J].中国粮油学报, 2013, 28 (2):123-128.
YANG C Y, LIU X M, CHEN Z Y, et al.Determination of phytosterols of fourteen edible vegetable oils by gas chromatography- mass spectrometry[J].Journal of the Chinese Cereals and Oils Association, 2013, 28 (2):123-128.
[14] YUAN C X, JU Y J, JIN R S, et al.Simultaneous HPLC-DAD analysis of tocopherols, phytosterols, and squalene in vegetable oil deodorizer distillates[J].Chromatographia, 2015, 78 (3-4):273-278.
[15] DEFIGUEIREDO L C, BONAFE E G, MARTINS J G, et al.Development of an ultrasound assisted method for determination of phytosterols in vegetable oil[J].Food Chemistry, 2018, 240:441-447.
[16] ZHANG L X, WANG S J, YANG R N, et al.Simultaneous determination of tocopherols, carotenoids and phytosterols in edible vegetable oil by ultrasound-assisted saponification, LLE and LC-MS/MS[J].Food Chemistry, 2019, 289:313-319.
[17] 彭祖茂,朱丽,邓梦雅, 等.超高效液相色谱-串联质谱同时测定植物油中14种营养成分[J].色谱, 2018, 36 (11):1 140-1 146.
PENG Z M, ZHU L, DENG M Y, et al.Simultaneous determination of 14 nutrients in vegetable oils by ultra high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2018, 36 (11):1 140-1 146.
[18] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范 食品理化检验[S].北京:中国标准出版社, 2008.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 27404—2008 Criterion on quality control of laboratories-chemical testing of food[S].Beijing:China Standards Press, 2008.
[19] 王李平,林晨,方军, 等.凝胶色谱-气相色谱法测定11种动植物油脂中角鲨烯的含量[J].食品工业科技,2015, 36 (6):69-71.
WANG L P, LIN C, FANG J, et al.Determination of squalene in edible oils of plant and animal by gel permeation chromatography - gas chromatography method[J].Science and Technology of Food Industry, 2015, 36 (6):69-71.