农产品中农药残留问题一直倍受政府和公众的关注,虽然我国对食品安全问题(包括蔬菜中农药残留标准)高度重视,但是由于我国蔬菜种植户分散,管理困难,所以仍存在农药使用超范围、非法添加隐性成分、超量使用等问题导致农药残留超标[1]。农药残留超标现象非常严重,在国内外普遍存在[2-4]。大量数据表明,蔬菜和水果中残留的农药种类主要是有机磷和氨基甲酸酯类,其中有机磷农药在当前杀虫剂市场份额中占70%[5]。因此开发快速检测农产品特别是蔬菜和水果中有机磷及氨基甲酸酯类农药的方法具有非常重要的意义。
目前,我国应用比较广泛的快速检测方法是酶抑制法,该法所测样品的前处理要求简单、成本低、检测时间短,非常适合我国小规模分散的销售体系中经常性的现场快速检测,我国也已将该方法列入国家标准。但是经过长期的检测实验发现有些辛辣类的蔬菜,如葱、大蒜、韭菜等无论是用气相色谱法还是酶抑制法均会对检测结果造成假阳性现象[6-7]。尤其是酶抑制法,国标中明确表明葱、蒜、萝卜、韭菜等辛辣蔬菜中含有对酶有影响的植物次生物质,容易产生假阳性[8]。因为这类蔬菜中富含蒜氨酸类物质及其活性酶[9]。当细胞破损后,酶会作用底物产生具有辛辣味的含硫化合物。该硫化物的结构与有机磷、有机氯等农药相似[10],因此对检测结果产生干扰。对于这类蔬菜一方面多采用磷酸处理[11],但这种方法污染环境、造成试剂的浪费,且残留的磷酸会对仪器及结果重复性产生较大影响;另一方面采用整株(体)蔬菜浸提或表面测定法[12],也只能减少而不是消除假阳性干扰。
为了更好地解决辛辣类蔬菜对快速检测中的酶抑制法产生假阳性的问题,并为麦麸酯酶作为植物酶源,在检测使用中提供真实可靠的依据。课题组前期已从麦麸中提取到具有较高活性的麦麸酯酶并对其动力学特性进行了研究[13-14],本文在其研究的基础上对市面上常见的4种辛辣蔬菜进行不同的加热处理,以期能减少或尽可能消除假阳性对检测结果的影响。
1 材料与方法
1.1 材料与试剂
麦麸酯酶,实验室自制;洋葱、香葱、大蒜、青椒,雅安市市售。
有机磷类农药标准品:敌敌畏(液体1.00 mg/mL)、甲基对硫磷(液体1.00 mg/mL)、乐果(液体1.00 mg/mL),农业部环境保护科研监测所;氨基甲酸酯类农药标准品:丁硫克百威(液体1.00 mg/mL)、西维因(固体纯度≥99.8%)、叶蝉散(固体纯度≥99.8%), 农业部环境保护科研监测所;α-乙酸萘酯,上海源叶生物科技有限公司;固兰B盐,上海蓝季科技发展有限公司;其他常用试剂均为分析纯。
农药标准液:6种农药全部配制成10 mg/L的储备液(丙酮),将敌敌畏、叶蝉散、西维因用0.20 mol/L磷酸盐缓冲液(pH 7.2)稀释成0.10、0.25、0.50 mg/L标准溶液;乐果、甲基对硫磷、丁硫克百威用0.20 mol/L磷酸盐缓冲液(pH 7.2)稀释成1.00、1.50、2.00 mg/L标准溶液。
1.2 仪器与设备
CP225D电子天平,德国Sartorius股份公司;HS6150D超声波清洗仪,恒奥科技有限公司;HH-2数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;UV-3100紫外可见分光光度仪计,上海美谱达仪器有限公司;Milli-Q超纯水纯化系统,美国密理博公司。
1.3 实验方法
1.3.1 麦麸酯酶的制备及蔬菜样品的预处理
1.3.1.1 麦麸酯酶的制备
从麦麸中提取麦麸酯酶参考叶麟等[15]的方法。
1.3.1.2 蔬菜的预处理
取香葱、青椒、洋葱和大蒜4种辛辣蔬菜用自来水、蒸馏水分别洗涤3次,放在干燥处并用滤纸片擦干备用。
1.3.2 蔬菜样品提取液的制备
将4种蔬菜样品剪成1 cm2的碎片[16],香葱、大蒜各2 g,青椒、洋葱各4 g放入提取瓶中,加入10 mL 5%(质量分数)磷酸盐缓冲液,使所有的样品都浸在溶液中,超声提取5 min,将上清液用滤纸过滤(青椒需要用0.45 μm滤膜过滤),滤液备用。
1.3.3 样品提取液对酶活性抑制率的测定
麦麸酯酶酶活抑制率的测定参考侯晓艳等[13]的方法,并稍作修改。于试管中加入4.25 mL的样品提取液,再加入0.25 mL麦麸酯酶,混匀后在35 ℃恒温水浴锅中反应30 min。取出试管加入0.25 mL α-乙酸萘酯溶液,40 ℃恒温水浴5 min后加入0.25 mL固兰B盐,再加入0.25 mL表面活性剂摇匀,最后加入20%(体积分数)0.25 mL盐酸溶液摇匀后读取吸光度值A1,作为实验组。用提取液替代样品提取液做为空白对照组A0,其他操作与样品提取液测定方法相同,通过测得的吸光度值计算酶活性抑制率,计算如公式(1)所示:
抑制率![]()
(1)
1.3.4 微波加热处理后样品提取液对酶活性抑制率的影响
准确称取20 g样品(大蒜整个、香葱和青椒整株、洋葱整片)放入100 mL的烧杯中,立即放入微波540 W加热,改变微波时间0、20、40、60、80、100 s,冷却后取出。按照方法1.3.2制备样品提取液,然后按照方法1.3.3测定酶活性抑制率,考察不同微波时间下蔬菜样品提取液对麦麸酯酶抑制率的影响。
1.3.5 水浴加热处理样品提取液对酶活性抑制率的影响
将4种蔬菜样品提取液置于恒温水浴锅中加热1 min,加热温度设置为25、70、80、90、100 ℃,加热后样品提取液冷却到室温,然后按照方法1.3.3测定酶活性抑制率,考察不同加热温度下蔬菜样品提取液对麦麸酯酶抑制率的影响。
1.3.6 样品提取液水浴加热不同时间下对酶活性抑制率的影响
将4种蔬菜样品提取液置于最适温度下的恒温水浴锅中分别加热1、2、3 min后取出冷却,然后按照方法1.3.3测定酶活性抑制率,考察不同加热时间下蔬菜样品提取液对麦麸酯酶抑制率的影响。
1.3.7 不同处理条件下农药标准液对酶活性抑制率的影响
用提取液分别配制成质量浓度为0.5 mg/L的农药标样(敌敌畏、叶蝉散、西维因)和1.0 mg/L的农药标样(乐果、甲基对硫磷、丁硫克百威)。通过上述实验选择最优的蔬菜处理方法,然后将含有农药的提取液在最优条件下处理,按照1.3.3方法测定麦麸酯酶酶活性抑制率,考察农药在此条件下的稳定性。
1.3.8 辛辣蔬菜样品提取液中农药残留检测
根据上述实验结果,选择最优的辛辣蔬菜处理方法。为了保证验证实验的准确性,不采用喷洒的方法,而是直接将农药标准品添加到蔬菜样品提取液中。使经过处理的样品提取液中敌敌畏、叶蝉散、西维因农药质量浓度分别为0.10、0.25、0.50 mg/L,乐果、甲基对硫磷、丁硫克百威质量浓度分别为1.00、1.50、2.00 mg/L作为实验组。同时在未经处理的样品提取液和磷酸盐缓冲液中添加相应的农药作为对照组,按照1.3.3方法进行检测,并计算酶活性抑制率。
1.4 数据分析
除特殊标注外均采用3次平行重复实验,所有实验数据均采用Excel数据处理软件,并采用Origin 9.1进行作图,结果用平均值±标准差表示。并采用SPSS 20.0软件进行相关显著性分析,0.01<P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 微波加热处理后样品提取液对酶活性抑制率的影响
将4种蔬菜样品提取液在540 W下微波处理不同的时间后测定酶活性抑制率,结果如图1所示。微波的作用是使含硫蔬菜中活性酶失活,这样在切碎时就不会产生含硫化合物,大大减少测定干扰。由于香葱的含水量比较少,所以当超过50 s后就会完全失水呈烘干状态,所以只考虑其在0~50 s内对酶活性抑制率的影响。0~20 s时4种辛辣蔬菜对麦麸酯酶的酶活性抑制率均显著下降(P<0.05),其中除大蒜外,其他3种蔬菜在20 s时酶活性抑制率均达到最低,分别为香葱12.97%、青椒33.80%、洋葱16.77%。而大蒜在40~60 s时酶活性抑制率达到最低为6.49%,且40 s和60 s差异不显著(P>0.05)。可能是因为大蒜整瓣的进行微波处理,比较厚,所以处理时间稍微久一点。当各蔬菜样品提取液对酶活性抑制率达到最低后随着微波加热时间的延长又呈现上升的趋势,可能是因为随着微波处理时间继续延长,蔬菜呈疲软状,细胞破碎,汁液流失,加速含硫化合物的生成,最终导致酶活性抑制率升高。除香葱外其余3种蔬菜在80~100 s时又呈下降的趋势,可能是因为微波时间过长,蔬菜严重缺水呈烘干状态,已完全不能食用,促使含硫化合物的酶失活。因此除大蒜微波加热需要40 s外,其他3种蔬菜微波加热20 s,但是该方法对青椒不适用,其最低抑制率仍能达到33%左右。
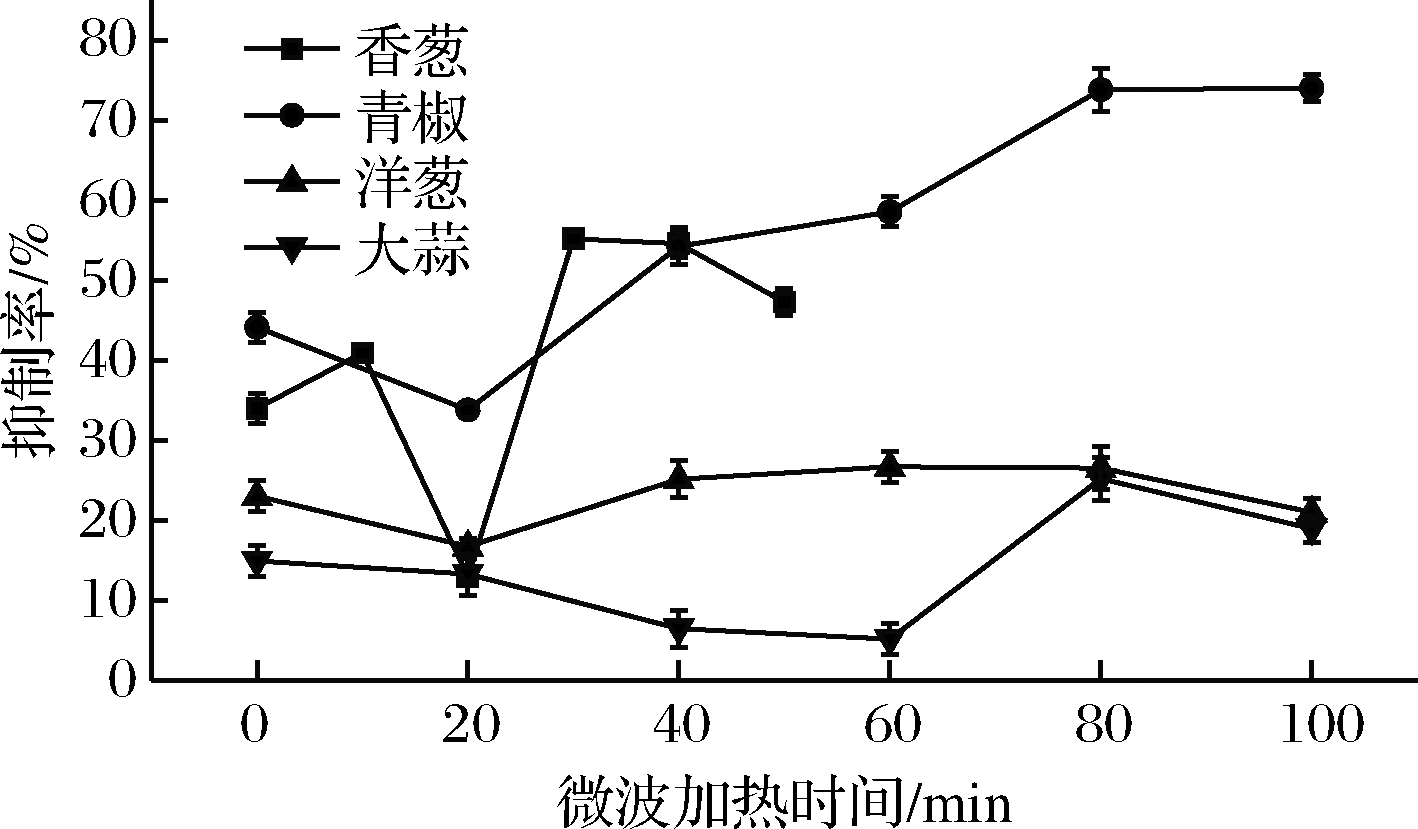
图1 不同微波处理时间对酶活性抑制率的影响
Fig.1 The effect of different microwave processing time on the activity inhibition rate
2.2 水浴加热处理后样品提取液对酶活性抑制率的影响
水浴加热的作用和微波是一样的,均是使辛辣蔬菜中可促使含硫化合物生成的活性酶失活,这样在切碎时就不会产生含硫化合物,大大减少测定干扰。
由图2可知,4种蔬菜样品提取液在25~80 ℃时都会使酶活性抑制率显著降低(P<0.05),在80~90 ℃时除洋葱外,其余3种蔬菜对酶活性抑制率差异不显著(P>0.05);在90~100 ℃时,4种蔬菜对酶活性抑制率差异均不显著(P>0.05)。因此,洋葱样品提取液在90 ℃时可达到消除假阳性效果,其对酶活性抑制率由原来的20.50%降低到2.95%,差异极显著(P<0.01),香葱、青椒、大蒜均在80 ℃时对酶活性抑制率分别由原来的37.06%、50.34%、17.02%降低到12.69%、33.61%、5.79%,差异极显著(P<0.01)。虽然青椒提取液经过加热处理前后对酶活抑制率差异极显著,但是仍比较接近阳性判定值[16],假阳性消除效果不理想,所以除青椒外,使用该方法进行处理对其他3种蔬菜均可达到消除假阳性效果。由图1和图2 可知,这2种方法均可以降低辛辣蔬菜样品提取液对酶活性的抑制作用,而且效果除洋葱外差异不是很大。但是微波加热由于处理时间、蔬菜的不同差异比较大,不容易掌控,而水浴加热是对样品提取液进行处理,所以更容易控制。由于青椒经过微波和水浴处理后,其对酶活性抑制率仍然高达33%左右,说明该方法不能有效消除检测青椒时产生的假阳性。是由于样品本身含有农药残留所造成的假阳性无法消除,还是该方法不适用于青椒还有待进一步研究,因此后续实验中不再将青椒作为分析样品。

图2 不同水浴温度对酶活性抑制率的影响
Fig.2 The effect of different water bath calefaction temperature on the activity inhibition rate
2.3 水浴加热不同时间后样品提取液对酶活性抑制率的影响
从表1可以得出,当加热温度达到一定值时,加热时间对酶活性抑制率的影响差异不显著(P>0.05)。因此,为了操作简便省时,避免残留农药的损失,选择最短加热时间1 min。青椒样品提取液对酶活性抑制率也没有随加热时间的增加而降低,进一步说明该方法不能有效去除青椒对实验结果造成的假阳性影响。
表1 不同处理时间下样品提取液对酶活性抑制率的影响 单位:
Table 1 The effect of different processing time on activity inhibition rate

时间/min香葱青椒洋葱大蒜112.97±1.08a33.61±3.11a2.95±0.72a5.79±2.13a211.06±1.71a34.38±1.66a2.88±1.01a6.49±1.57a311.68±1.93a32.54±2.59a2.57±1.58a6.91±2.41a
注:不同字母表示差异显著(P<0.05)(下同)
2.4 不同温度下加热农药对酶活性抑制率的影响
由表2可知,6种不同浓度的有机磷和氨基甲酸酯类农药分别在水浴温度为80、90 ℃与25 ℃室温条件下测定的酶活性抑制率差异不显著(P>0.05),说明这6种农药在80~90 ℃加热1 min可以保持良好的稳定性。因此,实验前对辛辣蔬菜处理的优化方法不会对残留农药造成损失,可以在实际检测中应用。
表2 不同温度下农药对麦麸酯酶酶活抑制率的影响 单位:%
Table 2 Pesticides at different temperatures on the influence of activity inhibition rate
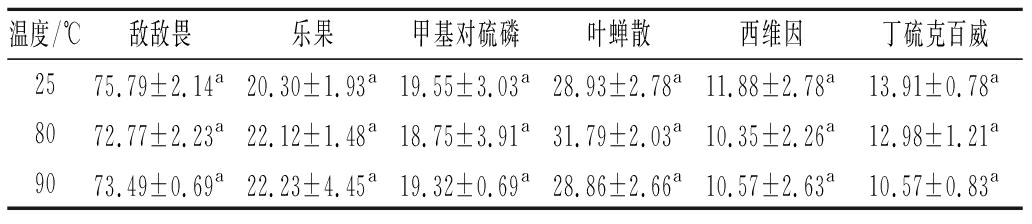
温度/℃敌敌畏乐果甲基对硫磷叶蝉散西维因丁硫克百威2575.79±2.14a20.30±1.93a19.55±3.03a28.93±2.78a11.88±2.78a13.91±0.78a8072.77±2.23a22.12±1.48a18.75±3.91a31.79±2.03a10.35±2.26a12.98±1.21a9073.49±0.69a22.23±4.45a19.32±0.69a28.86±2.66a10.57±2.63a10.57±0.83a
2.5 辛辣蔬菜样品提取液中农药检测
2.5.1 三种蔬菜中添加敌敌畏农药的检测
选定最优的水浴温度作为实验条件,对3种蔬菜添加不同质量浓度的敌敌畏分别进行检测,并以室温条件下的提取液和蔬菜样品提取液中添加相应浓度农药作为参比。由图3可知,含有不同浓度敌敌畏标准液的3种蔬菜样品提取液经过加热处理后对麦麸酯酶抑制率均比未经过加热处理的抑制率低,且与添加不同浓度的提取液对麦麸酯酶的抑制作用没有显著差异。未经过加热处理的样品提取液对麦麸酯酶的抑制率随着农药添加量的增大而增大。在敌敌畏添加浓度较低时,同种蔬菜经过加热处理的抑制率和未经加热处理的抑制率数值差异较大,当农药添加质量浓度达到最大值时(0.5 mg/L),同种蔬菜经过加热和未加热处理的抑制率差异明显减少。可能是因为在农药添加量少的情况下,抑制率主要受到蔬菜中含硫化合物的影响,而加热可以在一定程度上消除这种影响;而在农药添加量多的情况下,抑制率的升高主要是由农药引起的,并非蔬菜里的干扰物质,此时抑制率的升高就不仅仅是假阳性现象。
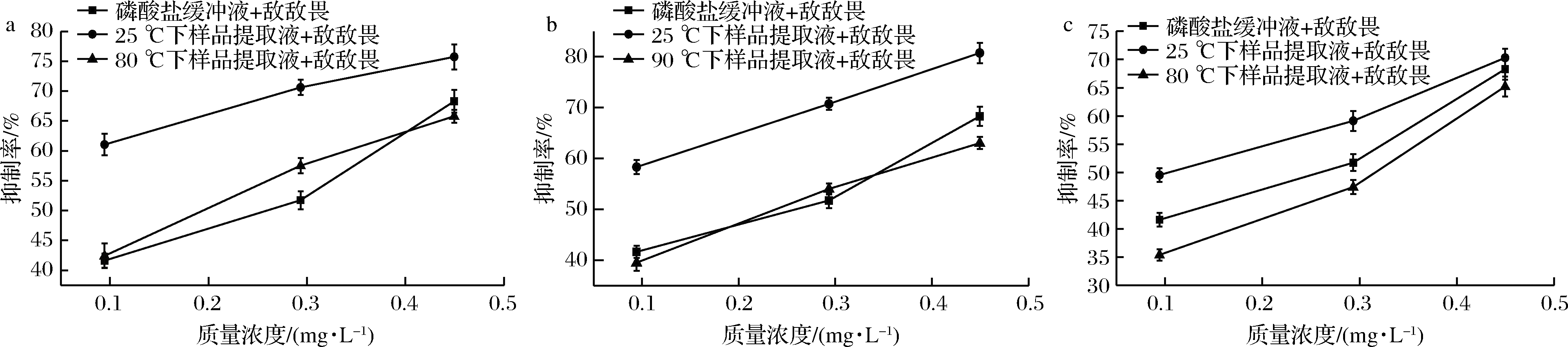
a-香葱;b-洋葱;c-大蒜
图3 蔬菜中添加敌敌畏浓度与抑制率关系
Fig.3 The relationship between dichlorvos concentration and inhibition rate in the vegetables
2.5.2 三种蔬菜中添加其他多种农药的检测
与上文相似,分别将乐果、甲基对硫磷、叶蝉散、西维因和丁硫克百威5种农药添加到3种蔬菜样品提取液及提取液中配制成不同浓度在25 ℃室温和最佳温度下水浴加热进行检测,以不加热的样品提取液作为参比,结果如表3所示。香葱样品提取液中分别添加5种农药配制成低浓度的溶液时,经过80 ℃水浴加热后对麦麸酯酶的抑制率与未加热的样品提取液相比均呈显著差异(P<0.05),而与添加相同质量浓度的提取液相比差异均不显著(P>0.05);在中等浓度下经过水浴加热后的样品提取液对麦麸酯酶的抑制率与未加热的相比,乐果、甲基对硫磷、丁硫克百威3种农药差异显著(P<0.05),而与添加相同质量浓度的提取液相比5种农药差异均不显著(P>0.05);在高浓度下经过水浴加热后的样品提取液对麦麸酯酶的抑制率与未加热的相比,乐果、甲基对硫磷2种农药差异显著(P<0.05),而与添加相同质量浓度的提取液相比,乐果、叶蝉散、西维因、丁硫克百威4种农药差异均不显著(P>0.05)。
表3 五种农药样品提取液与缓冲液对酶活性抑制率的比较结果
Table 3 Comparison of pesticides detection between the sample solution and buffer solution

蔬菜农药质量浓度酶活性抑制率/%(mg·L-1)25℃下提取液25℃下样品提取液加热样品提取液1.0012.55±1.83b29.66±2.17a14.94±0.95b乐果1.5020.49±3.23b34.4±2.28a21.15±0.48b2.0035.02±2.41b41.91±1.62a32.75±1.88b1.0017.58±1.57b24.41±3.22a17.59±2.83b甲基对硫磷1.5026.78±0.98b35.16±0.72a26.74±1.18b2.0040.77±0.64b49.79±1.61a37.44±1.53c0.1017.70±0.91b34.08±0.99a19.47±1.01b香葱叶蝉散0.2528.76±0.40b37.87±2.87a33.97±4.31ab0.5048.45±0.78a52.21±5.43a49.48±0.85a0.108.85±1.82b24.93±3.57a11.16±1.78b西维因0.2527.84±2.13a29.56±1.26a25.01±3.12a0.5042.18±1.92a45.42±0.59a43.70±2.50a1.0012.55±1.83b29.66±2.17a14.94±0.95b丁硫克百威1.5025.78±0.98b34.16±0.72a26.74±1.18b2.0041.18±1.92a44.42±0.59a42.70±2.50a1.0012.55±1.83b23.03±2.38a19.83±2.14a乐果1.5020.49±3.23b28.78±0.54a24.65±3.15ab2.0035.02±2.41a37.22±2.23a37.44±1.44a1.0017.58±1.57ab22.53±3.75a14.79±2.23b甲基对硫磷1.5026.78±0.98a26.93±2.24a24.85±1.07a2.0040.77±0.64a40.78±0.48a37.63±0.72a0.1017.70±0.91c24.62±1.81b17.53±0.67a洋葱叶蝉散0.2528.76±0.40b38.63±1.21a26.58±2.43c0.5048.45±0.78b54.45±2.01a47.30±4.30b0.108.85±1.82c27.88±0.64a15.75±3.36b西维因0.2527.84±2.13b32.24±2.06a27.10±1.86b0.5042.18±1.92a45.33±2.18a41.54±1.58a1.0017.58±1.57ab22.53±3.75a14.79±2.23b丁硫克百威1.5020.49±3.23b28.78±0.54a24.65±3.15ab2.0042.18±1.92a45.33±2.18a41.54±1.58a1.0012.55±1.83b17.75±2.58a10.40±0.86b乐果1.5020.49±3.23b27.05±0.45a20.87±1.12b2.0035.02±2.41a37.71±0.64a32.15±4.73a1.0017.58±1.57a16.28±0.16ab13.66±2.62b甲基对硫磷1.5026.78±0.98a22.86±1.34b23.19±1.08b2.0040.77±0.64a37.59±0.33a36.93±3.80a0.1017.70±0.91b27.20±0.58a19.09±0.84b大蒜叶蝉散0.2528.76±0.40b38.36±2.60a35.25±3.48ab0.5048.45±0.78a52.16±3.77a51.41±4.31a0.108.85±1.82b25.82±2.33a10.39±1.58b西维因0.2527.84±2.13b33.93±0.90a28.14±1.44b0.5042.18±1.92b49.47±3.92a47.89±1.99a1.0020.49±3.23b27.05±0.45a20.87±1.12b丁硫克百威1.5027.84±2.13b33.93±0.90a28.14±1.44b2.0040.77±0.64a37.59±0.33a36.93±3.80a
洋葱样品提取液中分别添加5种农药配制成低浓度的溶液时,经过90 ℃水浴加热后对麦麸酯酶的抑制率与未加热的样品提取液相比,甲基对硫磷、叶蝉散、西维因、丁硫克百威4种农药呈显著差异(P<0.05),而与添加相同质量浓度的提取液相比,甲基对硫磷、西维因、丁硫克百威3种农药差异不显著(P>0.05);在中等浓度下经过水浴加热后的样品提取液对麦麸酯酶的抑制率与未加热的相比,叶蝉散、西维因2种农药差异显著(P<0.05),而与添加相同质量浓度的提取液相比,乐果、甲基对硫磷、西维因、丁硫克百威4种农药差异不显著(P>0.05);在高浓度下经过水浴加热后的样品提取液对麦麸酯酶的抑制率与未加热的相比,叶蝉散差异显著(P<0.05),而与添加相同质量浓度的提取液相比,6种农药差异均不显著(P>0.05)。
大蒜样品提取液中分别添加5种农药配制成低浓度的溶液时,经过80 ℃水浴加热后对麦麸酯酶的抑制率与未加热的样品提取液相比,乐果、叶蝉散、西维因、丁硫克百威4种农药呈显著差异(P<0.05),而与添加相同质量浓度的提取液相比,乐果、叶蝉散、西维因、丁硫克百威4种农药差异不显著(P>0.05);在中等浓度下经过水浴加热后的样品提取液对麦麸酯酶的抑制率与未加热的相比,乐果、西维因、丁硫克百威3种农药差异显著(P<0.05),而与添加相同质量浓度的提取液相比,乐果、叶蝉散、西维因、丁硫克百威4种农药差异不显著(P>0.05);在高浓度下经过水浴加热后的样品提取液对麦麸酯酶的抑制率与未加热的相比,6种农药差异均不显著(P>0.05),而与添加相同质量浓度的提取液相比,6种农药差异也均不显著(P>0.05)。
由以上数据进行比较后可知样品提取液在合适温度下经过水浴加热可明显降低其对酶活性抑制作用,使抑制率更接近真实值。但是,水浴加热并不能完全保证消除蔬菜中含硫化合物的影响。通过分析还可发现与上文实验一致的现象,随着提取液中浓度的增大,经过加热的样品提取液与未加热的提取液对酶活性抑制率的差异逐渐减小。
3 结论
本研究采用微波处理法和水浴加热法同时进行研究,发现微波加热法虽然可以在一定程度上减少甚至消除辛辣蔬菜检测中的假阳性现象,但是在实际应用中存在很大局限性,如辛辣蔬菜的种类不同其质地也不同,所以加热的时间必须严格控制,否则加热过度造成蔬菜中汁液流失反而会增大酶活性抑制率,达不到消除的效果。并且该方法的效果比水浴加热法差,而水浴加热法对香葱、洋葱和大蒜假阳性消除情况均可满足检测要求,对样品提取液进行加热可控性好。香葱、洋葱、大蒜和青椒的最佳水浴加热温度分别为80、90、80、80 ℃,经过处理后的样品提取液对麦麸酯酶活性的抑制率分别由原来的37.06%、20.50%、17.02%、50.34%下降到12.69%、2.95%、5.79%、33.61%。但是2种方法对青椒样品提取液均不能有效降低其假阳性影响,究其原因是青椒样品本身含有农药造成假阳性无法消除还是该方法本身不适用青椒,还有待进一步研究。
[1] 祝文峰, 李太平.基于文献数据的我国蔬菜农药残留现状研究[J].经济问题, 2018(11):92-98.
ZHU W F, LI T P.Study on the status of vegetable pesticide residues in china based on literature data[J].On Economic Problems, 2018(11):92-98.
[2] 任晓姣, 白亚迪, 王党党, 等.西安市蔬菜水果有机磷农药残留规律研究[J].安徽农业科学, 2017, 45(1):91-93.
REN X J, BAI Y D, WANG D D, et al.Study on organophosphorus pesticide residues in vegetables and fruits in Xi′an[J].Journal of Anhui Agricultural Sciences, 2017, 45(1):91-93.
[3] 罗月, 朱永义, 何远东.2015-2017年某市蔬菜和水果中农药残留现状分析[J].医学动物防制, 2019, 35(7):651-653.
LUO Y, ZHU Y Y,HE Y D.Analysis of pesticide residues in vegetables and fruits in a city during 2015-2017[J].Journal of Medical Pest Control,2019, 35(7):651-653.
[4] LOZOWICKA B, ABZEITOVA E, SAGITOV A, et al.Studies of pesticide residues in tomatoes and cucumbers from Kazakhstan and the associated health risks[J].Environmental Monitoring & Assessment, 2015, 187(10):609.
[5] 郭子森, 刘永军, 沈娟.吉林省蔬菜农药残留现状及建议[J].吉林农业, 2018, 21(47):86-86.
GUO Z S, LIU Y J, SHEN J.Present situation and suggestion of pesticide residue in vegetables in Jilin province[J].Agriculture of Jilin, 2018, 21(47):86-86.
[6] 刘亚平, 张金艳, 孙东立.酶抑制率法在4种蔬菜农药残留快速检测中的应用[J].安徽农业科学,2014, 42(2):427-428;470.
LIU Y P, ZHANG J Y, SUN D L.Application of enzyme inhibition rate method in rapid detection of four vegetables pesticide residues[J].Journal of Anhui Agricultural Sciences,2014, 42(2):427-428;470.
[7] 胡贝贞, 宋伟华, 谢丽萍, 等.气相色谱-负化学离子源质谱法测定含硫蔬菜中残留的14种农药[J].色谱, 2008, 26(5):608-612.
HU B Z, SONG W H, XIE L P, et al.Determination of 14 pesticide residues in sulfur-containing vegetables by gas chromatography-negative chemical ionization mass spectrometry[J].Chinese Journal of Chromatography,2008, 26(5):608-612.
[8] 中华人民共和国卫生部, 中国国家标准化管理委员会, GB/T 5009.218—2008 水果和蔬菜中多种农药残留量的测定[S].北京:中国标准出版社,2008.
Ministry of Health of the People′s Republic of China, Standardization Administration of China.GB/T 5009.218—2008 Determination of multi pesticide residues in fruits and vegetables[S].Beijing:Standards Press of China, 2008.
[9] 陈龙军, 郭得平.葱蒜类作物中的蒜氨酸酶[J].植物生理学通讯, 2001, 37(5):471-474.
CHEN L J, GUO D P.Alliinase in garlic and allied species[J].Plant Physiology Communications, 2001, 37(5):471-474.
[10] 洪萍, 应杏秋.含硫蔬菜农药残留检测方法研究进展[J].中国卫生检验杂志, 2011, 21(9):2 355-2 357.
HONG P, YING X Q.Research progress on determination methods of pesticide residues in sulfur-containing vegetables[J].Chines Journal of Health Laboratory Technology, 2011, 21(9):2 355-2 357.
[11] 周华, 汪尤刚, 边天斌.磷酸处理-气相色谱法测定韭菜中有机磷农药[J].中国卫生检验杂志, 2012, 22(3):649-650.
ZHOU H, WANG Y G, BIAN T B.Determination of organophosphorus pesticides in leek by phosphoric acid treatment-gas chromatography[J].Chines Journal of Health Laboratory Technology,2012, 22(3):649-650.
[12] 郑金武, 江晓燕.蔬菜农药残留快速检测中消除假阳性的检测方法[J].安徽农学通报, 2012, 18(19):189;192.
ZHENG J W, JIANG X Y.Elimination of false positives in rapid detection of pesticide residues in vegetables[J].Anhui Agricultural Science Bulletin, 2012, 18(19):189;192.
[13] 侯晓艳, 姜露, 叶麟, 等.纯化方式对麦麸酯酶农药检测效能的影响[J].基因组学与应用生物学, 2019, 38(1):276-282.
HOU X Y, JIANG L, YE L, et al.Effect of purification methods on detection efficiency of wheat bran esterase[J].Genomics and Applied Biology,2019, 38(1):276-282.
[14] 侯晓艳, 姜露, 叶麟, 等.麦麸酯酶对有机磷及氨基甲酸酯类农药的动力学特性[J].分析测试学报, 2018, 37(3):324-330.
HOU X Y, JIANG L, YE L, et al.Kinetics characteristics of Wheat Bran esterase on organophosphorus and carbamate pesticides[J].Journal of Instrumental Analysis, 2018, 37(3):324-330.
[15] 叶麟, 杨雪, 张志清, 等.响应面法优化麦麸酯酶提取工艺[J].麦类作物学报, 2017, 37(3):420-427.
YE L, YANG X, ZHANG Z Q, et al.Optimization of extraction process for Wheat Bran esterase by response surface methodology[J].Journal of Triticeae Grops, 2017, 37(3):420-427.
[16] 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 5009.199—2003 蔬菜中有机磷和氨基甲酸酯类农药残留量的快速检测[S].北京:中国标准出版社,2003.
Ministry of Health of the People′s Republic of China, Standardization Administration of China.GB/T 5009.199—2003 Rapid detection for organophosphorus and carbamate pesticide residues in vegetables[S].Beijing:Standards Press of China, 2003.