酶促褐变是果蔬食品中普遍存在的一种现象,能够引起果蔬外观的劣变,导致果蔬的风味和营养发生变化。因此,在食品工业生产中使用相关技术手段对多酚氧化酶(polyphenol oxidase,PPO) 进行抑制,降低褐变发生率十分重要。化学抑制剂因具有方便高效的特点,近年来有关其对PPO抑制效果的报道越来越多,抑制机理的研究也日趋成熟。本文列举了五类化学抑制剂对 PPO的抑制作用和机理,并从分子水平上探讨了化学抑制剂对PPO构象的影响。
1 多酚氧化酶
1.1 PPO概述
PPO是自然界一种常见的氧化还原酶,广泛存在于各种生物中,其在食品工业有着重要的应用[1]。PPO通常先以无活性的前体形式存在,其前体一般由N-端导肽、中间高度保守的Cu结合区和C-端疏水区3部分组成。其中Cu结合区是该酶的主要功能区,其他部分则对酶的构象、高级结构的形成和维持起作用。PPO的活性位点在PPO催化反应中起着重要作用。如图1所示,PPO分子的活性位点有两个Cu,包括CuA和CuB 区域,CuA 区域含3个保守的His残基和1个Cys残基,CuB区域含3个或4个保守的His残基,形成了有特定三维结构的活性部位[2]。
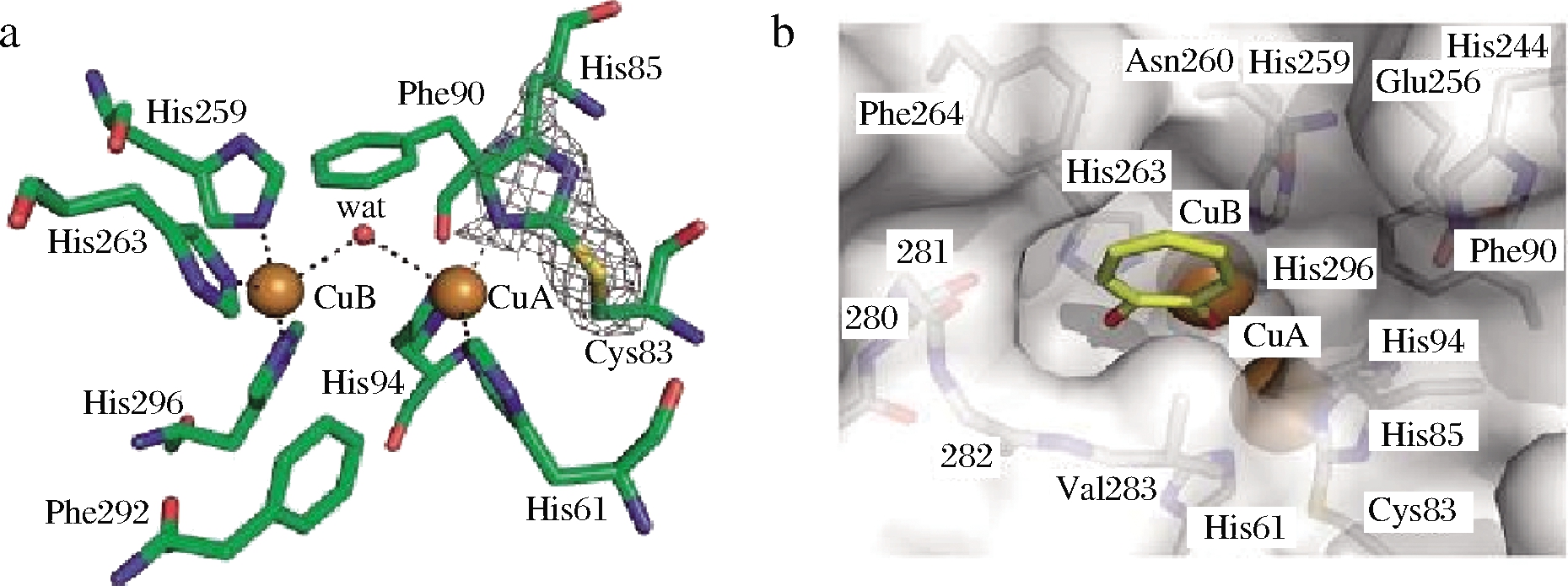
a-正交空间群中双核铜结合位点的三维结构;b-用tropolone展现表面活性中心的三维结构
图1 PPO Cu2+活性中心[2]
Fig.1 Binuclear copper binding site
不同种植物和同一植物体的不同部位、同一部位的多基因家族的不同成员之间,PPO的分子质量不同。PPO是一种寡聚蛋白分子,前体单体的分子质量为60~71 kDa,而成熟单体的分子质量为40~68 kDa,表明PPO分子由无活性转变为有活性的过程中经过了肽链加工[3]。不同种植物之间的PPO常常具有高度的相似性。研究发现苹果的PPOs氨基酸序列与番茄、土豆、蚕豆、葡萄等有43%~58%的相似性[4]。PPO是由核基因编码,多个基因控制,表现出多基因的家族性。其基因的表达比较复杂,不同种植物、同一植物体的不同部位及同一部位的多基因家族表达的种类及表达的量都不同。例如香蕉其编码的BPO1与BPO11、BPO34、BPO35之间序列同源性为50%左右,BPO34与BPO35同源性较高,达80%左右[5]。它们往往具有不同的底物特异性、表达时间和空间差异,表明PPO参与了多种生理过程。
1.2 PPO的酶促褐变
PPO是引起果蔬酶促褐变的主要内源性酶,PPO也因参与果蔬褐变而在食品科学领域得到广泛的研究。如图2所示,PPO的酶促褐变过程是指其在氧分子存在的条件下可催化单酚酶羟基化和将邻二酚氧化为邻醌;随后醌类化合物被氧化成醌衍生物,形成的邻醌与其他醌、氨基酸、蛋白质非酶聚合形成褐色化合物[6]。目前,主要存在3种关于PPO酶促褐变机理的假说:酚酶区域分布假说、自由基伤害假说和保护酶系统假说,其中酚酶区域性分布假说更受推崇[7]。该假说认为在组织细胞内存在两种形式的PPO,一种是游离态多酚氧化酶(sPPO),存在于细胞质中;一种是膜结合态多酚氧化酶(mPPO),束缚于细胞膜上。由于正常植物组织中的多酚类物质分布在细胞液泡内,PPO分布在各种质体或细胞质内,因此多酚类物质与PPO难以接触,即使它们与氧同时存在也不会发生褐变。而细胞膜结构一旦被破坏后,mPPO便游离出来,向sPPO转化,sPPO活性显著提高,表现PPO和酚类物质的区催化活性[8]。通常只有这种空间隔离被打破,PPO才表现出酶活性。果蔬加工及贮藏过程中的切割、破碎等外加条件会导致膜系统的破坏,打破区域化分布,酶和底物得以接触从而引起酶促褐变。
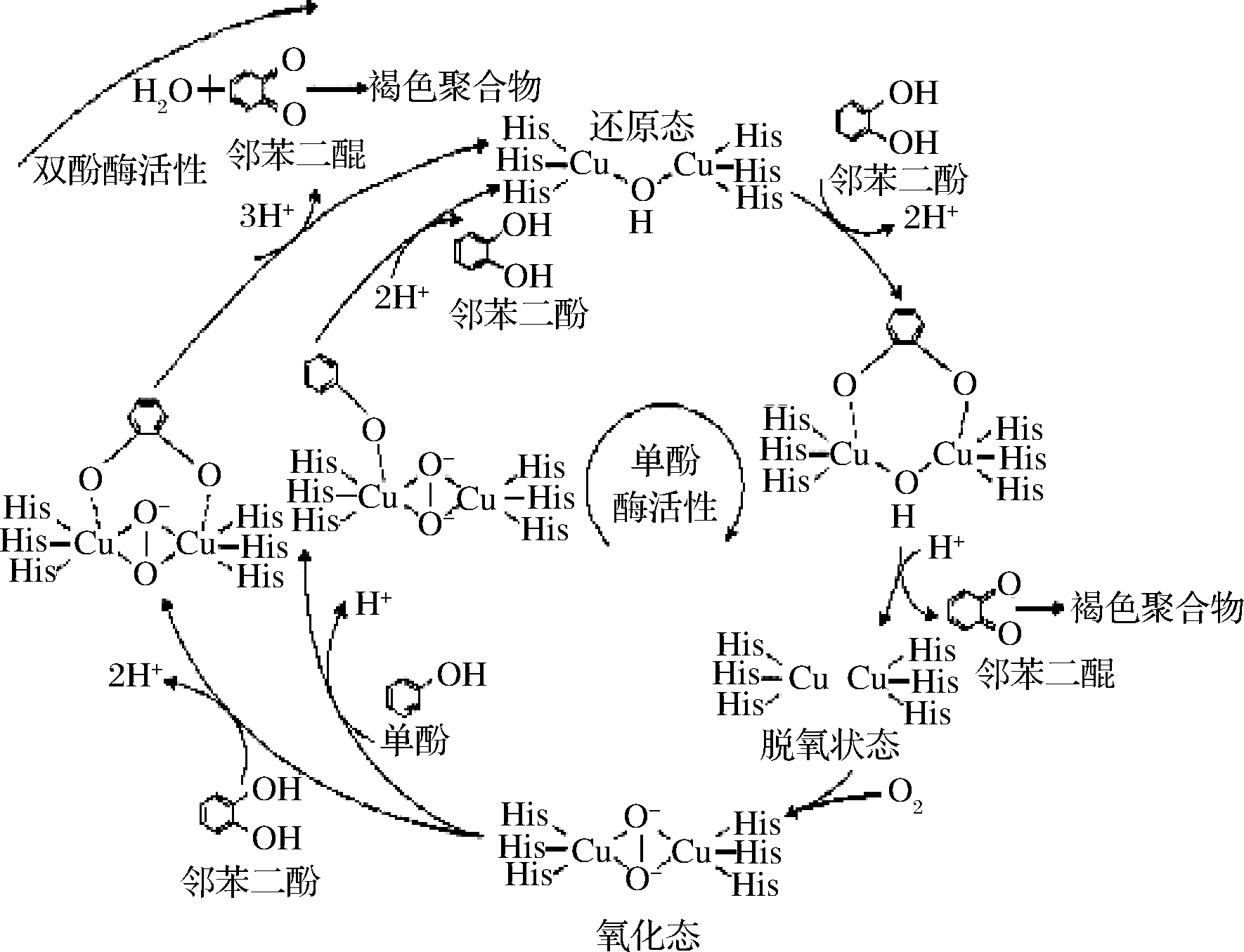
图2 单酚酶与二酚酶氧化反应过程[5]
Fig.2 Oxidation mechanism between monophenolase and diphenolase
1.3 PPO对果蔬食品的影响
PPO引起的酶促褐变是造成果蔬劣变的主要原因之一,据报道,全球50%以上的果蔬及其加工产品的损失是由酶促褐变引起的,其对果蔬产业造成了巨大经济损失[9]。以目前市场上较受欢迎的NFC果蔬汁和鲜切果蔬为例,NFC果蔬汁的生产需先破碎后榨汁,以提高出汁率。在破碎和压榨过程,细胞结构被破坏,多酚类物质更易溶出,使得果蔬汁中的多酚含量显著上升,同时更易与PPO接触,导致严重的酶促褐变发生。鲜切果蔬以其营养、方便、可食率达100%等特点深受欢迎,但在去皮、切分等加工过程中,细胞组织结构极易受到损伤, 使得细胞组织与空气直接接触,加速了酶促褐变进程。这些在贮藏、运输及加工的过程中不可避免发生的酶促褐变,影响了果蔬的商业价值,降低消费者的接受率,严重阻碍了果蔬产业发展。因此控制酶促褐变成为果蔬产品加工过程中极其重要的一步。
2 化学抑制剂
酶促褐变的发生需要3个条件:底物(多酚类物质)、氧介质、PPO。在实际生产中想要除去食品中PPO底物不仅困难而且不现实,因此使用抑制剂抑制PPO活性是一种有效的手段。化学抑制剂对PPO具有高效的抑制效果且使用方便,被广泛应用于果蔬产业,故对它的研究具有广泛的理论和实际意义。酶化学抑制剂种类繁多,其抑制机理也各不相同,本文将化学抑制剂分为以下五类进行讨论。
2.1 羧酸类
羧酸(carboxylic acid)作为食品组分天然存在于许多植物中,是由烃基与羧基相连构成的有机酸。目前发现很多羧酸类物质可作为PPO的有效抑制剂,如柠檬酸、草酸、酒石酸和苹果酸。柠檬酸作为最常见的羧酸,对芒果[10]、苹果[11]和香蕉[12]等提取获得的PPO抑制效果较好。在这些研究中柠檬酸的浓度范围较宽且大部分有效浓度范围高于10 mmol/L能抑制80%的PPO活性。草酸是二元酸,对苹果[11]、香蕉[12]和梨[13]等提取获得的PPO酶液抑制效果显著。在这些研究中草酸浓度在10 mmol/L就能有效抑制粗酶液中80%的PPO活性,与其他结构类似的羧酸相比抑制效果更强。同时,羧酸应用于食品体系也有着良好的抑制效果。羧酸类对果蔬汁和鲜切果蔬等食品体系中的PPO均有较好抑制效果,且大多抑制剂使用浓度范围与粗酶体系中相似。例如,添加0.5%~2.5%的柠檬酸于果蔬汁中能较好抑制褐变,采用1%~2%的柠檬酸浸泡鲜切果蔬能较好减少贮藏过程中颜色变化[14]。
羧酸主要通过降低体系pH、螯合铜辅基等2个方面来抑制PPO活性。羧酸作为酸化剂能降低体系pH,导致酶变性或者使酶处于最适pH范围外[11]。大多果蔬PPO的最适pH值在6.0~7.4,PPO在pH<4.0 时,甚至可完全失去活性。此外,羧酸作为螯合剂能与PPO活性位点的Cu2+相结合影响酶促反应[15]。草酸是食品工业中常用的金属螯合剂,与Cu2+具有较高的亲和性而形成螯合物,能有效抑制酶活性或减弱酶与底物的亲和力[16]。YORUK等[13]报道了草酸通过螯合Cu2+抑制梨的PPO活性,且无法通过透析得到恢复。
利用调酸降低pH值抑制果蔬褐变,是果蔬加工中最常用的方法。大多数羧酸是食品行业中使用范围极广的酸化剂,添加到产品中安全健康、口感好,可促进食欲。同时由于其水溶性和脂溶性较好,易于均匀地分散于各类食品中,在食品工业中常与热水烫漂联合使用能较好抑制PPO活性,护色效果显著。但羧酸在产品中的添加量十分关键,添加过少抑制效果不强,添加量过大会造成产品酸化严重,影响产品风味。
2.2 抗坏血酸及其衍生物
抗坏血酸及其衍生物(ascorbic acid derivatives)是一种天然抗氧化剂,具有酸的性质,是近年来研究最多的亚硫酸盐替代品。抗坏血酸作为应用最为广泛的PPO抑制剂之一,对苹果[17]、李子[18]和菠萝[19]等不同来源提取的PPO都具有强烈的抑制效果。研究发现,大多数的抗坏血酸浓度在低于1 mmol/L就能抑制粗酶液中90%的PPO酶活性,表明抗坏血酸在缓冲体系中对PPO的抑制是非常有效的。同时抗坏血酸在食品体系中也应用广泛,与缓冲液体系相比,食品体系中所用抗坏血酸浓度普通更高。抗坏血酸添加到果蔬汁中的浓度为5.7~500 mmol/L,有效浓度在57 mmol/L对PPO即可达到80%的抑制率;在鲜切果蔬中使用高于100 mmol/L的抗坏血酸对PPO即可达到80%的抑制率,有效延缓鲜切果蔬的褐变[20]。此外,抗坏血酸钠、抗坏血酸钙、磷酸抗坏血酸等抗坏血酸衍生物也能较好地抑制PPO活性,如添加1%的抗坏血酸钙可有效抑制鲜切鸭梨的褐变发生[21]。
抗坏血酸作为常用的抑制剂,其抑制作用主要是作为还原剂将酚还原成醌类物质,同时作为螯合剂与PPO的辅基Cu2+螯和,从而延缓或消除了褐变过程[17]。此外,还有研究表明抗坏血酸可通过和酚类物质竞争氧以减缓反应进程,其在果汁中可作为抗坏血酸氧化酶的底物在酶的催化作用下把将溶解在果汁中的氧消耗掉,从而抑制褐变[22]。
抗坏血酸是实际生产中较为理想的抑制剂,其安全性高、价格低廉,在工业生产中可以广泛的应用。抗坏血酸除了抑制褐变,作为还原剂可降低护色液的氧含量,具有漂白色素的作用,而且还能使VC维持在一个较高的水平上,提高了果蔬产品的食用价值和外观品质,具有深远的经济意义。然而,在实际生产中抗坏血酸的添加量十分重要,若添加量过少,不仅不能抑制褐变,反而会引起羰氨反应造成非酶褐变;若添加量过多,会导致成品在贮存期间因氧化后所形成的酮化合物与氨化合物发生非酶促褐变反应,从而加剧成品的变色[23]。
2.3 含硫氨基酸
含硫氨基酸(suifur-containing amino acids)是指分子式中含有硫元素,且这些硫元素形成的巯基等化学键具有一定的生理功能。L-半胱氨酸是最常用的含硫氨基酸抑制剂,对芒果[10]、李子[18]等提取获得的PPO具有较好的抑制效果。大部分研究发现L-半胱氨酸的浓度低于1 mmol/L时就能对PPO粗酶液表现出90%以上的抑制效果,甚至在低于0.1 mmol/L时也具有较好的抑制效果。同样地,L-半胱氨酸在食品体系中也能较好抑制PPO活性,使用10 mmol/L以上的L-半胱氨酸处理鲜切苹果、梨汁等可降低80%的PPO活性。此外,使用乙酰基半胱氨酸和谷胱甘肽也能较好抑制鲜切果蔬的PPO活性,其浓度大多在50 mmol/L就能较好抑制PPO活性,有效延缓褐变[24]。
目前,关于含硫氨基酸抑制PPO酶促褐变机制的研究众多,但抑制机理仍存在争议。以L-半胱氨酸为例,一是认为其抑制机理主要是因为L-半胱氨酸可以使多酚被氧化后生成的醌不与其他醌类、氨基酸和蛋白质等聚合生成络合物,而直接与其结合形成一种新的无色硫氢化合物,从而阻碍了酶促褐变反应进程;二是认为L-半胱氨酸中的SH基团对PPO活性区域的Cu2+具有很强的亲和力,能去除活性中心的Cu2+或取代与Cu紧密配合的His残基,从而改变PPO活性中心的结构使酶活降低;三是认为L-半胱氨酸并非阻止PPO氧化酚类,而是阻止酚类的聚合从而抑制褐变发生[25]。
L-半胱氨酸是PPO良好的抑制剂,尤其是在高浓度下其抑制效果显著。但高浓度的L-半胱氨酸会产生令人恶心的气味,同时因其具有漂白作用,能严重破坏食品风味和外观。因此要想有效抑制PPO酶活性,可以考虑采用多种抑制剂联合的方法。抑制剂联合是果蔬加工中常用的方法之一,多为2种或2种以上复合使用,且符合食用级标准。近年关于L-半胱氨酸与其他抑制剂联合使用效果的研究越来越多,通常L-半胱氨酸可与抗坏血酸或适量的pH调节剂如柠檬酸、苹果酸、醋酸等既可降低pH值抑制褐变发生率,又能较好保持产品的产品风味和外观。
2.4 酚酸
酚酸(phenolic acids)是一类含有酚环的有机酸,水果和蔬菜中含有许多种类的酚酸,其中一部分可作为PPO的底物而引起褐变,另一部分则可对PPO有抑制作用。肉桂酸存在于多种植物中,具有低毒、良好的生理活性等特征,能有效抑制棕榈[26]、菠萝[19]等不同来源提取获得的PPO活性。在上述研究中肉桂酸的浓度低于5 mmol/L可以抑制75%的PPO酶活,表明肉桂酸是一种有效的PPO抑制剂。同时研究发现肉桂酸衍生物对 PPO也具有抑制效果,如阿魏酸、2-氯肉桂酸等可展现出较强的抑制效果[27]。此外,没食子酸、咖啡酸、曲酸也是常见的PPO抑制剂。尤其是曲酸在许多研究中发现其浓度低于1 mmol/L时可使提取获得的PPO受到强烈抑制,甚至0.1 mmol/L的曲酸就有70%的抑制率。曲酸具有无色无味的优点, 加入果蔬汁中不改变其口味,1 mmol/L的曲酸即可较好抑制苹果汁中PPO活性,是优良的护色剂。
酚酸大多是竞争性抑制剂,具有与酚类底物类似的结构,能够占据酶的催化中心,从而阻碍底物的进入。肉桂酸及其衍生物主要是通过竞争性地占据PPO活性中心的位置,与PPO中双核Cu2+螯合,抑制PPO活性。此外,还有研究认为有些肉桂酸衍生物可被催化氧化成醌类物质,能与酶和底物的复合体结合,从而抑制产物的生成[28]。曲酸、没食子酸等酚酸可作为螯合剂与双铜离子强烈结合,阻碍底物进入酶催化中心,抑制PPO活性。KAHN等[29]认为曲酸的抑制机理还可能是因为曲酸具有抗氧化性,它的酚羟基可以被还原,通过去除氧以干扰酶促反应。
酚酸类抑制剂是PPO的良好抑制剂,但与模拟体系相比,酚酸在食品体系中的研究和应用相对较少,这可能是由于酚酸类抑制剂具有不明确的安全性和较低的水溶解度所致,因此在食品工业中较少使用此类抑制剂。
2.5 其他
除了上述四类抑制剂外,还有一些物质对PPO有较好的抑制效果。
蜂蜜是一种甜物质,研究发现蜂蜜能通过降低果汁中溶解氧的扩散速率来抑制变色,添加2.0%的蜂蜜可有效抑制PPO活性[30];据报道,洋葱的榨汁液能有效抑制苹果汁、鲜切苹果及莴苣的褐变,在这些食品中添加1%的洋葱榨汁液可降低70%的PPO活力,并且洋葱榨汁液经加热后会产生许多巯基化合物,巯基化合物可增强洋葱的抑制效果[31];4-己基间苯二酚(4-hexylresorcinol,4-HR)由于其无毒、非致突变性和非致癌特性,在食品工业中具有潜在的用途。GUERRERO等[32]研究发现4-HR与PPO的底物结构类似,其能优先结合到 PPO的活性部位,从而阻碍酶与底物的接触,抑制褐变的发生。因此4-HR作为一种高效的PPO抑制剂,使用0.1%的4-HR就能降低80%的提取获得的PPO活性[33]。此外,杜仲叶提取物、原花青素、茶叶提取物、桑树皮和桑树枝提取物等均能较好抑制PPO活性,但它们的抑制机理还未明确,在食品体系中的研究较少。
3 抑制剂对 PPO 的构象影响
酶蛋白的空间结构主要依靠大量较弱的次级键以及弱相互作用共同维持,PPO活性中心和它的三维构象有关,其中任何微小变化都可能导致酶失去活性。越来越多的研究发现能对PPO产生强酸作用、螯合作用、还原作用及强结合作用的化学抑制剂可以通过影响PPO的构象来抑制PPO活性。
目前常采用圆二色光谱仪、红外光谱仪、荧光光谱仪等仪器来研究酶蛋白三维结构的变化。圆二色(circular dichroism,CD)光谱可以反映出蛋白质或多肽链二级结构变化的信息;红外光谱可以研究分子的结构和化学键,并由此推测分子的立体构型;荧光光谱可以分析蛋白质分子在不同环境下的构象变化。此外,分子对接技术可以通过研究复合物中2个分子正确的结合位点和最佳取向,明确底物构象在形成复合物过程中的变化来探究抑制剂作用机理。
3.1 强酸作用
PPO对pH的变化敏感,高酸性环境会使酶蛋白上的Cu2+解离下来,造成PPO变性。柠檬酸、苹果酸、乳酸等是良好的酸化剂,即使在具有高离子强度的缓冲液中也能导致体系pH的明显下降,抑制PPO活性。
ZHOU等[34]研究了柠檬酸处理PPO后的构象变化,发现随着柠檬酸浓度增加,PPO二级结构中的α-螺旋含量逐渐降低,β-折叠含量逐渐增加,二级结构发生了变化。同样地,SHI等[35]通过CD光谱分析,发现在强酸环境下PPO的α-螺旋和β-折叠含量减少,而β-转角和无规则卷曲含量增加。α和β链的改变会导致多肽主链的部分延伸,从而使PPO的构象变得松散,造成构象变化。此外,酸性环境还会导致酶蛋白三级结构的部分破坏。LIU等[36]分析了柠檬酸处理PPO的荧光光谱,发现随着柠檬酸浓度增大,PPO的荧光强度逐渐降低,最大荧光发射波长出现红移。强酸环境引起的PPO变性可使部分内埋的氨基酸残基暴露在更为亲水的环境中,导致荧光强度出现下降。同样地,方志超等[37]研究了乳酸作用PPO的荧光光谱,发现随着溶液pH的降低,PPO荧光强度也不断降低,表明乳酸处理能破坏PPO三级结构。静电相互作用是化学键-离子键形成的本质,是影响蛋白酶结构、结合特异性和生物功能的重要因素之一。在酚酶多肽链的不同部位,存在着酸性氨基酸残基和碱性氨基酸残基,因而在不同部位的侧链基团之间存在静电相互作用。但这种静电相互作用易受到强酸环境的影响,强酸可通过质子化和去质子化效应来改变酶的离子化状态,从而造成酶构象变化[38]。
3.2 螯合作用
螯合作用是将具有供电子基团的化合物与金属离子结合并形成环状结构的络合物。PPO活性中心包含2个Cu2+位点,在氧气的传递和底物的氧化上起到重要作用,Cu2+可作为中心离子参与螯合作用。草酸、柠檬酸、曲酸等是常见的螯合剂,可通过螯合作用抑制PPO活性。
RAPEANU等[39]通过红外光谱分析,发现加入草酸后,其红外光谱强度出现增加,表明酶蛋白的骨架结构发生改变。严莉等[40]通过荧光光谱分析,发现随着草酸浓度增加,PPO荧光强度不断下降,并伴随着荧光猝灭。在正常生理条件下,PPO活性区域中的多肽链氢键网络排列规整,PPO始终维持相对稳定的状态。草酸分子与Cu2+螯合后,可导致酶活性区域的氢键网络发生重排,多肽链更为伸展,进而引起整体构象的改变。NOKTHAI等[41]通过分子对接模拟发现(图3),草酸分子大部分被掩埋进入PPO活性位点内,进入活性位点内的草酸通过氢键与Cu2+和带负电荷的His残基相互作用,键合成具有环状结构的配合物,破坏了该区域的氢键网络。同样地,LIU等[42]通过CD光谱分析,发现随着曲酸浓度增加,二级结构中的α-螺旋和β-螺旋出现增加。同时通过荧光光谱,发现PPO荧光强度不断下降, Trp残基周围微环境的疏水性逐渐减弱。抑制剂与PPO螯合形成络合物的过程,可导致其活性位点中的多肽链氢键网络重排,造成了PPO天然构象不稳定,再加上活性区域的疏水性减弱,进而导致了酶构象的变化。
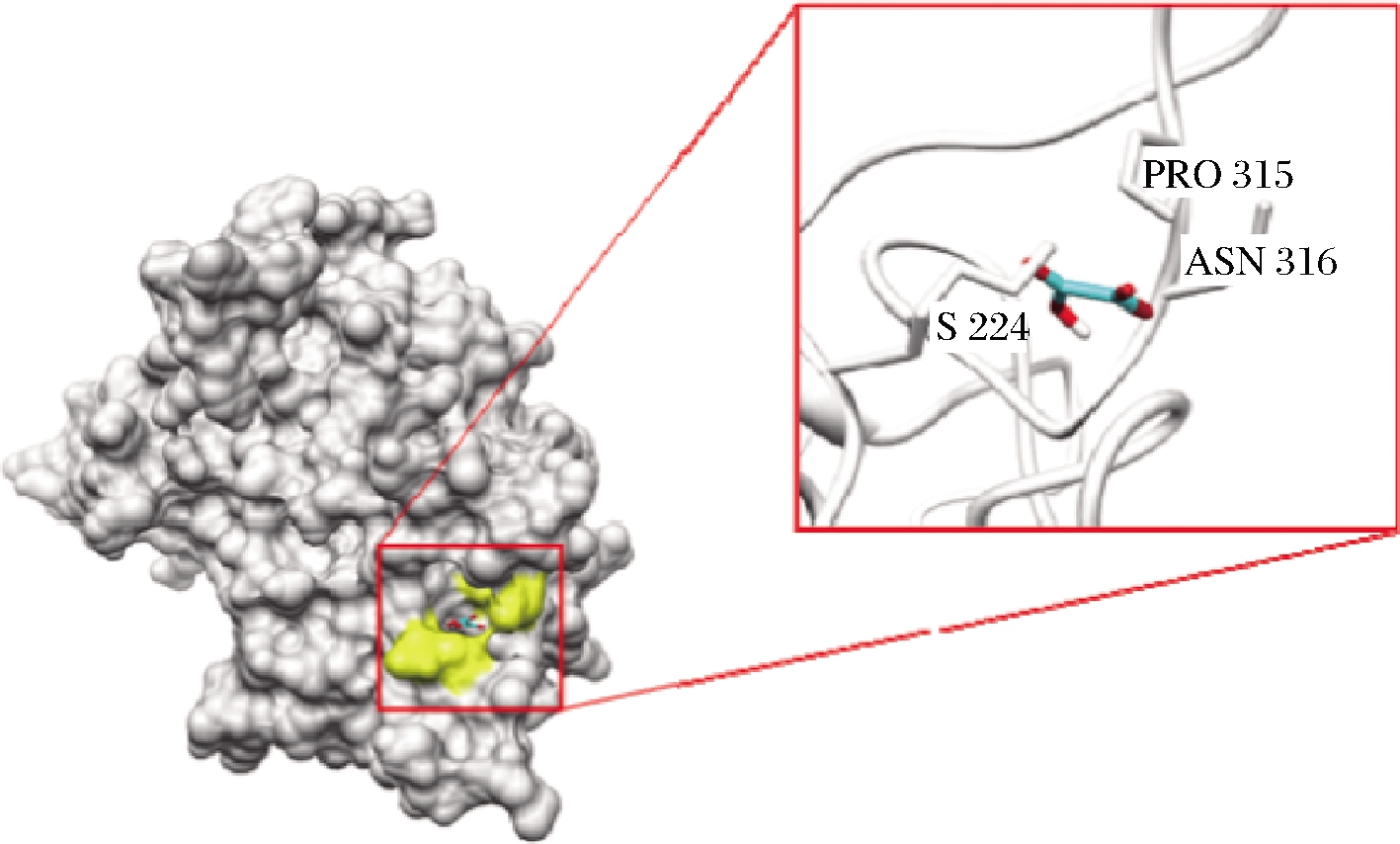
图3 PPO与草酸分子对接模拟图[41]
Fig.3 Docking simulation of PPO and oxalic acid
3.3 还原作用
抗坏血酸、L-半胱氨酸等具有还原作用的抑制剂可通过将醌还原成酚或与醌形成无色的硫醇-醌复合物,阻断了褐变产物形成抑制PPO酶活。
SI等[43]研究了抗坏血酸作用PPO后的CD光谱,发现PPO的α-螺旋含量降低,β-折叠和无规则卷曲的含量增加,PPO二级结构发生改变;通过荧光光谱分析,发现PPO荧光不断降低,内源荧光遭到猝灭,三级结构发生改变。抗坏血酸能够进入PPO活性区域,引起PPO活性位点氧化还原状态的改变,对其产生的还原作用可直接引起酶构象的改变。SENOL等[44]通过分子对接技术研究(图4),发现抗坏血酸进入酶活区域后,与PPO活性位点Phe264、His263、Ser282和Val283的氨基酸残基相互作用,并与His178和Lys180建立氢键,形成酶-抗坏血酸(AA-PPO)复合物。在AA-PPO配合物结合位点处存在疏水作用,催化位点的疏水性导致活性位点发生变化。同样地,BISWAS等[45]通过测定L-半胱氨酸处理PPO后的内源荧光,发现L-半胱氨酸对内源性荧光有一定的亲水作用,并随着浓度增加PPO表面疏水不断增强,PPO构象发生变化。L-半胱氨酸的还原作用使PPO发生部分去折叠,能直接诱导疏水表面的暴露,导致PPO三级结构变化[46]。还原类抑制剂与PPO特异性结合后,能直接引起PPO区域活性位点上构象的变化,即表现为疏水表面的逐渐暴露,活性位点疏水性增强。
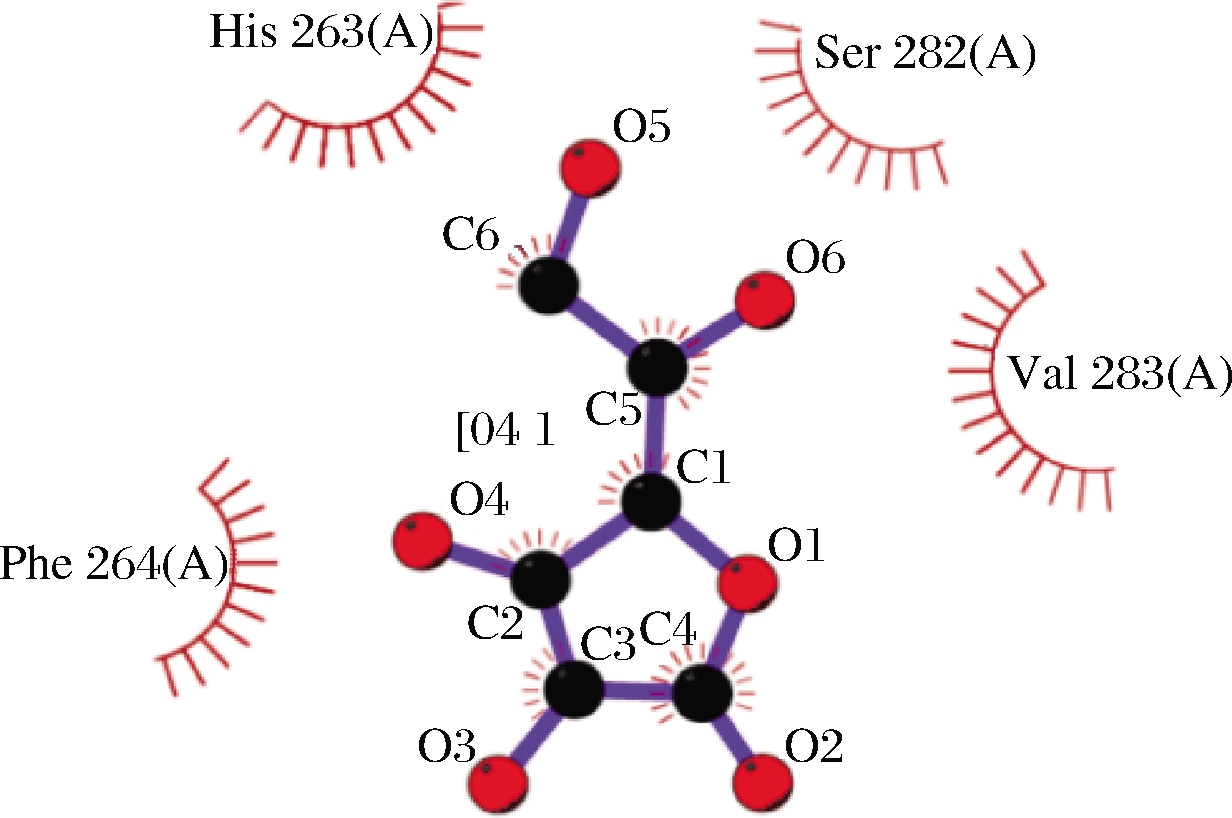
图4 PPO与抗坏血酸对接模拟图[44]
Fig.4 Docking simulation of PPO and ascorbic acid diagram
3.4 强结合作用
具有强结合作用的抑制剂会附着在活性位点或非活性位点形成复合物,通过空间位阻或改变蛋白质构象,抑制酶活。这些抑制剂大多是竞争性抑制剂,肉桂酸及其类似物可通过强结合作用来有效抑制PPO酶活。
ZHOU等[34]研究了肉桂酸对PPO构象的影响,通过CD光谱分析,发现随着肉桂酸浓度增加,其负椭圆值逐渐变大,表明PPO的有序结构出现下降;同时PPO中的α-螺旋含量逐渐下降,β-折叠含量略微上升,二级结构发生变化;通过荧光光谱分析,发现PPO荧光强度逐渐降低,最大吸收峰出现红移,PPO三级结构遭到破坏。可见,肉桂酸与PPO的强结合既能引起 PPO二级结构发生重排又导致PPO三级结构发生改变。YU等[47]用分子模拟分析PPO与肉桂酸结合方式(图5),发现肉桂酸能够嵌入PPO的疏水空腔,其苯环与His263残基形成π-π堆积,肉桂酸与PPO结合后能形成一个牢固的复合物,破坏了Trp、Tyr与铜离子之间的氢键,造成PPO功能损失。同样地,CUI等[48]研究了4-氯肉桂酸和4-乙氧肉桂酸两种肉桂酸衍生物对PPO的荧光变化,发现两者均能对PPO的内源荧光有猝灭作用,最大发射峰发生明显的位移,PPO三级结构发生改变。肉桂酸类抑制剂与PPO多肽链结合后,表现出强黏结作用,能破坏PPO活性区域附近的一些氨基酸残基与Cu2+之间的氢键,导致PPO多肽链氢键网络结构重排,PPO构象发生改变。
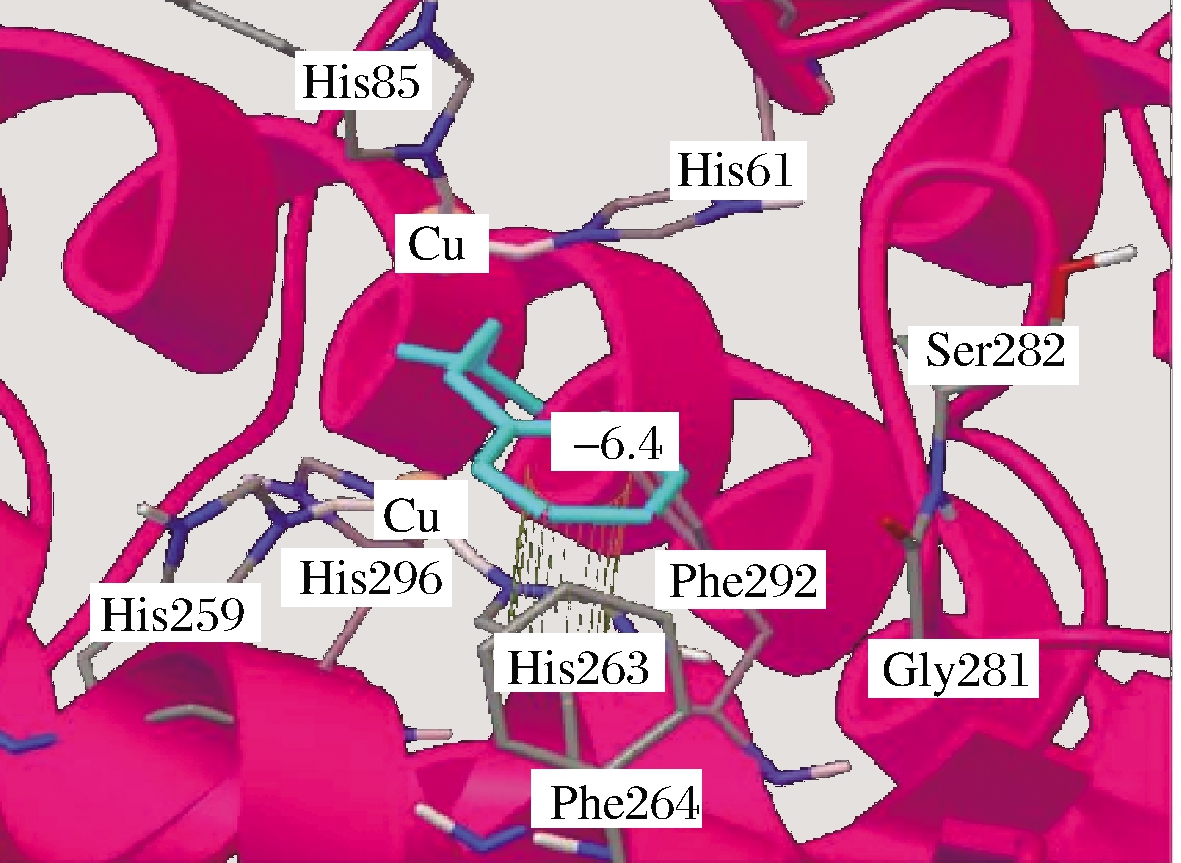
图5 PPO与肉桂酸分子对接模拟图[47]
Fig.5 Docking simulation of PPO and cinnamic acid
4 展望
由于PPO来源广泛,不同种类之间又存在一定的差异性,导致相同抑制剂对不同PPO产生的抑制效果也会不尽相同。随着科研工作者对不同果蔬食品中PPO的酶学研究不断深入,PPO的性质、酶促褐变机理、各种酚类底物与PPO的亲和力差异、化学抑制剂对PPO活性的抑制机理等内容将会越来越丰富和清晰。
目前,关于化学抑制剂对 PPO 活性影响的研究较多,但是对于化学抑制剂处理后PPO分子构象变化的研究较少。关于 PPO 的活性位点Cu2+的变化、酶促褐变机理、PPO二级结构和三级结构变化以及构象变化与酶促褐变反应之间的关联等方面还有待进一步研究探讨。随着现代科学技术的不断发展,蛋白质组学、分子和动力学模拟等技术将更多的应用于PPO研究,同时加强从分子水平上对PPO的深入研究,可为探明酶促褐变机理提供更多新方法。
[1] MAYER A M.Polyphenol oxidase in plants and fungi:Going places? A review[J].Phytochemistry, 2006, 67(21):2 318-2 331.
[2] ISMAYA W T, ROZEBOOM H J, WEI J A, et al.Crystal structure of Agaricus bisporus mushroom tyrosinase:Identity of the tetramer subunits and interaction with tropolone[J].Biochemistry, 2011, 50(24), 5 477-5 486.
[3] THYGESEN P W, DRY I B, ROBINSON S P.Polyphenol oxidase in potato-A multigene family that exhibits differential expression patterns[J].Plant Physiology, 1995, 109:525-531.
[4] KIM J Y, SEO Y S, KIM J E, et al.Two polyphenol oxidases are differentially expressed during vegetative and reproductive development and in response to wounding in the Fuji apple[J].Plant Science, 2001,161(6):1 145-1 152.
[5] GOODING P S, BIRD C, ROBINSON S P.Molecular cloning and characterisation of banana fruit polyphenol oxidase[J].Planta, 2001, 213:748-757.
[6] GERDEMANN C, EICKEN C, KREBS B, et al.The crystal structure of catechol oxidase:New insight into the function of type-3 copper proteins[J].Accounts of Chemical Research, 2002, 35(3):183-191.
[7] SUN H J, WANG J, TAO X M, et al.Purification and characterization of polyphenol oxidase from fape flower[J].Journal of Agricultural and Food Chemistry, 2012, 60(3):823-829.
[8] 弓志青,王文亮.果蔬采后酶促褐变机理及影响褐变的因素研究进展[J].中国食物与营养, 2012, 18(2):30-33.
GONG Z Q, WANG W L.Research advancement of enzymatic browning mechanism after harvest of the fruit and vegetable and its influence factors[J].Food and Nutrition in China, 2012, 18(2):30-33.
[9] 齐笑笑.果蔬采后酶促褐变机理及控制方法研究进展[J].北方园艺,2017(11):190-194.
QI X X.Research advance in enzymatic browning and inhibition method of postharvest of fruits and vegetables[J].Northern Horticulture, 2017(11):190-194.
[10] CHEEMA S, SOMMERHALTER M.Characterization of polyphenol oxidase activity in Ataulfo mango[J].Food Chemistry, 2015, 171:382-387.
[11] DU Y Q, DOU S J, WU S.Efficacy of phytic acid as an inhibitor of enzymatic and non enzymatic browning in apple juice[J].Food Chemistry, 2012, 135(2):580-582.
[12] ÜNAL MÜÜ.Properties of polyphenol oxidase from Anamur banana (Musa cavendishii)[J].Food Chemistry, 2007, 100(3):909-913.
[13] YORUK R, MARSHALL M R.A survey on the potential mode of inhibition for oxalic acid on polyphenol oxidase[J].Journal of Food Science, 2003, 68(8):2 479-2 485.
[14] SGROPPO S C, VERGARA L E, TENEV M D.Effects of sodium metabisulphite and citric acid on the shelf life of fresh cut sweet potatoes[J].Spanish Journal of Agricultural Research,2010,8(3):686-693.
[15] WILCOX D E, PORRAS A G, HWANG Y J, et al.Substrate analog binding to the coupled binuclear copper active site in tyrosinase[J].Chem Inform, 1985, 107(13):4 015-4 027.
[16] WU Y F, TSAI T H.Effect of organic acids on copper chemical mechanical polishing[J].Microelectronic Engineering, 2007, 84(12):2 790-2 798.
[17] PALMAOROZCO G, ORTIZMORENO A, DORANTES- LVAREZ L, et al.Purification and partial biochemical characterization of polyphenol oxidase from mamey (Pouteria sapota)[J].Phytochemistry, 2011, 72(1):82-88.
LVAREZ L, et al.Purification and partial biochemical characterization of polyphenol oxidase from mamey (Pouteria sapota)[J].Phytochemistry, 2011, 72(1):82-88.
[18] IONIF E, GURGU L, APRODU I, et al.Characterization, purification, and temperature/pressure stability of polyphenol oxidase extracted from plums (Prunus domestica)[J].Process Biochemistry, 2017, 56:177-185.
E, GURGU L, APRODU I, et al.Characterization, purification, and temperature/pressure stability of polyphenol oxidase extracted from plums (Prunus domestica)[J].Process Biochemistry, 2017, 56:177-185.
[19] DAS J R, BHAT S G, GOWDA L R.Purification and characterization of a polyphenol oxidase from the Kew cultivar of Indian pineapple fruit[J].Journal of Agricultural and Food Chemistry, 1997, 45(6):2 031-2 035.
[20] YAN S L, LUO Y G, ZHOU B, et al.Dual effectiveness of ascorbic acid and ethanol combined treatment to inhibit browning and inactivate pathogens on fresh-cut apples[J].LWT Food Science & Technology, 2017, 80:311-320.
[21] 梁晓璐,陈义伦.抗坏血酸钙处理对鲜切鸭梨品质的影响[J].食品与发酵工业,2012,38(1):190-194.
LIANG X L, CHEN Y L.Effect of calcium ascorbate treatment on the quality in fresh-cut Yali pear[J].Food and Fermentation Industries, 2012,38(1):190-194.
[22] ALI H M, EIGIZAWY A M, ELBASSIOUNY R E, et al.Browning inhibition mechanisms by cysteine, ascorbic acid and citric acid, and identifying PPO-catechol-cysteine reaction products[J].Journal of Food Science & Technology, 2015, 52 (6):3 651-3 659.
[23] BACHEM C W, HOEVEN R S V D, BRUIJN S M D, et al.Visualization of differential gene expression using a novel method of RNA fingerprinting based on AFLP:Analysis of gene expression during potato tuber development[J].Plant Journal, 1996, 9(5):745-753.
[24] FRIEDMAN M, MOLN R-PERL I, KNIGHTON D R.Browning prevention in fresh and dehydrated potatoes by SH-containing amino acids[J].Food Additives & Contaminants, 1992, 9(5):499-503.
R-PERL I, KNIGHTON D R.Browning prevention in fresh and dehydrated potatoes by SH-containing amino acids[J].Food Additives & Contaminants, 1992, 9(5):499-503.
[25] NEGISHI O, OZAWZ T.Inhibition of enzymatic browning and protection of sulfhydrl enzymes by thiol compounds[J].Phytochemistry,2000,54(5):481-487.
[26] ROBERT C, ROUCH C, CADET F.Inhibition of palmito (Acanthophoenix rubra) polyphenol oxidase by carboxylic acids[J].Food Chemistry, 1997, 59(3):355-360.
[27] SUKHONTHARA S, KAEWKA K, THEERAKULKAIT C.Inhibitory effect of rice bran extracts and its phenolic compounds on polyphenol oxidase activity and browning in potato and apple puree[J].Food Chemistry, 2016, 190:922-927.
[28] BATTAINI G, MONZANI E, CASELLA L, et al.Inhibition of the catecholase activity of biomimetic dinuclear copper complexes by kojic acid[J].Journal of Biological Inorganic Chemistry, 2000, 5(2):262-268.
[29] KAHN V, BEN-SHALOM N, ZAKIN V.Effect of kojic acid on the oxidation of N-acetyldopamine by mushroom tyrosinase[J].Journal of agricultural and food chemistry, 1997, 45(11):4 460-4 465.
[30] LEE M Y, LEE M K, PARK I.Inhibitory effect of onion extracton polyphenol oxidase and enzymatic browning of taro (Colocasiaanti-quorum var.esculenta)[J].Food Chemistry, 2007,105(2):528-532.
[31] KIM M J, KIM C Y, PARK I.Prevention of enzymatic browning of pear by onion extract[J].Food Chemistry, 2005, 89(2):181-184.
[32] GUERRERO BELTR N J A, SWANSON B G, BARBOSA
N J A, SWANSON B G, BARBOSA ![]() G V.Inhibition of polyphenoloxidase in mango puree with 4-hexylresorcinol, cysteine and ascorbic acid[J].LWT-Food Science and Technology, 2005, 38(6):625-630.
G V.Inhibition of polyphenoloxidase in mango puree with 4-hexylresorcinol, cysteine and ascorbic acid[J].LWT-Food Science and Technology, 2005, 38(6):625-630.
[33] LUO Y, BARBOSACANOVAS G V.Enzymatic browning and its inhibition in new apple cultivars slices using 4-hexylresorcinol in combination with ascorbic acid[J].Food Science and Technology International, 1997, 3(3), 195-201.
[34] ZHOU L, LIAO T, LIU W, et al.Inhibitory effects of organic acids on polyphenol oxidase:From model systems to food systems[J].Critical Reviews in Food Science and Nutrition, 2020,60(21):3 594-3 621.
[35] SHI C,DAI Y,LIU Q,et al.The FT-IR spectrometric analysis of the changes of polyphenol oxidase Ⅱ secondary structure[J].Journal of Molecular Structure,2003,644(1):139-144.
[36] LIU W, ZOU L, LIU J, et al.The effect of citric acid on the activity, thermodynamics and conformation of mushroom polyphenol oxidase[J].Food Chemistry,2013,140(1-2):289-295.
[37] 方志超,周磊,刘伟,等.乳酸对多酚氧化酶活性与构象的影响[J].食品工业科技,2014,35(16):117-120.
FANG Z C, ZHOU L, LIU W, et al.Effect of lactic acid on activity and conformation of polyphenol oxidase[J].Science and Technology of Food Industry, 2014,35(16):117-120.
[38] YI J Y, JIANG B, ZHANG Z, et al.Effect of ultrahigh hydrostatic pressure on the activity and structure of mushroom (Agaricus bisporus) polyphenoloxidase[J].Journal of Agricultural & Food Chemistry, 2012, 60(2):593-599.
[39] RAPEANU G, LOEY A V, SMOUT C, et al.Biochemical characterization and process stability of polyphenoloxidase extracted from Victoria grape (Vitis vinifera ssp.Sativa)[J].Food Chemistry, 2006, 94(2):253-261.
[40] 严莉,朴龙斗,周海梦. Computational simulations integrating inhibition kinetics of tyrosinase by oxalic acid [C].第十届全国酶学学术讨论会论文集,杭州:中国生物化学与分子生物学会, 2011.
YAN L, PIAO L D, ZHOU H M. Computational simulations integrating inhibition kinetics of tyrosinase by oxalic acid[C].Proceedings of the Tenth National Symposium on Enzymology, Hangzhou: The Chinese Society of Biochemistry and Molecular Biology,2011.
[41] NOKTHAI P, LEE V S, SHANK L, et al.Molecular modeling of peroxidase and polyphenol oxidase:substrate specificity and active site comparison[J].International Journal of Molecular Sciences, 11(9):3 266-3 276.
[42] LIU W B, YOU X,WANG C L, et al.Study on the interaction of kojic acid with tyrosinase by spectroscopic methods[J].Journal of Computational Chemistry & Molecular Modeling 2020,4(2):365-375.
[43] SI Y X, WANG Z J, PARK D, et al.Effect of hesperetin on tyrosinase:Inhibition kinetics integrated computational simulation study[J].International Journal of Biological Macromolecules, 2012, 50(1):257-262.
[44] SENOL F S, KHAN M T H, ORHAN G, et al.In silico approach to inhibition of tyrosinase by ascorbic acid using molecular docking simulations[J].Current Topics in Medicinal Chemistry, 2014, 14(12):1 469-1 472.
[45] BISWAS R, MUKHERJEE P K, DALAI M K, et al.Tyrosinase inhibitory potential of purpurin in Rubia cordifolia-A bioactivity guided approach[J].Industrial Crops and Products, 2015, 74:319-326.
[46] ROBERT C, RICHARD-FORBET F, ROUCH C, et al.A kinetic study of the inhibition of palmito polyphenol oxidase by L-cysteine[J].International Journal of Biochemistry & Cell Biology, 1996, 28(4):457-463.
[47] YU Q Y, FAN L P, DUAN Z H.Five individual polyphenols as tyrosinase inhibitors:Inhibitory activity, synergistic effect, action mechanism, and molecular docking.[J].Food Chemistry,2019,297:124 910.
[48] CUI Y, HU Y H, YU H, et al.Inhibition kinetics and molecular simulation of p -substituted cinnamic acid derivatives on tyrosinase[J].International Journal of Biological Macromolecules, 2017,95(9):1 289-1 297.