我国是水产养殖和捕捞大国,其中虾类资源丰富,2019年我国虾类年产量约为685万t[1]。在捕捞过程中获得个体小、价格低的虾及加工过程中产生的副产物统称为低值虾,包括毛虾及各类虾头、虾壳、虾尾等,约占总产量的40%。目前虾及其副产物多被用来制作虾酱、饮料、海鲜风味料或作饲料、肥料,虾头、虾壳等因富含活性物质可用来提取虾青素、虾油和甲壳素等,但在化学加工中可能造成资源二次浪费或增加成本,故以生物转化的方式提高低值虾的利用率已成为近年来的研究热点。
生物活性肽是蛋白质通过发酵或酶解后经分离纯化得到的具有特定生理功效的肽段或氨基酸[2],现已从不同物质中鉴定出3 200多类生物活性肽[3],因氨基酸组成不同而具有不同功能特性。与人工合成的活性物质相比,生物活性肽具有选择性生理作用、易消化吸收、无毒副作用等突出优势[4]。目前,活性肽的来源主要为植物及乳制品,以虾类及其副产物为原料制备生物活性肽,不仅充分利用水产资源、减少污染,而且从不同虾类蛋白肽中鉴定出的多种生物活性表明,虾及其副产物可作为活性肽的良好来源应用于医药和食品领域,具有开发保健食品的潜能和较大的经济效益。本文从虾类生物活性肽的分离纯化与鉴定、活性类型及结构特征等方面进行综述,完整地展现虾类生物活性肽的应用,为虾类活性肽的继续开发和虾类高值化利用提供参考。
1 虾类生物活性肽的分离提取
1.1 自溶作用
虾体内除营养成分外还富含活性很高的内源酶,包括蛋白酶、磷酸酶、核酸酶和羧肽酶等[5],其中虾头中蛋白酶的种类和含量甚至高于虾肉。在一定条件下内源酶被激活,释放至周围与相应的机体组织反应、蛋白质发生降解,从而引起虾的自溶作用。虾中的蛋白质以氨基酸、肽和可溶性蛋白质的形式释放出来[6],这是获得虾类活性物质的一种常见方式。为提高自溶作用产生蛋白质的得率,除了从温度、pH、反应时间和底物浓度等因素优化自溶条件外,还可使用超声波[7]、紫外照射[8]等技术辅助或诱导自溶。但自溶作用过程中内源酶的种类较多且常与外源酶共同作用,这就不可避免地产生组分复杂的产物[6],且细菌迅速繁殖导致虾类腐败,常采用物理方法或化学技术等破坏细胞组织或抑制酶的活性,从而调控自溶作用的进程。
1.2 外源酶水解
制备多肽最常用的方法是酶解法,即蛋白质以一定比例与水复配后加入适量蛋白酶进行水解。常用的酶制剂有碱性蛋白酶、风味蛋白酶、动物蛋白酶和木瓜蛋白酶等,不同虾类多肽酶解条件见表1。因酶解位点不同所得多肽的活性也有所不同,付雪艳等[9]分别使用碱性蛋白酶和中性蛋白酶水解中国毛虾,结果显示碱性酶解多肽具有一定的降压作用。
表1 不同虾类蛋白源多肽的酶解条件
Table 1 The enzymatic hydrolysis conditions of different shrimp protein source peptides
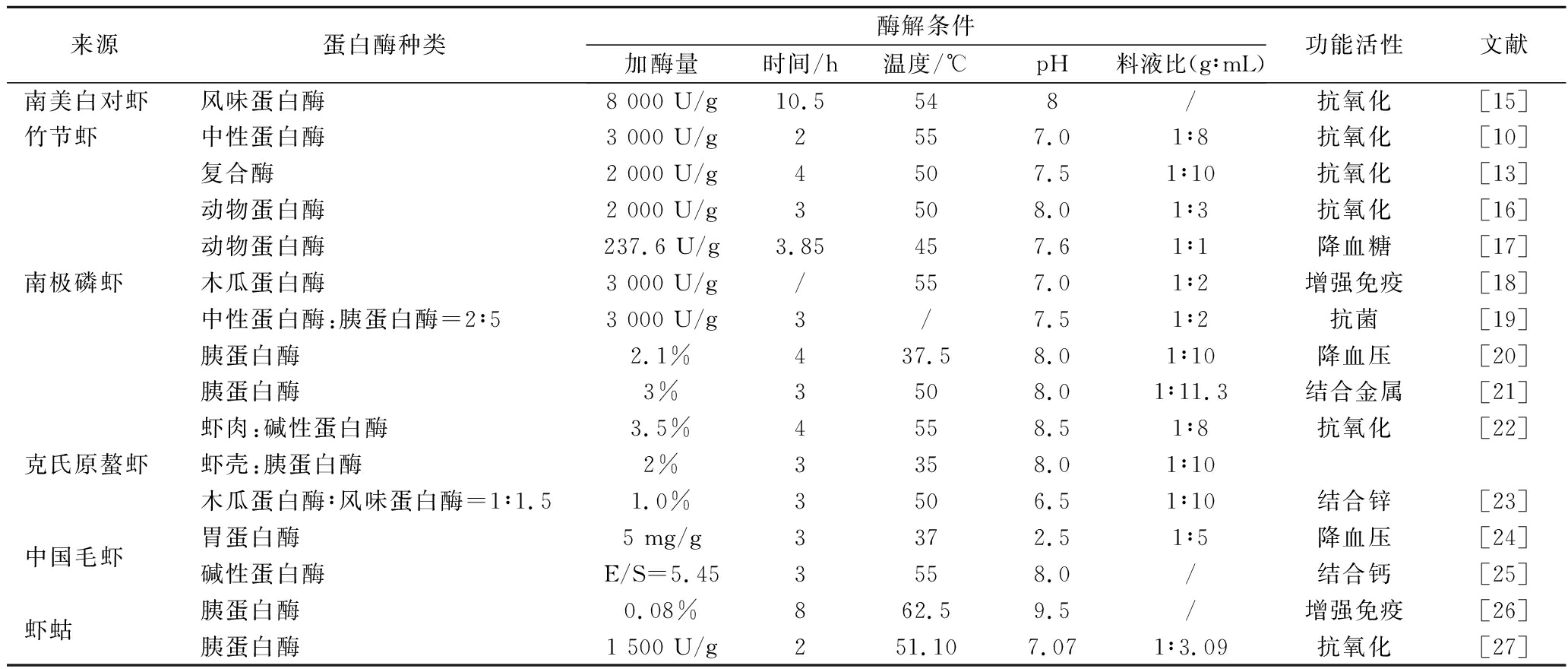
来源蛋白酶种类酶解条件加酶量时间/h温度/℃pH料液比(g∶mL)功能活性文献南美白对虾风味蛋白酶8 000 U/g10.5548/抗氧化[15]竹节虾中性蛋白酶3 000 U/g2557.01∶8抗氧化[10]复合酶2 000 U/g4507.51∶10抗氧化[13]动物蛋白酶2 000 U/g3508.01∶3抗氧化[16]动物蛋白酶237.6 U/g3.85457.61∶1降血糖[17]南极磷虾木瓜蛋白酶3 000 U/g/557.01∶2增强免疫[18]中性蛋白酶:胰蛋白酶=2∶53 000 U/g3/7.51∶2抗菌[19]胰蛋白酶2.1%437.58.01∶10降血压[20]胰蛋白酶3%3508.01∶11.3结合金属[21]虾肉:碱性蛋白酶3.5%4558.51∶8抗氧化[22]克氏原螯虾虾壳:胰蛋白酶2%3358.01∶10木瓜蛋白酶∶风味蛋白酶=1∶1.51.0%3506.51∶10结合锌[23]中国毛虾胃蛋白酶5 mg/g3372.51∶5降血压[24]碱性蛋白酶E/S=5.453558.0/结合钙[25]虾蛄胰蛋白酶0.08%862.59.5/增强免疫[26]胰蛋白酶1 500 U/g251.107.071∶3.09抗氧化[27]
单个酶制剂对蛋白质的水解作用有限,可使用超声波[10]、微波[11]等技术辅助酶解从而提升水解效果。将2种或多种酶复合使用可显著提高蛋白水解程度和多肽得率。李静等[12]分别用5种蛋白酶于各自适宜条件下酶解低值虾粉,从中优选出中性蛋白酶和风味蛋白酶并且通过复合配制这2种蛋白酶制备得到42.93%呈味肽,这主要体现了中性蛋白酶的无明显选择性,又体现木瓜蛋白酶的专一性[13]。通过胃蛋白酶和胰蛋白酶的共同作用,可在一定程度上模拟体外胃肠消化过程所获多肽。李锐等[14]利用胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶复合酶解克氏原螯虾虾头,得到的模拟消化产物具有一定降压活性,并经分离纯化能够得到活性更高的新型肽。
1.3 食品加工
虾类通过特定食品加工过程也可获得具有生物活性的物质。在发酵过程中,微生物作用不仅使虾酱产生特殊风味还具有更强的抗氧化活性[28],KLEEKYAI等[29]从泰国传统发酵虾酱中分离纯化出抗氧化肽和血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽,但发酵过程难以控制且时间长故较少使用。此外,实验证明美拉德反应可显著增强蛋白质、肽和氨基酸的功能特性和抗氧化活性[30]。汪清等[31]对比克氏原螯虾蛋白肽及其美拉德产物的抗氧化活性得知,蛋白肽美拉德反应后还原力、羟自由基清除能力和DPPH自由基清除能力均增大,表明美拉德反应可有效提高克氏原螯虾蛋白肽的抗氧化能力,这可能由于肽在美拉德反应中羟基和吡咯基团的电子转移活性以及还原酮的供氢能力终止了自由基链反应[32]。
2 虾类生物活性肽的分离纯化及鉴定
在分离纯化过程中,通常采用多种方法使组分复杂且分子质量相近的蛋白水解物经逐步分离纯化得到较为纯净且活性较高的肽段:首先采用超滤将蛋白水解物分成分子质量不同的组分,然后选出活性最高的组分经凝胶过滤层析或离子交换色谱二次分离,最后对最高活性组分使用高效液相色谱(HPLC)进行纯化。因肽的分子质量一般小于10 kDa,柱层析时常选择sephadex G系统进行分离。固相萃取技术也是常用来分离和富集化合物的一种技术,固体吸附剂将液体中的目标物质吸附后再通过加热解吸附或洗脱液直接洗脱,其中洗脱条件对目标肽段的活性具有显著影响[33]。为得到更好的纯化效果,胡川[34]先对比了超滤膜和纳滤膜对去除小龙虾虾壳酶解液中的大分子蛋白质、多糖及小分子盐类之间的差异,结果显示超滤过程需经过2次过滤而对蛋白质损失较高,而纳滤后的酶解液不仅除盐率高还具有浓缩作用;然后又比较G25葡聚糖凝胶柱、SPE固相萃取柱和superdex 30pg 葡聚糖凝胶柱对于小龙虾虾壳多肽分离纯化的效果,其中superdex 30pg 葡聚糖凝胶柱可达到进一步除盐的效果。
纯化后的肽段要通过结构鉴定确定其氨基酸序列,常用的活性肽结构鉴定方法有质谱法、核磁共振法、紫外光谱法等。根据电离源和分析器的不同,质谱法可分为多种类型,在鉴定不同活性肽时常使用不同技术,如二肽基肽酶-IV抑制肽的鉴定常用三重四级杆质谱法(TSQ-MS)和基层辅助激光解析电离-飞行时间质谱(MALDI-ToF-MS)法[17],鉴定ACE抑制肽时使用电喷雾电离质谱(ESI-MS)[35]等。毛细管电泳-飞行时间质谱(CE-ToF-MS)可对百余种可溶性肽同时分析,适合对大分子物质进行分离分析并极大地缩短鉴定时间[36],但常用于检测紫外吸收较弱的化合物。制备虾类生物活性肽的具体操作流程见图1。
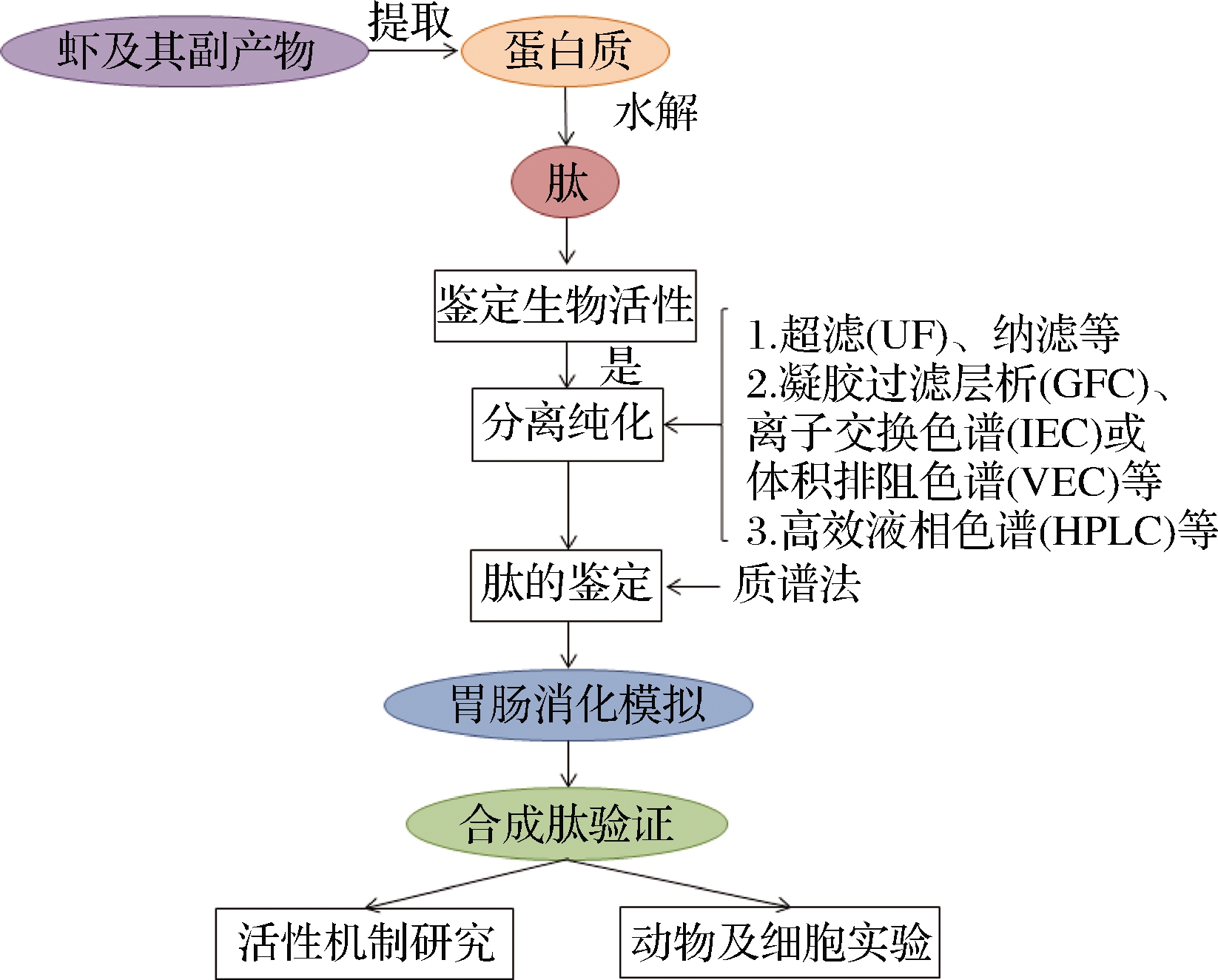
图1 制备虾类生物活性肽的常规流程
Fig.1 Routine process for preparing shrimp bioactive peptides
3 虾类生物活性肽的功能活性
目前已从不同虾及其副产物中鉴定出多种功能活性,包括抗氧化、降血压、降血糖、免疫调节、抗菌和金属结合等活性。主要虾类生物活性肽的获得方式、功能活性、结构特征及活性评价见表2。
表2 主要虾类生物活性肽
Table 2 The main bioactive peptides from shrimps
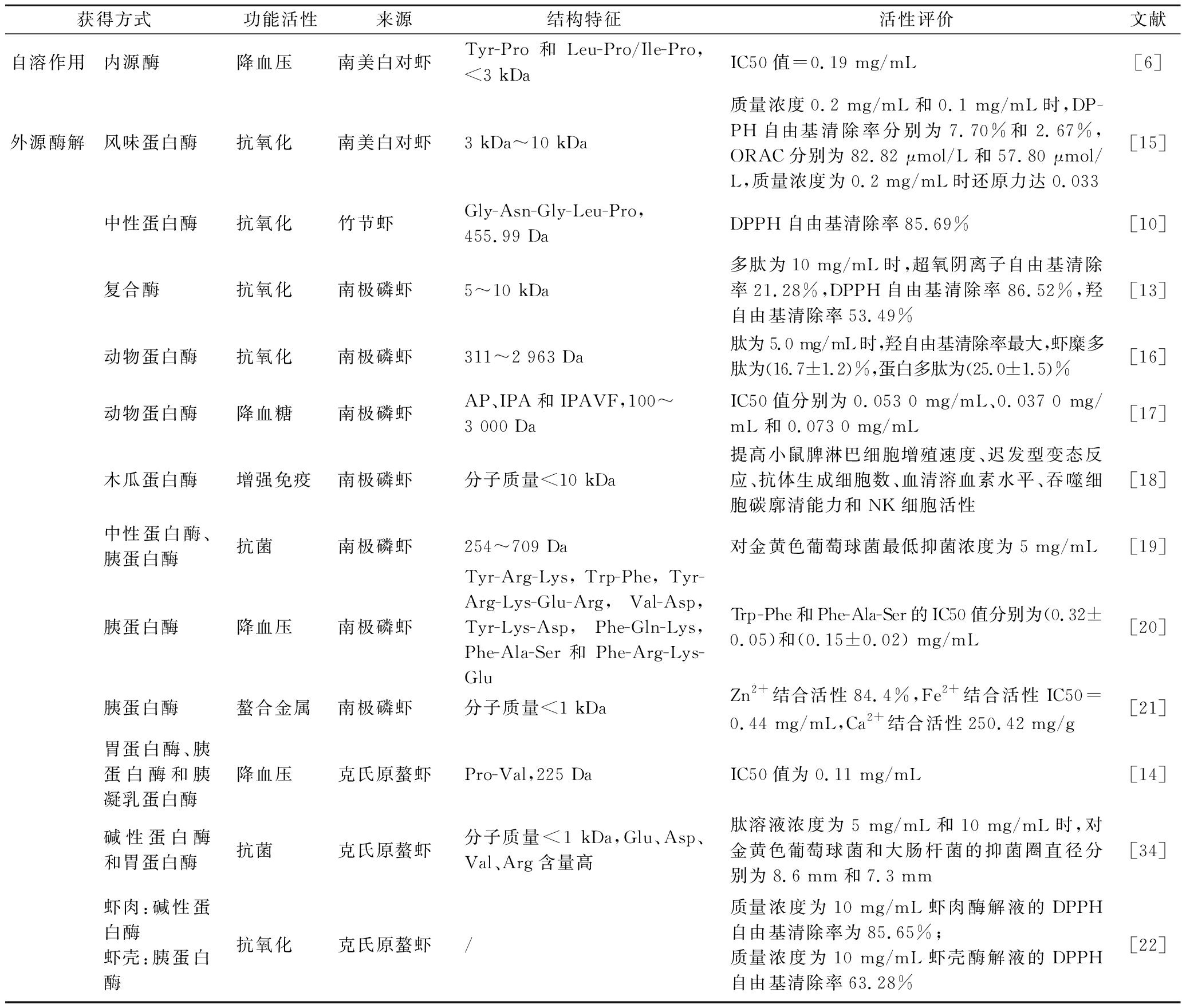
获得方式功能活性来源结构特征活性评价文献自溶作用内源酶降血压南美白对虾Tyr-Pro和Leu-Pro/Ile-Pro,<3 kDaIC50值=0.19 mg/mL[6]外源酶解风味蛋白酶抗氧化南美白对虾3 kDa~10 kDa质量浓度0.2 mg/mL和0.1 mg/mL时,DP-PH自由基清除率分别为7.70%和2.67%,ORAC分别为82.82 μmol/L和57.80 μmol/L,质量浓度为0.2 mg/mL时还原力达0.033[15]中性蛋白酶抗氧化竹节虾Gly-Asn-Gly-Leu-Pro,455.99 DaDPPH自由基清除率85.69%[10]复合酶抗氧化南极磷虾5~10 kDa多肽为10 mg/mL时,超氧阴离子自由基清除率21.28%,DPPH自由基清除率86.52%,羟自由基清除率53.49%[13]动物蛋白酶抗氧化南极磷虾311~2 963 Da肽为5.0 mg/mL时,羟自由基清除率最大,虾糜多肽为(16.7±1.2)%,蛋白多肽为(25.0±1.5)%[16]动物蛋白酶降血糖南极磷虾AP、IPA和IPAVF,100~3 000 DaIC50值分别为0.053 0 mg/mL、0.037 0 mg/mL 和0.073 0 mg/mL[17]木瓜蛋白酶增强免疫南极磷虾分子质量<10 kDa提高小鼠脾淋巴细胞增殖速度、迟发型变态反应、抗体生成细胞数、血清溶血素水平、吞噬细胞碳廓清能力和NK细胞活性[18]中性蛋白酶、胰蛋白酶抗菌南极磷虾254~709 Da对金黄色葡萄球菌最低抑菌浓度为5 mg/mL[19]胰蛋白酶降血压南极磷虾Tyr-Arg-Lys,Trp-Phe,Tyr-Arg-Lys-Glu-Arg,Val-Asp,Tyr-Lys-Asp,Phe-Gln-Lys,Phe-Ala-Ser和Phe-Arg-Lys-GluTrp-Phe和Phe-Ala-Ser的IC50值分别为(0.32±0.05)和(0.15±0.02) mg/mL[20]胰蛋白酶螯合金属南极磷虾分子质量<1 kDaZn2+结合活性84.4%,Fe2+结合活性IC50= 0.44 mg/mL,Ca2+结合活性250.42 mg/g[21]胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶降血压克氏原螯虾Pro-Val,225 DaIC50值为0.11 mg/mL[14]碱性蛋白酶和胃蛋白酶抗菌克氏原螯虾分子质量<1 kDa,Glu、Asp、Val、Arg含量高肽溶液浓度为5 mg/mL和10 mg/mL时,对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别为8.6 mm和7.3 mm[34]虾肉:碱性蛋白酶虾壳:胰蛋白酶抗氧化克氏原螯虾/质量浓度为10 mg/mL虾肉酶解液的DPPH自由基清除率为85.65%;质量浓度为10 mg/mL虾壳酶解液的DPPH自由基清除率63.28%[22]
续表2
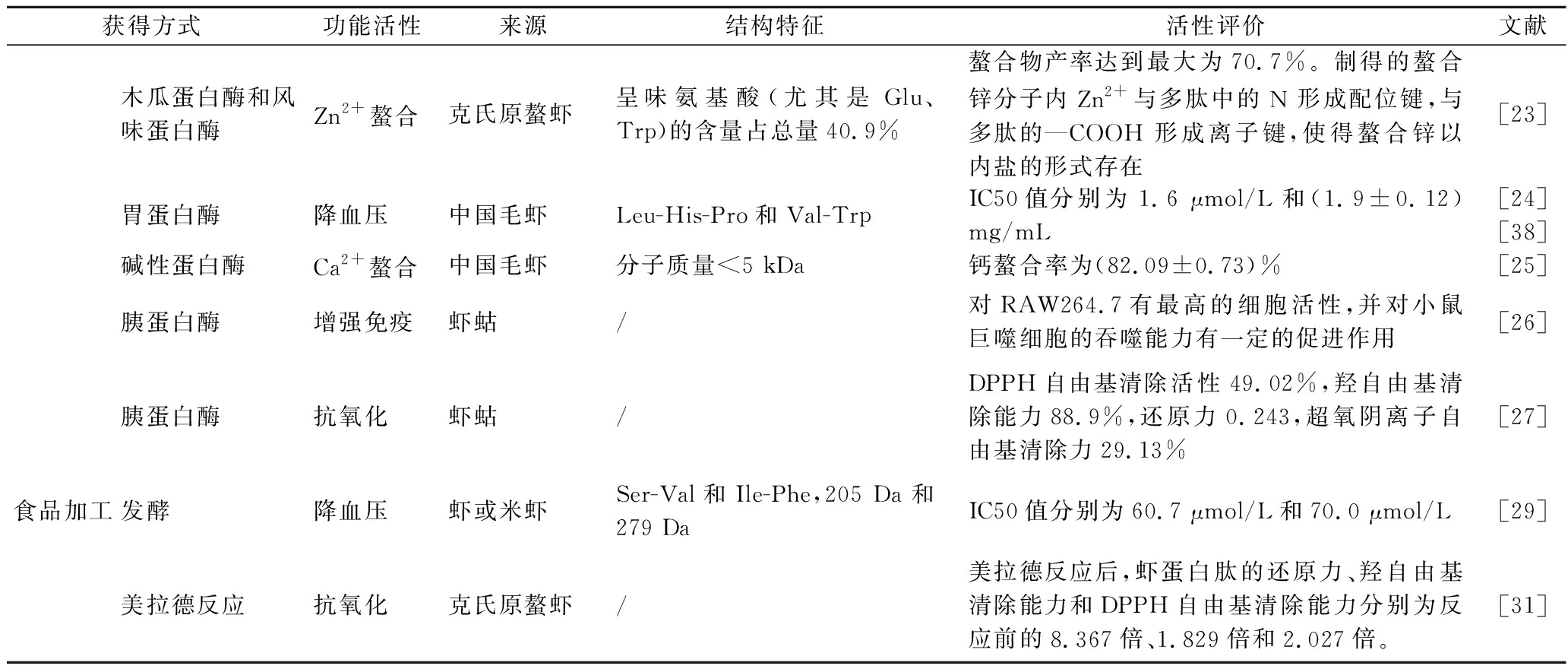
获得方式功能活性来源结构特征活性评价文献木瓜蛋白酶和风味蛋白酶Zn2+螯合克氏原螯虾呈味氨基酸(尤其是Glu、Trp)的含量占总量40.9%螯合物产率达到最大为70.7%。制得的螯合锌分子内Zn2+与多肽中的N 形成配位键,与多肽的—COOH 形成离子键,使得螯合锌以内盐的形式存在[23]胃蛋白酶降血压中国毛虾Leu-His-Pro和Val-TrpIC50值分别为1.6 μmol/L和(1.9±0.12) mg/mL[24][38]碱性蛋白酶Ca2+螯合中国毛虾分子质量<5 kDa钙螯合率为(82.09±0.73)%[25]胰蛋白酶增强免疫虾蛄/对RAW264.7有最高的细胞活性,并对小鼠巨噬细胞的吞噬能力有一定的促进作用[26]胰蛋白酶抗氧化虾蛄/DPPH自由基清除活性49.02%,羟自由基清除能力88.9%,还原力0.243,超氧阴离子自由基清除力29.13%[27]食品加工发酵降血压虾或米虾Ser-Val和Ile-Phe,205 Da和279 DaIC50值分别为60.7 μmol/L和70.0 μmol/L[29]美拉德反应抗氧化克氏原螯虾/美拉德反应后,虾蛋白肽的还原力、羟自由基清除能力和DPPH自由基清除能力分别为反应前的8.367倍、1.829倍和2.027倍。[31]
3.1 抗氧化活性
活性肽作为生物抗氧化剂可通过多种途径抑制脂质氧化和其他 生物分子氧化,包括活性氧失活、清除自由基、金属螯合、氢过氧化物减少等。因为肽段比完整的蛋白质具有更高的抗氧化活性,所以蛋白质水解生成肽类是获得抗氧化剂的更好方式[37]。已有研究表明多种虾类及其副产物是抗氧化肽的良好来源。现从凡纳滨对虾[15](3 kDa~10 kDa)、南极磷虾[16](311~2 963 Da)、竹节虾[10](Gly-Asn-Gly-Leu-Pro,455.99 Da)、克氏原螯虾[22]、虾蛄[27]等蛋白酶解产物中鉴定出抗氧化肽,经总结得知分子质量约为300~3 000 Da,并富含Gly、Leu、Pro等疏水性氨基酸,有些分子质量为3 kDa~10 kDa的蛋白质也显示出一定的抗氧化活性。由于抗氧化活性的评价指标较多且未有统一标准,故不同文献会采用不同指标反映其活性,一般来说虾类抗氧化肽的DPPH自由基清除率为50%~87%,羟自由基清除率为53%~89%,超氧阴离子自由基清除力为21%~29%,还原力为0.033~0.243,或因虾的种类、酶解条件及分离纯化程度的不同导致结果存在差异。
3.2 降压活性
高血压是一种常见的心血管疾病,影响我国约25%的成年人。目前使用的降压药多为人工合成,虽然可以显著降低血压,但存在明显副作用,而来源于虾类的降血压肽因具有天然安全、无毒副作用等优势已逐渐被人重视。降压肽是一类对ACE有抑制作用的活性肽,通过抑制ACE阻止血管紧张素I型转化为具有收缩血管作用的II型,同时阻碍扩张血管的缓激肽降解,又称为ACE抑制肽。ZHANG和CAO等[24-38]从中国毛虾胃蛋白酶水解物中分离出2条短肽(Leu-His-Pro和Val-Trp),二者均具有ACE抑制活性且前者的抑制率高达92.7%,经对自发性高血压大鼠进行动物实验表现出显著的降压作用。有研究表明虾类降血肽的ACE抑制活性与Trp、Leu、Val等疏水性氨基酸含量有关。CHEUNG等[39]研究蛋白酶类型等因素对异拟长额虾(Pandalopsis dispar)加工副产物水解物的影响,结果显示由碱性磷酸酶和复合蛋白酶水解得到的产物具有较强的ACE抑制活性,但因含有大量疏水性氨基酸而具有强烈苦味。
3.3 降糖活性
糖尿病是以高血糖为主要特征的代谢性疾病,现已成为继恶性肿瘤、心血管疾病之后的世界第三大慢性疾病,其中II型糖尿病占95%,降血糖肽因作用机制不同可分为α-葡萄糖苷酶抑制肽、α-淀粉酶抑制肽、二肽基肽酶-IV(DPP-IV)抑制肽等。虾类生物活性肽的降血糖作用主要是通过抑制DPP-IV酶实现的。DPP-IV抑制肽通过降低肠上皮细胞分泌的胰高血糖素样肽-1(GLP-1)和抑胃肽(GIP)等激素的降解速率,提高内源性GLP-1和GIP水平,促进合成胰岛素并保护胰岛β细胞,达到降低II型糖尿病患者餐后血糖的作用。目前国内外对于虾类DPP-IV抑制肽的研究较少,KETNAWA等[40]在熟制的南美白对虾蛋白酶水解液中测定出DPP-IV抑制活性(抑制率为22.7%~66.7%),且酶解液的DPP-IV抑制活性显著高于未水解的蛋白,这表明了酶解可增强蛋白质的DPP-IV抑制活性,但该实验未继续分离纯化得到特定的肽段。吉薇[17]从南极磷虾蛋白中分离出3条DPP-IV抑制肽(Ala-Pro、Ile-Pro-Ala和Ile-Pro-Ala-Val-Phe),它们的分子质量为100~3 000 Da,这表明DPP-IV抑制肽多含Ile、Val、Pro等疏水性氨基酸和Ala等氨基酸组成。
3.4 免疫调节活性
具有免疫调节功能的生物活性肽在细胞或动物实验中常显示出免疫调控作用[41],目前虾类活性肽的免疫调节作用多显示于小鼠体内实验中。徐恺[18]研究南极磷虾肽对小鼠提高免疫力等方面的影响,结果显示南极磷虾肽能够提高小鼠脾淋巴细胞增殖速度、迟发型变态反应、抗体生成细胞数、血清溶血素水平、吞噬细胞碳廓清能力和NK细胞活性,证明南极磷虾肽能够显著提高小鼠免疫力。卜天等[26]研究表明虾蛄多肽在最佳酶解条件下对小鼠巨噬细胞具有最高细胞活性并促进其吞噬能力。但国内对于虾类免疫调节肽的研究主要体现肽的功能活性,对其结构特征未有深入研究。
3.5 抗菌活性
抗菌肽能够抵抗微生物入侵起到保护宿主的作用,在发挥抑菌作用时具有抗菌谱广、不易产生耐药性的特点[42]。抗菌肽的结构较为独特,分子质量一般大于1 000 Da,含有10~50个氨基酸残基,包括数个带正电荷的氨基酸残基或在酸性条件下带有组氨酸,并且疏水性结构占比超过一半[43]。虽然虾类多肽对革兰氏阴性菌及革兰氏阳性菌都具有较好的抑制作用,但来源于不同原料的多肽其抑菌作用也有所差异。赵玲[19]筛选南极磷虾多肽各级组分对金黄色葡萄球菌等6种菌的抑菌作用,结果显示中性蛋白酶和碱性蛋白酶复合酶解多肽对金黄色葡萄球菌的抑菌活性最明显。PAN等[44]从日本沼虾中分离纯化出的蛋白MjRCP75对金黄色葡萄球菌(G+)、大肠杆菌(G-)和副溶血性弧菌(G-)均显示出明显的抗菌活性,其中对副溶血性弧菌的抑制作用最强。
3.6 金属结合活性
金属结合肽就是处于肽中心位置磷酸化的丝氨酸基团和谷氨酰残基与金属元素螯合后阻碍金属离子相互作用的活性肽,不仅可增强肽与金属元素复合物的溶解度[45],而且某些抗氧化活性也是通过螯合后抑制金属离子在生物氧化中传递而实现的,常见的螯合矿物元素有钙、锌、铁等。陈丽丽等[23]用木瓜蛋白酶和风味蛋白酶复合酶解克氏原螯虾的副产物提取多肽并与Zn2+螯合,最佳工艺下螯合物产率达70.7%。铁离子结合肽因来源丰富故结合位点较多。HUANG等[46]研究通过碱性蛋白酶水解分离虾加工副产物中的铁结合肽,结果显示水解度为8%的水解产物其铁结合能力最强;通过与铁结合肽和铁肽复合物的红外光谱比较,表明铁的结合位点主要在羧酸根基团。
4 虾类生物活性肽的结构特征
4.1 分子质量
虾类生物活性肽因原料及蛋白酶种类不同而水解度不同,分子量也有所差异,一般来说生物活性肽的分子质量小于6 kDa[47],这是因为低分子质量的肽更容易穿过胃肠屏障与目标物质结合发挥作用。经总结发现抗氧化肽的分子质量通常为300~5 000 Da;ACE抑制肽的分子质量一般为200~3 000 Da;DPP-IV抑制肽分子质量为100~3 000 Da;免疫调节肽的结构特征研究较少,故其分子质量范围较模糊;抗菌肽中以大分子肽(>1 kDa)为主,也有部分是小分子肽(<1 kDa);金属结合肽的分子质量与螯合活性间存在一定联系,一般认为铁螯合肽的分子质量在1 000 Da以下,锌螯合肽分子质量小于550 Da。同一种虾使用不同酶制剂水解得到的抗氧化肽分子质量也有所差别。郑景如等[48]使用胰蛋白酶优选南极磷虾蛋白肽具有抗氧化活性的组分,其中分子质量小于3 kDa的组分ABTS自由基清除作用最佳,分子质量为3 kDa~10 kDa的组分DPPH自由基清除率高。李芙蓉[13]对复合酶水解南极磷虾虾粉多肽的分子质量和生物活性进行研究,得知分子质量为5 kDa~10 kDa的多肽具有抗氧化活性,其中疏水性氨基酸在清除DPPH自由基和羟自由基中起主要作用。
4.2 氨基酸序列
氨基酸种类和序列是决定虾类多肽生物活性的主要因素。一般来说虾类抗氧化肽、ACE抑制肽和DPP-IV抑制肽多含Leu、Ile、Val、Pro等疏水性氨基酸及Phe、Trp等芳香族氨基酸。ZHAO等[20]从南极磷虾中分离出8种降压肽均为2~4肽,且第一位点氨基酸为Trp或Phe。DPP-IV抑制肽常为2~11肽,JI等[49]使用动物蛋白酶水解南极磷虾蛋白,采用超滤、凝胶色谱柱和RP-HPLC对水解物分离纯化后经QTof-MS鉴定出Ala-Pro(AP)和Ile-Pro-Ala(IPA)2种DPP-IV抑制肽;分子对接分析表明AP和IPA对DPP-IV抑制作用主要是由于它们与DPP-IV中91~96和101~105号氨基酸形成了强大的相互作用表面力。这表明氨基酸数量较少且多为疏水性氨基酸的结构可能便于多肽的运输并与作用位点结合。抗菌肽多含疏水性氨基酸及酸性氨基酸。JIRAVANICHPAISA等[50]从克氏原螯虾中分离纯化出一种具有14个氨基酸残基的抗菌肽(astacidin 2),其中富含脯氨酸/精氨酸,采用MALDI-ToF-MS测定得到其主要序列是带有酰胺化C末端的RPRPNURPRPIYRP,分子质量为1 838 Da。抗菌肽astacidin 2对革兰氏阳性菌和革兰氏阴性菌都具有较强的抑制作用,并且可以通过使用2种蛋白酶对N末端和C末端进行处理后合成为前肽。金属结合肽的结合能力与氨基酸残基密切相关,其中谷氨酸、天冬氨酸和组氨酸的含量在肽与Zn2+、Ca2+结合过程中至关重要。何晨[21]以南极磷虾为原料制备高纯度的金属结合肽,结果显示胰蛋白酶水解肽的Zn2+、Fe2+和Ca2+结合能力最强,这与分子质量和酸性氨基酸含量有关,表明南极磷虾肽可作为金属离子的有效载体。全沁果[51]使用碱性蛋白酶和风味蛋白酶复合酶解南极磷虾并采用硫酸锌法制备南极磷锌螯合肽,在最佳工艺条件下得到的磷虾肽其锌离子螯合率高达76.31%,其中Asn、Glu、Lys、His和Cys含量明显上升。
5 展望
目前对虾类生物活性肽的研究越来越多,但研究进展相对比较缓慢,希望未来的研究可在以下几个方面有所突破:
(1)扩大功能性研究:此前研究中原料的选择主要包括南极磷虾、克氏原螯虾、凡纳滨对虾、中国毛虾等,对于其他虾类及其副产物的研究还不是很多;已鉴定的活性肽中抗氧化肽、金属结合肽和ACE抑制肽较多,对免疫活性和降血糖活性的研究甚少。故在今后的实验中可以扩大原料选择范围并对更多活性功能展开研究。
(2)作用机理研究:在目前的研究中对虾类生物活性肽多为体外定性鉴定,少数文章进行动物实验及定量研究,而且对于某些活性肽的作用机理尚不明确。因此可将虾类活性肽的定量实验作为研究重点并在不同动物模型中进行体内活性测定,同时确定其活性机制。
(3)产品开发研究:从虾中获取生物活性肽的目的是为了将功能食品应用于人体健康管理,故对于活性肽的色、香、味等感官要求较高,但大部分生物活性肽因含有疏水性残基而不可避免地产生苦味,所以减轻或消除肽的苦味而保留生物活性也是值得关注的研究方向。
[1] 农业农村部渔业渔政管理局编. 中国渔业统计年鉴2020[M]. 北京: 中国农业出版社, 2020.
Fisheries and Fisheries Administration of the Ministry of Agriculture and Rural Affairs. China Fishery Statisical Yearbook 2020[M]. Beijing: China Agriculture Press, 2020.
[2] LIU M, WANG Y, LIU Y, et al.Bioactive peptides derived from traditional Chinese medicine and traditional Chinese food:A review[J].Food Research International, 2016, 89(1):63-73.
[3] PIOTR M, JERZY D, ANNA I, et al.BIOPEP database and other programs for processing bioactive peptide sequences[J].Journal of AOAC International, 2008, 91(4):965-980.
[4] NONGONIERMA A B, FITZGERALD R J.Structure activity relationship modelling of milk protein-derived peptides with dipeptidyl peptidase IV (DPP-IV) inhibitory activity[J].Peptides, 2016, 79:1-7.
[5] 刘志东, 王鲁民, 陈雪忠, 等.南极磷虾蛋白的研究进展[J].食品与发酵工业, 2017, 43(7):242-251.
LIU Z D, WANG L M, CHEN X Z, et al.Research progress on the protein derived from Antarctic krill (Euphausia superba Dana)[J].Food and Fermentation Industries, 2017, 43(7):242-251.
[6] 朱国萍. 凡纳滨对虾虾头自溶制备降血压肽的研究[D].湛江:广东海洋大学, 2010.
ZHU G P.Preparetion of antihypertensive peptides from Litopenaeus vnnamei head via autolysis[D].Zhanjiang:Guangdong Ocean University, 2010.
[7] 田雅清, 郑华, 林捷, 等.近江牡蛎的超声波辅助自溶及酶解条件研究[J].水产科学, 2015, 34(7):438-443.
TIAN Y Q, ZHENG H, LIN J, et al.Optimization of ultrasound-assisted autolsis and exogenous hydrolysis in Jinjiang oyster (Crassostrea rivularis)[J].Fisheries Science, 2015, 34(7):438-443.
[8] CAO W, TIAN S, WANG H, et al.Release principle of peptides and amino acids during the autolysis of shrimp head from Litopenaeus vannamei after UV-C irradiation stress[J].Food Science & Nutrition, 2019, 8(1):170-178.
[9] 付雪艳, 薛长湖, 宁岩, 等.中国毛虾酶解多肽降压作用的初步探讨[J].海洋科学, 2005, 29(3):20-24.
FU X Y, XUE C H, NING Y, et al.Study of antihypertensive effect of polypeptides from Acetes chinensis on renovasular antihypertensive rats[J].Marine Sciences, 2005, 29(3):20-24.
[10] 黄湛媛, 李丽, 熊宇飞, 等.超声辅助竹节虾头酶解及抗氧化肽分离研究[J].核农学报, 2017, 31(8):1 556-1 566.
HUANG Z Y, LI L, XIONG Y F, et al.Study on ultrasound-assisted enzymatic hydrolysis of Penaeus japonicas head and separation of the antioxidant peptides[J].Journal of Nuclear Agricultural Sciences, 2017, 31(8):1 556-1 566.
[11] SIEWE F B, KUDRE T G, BETTADAIAH B K, et al.Effects of ultrasound-assisted heating on aroma profile, peptide structure, peptide molecular weight, antioxidant activities and sensory characteristics of natural fish flavouring[J].Ultrasonics Sonochemistry, 2020, 65:105 055.
[12] 李静, 刘嘉俊, 邓毛程.低值虾制备呈味肽的酶解工艺[J].中国调味品, 2016, 41(1):112-116.
LI J, LIU J J, DENG M C.Optimization of enzymatic hydrolysis process doe prepring flavor peptide by low-value shrimp[J].China Condiment, 2016, 41(1):112-116.
[13] 李芙蓉. 南极磷虾虾粉多肽的分离纯化及活性研究[D].上海:上海海洋大学, 2019.
LI F R.Isolation, purification and activity of shrimp powder polypeptides from Antarctic krill[D].Shanghai:Shanghai Ocean University, 2019.
[14] 李锐, 邹茜, 孙玉林, 等.克氏原螯虾虾头模拟胃肠道消化产物中ACE抑制肽的分离纯化与鉴定[J].食品与发酵工业, 2019, 45(6):139-146.
LI R, ZOU Q, SUN Y L, et al.Isolation and identification of ACE inhibitory peptide from simulated gastrointestinal digestion products of crayfish (Procambarus clarkia) head[J].Food and Fermentation Industries, 2019, 45(6):139-146.
[15] 王晋, 张风, 周爱梅, 等.虾头、虾壳抗氧化肽的分离纯化及其对秀丽隐杆线虫的抗氧化作用[J].食品科学, 2019, 40(3):56-63.
WANG J, ZHANG F, ZHOU A M, et al.Purification of antioxidant peptides derived from enzymatic hydrolysates of shrimp heads and shells and their antioxidant protection in Caenorhabditis elegans[J].Food Science, 2019, 40(3):56-63.
[16] 朱俊向, 于丁一, 宋玉凤, 等.动物蛋白水解酶法制备南极磷虾多肽及其抗氧化活性[J].中国调味品, 2019, 44(4):104-107.
ZHU J X, YU D Y, SONG Y F, et al.Preparation and antioxidant activity of Antarctic krill peptidess by animal proteolytic enzyme[J].China Condiment, 2019, 44(4):104-107.
[17] 吉薇. 南极磷虾蛋白源二肽基肽酶-Ⅳ(DPP-Ⅳ)抑制肽的研究[D].湛江:广东海洋大学, 2017.
JI W.Study on dipeptidyl peptidase-IV (DPP-IV) inhibitory peptides derived from Antarctic krill protein[D].Zhanjiang:Guangdong Ocean University, 2017.
[18] 徐恺. 南极磷虾肽抗疲劳、耐缺氧以及抗衰老、提高免疫力实验研究[D].青岛:中国海洋大学, 2012.
XU K.Experimental study of the functions of Antarctic krill peptides on ftigue resistance, anti-hypoxia, anti-aging and immunity improvement[D].Qingdao:China Ocean University, 2012.
[19] 赵玲. 南极磷虾(Euphausia superba)抑菌活性肽的初步纯化及其作用机理研究[D].青岛:青岛大学, 2012.
ZHAO L.Preliminary purification and mechanism of antibacterial activity peptides from Antarctic krill (Euphausia superba)[D].Qingdao:Qingdao University, 2012.
[20] ZHAO Y Q, ZHANG L, TAO J, et al.Eight antihypertensive peptides from the protein hydrolysate of Antarctic krill (Euphausia superba):Isolation, identification, and activity evaluation on human umbilical vein endothelial cells (HUVECs)[J].Food Research International, 2019, 121:197-204.
[21] 何晨. 南极磷虾金属结合肽的制备及其结合机理研究[D].青岛:中国海洋大学, 2014.
HE C.Studies on the preparation and metal-binding mechanism of Antarctic krill peptides[D].Qingdao:China Ocean University, 2014.
[22] 时丽霞. 酶法制备克氏原螯虾活性肽及其活性初步研究[D].南京:南京农业大学, 2014.
SHI L X.Preparatoin of bioactive peptides from crayfish and prelliminary evaluation of its activity[D].Nanjing:Nanjing Agricultural University, 2014.
[23] 陈丽丽, 余江稳, 潘博, 等.克氏原螯虾壳肽螯合锌的制备其性质研究[J].江西科技师范大学学报, 2017, (6):65-70.
CHEN L L, YU J W, PAN B, et al.Study on preparation of crayfish shell polypeptides chelated with zinc and its property[J].Journal of Jiangxi Science & Technology Normal University, 2017, (6):65-70.
[24] ZHANG C, CAO W, HONG P, et al.Angiotensin I converting enzyme inhibitory activity of Acetes chinensis peptic hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J].International Journal of Food Science & Technology, 2009, 44(10):2 042-2 048.
[25] 陈新峰. 中国毛虾肽钙制备关键技术及富肽钙毛虾酱的研制[D].杭州:浙江大学, 2016.
CHEN X F.Key technology in preparation of Acetes Chinensis peptide chelating calcium and develoment of the paste enriched with peptide chelating calcium[D].Hangzhou:Zhejiang University, 2016.
[26] 卜天, 马剑茵.虾蛄多肽酶解工艺的优化及其体外免疫活性研究[J].安徽农业科学, 2015, 43(7):139-140.
BU T, MA J Y.Optimization of enzymatic hydrolysis conditions of Oratosquilla oratoria polypeptide and its immunological activity in vitro[J].Journal of Anhui Agricultural Science, 2015, 43(7):139-140.
[27] 李云涛, 陈博, 马剑茵.虾蛄肉酶法制备抗氧化肽的工艺优化和活性研究[J].海洋与湖沼, 2014, 45(2):335-340.
LI Y T, CHEN B,MA J Y.Optimization for preparation of antioxidant pepide from Oratosquilla oratoria meat by enzymatic hydrolysis[J].Oceanologia et Limnlogia Sinica, 2014, 45(2):335-340.
[28] PONGSETKUL J, BENJAKUL S, VONGKAMJAN K, et al.Changes in volatile compounds, ATP-related compounds and antioxidative properties of Kapi, produced from Acetes vulgaris, during processing and fermentation[J].Food Bioscience, 2017, 19:49-56.
[29] KLEEKAYAI T, HARNEDY P A, O'KEEFFE M B, et al.Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J].Food Chemistry, 2015, 176:441-447.
[30] XU Z Z, HUANG G Q, XU T C, et al.Comparative study on the Maillard reaction of chitosan oligosaccharide and glucose with soybean protein isolate[J].International Journal of Biological Macromolecules, 2019, 131:601-607.
[31] 汪清, 李婷, 陈丽丽, 等.克氏原螯虾蛋白肽及其美拉德反应产物抗氧化活性的研究[J].江西水产科技, 2017(2):3-8.
WANG Q, LI T, CHEN L L, et al.Study on antioxidant activity of Procambarus clarkii protein peptides and Maillard reaction products[J].Jiangxi Fishery Science and Technology, 2017(2):3-8.
[32] NOOSHKAM M, VARIDI M, VERMA D K.Functional and biological properties of Maillard conjugates and their potential application in medical and food:A review[J].Food Research International, 2020, 131:109 003.
[33] HARNEDY P A, O'KEEFFE M B, FITZGERALD R J.Purification and identification of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from the macroalga Palmaria palmata[J].Food Chemistry, 2015, 172:400-406.
[34] 胡川. 酶法水解小龙虾虾壳制备小分子生物活性肽研究[D].武汉:湖北工业大学, 2016.
HU C.Research on preparation of biologically active peptides by enzymolysis from shrimp shell[D].Wuhan:Hubei University of Technology, 2016.
[35] AIELLO G, LI Y, BOSCHIN G, et al.Chemical and biological characterization of spirulina protein hydrolysates:Focus on ACE and DPP-IV activities modulation[J].Journal of Functional Foods, 2019, 63:102 592.
[36] DUPONT D.Peptidomic as a tool for assessing protein digestion[J].Current Opinion in Food Science, 2017, 16:53-58.
[37] ELIAS R J, KELLERBY S S, DECKER E A.Antioxidant activity of proteins and peptides[J].Critical Reviews in Food Science & Nutrition, 2008, 48(5):430-441.
[38] CAO W, ZHANG C, HONG P, et al.Purification and identification of an ACE inhibitory peptide from the peptic hydrolysate of Acetes chinensis and its antihypertensive effects in spontaneously hypertensive rats[J].International Journal of Food Sicence & Technology, 2010, 45(5):959-965.
[39] CHEUNG I W Y, LI-CHAN E C Y.Angiotensin-I-converting enzyme inhibitory activity and bitterness of enzymatically-produced hydrolysates of shrimp (Pandalopsis dispar) processing byproducts investigated by Taguchi design[J].Food Chemistry, 2010, 122(4):1 003-1 012.
[40] KENTNAWA S, MARíNEZ-ALVAREZ O, GóMEZ-ESTACA J,et al.Obtaining of functional components from cooked shrimp (Penaeus vannamei) by enzymatic hydrolysis[J].Food Bioscience, 2016, 15:55-63.
[41] SANTIAGO-L PEZ L, HERN
PEZ L, HERN NDEZ-MENDOZA A, VALLEJO-CORDOBA B, et al.Food-derived immunomodulatory peptides[J].Journal of the Science of Food and Agriculture, 2016, 96(11):3 631-3 641.
NDEZ-MENDOZA A, VALLEJO-CORDOBA B, et al.Food-derived immunomodulatory peptides[J].Journal of the Science of Food and Agriculture, 2016, 96(11):3 631-3 641.
[42] 郭娟, 贠建民, 邓展瑞, 等.Bacillus pumilus HN-10抗真菌肽P-1对Trichothecium roseum的抑菌机理[J/OL].食品科学:1-9.http://kns.cnki.net/ kcms/ detail/11.2206.TS.20181130.1627.066.html.
GUO J, YUN J M, DENG Z R, et al.Antimicrobial mechanism of Bacillus pumilus HN-10 antifungal peptide P-1 against Trichothecium roseum[J/OL].Food Science:1-9.http://kns.cnki.net/ kcms/ detail/11.2206.TS.20181130.1627.066.html.
[43] 胡媛媛, 姚波.鱼类抗菌肽的研究进展[J].武汉工程大学学报, 2020, 42(1):8-17.
HU Y Y, YAO B.Advance in research of fish antimicrobial peptides[J].Journal of Wuhan Institute of Technology, 2020, 42(1):8-17.
[44] PAN C, ISHIZAKI S, CHEN S, et al.Purification, characterization and antibacterial activities of red color-related protein found in the shell of Kuruma shrimp, Marsupenaeus japonicus[J].Food Chemistry, 2020, 310:125 819.
[45] MIQUEL E, ![]() A, BARBER
A, BARBER R, et al.Casein phosphopeptides released by simulated gastrointestinal digestion of infant formulas and their potential role in mineral binding[J].International Dairy Journal, 2006, 16(9):992-1 000.
R, et al.Casein phosphopeptides released by simulated gastrointestinal digestion of infant formulas and their potential role in mineral binding[J].International Dairy Journal, 2006, 16(9):992-1 000.
[46] HUANG G, REN Z, JIANG J.Separation of iron-binding peptides from shrimp processing by-products hydrolysates[J].Food and Bioprocess Technology, 2011, 4(8):1 527-1 532.
[47] 刘铭, 刘玉环, 王允圃, 等.制备、纯化和鉴定生物活性肽的研究进展及应用[J].食品与发酵工业, 2016, 42(4):244-251.
LIU M, LIU Y H, WANG Y P, et al.Research progress on production, purification and identification of bioactive peptides and its challenges in application[J].Food and Fermentation Industries, 2016, 42(4):244-251.
[48] 郑景如, 孙馨娉, 蔡紫仪, 等.优选南极磷虾蛋白肽抗氧化活性组分[J].食品安全质量检测学报, 2020, 11(1):189-195.
ZHENG J R, SUN X P, CAI Z Y, et al.Optimizing the antioxidant components of Antarctic krill protein peptides[J].Journal of Food Safety and Quality, 2020, 11(1):189-195.
[49] JI W, ZHANG C, JI H.Purification, identification and molecular mechanism of two dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from Antarctic krill (Euphausia superba) protein hydrolysate[J].Journal of Chromatography B, 2017, 1064:56-61.
[50] JIRAVANICHPAISA L P, LEE S Y, KIM Y A, et al.Antibacterial peptides in hemocytes and hematopoietic tissue from freshwater crayfish Pacifastacus leniusculus:Characterization and expression pattern[J].Developmental & Comparative Immunology, 2007, 31(5):450-455.
[51] 全沁果. 南极磷虾蛋白源锌螯合肽的制备及其特性研究[D].湛江:广东海洋大学, 2019.
QUAN Q G.Study on preparation of zinc chelating peptide derived from Euphausia superba protein and its properties[D].Zhanjiang:Guangdong Ocean University, 2019.