猕猴桃具有丰富的营养价值,富含VC、多种矿物质、氨基酸等营养物质,是三大新兴水果之一。猕猴桃果实属于呼吸跃变型,采后常温下贮藏极易软化、腐烂,针对猕猴桃的生理特性研究的保鲜技术主要有热处理[1]、气调[2]、低温[3-4]、植物生长调节剂[5-8]、涂膜[9-10]、乙烯[11]及其抑制剂1-MCP[12-13]等。
低温能有效地延缓猕猴桃果实的软化和衰老,是维持猕猴桃贮藏品质的主要手段,但不适宜低温反而会引起冷害[14]。冷害导致果实呼吸代谢和乙烯释放异常、活性氧代谢失衡、激素代谢紊乱以及能量代谢异常等,从而加快腐烂[15]。研究发现,果实适宜成熟不仅能提高其对环境的适应性,还能增强其抗病性[16-19]。采后延迟24 h贮藏或低剂量乙烯处理通过提高抗氧化酶活性,降低呼吸速率和乙烯释放速率,有效地缓解油桃和梨的冷害[17-18]。适宜的挂树预贮能降低‘徐香’猕猴桃冷敏性,然而,挂树预贮2周或乙烯处理则促进呼吸速率和乙烯释放高峰的出现,加速果实衰老和腐烂[19-20],说明适宜成熟能维持猕猴桃果实的贮藏品质,但过于成熟则会加速腐烂。前期研究发现,猕猴桃果实后熟至可溶性固形物(total soluble solids,TSS)为9.5%时可有效延长其冷藏后货架期并维持其冷藏后货架品质[21],说明适宜后熟对果实的贮藏品质有一定的效果,但其作用效应尚不清楚。
为此,本试验以‘贵长’猕猴桃为试材,研究适宜后熟对猕猴桃低温冷藏后货架成熟时品质的影响,为猕猴桃贮藏保鲜技术研发奠定基础。
1.1.1 试验材料
‘贵长’猕猴桃,采摘自贵州省修文县平滩村猕猴桃种植基地。根据《修文县猕猴桃标准化生产规程》,当果实的TSS达到(6.5±0.5)%时采收,采后4 h内运回贵州省果品加工工程技术研究中心研究室。
1.1.2 试验仪器
PAL-BX手持型糖酸一体机,日本Atago公司;TA.XT.Plus物性测定仪,英国Stable Micro Systems公司;AS3120A小型超声波提取器,天津奥特赛恩斯仪器有限公司;UV-2550紫外分光光度计,日本岛津公司;HBS-1096A酶标分析仪,南京德铁实验设备有限公司。
1.2.1 样品处理方法
当猕猴桃TSS达到(6.5±0.5)%时采摘,选择无病虫害、无机械损伤的果实。分为3组,分别在散去田间热、后熟至TSS (9.0±0.5)%[(25±1) ℃、RH (80±5)%放置5 d])、后熟至TSS(14.5±0.5)%[(25±1) ℃、RH (80±5)%放置11 d]时,转入(4±0.5) ℃、RH (90±5)%冷库中贮藏,分别计为CK、TSS 9.5%和TSS 14.5%,每个处理3个重复。每冷藏10 d取1次样,于(25±1) ℃、RH (90±5)%下货架成熟,当硬度降至(4.5±0.5) N时,测定其腐烂率、呼吸速率、乙烯释放速率、总可溶性固形物含量和总有机酸含量。去皮取果肉部分,切碎后立即用液氮打浆于-80 ℃保存,用于测定其他指标。
1.2.2 腐烂率
各重复固定30个果实,货架成熟时统计腐烂率。腐烂率用计数法测定,按公式(1)计算腐烂率:
腐烂率![]()
(1)
1.2.3 总有机酸和TSS测定
每个重复选取5个猕猴桃,去皮切碎混匀后打浆,4 000 r/min离心10 min,上清液用于测定总有机酸和TSS。采用PAL-BX手持型糖酸一体机测定上清液的TSS,结果用%表示;取1 g上清液,用重蒸馏水定容至50 g,用PAL-BX手持型糖酸一体机测定总有机酸含量,结果用%表示。
1.2.4 呼吸速率和乙烯释放速率测定
呼吸速率和乙烯释放速率测定参照XIE等[22]方法测定。
1.2.5 营养成分的测定
抗坏血酸(vitamin C,VC)含量:采用比色法测定[23],以mg/100g表示;还原性谷胱甘肽(glutathione,GSH)含量:采用比色法测定[5],以mg/100g表示;多酚含量:采用福林酚法测定[23],以mg/100g表示。
1.2.6 活性氧代谢的测定
超氧阴离子![]() 产生速率和过氧化氢(H2O2)含量:采用比色法[24]测定,分别以mmol/(min·g)和mmol/g表示;超氧化物歧化酶(superoxide dismutase,SOD)活性:采用邻苯三酚自氧化法[11]测定,以U/g表示;脂肪氧化酶(lipoxygenase,LOX)活性:采用比色法[13]测定,以U/g表示。
产生速率和过氧化氢(H2O2)含量:采用比色法[24]测定,分别以mmol/(min·g)和mmol/g表示;超氧化物歧化酶(superoxide dismutase,SOD)活性:采用邻苯三酚自氧化法[11]测定,以U/g表示;脂肪氧化酶(lipoxygenase,LOX)活性:采用比色法[13]测定,以U/g表示。
数据分析采用Microsoft Excel软件进行计算、整理,使用SPSS 22中Duncan′s多重比较法进行组间差异分析(P<0.05),采用Graph Pad Prism 7.0绘图。
随着冷藏期的延长,猕猴桃的腐烂率呈显著上升趋势,TSS 9.5%处理能显著延缓腐烂(P<0.05),TSS 14.5%处理则加速腐烂(P<0.05)。在贮藏前30 d,对照组腐烂率高于TSS 9.5%处理组,贮藏30~40 d时对照组腐烂率急剧上升,贮藏40 d时腐烂率达100%,而处理组贮藏60 d后货架成熟时仍未完全腐烂(图1-a)。在整个过程中,猕猴桃果实TSS呈先增后降趋势,TSS 9.5%处理组果实的TSS相对稳定(图1-b)。由此说明,适宜后熟能有效维持果实内的TSS含量,延缓猕猴桃果实的腐烂。

a-腐烂率;b-TSS
图1 适宜后熟对猕猴桃冷藏后货架成熟时腐烂率和TSS的影响
Fig.1 Effect of adequate postharvest ripening on decay rate and TSS content of kiwifruit during shelf life after cold storage
注:不同小写字母表示同一天不同处理差异显著(P<0.05)(下同)
随着冷藏期的延长,对照组呼吸速率持续增加。TSS 9.5%处理组和TSS 14.5%处理组果实的呼吸速率先增后减再增。TSS 9.5%处理组在冷藏20 d后货架成熟时达到呼吸高峰,而TSS 14.5%处理组果实则在冷藏30 d后货架成熟时达到呼吸峰。后熟至TSS 9.5%处理组冷藏30 d后货架成熟呼吸速率显著低于对照组和TSS 14.5%处理组(P<0.05)(图2-a),40~50 d时TSS 9.5%处理组呼吸速率显著低于TSS 14.5%处理组(P<0.05)。随着冷藏时间延长,对照组乙烯释放速率逐渐增加。TSS 9.5%处理组果实乙烯释放速率呈先增后减趋势,TSS 14.5%处理组果实乙烯释放速率则呈先增后减再增的趋势,但均在贮藏20 d后的货架成熟时到达峰值。贮藏10 d和30~60 d,TSS 9.5%处理组果实乙烯释放速率均显著低于其他处理组(P<0.05),贮藏60 d时显著上升(P<0.05)。贮藏60 d时TSS 14.5%处理组果实乙烯释放速率与对照30 d时一致,TSS 9.5%处理组果实乙烯释放速率则显著低于TSS 14.5%处理组(P<0.05)(图2-b)。由此说明,猕猴桃果实适宜后熟能有效抑制果实冷藏后货架成熟时的呼吸速率和乙烯释放速率,降低自身代谢消耗。
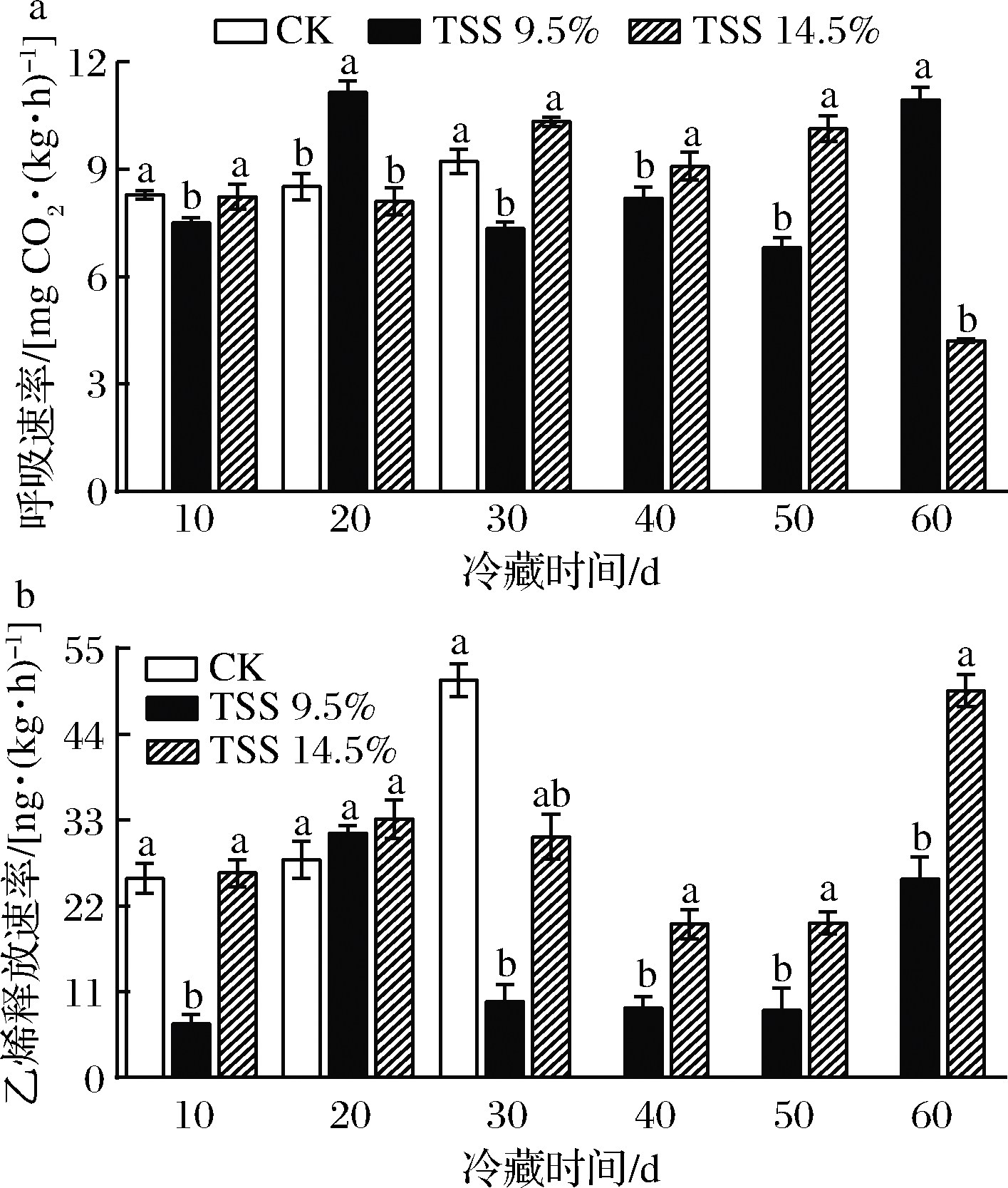
a-呼吸速率;b-乙烯生成速率
图2 适宜后熟对猕猴桃冷藏后货架成熟时呼吸速率和乙烯生成速率的影响
Fig.2 Effect of adequate postharvest ripening on the respiration rate and ethylene release rate of kiwifruit during shelf after cold storage
随着冷藏时间延长,货架成熟时总有机酸含量呈下降趋势。处理组冷藏前20 d出现上升趋势,但冷藏30 d时对照组的总有机酸含量显著高于两个处理组(P<0.05)。TSS 9.5%处理组果实总有机酸含量变化平缓,TSS 14.5%处理组总有机酸含量则逐渐增加。冷藏后货架成熟时,对照组VC含量逐渐下降。处理组先增后减,在冷藏20 d后货架成熟时达到峰值;冷藏前20 d时,TSS 9.5%处理组果实的VC含量显著高于对照组(P<0.05),贮藏30 d后则相反;整个贮藏期间,TSS 9.5%处理组果实的VC含量均显著高于TSS 14.5%处理组(P<0.05)。随着冷藏时间增加,货架成熟时对照组多酚含量下降。处理组先增后减,但峰值出现时间不同。整个过程中,对照组多酚含量显著低于后熟处理组(P<0.05),TSS 9.5%处理组在冷藏20 d货架成熟时达到峰值,显著高于其他组(P<0.05),后期则维持果实多酚含量。冷藏后货架成熟时GSH含量持续上升,处理组GSH含量则先增后减,20 d达到峰值,其中TSS 9.5%处理组果实的GSH含量显著高于其他组(P<0.05)(表1)。由此说明,适宜后熟有利于维持猕猴桃果实的营养成分。
表1 适宜后熟对猕猴桃冷藏后货架成熟时营养成分的影响
Table 1 Effect of adequate postharvest ripening on the nutrition contents of kiwifruit during shelf after cold storage
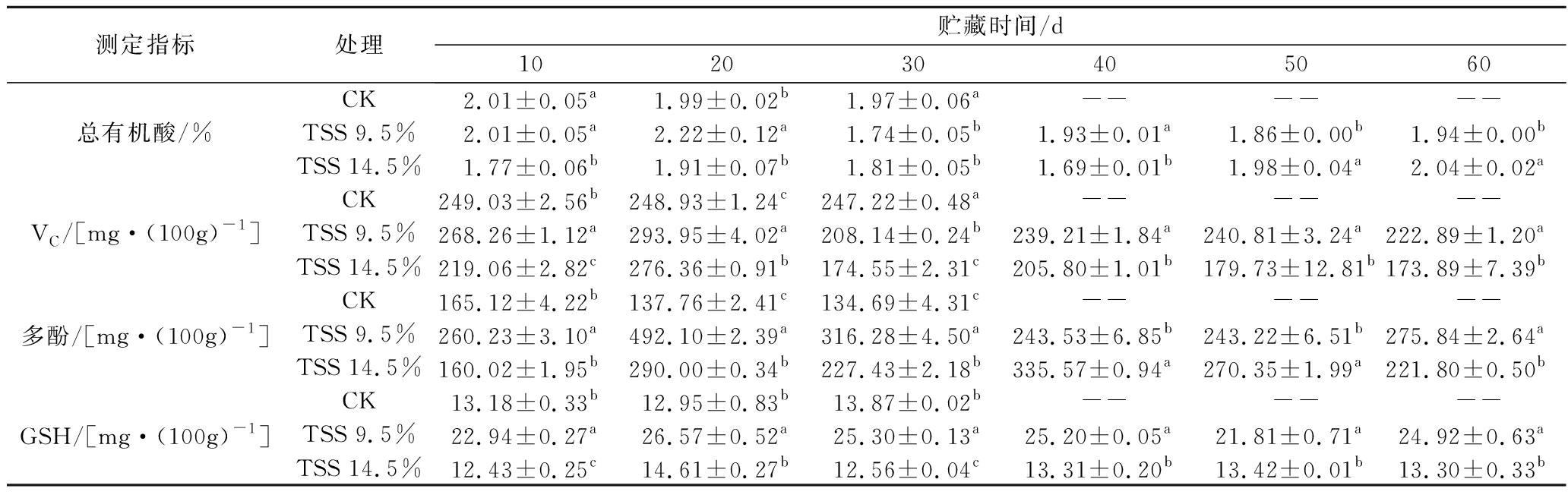
测定指标处理贮藏时间/d102030405060CK2.01±0.05a1.99±0.02b1.97±0.06a------总有机酸/%TSS 9.5%2.01±0.05a2.22±0.12a1.74±0.05b1.93±0.01a1.86±0.00b1.94±0.00bTSS 14.5%1.77±0.06b1.91±0.07b1.81±0.05b1.69±0.01b1.98±0.04a2.04±0.02aCK249.03±2.56b248.93±1.24c247.22±0.48a------VC/[mg·(100g)-1]TSS 9.5%268.26±1.12a293.95±4.02a208.14±0.24b239.21±1.84a240.81±3.24a222.89±1.20aTSS 14.5%219.06±2.82c276.36±0.91b174.55±2.31c205.80±1.01b179.73±12.81b173.89±7.39bCK165.12±4.22b137.76±2.41c134.69±4.31c------多酚/[mg·(100g)-1]TSS 9.5%260.23±3.10a492.10±2.39a316.28±4.50a243.53±6.85b243.22±6.51b275.84±2.64aTSS 14.5%160.02±1.95b290.00±0.34b227.43±2.18b335.57±0.94a270.35±1.99a221.80±0.50bCK13.18±0.33b12.95±0.83b13.87±0.02b------GSH/[mg·(100g)-1]TSS 9.5%22.94±0.27a26.57±0.52a25.30±0.13a25.20±0.05a21.81±0.71a24.92±0.63aTSS 14.5%12.43±0.25c14.61±0.27b12.56±0.04c13.31±0.20b13.42±0.01b13.30±0.33b
注:不同小写字母表示同一天不同处理差异显著(P<0.05),--表示果实已腐烂未测定
‘贵长’猕猴桃果实冷藏后货架成熟时![]() 产生速率呈先增后减趋势。后熟处理组
产生速率呈先增后减趋势。后熟处理组![]() 产生速率变化规律一致,在冷藏20 d后货架成熟时
产生速率变化规律一致,在冷藏20 d后货架成熟时![]() 产生速率均有所下降,不同处理果实
产生速率均有所下降,不同处理果实![]() 产生速率峰值及时间不同。TSS 9.5%处理组果实的
产生速率峰值及时间不同。TSS 9.5%处理组果实的![]() 产生速率均显著高于对照组和TSS 14.5%处理组(P<0.05)。猕猴桃果实冷藏后货架成熟时SOD活性呈先增后降趋势。对照组SOD活性在冷藏20 d后货架成熟时达到峰值后显著下降(P<0.05),TSS 9.5%处理组则显著延缓SOD活性下降(P<0.05);TSS 14.5%处理组果实在冷藏前30 d货架成熟时SOD活性相对稳定,冷藏30~40 d后货架成熟时显著下降(P<0.05),随后相对平稳。猕猴桃果实冷藏后货架成熟时H2O2含量呈先降后增趋势。后熟处理组均在冷藏50 d后货架成熟时H2O2含量达到峰值,随后显著下降,且TSS 9.5%处理组显著高于TSS 14.5%处理组(P<0.05)。对照组猕猴桃果实冷藏后货架成熟时LOX活性逐渐增加。TSS 14.5%处理组果实在冷藏10 d货架成熟时LOX活性显著高于对照组和TSS 9.5%处理组(P<0.05),但在冷藏20~30 d后货架成熟时显著低于TSS 9.5%处理组(P<0.05)。由此可知,适宜后熟能抑制货架成熟时LOX活性,提高
产生速率均显著高于对照组和TSS 14.5%处理组(P<0.05)。猕猴桃果实冷藏后货架成熟时SOD活性呈先增后降趋势。对照组SOD活性在冷藏20 d后货架成熟时达到峰值后显著下降(P<0.05),TSS 9.5%处理组则显著延缓SOD活性下降(P<0.05);TSS 14.5%处理组果实在冷藏前30 d货架成熟时SOD活性相对稳定,冷藏30~40 d后货架成熟时显著下降(P<0.05),随后相对平稳。猕猴桃果实冷藏后货架成熟时H2O2含量呈先降后增趋势。后熟处理组均在冷藏50 d后货架成熟时H2O2含量达到峰值,随后显著下降,且TSS 9.5%处理组显著高于TSS 14.5%处理组(P<0.05)。对照组猕猴桃果实冷藏后货架成熟时LOX活性逐渐增加。TSS 14.5%处理组果实在冷藏10 d货架成熟时LOX活性显著高于对照组和TSS 9.5%处理组(P<0.05),但在冷藏20~30 d后货架成熟时显著低于TSS 9.5%处理组(P<0.05)。由此可知,适宜后熟能抑制货架成熟时LOX活性,提高![]() 产生速率和SOD活性,加速
产生速率和SOD活性,加速![]() 向H2O2的转化,降低活性氧代谢对果实的伤害(图3)。
向H2O2的转化,降低活性氧代谢对果实的伤害(图3)。
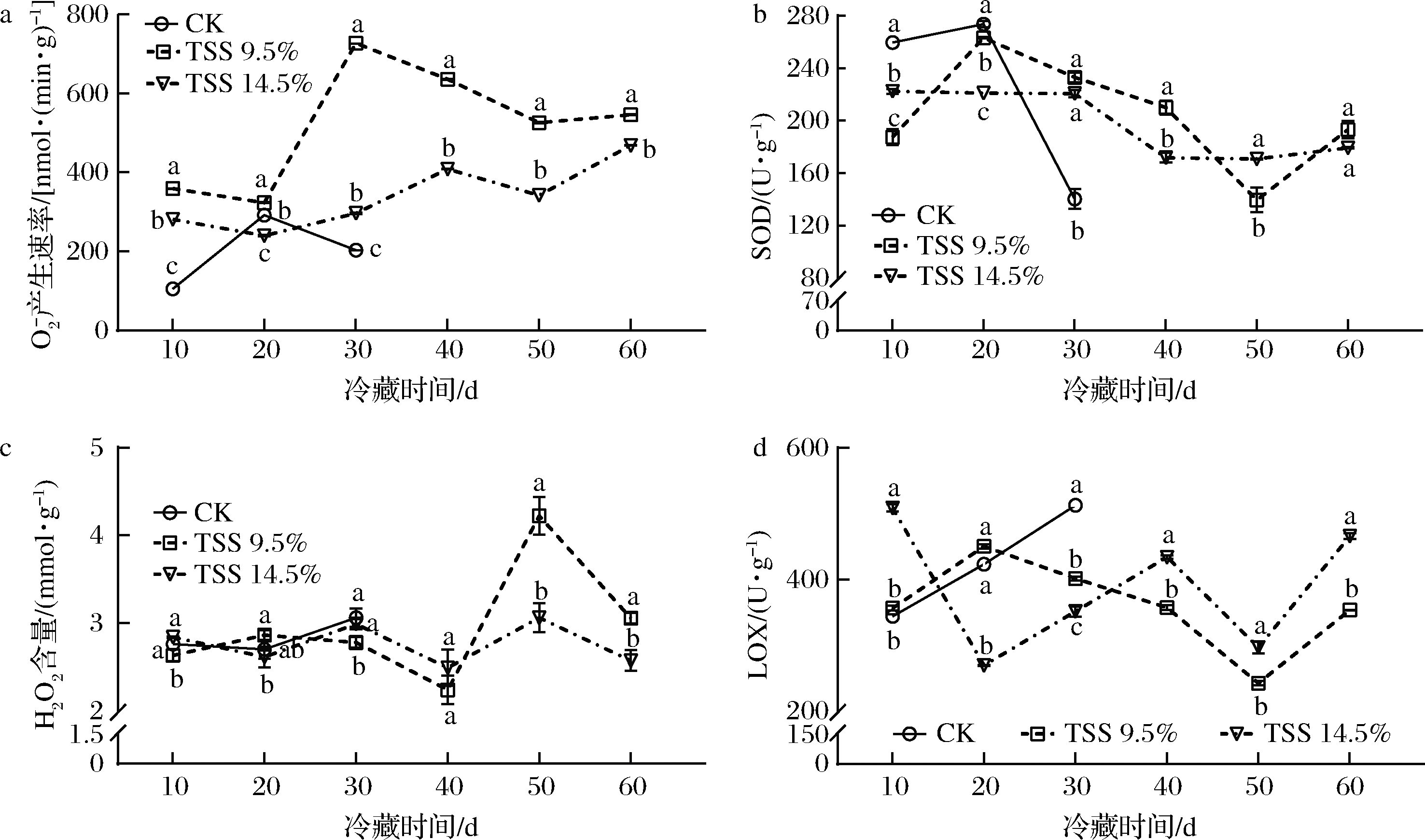
![]() 生产速率;b-SOD活性;b-H2O2含量;d-LOX活性
生产速率;b-SOD活性;b-H2O2含量;d-LOX活性
图3 适宜后熟对猕猴桃冷藏后货架活性氧的影响
Fig.3 Effect of adequate postharvest ripening on reactive oxygen species of kiwifruit during shelf after cold storage
猕猴桃冷藏后货架成熟时果实理化特性、营养成分与活性氧代谢之间关系密切(表2)。猕猴桃果实的腐烂率与![]() 含量呈极显著正相关,而与SOD活性呈极显著负相关;呼吸强度与TSS呈显著负相关;乙烯释放速率与LOX活性呈显著正相关,与GSH含量呈极显著负相关,而与
含量呈极显著正相关,而与SOD活性呈极显著负相关;呼吸强度与TSS呈显著负相关;乙烯释放速率与LOX活性呈显著正相关,与GSH含量呈极显著负相关,而与![]() 含量呈显著负相关;VC含量与H2O2含量呈极显著正相关,与LOX活性呈显著负相关;GSH含量与多酚含量和
含量呈显著负相关;VC含量与H2O2含量呈极显著正相关,与LOX活性呈显著负相关;GSH含量与多酚含量和![]() 含量呈极显著正相关;SOD活性与H2O2含量呈显著负相关。
含量呈极显著正相关;SOD活性与H2O2含量呈显著负相关。
表2 各指标间相关性分析
Table 2 Correlation analysis among indexes
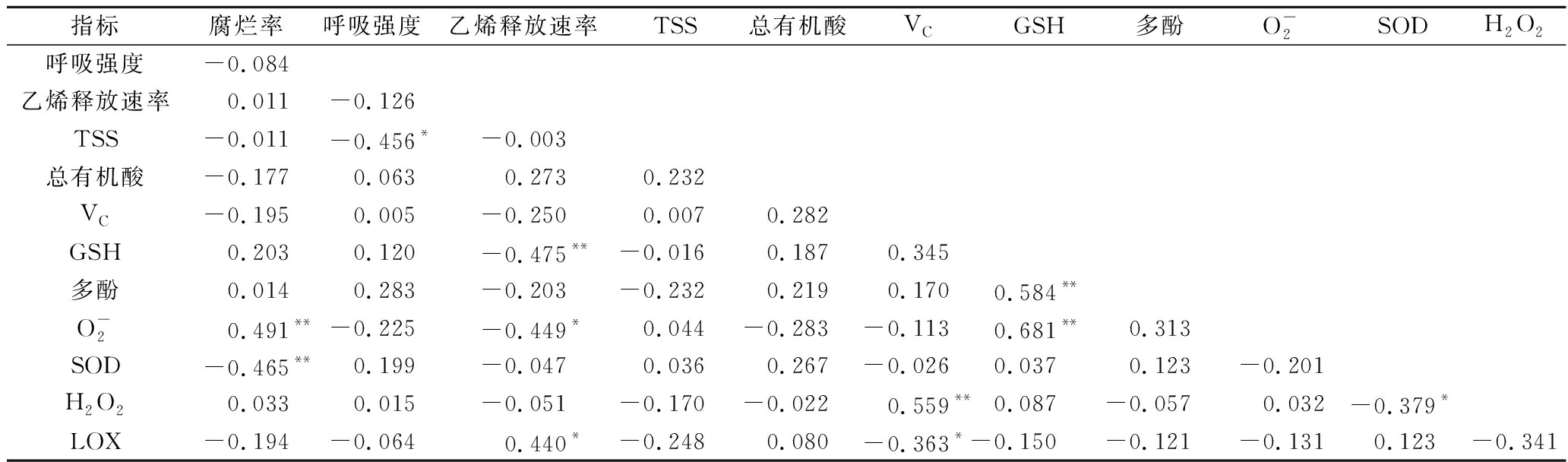
指标腐烂率呼吸强度乙烯释放速率TSS总有机酸VCGSH多酚O-2SODH2O2呼吸强度-0.084乙烯释放速率0.011-0.126TSS-0.011-0.456*-0.003总有机酸-0.1770.0630.2730.232VC-0.1950.005-0.2500.0070.282GSH0.2030.120-0.475**-0.0160.1870.345多酚0.0140.283-0.203-0.2320.2190.1700.584**O-20.491**-0.225-0.449*0.044-0.283-0.1130.681**0.313SOD-0.465**0.199-0.0470.0360.267-0.0260.0370.123-0.201H2O20.0330.015-0.051-0.170-0.0220.559**0.087-0.0570.032-0.379*LOX-0.194-0.0640.440*-0.2480.080-0.363*-0.150-0.121-0.1310.123-0.341
注:**表示极显著(P<0.01);*表示显著(P<0.05)
低温冷害诱导猕猴桃果实产生乙烯增加,促进腐烂[14]。前期研究发现,适宜乙烯积累有助于降低冷藏期间果实的呼吸速率和乙烯释放速率,抑制果实冷藏后腐烂[17,20]。本实验TSS 9.5%处理显著降低冷藏后货架时呼吸和乙烯峰值的时间,对照组和TSS 14.5%处理组在冷藏10 d后货架时乙烯释放速率显著高于TSS 9.5%处理组,加快冷藏后货架时果实腐烂,以致对照组和TSS 14.5%处理组腐烂率显著高于TSS 9.5%处理组,对照组果实在冷藏40 d后货架时全部腐烂,与蓝莓和‘徐香’猕猴桃研究结果相似[17,20]。乙烯不仅具有调节植物后熟衰老的作用,还诱导植物产生抗病防御反应[25],适宜后熟积累乙烯提高果实的防御反应,避免冷藏过程冷害引起的生理紊乱,从而维持冷藏后货架的品质。
本研究发现,TSS 9.5%处理组猕猴桃果实冷藏后货架时VC含量显著高于对照组和TSS 14.5%处理组,挂树预贮3周时TSS达9.81%,出库时果实VC含量显著低于对照组[20],说明采后适宜后熟比挂树预贮更能维持果实中VC含量,可能是由于后熟过程中积累适量乙烯启动自身防御系统,减少冷害等生理紊乱引起的VC损失。而挂树预贮TSS 9.81%后直接冷藏,冷害导致营养物质消耗加快。TSS 9.5%处理组在冷藏10~30 d后货架时,多酚含量显著高于对照组和TSS 14.5%处理组,且在冷藏60 d后货架时仍保持较高的多酚含量。可能是适宜后熟产生的乙烯诱导果实对低温胁迫的防御反应,促进酚类物质的合成,与乙烯处理果实中酚类物质含量较高结果相似[26],TSS 9.5%处理组果实冷藏后货架时GSH含量显著高于对照组和TSS 14.5%处理组,与褪黑素处理提高猕猴桃GSH含量结果一致[5],说明适宜后熟能提高果实的抗氧化物质,延缓果实衰老。
果蔬冷害导致其活性氧代谢紊乱和细胞膜损![]() 在SOD催化下歧化生成H2O2,H2O2在VC- GSH循环系统的作用下进一步分解为水和氧。低剂量乙烯和挂树预贮1周处理,通过提高果实的抗氧化物酶活性、降低冷敏性,从而维持果实冷藏品质[18-19]。本实验对照组
在SOD催化下歧化生成H2O2,H2O2在VC- GSH循环系统的作用下进一步分解为水和氧。低剂量乙烯和挂树预贮1周处理,通过提高果实的抗氧化物酶活性、降低冷敏性,从而维持果实冷藏品质[18-19]。本实验对照组![]() 产生速率和SOD活性均呈先增后降趋势,在冷藏20 d后货架时达到峰值,随后显著下降。对照组在冷藏10 d后货架时
产生速率和SOD活性均呈先增后降趋势,在冷藏20 d后货架时达到峰值,随后显著下降。对照组在冷藏10 d后货架时![]() 产生速率显著低于TSS 9.5%处理组和TSS 14.5%处理组,但SOD活性则显著高于TSS 9.5%处理组和TSS 14.5%处理组,说明冷害诱导SOD活性增加,促进
产生速率显著低于TSS 9.5%处理组和TSS 14.5%处理组,但SOD活性则显著高于TSS 9.5%处理组和TSS 14.5%处理组,说明冷害诱导SOD活性增加,促进![]() 歧化转化为H2O2,然而由于VC和GSH的损失以致VC-GSH循环系统清除力降低,H2O2分解受阻,以致活性氧代谢失衡,加速果实腐烂。TSS 9.5%处理组果实
歧化转化为H2O2,然而由于VC和GSH的损失以致VC-GSH循环系统清除力降低,H2O2分解受阻,以致活性氧代谢失衡,加速果实腐烂。TSS 9.5%处理组果实![]() 产生速率和SOD活性均高,可能是由于果实成熟至食用时也是衰老的体现,通过高的SOD 将衰老产生的高
产生速率和SOD活性均高,可能是由于果实成熟至食用时也是衰老的体现,通过高的SOD 将衰老产生的高![]() 歧化为H2O2,从而维持动态平衡。TSS 9.5%处理能有效抑制猕猴桃果实冷藏后货架时LOX活性波动引起细胞膜损伤。因此,TSS 9.5%处理可能是通过提高冷藏过程果实的抗氧化物酶活性,来维持果实冷藏后的货架品质[18-19]。
歧化为H2O2,从而维持动态平衡。TSS 9.5%处理能有效抑制猕猴桃果实冷藏后货架时LOX活性波动引起细胞膜损伤。因此,TSS 9.5%处理可能是通过提高冷藏过程果实的抗氧化物酶活性,来维持果实冷藏后的货架品质[18-19]。
综上所述,适宜后熟能有效维持猕猴桃果实冷藏及冷藏后货架品质,而过于成熟则加快其衰老。适宜后熟可能通过控制其呼吸速率和乙烯释放速率、降低果实营养物质损耗、提高果实抗氧化物酶的活性、维持活性氧代谢平衡等来维持猕猴桃果实冷藏后货架品质,其作用机理仍需进一步深入研究。
[1] MA Q, SUO J, HUBER D J, et al.Effect of hot water treatments on chilling injury and expression of a new C-repeat binding factor (CBF) in ‘Hongyang’ kiwifruit during low temperature storage[J].Postharvest Biology and Technology, 2014, 97:102-110.
[2] 胡花丽,王毓宁,李鹏霞.气调贮藏对猕猴桃抗坏血酸-谷胱甘肽代谢的影响[J].现代食品科技, 2015, 31(7):152-159.
HU H L, WANG Y N, LI P X.Effect of controlled-atmosphere storage on ascorbate-glutathione metabolism in kiwifruit[J].Modern Food Science and Technology, 2015, 31(7):152-159.
[3] MANNING M, BURDON J, DE S N, et al.Maturity and postharvest temperature management affect rot expression in ‘Hort16A’ kiwifruit[J].Postharvest Biology and Technology, 2016, 113:40-47.
[4] GWANPUA S G, JABBAR A, ZHAO M, et al.Investigating the potential of dual temperature storage as a postharvest management practice to mitigate chilling injury in kiwifruit[J].International Journal of Refrigeration, 2018, 86:62-72.
[5] 胡苗,李佳颖,饶景萍.褪黑素处理对采后猕猴桃果实后熟衰老的影响[J].食品科学, 2018, 39(19):226-232.
HU M, LI J Y, RAO J P.Effect of melatonin on ripening and senescence of postharvest kiwifruits[J].Food Science, 2018, 39(19):226-232.
[6] 黎晓茜,龙友华,尹显慧,等.茉莉酸甲酯处理对猕猴桃软腐病菌作用机制及果实品质的影响[J].食品科学, 2019, 40(15):239-248.
LI X Q, LONG Y H, YIN X H, et al.Mechanism of action of methyl jasmonate against kiwifruit soft rot and its effect on fruit quality[J].Food Science, 2019, 40(15):239-248.
[7] PAN L Y, ZHAO X Y, CHEN M, et al.Effect of exogenous methyl jasmonate treatment on disease resistance of postharvest kiwifruit[J].Food Chemistry, 2020, 305:125 483.
[8] 盘柳依,赵显阳,陈明,等.茉莉酸甲酯调控防御酶活性诱导猕猴桃果实抗采后软腐病[J].植物保护,2019,45(1):75-80.
PAN L Y, ZHAO X Y, CHEN M, et al.Regulation of defense enzymes by methyl jasmonate to induce the resistance of kiwifruits against soft rot[J].Plant Protection,2019,45(1):75-80.
[9] 张承,李明,龙友华,等.采前喷施壳聚糖复合膜对猕猴桃软腐病的防控及其保鲜作用[J].食品科学,2016,37(22):274-281.
ZHANG C, LI M, LONG Y H, et al.Control of soft rot in kiwifruit by pre-harvest application of chitosan composite coating and its effect on preserving and improving kiwifruit quality[J].Food Science, 2016,37(22):274-281.
[10] ZHANG C, LONG Y H, LI J H, et al.A chitosan composite film sprayed before pathogen infection effectively controls postharvest soft rot in kiwifruit[J].Agronomy, 2020,10(2):265-279.
[11] 石小玉,谢国芳,王先彬,等.外源乙烯对“贵长”猕猴桃货架品质的影响[J].食品工业,2018,39(6):74-76.
SHI X Y, XIE G F, WANG X B, et al.Effect of exogenous ethylene on the shelf quality of ‘guichang’ kiwifruit[J].The Food Industry, 2018,39(6):74-76.
[12] HUAN C, ZHANG J, JIA Y, et al.Effect of 1-methylcyclopropene treatment on quality, volatile production and ethanol metabolism in kiwifruit during storage at room temperature[J].Scientia Horticulturae, 2020,265:109 266.
[13] LI H, SUO J T, HAN Y, et al.The effect of 1-methylcyclopropene, methyl jasmonate and methyl salicylate on lignin accumulation and gene expression in postharvest ‘xuxiang’ kiwifruit during cold storage[J].Postharvest Biology and Technology, 2017, 124:107-118.
[14] SUO J, LI H, BAN Q, et al.Characteristics of chilling injury-induced lignification in kiwifruit with different sensitivities to low temperatures[J].Postharvest Biology and Technology, 2018, 135:8-18.
[15] 杨青珍. 猕猴桃果实采后冷害发生生理机制及调控作用[D].杨凌:西北农林科技大学,2013.
YANG Q Z.Physiological mechanism and regulation of chilling injury in postharvest kiwifruit[D].Yangling:Northwest A&F University,2013.
[16] 姜爱丽,孟宪军,胡文忠,等.外源乙烯处理对采后蓝莓感官性状和呼吸代谢的影响[J].食品工业科技,2011,32(9):375-378;383.
JIANG A L, MENG X J, HU W Z, et al.Effects of exogenous ethylene treatments on sensory properties and metabolism of postharvest blueberry fruits[J].Science and Technology of Food Industry, 2011,32(9):375-378;383.
[17] ZHOU H W, DONG L I, BEN-ARIE R, et al.The role of ethylene in prevention of chilling injury in nectarines[J].Journal of Plant Physiology, 2001, 158(1):55-61.
[18] MA Y R, YANG M N, WANG J J, et al.Application of exogenous ethylene inhibits postharvest peel browning of ‘Huangguan’ pear[J].Frontiers in Plant Science, 2017, 7:2 029
[19] 屈魏,高萌,冉昪,等.挂树预贮对‘徐香’猕猴桃采后耐贮性和冷敏性的影响[J/OL].食品科学,2020.http://kns.cnki.net/kcms/detail/11.2206.TS.20200108.1518.053.html.
QU W, GAO M, RAN B, et al.Effects of pre-storage of hanging trees on storability and cold sensitivity of ‘Xuxiang’ kiwifruit after harvest[J/OL].Food Science,2020.http://kns.cnki.net/kcms/detail/11.2206.TS.20200108.1518.053.html.
[20] 裴哗哗,郭乐音,马艳萍,等.不同浓度乙烯处理对采后“徐香”猕猴桃果实冷害的影响[J].保鲜与加工, 2020, 20(3):47-52.
PEI H H, GUO L Y, MA Y P, et al.Effects of different concentrations of ethylene treatments on chilling injury in postharvest ‘xuxiang’ kiwifruit[J].Storage and Process, 2020, 20(3):47-52.
[21] 谢国芳,石小玉,孔德银,等.一种猕猴桃鲜果贮藏保鲜方法:中国, ZL201710409988.0[P].2020-02-11.
XIE G F, SHI X Y, KONG D Y, et al.A method of fresh kiwifruit storage:China, ZL201710409988.0[P].2020-02-11.
[22] XIE G F, TAN S M, YU L.Effect of cultivar on quality of the common bean during storage[J].Internation Agricultural Engineering Journal,2015, 24(2):69-78.
[23] NUNCIO-J UREGUI N, MUNERA-PICAZO S,
UREGUI N, MUNERA-PICAZO S,  NGEL C S, et al.Bioactive compound composition of pomegranate fruits removed during thinning[J].Journal of Food Composition and Analysis, 2015, 37:11-19.
NGEL C S, et al.Bioactive compound composition of pomegranate fruits removed during thinning[J].Journal of Food Composition and Analysis, 2015, 37:11-19.
[24] LUO H, JIANG J, ZHANG L, et al.Effect of gibberellic acid and 6-benzylaminopurine on lignification of fresh-cut zizania latifolia during refrigerated (1 ℃) storage[J].Journal of Food Processing and Preservation, 2013, 37(5):864-869.
[25] YANG Y, SHAH J, KLESSIG D F.Signal perception and transduction in plant defense responses[J].Genes & development, 1997,11:1 621-1 639.
[26] PARK Y S, JUNG S T, GORINSTEIN S.Ethylene treatment of ‘Hayward’ kiwifruits (Actinidia deliciosa) during ripening and its influence on ethylene biosynthesis and antioxidant activity[J].Entia Horticulturae, 2006, 108(1):22-28.