黄酮类化合物是植物中重要的次生代谢产物,其作为强烈的抗氧化剂、自由基清除剂、二价阳离子螯合剂和脂质过氧化剂,在抗病毒、消炎、降血脂、降血糖、抑菌和抗癌等方面发挥着重要的作用[1]。最新研究显示,某些黄酮类化合物能够与新型冠状肺炎病毒(SARS-CoV-2)的刺突蛋白、解旋酶和蛋白酶位点高亲和力结合,具有预防或治疗新型冠状肺炎的潜力[2]。由于天然产物的化学多样性和天然亲和性,无论是标准化的提取物形式还是基于中药药理特性的纯化合物,都在新药开发中发挥着重要的作用。因此,迅速筛选出富含黄酮类化合物的植物对于推进含有黄酮类化合物的保健食品或中成药的研发进程至关重要,但目前黄酮类化合物的检测主要集中在仪器分析方面,仪器分析受限于昂贵的仪器和熟练操作的检测人员,而免疫分析法具有操作简单、灵敏度高、样品容量大、仪器化程度高和分析成本低等优点,是一种非常有潜力的检测方法。近年来,国内外科研人员在黄酮类化合物半抗原以及抗体制备这一领域做了大量的探索和研究,并取得了一定的进展。
1 黄酮类化合物抗原和抗体的制备
1.1 黄酮类化合物半抗原及完全抗原的制备
从结构上来看,黄酮类化合物可看作是由C6-C3-C6构成的一系列化合物的总称,如图1所示,其基本骨架是两个苯环(A环与B环)通过3个碳(C环)相互连接而成。根据三碳链氧化程度、B环连接位置以及三碳链是否成环等特点可将黄酮类化合物分为黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、查尔酮、二氢查尔酮、异黄酮、二氢异黄酮、高异黄酮、黄烷醇、花色素、双苯吡酮等。
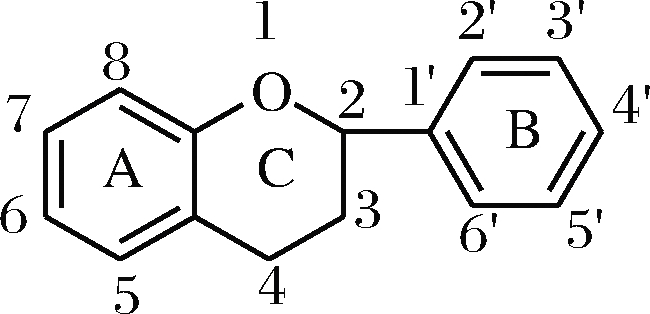
图1 黄酮类化合物的基本骨架
Fig.1 The structure of flavonoid
这些黄酮类化合物均属于小分子化合物,而小分子化合物(相对分子质量通常小于1 000 Da)由于分子体积和空间位阻的原因,通常只有一个T细胞表位而无B细胞表位,故只有反应原性而无免疫原性,即它们只能与机体中的抗体或致敏淋巴细胞结合而无法诱导机体产生针对该小分子的抗体或致敏淋巴细胞。因此黄酮类化合物需要与大分子结合变成完全抗原才能产生免疫原性。但大多数小分子化合物没有能与大分子结合的基团,针对这个问题,人们普遍将待测小分子化合物进行衍生合成具有一定长度碳链的小分子化合物即人工半抗原,再与载体蛋白结合成完全抗原,才能够刺激动物机体产生特异性的抗体。
柚皮苷、甘草苷、芦丁、牡荆素、斯皮诺素、大豆苷等黄酮类化合物本身含有糖基,可以采用高碘酸钠法将糖环氧化成双醛基,再与载体蛋白上的氨基进行偶联。橙皮素、柚皮素、槲皮素等黄酮类化合物虽然没有糖基,但本身含有酚羟基和羰基,可以与琥珀酸酐、溴丁酸乙酯、O-(羧甲基)羟胺等化合物反应衍生出含有羧基的半抗原,然后用碳二亚胺法[3]、活泼酯法[4]和混合酸酐法[5]与载体蛋白进行偶联。
与半抗原偶联的大分子物质被称为载体,载体与半抗原结合后就能产生免疫原性,因为两者形成的大分子化合物能够诱导机体产生新的T细胞表位和B细胞表位,进而产生抗体。因此,载体决定了免疫应答的特异性、融合的效率、特异性克隆的数目以及最终得到的抗体效价。最常用的载体为蛋白类,包括牛血清白蛋白(bovine serum albumin,BSA)、人血清蛋白(human serum albumin,HSA)、兔血清蛋白(rabbit serum albumin,RSA)、卵清蛋白(ovalbumin,OVA)、钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)以及小鼠血清白蛋白(mouse serum albumin,MSA)、小鼠免疫球蛋白M(mouse immunoglobulin M,MIM)、破伤风类毒素(tetanus toxoid,TT)等。其他类型的载体还有多聚赖氨酸(poly-lysine,PLL)、羧甲基纤维素、聚乙烯比咯烷酮等。其中,BSA因其理化性质稳定、自由氨基多且价廉易得,在不同的pH和离子强度下以及在含某些有机溶剂的情况下仍保持较大的溶解度,常作为合成完全抗原的载体。而OVA由于其免疫原性较其他蛋白弱,可以作为无关的载体蛋白用于抗体的筛选和免疫测定,常被用作包被原。
1.2 黄酮类化合物抗体的制备
1.2.1 二氢黄酮类
目前已制备出抗体的二氢黄酮类化合物包括柚皮苷、芸香柚皮苷、橙皮苷和柚皮素等。柚皮苷主要存在于柚、葡萄柚、酸橙等其他常见的柑橘属水果中,其具有缓解氧化应激、炎症、糖尿病等功效,且对骨再生、遗传损伤、心血管疾病和代谢综合征有多种药理作用[6]。ZHANG等[7]使用高碘酸钠法制备了柚皮苷的完全抗原,并通过免疫小鼠制备出抗柚皮苷单克隆抗体。芸香柚皮苷主要存在于甜橙、宽皮柑橘和杂柑等柑橘属水果中,其在治疗阿尔兹海默症方面有一定的潜力[8]。橙皮苷主要存在于甜橙、宽皮柑橘和柠檬等柑橘属水果中,在薄荷、连翘和丹参等中药中也能检出[9],它能够保护肝脏免受炎症和氧化应激介导的自然和化学毒素的损伤[10],具有调节多种心血管疾病危险因素的功效[11],其与SARS-CoV-2主要细胞受体结合的亲和力高于已经推荐用于临床试验的药物[9],且它与冠状病毒“刺突”蛋白以及将病毒早期蛋白(pp1a和ppa1b)转化为负责病毒复制复合物的主要蛋白酶结合的能量都低于临床试验药物,这表明橙皮苷具有有效的抗病毒作用[12]。LIU等[13]利用N,N′-羰基-二咪唑法制备出橙皮苷和芸香柚皮苷的完全抗原,并通过免疫小鼠制备出特异性的单克隆抗体。所有柑橘类水果都含有黄烷酮苷配基橙皮素和柚皮素,但它们很少以游离苷元的形式存在于果实中。甜橙中主要的黄烷酮苷是橙皮苷和芸香柚皮苷,而在酸橙中主要的两种黄烷酮苷是新橙皮苷和柚皮苷。橙皮素和橙皮苷都被认为与SARS-CoV-2的受体具有极强的结合能力,并具有显著的抗炎活性,且能干扰冠状病毒侵入和复制周期的不同阶段,因此,有预防和治疗新冠肺炎的潜力[2, 9]。柚皮素对咳嗽、痰和哮喘具有明显的药理作用[14],更重要的是它对在SARS-CoV-2感染中可能起关键作用的溶酶体内双孔通道家族(two-pore channels,TPCs)有抑制作用,进而阻断SARS-CoV-2的传播[15],也有报道指出柚皮素可能通过抑制SARS-CoV-2主要蛋白酶、3-胰凝乳蛋白酶样蛋白酶(3-chymotrypsin-like protease,3CLpro)和降低血管紧张素转换酶(angiotensin-converting enzyme 2,ACE2)受体活性来发挥治疗作用[16]。SHINKARUK等[5]合成了橙皮素和柚皮素的8种羧酸半抗原,然后采用混合酸酐法制备出完全抗原,筛选出灵敏度较高的多克隆抗体抗-h4-橙皮素和抗-h4-柚皮素。甘草苷主要存在于中药甘草中,它具有抗抑郁的功效[17]。FUJII等[18]采用高碘酸钠法制备甘草苷-HSA和甘草苷-KLH,经基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ ionization time of flight mass spectrometry,MALDI-TOF-MS)进行鉴定和偶联比的测定。其中,甘草苷-KLH作为免疫原免疫小鼠得到抗甘草苷单克隆抗体。
1.2.2 黄酮醇类
目前,黄酮醇类化合物中仅有槲皮素制备出了抗体。槲皮素存在于铁皮石斛、银杏等植物中,具有抗登革热病毒[19]的功效。此外,VC和槲皮素协同作用能够预防SARS-CoV-2感染,因此,可用来作为治疗COVID-19患者的辅助药物[20]。姜玲等[21]进行琥珀酸酐反应得到槲皮素中间体,再采用混合酸酐法合成槲皮素完全抗原,使用红外光谱分析、紫外光谱分析以及薄层色谱分析方法进行鉴定,基于成功合成的完全抗原制备出抗槲皮素多克隆抗体。
1.2.3 黄酮类
黄酮类化合物中川陈皮素、黄芩苷、芦丁等已制备出了抗体。川陈皮素主要存在于宽皮柑橘和甜橙的果皮以及中药陈皮和枳实中,其能够抑制结肠直肠癌病变的几个标志性特征,主要包括阻止细胞周期形成、抑制细胞增殖、诱导凋亡、阻止肿瘤形成、减少炎症作用和限制血管生成[22]。CUI等[4]先合成了川陈皮素的羧基衍生物,然后使用活性酯法偶联蛋白得到完全抗原,免疫小鼠制得单克隆抗体。黄芩苷主要存在于中药黄芩中,据报道,黄芩苷具有抗癌、抗菌和抗氧化的作用[23]。最新研究显示,黄芩苷对SARS-CoV-2的主要蛋白酶(3CLpro)有明显的抑制作用,即有抗该病毒的潜力[24]。KIDO等[25]利用碳二亚胺法合成了免疫原黄芩苷-BSA和包被原黄芩苷-人血清白蛋白,并使用MALDI-TOF-MS对其进行鉴定。用免疫原免疫小鼠得到抗黄芩苷单克隆抗体。芦丁存在于槐米、槐角、芸香全草、红旱莲、荞麦等植物中[26]。芦丁在神经退行性过程中有潜在的治疗作用[27],最新研究显示,SARS-CoV-2主蛋白酶(Mpro)负责该病毒的蛋白水解突变,并对其生命周期至关重要,因此,抑制这种蛋白酶最终有可能消灭病毒,而芦丁能够有效抑制该酶[28]。包小燕等[26]采用高碘酸钠法合成芦丁完全抗原,用紫外扫描和SDS-PAGE对其进行鉴定,以此抗原免疫健康雄性新西兰大白兔,制备多克隆抗体。牡荆素存在于狼尾草、山楂、木豆、绿豆、苔藓、西番莲、竹、含羞草、小麦叶片、蔓荆子中,其具有抗氧化、抗癌、抗炎、抗痛觉过敏和神经保护作用[29],也具有作为治疗阿尔兹海默症的候选药物的潜力[30]。冯盛岚等[31]采用高碘酸钠氧化法制备出牡荆素-BSA的免疫抗原和牡荆素-OVA的包被原,并用紫外分光光度法和薄层色谱法进行鉴定,采用免疫抗原免疫小鼠得到多克隆抗体。木犀草苷主要存在于金银花中,是金银花质量控制指标之一[32]。它被用于治疗包括发烧、关节炎和感染等多种疾病[33],可能参与抑制SARS-CoV-2感染周期的关键蛋白(3CLpro)[34]。张波等[32]以木犀草素-7-O-β-D-葡萄糖醛酸苷为原料,通过活泼酯法制备出木犀草苷完全抗原并通过免疫小鼠得到木犀草苷高效价多克隆抗体。斯皮诺素存在于酸枣仁中,其可通过调节纤溶酶活性,减弱阿尔兹海默症相关的突触功能障碍,有治疗阿尔兹海默症的潜力[35],也具有催眠和抗焦虑的药效[36]。章飚等[37]以高碘酸钠法制备出斯皮诺素完全抗原,通过免疫小鼠制备出多克隆抗体。
1.2.4 异黄酮类
目前已制备出抗体的异黄酮类化合物包括大豆苷和葛根素等。大豆苷主要存在于豆科植物中,大豆苷属于大豆异黄酮,具有抗癌、降胆固醇、抗心血管疾病、促进成骨细胞分化、抗骨质疏松[38]等功能。QU等[39]采用高碘酸钠法制备大豆苷完全抗原经小鼠免疫得到抗大豆苷单克隆抗体。YUSAKUL等[40]采用曼尼希法制备大豆苷完全抗原,并通过MALDI-TOF-MS进行鉴定,用成功制备的完全抗原免疫小鼠得到特异性极好的单克隆抗体。葛根素主要存在于葛根中,具有抗氧化、抗炎、抗癌、降胆固醇、保护肝脏和神经保护等作用,也是流感病毒神经氨酸酶的有效抑制剂[41]。QU等[42]运用高碘酸钠法合成了葛根素完全抗原并免疫小鼠得到单克隆抗体。
2 黄酮类化合物抗体的应用
黄酮类化合物的抗体主要应用于多种免疫分析方法的建立,如酶联免疫分析方法、免疫亲和色谱方法、荧光免疫分析方法、免疫层析试纸条和Eastern blotting法等,可实现特定黄酮类化合物的定性定量检测、“一步法”分离及定位等多种功能。
2.1 酶联免疫分析方法
酶联免疫分析方法是将抗原抗体的特异性结合反应与酶的高效催化作用相结合,实现对抗原或抗体的定性定量检测,黄酮类化合物主要采用的是间接竞争酶联免疫分析方法(indirect competitive enzyme linked immunosorbent assay,ic-ELISA),ic-ELISA中包被的抗原先与非酶标一抗结合,再引入酶标二抗与一抗特异性结合,最后加入底物显色。此外,也有学者开发出双抗夹心酶联免疫分析方法,通过筛选出两种不同的单克隆抗体同时结合在抗原的两个不同表位,由于两个表位之间的距离较大,不会影响抗原抗体之间的结合。ZHANG等[7]利用制备出的柚皮苷单克隆抗体建立ic-ELISA方法,在3.91~250 ng/mL能够检测到唾液中的柚皮苷,IC50值为52.25 ng/mL,最低检测限为5.04 ng/mL。参考该抗体的制备方法,该课题组制备了两种亚型的抗体[43] mAb1和mAb2,建立了双抗夹心酶联免疫分析方法,与ic-ELISA方法相比,灵敏度更高,最低检测限达到了6.78 ng/mL。SHINKARUK等[5]利用制备的多克隆抗体抗-h4-橙皮素和抗-h4-柚皮素建立ic-ELISA,柚皮素抗体的IC50值和最低检测限分别为0.98 ng/mL和0.12 ng/mL,橙皮素抗体的IC50值和最低检测限分别为1.96 ng/mL和0.24 ng/mL。之后,制备添加有0.02%、0.05%和0.1%的橙皮素和柚皮素半合成食物来喂养小鼠,用建立的酶联免疫分析方法测定饮食后对小鼠血浆和尿液中橙皮素和柚皮素的含量进行药代动力学研究,其测定结果和高效液相色谱法测定结果相吻合。FUJII等[18]利用抗甘草苷单克隆抗体,开发出ic-ELISA方法,检测限为0.39~25 μg/mL,加标回收率为100.9%~103.7%,并对13种甘草制品中甘草苷的含量进行了测定,其测定结果与HPLC一致。
CUI等[4]利用川陈皮素单克隆抗体,建立了ic-ELISA方法,线性范围为0.52~12.3 ng/mL,IC50值为2.43 ng/mL,并对13种柑橘及4种柑橘属中药中的川陈皮素含量进行了测定,其测定结果与UPLC-MS/MS的测定结果相一致。KIDO等[25]利用抗黄芩苷单克隆抗体建立ic-ELISA方法,检测限为200 ng/mL~2 μg/mL,平均加标回收率为98.0%,对11种中药中黄芩苷的含量进行测定,其结果与HPLC的测定结果相吻合。苏歆等[3]利用黄芩苷单克隆抗体,建立ic-ELISA方法,在2.67~1 029.00 ng/mL能检测到精制清开灵注射液中的黄芩苷含量。包小燕等[26]制备的芦丁多克隆抗体,特异性较好,基于该抗体建立竞争酶联免疫分析方法,经方法学考察,灵敏度IC50值为5.37 mg/mL,最低检测限为1 mg/mL,平均添加回收率为102%,但未进行实际样品的检测。冯盛岚等[31]制备出牡荆素多克隆抗体,并建立ic-ELISA方法,线性检测范围为0.028 8~18 μg/mL,但未进行实际样品的检测。张波等[32]利用木犀草苷多克隆抗体,建立ic-ELISA检测标准曲线,灵敏度IC50值为298.7 μg/mL,线性范围为18.4~4 852.4 μg/L,虽未检测实际样品,但由于木犀草苷是金银花质量控制指标之一,为金银花的质量控制提供了一种新方法。SAKAMOTO等[44]利用制备的大豆苷单克隆抗体建立ic-ELISA方法,检测范围为1.56~100 ng/mL,加标回收率为98.99%~104.94%,并测定了几种富含大豆黄酮的中草药及大豆制品,测定结果与HPLC相吻合。QU等[39]基于抗大豆苷单克隆抗体建立ic-ELISA方法,IC50值为780.7 ng/mL,在10~10 000 ng/mL能够检测大豆苷的含量。QU等[42]基于抗葛根素单克隆抗体,建立了ic-ELISA方法,平均加标回收率为101.4%,在10 ng/mL~1 μg/mL测定了8种中成药中葛根素的含量,并使用HPLC进行确证,结果具有一致性。基于该单克隆抗体,该课题组还建立了ic-ELISA方法进行人唾液中葛根素的药代动力学研究[45]。
2.2 免疫亲和色谱方法
免疫亲和色谱方法(immunoaffinity chromatography,IAC)是基于免疫亲和层析柱进行天然产物分离和纯化的方法,其与传统的色谱方法相比,可大大简化预处理和分离过程。QU等[46]制备了柚皮苷免疫亲和层析柱用于枳实中柚皮苷的选择性提取和检测,该柱子亲和性良好,最多能结合250 μg的柚皮苷,而对其他化合物基本不吸附。LIU等[13]基于橙皮苷和芸香柚皮苷的特异性单克隆抗体制备出免疫亲和层析柱进行中药陈皮及其制剂的纯化前处理,制备的免疫亲和柱结合能力较好,橙皮苷和芸香柚皮苷的结合能力分别为16 μg/mL和27 μg/mL,两者提取的加标回收率为94.05%~109.15%。QU等[39]使用抗大豆苷单克隆抗体制备了免疫亲和层析柱,结果表明,该免疫亲和柱能高效、特异地从豆科植物中分离与大豆苷结构类似的大豆异黄酮。QU等[42]对抗葛根素单克隆抗体在免疫亲和层析柱中的应用进行了研究。最后,开发并验证了将葛根素完全从其母体药物中特异性剔除的方法,即knock-out提取物制备方法。
2.3 荧光免疫分析方法
荧光免疫分析方法是基于荧光素标记的抗体建立的免疫分析方法,与常规的酶联免疫分析方法相比,其反应时间较短,缩短了反应体系暴露于反应温度的时间降低了边缘效应导致的误差。SHAN等[47]将异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记在抗黄芩苷单克隆抗体上建立了间接竞争荧光免疫分析方法,检测限为6.4 ng/mL~500 μg/mL,相较于ic-ELISA方法的检测限16~1 280 ng/mL,灵敏度显著提高,并对中药黄芩和柴胡中的黄芩苷含量进行测定。
2.4 免疫层析试纸条
免疫层析试纸条即基于膜的横向流动免疫色谱条,常见的有胶体金试纸条和量子点试纸条,其二者的优点均是大大简化了检测程序,避免了长时间孵育和复杂的操作步骤,且方便易携带能够实现常规监测大量样品的目的。PAUDEL等[48]将胶体金标记在抗黄芩苷抗体上,开发出免疫层析试纸条联合ic-ELISA快速一步检测黄芩苷的方法,检测限为200 ng/mL~2 μg/mL,检测时间仅需15 min,但未进行实际样品的检测。QU等[49]采用量子点(qunrrtum dots,QDs)偶联抗葛根素单克隆抗体形成探针建立了一种快速定量的侧流免疫分析方法,其中,二抗固定在硝化纤维素膜的一端(质控线),而葛根素-BSA固定在另一端(检测线),在10 min内能够测定水中和生物样品中的葛根素含量。该方法的检测限为1~10 μg/mL,IC50值为75.58 ng/mL,定量限为5.8 ng/mL,加标回收率为97.38%~116.56%。
2.5 Eastern blotting
Eastern blotting法是基于薄层色谱法和固相免疫技术而发展起来的免疫染色分析方法。首先将目标物通过薄层色谱法进行分离,然后加入染料通过加热的方法将薄层色谱法分离的化合物转染至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜或聚醚砜滤(polyether sulfone,PES)膜上,加入与小分子偶联的蛋白,在PVDF膜或PES膜上实现完全抗原的制备与包被,接下来加入目标化合物的单克隆抗体及酶标二抗通过抗原抗体的结合实现目标化合物的可视化检测。FUJII等[50]利用抗甘草苷单克隆抗体,开发出Eastern blotting法,通过免疫染色,能够在PES薄膜上显示出样品中甘草苷的含量,结合免疫组织化学定位技术实现了甘草苷在鲜甘草根中含量分布的可视化定位检测。
3 结论与展望
在预防COVID-19的许多措施中,植物来源的黄酮类化合物的作用也被重视,一直以来,从植物中提取的活性化合物被称为病毒抑制剂,且由于黄酮类化合物具有多效性和无全身毒性的优势,在未来的临床试验中可能成为丰富抗新型冠状病毒感染药物库的目标化合物。因此,加快富含黄酮类化合物植物的筛选刻不容缓,免疫分析方法在常规检测大量样品中凸显优势,值得大量开发和应用。
迄今为止,国内外学者主要采用高碘酸钠法、活泼酯法、碳二亚胺法制备黄酮类化合物的完全抗原,并通过免疫新西兰大白兔和小鼠制备多克隆抗体和单克隆抗体。基于制备的抗体建立免疫分析方法,其中建立的间接竞争酶联免疫分析方法能够快速准确地定量分析生物样本或植物粗提取物中有效成分的含量并应用于中药质量控制和中药药代动力学的研究。其次,可将单克隆抗体与固相载体相偶联,制成免疫亲和柱,应用于复杂样品的前处理以及knock-out提取物的制备。已制备出的黄酮类化合物的抗体为建立我国自己的黄酮类化合物单克隆抗体细胞库奠定了基础,同时也使研制多种成分并行检测抗体芯片成为可能。试纸条的研发可应用于田间地头、流通市场实现中药材的现场真伪鉴别和快速分级,也可实现新资源考察时的野外作业现场初筛。
然而,植物中黄酮类化合物的免疫分析还存在诸多空白,大多数黄酮类化合物未制备出多克隆或单克隆抗体。有些化合物已制备出抗体但未建立免疫分析方法,有些虽然建立了免疫分析方法,但存在灵敏度低、特异性差、基质干扰大等问题,不能实现对实际样品的检测。因此,未来我们可以从以下方面做出努力:
(1)扩大黄酮类化合物的抗体数量,完善基于免疫芯片技术的中药制剂致敏成分筛查体系。
(2)根据黄酮类化合物的结构差异,设计合成新型半抗原,制备出灵敏度高、特异性强的抗体,降低基质干扰,提高实际样品检测准确度。
(3)开发免疫传感器,提高灵敏度,加大样品测定时的稀释倍数,从而达到降低基质效应的目的。
(4)目前还未发现植物来源的黄酮类化合物基因工程抗体的报道,黄酮类化合物抗体在遗传育种、抗体治疗和代谢组学等领域的应用尚待研究。
总之,随着人们对植物源黄酮类化合物越来越重视,黄酮类化合物的抗体必将在食品和医疗等领域发挥更大的作用。
表1 黄酮类化合物的抗体及免疫分析方法
Table 1 Antibodies and immunoassay methods of flavonoids
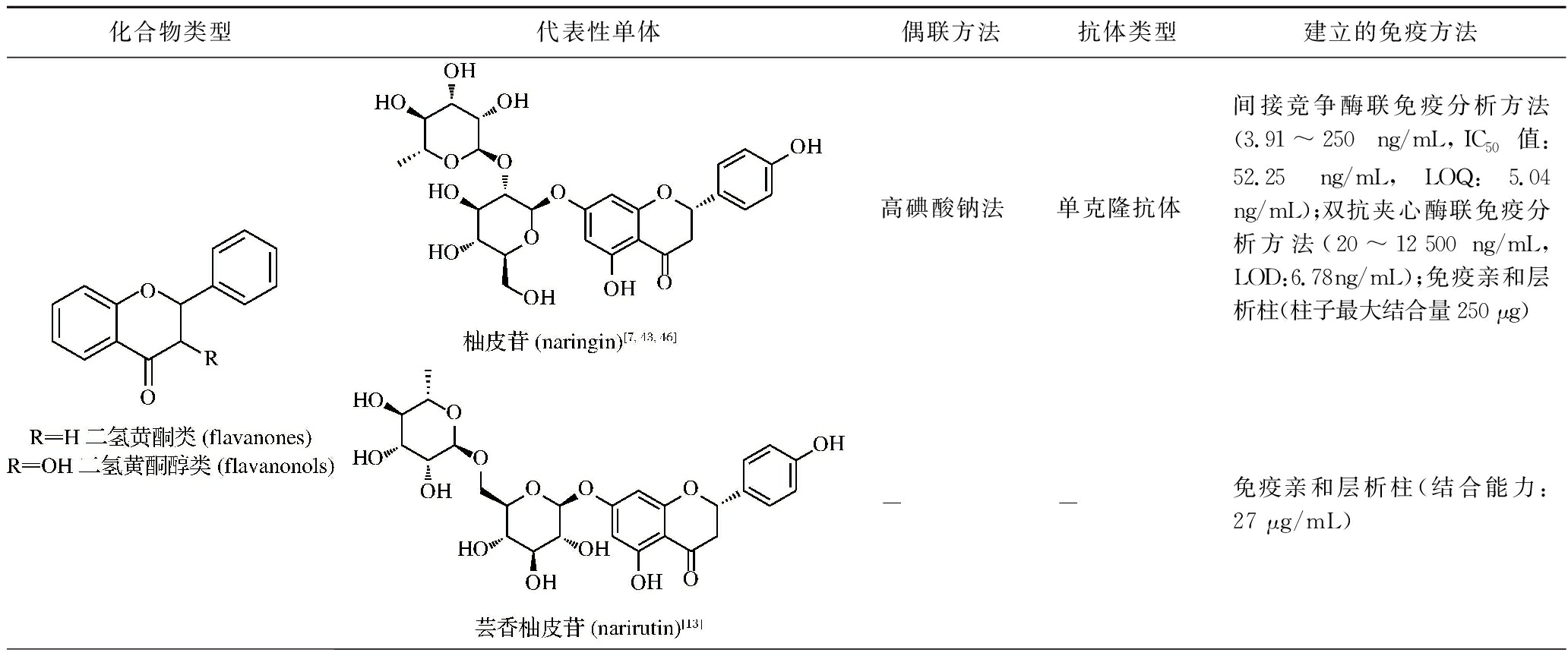
化合物类型代表性单体偶联方法抗体类型建立的免疫方法高碘酸钠法单克隆抗体间接竞争酶联免疫分析方法(3.91~250 ng/mL,IC50值:52.25 ng/mL,LOQ:5.04ng/mL);双抗夹心酶联免疫分析方法(20~12 500 ng/mL,LOD:6.78ng/mL);免疫亲和层析柱(柱子最大结合量250 μg)--免疫亲和层析柱(结合能力:27 μg/mL)
续表1
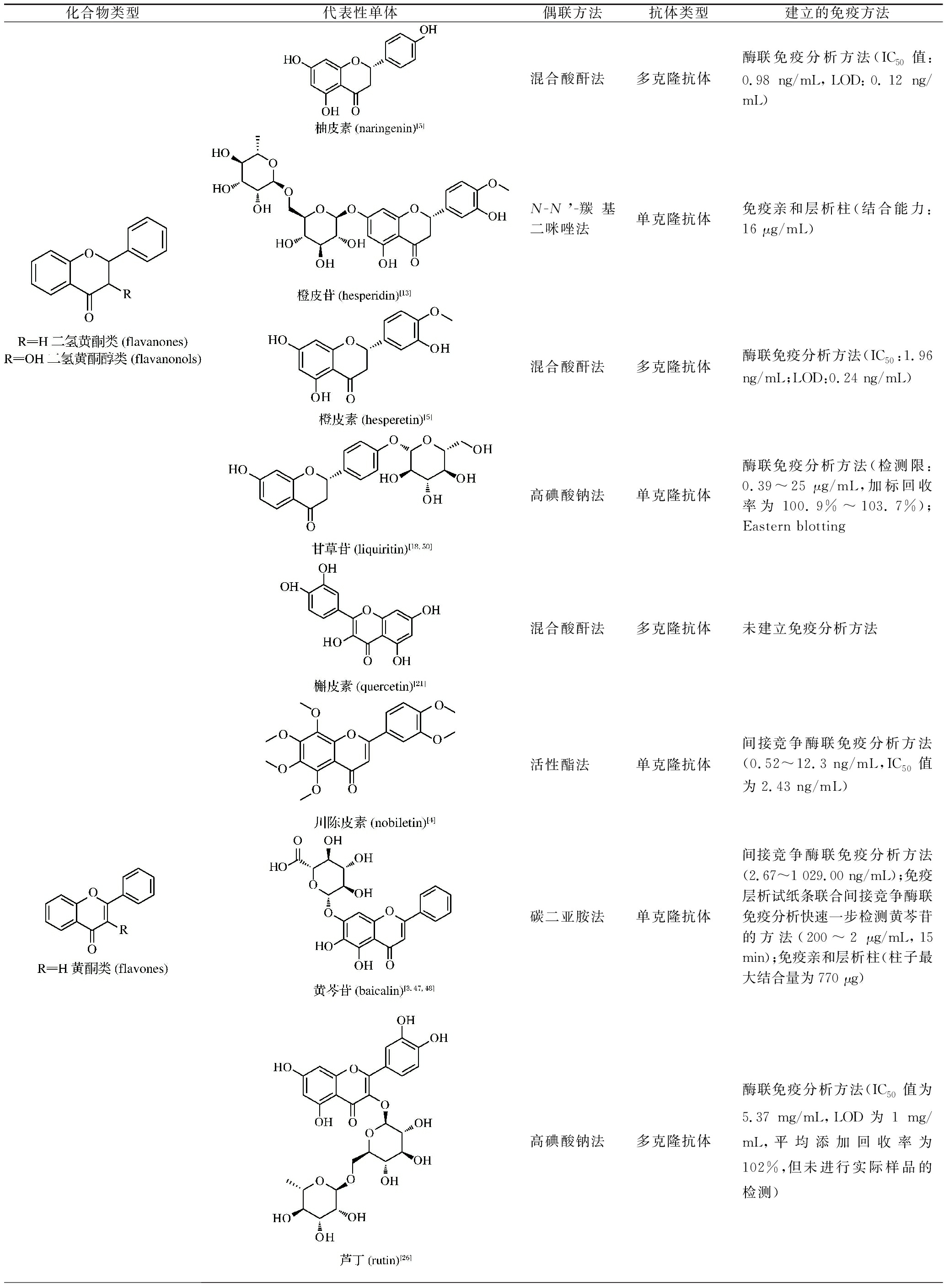
化合物类型代表性单体偶联方法抗体类型建立的免疫方法混合酸酐法多克隆抗体酶联免疫分析方法(IC50值:0.98 ng/mL,LOD:0.12 ng/mL)N-N’-羰基二咪唑法单克隆抗体免疫亲和层析柱(结合能力:16 μg/mL)混合酸酐法多克隆抗体酶联免疫分析方法(IC50:1.96 ng/mL;LOD:0.24 ng/mL)高碘酸钠法单克隆抗体酶联免疫分析方法(检测限:0.39~25 μg/mL,加标回收率为100.9%~103.7%);Eastern blotting混合酸酐法多克隆抗体未建立免疫分析方法活性酯法单克隆抗体间接竞争酶联免疫分析方法(0.52~12.3 ng/mL,IC50值为2.43 ng/mL)碳二亚胺法单克隆抗体间接竞争酶联免疫分析方法(2.67~1 029.00 ng/mL);免疫层析试纸条联合间接竞争酶联免疫分析快速一步检测黄芩苷的方法(200~2 μg/mL,15 min);免疫亲和层析柱(柱子最大结合量为770 μg)高碘酸钠法多克隆抗体酶联免疫分析方法(IC50值为5.37 mg/mL,LOD为1 mg/mL,平均添加回收率为102%,但未进行实际样品的检测)
续表1

化合物类型代表性单体偶联方法抗体类型建立的免疫方法高碘酸钠法多克隆抗体酶联免疫分析方法(0.028 8~18 μg/mL,但未进行实际样品的检测)活泼酯法多克隆抗体酶联免疫分析方法(IC50值=298.7 μg/mL,线性范围为18.4~4 852.4 μg/L,未检测实际样品)高碘酸钠法多克隆抗体酶联免疫分析方法(LOD为211.6 μg/L,未检测实际样品)高碘酸钠法单克隆抗体间接竞争酶联免疫分析方法(10~10 000 ng/mL,IC50值为780.7 ng/mL,LOD为20.07 ng/mL);免疫亲和层析柱(柱子最大结合量为220 μg)曼尼希法单克隆抗体间接竞争酶联免疫分析方法(1.56~100 ng/mL,加标回收率为98.99%~104.94%)高碘酸钠法单克隆抗体间接竞争酶联免疫分析方法(10~1 μg/mL,平均加标回收率为101.4%;5~1 280 ng/mL,IC50值为140.00ng/mL,LOD为2.47 ng/mL,加标回收率为95%~115%);量子点荧光免疫分析方法(1~10 μg/mL,IC50值为75.58 ng/mL,定量限为5.8 ng/mL,加标回收率为97.38%~116.56%);免疫亲和层析法(结合能力22 μg/mL)
注:“-”表示无
[1] JAIN V K, CHOUDHARY G P, DARWHEKAR G N.Flavonoids impact on prevention and treatment of obesity and related metabolic risk factors[J].International Journal of Pharmaceutical Sciences and Research, 2019, 10(10):4 420-4 429.
[2] NGWA W, KUMAR R, THOMPSON D, et al.Potential of flavonoid-inspired phytomedicines against COVID-19 [J].Molecules, 2020, 25(11):2 707.
[3] 苏歆, 屈会化, 赵琰, 等.基于黄芩苷单克隆抗体的ELISA快速检测方法的建立 [J].药物分析杂志, 2013, 33(6):946-949.
SU X, QU H H, ZHAO Y, et al.Establishment of quick enzyme-linked immunosorbent assay with monoclonal antibody against baicalin [J].Chinese Journal of Pharmaceutical Analysis, 2013, 33(6):946-949.
[4] CUI Y L, ZHAO J, ZHOU J, et al.Development of a sensitive monoclonal antibody-based indirect competitive enzyme-linked immunosorbent assay for analysing nobiletin in citrus and herb samples [J].Food Chemistry, 2019, 293:144-150.
[5] SHINKARUK S, LAMOTHE V, SCHMITTER J M, et al.Development and validation of two new sensitive ELISAs for Hesperetin and Naringenin in biological fluids [J].Food Chemistry, 2010, 118(2):472-481.
[6] CHEN R, QI Q L, WANG M T, et al.Therapeutic potential of naringin:An overview[J].Pharmaceutical Biology, 2016, 54(12):3 203-3 210.
[7] ZHANG Y, QU B P, QIN G F, et al.Development of a sensitive and reliable enzyme-linked immunosorbent assay for detecting naringin in human saliva[J].Analytical Methods, 2016, 8(5):987-994.
[8] CHAKRABORTY S, BASU S.Multi-functional activities of citrus flavonoid narirutin in Alzheimer's disease therapeutics:An integrated screening approach and in vitro validation [J].International Journal of Biological Macromolecules, 2017, 103:733-743.
[9] MENEGUZZO F, CIRIMINNA R, ZABINI F, et al.Review of evidence available on hesperidin-rich products as potential tools against COVID-19 and hydrodynamic cavitation-based extraction as a method of increasing their production[J].Processes, 2020, 8(5):549.
[10] TABESHPOUR J, HOSSEINZADEH H, HASHEMZAEI M, et al.A review of the hepatoprotective effects of hesperidin, a flavanon glycoside in citrus fruits, against natural and chemical toxicities [J].Daru-Journal of Pharmaceutical Sciences, 2020, 28(1):305-317.
[11] MAS-CAPDEVILA A, TEICHENNE J, DOMENECH-COCA C, et al.Effect of hesperidin on cardiovascular disease risk factors:The role of intestinal microbiota on hesperidin bioavailability[J].Nutrients, 2020, 12(5):1 488.
[12] BELLAVITE P, DONZELLI A.Hesperidin and SARS-CoV-2:New light on the healthy function of citrus fruits[J].Antioxidants (Basel Switzerland), 2020, 9(8):742.
[13] LIU L N, WANG Y, JIN H Y, et al.Application of immunoaffinity purification technology as the pretreatment technology for traditional Chinese medicine:Its application to analysis of hesperidin and narirutin in traditional Chinese medicine preparations containing Citri reticulatae Pericarpium[J].Journal of Chromatography B, 2016, 1 021:122-128.
[14] PATEL K, SINGH G K, PATEL D K.A review on pharmacological and analytical aspects of naringenin[J].Chinese Journal of Integrative Medicine, 2018, 24(7):551-560.
[15] FILIPPINI A, D′AMORE A, PALOMBI F, et al.Could the inhibition of endo-lysosomal two-pore channels(TPCs) by the natural flavonoid naringenin represent an option to fight SARS-CoV-2 infection? [J].Frontiers in Microbiology, 2020, 11:970.
[16] TUTUNCHI H, NAEINI F, OSTADRAHIMI A, et al.Naringenin, a flavanone with antiviral and anti-inflammatory effects:A promising treatment strategy against COVID-19 [J].Phytotherapy Research, 2020, 34(12):3 137-3 147.
[17] CHEN M, ZHANG Q P, ZHU J X, et al.Involvement of FGF-2 modulation in the antidepressant-like effects of liquiritin in mice [J].European Journal of Pharmacology, 2020, 881:173 297.
[18] FUJII S, MORINAGA O, UTO T, et al.Development of a monoclonal antibody-based immunochemical assay for liquiritin and its application to the quality control of licorice products[J].Journal of Agricultural and Food Chemistry, 2014, 62(15):3 377-3 383.
[19] WU W, LI R, LI X, et al.Quercetin as an antiviral agent inhibits influenza a virus (IAV) entry[J].Viruses, 2016, 8(1):6.
[20] BIANCATELLI R M L C, BERRILL M, CATRAVAS J D, et al.Quercetin and vitamin C:An experimental, synergistic therapy for the prevention and treatment of SARS-CoV-2 related disease (COVID-19) [J].Frontiers in Immunology, 2020, 11:1-11.
[21] 姜玲, 章文才, 柯云, 等.抗槲皮素抗体的研制 [J].免疫学杂志, 2000, 16(5):383-386.
JIANG L, ZHANG W C, KE Y, et al.Development of anti-quercetin antibodies [J].Immunological Journal, 2000, 16(5):383-386.
[22] GOH B H, TAN S H, CHAN C K, et al.Nobiletin and derivatives:Functional compounds from citrus fruit peel for colon cancer chemoprevention[J].Cancers, 2019, 11(6):867.
[23] HUANG T, LIU Y N, ZHANG C L.Pharmacokinetics and bioavailability enhancement of baicalin:A review[J].European Journal of Drug Metabolism and Pharmacokinetics, 2019, 44(2):159-168.
[24] JO S, KIM S, KIM D Y, et al.Flavonoids with inhibitory activity against SARS-CoV-2 3CLpro [J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2020, 35(1):1 539-1 544.
[25] KIDO K, MORINAGA O, SHOYAMA Y, et al.Quick analysis of baicalin in Scutellariae Radix by enzyme-linked immunosorbent assay using a monoclonal antibody [J].Talanta, 2008, 77(1):346-350.
[26] 包小燕, 贺福元, 曾姣丽, 等.芦丁完全抗原的合成鉴定及免疫原性分析 [J].中国中药杂志, 2013, 38(3):397-401.
BAO X Y, HE F Y, ZENG J L, et al.Synthesis and identification of rutin complete antigen and analysis its immunogenicity [J].China Journal of Chinese Materia Medica, 2013, 38(3):397-401.
[27] BUDZYNSKA B, FAGGIO C, KRUK-SLOMKA M, et al.Rutin as neuroprotective agent:From bench to bedside[J].Current Medicinal Chemistry, 2019, 26(27):5 152-5 164.
[28] DAS P, MAJUMDER R, MANDAL M, et al.In-Silico approach for identification of effective and stable inhibitors for COVID-19 main protease (Mpro) from flavonoid based phytochemical constituents of Calendula officinalis[J].Journal of Biomolecular Structure & Dynamics, 2020(2):1-16.
[29] HE M, MIN J W, KONG W L, et al.A review on the pharmacological effects of vitexin and isovitexin [J].Fitoterapia, 2016, 115:74-85.
[30] YAHAYA M A F, ZOLKIFFLY S Z I, MOKLAS M A M, et al.Possible epigenetic role of vitexin in regulating neuroinflammation in Alzheimer′s disease[J].Journal of Immunology Research, 2020(7):1-7.
[31] 冯盛岚, 屈会化, 贺娜娜, 等.牡荆素人工抗原的合成与免疫原性的鉴定 [J].中成药, 2015, 37(4):805-809.
FENG S L, QU H H, HE N N, et al.Synthesis and identification of artificial antigens of vitexin [J].Chinese Traditional Patent Medicine, 2015, 37(4):805-809.
[32] 张波, 詹志来, 康利平, 等.木犀草苷人工抗原合成及免疫原性鉴定 [J].中国中药杂志, 2015, 40(22):4 359-4 363.
ZHANG B, ZHAN Z L, KANG L P, et al.Preparation and immunogenicity identification of artificial antigen for luteoloside [J].China Journal of Chinese Materia Medica, 2015, 40(22):4 359-4 363.
[33] ZHANG B, NAN T G, ZHAN Z L, et al.Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for luteoloside detection in Flos Lonicerae Japonicae [J].Analytical and Bioanalytical Chemistry, 2016, 408(22):6 053-6 061.
[34] RUSSO M, MOCCIA S, SPAGNUOLO C, et al.Roles of flavonoids against coronavirus infection [J].Chemico-Biological Interactions, 2020, 328:109 211.
[35] CAI M D, JUNG I, KWON H Y, et al.Spinosin attenuates Alzheimer′s disease-associated synaptic dysfunction via regulation of plasmin activity[J].Biomol Ther, 2020, 28(2):131-136.
[36] KIM D H, RYU J H.How do Oroxylin A and spinosin exert their activities on cognitive function? [J].Natural Product Sciences, 2020, 26(1):1-9.
[37] 章飚, 李彦川, 冯红, 等.斯皮诺素人工抗原的合成及免疫原性鉴定 [J].中国中药杂志, 2018, 43(13):2 747-2 750.
ZHANG B, LI Y C, FENG H, et al.Synthesis and identification of artificial antigen of spinosin [J].China Journal of Chinese Materia Medica, 2018, 43(13):2 747-2 750.
[38] WEI G J, LIANG T H, WEI C M, et al.Daidzin inhibits RANKL-induced osteoclastogenesis in vitro and prevents LPS-induced bone loss in vivo[J].Journal of Cellular Biochemistry, 2019, 120(4):5 304-5 314.
[39] QU H H, QU B P, WANG X Q, et al.Rapid, sensitive separation of the three main isoflavones in soybean using immunoaffinity chromatography[J].Journal of Separation Science, 2016, 39(6):1 195-1 201.
[40] YUSAKUL G, SAKAMOTO S, JUENGWATANATRAKUL T, et al.Preparation and application of a monoclonal antibody against the isoflavone glycoside daidzin using a mannich reaction-derived hapten conjugate[J].Phytochemical Analysis, 2016, 27(1):81-88.
[41] WANG H X, ZENG M S, YE Y, et al.Antiviral activity of puerarin as potent inhibitor of influenza virus neuraminidase[J].Phytotherapy Research, 2020: 13.
[42] QU H H, ZHANG G L, LI Y F, et al.Development of an enzyme-linked immunosorbent assay based on anti-puerarin monoclonal antibody and its applications[J].Journal of Chromatography B, 2014, 953-954:120-125.
[43] QU H H, WANG X Q, QU B P, et al.Sandwich enzyme-linked immunosorbent assay for naringin[J].Analytica Chimica Acta, 2016, 903:149-155.
[44] SAKAMOTO S, YUSAKUL G, PONGKITWITOON B, et al.Simultaneous determination of soy isoflavone glycosides, daidzin and genistin by monoclonal antibody-based highly sensitive indirect competitive enzyme-linked immunosorbent assay[J].Food Chemistry, 2015, 169:127-133.
[45] QU H H, WAN F, SHAN W C, et al.Pharmacokinetic analysis of orally administered puerarin in human saliva using an indirect competition ELISA[J].Analytical Methods, 2015, 7(19):8 335-8 343.
[46] QU H H, ZHANG Y, QU B P, et al.Novel immunoassay and rapid immunoaffinity chromatography method for the detection and selective extraction of naringin in Citrus aurantium[J].Journal of Separation Science, 2016, 39(7):1 389-1 398.
[47] SHAN W C, CHENG J J, QU B P, et al.Development of a fluorescence-linked immunosorbent assay for baicalin[J].Journal of Fluorescence, 2015, 25(5):1 371-1 376.
[48] PAUDEL M K, PUTALUN W, SRITULARAK B, et al.Development of a combined technique using a rapid one-step immunochromatographic assay and indirect competitive ELISA for the rapid detection of baicalin[J].Analytica Chimica Acta, 2011, 701(2):189-193.
[49] QU H H, ZHANG Y, QU B P, et al.Rapid lateral-flow immunoassay for the quantum dot-based detection of puerarin[J].Biosensors & Bioelectronics, 2016, 81:358-362.
[50] FUJII S, MORINAGA O, UTO T, et al.Development of double eastern blotting for major licorice components, glycyrrhizin and liquiritin for chemical quality control of licorice using anti-glycyrrhizin and anti-liquiritin monoclonal antibodies[J].Journal of Agricultural and Food Chemistry, 2016, 64(5):1 087-1 093.