L-异亮氨酸作为哺乳动物8种必需氨基酸之一,是合成人体激素及酶类的原料,能够促进蛋白质合成并抑制其分解[1]。近年来,随着L-异亮氨酸在医药保健、食品加工和饲料工业中的应用研究不断深入,市场对L-异亮氨酸的需求在不断生长。L-异亮氨酸虽已实现工业化生产,但目前产量仍不能满足需要,目前我国L-异亮氨酸的需求缺口较大,并且年需求量逐年增加[2]。
一般认为微生物在生长旺盛期,正常代谢不会出现在培养液中大量分泌特定的中间代谢物的现象,谷氨酸棒杆菌(Corynebacterium glutamate)为了积累特定的氨基酸,必须使用某些方法使其代谢或结构异常化[3-5]。谷氨酸棒杆菌发酵在不同的阶段细胞形态会产生不同的变化,增殖培养时期菌株以生长分裂、倍速扩增菌体生物量为目的,而在生产目的产物异亮氨酸时,需要实现菌体形态的“发酵转换”,限制细胞膜的合成,菌体伸长、膨胀,形成生产型细胞,开始积累L-异亮氨酸[6-7]。而这种“发酵转换”,需要通过各种物理、化学或生物手段对细胞膜的合成或细胞膜本身进行干扰或破坏[8]。这些方法包括发酵液中添加表面活性剂、CaCl2、限制发酵培养基中生物素含量、减少葡萄糖供应使菌体处于亚生长状态等[9]。
研究表明超声对发酵液产生的微扰动可以加速细胞间的物质交换,加强发酵液中的CO2和O2的交换速率,从而促进细胞的增殖,而超声产生的切向力可在细胞表面瞬间造成微伤,使细胞壁局部破裂,增强细胞膜的通透性和产酸能力[14]。研究通过在发酵罐内添加超声装置,在发酵的某些时期对发酵液进行在线超声,通过增强发酵液的流动性及增强细胞膜的通透性,解决谷氨酸棒杆菌发酵适应期较长,菌体产酸转型慢、转型不彻底的问题[10-13]。
1 材料与方法
1.1 菌种
谷氨酸棒杆菌YILM1504,由天津科技大学代谢工程实验室保存。
1.2 发酵培养基
葡萄糖60 g/L,酵母粉3 g/L,蛋白胨12 g/L,(NH4)2SO4·7H2O 3 g/L,KH2PO4 1.6 g/L,VB1 0.3 mg/L,豆饼水解液15 mL/L,赖氨酸1 g/L,谷氨酸3 g/L,甲硫氨酸0.2 g/L,玉米浆干粉30 g/L。
1.3 仪器与设备
LDZH-100KBS型全自动立式蒸汽灭菌器,天津博鑫生物科技有限公司;5 L 自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E 生物传感分析仪,山东省科学院生物研究所;Agilent1200高效液相色谱仪,Agilent Technologies;KQ-C 高压蒸汽发生器,上海奉贤协新机电厂;752 分光光度计,上海分析仪器厂;OLYMPUS 生物显微镜,日本 OLYMPUS 会社。
1.4 培养方法
种子罐培养条件:接种量2支茄形瓶(250 mL),发酵体积2 L,培养温度32 ℃,pH 6.8~7.0,溶氧30%以上,转速与溶氧联动,种子培养12~15 h。
发酵罐培养条件:接种量600 mL,发酵体积3 L, 培养温度32 ℃,pH 6.8~7.0,溶氧30%以上,转速与溶氧联动,发酵时间36~40 h。
1.5 实验方法
通过单因素试验对超声条件的确定,如表1所示,选取超声周期、超声功率、超声频率、超声时间、超声模式进行5因素4水平的L16(54)正交试验,对试验结果进行分析。采用综合平衡分析法确定超声的最佳组合条件[15]。
表1 正交试验因素水平表
Table 1 Horizontal table of orthogonal experimental factors
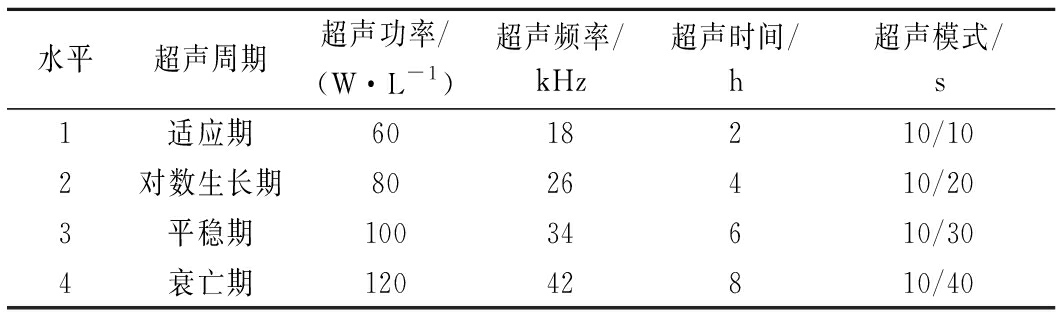
水平超声周期超声功率/(W·L-1)超声频率/kHz超声时间/h超声模式/s1适应期6018210/102对数生长期8026410/203平稳期10034610/304衰亡期12042810/40
注:超声模式10/10表示设置超声模式为开10 s,停10 s
1.6 检测方法
1.6.1 细胞膜内外两侧Ca2+浓度
Ca2+浓度检测参考文献[16]进行。
1.6.2 L-苏氨酸脱氨基酶活性检测
在发酵罐中取适量的菌液,4 ℃ 8 000 r/min离心收集菌体,用50 mmol/L Tris-HCl清洗菌体2次,并重悬菌体。然后将悬浮菌体,经过超声破碎(开2 s停3 s、4 ℃、400 W、10 min),4 ℃ 12 000 r/min 离心30 min去除细胞碎片,上清液即为粗酶液。蛋白浓度通过BCA Protein Assay Kit测定。酶活性重复3次测定。L-苏氨酸脱氨基酶的酶活性通过检测ɑ-酮丁酸的生成来确定。L-苏氨酸脱氨基酶的酶活定义为每分钟生成1 μmol ɑ-酮丁酸所需要的酶活为1 U[17]。
2 结果与分析
2.1 超声对菌体生物量的影响
2.1.1 超声对菌体不同生长阶段的影响
L-异亮氨酸发酵是一个连续动态过程,在不同的生长阶段菌体形态结构、代谢途径不同,超声所起的作用不同。实验将菌体发酵分为适应期、对数生长期、平稳期、衰亡期4个阶段,实验设计在不同阶段超声,探究不同阶段超声对菌体的影响。
如图1所示,对谷氨酸棒杆菌发酵不同生长阶段1 h连续超声,在适应期、对数期和平稳期生物量分别增加了15.6%、63.2%、23.6%,这可能是在适应期及对数生长期,超声对菌体损伤较小,超声加剧了培养基的扰动,加速了罐内营养物质及氧气的微扰动,提高了细胞膜内外物质交换的传输速率;而在平稳期,超声所起到的微扰动能力,解决了副产物堆积、营养供应不足等问题,增加了菌体活力[18]。但同时,超声对衰亡期菌体生长产生负面效果,菌体生物量下降了35.8%,这是因为在菌体衰亡期,超声剪切作用力加速了菌体破碎死亡。因此可在适应期、对数生长期和平稳期超声发酵,提高菌体总体基数,为产酸总量的提高提供生物量基础。
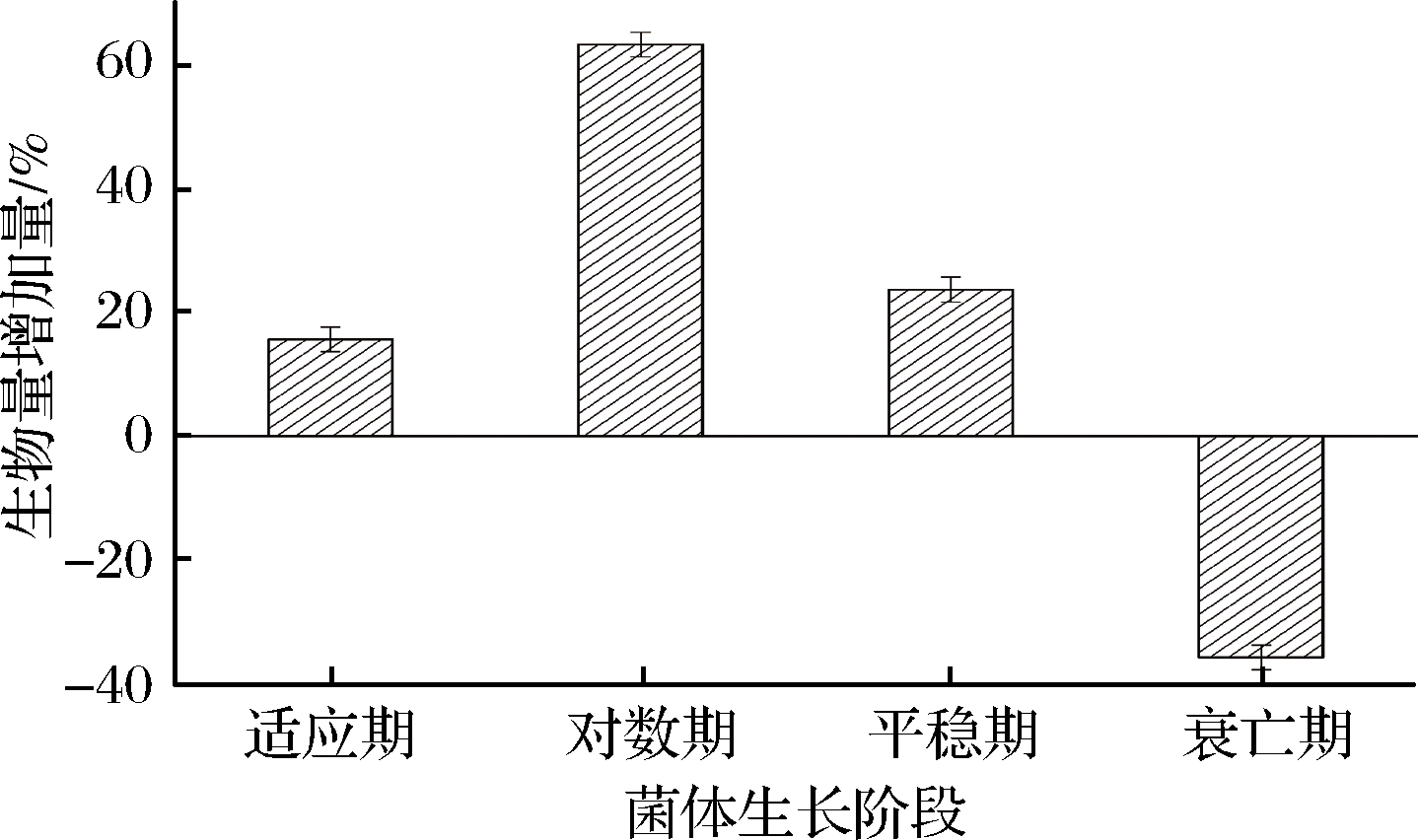
图1 超声对菌体不同生长阶段的影响
Fig.1 Influence of ultrasound on different growth stages of bacteria
2.1.2 超声功率对菌体生物量的影响
实验设计在对数生长期,分别用60、80、100、120 W/L不同的超声功率,探究超声功率对菌体生物量的影响。
如图2所示,超声功率<100 W/L时,对菌体的增长均有效果,在功率达到80 W/L时效果最好;但功率超过120 W/L时,对菌体生长产生抑制作用。超声刺激菌体生长不一定与功率成正比,有时小功率也会产生增殖效果,但功率过小就会失去微扰动及菌体刺激作用;而功率大到一定的数值,虽然扰动及剪切效果增强,但空化强度大大增加,干扰菌体正常的生长分裂,使菌体细胞膜内外环境失衡,正常的菌体形态发生形变,破碎死亡,降低菌体活力[19]。
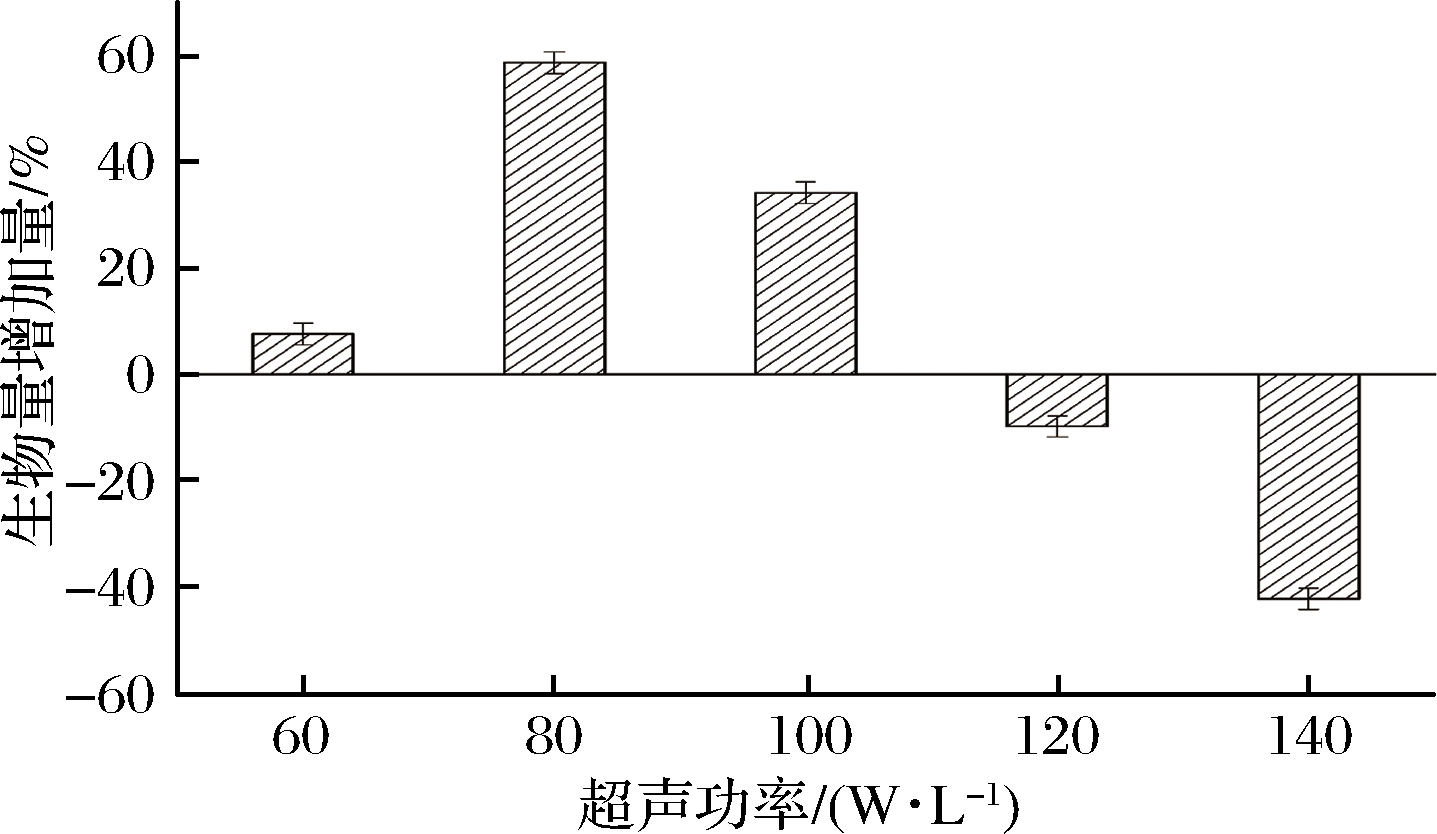
图2 超声功率对菌体生物量的影响
Fig.2 Effect of ultrasonic power on the biomass of bacteria
2.1.3 超声频率对菌体生物量的影响
实验设计在对数生长期,分别用10、18、26、34、42 kHz超声频率,探究超声频率对谷氨酸棒杆菌生物量的影响。
由图3可知,不同的超声频率对菌体生物量的影响较大,在超声频率为18 kHz时,菌体生物量下降了13.6%,但当超声频率为26 kHz时,菌体生物量增加了42.4%,随后将超声频率增加到42 kHz时,菌体生物量剧烈下降了45.3%。菌体的增长量随超声频率的梯度增加呈现极陡的波浪状,生物量急速升降。这种现象可能类似于电磁波的窗效应,指在某一频段内,只有某些个离散的、频率区间极窄的电磁波才能产生的生物学效应,而不同于图2所示80 W/L是该菌功率窗,该菌的生物学效应在26 kHz还存在1个频率窗[20]。
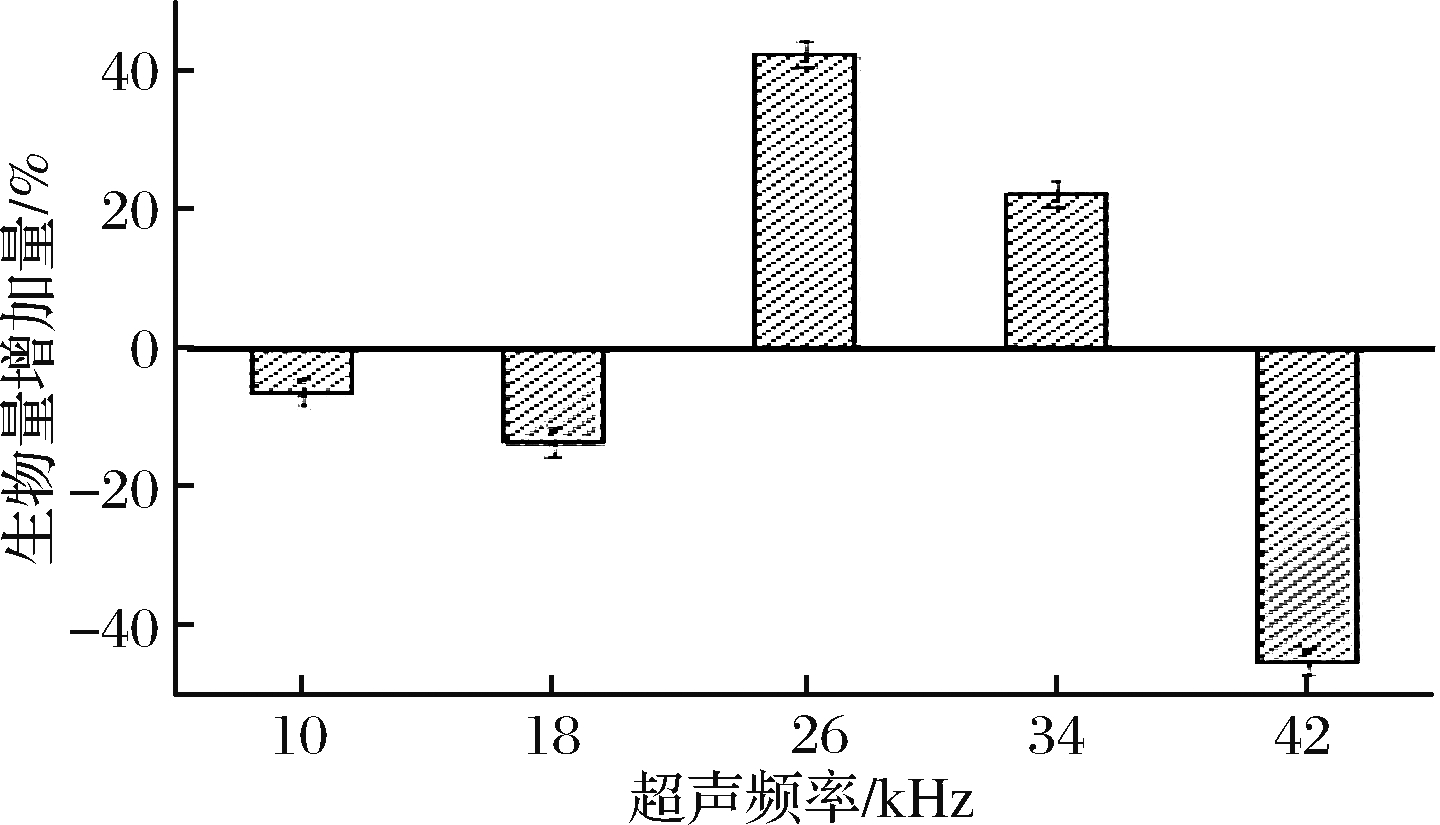
图3 超声频率对菌体生物量的影响
Fig.3 Effect of ultrasonic frequency on the biomass of bacteria
2.1.4 超声时间对菌体生物量的影响
在对数生长期分别超声0、2、4、6、8、10 h后,检测发酵结束后菌体生物量,探究超声时间对菌体生物量的影响。
从图4可知,0~8 h随着超声时间的增加,菌体生物量逐渐增加,在超声6 h后,菌体增加量达到最大,随后对菌体生长产生抑制作用,在超声10 h后菌体量比对照组降低了21.2%。对数生长期菌体增殖速度快,低频率低能量的超声对菌体的损伤较小,同时短时间的空化作用,形成的流体微扰动,可以增加细胞内外物质的交换速率,有利于菌体的生长;但超声时间过长使得空化事件增多,对细胞膜通透性影响增大,损坏了细胞的结构,从而引起细胞崩解[21]。
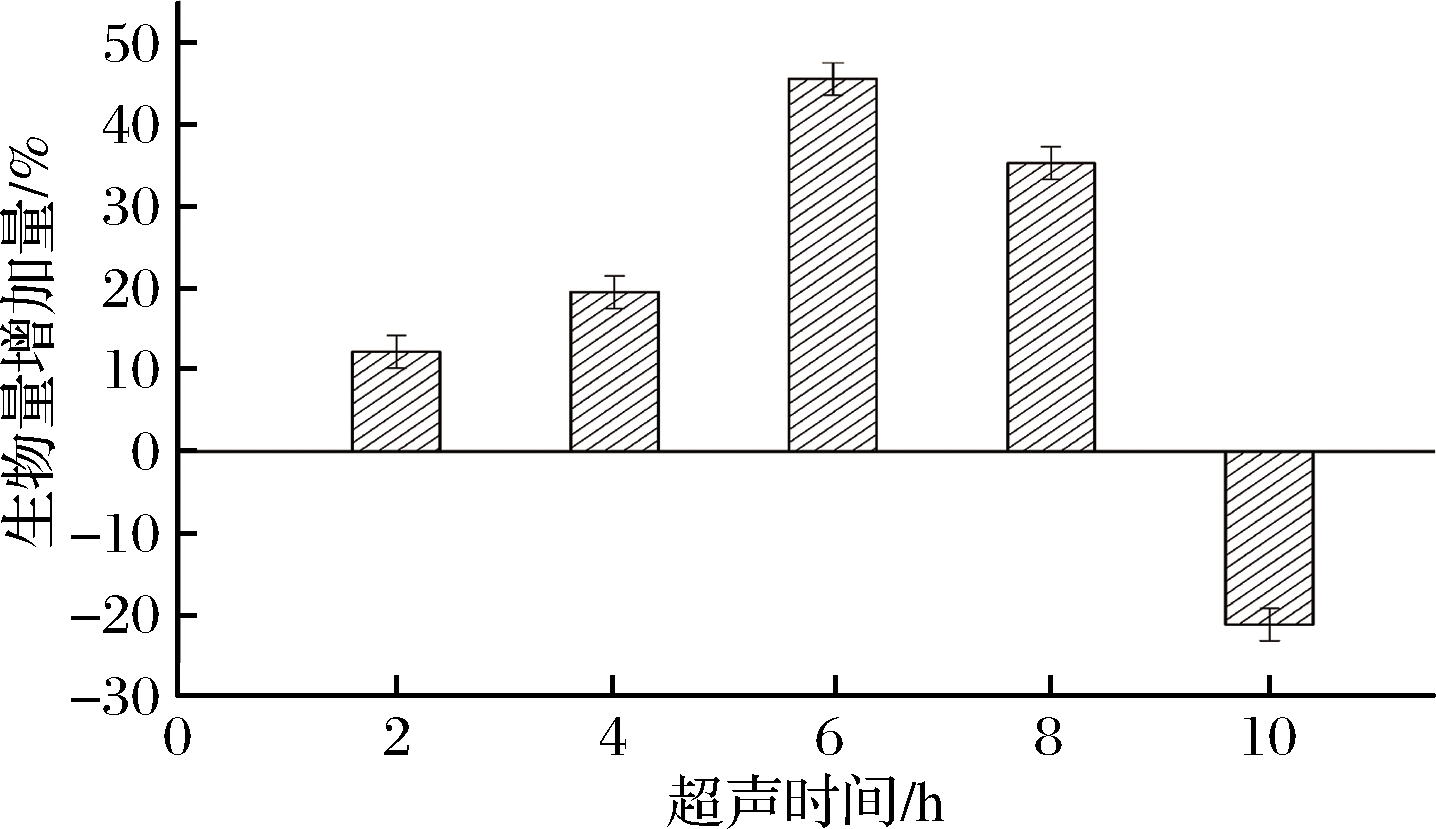
图4 超声时间对菌体生物量的影响
Fig.4 Effect of ultrasonic time on the biomass of bacteria
2.1.5 超声模式对菌体生物量的影响
设计在对数生长期使用不同的处理模式,分别为先开10 s,再停10、20、30、40、50 s,循环往复,持续6 h,探究间隔时间对菌体生物量的影响。
由图5可知,谷氨酸棒杆菌对低频率低能量的超声耐受能力很强,在不同的处理模式下菌体生物量都有明显的增长,但在处理模式开10 s停30 s模式下,效果最好,菌体生物量增加了46%。这可能是因为对数期菌体生长旺盛,超声处理的影响较小,且超声波可以将微生物在培养过程中形成的细胞束松散开来,提高了菌体对营养物质的利用,从而促进了菌体的生长繁殖,提高了微生物的生物量。
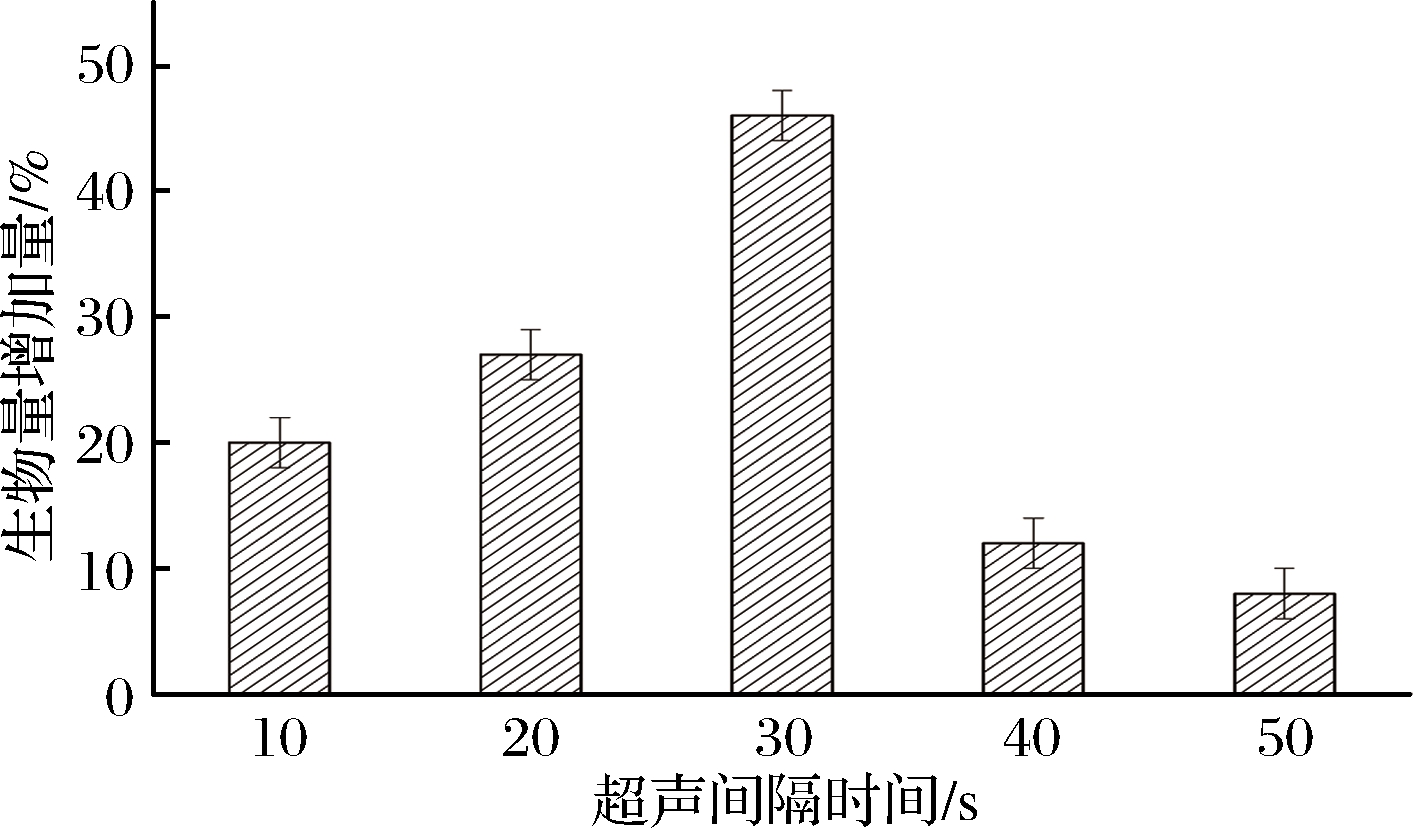
图5 超声模式对菌体生物量的影响
Fig.5 Effect of ultrasonic pattern on the biomass of bacteria
2.2 超声对谷氨酸棒杆菌产L-异亮氨酸的影响
在单因素基础上,设计L16(54)正交试验,以L-异亮氨酸生成量为评价标准,结果见表2。
由正交试验结果可知,因素1均值2最大,即在对数生长期超声细胞菌体产异亮氨酸最好;因素2均值2最大,即超声功率为80 W/L产酸效果最好;因素3均值1最大,即超声频率为18 kHz产酸效果最好;因素4均值1最大,超声时间2 h对产酸最有利;因素5均值1最大,说明超声模式为开10 s停10 s产酸效果最好。对比表2极差数值发现,影响L-异亮氨酸产量的主要因素是对菌体超声阶段的选择,剩下依次的超声功率、超声频率、超声模式,最后是超声时间对L-异亮氨酸产量的影响。
表2 正交实验结果
Table 2 Orthogonal experimental results
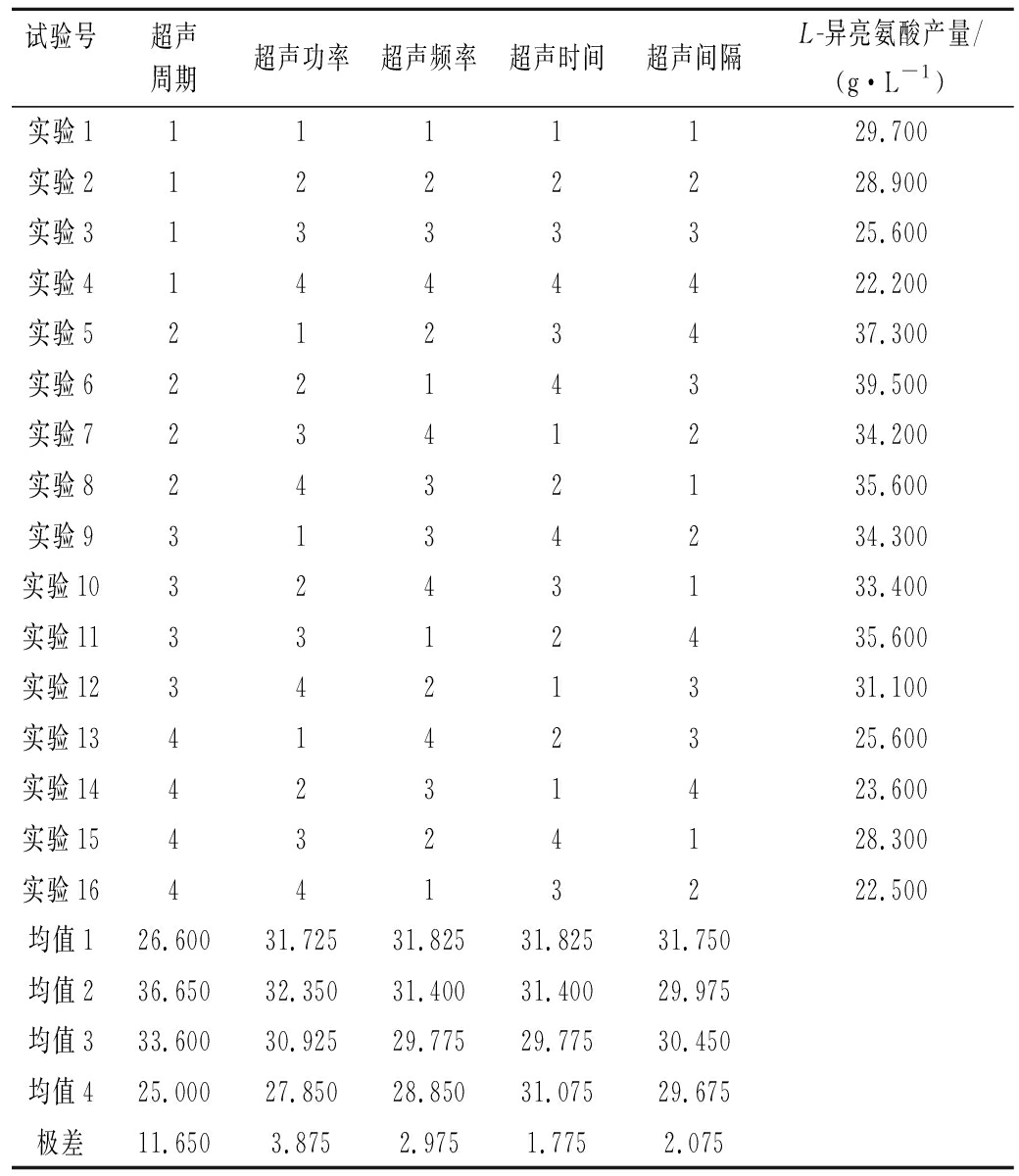
试验号超声周期超声功率超声频率超声时间超声间隔L-异亮氨酸产量/(g·L-1)实验11111129.700实验21222228.900实验31333325.600实验41444422.200实验52123437.300实验62214339.500实验72341234.200实验82432135.600实验93134234.300实验103243133.400实验113312435.600实验123421331.100实验134142325.600实验144231423.600实验154324128.300实验164413222.500均值126.60031.72531.82531.82531.750均值236.65032.35031.40031.40029.975均值333.60030.92529.77529.77530.450均值425.00027.85028.85031.07529.675极差11.6503.8752.9751.7752.075
对比生物素与L-异亮氨酸最优超声条件,使用综合平衡分析法分析得出最终超声发酵条件,如表3所示。由表2可知,超声周期的极差达到了11.650,说明影响产酸量的最大因素是超声周期,对比产酸与生物量发现最优超声条件都是在对数生长期,同时超声功率一致在80 W/L产酸量与生物量都达到最高选择;在超声频率最优条件上,生物量与产酸量不同,但18 kHz或26 kHz对L-异亮氨酸产量的均值相差不大,同时考虑到频率越低,超声产生的空化泡的数量越大,空化越强烈,菌体受损越严重,因此选择26 kHz超声频率;在超声时间和超声模式上,生物量与产酸量的最优条件也相差很大,但对于产酸条件来说,极差分别为1.775和2.075,都是次要因素,为保证生物量,增加具有产酸能力的菌体量基数,超声条件趋向于生物量最优条件,即超声时间为6 h,超声模式为开10 s停30 s。
表3 超声对生物量与L-异亮氨酸对比结果
Table 3 Comparison results of biomass and L-isoleucine by ultrasound
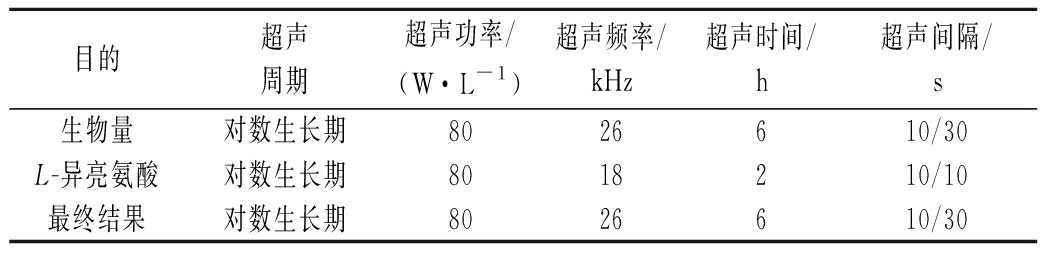
目的超声周期超声功率/(W·L-1)超声频率/kHz超声时间/h超声间隔/s生物量对数生长期8026610/30L-异亮氨酸对数生长期8018210/10最终结果对数生长期8026610/30
2.3 超声对跨膜行为的影响
细胞在不同生长时期摄取外源Ca2+的能力与胞外Ca2+的跨膜传导能力有关。超声处理对数生长期细胞,探究不同超声时间后,细胞膜内外两侧Ca2+浓度变化。
取超声结束后对数生长期的细胞,Fura-4/AM负载后,测定胞内荧光强度变化,用负载后的溶液在激光波长652 nm处比较荧光强度,胞内Ca2+浓度与荧光强度成正比,如图6所示,随着超声时间的增加,胞内Ca2+浓度不断升高,在超声6 h达到最高,比未超声前胞内Ca2+浓度增加了75%,细胞膜与外界物质交换频繁,有利于胞外Fluo-4/AM荧光探针的进入;随后超声时间的延长荧光强度逐渐减弱,超声时间过长改变了菌体正常生长环境,导致细胞产生应激反应,与胞外的物质和能量交换速率下降,造成Fluo-4/AM荧光探针的负载量减少,致使荧光强度下降。总的结果来看,超声处理增加了细胞膜的通透性,加速了细胞膜两侧的流动性,同时跨膜Ca2+浓度对于刺激膜蛋白活性及维持细胞膜骨架的稳定性非常重要。
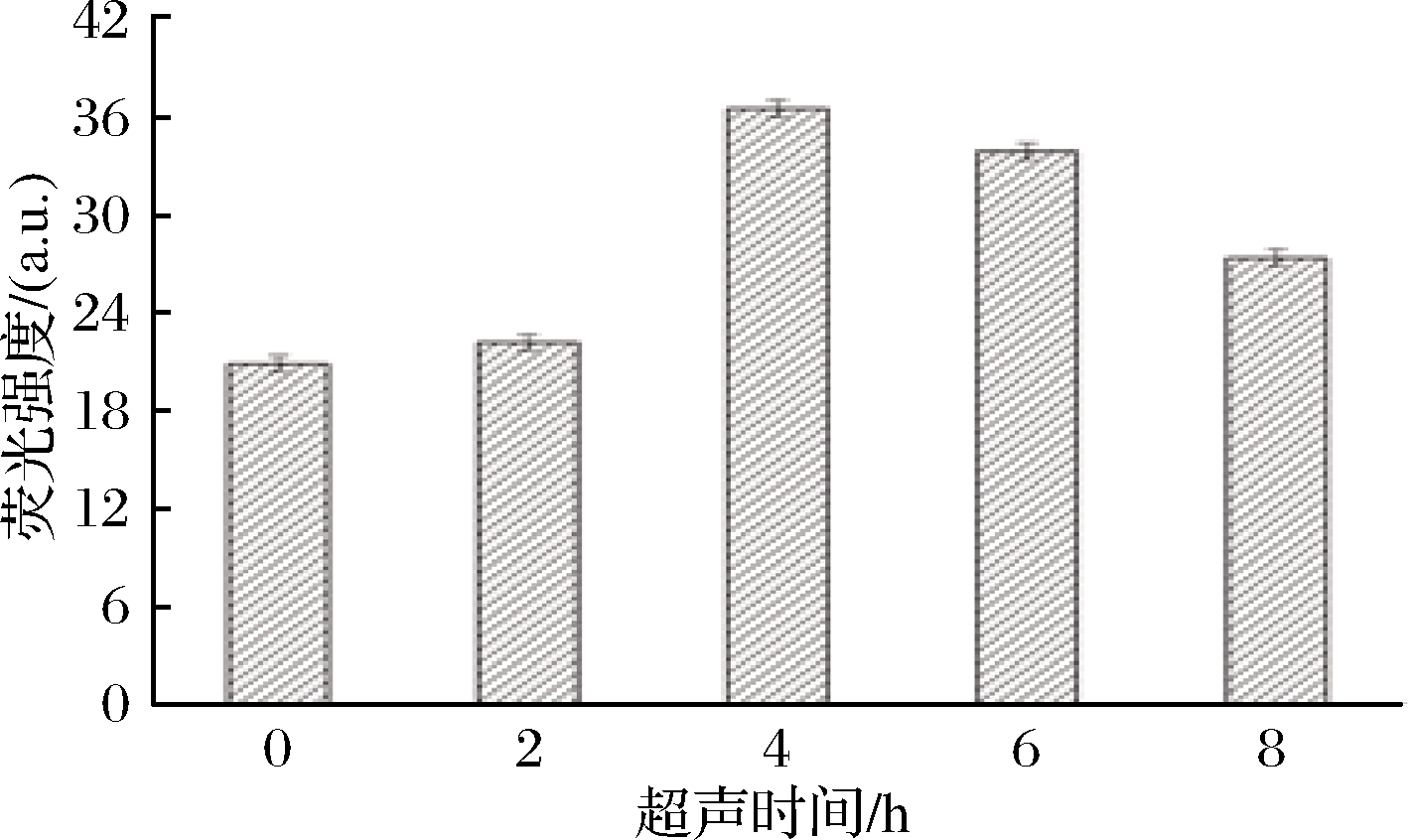
图6 超声时间对细胞膜通透性的影响
Fig.6 Influence of ultrasound time on membrane permeability
2.4 超声对酶活的影响
超声功率是影响L-异亮氨酸产量的第二大因素,探究不同超声功率下随着超声时间的增长L-苏氨酸脱氨基酶的活性变化如图7所示。
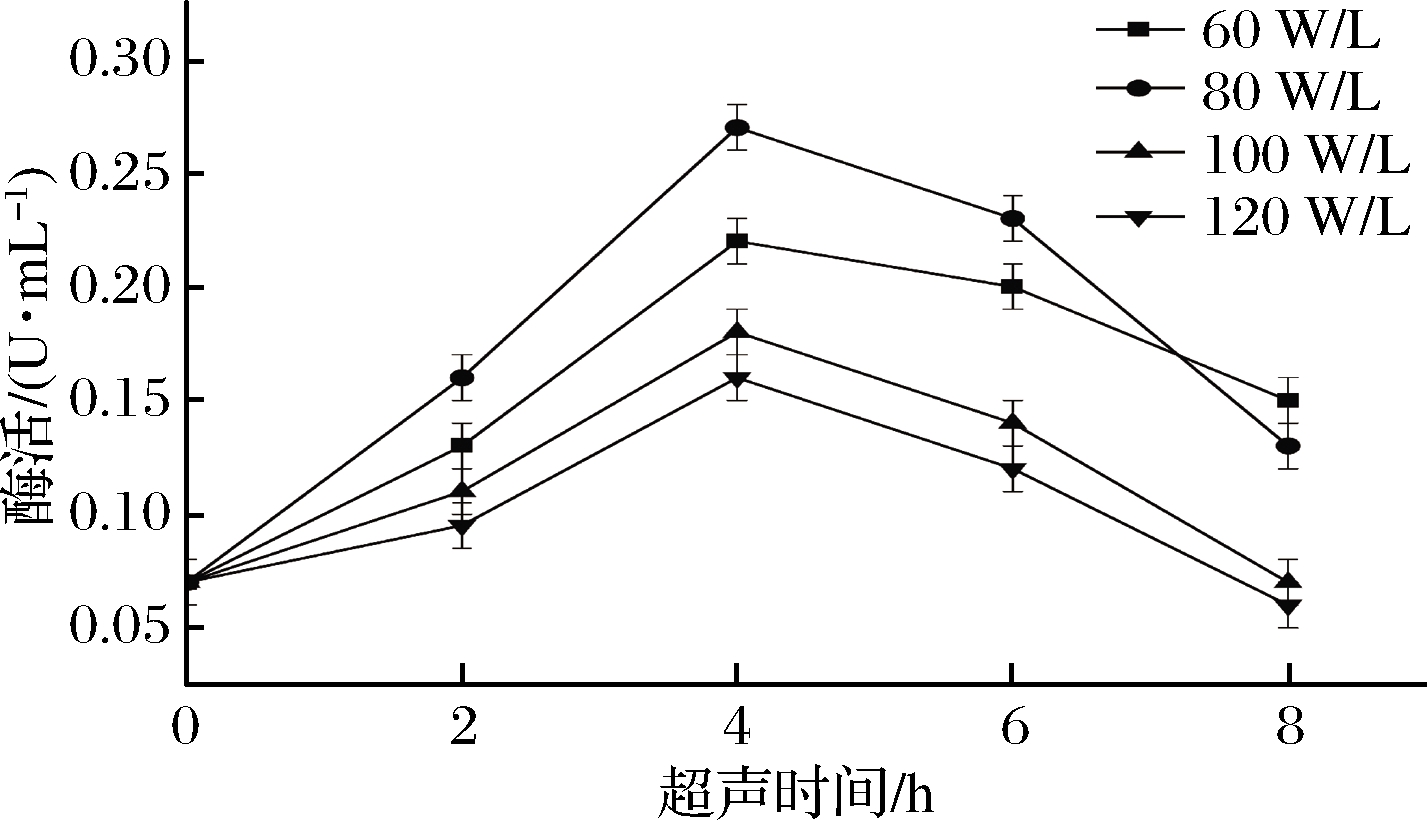
图7 超声时间与功率对酶活的影响
Fig.7 Effects of ultrasonic time and power on enzyme activity
由图7可知,L-苏氨酸脱氨基酶活性随超声时间先增强后减小,大约在超声4 h前后达到峰值,且超声时间4 h,超声功率为80 W/L时,L-苏氨酸脱氨基酶活性最强,达到(0.27±0.02)U/mL;随着超声功率的增强,L-苏氨酸脱氨基酶的活性先上升,随后在80 W/L达到顶点后快速下降,酶活分别降至(0.18±0.01)U/mL(100 W/L)、(0.16±0.01)U/mL(20 W/L)。同时,低功率超声随着超声时间的增加下降趋势最为平稳,说明低强度超声在细胞表面瞬间造成微伤,使细胞壁局部破裂,改变了细胞膜的通透性,加速了细胞内外物质交换,但因为其强度不够,超声所造成的细胞表面的伤口较小,细胞可正常修复。
2.5 超声对菌体形态的影响
发酵3 h后经过26 kHz,80 W/L 超声处理谷氨酸棒杆菌对数1 h 后(其余处理条件均相同),比较超声处理的谷氨酸棒杆菌和未处理的菌体形态如图8所示。谷氨酸棒杆菌的显著特征是前期菌体扩培阶段菌体分散,菌体小而近圆型,以分裂扩培为主要目的,中期菌体需要转换菌体形态,转为产酸形态,菌体粗壮呈椭圆型,菌体多为“八”字形态。而未进行超声处理的菌体小而圆,以分裂增殖为主,菌液经过超声处理后,菌体数量明显增多,且菌体大而粗壮,活力强,利于产酸。超声加速了菌体的增殖并提前实现菌体“形态转换”,产酸提前,菌体产酸能力得到加强。
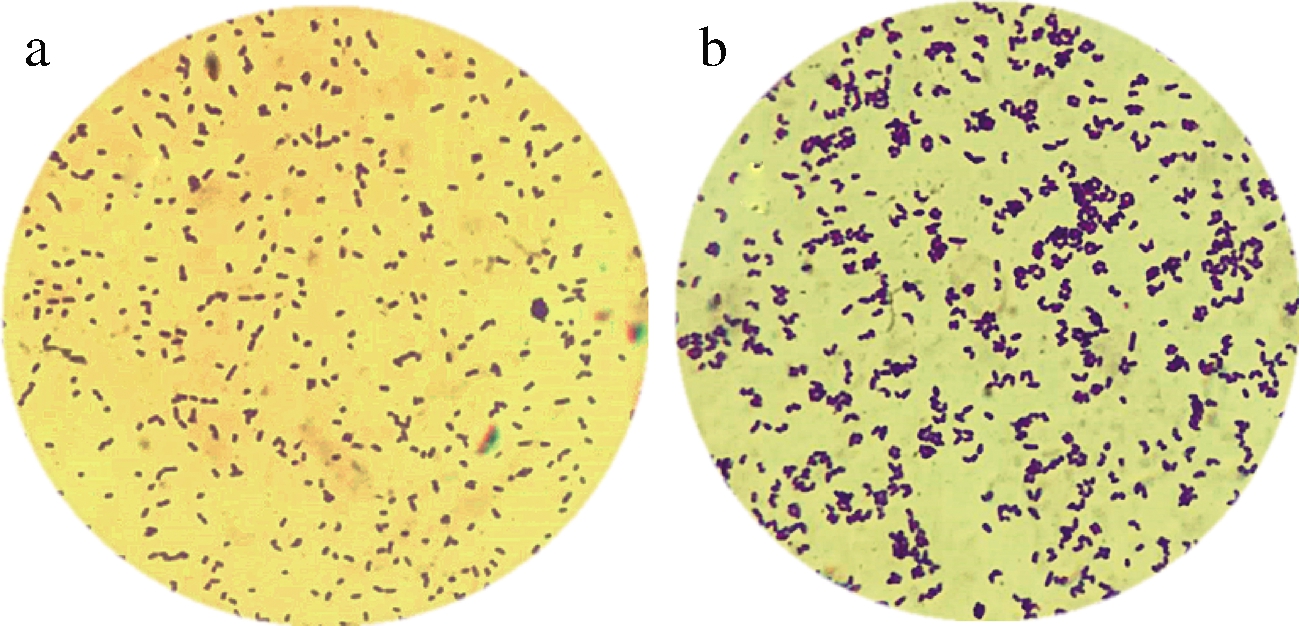
a-未超声;b-超声
图8 未超声与超声的菌体形态
Fig.8 Morphology of bacteria without ultrasound and ultrasound
2.6 超声对菌体生物量、产酸能力及葡萄糖消耗的影响
由前期工作可以得出综合生物量与L-异亮氨酸双重考虑的超声标准,为在谷氨酸棒杆菌适应期、对数生长期和平稳期,用80 W/L、18 kHz罐内分别连续超声2、6、1 h,超声模式设置为每超声10 s,停30 s,循环往复。由此设计对比实验,以未超声条件发酵为对照组,最优超声条件发酵为优化组,绘制生物量与L-异亮氨酸生成量过程曲线,探究罐内超声结果的优越性。
由图9-a对照组生物量曲线可以看出,超声后发酵适应期几乎消失,菌体发酵适应阶段缩短至2 h以内,菌体快速进入对数生长期;同时对数生长期从2 h延续到24 h,且24 h菌体生物量达到了39.4 g/L,比对照组增加了35.7%;几乎无衰亡期,直至40 h结束菌体活力依旧很强,最终菌体量达到了41.0 g/L,比对照组提高了74.5%。由图9-a优化组L-异亮氨酸产量曲线可以看出,超声优化后产酸提前了2 h,并且在对数生长中后期及平稳期,L-异亮氨酸产量增长趋势明显,由于谷氨酸棒杆菌产L-异亮氨酸为生长偶联型,高生物量有利于产酸速率的提升,最终L-异亮氨酸产量达到了39.0 g/L,比对照组产酸量提升了69.6%。
由图9-b可知,超声后葡萄糖消耗量达到了482 g/L,比未超声多消耗了41.97%;但葡萄糖对菌体转化率及L-异亮氨酸转化率上升显著(P<0.05),在10 h,葡萄糖对菌体转化率达到最大,超声后葡萄糖对菌体转化率比未超声增加了14.92%,菌体活力旺盛;同时对比葡萄糖对L-异亮氨酸转化率曲线,超声后葡萄糖转化率在第20 h达到最大值,延长了2 h,转化率为0.397 g/g,比未超声增加了13.75%,且超声20 h后,葡萄糖对L-异亮氨酸转化率曲线下降速率平缓,加强了菌体后期产酸能力。

a-实心代表生物量,空心代表L-异亮氨酸产酸量;b-实心代表葡萄糖消耗量,空心代表葡萄糖对菌体转化率,左空右实代表葡萄糖对L-异亮氨酸转化率
图9 超声与未超声对生物量与L-异亮氨酸生成量及对葡萄糖消耗量与转化率的影响
Fig.9 Effects of ultrasound and non-ultrasound on biomass and L-isoleucine production and glucose consumption and conversion
3 结论
在发酵过程中用超声作为物理手段处理发酵液,对于谷氨酸棒杆菌发酵产L-异亮氨酸效果显著,其超声周期、超声功率、超声频率、超声时间和超声模式都会对菌体的增殖及产酸能力都有很强的提升能力。谷氨酸棒杆菌超声发酵的最优条件为:用80 W/L、26 kHz超声波,在菌体适应期、对数生长期及平稳期分别超声2、6、1 h,超声模式设置为开10 s、停30 s。超声形成的流体微扰动,使发酵液中分子活性提高,可以增加细胞内外物质的交换速率,有利于菌体的生长,结果显示,直至40 h结束菌体活力依旧很强,最终菌体量达到了41.0 g/L,比未超声提高了74.5%;超声形成的机械切向力,在细胞表面瞬间造成微伤,使细胞壁局部破裂,改变了细胞膜的通透性,加速了细胞内外物质交换,解除了胞内产物浓度过高而产生终产物抑制,最终L-异亮氨酸产量达到了39.0 g/L,比未超声产酸量提升了69.6%。
[1] 王壮壮,魏佳,于海波,等.L-异亮氨酸高产菌选育及其培养基优化[J].生物技术通报,2019,35(1):82-89.
[1] WANG Z Z, WEI J, YU H B, et al.Breeding of strain producing L-isoleucine and medium optimization for it[J].Biotechnology Bulletin, 2019,35(1):82-89.
[2] 李忠财,董会娜,丛丽娜,等.双组份转运系统BrnFE的过表达和表面活性剂的添加对谷氨酸棒杆菌发酵生产L-异亮氨酸的影响[J].工业微生物,2016,46(4):1-7.
LI Z C, DONG H N, CONG L N, et al.Effects of overexpressing two-component export system Brn FE and adding surfactants on L-isoleucine production by Corynebacterium glutamicum[J].Industrial Microbiology, 2016,46(4):1-7.
[3] YIN L, SHI F, HU X, et al.Increasing L-isoleucine production in Corynebacterium glutamicum by overexpressing global regulator Lrp and two-component export system BrnFE[J].Journal of Applied Microbiology,2013,114(5):1 369-1 377.
[4] 孔帅,陈敏,郑美娟,等.常温常压等离子体诱变选育高产L-异亮氨酸谷氨酸棒杆菌[J].中国酿造,2019,38(7):76-79.
KONG S, CHEN M, ZHENG M J, et al.Mutation breeding of high-yield L-isoleucine Corynebacterium glutamicum by atmospheric and room temperature plasmas mutagenesis[J].China Brewing,2019,38(7):76-79.
[5] 户红通,徐达,徐庆阳,等.超声辅助细胞转型的谷氨酸发酵工艺[J].食品与发酵工业,2019,45(1):44-48.
HU H T, XU D, XU Q Y, et al.Cell transformation by glutamic acid fermentation process assisted by ultrasound[J].Food and Fermentation Industries, 2019,45(1):44-48.
[6] 还晓静,李坤,史锋,等.谷氨酸棒杆菌NAD激酶的过表达对L-异亮氨酸合成的促进作用[J].生物工程学报,2012,28(9):1 038-1 047.
HUAI X J, LI K, SHI F, et al, Overexpression of Corynebacterium glutamicum NAD kinase improves L-isoleucine biosynthesis[J].Chinese Journal of Biotechnology, 2012,28(9):1 038-1 047.
[7] 李燕军,张海宾,麻杰,等.代谢工程改造大肠杆菌合成L-异亮氨酸的研究[J].发酵科技通讯,2016,45(3):133-139.
LI Y J, ZHANG H B, MA J, et al.Study on metabolic engineering of Escherichia coli for L-isoleucine production[J].Bulletin of Fermentation Science and Technology, 2016,45(3):133-139.
[8] 沈加彬,胡荣涛,罗磊,等.响应面法优化L-异亮氨酸产生菌的摇瓶发酵条件[J].福建师范大学学报(自然科学版),2018,34(2):48-56.
SHEN J B, HU R T, LUO L, et al.Optimization the flask-shaking fermentation conditions of an L-isoleucine producing strain brevibacterium flavum by response surface method[J].Journal of Fujian Normal University (Natural Science Edition), 2018,34(2):48-56.
[9] 于丽男,刘慧燕,方海田,等.L-异亮氨酸高产菌种的选育与响应面法优化发酵培养条件的研究[J].食品科技,2015,40(10):9-16.
YU L N, LIU H Y, FANG H T, et al.Study on breeding of L-isoleucine producing strain and optimization of the fermentation medium by response surface methodology[J].Food Science and Technology, 2015,40(10):9-16.
[10] 汪雨晨,陶阳,李丹丹,等.低频低强度超声波辅助植物乳杆菌发酵白果汁的代谢特性研究[J].食品与发酵工业,2020,46(22):55-63.
WANG Y C, TAO Y, LI D D, et al.Metabolic characteristics of Lactobacillus plantarum during ginkgo kernel juice fermentation assisted with low-frequency and low- intensity ultrasound[J].Food and Fermentation Industries,2020,46(22):55-63.
[11] PAWAR S V, RATHOD VIRENDRA K.Role of ultrasound in assisted fermentation technologies for process enhancements[J].Preparative biochemistry &biotechnology,2020,50(6).627-634.
[12] SHIKHA O K, TIMOTHY J.MASON C P.et al.Ultrasound technology for food fermentation applications[J]. Ultrasonics Sonochemistry,2017,34:410-417.
[13] GDAI C, WANG B, WANG J, et al.Effect of ultrasound stimulation on metabolic modulation of pyruvic acid[J].Colloids and Surfaces B:Biointerfaces,2004,36(2):101-104.
[14] RUAN S, LOU J, LI Y, et al.Ultrasound-assisted liquid-state fermentation of soybean meal with Bacillus subtilis:Effects on peptides content, ACE inhibitory activity and biomass[J].Process Biochemistry,2020,91:73-82.
[15] 史磊,刘春雨,张盼盼,等.正交实验法优选发酵蜈蚣粉中水溶性总蛋白提取工艺及其抗肿瘤效果[J].山东中医杂志,2017,36(8):710-713.
SHI L, LIU C Y, ZHANG P P, et al.Optimization of extraction process for total water soluble proteins in fermented centipede powders by orthogonal test[J].Shandong Journal of Traditional Chinese Medicine, 2017,36(8):710-713.
[16] VOGT M, HAAS S, KLAFFL S, et al.Pushing product formation to its limit:Metabolic engineering of Corynebacterium glutamicum for L-leucine overproduction[J].Metabolic Engineering, 2014, 22:40-52.
[17] MARIENHAGEN J, EGGELING L.Metabolic function of Corynebacterium glutamicum Aminotransferases AlaT and AvtA and impact on L-Valine production[J].Applied and Environmental Micrchology,2008,74(24):7 457-7 462.
[18] 吴佳敏,伍时华,杨晓,等.生料发酵白酒超声陈化条件[J].食品工业,2020,41(3):65-70.
WU J M, WU S H, YANG X, et al.The ultrasonic aging condition of uncooked fermentation liquor[J].The Food Industry, 2020,41(3):65-70.
[19] SAJAD S, SEYED S S, SAEID H.Stimulatory effects of low intensity ultrasound on the growth kinetics and metabolic activity of Lactococcus lactis subsp. Lactis[J].Process Biochemistry,2020,89:1-8.
[20] 王红梅,蒋思睿,陶阳,等.超声辅助植物乳杆菌发酵苹果及草莓汁过程中菌体生长及酚类等物质代谢[J].食品科学,2020,41(14):72-81.
WANG H M, JIANG S R, TAO Y, et al.Effect of ultrasound on microbial growth and metabolisms of various components including phenolics during fermentation of apple and strawberry juice by lactobacillus plantarum[J].Food Science,2020,4(14):72-81.
[21] HUANG G, CHEN S, TANG Y, et al.Stimulation of low intensity ultrasound on fermentation of skim milk medium for yield of yoghurt peptides by Lactobacillus paracasei[J].Ultrasonics sonochemistry,2019,51:315-342.