麝香猫(Viverra zibetha)分布于中国、印尼、孟加拉等国的热带雨林、亚热带常绿阔叶林[1-4],是我国二级重点保护动物,并入选濒危野生动植物种国际贸易公约[5]。成熟咖啡果被麝香猫取食后在胃蛋白酶等的作用下咖啡果皮、果胶质水解,一般固体食物在pH 1.3~1.8的胃部消化3~4 h,随后进入小肠,pH值升至3.5,在胰蛋白酶作用下停留约0.5~1 h,最终到达大肠形成残渣排出,整个过程8~10 h,这样的咖啡便被称作“麝香猫咖啡”或“猫屎咖啡”(Kopi Luwak)。由于其数量稀少,产量极低,风味独特价格不菲。近年来针对猫屎咖啡也有一些研究,MARCONE[6]在麝香猫消化道中发现的酶解过程改变了咖啡豆的化学成分,并能改变咖啡烘焙后的感官品质。MARTINEZ[7]等采用猪胃蛋白酶处理咖啡以改善咖啡的口感,减少咖啡苦味,改善香气和咖啡杯品。佟世生等[8]以云南小粒咖啡去皮鲜果利用胃蛋白酶处理后的咖啡感官评价结果高于未处理组。云南是优质咖啡生长的沃土,贡献着约95%的中国和1%的世界咖啡产量,但多以初级产品出口,技术含量低,高品质技术的咖啡研究相对欠缺。目前国内外已有一些采用咖啡鲜果酶解[9]和发酵[10-11]方式进行体外模拟麝香猫咖啡的研究,但由于咖啡鲜果加工有季节性因素影响,利用干豆复水酶解体外模拟发酵咖啡尚未见报道。此外常规咖啡生产中发酵均为自然露天发酵,给咖啡品质带来了不确定性。本研究以云南阿拉比卡咖啡干豆为原料,经复水利用胃、胰蛋白酶进行体外模拟发酵,结合杯测、理化、风味特征分析,对发酵咖啡品质进行评价,同时对烘焙咖啡理化、风味特征成分与杯测指标间的相关性进行分析。以期为后期益生菌发酵咖啡的创新加工,清洁化、批量化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
云南阿拉比卡种卡蒂姆咖啡(手工精选S17,全水洗处理,2015年保山豆,海拔约1 000 m,年平均气温在18.4~20.0 ℃,年日照2 281~2 453 h,年降雨量1 400~1 700 mm)。120 U/g胃蛋白酶、4 000 U/g胰蛋白酶、牛血清蛋白均为AR级。
1.2 仪器与设备
Brewista 200 mL杯测碗、杯测勺,苏州顺和丰家电科技有限公司;标准生豆、咖啡粉分级筛,台湾琥珀色咖啡研究室;SANTOKER R500F咖啡烘焙机,北京三豆客科技有限公司;HYP-308型消化炉,上海纤检仪器有限公司;KDN-04B型凯氏定氮仪,浙江托普仪器有限公司;F800纤维测定仪,济南海能仪器股份有限公司;METTLER TOLEDO HS153水分测定仪,梅特勒-托利多集团。
1.3 实验方法
1.3.1 不同复水时间对咖啡豆的影响
咖啡生干豆用无菌超纯水浸泡0~18 h。测定吸水率(泡后捞起咖啡吸干水质量/干豆质量),千分尺测量单颗粒豆体体积(长×宽×高),折光仪测定水中可溶性固形物含量(total soluble solids,TSS),pH计测定水pH值。
1.3.2 体外发酵流程
体外模拟发酵液的制备参考《中国药典》[12]配制人工胃液(simulated gastric fluid,SGF)、人工小肠液(simulated intestinal fluid,SIF)、人工结肠液(simulated colon fluid,SCF),流程如下:
复水10 h的咖啡豆→SGF发酵→SIF发酵→SCF发酵→冷冻干燥
将SGF、SIF、SCF分别置于3个自封袋,咖啡豆与发酵液各按料液比4∶1(g∶mL)混合排空,置于37 ℃恒温水浴锅中,依次按SGF、SIF、SCF顺序发酵。发酵总时间为0、2、4、6、8、10 h,总时间中SGF时间∶SIF时间∶SCF时间=4∶1∶0,发酵完毕蒸馏水冲洗1次,冷冻干燥。
1.3.3 咖啡豆的烘焙与杯测
用SANTOKER R500E烘焙机烘焙咖啡豆。气源液化石油气,火力0.5 kPa,风门4,转速60 r/min,入豆温度180~190 ℃,烘焙时间15 min,中深度烘焙(Agtron值控制在60~75,失水率控制在12%~15%)。
采用美国精品咖啡协会评分标准,参考LINGLE[13]的杯测方法,13人参加杯测,杯测指标中一致性、干净度、甜度等级均按每项满分10分给分,平衡性按7.5分给分,不做评测。其他每个小项满分为10分,以6分为起评分,共分为4个级别, 6分为“好”;7分为“非常好”;8分为“优秀”;9分以上为“超凡”。
1.3.4 咖啡基本理化成分分析及数据整理
总灰分测定[14];总膳食纤维测定[15];还原糖测定y=1.945x-0.040 2(R2=0.993 5)[16];脂肪测定[17];总蛋白质测定[18];多糖测定(蒽酮硫酸比色法)y=18.839x+0.026 1(R2=0.982 5)[19-20];可溶性蛋白质测定(考马斯亮蓝G250)y=0.008x+0.035 7(R2=0.993 8)[21];多酚含量测定(福林酚法)y=1.038 6x+0.033 5(R2=0.984 8)[22-23]均参照文献进行。
游离氨基酸测定:采用酸水解法,色谱条件为Agilent Hypersil ODS柱 (5 μm, 4.0 mm×250 mm);流动相A:V(27.6 mmol/L醋酸钠)∶V(三乙胺)∶V(四氢呋喃)=500∶0.11∶2.5, 流动相B:V(80.9 mmol/L醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2;流速为1 mL/min;柱温40 ℃;紫外检测器检测波长为338 nm, 以外标法进行定量。
有机酸含量测定:采用离子色谱法,色谱条件为Kromasil C18柱,柱温40 ℃,流动相为V(乙腈)∶V(25 mmol/L磷酸溶液)=17∶83,流速为1.0 mL/min检测波长306 nm。
实验数据用Excel整理,采用SPSS 19.0进行统计分析。
2 结果与分析
2.1 不同浸泡时间对咖啡豆性状的影响
如图1所示,咖啡生干豆复水10 h后吸水率、单颗粒体积增长,吸胀作用达到极限;同时水中TSS在12 h后保持相对稳定。经18 h吸胀作用,水pH值逐渐从7.02下降至6.26,咖啡生干豆经10~12 h浸泡能充分吸胀,且豆内容物渗出较少。
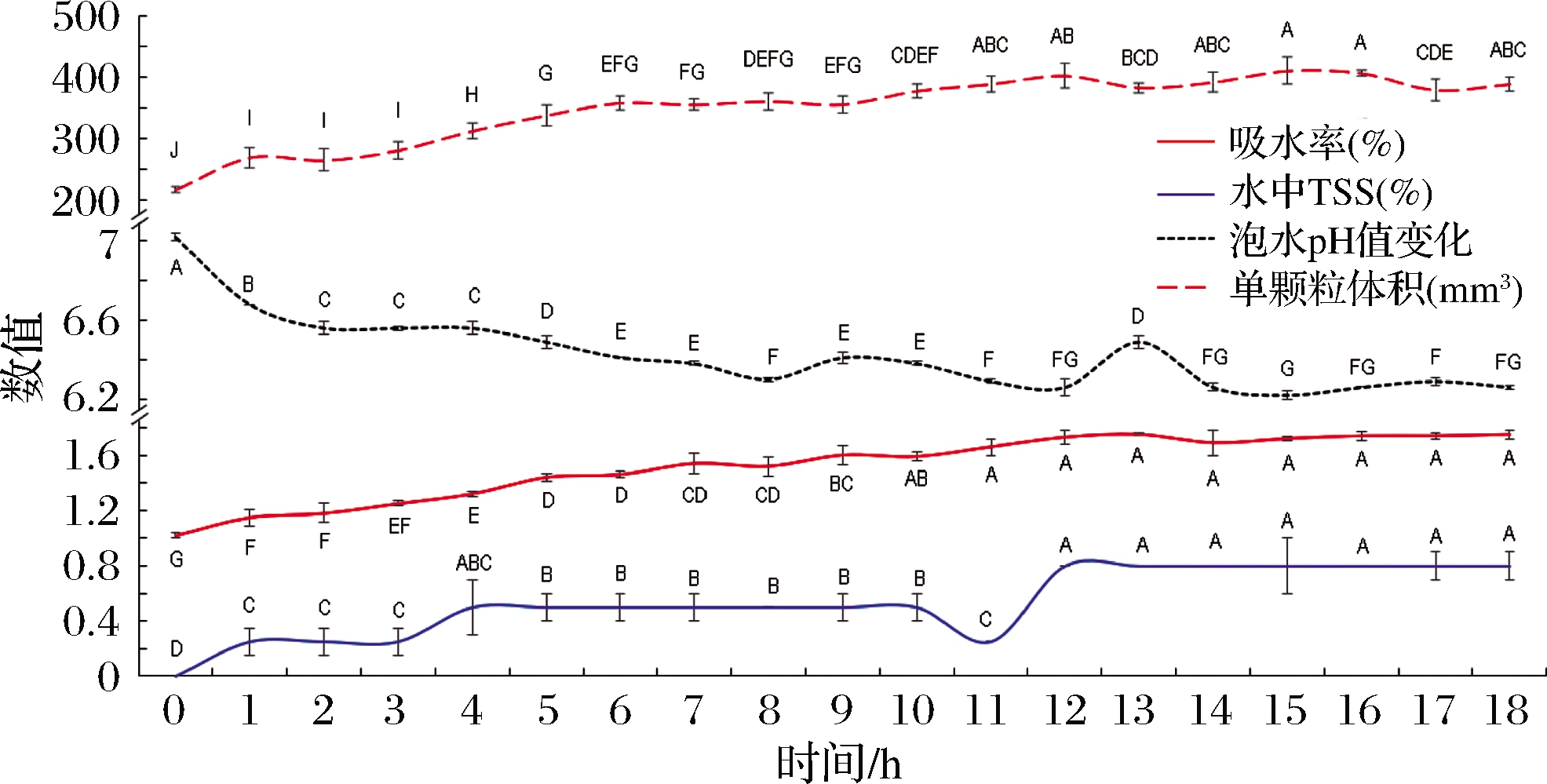
图1 浸泡时间对咖啡豆性状的影响
Fig.1 Effect of soaking time on the traits of the coffee beans
注:不同大写字母表示差异显著(P<0.05)
2.2 不同发酵时间对咖啡豆理化成分的影响
如表1所示,在发酵过程中,多糖呈现下降趋势,至8 h含量达到最低(3.22±0.28)%(质量分数),这与胡婕伦[24]的研究结果一致,多糖在强酸性环境会发生解聚和断裂[25],因此在消化过程中多糖含量逐渐减少,而还原糖含量逐渐上升,至8 h达到最高,为(3.98±0.21)%(质量分数),这一趋势与多糖含量的变化相对应,原因可能是多糖分子糖苷键发生断裂,还原末端增加[26-27];同时多糖被胃液和小肠液中的胃蛋白酶和胰蛋白酶降解为低聚糖,进而被降解为单糖[28],因此还原糖含量升高。总蛋白含量在消化过程中先下降而后上升再下降,在6 h含量最高为(8.54±0.17)%(质量分数);可溶性蛋白、酚类消化2 h后呈下降趋势,这与李俶等[29]的研究结果一致,多酚类物质经过体外模拟胃肠道消化后,多酚含量降低,可能是肠道中的胰蛋白酶对酚类物质进行消化分解的原因[30];徐俊杰[31]研究表明脂肪的消化是在胃脂酶和胰脂酶的催化作用下发生水解,本研究结果显示,脂肪含量在消化2 h后变化不显著(P>0.05),膳食纤维和灰分含量变化不显著(P>0.05)。
表1 发酵时间对咖啡豆理化性质的影响 单位:%(质量分数)
Table 1 Effect of fermentation time on physicochemical properties of coffee beans

发酵时间/h多糖还原糖脂肪总蛋白可溶性蛋白酚类膳食纤维灰分原咖啡豆4.87±0.16A3.79±0.21AB18.98±0.48A5.46±0.44BC2.18±0.07A4.59±0.26A36.17±0.29B1.73±0.06A04.13±0.23B3.48±0.25BCD12.82±0.71C6.61±0.62B2.24±0.09A4.42±0.22A40.88±0.79A1.38±0.01B23.85±0.42BC3.57±0.22BCD15.32±0.47BC6.24±0.56B1.85±0.02B4.12±0.14B41.71±1.21A1.26±0.23B43.83±0.24BC3.32±0.20D16.66±0.00B4.60±0.14C1.27±0.04D4.01±0.10B42.06±0.32A1.31±0.10B63.37±0.15DE3.76±0.32ABC14.82±0.70BC8.54±0.17A1.38±0.27CD4.06±0.10B40.22±0.55A1.30±0.12B83.22±0.28E3.98±0.21A16.32±0.00B5.27±0.36BC1.54±0.34C4.06±0.05B40.48±0.95A1.23±0.25B103.68±0.26CD3.55±0.33BCD14.66±1.42BC5.59±0.29BC1.56±0.10C3.71±0.06C40.34±0.04A1.30±0.08B
注:同列肩标不同大写字母表示差异显著(P<0.05)
2.3 不同发酵时间对咖啡豆氨基酸含量的影响
如图2所示,不同发酵阶段咖啡豆中共检出17种游离氨基酸,其中谷氨酸含量在不同发酵阶段均为最高,平均占总游离氨基酸含量的20.76%。其次为天门冬氨酸、赖氨酸和亮氨酸,平均分别各占总游离氨基酸含量的9.56%、7.87%和7.82%,蛋氨酸平均占总游离氨基酸含量的0.97%,是不同发酵阶段咖啡豆中含量最少的氨基酸。LEE等[32]发现在咖啡自然发酵过程中脯氨酸和天冬氨酸浓度会增加1.5倍,但本实验酶解阶段不同游离氨基酸随发酵时间的增加变化无规律。
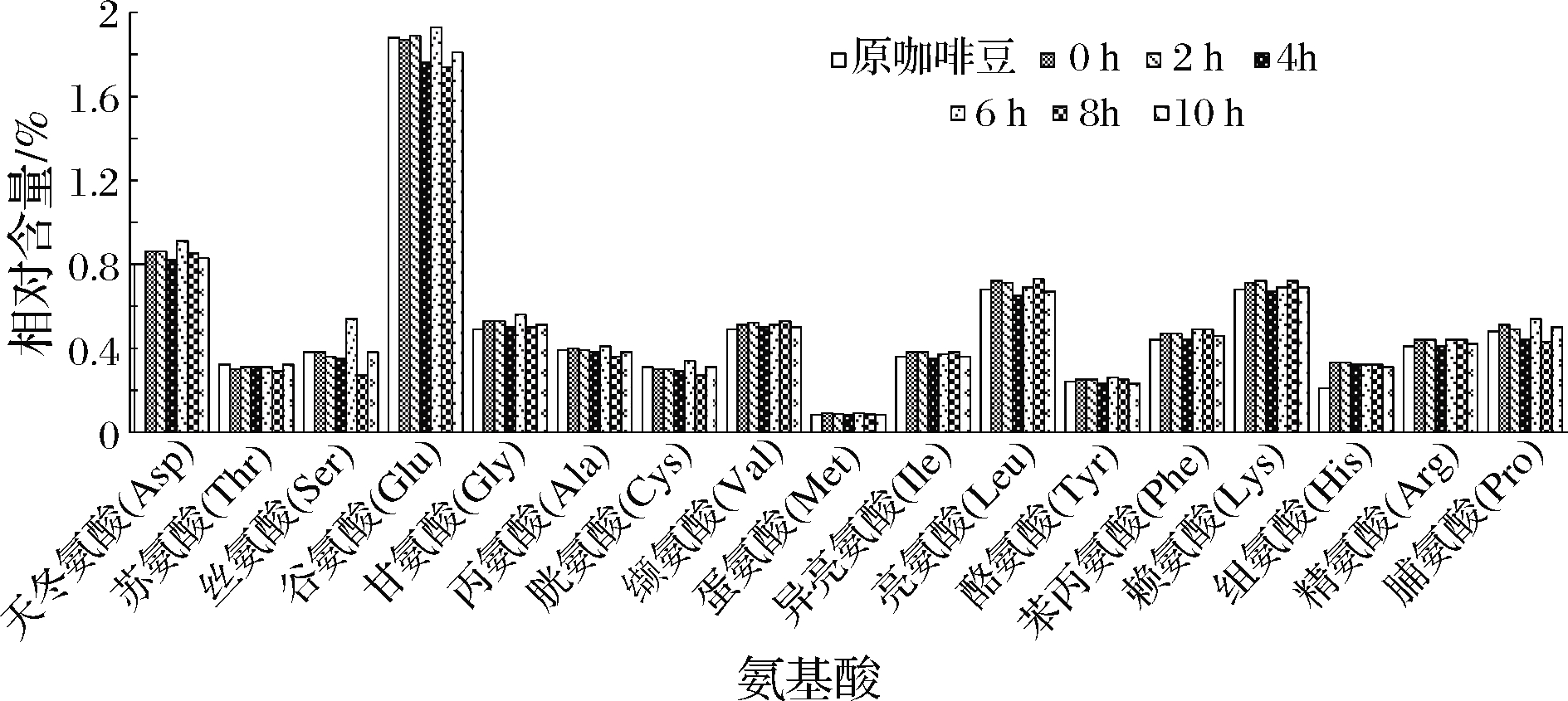
图2 发酵时间对咖啡豆氨基酸含量的影响
Fig.2 Effect of fermentation time on the content of amino acids
2.4 不同发酵时间对咖啡豆呈酸苦味前体物的影响
咖啡的酸味主要来源于咖啡中柠檬酸和苹果酸[33],苦味的前体是咖啡中的绿原酸和咖啡因[34],涩味主要来源于绿原酸、葫芦巴碱和奎宁酸[35]。咖啡浸泡后葫芦巴碱和奎宁酸含量下降约50%,这与PANJI等[36]研究结果一致,咖啡消化发酵后可减少涩味,提高杯品。随着发酵时间增加,绿原酸和柠檬酸的含量逐渐增加,可能使产品烘焙后酸苦味增加,苹果酸含量减少,与WANG[37]等的研究结果一致,苹果酸在消化后被部分分解,含量降低。咖啡因含量基本不变,说明酶解消化对咖啡因含量影响不大。
表2 发酵时间对呈酸苦味前体物质的影响
Table 2 The effect of fermentation time on the precusor substances of acid and bitter
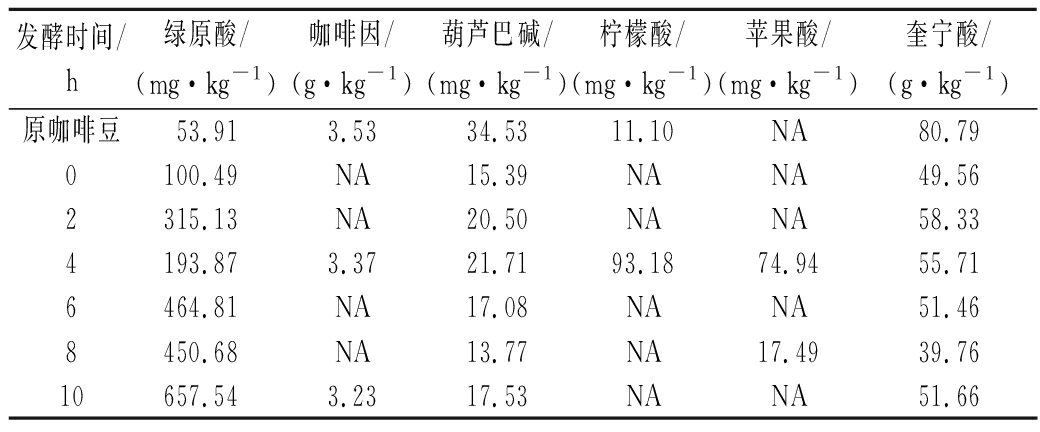
发酵时间/h绿原酸/(mg·kg-1)咖啡因/(g·kg-1)葫芦巴碱/(mg·kg-1)柠檬酸/(mg·kg-1)苹果酸/(mg·kg-1)奎宁酸/(g·kg-1)原咖啡豆53.913.5334.5311.10NA80.790100.49NA15.39NANA49.562315.13NA20.50NANA58.334193.873.3721.7193.1874.9455.716464.81NA17.08NANA51.468450.68NA13.77NA17.4939.7610657.543.2317.53NANA51.66
注:NA表示未测出
2.5 发酵咖啡豆的杯品
从杯品总分来看,发酵2 h咖啡杯品较0 h高,差异不显著(P>0.05),发酵2 h咖啡干香、湿香及风味评分较高,咖啡香气由美拉德反应和其他热催化反应所形成,糖、蛋白质、氨基酸和酚类等化合物在咖啡香气的形成中起着重要作用,是重要的香气前体。发酵2 h风味丰富、杯品最高,发酵4 h咖啡酸质较高。发酵过程中体脂感波动变化,与理化分析结果中脂肪含量变化相对应。随着消化时间增加杯品分呈现波动,但均比0 h杯品高。
表3 发酵时间对烘焙咖啡豆杯品的影响 单位:分
Table 3 Effect of fermentation time on the coffee cup quality
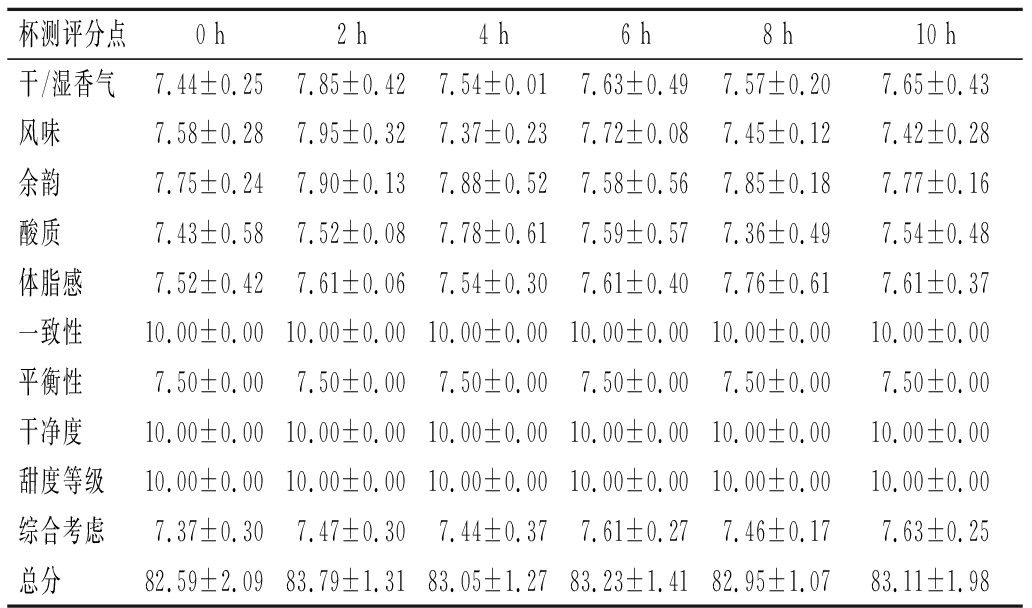
杯测评分点0 h2 h4 h6 h8 h10 h干/湿香气7.44±0.257.85±0.427.54±0.017.63±0.497.57±0.207.65±0.43风味7.58±0.287.95±0.327.37±0.237.72±0.087.45±0.127.42±0.28余韵7.75±0.247.90±0.137.88±0.527.58±0.567.85±0.187.77±0.16酸质7.43±0.587.52±0.087.78±0.617.59±0.577.36±0.497.54±0.48体脂感7.52±0.427.61±0.067.54±0.307.61±0.407.76±0.617.61±0.37一致性10.00±0.0010.00±0.0010.00±0.0010.00±0.0010.00±0.0010.00±0.00平衡性7.50±0.007.50±0.007.50±0.007.50±0.007.50±0.007.50±0.00干净度10.00±0.0010.00±0.0010.00±0.0010.00±0.0010.00±0.0010.00±0.00甜度等级10.00±0.0010.00±0.0010.00±0.0010.00±0.0010.00±0.0010.00±0.00综合考虑7.37±0.307.47±0.307.44±0.377.61±0.277.46±0.177.63±0.25总分82.59±2.0983.79±1.3183.05±1.2783.23±1.4182.95±1.0783.11±1.98
注:所有杯测评分点得分随时间变化均不显著(P>0.05)
2.6 烘焙发酵咖啡豆杯测指标与基本理化成分的相关性分析
发酵咖啡豆经烘焙后体脂感与多糖和灰分含量呈极显著(P<0.01)和显著负(P<0.05)相关,相关系数分别为0.887和0.820,咖啡中多糖和灰分含量增加会降低咖啡的醇厚感。余韵与可溶性蛋白含量呈显著正相关(P<0.05),相关系数为0.812,可溶性蛋白质丰厚的咖啡回味会略强。咖啡的干/湿香气、风味、酸质与咖啡基本理化成分之间相关性不大(P>0.05)。咖啡的杯测指标与总蛋白含量相关性不大,与胡双芳等[38]研究一致。
表4 发酵咖啡杯测评分与基本理化成分的Pearson相关分析
Table 4 Correlation analysis (Pearson correlation) between coffee cup quality and physicochemical components of coffee beans
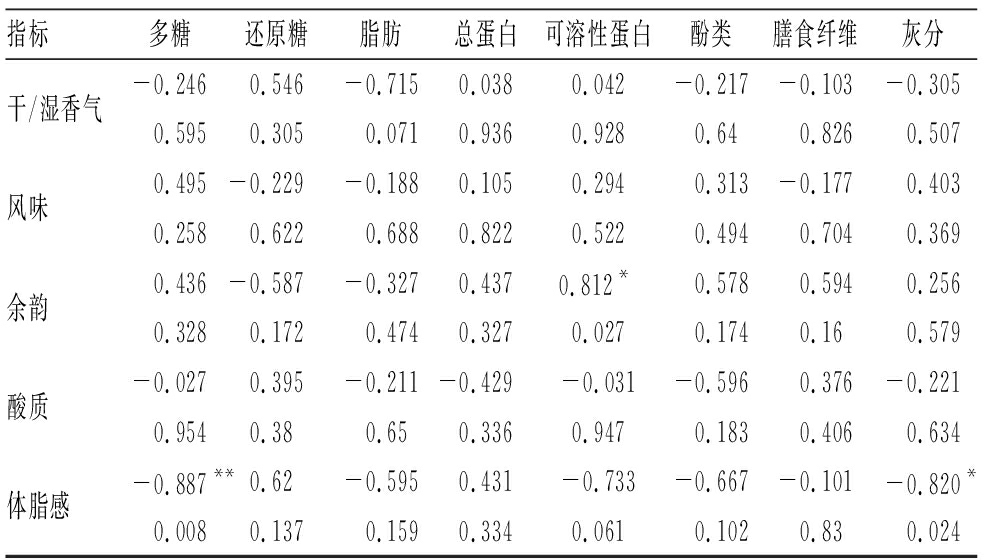
指标多糖还原糖脂肪总蛋白可溶性蛋白酚类膳食纤维灰分干/湿香气-0.2460.546-0.7150.0380.042-0.217-0.103-0.3050.5950.3050.0710.9360.9280.640.8260.507风味0.495-0.229-0.1880.1050.2940.313-0.1770.4030.2580.6220.6880.8220.5220.4940.7040.369余韵0.436-0.587-0.3270.4370.812*0.5780.5940.2560.3280.1720.4740.3270.0270.1740.160.579酸质-0.0270.395-0.211-0.429-0.031-0.5960.376-0.2210.9540.380.650.3360.9470.1830.4060.634体脂感-0.887**0.62-0.5950.431-0.733-0.667-0.101-0.820*0.0080.1370.1590.3340.0610.1020.830.024
注:表中“**”表示在P<0.01水平极显著相关,“*”表示在P<0.05水平显著相关(下同)
2.7 烘焙发酵咖啡豆杯测指标与风味特征成分的相关性分析
发酵咖啡豆烘焙后的风味与绿原酸的含量呈极显著(P<0.01)正相关,相关系数为0.982,绿原酸较高的咖啡豆风味明显,较容易识别。酸质与柠檬酸和苹果酸含量呈极显著(P<0.01)正相关,相关系数分别为0.885、0.875,说明高含量柠檬酸和苹果酸能给咖啡带来丰富酸质感。体脂感与葫芦巴碱和奎宁酸呈显著(P>0.05)负相关,相关系数分别为0.828、0.823,咖啡中随着葫芦巴碱和奎宁酸含量增加,咖啡醇厚度下降。其他杯测指标与理化成分之间相关性不明显(P>0.05),咖啡的干/湿香气、余韵与咖啡风味特征成分之间相关性不大。
表5 发酵咖啡杯测评分与呈酸苦味前体物的Pearson关系分析
Table 5 Correlation analysis (Pearson correlation) between coffee cup quality and precursors substances of acid and bitter in coffee beans
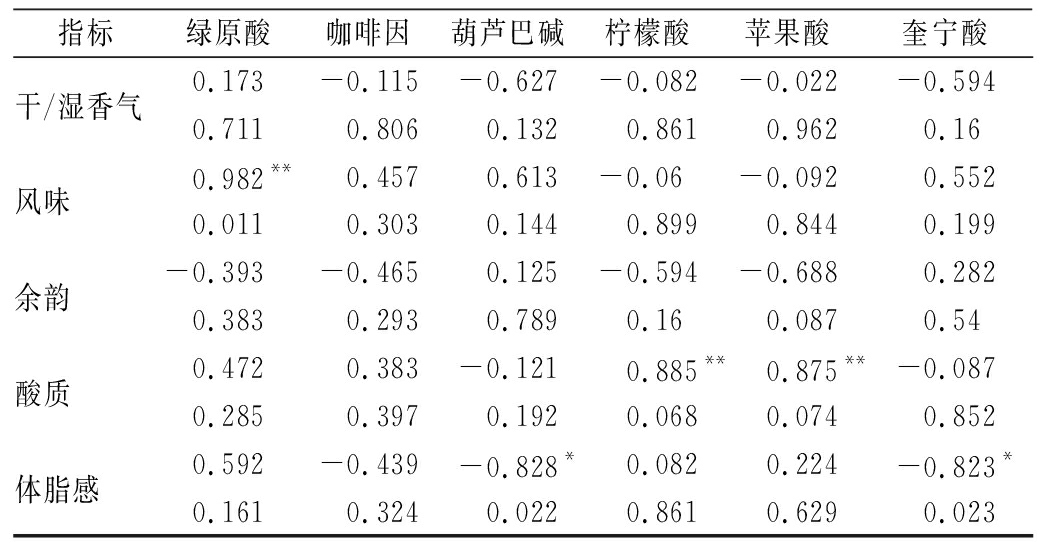
指标绿原酸咖啡因葫芦巴碱柠檬酸苹果酸奎宁酸干/湿香气0.173-0.115-0.627-0.082-0.022-0.5940.7110.8060.1320.8610.9620.16风味0.982**0.4570.613-0.06-0.0920.5520.0110.3030.1440.8990.8440.199余韵-0.393-0.4650.125-0.594-0.6880.2820.3830.2930.7890.160.0870.54酸质0.4720.383-0.1210.885**0.875**-0.0870.2850.3970.1920.0680.0740.852体脂感0.592-0.439-0.828*0.0820.224-0.823*0.1610.3240.0220.8610.6290.023
3 结论
咖啡生干豆最佳复水时间为10~12 h,豆体内容物渗出较少,利于后期发酵。在发酵过程中,多糖呈下降趋势,还原糖含量逐渐上升,总蛋白含量先下降再上升最后下降;可溶性蛋白、酚类消化2 h后呈下降趋势,脂肪含量在消化2 h后变化不显著(P>0.05);膳食纤维和灰分含量变化不显著(P>0.05)。咖啡豆游离氨基酸中谷氨酸含量占比最高为20.76%,其次为天门冬氨酸、赖氨酸和亮氨酸。在不同发酵阶段,游离氨基酸随发酵时间的增减变化无规律。而咖啡中风味特征成分绿原酸和柠檬酸的含量随发酵进行逐渐增加,苹果酸含量减少,咖啡因含量基本不变。咖啡中绿原酸会极显著影响咖啡风味表现,柠檬酸和苹果酸高低决定了咖啡的酸质,可溶性蛋白含量高低影响到咖啡余韵,多糖、灰分、葫芦巴碱、奎宁酸过高则会降低咖啡杯品醇厚度。
[1] 郑作新.脊椎动物分类学[M].北京:中国农业出版社, 1982.
ZHENG Z X.Vertebrate Taxonomy[M].Beijing:China Agricultural Press, 1982.
[2] 罗蓉,谢家华,辜永河.贵州兽类志[M].贵阳:贵州科技出版社, 1993.
LUO R, XIE J H, GU Y H.Guizhou Animal Chronicles[M].Guiyang:Guizhou Science and Technology Press, 1993.
[3] TAWALI A B, LAGA A.Luwak coffee in vitro fermentation:Literature review[C].IOP Conference Series:Earth and Environmental Science.IOP Publishing, 2019.
[4] 钟福生.小灵猫的资源、开发利用现状与分布[J].湖南环境生物职业技术学院学报, 2001, 7(2):24-26.
ZHONG F S.Status & distribution of exploitation and utilization in Lesser Civits’ resource[J].Journal of Hunan Environment-Biological Polytechnic, 2001, 7(2):24-26.
[5] 黎跃成,万德光.中国药用动物原色图鉴[M].上海:上海科学技术出版社,2010.
LI Y C, WAN D G.Primary Color Atlas of Chinese Medicinal Animals[M].Shanghai:Shanghai Scientific & Technical Publishers, 2010.
[6] MARCONE M F.Composition and properties of Indonesian palm civet coffee (Kopi Luwak) and Ethiopian civet coffee[J]. Food Research International, 2004, 37(9):901-912.
[7] MARTINEZ L F, BALABAN M O.Quality Enhancement of Coffee Beans by Acid and Enzyme Treatment:U.S.Patent Application 12/392,757[P].2009-09-03.
[8] 佟世生,王丽,靳静言,等.酶解咖啡鲜果对烘焙咖啡饮用品质和化学成分的影响研究[J].食品研究与开发, 2016, 37(10):49-54;90.
TONG S S, WANG L, JIN J Y, et al.Conditions optimization of enzymolysis on coffee fruit and the impact study on coffee drinking quality and chemical composition[J].Food Research and Development, 2016, 37(10):49-54;90.
[9] 佟世生,王丽,靳静言,等.酶解偶联发酵体外模拟麝香猫咖啡的电子舌相关性分析[J].食品工业科技, 2015, 36(22):133-136;142.
TONG S S, WANG L, JIN J Y, et al.Correlation analysis of simulation civet coffee by purebred fermentated coupling with pepsin enzymatic pre-hydrolysis in vitro with electronic tongue[J].Science and Technology of Food Industry, 2015, 36(22):133-136;142.
[10] GILBERTO V D M P, ![]() P D C N, MEDEIROS A B P, et al.Potential of lactic acid bacteria to improve the fermentation and quality of coffee during on-farm processing[J].International Journal of Food Science & Technology, 2016, 51(7):1 689-1 695.
P D C N, MEDEIROS A B P, et al.Potential of lactic acid bacteria to improve the fermentation and quality of coffee during on-farm processing[J].International Journal of Food Science & Technology, 2016, 51(7):1 689-1 695.
[11] BRESSANI A P P, MARTINEZ S J, EVANGELISTA S R, et al.Characteristics of fermented coffee inoculated with yeast starter cultures using different inoculation methods[J].LWT, 2018, 92:212-219.
[12] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015.
National Pharmacopoeia Committee.Chinese Pharmacopoeia[M].Beijing:China Medical Science and Technology Press, 2015.
[13] LINGLE T R, MENON S N.Cupping and Grading-Discovering Character and Quality[M].The Craft and Science of Coffee,2017.
[14] 中华人民共和国国家卫生和计划生育委员会.GB 5009.4—2016食品安全国家标准 食品中灰分的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the PRC.GB 5009.4—2016 National Standard for Food safety Determination of ash content in food[S].Beijing:China Standards Press, 2016.
[15] 中华人民共和国国家卫生和计划生育委员会.GB 5009.88—2014食品安全国家标准 食品中膳食纤维的测定[S].北京:中国标准出版社, 2014.
National Health and Family Planning Commission of the PRC.GB 5009.88—2014 National Standard for Food safety Determination of dietary fiber[S].Beijing:China Standards Press, 2014.
[16] 中华人民共和国国家卫生和计划生育委员会.GB 5009.7—2016食品安全国家标准 食品中还原糖的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the PRC.GB 5009.7—2016 National Standard for Food safety Determination of reducing sugar[S].Beijing:China Standards Press, 2016.
[17] 中华人民共和国国家卫生和计划生育委员会.GB 5009.6—2016食品安全国家标准 食品中脂肪的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the PRC.GB 5009.6—2016 National Standard for Food safety Determination of fat[S].Beijing:China Standards Press, 2016.
[18] 中华人民共和国国家卫生和计划生育委员会.GB 5009.5—2016食品安全国家标准 食品中蛋白质的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the PRC.GB 5009.5—2016 National Standard for Food safety Determination of Protein[S].Beijing:China Standards Press, 2016.
[19] BALLESTEROS L F, JOSÉ A TEIXEIRA, MUSSATTO S I.Extraction of polysaccharides by autohydrolysis of spent coffee grounds and evaluation of their antioxidant activity[J].Carbohydrate Polymers, 2017, 157:258-266.
[20] 张帅,程昊,邱彩霞,等.超声波诱变对猴头菇粗多糖的影响[J].食品与发酵工业, 2020, 46(2):126-130.
ZHANG S, CHENG H, QIU C X, et al.Effect of ultrasonic mutation on crude polysaccharide of Hericium erinaceus[J].Food And Fermentation Industries, 2020, 46(2):126-130.
[21] 张颖,张光艳,王宇翔,等.不同花源蜂蜜蛋白质组分及提取方法的比较[J].食品与发酵工业, 2019, 45(14):91-96.
ZHANG Y, ZHANG G Y, WANG Y X, et al.Comparison of protein composition and extraction methods between honey from different floral origins[J].Food and Fermentation Industries, 2019, 45(14):91-96.
[22] KWAK H S, JI S, JEONG Y.The effect of air flow in coffee roasting for antioxidant activity and total polyphenol content[J].Food Control, 2017, 71:210-216.
[23] 吴振,李红,王勇德,等.不同热处理温度对蓝莓果汁在冷藏过程中多酚和黄酮含量的影响[J].食品与发酵工业, 2019, 45(17):209-215.
WU Z, LI H, WANG Y D, et al.Effects of different thermal-treated temperatures on polyphenols and flavonoids of blueberry juice during cold storage[J].Food and Fermentation Industries, 2019, 45(17):209-215.
[24] 胡婕伦. 大粒车前子多糖体内外消化与酵解特征体系构建及其促进肠道健康的作用[D].南昌:南昌大学, 2014.
HU J L.Establishment of a system for in vitro and in vivo studies on digestion and fermentation of polysaccharide from seeds of Plantago asiatica L.with its beneficial effects on intestinal health[D].Nanchang:Nanchang University, 2014.
[25] FISHMAN M L, COOKE P, HOTCHKISS A, et al.Progressive dissociation of pectin[J].Carbohydrate Research, 1993, 248(3):303-316.
[26] CHEN J, LIANG R H, LIU W, et al.Degradation of high-methoxyl pectin by dynamic high pressure microfluidization and its mechanism[J].Food Hydrocolloids, 2012, 28(1):121-129.
[27] 邹晓莉,江水,郑波,等.高效阴离子色谱法分离测定蜂蜜和保健食品多糖水解产物中的单糖组成[J].四川大学学报(医学版), 2008(5):836-838.
ZOU X L, JIANG S, ZHENG B, et al.Determination of monosaccharides in honey and polysaccharide hydrolyzate of functional food by high performance anion exchange chromatography[J].Journal of Sichuan University (Med Sci Edi), 2008(5):836-838.
[28] 张冠亚,黄晓君,聂少平,等.体外模拟3种消化液对铁皮石斛多糖的消化作用[J].食品科学, 2014, 35(23):279-283.
ZHANG G Y, HUANG X J, NIE S P, et al.Effects of three digestive juices on the in vitro digestion of Dendrobium offcinale polysaccharide[J].Food Science, 2014, 35(23):279-283.
[29] 李俶,王谢祎,翟宇鑫,等.多酚化合物体外模拟消化的稳定性分析[J].食品科学, 2016, 37(13):1-5.
LI T, WANG X Y, ZHAI Y X, et al.Stability of polyphenols during in vitro digestion[J].Food Science, 2016, 37(13):1-5.
[30] FULGENCIO S C, JOSÉ S, ISABEL G.Intake and bioaccessibility of total polyphenols in a whole diet[J].Food Chemistry, 2006, 101(2):492-501.
[31] 徐俊杰. 甘油三酯的体外模拟消化水解研究[D].无锡:江南大学, 2014.
XU J J.Study on triglyceride hydrolysis during in vitro digestion[D].Wuxi:Jiangnan University, 2014.
[32] LEE L W, TAY G Y,CHEONG M W, et al.Modulation of the volatile and non-volatile profiles of coffee fermented with Yarrowia lipolytica:I.Green coffee[J].LWT Food Science and Technology, 2017, 77:225-232.
[33] 于淼. 云南德宏地区咖啡豆的风味品质特性研究[D].大庆:黑龙江八一农垦大学, 2017.
YU M.Study on flavor quality of coffee beans in Dehong area of Yunnan[D].Daqing:Heilongjiang BayiAgricultural University, 2017.
[34] 虞健. 不同烘焙程度咖啡感官特征及主要化学成分分析[D].无锡:江南大学, 2014.
YU J.Sensory evaluation of coffee in different roasting degrees and analysis of the main effecting chemicals[D].Wuxi:Jiangnan University, 2014.
[35] FUJIOKA K,SHIBAMOTO T.Chlorogenic acid and caffeine contents in various commercial brewed coffees[J].Food Chemistry, 2008, 106(1):217-221.
[36] PANJI T, PRIYONO, SUHARYANTO, et al.“CIRAGI”- The microbial fermentation starter for developing excellent coffee flavour[C].IOP Conference Series:Earth and Environmental Science, 2018,99(1):409-420.
[37] WANG C H, SUN J C, LASSABLIERE B, et al.Potential of lactic acid bacteria to modulate coffee volatiles and effect of glucose supplementation:Fermentation of green coffee beans and impact of coffee roasting[J].Journal of the Science of Food and Agriculture, 2018,99(1):409-420.
[38] 胡双芳,卫亚西,邢精精,等.咖啡豆的化学组分差异与感官品质的相关性分析[J].食品工业科技, 2013, 34(24):125-129.
HU S F, WEI Y X, XING J J, et al.Correlation analysis between chemical components and sensory quality of coffee[J].Science and Technology of Food Industry, 2013, 34(24):125-129.