菠萝蜜(Artocarpus heterophyllus Lam.)又称波罗蜜,属于桑科(Moraceae)波罗蜜属(Artocarpus)植物,是典型的特色热带果树和木本粮作物,主要分布在印度、孟加拉国、中国和一些东南亚热带地区[1-2]。菠萝蜜果肉占果实重量的30%~35%,果肉肥厚、香味浓郁,被誉为“热带水果皇后”,富含菠萝蜜多糖、酚类化合物、类胡萝卜素等生物活性物质,具有抗氧化、辅助降血糖、提高免疫力等有益的生理作用[3-6]。但是由于菠萝蜜鲜果肉的高糖低酸环境,其极易遭受腐败微生物的侵染而缩短其储藏期从而限制其商业化应用。菠萝蜜果酒作为菠萝蜜果肉的精深加工产品,可提高菠萝蜜产品的附加值,目前对于菠萝蜜果酒的研究报道主要集中在菠萝蜜果酒的菌种选育[7]、发酵工艺[8]、香气成分[9]、生物活性成分[10]和抗氧化活性评价[11]研究,而关于菠萝蜜果酒发酵过程酵母菌体生长、还原糖基质消耗和乙醇产量生成的动力学变化规律尚未研究报道。
菠萝蜜果酒发酵过程中酵母菌体生长、还原糖基质消耗和乙醇产量生成的变化都存在一定的规律。微生物发酵动力学主要讨论的正是微生物发酵过程中菌体生长、底物消耗和产物生成之间的动态平衡和内在规律,通过数学模型定量描述发酵过程的速率及影响速率的因素[12]。目前,许多研究已通过建立不同发酵型果酒如红心火龙果酒[13]、仙人掌果酒[14]、山葡萄酒[15]、草莓果酒[16]、芒果酒[17]等的发酵动力学模型来描述酵母数目、糖消耗和乙醇生成量的规律,研究结果表明Logistic 、SGompertz、Boltzmann和DoseResp均能较好地体现菌体浓度、底物浓度和生成物浓度间的关系。然而,每种果酒因自身发酵环境不同而适用的发酵动力学模型存在一定差异。
本研究拟采用经典的Logistic、SGompertz、Boltzmann和DoseResp,对菠萝蜜果酒发酵过程中酵母菌体生长、还原糖基质消耗和乙醇产量生成的变化规律进行非线性拟合,建立菠萝蜜果酒分批发酵动力学模型,为菠萝蜜果酒的分批发酵向连续发酵的过渡和工业化发酵工艺控制提供理论支持。
1 材料与方法
1.1 材料与试剂
菠萝蜜,品种为香饮所11号,采摘于海南省万宁市兴隆热带植物园;RV171型葡萄酒活性干酵母(Saccharomyces cerevisiae),安琪酵母股份有限公司;果胶酶(500 U/mg,BR级),上海源叶生物科技有限公司;亚硫酸氢钠(分析纯),阿拉丁试剂(上海)有限公司;3, 5-二硝基水杨酸(化学纯),国药集团化学试剂有限公司;氢氧化钠、无水乙醇、四水合酒石酸钾钠、苯酚、无水亚硫酸钠、蔗糖、葡萄糖(分析纯),西陇科学股份有限公司。
1.2 仪器与设备
AL104电子天平,梅特勒-托利多仪器(上海)有限公司;HX-PB908多功能料理机,佛山市海迅电器有限公司;DK-98-11A电热恒温水浴锅,天津市泰斯特仪器有限公司;手持糖量折光仪(WZS-80),上海仪电物理光学仪器有限公司;LRH-250F生化培养箱,上海一恒科学仪器有限公司;GI54DW自动压力蒸汽灭菌锅,致微(厦门)仪器有限公司;HR50-ⅡA2生物安全柜,青岛海尔特种电器有限公司;血球计数板,上海市求精生化试剂仪器有限公司;CX31RTSF生物显微镜,奥林巴斯(中国)有限公司;SPECORD 250PLUS紫外/可见分光光度计,德国耶拿分析仪器股份公司;Z36HK台式高速冷冻离心机,贺默(上海)仪器科技有限公司;酒精计,河北省武强县华欧仪器仪表厂;TC-15套氏恒温器,海宁市新华医疗器械厂;DLSB-5L-10 ℃低温冷却液循环泵,巩义市河洛大研仪器厂。
1.3 实验方法
1.3.1 菠萝蜜果酒发酵工艺流程
菠萝蜜果酒发酵工艺流程如下:
菠萝蜜果实→去果皮和种子、取果肉→打浆→酶解→调节糖度→灭菌→接种→恒温发酵培养→菠萝蜜果酒→样品测定
挑选成熟、无病虫害腐烂的菠萝蜜果实,切分除去果皮和种子,取出果肉,按照1∶2(g∶mL)比例添加蒸馏水打浆。用40 mg/L的果胶酶进行果浆酶解,酶解温度为45 ℃,酶解时间为3 h。添加蔗糖调整菠萝蜜果浆糖度至21 °Bx。加入一定量的亚硫酸氢钠使果浆中的SO2含量达40 mg/L。果浆在60 ℃ 条件下灭菌30 min,然后冷却至室温,接种活化后的酵母(将一定量的干酵母用10倍量的含有1/3菠萝蜜果浆和2/3灭菌蒸馏水的混合液在35 ℃条件下活化30 min),使果浆中的干酵母用量达400 mg/L。恒温发酵一段时间得到菠萝蜜果酒样品,发酵控温为24 ℃,发酵时间为168 h,每24 h取样分析测定。
1.3.2 检测方法
1.3.2.1 酵母菌数量检测
根据胡永正等[18]的方法有所改动,采用血球计数板对果酒发酵液中酵母菌数直接计数,实验所用计数板为25×16型。取果酒发酵液用无菌水稀释至适当的倍数,取少量滴在血球计数板上,盖上盖玻片,在生物显微镜下观察计数酵母菌个数。按公式(1)计算酵母菌数量:
酵母菌数/(CFU·mL-1)
![]() 稀释倍数
稀释倍数
(1)
1.3.2.2 还原糖含量检测
采用3, 5-二硝基水杨酸(3, 5-dinitrosalicylicacid, DNS)比色法测定果酒发酵液中的还原糖含量[19]。DNS试剂按照农业部标准配制,葡萄糖标准曲线回归方程为y=0.436 1x+0.067 7,相关系数R2=0.997 4。
1.3.2.3 酒精度检测
按照GB 5009.225—2016《食品国家安全标准 酒中乙醇浓度的测定》规定[20],发酵液先蒸馏,然后采用酒精计法测定菠萝蜜果酒中的酒精度。酒精度表示在20 ℃条件下的乙醇体积分数。
1.4 数据处理与分析
1.4.1 数据处理
每组实验重复3个平行,结果取其平均值,采用Origin 9.0对数据进行统计与作图分析,选取合适的动力学模型对酵母菌体生长、还原糖基质消耗和乙醇产量生成情况进行非线性拟合,并利用每个模型的拟合系数R2作为可靠性评价标准来筛选出拟合度高的动力学模型进行定量描述。
1.4.2 发酵动力学模型
酵母菌体生长动力学模型拟合:根据实验数据分析,酵母菌体的生长呈“S”型曲线,结合经验模型,选取Logistic、SGompertz和Botlezman模型进行非线性拟合,选取拟合R2系数最大的模型对描述酵母菌体生长规律[14]。
乙醇产量生成动力学模型拟合:乙醇是酵母菌转化糖类代谢而生成的产物,其生成速率与酵母细胞生长速率有密切联系,属于生长偶联型,呈现“S”型曲线,因此选用Logistic、SGompertz和Botlezman经典模型对其进行非线性拟合,选用拟合系数R2最大的模型描述乙醇产量生成[21]。
还原糖基质消耗动力学模型拟合:酵母发酵果酒过程消耗还原糖基质作为能量来源并产生乙醇,因此选用Logistic、DoseResp与Botlzman模型进行非线性拟合,选用拟合系数R2最大的模型描述还原糖基质消耗情况[22]。
2 结果与分析
2.1 菠萝蜜果酒发酵过程中酵母菌数、还原糖含量和酒精度变化趋势
酿酒酵母(S.cerevisiae)分批发酵菠萝蜜果浆过程中酵母菌数、还原糖含量和酒精度变化如图1所示。酿酒酵母经过稀浓度菠萝蜜果浆的活化后能快速适应高浓度菠萝蜜果浆的发酵环境,在48 h的发酵期,由于养分充足酵母菌数进入对数生长期,呈指数趋势生长。随后因为还原糖基质的消耗和乙醇代谢产物的积累,酵母菌体的生长速率下降,细胞死亡速率上升,当两者状态平衡时,酵母菌数进入稳定期[22],此时酵母菌数最高达到5.27×108 CFU/mL。96 h后酵母菌数开始进入衰亡期,可能是发酵环境中还原糖基质和酵母细胞内所储能量消耗殆尽,酵母细胞在自身酶的作用下发生自溶而导致酵母菌数量的减少[23]。酿酒酵母发酵菠萝蜜果浆过程消耗还原糖基质产生酒精,体系中的还原糖含量随着发酵时间的增加而减少,至72 h时基本被酵母菌消耗完全,含量下降至3.30 g/L,与酵母菌体的生长时间点相一致。酒精是酵母菌厌氧发酵过程中转化糖类代谢而生成的产物。酒精度随着发酵时间的延长呈逐渐上升的趋势,发酵48 h前,因酵母菌的快速增长和还原糖的快速消耗,酒精亦快速生成,到达72 h时,酒精度达到最大值,为10.8%vol,表明酒精的生成与酵母菌生长和还原糖消耗是相对应的。
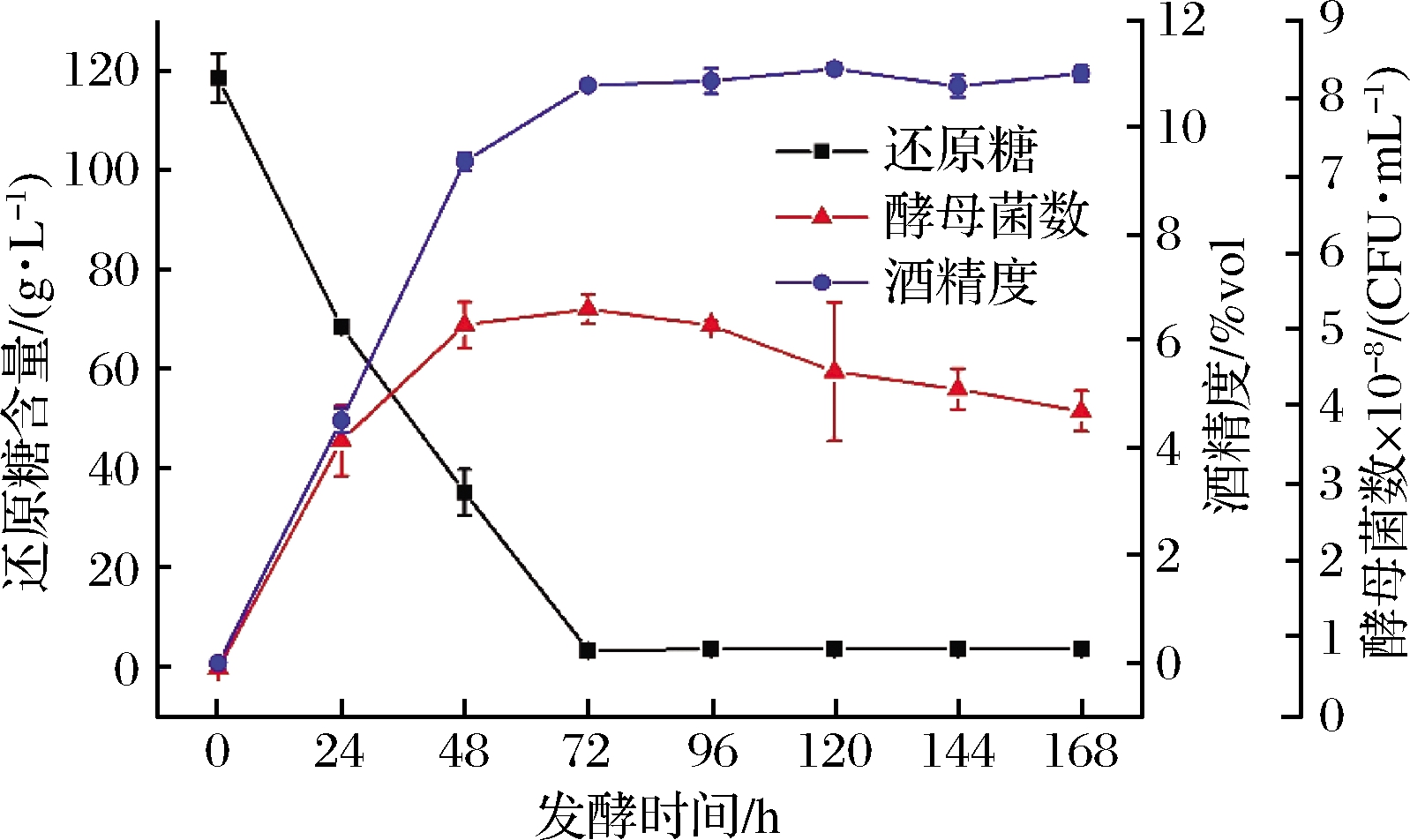
图1 菠萝蜜果酒发酵过程中酵母菌数、还原糖含量和酒精度变化规律
Fig.1 Changes of yeast count, reducing sugar content and alcohol content during fermentation of jackfruit wine
2.2 菠萝蜜果酒发酵动力学模型的建立
2.2.1 酵母菌体生长动力学模型
由图1可知,酿酒酵母在菠萝蜜果浆的发酵环境中96 h后进入菌体衰亡期,而在发酵0~96 h处在对数生长期和稳定期,因此本研究拟对发酵0~96 h时期的酵母菌体生长情况进行非线性拟合。Logistic、SGompertz和Boltzmann模型对酵母菌体生长情况的非线性拟合结果如表1和图2所示。由图2的拟合曲线分析可知,模型拟合下的酵母菌生长曲线在菠萝蜜果酒发酵72 h后趋于稳定,在72 h时酵母菌体数量达到最高值。从表1的拟合方程和拟合系数分析可知,3种模型均能很好地预测酵母菌体的生长状况。相比于Logistic模型(R2为0.993 59)和SGompertz模型(R2为0.992 03),Boltzmann模型的拟合系数R2为0.993 96,对酵母菌的生长情况的拟合效果最佳。因而Boltzmann模型比其他2个模型更适合对菠萝蜜果酒中酵母菌生长情况进行定量描述。
表1 酵母菌体生长的拟合方程及其拟合系数
Table 1 Fitting equation of yeast growth and its fitting coefficient

模型拟合方程R2LogisticY=5.165 67-4.545 621+(x21.234 26)4.988 980.993 59SGompertzY=5.242 87×e-e×[-0.074 6×(x-10.537 18)]0.992 03BoltzmannY=5.166 44-4.900 021+ex-18.700 17.322 230.993 96
2.2.2 乙醇产量生成动力学模型
采用Logistic、SGompertz和Boltzmann模型对菠萝蜜果酒发酵过程乙醇产量生成情况进行拟合,菠萝蜜果酒发酵过程酒精度实际值与拟合曲线如图3所示。3种模型拟合下的酒精生成曲线与图2中的酵母菌生长曲线基本同步,酵母菌在对数生长期内代谢产生酒精的增长速度迅速增加,酒精度在菠萝蜜果酒发酵72 h后趋于稳定,在72 h时酒精度达到最大值。3种模型的拟合方程和拟合系数如表2所示,Logistic、SGompertz和Boltzmann模型的拟合系数R2分别为0.997 94、0.999 05和0.999,SGompertz和Boltzmann模型的R2比Logistic模型的R2值更趋近于1.0,说明SGompertz和Boltzmann模型均能较好地描述菠萝蜜果酒发酵过程乙醇的动态增长过程。
表2 乙醇产量生成的拟合方程及其拟合系数
Table 2 Fitting equation of ethanol production and its fitting coefficient

模型拟合方程R2LogisticY=11.077 46-11.071 91+(x27.0717)3.125 210.997 94SGompertzY=10.977 42×e-e×[-0.073 44×(x-22.383 66)]0.999 05BoltzmannY=10.968 18-12.297 31+ex-25.131 4711.915 040.999

a-Logistic模型;b-SGompertz模型;c-Boltzmann模型
图2 发酵动力学模型下的酵母菌生长拟合曲线
Fig.2 Growth fitting curve of yeast under fermentation kinetics model

a-Logistic模型;b-SGompertz模型;c-Boltzmann模型
图3 发酵动力学模型下的乙醇产量生成拟合曲线
Fig.3 Fit curve of ethanol production under fermentation kinetics model
2.2.3 还原糖基质消耗动力学模型
Logistic、DoseResp和Boltzmann模型对还原糖含量的拟合方程、拟合系数和拟合曲线见表3和图4。由图4可知,3种模型对还原糖的拟合曲线趋势基本一致,在菠萝蜜果酒发酵的前72 h,还原糖消耗量逐渐增大,在发酵72 h后,酵母菌数和酒精度的变化趋于稳定,还原糖含量变化亦趋于稳定,这也表明菠萝蜜果酒主发酵的结束。由表3可知,3种模型对于还原糖基质的消耗拟合效果相较于酵母菌数和酒精度的较差,Logistic、DoseResp和Boltzmann模型的拟合系数R2分别为0.978 46、0.987 05和0.987 05,DoseResp和Boltzmann模型的拟合系数一致,均高于Logistic模型,说明2种模型均能较好地反映菠萝蜜果酒发酵过程还原糖消耗的变化。
表3 还原糖基质消耗的拟合方程及其拟合系数
Table 3 Fitting equation of reducing sugar consumption and its fitting coefficient

模型拟合方程R2Logisticy=119.823 731+(x28.854 84)2.231 99-1.647 190.978 46DoseRespy=1.973+155.354 741+10-0.023 78×(19.787 67-x)0.987 05Boltzmanny=1.973 06+155.353 761+ex-19.787 9218.265 450.987 05
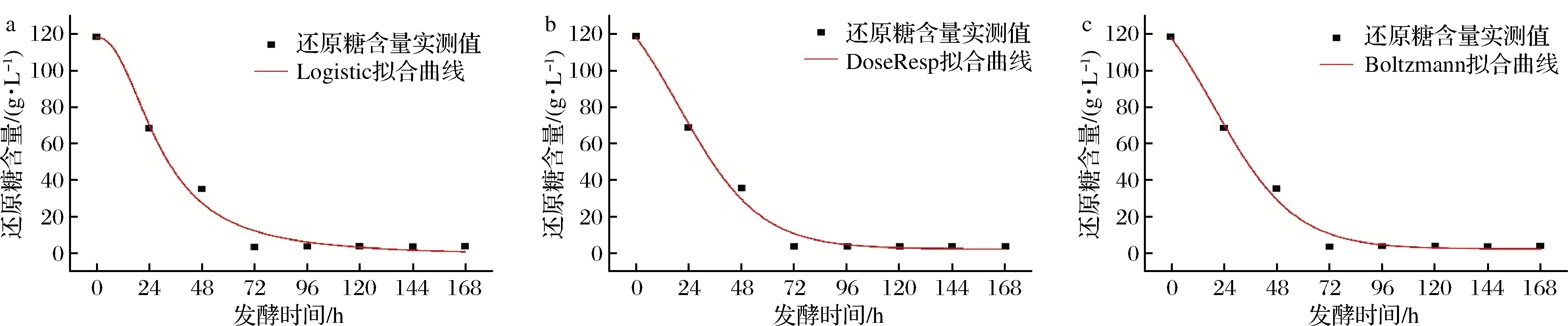
a-Logistic模型;b-DoseResp模型;c-Boltzmann模型
图4 发酵动力学模型下的还原糖基质消耗拟合曲线
Fig.4 Fit curve of reducing sugar consumption under fermentation kinetics model
在微生物的生长过程中,最活跃的时期是对数生长期,伴随营养物质的贮存和初级代谢产物的产生,微生物的发酵行为可通过数学模型被清楚地描绘[24]。李雪等[14]应用Logistic、SGompertz、DoseResp和Boltzmann模型对仙人掌果酒的酵母菌数、酒精度、还原糖量进行非线性拟合,拟合度均大于0.99。张琪等[22]采用Logistic、DoseResp、Boltzmann和SGompertz等模型对黑加仑果酒发酵过程的拟合结果均呈现较好的拟合效果。李侠等[21]同样用上述4个模型拟合红枣酒的发酵过程,分别呈现出SGompertz、Boltzmann和 DoseResp模型对酵母生长、乙醇生成、还原糖消耗的拟合度最高,研究结果与本研究的情况一致,本研究采用SGompertz、Boltzmann模型对乙醇产量生成的拟合系数能达到0.999。而实验中DoseResp和Boltzmann模型对还原糖的拟合系数只有0.98,与张琪等[25]的研究情况一致,可能是由于酿酒酵母生长繁殖旺盛,在72 h时已将还原糖几乎消耗完全,实验值低于拟合模型的预测值。
3 结论
本研究采用经典的Logistic、SGompertz、Boltzmann和DoseResp发酵动力学模型对菠萝蜜果酒分批发酵过程的酵母菌体生长、还原糖基质消耗和乙醇产量生成进行非线性拟合,选用拟合系数R2对拟合模型进行可靠性评价。模型均能较好的描述菠萝蜜果酒发酵过程的动力学特征,Boltzmann模型能更好地适用于酵母菌体生长、还原糖基质消耗和乙醇产量生成的模拟。本实验的发酵动力学研究可以预测实验指标,从而为菠萝蜜果酒大型的发酵工艺控制提供理论基础。
[1] BALIGA M S, SHIVASHANKARA A R, HANIADKA R, et al.Phytochemistry, nutritional and pharmacological properties of Artocarpus heterophyllus Lam.(jackfruit):A review[J].Food Research International, 2011, 44(7):1 800-1 811.
[2] 张彦军, 王少曼, 左慧玉, 等.菠萝蜜主要功能活性成分及其研究进展[J].食品科学技术学报, 2019, 37(6):16-22.
ZHANG Y J, WANG S M, ZUO H Y, et al.Research progress on main functional component of Artocarpus heterophyllus Lam.[J].Journal of Food Science and Technology, 2019, 37(6):16-22.
[3] SWAMI S B, THAKOR N J, HALDANKAR P M, et al.Jackfruit and its many functional components as related to human health:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2012, 11(6):565-576.
[4] ZHU K X, YAO S W, ZHANG Y J, et al.Effects of in vitro saliva, gastric and intestinal digestion on the chemical properties, antioxidant activity of polysaccharide from Artocarpus heterophyllus Lam.(Jackfruit) pulp[J].Food Hydrocolloids, 2019, 87:952-959.
[5] YAO X, WU D, DONG N N, et al.Moracin C, a phenolic compound isolated from Artocarpus heterophyllus, suppresses lipopolysaccharide-activated inflammatory responses in murine Raw 264.7 macrophages[J].International Journal of Molecular Sciences, 2016, 17(8):1 199-1 213.
[6] ZHU K X, ZHANG Y J, NIE S P, et al.Physicochemical properties and in vitro antioxidant activities of polysaccharide from Artocarpus heterophyllus Lam.pulp[J].Carbohydrate Polymers, 2017, 155:354-361.
[7] 梁裕崴, 黄和, 黄君梅, 等.菠萝蜜果酒发酵菌种的选育及其性能测定[J].食品工业科技, 2019, 40(5):151-156.
LIANG Y W, HUANG H, HUANG J M, et al.Breeding and performance test of fermentation bacteria for jackfruit wine[J].Science and Technology of Food Industry, 2019, 40(5):151-156.
[8] 张玲, 张钟, 赖志聪, 等.发酵型菠萝蜜果酒加工工艺研究[J].湖北农业科学, 2011, 50(10):2 096-2 100.
ZHANG L, ZHANG Z, LAI Z C, et al.Study on processing technology of fermented jackfruit wine[J].Hubei Agricultural Sciences, 2011, 50(10):2 096-2 100.
[9] 贺书珍, 初众, 谭乐和, 等.不同酵母发酵对菠萝蜜果酒香气成分的影响[J].热带农业科学, 2017, 37(9):76-82.
HE S Z, CHU Z, TAN L H, et al.Effect of different yeast on volatile aroma compounds in jackfruit wines[J].Chinese Journal of Tropical Agriculture, 2017, 37(9):76-82.
[10] PATRA J K, SINGDEVSACHAN S K, SWAIN M R.Biochemical composition and antioxidant potential of fermented tropical fruits juices Antioxidant potential of fermented fruits juices[J].Agro Food Industry Hi-Tech, 2016, 27(4):29-33.
[11] JAGTAP U B, WAGHMARE S R, LOKHANDE V H, et al.Preparation and evaluation of antioxidant capacity of Jackfruit (Artocarpus heterophyllus Lam.) wine and its protective role against radiation induced DNA damage[J].Industrial Crops and Products, 2011, 34(3):1 595-1 601.
[12] 张佩, 陈默, 胡国元.胞内羧甲基茯苓多糖的发酵动力学[J].食品与发酵工业, 2020, 46(6):49-53.
ZHANG P, CHEN M, HU G Y.Study on fermentation kinetics of intracellular carboxymethylpachyman[J].Food and Fermentation Industries, 2020, 46(6):49-53.
[13] 靳梦楚, 李雪, 张宇翔, 等.红心火龙果果酒发酵动力学研究[J].食品科技, 2017, 42(6):106-110.
JIN M C, LI X, ZHANG Y X, et al.Fermentation kinetics of red pulp hylocereusundatus wine[J].Food Science and Technology, 2017, 42(6):106-110.
[14] 李雪, 白新鹏, 曹君, 等.仙人掌果酒发酵动力学及其抗氧化性[J].食品科学, 2017, 38(4):87-92.
LI X, BAI X P, CAO J, et al.Fermentation kinetics and antioxidant activity of cactus wine[J].Food Science, 2017, 38(4):87-92.
[15] 吴树坤, 邓杰, 范勇, 等.山葡萄酒发酵动力学及抗氧化活性研究[J].食品与发酵工业, 2018, 44(4):42-48.
WU S K, DENG J, FAN Y, et al.Fermentation kinetics and antioxidant activity of mountain Vitis amurensis wine[J].Food and Fermentation Industries, 2018, 44(4):42-48.
[16] 王荣荣, 姜兴旭, 朱静.草莓果酒发酵动力学模型研究[J].信阳师范学院学报(自然科学版), 2019, 32(4):649-653.
WANG R R, JIANG X X, ZHU J.The fermentation dynamic of strawberry wine[J].Journal of Xingyang Normal University (Natural Science Edition), 2019, 32(4):649-653.
[17] 熊亚, 李敏杰, 姜少娟.芒果酒发酵动力学模型及抗氧化性研究[J].食品工业科技, 2019, 40(19):7-12.
XIONG Y, LI M J, JIANG S J.Establishment of the dynamic model and the antioxidant activity of mango wine during fermentation[J].Science and Technology of Food Industry, 2019, 40(19):7-12.
[18] 胡永正, 李明元, 李梅, 等.桑葚果酒分批发酵动力学研究[J].食品与机械, 2016, 32(12):7-11;44.
HU Y Z, LI M Y, LI M, et al.The batch fermentation kinetics of mulberry fruit wine[J].Food & Machinery, 2016, 32(12):7-11;44.
[19] 杨泉女, 周权驹, 吴松健, 等.3,5-二硝基水杨酸法与酶法测定甜玉米还原糖和蔗糖含量的比较[J].中国农业科技导报, 2017, 19(11):125-131.
YANG Q N, ZHOU Q J, WU S J, et al.Comparison of 3,5-dinitrosalicylic acid method and enzymatic method in the determination of sugar and sucrose content in sweet corn[J].Journal of Agricultural Science and Technology, 2017, 19(11):125-131.
[20] 国家卫生和计划生育委员会. GB 5009.225—2016 食品安全国家标准 酒中乙醇浓度的测定[S].北京:中国标准出版社.2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.225—2016 Determination of ethanol concentration in national food safety standard wine[S].Beijing:China Agricultural Press, 2016.
[21] 李侠, 彭丹, 张春晖, 等.红枣酒发酵动力学研究[J].中国酿造, 2012, 31(1):190-193.
LI X, PENG D, ZHANG C H, et al.Fermentation dynamics of red data wine[J].China Brewing, 2012, 31(1):190-193.
[22] 张琪, 朱立斌, 朱丹, 等.黑加仑果酒发酵动力学研究[J].中国酿造, 2020, 39(2):125-128.
ZHANG Q, ZHU L B, ZHU D, et al.Fermentation kinetics of blackcurrant fruit wine[J].China Brewing, 2012, 31(1):190-193.
[23] 蒋新龙. 发酵工程[M].杭州:浙江大学出版社, 2011.
JIANG X L.Fermentation Engineering[M].Hangzhou:Zhejiang University Press, 2011.
[24] SIVARATHNAKUMAR S, JAYAMUTHUNAGAI J, BASKAR G, et al.Bioethanol production from woody stem Prosopis juliflora using thermo tolerant yeast Kluyveromyces marxianus and its kinetics studies[J].Bioresource Technology, 2019, 293:122 060.
[25] 张琪, 朱丹, 牛广财, 等.沙棘果酒发酵动力学及其抗氧化活性[J].食品与发酵工业, 2019, 45(15):53-58.
ZHANG Q, ZHU D, NIU G C, et al.Fermentation kinetics and antioxidant activity of sea buckthorn wine[J].Food and Fermentation Industries, 2019, 45(15):53-58.