冷冻贮藏是水产品的主要贮藏方式,但在其贮藏、运输、加工过程中经常会发生冻融循环(冷冻-解冻-冷冻)。由于分离蛋白中蛋白质已经发生变性,使分离蛋白极度不稳定,冻融循环后增加了蛋白质的氧化程度,降低了其持水性[1],使分离蛋白的品质较大程度地降低,因此提高分离蛋白的抗冻性对低值蛋白高值化有非常重要的意义。而商业抗冻剂(4.0%蔗糖、4.0%山梨醇、0.3%多聚磷酸盐)会引入较多的糖,导致蛋白甜味增加,从而影响口感,同时可能会减少适用人群。因此寻找一种不含热量又具有较高抗氧化活性新型的抗冻剂成为水产品贮藏过程中重要的问题。
魔芋多糖(konjac glucomannan,KGM)不易被机体消化吸收,不含热量并能减少和延缓葡萄糖的吸收,具有良好的乳化性、吸水性、稳定性、成膜性及凝胶形成能力,是一种良好的食品添加剂。较多研究表明,鱼蛋白水解产物是一种有效的抗冻剂,例如LIMPISOPHON等[2]研究显示,蓝鲨鱼皮水解90 min的酶解产物能有效抑制鳕鱼鱼糜的冷冻变性;DEY等[3]研究表明,斑节对虾下脚料水解产物通过抑制蛋白冷冻变性,延缓叫姑鱼鱼糜的凝胶劣化;KITTIPHATTANABAWON等[4]研究表明,水解产物可替代传统抗冻剂,并在鱼糜产品中产生较低的甜味。因此本研究把蓝点马鲛鱼分离蛋白酶解产物和魔芋精粉进行复配,以蓝点马鲛鱼分离蛋白为研究对象,与商业抗冻剂(4.0%蔗糖、4.0%山梨醇、0.3%多聚磷酸盐)进行对比,通过循环冻融对分离蛋白保水性和蛋白氧化变性程度的影响评价其抗冻效果。
1 材料与方法
1.1 实验材料
蓝点马鲛鱼(Scomberomorus niphonius),2017年10月购于上海市临港新城芦潮港海鲜市场,冰鲜运输至实验室,立刻去头、内脏和鳍,采肉后于-40 ℃冷藏备用。分离蛋白制备与漂洗鱼糜采用本课题前期研究方法制备[5]。
酶解产物溶液制备:以蓝点马鲛鱼分离蛋白为底物,碱性蛋白酶酶解2 h,风味蛋白酶酶解2 h得到蓝点马鲛鱼分离蛋白酶解液,将酶解液冷冻干燥后,用超纯水定量配制为质量浓度10、20、30、40、50、60 mg/mL的酶解产物溶液,4 ℃贮藏备用。
白魔芋粉,强森魔芋有限公司;羰基试剂盒(货号:BC1275)、总巯基试剂盒(货号:BC1375),Solarbio。
1.2 主要仪器
SAF-680T酶标分析仪,上海巴玖实业有限公司;PQ 001型台式脉冲核磁共振分析仪,上海纽迈电子科技有限公司;TA-XT Plus型质构仪,英国Stable Micro System 公司;FE20型pH计,上海梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1 质构分析
将不同添加质量分数(0.3%、0.4%、0.5%、0.6%)魔芋加入分离蛋白中,在水浴条件下进行擂溃3 min,置于密封针管中,40 ℃水浴加热20 min,然后在95 ℃水浴加热20 min,取出凝胶冷却至室温后,在4 ℃冰箱中过夜,备用。
凝胶强度:将鱼糜凝胶切成直径10 mm、高10 mm的圆柱体,在室温条件下平衡30 min,测定凝胶的硬度、弹性。
参数设置:参考马海建等[6]的方法略加修改,测前速度2 mm/s,测试速度1 mm/s,测后速度1 mm/s,下压距离50%,触发力5 g,探头型号选择P/50。
1.3.2 持水力测定
将鱼糜凝胶切成直径10 mm、高10 mm的圆柱体,质量记为m1,用双层滤纸包裹后置于50 mL离心管中,于4 ℃下冷冻离心10 min(5 000 r/min),取出凝胶质量记为m2[7],持水力按公式(1)计算:
持水力![]()
(1)
1.3.3 抗氧化分析
DPPH自由基清除率测定:参考FLOEGEL等[8]的方法稍加修改,取1 mg DPPH溶于约20 mL无水乙醇中,超声5 min后摇匀,在519 nm处测定吸光值,记为A,使A在1.2~1.3,避光备用(3.5 h内用完)。
取2 mL DPPH溶液加入5 mL棕色离心管中,加入1 mL不同浓度的酶解产物溶液,混匀后避光反应30 min,取200 μL该溶液加入96孔板中,在519 nm处测定吸光值,DPPH自由基清除率按公式(2)计算:
DPPH自由基清除率![]()
(2)
式中:A0,超纯水代替样品测定的吸光值;A1,样品测定的吸光值;A2,乙醇代替 DPPH 溶液测定的吸光值。
ABTS阳离子自由基清除率:取3 mg ABTS溶于约0.735 mL超纯水中,混匀后取0.4 mL该溶液与相同体积的K2S2O8(2.6 nmol/L)混合,反应12 h(黑暗、室温),再稀释40~50倍,直到在734 nm的吸光值为(0.7±0.02),避光备用。
取1 mL ABTS溶液加入10 μL不同浓度的酶解产物溶液,振荡混匀后避光反应6 min,在734 nm处测定吸光值,ABTS+自由基清除率按公式(3)计算:
ABTS阳离子自由基清除率![]()
(3)
式中:A1,样品测定的吸光值;A0,超纯水代替样品测定的吸光值。
1.3.4 冻融循环处理
将制备好的样品分成4组,每组包括6个1 cm×1 cm×0.5 cm、4个3 cm×3 cm×0.5 cm分离蛋白样品,在-20 ℃下进行冷冻贮藏,4 ℃解冻12 h,放回-20 ℃下进行冷冻贮藏,作为1次冻融。7 d循环1次,重复上述步骤,进行第2次、第3次冻融[1]。
1.3.5 解冻损失
参考XIA等[9]的方法,将1 cm×1 cm×0.5 cm样品在未解冻前称质量,记为m3,解冻后用滤纸吸取表面水分,称质量,记为m4,按公式(4)计算解冻损失:
解冻损失![]()
(4)
1.3.6 蒸煮损失
参考刘广娟等[10]的方法,将1 cm×1 cm×0.5 cm样品在解冻后称质量,记为m5,用聚乙烯包装袋密封后100 ℃蒸制 3 min,再冰浴2 min,4 ℃冷却10 min,擦拭表面水分称质量,记为m6,按公式(5)计算蒸煮损失:
蒸煮损失![]()
(5)
1.3.7 水分分布
参考谭明堂等[11]的方法,并稍加修改。测定条件:质子共振频率18.169 MHz,磁体强度0.43 T,磁体温度32 ℃。测量参数:T值(90°脉冲与180°脉冲之间的时间)200 s,重复采样间隔为2 000 ms,累加次数4次。得到8 000个回波,反演后得到结合水、不易流动水和自由水的相对百分含量。
1.3.8 羰基含量
利用羰基试剂盒测定肌原纤维蛋白羰基含量。
1.3.9 巯基含量
利用总巯基试剂盒测定肌原纤维蛋白巯基含量。
1.3.10 数据分析
数据由Excel、SPSS 20.0 进行分析,结果以平均值±标准偏差表示,n=3。
2 结果与分析
2.1 魔芋对分离蛋白凝胶特性的影响
不同魔芋添加量的分离蛋白凝胶特性分析结果如表1所示。分离蛋白的硬度、弹性、白度、持水力随着魔芋添加量的增加而增大。这与黄莉等[12]的研究结论一致,当魔芋添加量(质量分数,下同)在0.4%时,与添加量为0、0.3%相比,硬度、弹性、白度、持水力均具有显著性差异(P<0.05),但硬度、弹性、白度随添加量从0.4%增加0.6%不会出现显著性地增长(P>0.05)。持水力结果显示,当魔芋添加量从0.4%增加0.5%时,会显著提升分离蛋白的持水力,因此选择魔芋添加量为0.5%,使分离蛋白凝胶具有较好的凝胶特性。
表1 不同魔芋添加量的分离蛋白凝胶特性
Table 1 Gel properties of protein isolates with
different konjac additions
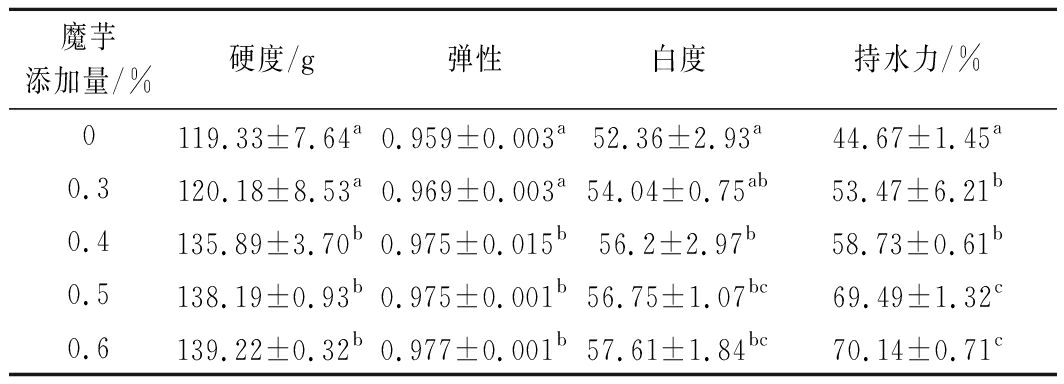
魔芋添加量/%硬度/g弹性白度持水力/%0119.33±7.64a0.959±0.003a52.36±2.93a44.67±1.45a0.3120.18±8.53a0.969±0.003a54.04±0.75ab53.47±6.21b0.4135.89±3.70b0.975±0.015b56.2±2.97b58.73±0.61b0.5138.19±0.93b0.975±0.001b56.75±1.07bc69.49±1.32c0.6139.22±0.32b0.977±0.001b57.61±1.84bc70.14±0.71c
注:同列不同字母表示有显著性差异(P<0.05)(下同)
2.2 分离蛋白酶解物的抗氧化分析
以碱性蛋白酶酶解90 min 后再采用风味蛋白酶酶解90 min的蓝点马鲛鱼分离蛋白酶解物为原料,研究不同质量浓度(10、20、30、40、50、60 mg/mL)的抗氧化能力,以DPPH自由基、ABTS阳离子自由基的清除率来表示,结果如图1所示。随酶解物浓度的增加,DPPH、ABTS阳离子自由基的清除率也呈现增加的趋势,当质量浓度从30 mg/mL增加到40 mg/mL时,DPPH自由基清除率曲线具有最大斜率,质量浓度从40 mg/mL增加到60 mg/mL时,DPPH自由基清除率增加不明显,因此选择分离蛋白酶解物质量浓度40 mg/mL作为分离蛋白抗冻剂的添加量,与0.5%魔芋复配后与商业抗冻剂进行比较,研究其抗冻效果。

图1 不同质量浓度的分离蛋白酶解物抗氧化特性
Fig.1 Antioxidant properties of different concentrations
of fish protein isolate hydrolysates
2.3 分离蛋白抗冻性研究
2.3.1 解冻损失和蒸煮损失
保水性 (water holding capacity,WHC) 是评价肉质的重要指标之一,保水性的高低会直接影响凝胶的风味、质构等[13]。本实验利用解冻损失和蒸煮损失探究不同抗冻剂在反复冻融条件下对分离蛋白保水性的影响。复配组与商业抗冻剂组的实验结果如图2、图3。

图2 反复冻融对分离蛋白解冻损失的影响
Fig.2 Effect of freeze-thaw cycles on thawing loss
of fish protein isolates
注:Y-分离蛋白;S-商业抗冻剂;E-复配组;
图中不同字母表示有显著性差异(P<0.05)下同
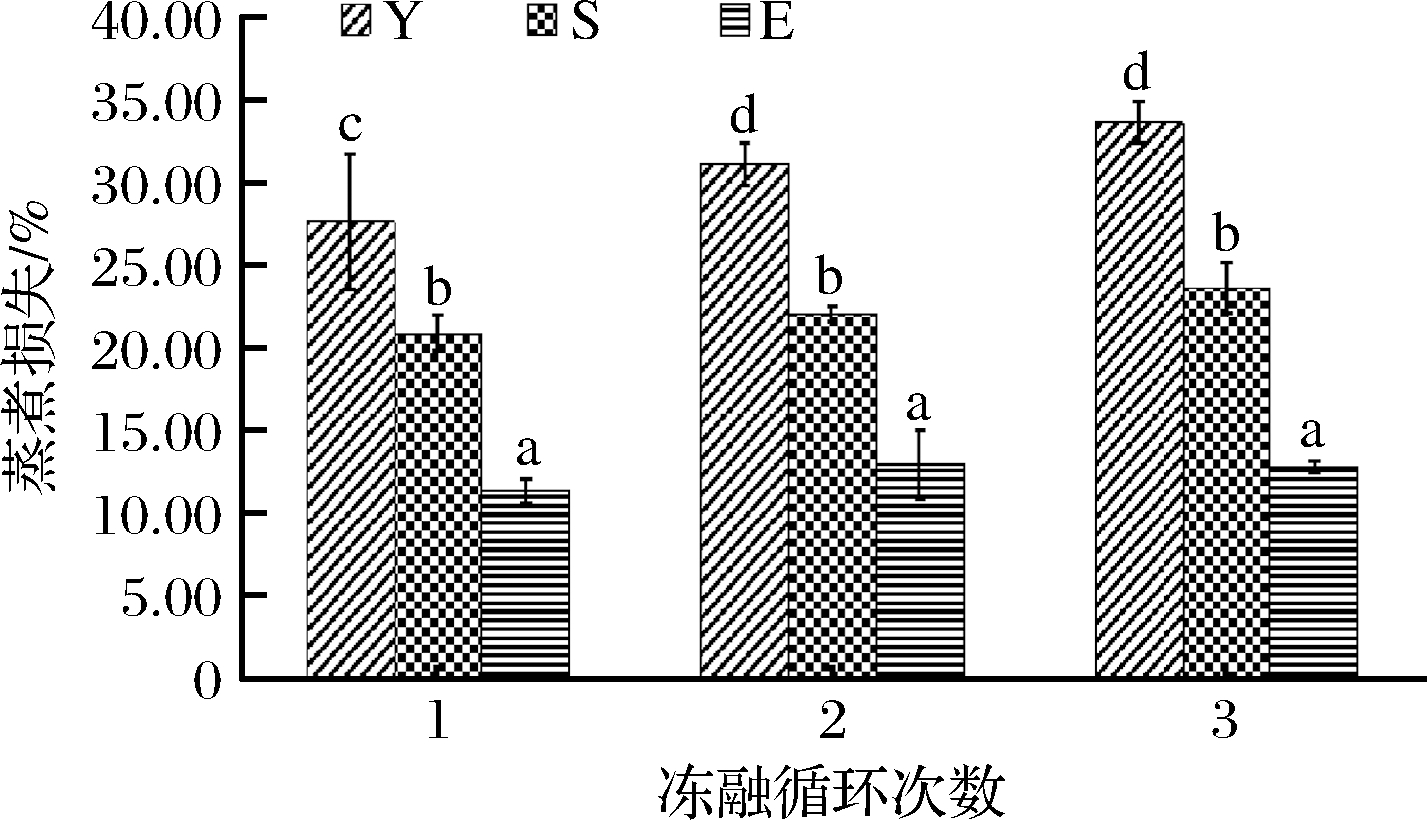
图3 反复冻融对分离蛋白蒸煮损失的影响
Fig.3 Effect of freeze-thaw cycles on cooking loss
of fish protein isolates
解冻损失结果显示,分离蛋白组随着冻融循环次数的增多,解冻损失呈现增加的趋势,且有显著性差异(P<0.05),可能是由于反复冻融,分离蛋白中冰晶的变化和脱水缩合对蛋白质天然纤维结构造成不可逆的机械损伤,影响蛋白质的复水能力,因而使分离蛋白无法更好地存留更多的自由水[14]。而复配组与商业抗冻剂组在3次冻融中,解冻损失没有显著性差异(P>0.05),由于这2种抗冻剂中带有较多的亲水基团,会抑制巨大冰晶体的形成,减少分离蛋白的开链变性,使其可吸附更多的水分[15]。
蒸煮损失结果与解冻损失一致,复配组与商业抗冻剂组在3次冻融中蒸煮损失没有显著性差异(P>0.05),3组实验中,蒸煮损失率由高到低依次为分离蛋白>商业抗冻剂>复配组,且每组之间有显著性差异(P<0.05),蒸煮损失越大,说明该组凝胶中含水量越小,直接影响分离蛋白凝胶后的质构特性[16]。虽然商业抗冻剂的解冻损失与分离蛋白在第2、3次冻融后无显著差异,但其蒸煮损失低于分离蛋白组,且有显著差异(P<0.05),可能是由于分离蛋白组在解冻过程中空间结构变化较大,从而导致蒸煮后肌肉持水力降低[17]。综上,在反复冻融条件下,复配组具有更好的保水性。
2.3.2 水分分布
核磁共振(nuclear magnetic resonance,NMR)的横向弛豫时间T2可应用于检测肉类的水分分布及状态,且T2时间越小,说明水分与底物结合越紧密,即水分向低自由度迁移[18]。T21 (0.01~10 ms) 代表与蛋白质等大分子紧密结合的结合水, T22 (10~10 ms) 为存在于肌原纤维及膜之间的不易流动水。T23 (100~1 000 ms)代表存在于细胞外或肌原纤维外易流动的自由水[19]。T2反演谱中T21、T22、T23各峰面积占总峰面积的比例分别代表结合水、不易流动水、自由水的相对含量。
如表2所示,分离蛋白组T21、T22随着冻融次数的增加而减少,其中不同冻融次数的T22有显著性差异(P<0.05),但T23随冻融次数的增加而增加,且有显著性差异(P<0.05)。说明随着冻融次数的增加,分离蛋白与自由水之间的结合程度下降。可能因为冻融过程中,冰晶的变化使蛋白质空间结构改变,降低其吸附水的能力[20],这与保水性实验结果一致。
表2 冻融循环对分离蛋白T2弛豫时间的影响
Table 2 Effect of freeze-thaw cycles on T2 relaxation
time of fish protein isolates
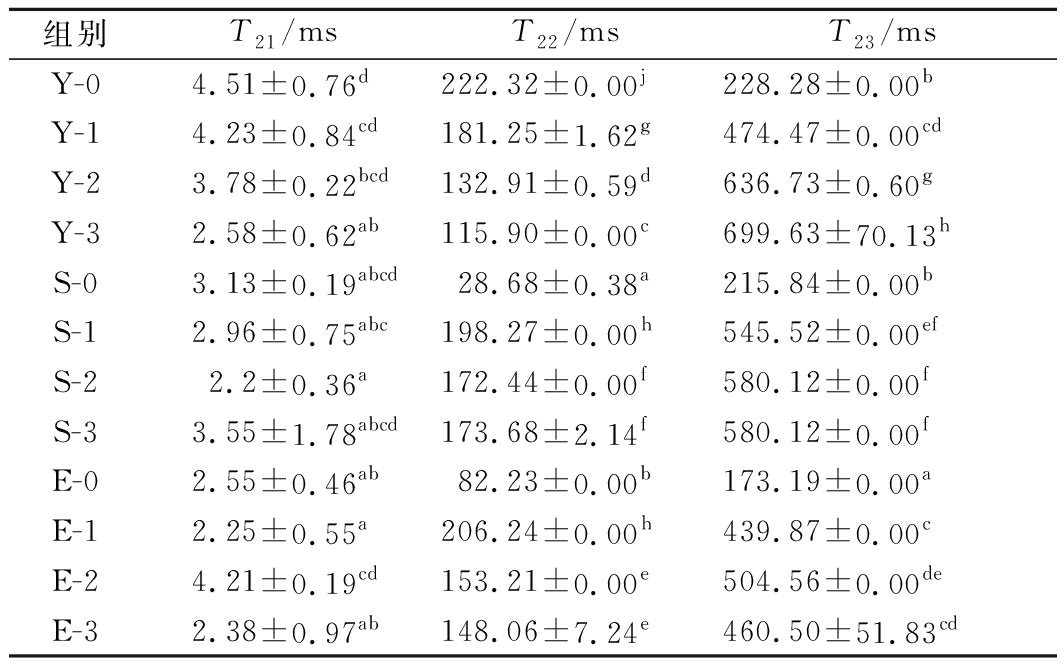
组别T21/msT22/msT23/msY-04.51±0.76d222.32±0.00j228.28±0.00bY-14.23±0.84cd181.25±1.62g474.47±0.00cdY-23.78±0.22bcd132.91±0.59d636.73±0.60gY-32.58±0.62ab115.90 ±0.00c699.63±70.13hS-03.13±0.19abcd28.68±0.38a215.84±0.00bS-12.96±0.75abc198.27±0.00h545.52±0.00efS-22.2 ±0.36a172.44±0.00f580.12±0.00fS-33.55±1.78abcd173.68±2.14f580.12±0.00fE-02.55±0.46ab82.23±0.00b173.19±0.00aE-12.25±0.55a206.24±0.00h439.87±0.00cE-24.21±0.19cd153.21±0.00e504.56±0.00deE-32.38±0.97ab148.06±7.24e460.50±51.83cd
注: Y-1、Y-2、Y-3分别代表分离蛋白1次冻融、2次冻融、3次冻融,S、E同Y(下同)
T22结果显示,与分离蛋白相比加入抗冻剂后显著降低,说明2种抗冻剂够有效降低不易流动水的流动性,向结合水迁移,并在冻融1次后达到稳定状态,导致在2次、3次冻融后变化不显著,有效防止不易流动水的变化。商业抗冻剂与复配组结果均显示,T23在1次冻融后增加程度较高,说明在1次冻融后自由水流动性增强,会造成解冻损失增加。2次冻融后,商业抗冻剂组和复配组中T23变化较小,始终小于分离蛋白组,说明1次冻融对分离蛋白影响较大,2种抗冻剂均能够不同程度抑制分离蛋白二级、三级结构的冷冻变性,从而减少水分分布的改变。综上,商业抗冻剂和复配组能在稳定结合水、自由水的同时,减少不易流动水的流动性,具有较好的保水性。
T2反演谱中结合水、不易流动水、自由水的相对含量如表3所示,随着冻融次数的增加,自由水的相对含量均显示出增长的趋势,而结合水相对含量未出现显著性差异,因此可得冻融循环会使分离蛋白中不易流动水变为自由水,从而含量减少。在经过3次冻融循环后,分离蛋白组、商业抗冻剂组、复配组自由水含量分别是初始分离蛋白自由水含量的18.04、17.88、11.79倍,自由水易流失,可能造成解冻损失分离蛋白组>商业抗冻剂组>复配组的趋势,由此可知,复配组能够有效提高分离蛋白在冻融循环条件下的保水性。
表3 反复冻融对分离蛋白水分分布的影响
Table 3 Effect of freeze-thaw cycles on of fish protein
isolates moisture-distribution
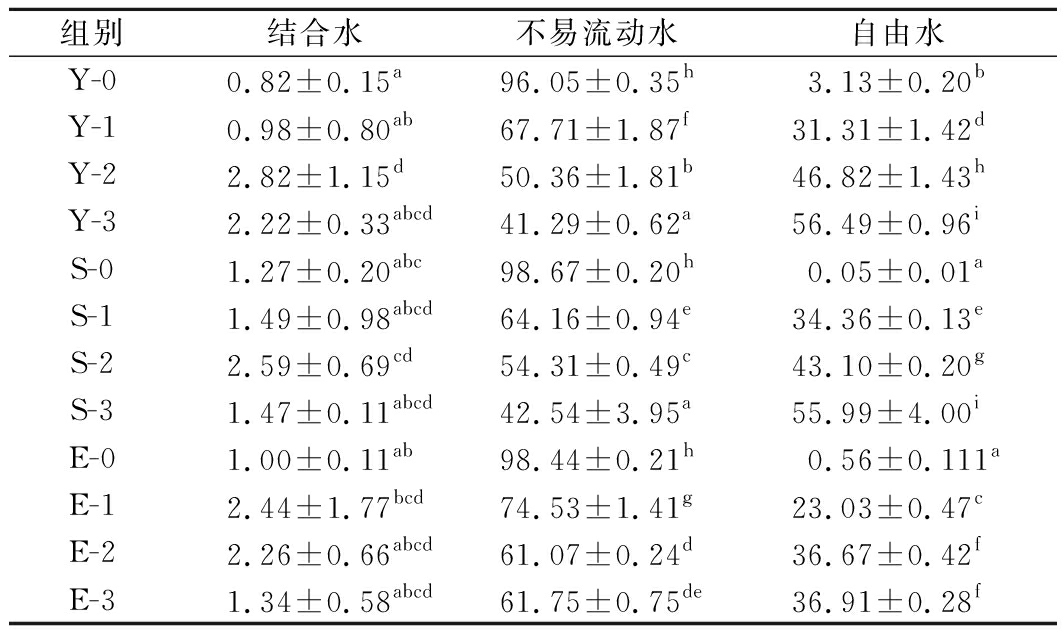
组别结合水不易流动水自由水Y-00.82±0.15a96.05±0.35h3.13±0.20bY-10.98±0.80ab67.71±1.87f31.31±1.42dY-22.82±1.15d50.36±1.81b46.82±1.43hY-32.22±0.33abcd41.29±0.62a56.49±0.96iS-01.27±0.20abc98.67±0.20h0.05±0.01aS-11.49±0.98abcd64.16±0.94e34.36±0.13eS-22.59±0.69cd54.31±0.49c43.10±0.20gS-31.47±0.11abcd42.54±3.95a55.99±4.00iE-01.00±0.11ab98.44±0.21h0.56±0.111aE-12.44±1.77bcd74.53±1.41g23.03±0.47cE-22.26±0.66abcd61.07±0.24d36.67±0.42fE-31.34±0.58abcd61.75±0.75de36.91±0.28f
2.3.3 羰基含量
蛋白质羰基多由蛋白质分子受到自由基氧化修饰产生[21],例如蛋白质一级结构氨基酸分子受到活自由基攻击氧化生成[22]、蛋白质肽链断裂产生等[23]。因此,可用羰基含量量化蛋白质氧化变性的程度。
如图4所示,随着冻融循环次数的增加,各组中羰基含量呈现增高的趋势,且有显著性差异(P<0.05),说明反复冻融会造成蛋白质羰基含量的增高,即造成蛋白质氧化变性程度逐渐变大。1次冻融后,商业抗冻剂组与复配组的羰基含量均小于未冻融组的羰基含量,可能由于冻融前分离蛋白直接暴露于空气中且温度较高,造成蛋白氧化迅速从而导致羰基含量增加,而冻融过程在低温条件下进行,可能在一定程度上减缓蛋白质的氧化变性,另一方面可能是由于抗冻剂中的抗氧化成分逐渐发挥作用,也会抑制蛋白质的氧化变性。相同冻融条件下,商业抗冻剂组的羰基含量始终小于分离蛋白组,说明商业抗冻剂也可减缓蛋白质的氧化变性,可能是通过抑制蛋白质开链变性,减少氨基酸的暴露,从而降低氨基酸接触自由基的几率[24]。在3次冻融后复配组的羰基含量最低,且与未冻融组、2次冻融后的商业抗冻剂组均无显著性差异(P>0.05),可能由于酶解产物具有较强的清除自由基的作用,通过抑制自由基的产生抑制蛋白质的氧化。由此可得,复配组抑制蛋白质氧化变性的能力强于商业抗冻剂组。

图4 反复冻融对分离蛋白羰基含量的影响
Fig.4 Effect of freeze-thaw cycles on carbonyl content
of fish protein isolates
2.3.4 巯基含量
巯基(—SH)活性较强,参与维持蛋白质空间结构,但易被氧化为二硫键(—S—S—),改变蛋白质的空间结构,巯基含量相应减少[25]。因此巯基含量的变化也可评价蛋白质的氧化变性程度。
如图5所示,随着冻融循环次数的增加,分离蛋白组中巯基含量呈现降低的趋势,且有显著性差异(P<0.05),说明蛋白质氧化变性程度逐渐变大,可能由于巯基被氧化为二硫键造成蛋白质空间结构改变,也可能发生了使蛋白质巯基含量减少的蛋白质聚集。商业抗冻剂组1~3次冻融后巯基含量无显著性差异,说明商业抗冻剂能够在一定程度上稳定蛋白质的空间结构,可能是由于多聚磷酸盐的添加使其远离等电点并带有同种电荷,以及多烃基化合物与蛋白质发生反应,能够在一定程度上避免蛋白质的聚集[26]。复配组的巯基含量第2次冻融后才出现显著性降低,且巯基含量高于商业抗冻剂组,说明其维持蛋白质空间结构和抑制巯基氧化程度强于商业抗冻剂组,可能是由于复配组中有高浓度带负电荷的谷氨酸和天冬氨酸,可与蛋白质形成复合物使之带有许多负电荷,避免蛋白质聚集[27],同时酶解产物具有较强的抗氧化能力,能够在一定程度上抑制蛋白质巯基的氧化,从而抑制蛋白质氧化变性。这与羰基研究结果一致,说明复配组能够更好地抑制蛋白质氧化变性。
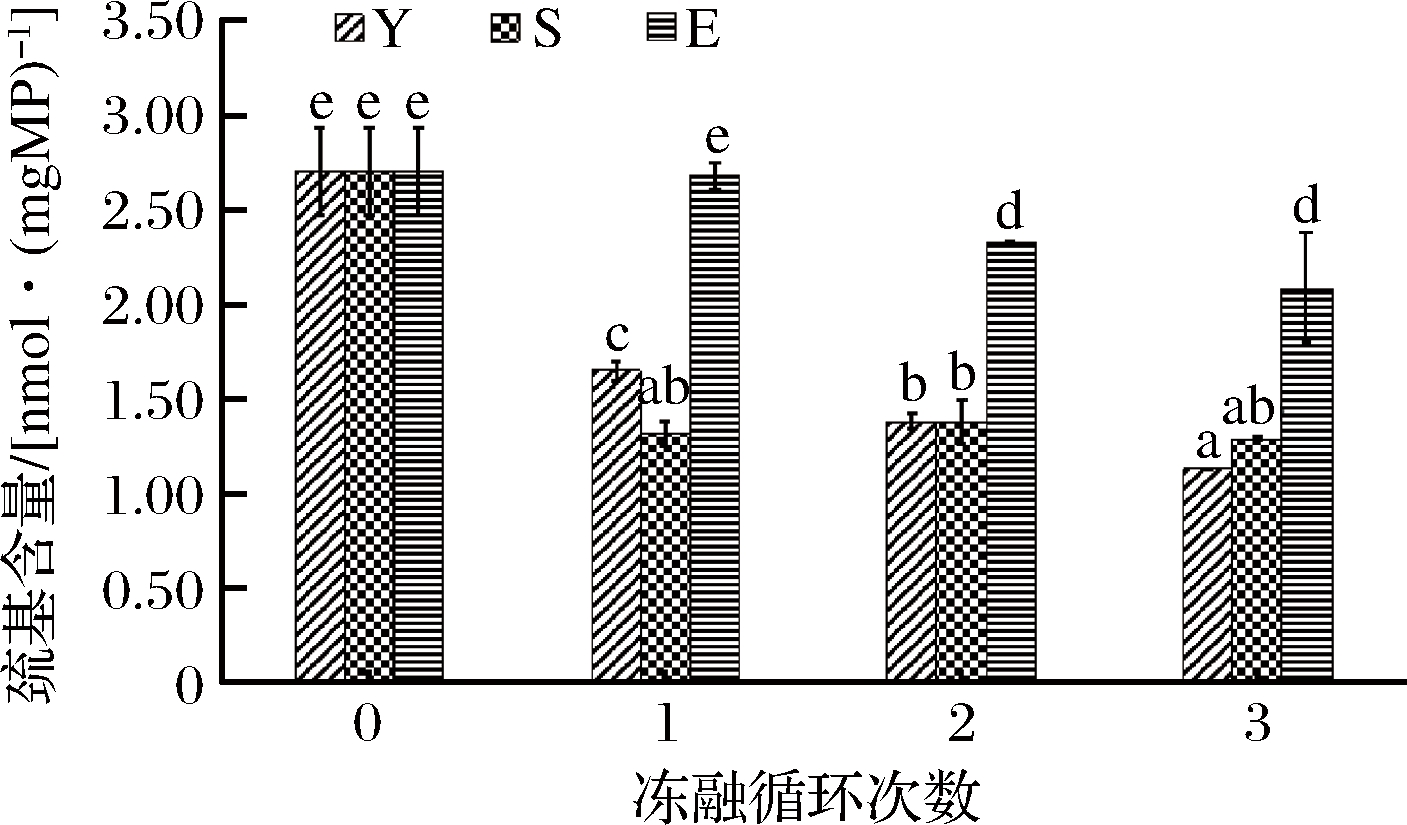
图5 反复冻融对分离蛋白巯基含量的影响
Fig.5 Effect of freeze-thaw cycles on sulfhydry
groups content of fish protein isolates
3 结论
综上,随着冻融次数的增加,自由水的含量、解冻损失、蒸煮损失都呈现增加的趋势,但复配组比商业抗冻剂组能够更好地减缓这种趋势,尤其是复配组能够使解冻损失、蒸煮损失分别降低到4.0%、13%以下,同时也降低样品中不易流动水向自由水的转换,有效提高分离蛋白的保水性,其抗冻机理一方面可能是酶解产物含有大量的亲水性氨基酸,能够与水作用形成氢键,增强冻融循环中水的稳定性,通过有效减少巨大冰晶的形成,阻止蛋白质开链变性。另一方面可能是由于KGM与肌球蛋白间形成新的氢键,从而形成稳定而致密的网状结构,增加分离蛋白的抗冻性。羰基、巯基研究结果显示,复配组能够有效抑制分离蛋白在冻融循环下的氧化变性,可能由于酶解产物具有较高的抗氧化活性,可有效延缓分离蛋白空间结构改变,提高分离蛋白保水性和抗冻特性。因此可将4.0%蓝点马鲛鱼分离蛋白酶解产物和0.5%魔芋复配作为蓝点马鲛鱼分离蛋白的抗冻剂,同时符合低甜度、低热量的消费趋势。但酶解产物添加后对分离蛋白风味特性的影响并未研究,且较多酶解产物都会呈现明显的苦味,因此需进一步优化酶解工艺,减少不必要味道的产生。
[1] 常通.酸碱法提取鳙鱼蛋白及鱼糜凝胶品质的研究[D].武汉:华中农业大学,2014.
CHANG T.Extraction of bighead carp muscle proteins and surimi gel quality by pH-shift processing[D].Wuhan:Huazhong Agricultural University,2014.
[2] LIMPISOPHON K,IGUCHI H,TANAKA M,et al.Cryoprotective effect of gelatin hydrolysate from shark skin on denaturation of frozen surimi compared with that from bovine skin[J].Fisheries Science,2015,81(2):383-392.
[3] DEY S S,DORA K C,RAYCHAUDHURI U,et al.Cryoprotective effect of shrimp waste protein hydrolysate on croaker surimi protein and gel characteristics during frozen storage[J].Fishery Technology,2013,50:50-59.
[4] KITTIPHATTANABAWON P,BENJAKUL S,VISESSANGUAN W,et al.Cryoprotective effect of gelatin hydrolysate from blacktip shark skin on surimi subjected to different freeze-thaw cycles[J].LWT-Food Science and Technology,2012,47(2):437-442.
[5] 樊震宇,张龙,袁凯,等.蓝点马鲛鱼(Scomberomorus niphonius)分离蛋白的气味特性[J].食品与发酵工业,2019,45(3):206-214.
FAN Z Y,ZHANG L,YUAN K,et al.Research on flavor characteristics of Scomberomorus niphonius fish protein isolates[J].Food and Fermentation Industries,2019,45(3):206-214.
[6] 马海建,施文正,汪之和.响应面试验优化超高压制备马铃薯淀粉草鱼鱼糜制品工艺[J].食品科学,2016,37(24):8-15.
MA H J,SHI W Z,WANG Z H,et al.Ptimization of production of grass carp surimi with added potato starch by ultra-high pressure processing using response surface analysis[J].Food Science,2016,37(24):8-15.
[7] 付璐璐,黄建联,赵建新,等.葡萄糖氧化酶对金线鱼鱼糜凝胶特性的影响[J].中国食品学报,2016,16(8):59-64.
FU L L,HUANG J L,ZHAO J X,et al.The effect of glucose oxidase on gel characteristic of the threadfin bream surimi[J].Journal of Chinese Institute of Food Science and Technology,2016,16(8):59-64.
[8] FLOEGEL A,KIM D O,CHUNG S J,et al.Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods[J].Journal of Food Composition & Analysis,2011,24(7):1 043-1 048.
[9] XIA X,KONG B,LIU Q,et al.Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J].Meat Science,2009,83(2):239-245.
[10] 刘广娟,徐泽权,邢世均,等.卡拉胶、转谷氨酰胺酶及大豆分离蛋白对猪PSE肉低温香肠保水性和感官品质的影响[J].肉类研究,2019,33(3):34-39.
LIU G J,XU Z Q,XING S J,et al.Effects of carrageenan,transglutaminase and soybean protein isolate on water-holding capacity and sensory quality of low-temperature sausage made from PSE pork[J].Meat Research,2019,33(3):34-39.
[11] 谭明堂,谢晶,王金锋.不同冻结方式对鱿鱼品质的影响[J].食品与发酵工业,2019,45(11):136-142.
TAN M T,XIE J,WANG J F.Influences of different freezing methods on the quality of squids[J].Food and Fermentation Industries,2019,45(11):136-142.
[12] 黄莉,吕鸿皓,董福家,等.骨蛋白水解物和魔芋复配对冷冻鱼糜抗冻效果的研究[J].食品工业科技,2014,35(22):139-144.
HUANG L,LV H H,DONG F J,et al.Study on properties of boneprotein hydrolyzate and konjac and their applications as antifreeze in frozen carp surimi[J].Science and Technology of Food Industry,2014,35(22):139-144.
[13] 张丹,孙金辉,王晓香,等.反复冻融对兔背最长肌肉品质特性和微观结构的影响[J].食品科学,2014,35(7):38-42.
ZHANG D,SUN J H,WANG X X,et al.Effects of freeze-thaw cycle on the quality properties and microstructure of rabbit muscle[J].Food Science,2014,35(7):38-42.
[14] ALEX P,HANS Z.Preservation mechanisms of trehalose in food and biosystems[J].Colloids and Surfaces B:Biointerfaces,2004,40(2):107-113.
[15] 杨贤庆,袁悦,赵永强,等.冷冻鱼糜绿色抗冻剂的研究进展[J].上海海洋大学学报,2018,27(5):789-796.
YANG X Q,YUAN Y,ZHAO Y Q,et al.Progress on green cryoprotectants for frozen surimi[J].Journal of Shanghai Ocean University,2018,27(5):789-796.
[16] 井月欣,赵云苹,张金浩,等.冻融循环对大菱鲆不同部位肌肉品质的影响[J].食品科学,2018,39(21):266-272.
JING Y X,ZHAO Y P,ZHANG J H,et al.Effect of freeze-thaw cycles on the quality of muscles from different parts of Scophthalmus maximus[J].Food Science,2018,39(21):266-272.
[17] 余力,贺稚非,ENKHMAA B,等.不同解冻方式对伊拉兔肉品质特性的影响[J].食品科学,2015,36(14):258-264.
YU L,HE Z F,ENKHMAA B,et al.Effects of different thawing methods on quality characteristics of hyla rabbit meat[J].Food Science,2015,36(14):258-264.
[18] MANTLE M D,SEDERMAN A J.Dynamic MRI in chemical process and reaction engineering[J].Progress in Nuclear Magnetic Resonance Spectroscopy,2003,43(1-2):3-60.
[19] HAN M Y,WANG P,XU X L,et al.Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J].Food Research International,2014,62:1 175-1 182.
[20] 石芳,廖霞,李福香,等.基于低场核磁共振技术研究冻融过程中松茸品质的变化[J].食品与发酵工业,2018,44(7):89-95.
SHI F,LIAO X,LI F X,et al.Quality changes of tricholoma matsutake during freeze-thaw cycles by low-field nuclear magnetic resonance[J].Food and Fermentation Industries,2018,44(7):89-95.
[21] STADTMAN R E.Oxidation of free amino acids and amino acid residues in proteins by radiolysis and by metal-catalyzed reactions[J].Annual Review of Biochemistry,1993,62(1):797-821.
[22] 李向红,李敏,刘永乐,等.鲢鱼加工副产物酶解产物对冻融鱼糜肌原纤维蛋白性质的影响[J].中国食品学报,2018,18(3):59-66.
LI X H,LI M,LIU Y L,et al.Effects of hydrolysates from silver carp processing by-products on properties of myofibrillar protein in freeze-thawed surimi[J].Journal of Chinese Institute of Food Science and Technology,2018,18(3):59-66.
[23] 赵冰,张顺亮,李素,等.脂肪氧化对肌原纤维蛋白氧化及其结构和功能性质的影响[J].食品科学,2018,39(5):40-46
ZHAO B,ZHANG S L,LI S,et al.Effect of lipid oxidation on myofibrillar protein oxidation,structure and functional characteristics[J].Food Science,2018,39(5):40-46.
[24] MEHDI N,SOOTTAWAT B.Potential application of seafood-derived peptides as bifunctional ingredients,antioxidant-cryoprotectant:A review[J].Journal of Functional Foods,2015,19:753-764.
[25] CHENG I W Y,LICEAGA A M,EUNICE C Y L.Pacific hake (Merluccius productus) hydrolysates as cryoprotective agents in frozen pacific cod fillet mince[J].Journal of Food Science,2010,74(8):C588-C594.
[26] CAMPO-DEANO L,TOVAR C A,POMBO M J,et al.Rheological study of giant squid surimi (Dosidicus gigas) made by two methods with different cryoprotectants added[J].Journal of Food Engineering,2009,94(1):26-33.
[27] JENKELUNASE P J,LICHAN E.Production and assessment of Pacific hake (Merluccius productus) hydrolysates as cryoprotectants for frozen fish mince.[J].Food Chemistry,2018,239:535.