呼吸道感染仍然是全球关注的健康问题,具有多发性且易反复,临床多采用抗生素治疗。但是抗生素的使用可能会导致呼吸道菌群丰度和多样性的下降,从而增加致病菌定植的危险[1],同时致使各种耐药菌不断出现,为临床感染治疗带来极大的挑战。而“细菌疗法”可以为预防或治疗细菌感染提供一种有效的替代抗生素的方法。“细菌疗法”是指通过使用益生菌干扰病原体的一种新的治疗手段[2]。益生菌是一类摄入适当剂量后对宿主健康有益的“活的微生物”的总称,被广泛应用于食品、畜牧等领域[3-4]。益生菌通常可分3大类:乳杆菌类、双歧杆菌类、革兰氏阳性球菌类。益生菌的作用机制主要是通过分泌抗菌物质、营养竞争、形成益生菌膜等干扰或抑制病原菌的生长[5]。益生菌作为抗生素的有效替代品,有助于重建菌群平衡,同时防止或减少致病菌的黏附和定植机会[6]。大量研究结果表明,益生菌在调节人体微生态平衡、治疗肠道疾病[7]、预防过敏性疾病[8]等多个方面发挥重要作用。目前,对肠道益生菌产品的研究最广泛[9],对呼吸道益生菌的开发和利用尚不足。因此,有学者提出筛选健康人群口咽部正常菌群中的优势菌作为研究呼吸道益生菌的候选菌株[10]。甲型链球菌如唾液链球菌、缓征链球菌、口腔链球菌等是定植在人体上呼吸道的正常菌群,在健康儿童口咽部菌群中占主导地位[11-12]。研究表明,甲型链球菌在体内外对致病菌具有明显的拮抗作用[13]。BIDOSSI等[14]发现唾液链球菌 24SMB和口腔链球菌 89A具有抑制所选病原体的生物膜形成的能力。王冲等[15]通过小鼠模型证实甲型链球菌能抑制病原菌在黏膜上皮细胞定植,保护小鼠呼吸道的菌群平衡。ROOS等[16]用甲型链球菌协同抗生素治疗咽炎和中耳炎,可以有效的降低复发率。这些研究都表明甲型链球菌作为呼吸道的优势菌群,在维护上呼吸道菌群平衡,防治呼吸道感染等方面具有重要作用。
甲型链球菌作为良好呼吸道益生菌的候选菌株,其安全性也是关注的热点。但是目前国内外对于链球菌的安全性评价没有统一标准和方法,目前相关性研究都是从耐药性、毒力基因和动物实验等方面进行评价的。本课题组在健康儿童口咽部通过分离筛选得到了2株对金黄色葡萄球菌等多种致病菌具有拮抗作用的甲型链球菌,通过急性毒性实验,细菌移位能力评价及抗生素敏感性检测,对2株益生菌进行体内外安全性初步评价,以期为人源性呼吸道益生菌制剂的开发提供基础研究依据。
1 材料与方法
1.1 实验菌株与动物
实验菌株1-4和4-2均为通过健康儿童口咽部菌群分离筛选后得到的具有广谱拮抗作用的菌株。
动物为SPF级昆明种小鼠(雌雄各半),由辽宁省长生生物技术股份有限公司提供。生产许可证号:SCXK(辽)2 015-0001。本研究严格遵守沈阳医学院动物护理与实验伦理委员会审查和批准的要求进行,动物伦理实验编号为2015052902。
1.2 实验方法
1.2.1 菌株处理
将菌株接种于含有5%脱纤维羊血的BHI营养琼脂平板上,37 ℃条件下培养24 h对其进行平板菌落计数。无菌条件下,刮取菌落溶于无菌生理盐水中,配制菌体浓度为1×108、1×109、1×1010 CFU/mL,制备为低、中、高剂量的口服菌悬液,用于急性毒性实验。
1.2.2 动物分组与饲养
SPF级昆明种小鼠,体重为(20±2) g,适应性饲养7 d后,按照随机分组原则分为7组,每组雌雄各5只,分别为生理盐水对照组,菌株1-4高剂量组,菌株1-4中剂量组,菌株1-4低剂量组,菌株4-2高剂量组,菌株4-2中剂量组,菌株4-2低剂量组。实验期间小鼠同室分笼喂养,自由采光和饮水。
1.2.3 急性毒性实验
本实验参照GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》和《保健食品检验与评价技术规范2003版》的要求进行操作。适应饲养结束后,实验组小鼠给予口服相应浓度的菌悬液处理,对照组小鼠给予生理盐水口服处理,剂量为2 mL,口服1次。7 d内连续观察小鼠的活动状态,毒性迹象以及死亡情况,每天对小鼠的体重和采食量进行称重记录。结束后称重并用颈椎脱臼法处死小鼠,进行解剖检查,计算心、肝、脾、肺、肾的脏器指数。
1.2.4 细菌移位实验
无菌操作取小鼠心、肝、脾、肺、肾脏器的组织各1 g匀浆,用无菌L棒涂布于含有5%脱纤维羊血的BHI琼脂平板上,37 ℃倒置培养24 h后,观察是否出现特征菌落。
1.2.5 耐药性检测
选取10种常见的抗生素药敏纸片包括万古霉素、利奈唑胺、氨苄西林、红霉素、青霉素、氯霉素、克林霉素、头孢噻肟、头孢曲松。采用药敏纸片扩散法进行药敏实验。配制0.5麦氏的菌悬液,取100 μL的菌悬液涂布于MH固体培养基待完全吸收后,将药敏纸片放在培养基上,静置15 min后,放入细菌培养箱37 ℃倒置培养24 h后,测量并记录抑菌圈直径。
1.3 数据处理
实验数据采用均数±标准差![]() 表示,使用Graphpad Prism 7进行绘图,使用SPSS 20.0软件对数据统计,不同组间比较采用单因素方差分析进行差异显著性分析。显著性水平为P<0.05。
表示,使用Graphpad Prism 7进行绘图,使用SPSS 20.0软件对数据统计,不同组间比较采用单因素方差分析进行差异显著性分析。显著性水平为P<0.05。
2 结果与分析
2.1 急性毒性实验
2.1.1 小鼠体重和采食量
不同菌株口服急性毒性实验期间,未出现小鼠死亡情况,小鼠皮毛、饮水、躯体活动和行为模式均表现正常,未发现急性中毒体征和相关的毒性反应。体重和采食量急性毒性实验中重要的判断指标。实验过程中,菌株1-4和4-2不同剂量组小鼠的体重增长趋势正常(图1和图2),与对照组无显著性差异(P>0.05)。
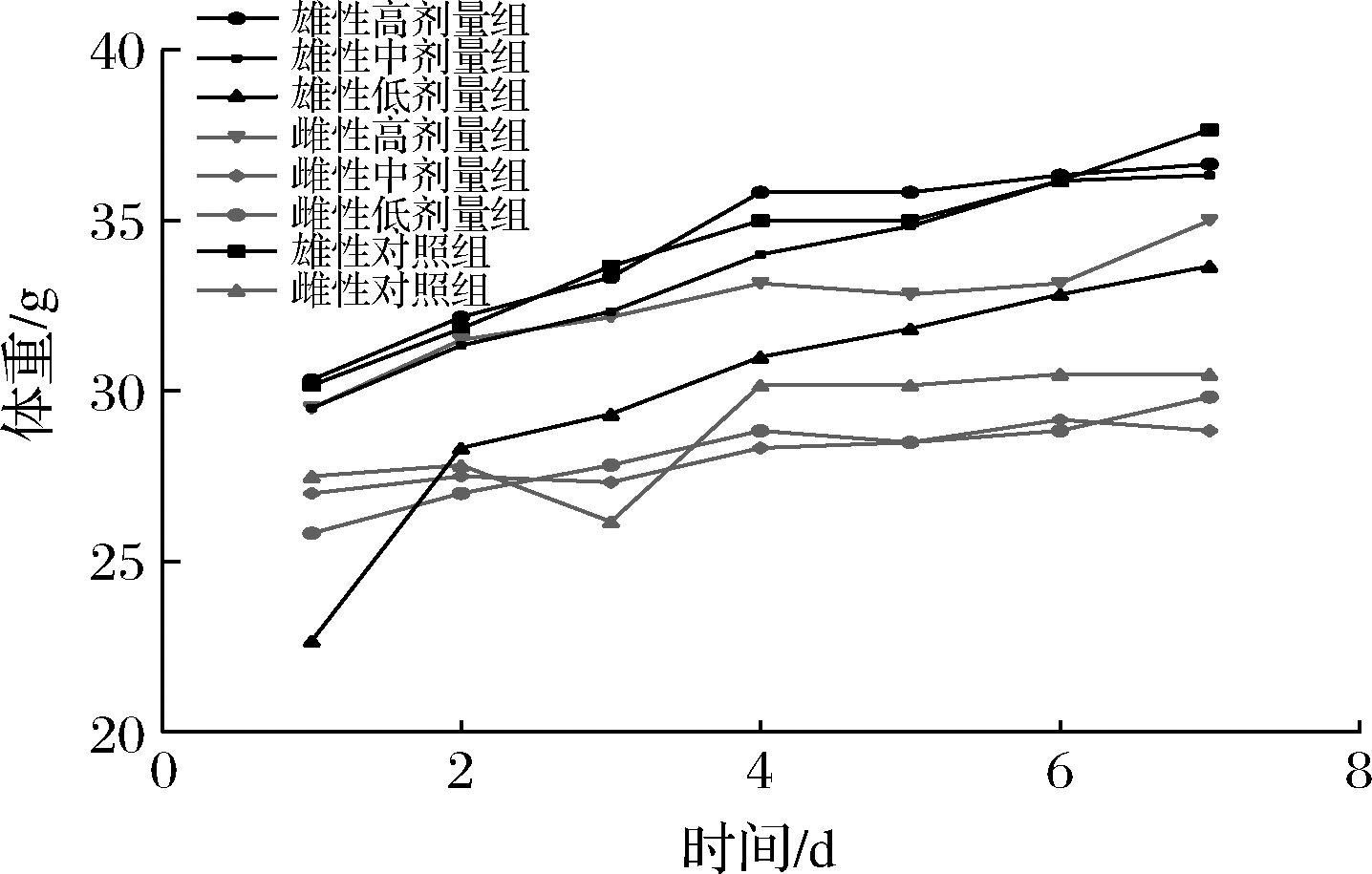
图1 菌株1-4小鼠体重增长趋势
Fig.1 Changes in body weight of strains 1-4 in mice
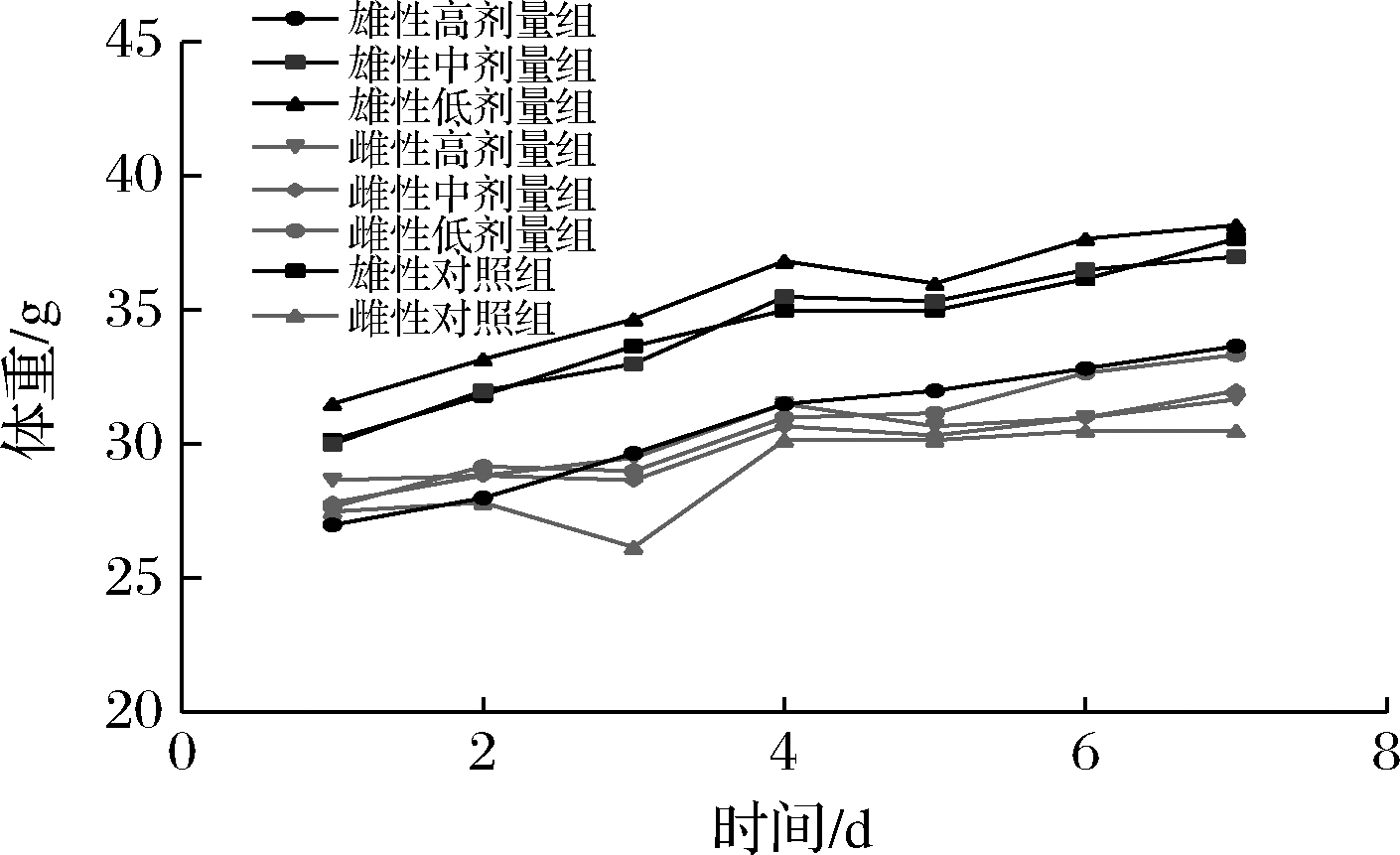
图2 菌株4-2小鼠体重增长趋势
Fig.2 Changes in body weight of strains 4-2 in mice
对给予口服菌株1-4和4-2处理后7 d内小鼠的平均采食量进行统计分析,结果如表1所示。菌株1-4和4-2口服对雄性小鼠的采食量无影响(F=0.903,P=0.454;F=0.283,P=0.599),口服菌株1-4和4-2的雌性小鼠7 d内的平均采食量较对照组相比有不同程度的降低,但与对照组相比无显著统计学差异(F=0.56,P=0.457,F=0.781,P=0.068)。实验表明口服菌株1-4和4-2对小鼠的体重和进食量没有影响。
表1 给药后各组小鼠采食量
Table 1 Feed intake of each group after administration
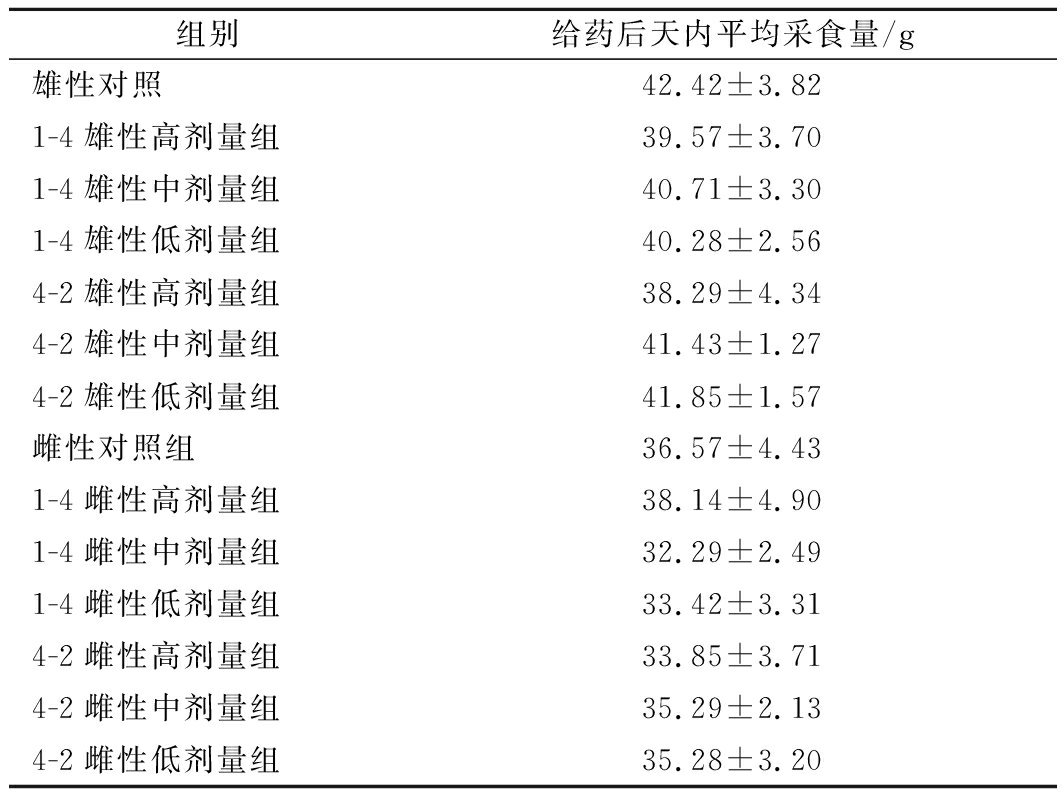
组别给药后天内平均采食量/g雄性对照42.42±3.821-4雄性高剂量组39.57±3.701-4雄性中剂量组40.71±3.301-4雄性低剂量组40.28±2.564-2雄性高剂量组38.29±4.344-2雄性中剂量组41.43±1.274-2雄性低剂量组41.85±1.57雌性对照组36.57±4.431-4雌性高剂量组38.14±4.901-4雌性中剂量组32.29±2.491-4雌性低剂量组33.42±3.314-2雌性高剂量组33.85±3.714-2雌性中剂量组35.29±2.134-2雌性低剂量组35.28±3.20
2.1.2 脏器指数变化
7 d实验结束后,对小鼠进行解剖,肉眼观察并未发现心、肝、脾、肺、肾等脏器异常,用生理盐水清洗称重后,计算脏器指数,结果如表2所示。经结果统计分析,发现口服不同菌株的小鼠脏器指数与生理盐水对照组均无显著性差异。(P>0.05)。说明菌株1-4和4-2对小鼠主要内脏器官无有害影响。
表2 脏器指数
Table 2 Viscera index
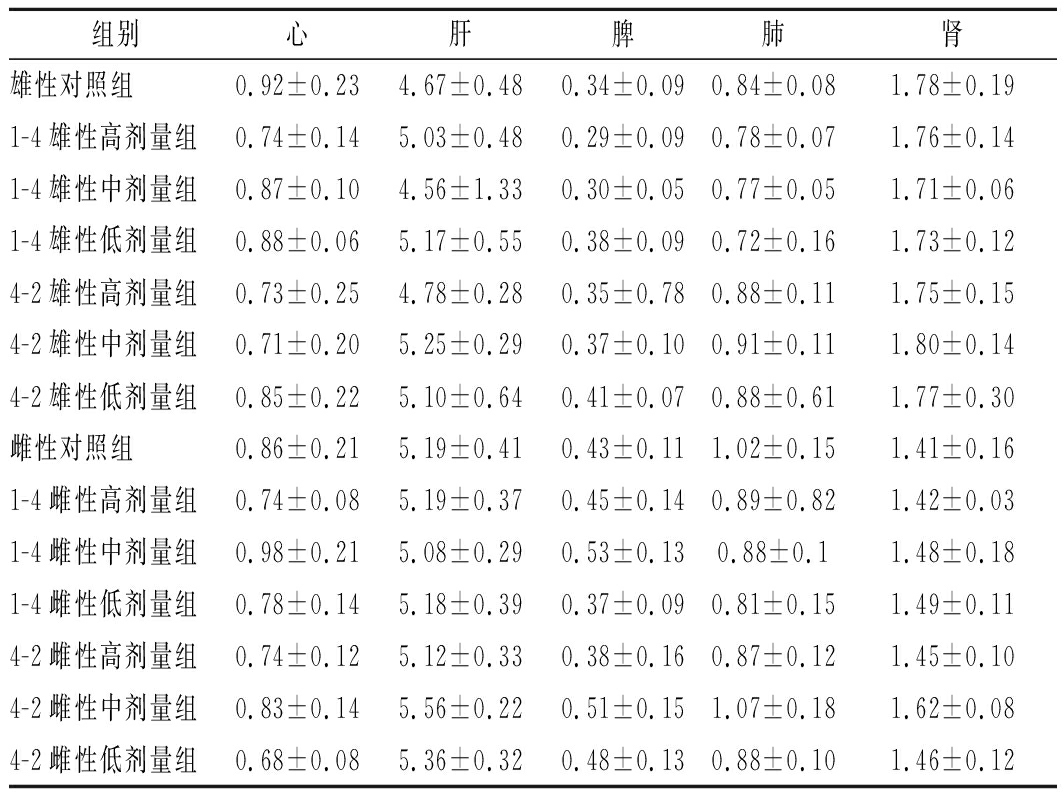
组别心肝脾肺肾雄性对照组0.92±0.234.67±0.480.34±0.090.84±0.081.78±0.191-4雄性高剂量组0.74±0.145.03±0.480.29±0.090.78±0.071.76±0.141-4雄性中剂量组0.87±0.104.56±1.330.30±0.050.77±0.051.71±0.061-4雄性低剂量组0.88±0.065.17±0.550.38±0.090.72±0.161.73±0.124-2雄性高剂量组0.73±0.254.78±0.280.35±0.780.88±0.111.75±0.154-2雄性中剂量组0.71±0.205.25±0.290.37±0.100.91±0.111.80±0.144-2雄性低剂量组0.85±0.225.10±0.640.41±0.070.88±0.611.77±0.30雌性对照组0.86±0.215.19±0.410.43±0.111.02±0.151.41±0.161-4雌性高剂量组0.74±0.085.19±0.370.45±0.140.89±0.821.42±0.031-4雌性中剂量组0.98±0.215.08±0.290.53±0.130.88±0.11.48±0.181-4雌性低剂量组0.78±0.145.18±0.390.37±0.090.81±0.151.49±0.114-2雌性高剂量组0.74±0.125.12±0.330.38±0.160.87±0.121.45±0.104-2雌性中剂量组0.83±0.145.56±0.220.51±0.151.07±0.181.62±0.084-2雌性低剂量组0.68±0.085.36±0.320.48±0.130.88±0.101.46±0.12
2.2 细菌移位实验
取小鼠心、肝、脾、肺、肾脏器组织匀浆,涂布于含有5%脱纤维羊血的BHI琼脂平板上,经37 ℃倒置培养24 h后未观察到与菌株1-4和菌株4-2相似的灰白色,针尖样大小的α溶血性链球菌菌落。实验结果表明小鼠口服菌株1-4和4-2后,没有发生细菌移位生长的现象。
2.3 耐药性检测
本试验检测了菌株1-4和4-2对常见10种抗生素的敏感性,参照美国临床和实验室标准协会(CLSI)M100 S27标准进行判断实验结果显示两株菌对大部分抗生素具有较高的敏感性,菌株1-4对头孢曲松表现为抗性,4-2菌株对红霉素具有抗性,具体结果见表3。
表3 菌株耐药性结果
Table 3 Results of bacterial strain resistance
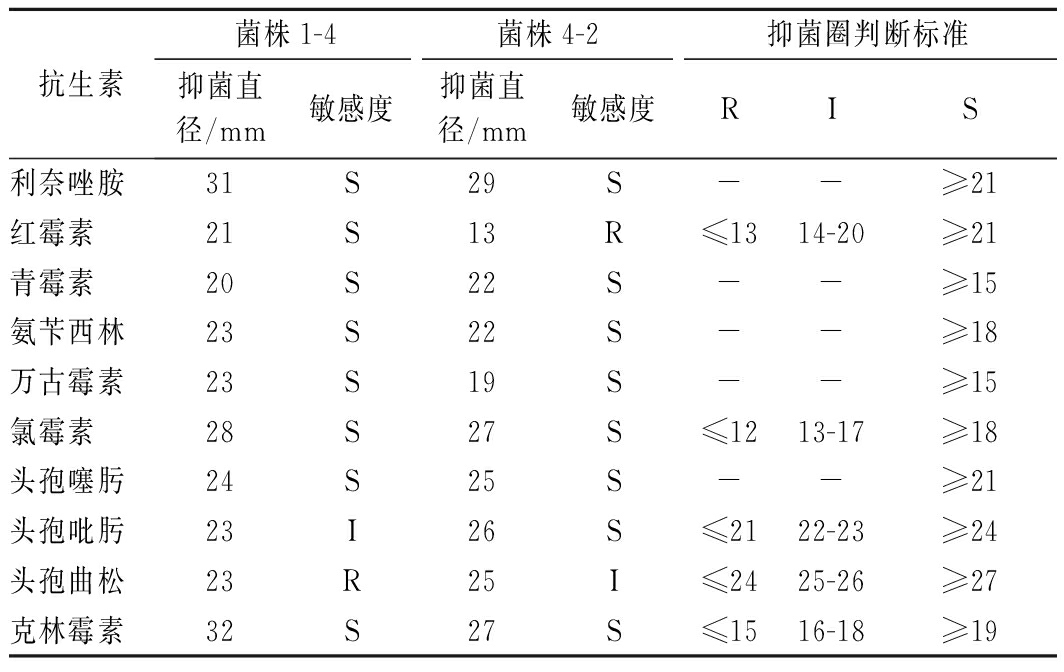
抗生素菌株1-4菌株4-2抑菌圈判断标准抑菌直径/mm敏感度抑菌直径/mm敏感度RIS利奈唑胺31S29S--≥21红霉素21S13R≤1314-20≥21青霉素20S22S--≥15氨苄西林23S22S--≥18万古霉素23S19S--≥15氯霉素28S27S≤1213-17≥18头孢噻肟24S25S--≥21头孢吡肟23I26S≤2122-23≥24头孢曲松23R25I≤2425-26≥27克林霉素32S27S≤1516-18≥19
注:S-敏感;I-中介;R-耐药
有研究表明大多数甲型链球菌可以合成核糖体甲基化酶,使23S rRNA的特定腺嘌呤甲基化从而阻断大环内酯类药物与核糖体的结合,链球菌属多个菌株对红霉素等大环内酯类药物具有普遍耐受性。
3 结论与讨论
目前人们对肠道益生菌产品研究最广泛,对呼吸道益生菌的开发和利用尚不足。甲型链球菌作为口咽部菌株的主要定植者,可以分泌细菌素或抗菌肽等抑菌产物来抑制有害菌的生长且具有较好的黏附力,是人类口服益生菌的良好候选菌[17]。本研究在健康儿童口咽部经过分离筛选后得到2株对金黄色葡萄球菌等多个致病菌具有抑菌作用的甲型链球菌,但其安全性还需要进行初步的评价。
动物模型是评价益生菌安全性的常用手段,为期7 d的急性毒性实验结果表明,口服不同剂量的益生菌实验期间,小鼠生理状态正常,未发现死亡和急性中毒体征。各组小鼠的体重均有增加,体重增长趋势与采食量的变化相吻合。小鼠体重和采食量的变化,实验组与对照组无统计学差异。结果表明口服2株菌对小鼠的健康指标无负面影响。解剖后,心、肝、脾、肺、肾主要内脏器官均无异常,各实验组脏器指数与生理盐水对照组无统计学差异。益生菌移位可能引发感染,包括菌血症、败血症或心内膜炎等[18],因此细菌移位生长能力也是评级益生菌安全性的重要指标,小鼠的脏器组织匀浆在BHI营养琼脂平板经培养后,未发现与菌株1-4和4-2相同的灰白色,针尖样大小的菌落,证实2株菌在小鼠体内不会发生细菌移位生长现象,体内实验结果表明,口服2株益生菌对小鼠无毒性作用。益生菌安全性另一个非常重要的方面是其耐药性,肉汤稀释法和纸片扩散法常用来检测菌株的药物敏感性,肉汤稀释法能够准确的检测最低杀菌浓度和最低抑菌浓度,但操作繁琐,费时费力。K-B纸片扩散法操作起来相对简便且成本小,因此成为目前评价抗生素敏感性应用最多的药敏方法[19]。本研究通过纸片扩散法评价2株菌对常见抗生素的敏感性,参照美国临床和实验室标准协会(CLSI)M100 S27标准进行判断。结果显示2菌株对大多数抗生素具有高度敏感性,菌株4-2和1-4分别对红霉素和头孢曲松表现为低敏感性,但没有提取耐药质粒。本研究选取的是呼吸道疾病常用的抗生素,对其他的抗生素是否具有抗性在后续研究应当补充。
综合上述实验结果,甲型链球菌1-4和4-2被证实对小鼠无急性毒性作用,表现为较高的移位安全性,对多数常见抗生素普遍敏感,初步表明具有良好的安全性,为其日后的开发和应用提供研究基础。但是为了提供更加全面的安全性评价,在接下来的研究中,我们应该继续研究其毒力基因,异常代谢以及慢性毒性实验等,进一步验证其作为呼吸道益生菌的安全性。
[1] PETTIGREW M M,LAUFER A S,GENT J F,et al.Upper respiratory tract microbial communities,acute otitis media pathogens,and antibiotic use in healthy and sick children[J].Applied and Environmental Microbiology,2012,78(17):6 262-6 270.
[2] SANDERS M E.Probiotics in 2015:Their scope and use[J].Journal of Clinical Gastroenterology,2015,49(1):2-6.
[3] EJTAHED H S,MOHTADI-NIA J,HOMAYOUNI-RAD A,et al.Effect of probiotic yogurt containing Lactobacillus acidophilus and Bifidobacterium lactis on lipid profile in individuals with type 2 diabetes mellitus[J].Journal of Dairy Science,2011,94(7):3 288-3 294.
[4] KALAM A M A,MANOBENDRO S,TIEJUN L,et al.Probiotic species in the modulation of gut microbiota:An overview[J].Biomed Research International,2018,2018(8):9 478 630.
[5] CITI S.Intestinal barriers protect against disease[J].Science,2018,359(6 380):1 097-1 098.
[6] CAGLAR E,KARGUL B,TANBOGA I.Bacteriotherapy and probiotics’ role on oral health[J].Oral Diseases,2010,11(3):131-137.
[7] 张研, 蒋鸿阳,刘殿媛,等.益生菌应用对2型糖尿病患者肠道菌群的影响[J].中国老年保健医学,2019(4):63-66.
ZHANG Y,JIANG,H Y,LIU D Y,et al.Effects of probiotics on gut microbiota in type 2 diabetes patients[J].Chinese Journal of Geriatric Care,2019(4):63-66.
[8] Van BEVER H P,NAGARAJAN S,SHEK L P,et al.Option:Primary prevention of allergy:Will it soon become a reality?[J].Pediatr Allergy Immunol,2016,27(1):6-12.
[9] GAREAU M G,SHERMAN P M,WALKER W A.Probiotics and the gut microbiota in intestinal health and disease[J].Nat Rev Gastroenterol Hepatol,2010,7(9):503-514.
[10] URTON J P,WESCOMBE P A,MOORE C J,et al.Safety assessment of the oral cavity probiotic Streptococcus salivarius K12[J].Appl Environ Microbiol,2006,72(4):3 050-3 053.
[11] CARLSSON J,GRAHNEN H,JONSSON G,et al.Early establishment of Streptococcus salivarius in the mouth of infants[J].Journal of Dental Research,1970,49(2):415.
[12] KAZOR C E,MITCHELL P M,LEE A M,et al.Diversity of bacterial populations on the tongue dorsa of patients with halitosis and healthy patients[J].Journal of Clinical Microbiology,2003,41(2):558-563.
[13] JOHANSON W G JR,BLACKSTOCK R,PIERCE A K,et al.The role of bacterial antagonism in pneumococcal colonization of the human pharynx[J].Lab Clin Med,1970,75(6):946-952.
[14] BIDOSSI A,GRANDI D R,TOSCANO M,et al.Probiotics Streptococcus salivarius 24SMB and Streptococcus oralis 89a interfere with biofilm formation of pathogens of the upper respiratory tract[J].BMC Infect Dis,2018,18(2):653.
[15] 王冲,何亮,曾忠铭.小鼠口咽部甲型链球菌的微生态研究[J].中华全科医学,2010,8(8):944-946.
WANG C,HE L,ZENG Z M.Study on oropharyngeal ecosystem of alpha-haemolytic Streptococci[J].Chinese Journal of General Practice,2010,8(8):944-946.
[16] ROOS K,HAKANSSON E G,HOLM S.Effect of recolonisation with ‘interfering’ α Streptococci on recurrences of acute and secretory otitis media in children:Randomised placebo controlled trial[J].British Medical Journal,2001,322(7 280):210-212.
[17] SANTAGATI M,SCILLATO M,PATAN F,et al.Bacteriocin-producing oral Streptococci and inhibition of respiratory pathogens[J].Pathogens & Disease,2012,65(1):23-31.
F,et al.Bacteriocin-producing oral Streptococci and inhibition of respiratory pathogens[J].Pathogens & Disease,2012,65(1):23-31.
[18] 王坚镪,丁在咸,张旻.益生菌对炎症性肠病小鼠肠道菌群紊乱及细菌移位的影响[J].上海交通大学学报(医学版),2010(2):186-190.
WANG J Q,DING Z X,ZHANG M.Effect of probiotics on intestinal flora disturbance and bacterial translocation in mice with spontaneous colitis[J].Journal of Shanghai Jiaotong University,2010(2):186-190.
[19] 冯大伟, 周家春.益生乳酸菌的纸片扩散法药敏性试验评价[J].微生物学通报,2010,37(3):454-464.
FENG D W,ZHOU J C.Evaluation of agar disc diffusion method for determining antibiotic susceptobility of lactic acid bacteria strains by a selected culture medium[J].Microbiology China,2020,37(3):454-464.