红枣(Ziziphus jujuba Mill.),又名大枣、枣子、中华大枣,有“维生素王”之称,是鼠李科枣属植物枣树的果实[1]。红枣是药食同源品种,富含维生素、多糖、蛋白质、有机酸、黄酮和环磷酸腺苷等营养物质,具有补中益气、养血安神、治疗脾虚食少与妇人脏躁等病症的功效[2]。
多糖是红枣中一种重要的生物活性物质,研究表明红枣多糖具有抗氧化[3]、抗肿瘤[4]、保肝[5]和降血脂[6]等多种生物活性。超声波辅助提取具有提取时间短、操作简单、成本低及提取率高等优点[7],广泛应用于植物功能组分的提取中。红枣多糖的抗氧化活性主要集中于体外抗氧化评价,体内抗氧化评价研究较少,斑马鱼与人体器官在分子水平、生理结构等方面非常相似[8],其模型能够反映活性成分的体内抗氧化效果。本实验以新疆哈密大枣为研究对象,采用响应面优化超声波辅助提取多糖,并研究了多糖的结构表征、体外以及斑马鱼体内抗氧化活性。
1 材料与方法
1.1 材料与试剂
新疆哈密大枣,泰安枣批发市场;皮肤荧光转基因斑马鱼,山东省科学院生物研究所斑马鱼药物筛选平台。
浓硫酸,优级纯,济南试剂总厂;苯酚、石油醚、无水乙醇、葡萄糖,分析纯,天津市凯通化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),分析纯,上海华蓝化学科技有限公司;2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),分析纯,合肥博美生物科技有限公司;正丁醇,分析纯,天津市大茂化学试剂厂;单糖标准品(鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、木糖、果糖、半乳糖醛酸、葡萄糖醛酸),色谱纯,上海源叶生物科技有限公司;甲硝唑、维生素C,分析纯,上海生物化工公司;链霉蛋白酶、氨基苯甲酸乙酯甲磺酸盐,分析纯,美国Sigma公司。
1.2 仪器与设备
754 N紫外可见分光光度计,上海奥普勒仪器有限公司;UV—2450紫外可见分光光度计,日本岛津公司;KQ500DE型数控超声波清洗器,昆山市超声仪器有限公司;高效阴离子交换色谱仪、Nicole iS10型红外光谱仪,美国Thermo Fisher Scientific科技公司;X51型倒置显微镜,日本Olympus公司;Forma 3111型水套式CO2培养箱,美国Forma公司;斑马鱼养殖饲养设备,北京爱生科技公司。
1.3 实验方法
1.3.1 红枣多糖的提取
红枣去核切片→干燥粉碎、过40目筛→超声提取红枣多糖→离心取上清液→加入4倍体积无水乙醇醇沉过夜→离心取沉淀定容→苯酚硫酸法测多糖含量
1.3.1.1 单因素试验
以1.0 g枣粉为基准,固定提取温度60 ℃,超声时间30 min,超声功率300 W,研究不同液料比10∶1、15∶1、20∶1、25∶1、30∶1 (mL∶g)对红枣多糖提取率的影响;固定液料比20∶1 (mL∶g),超声时间30 min,超声功率300 W,研究不同提取温度40、50、60、70、80 ℃对红枣多糖提取率的影响;固定液料比20∶1(mL∶g),提取温度60 ℃,超声功率300 W,研究不同超声时间10、20、30、40、50 min对红枣多糖提取率的影响;固定液料比20∶1 (mL∶g)、提取温度60 ℃、超声时间30 min,研究不同超声功率100、200、300、400、500 W对红枣多糖提取率的影响。
1.3.1.2 响应面优化设计
在单因素试验的基础上,固定超声功率200 W,确定超声温度、液料比以及超声时间的3因素3水平。利用Design-Expert 8.0.6 软件Box-Behnken 法设计优化试验,以多糖提取率为响应值,研究提取红枣多糖的最优工艺参数。响应面水平如表1所示。
表1 响应面试验因素水平表
Table 1 Factors and levels of response surface experiment

水平因素A(超声温度)/℃B[液料比(mL∶g)]C(超声时间)/min-14010∶11005015∶120+16020∶130
1.3.2 红枣多糖分离纯化
将最优条件得到的多糖样品进行石油醚脱脂,用石油醚和粗多糖溶液按1∶1体积比充分混匀,用分液漏斗分离,重复3次脱脂;Sevage法脱蛋白[9];通过透析去除小分子杂质,浓缩后冷冻干燥多糖组分,用于后续实验。
1.3.3 指标测定
采用苯酚硫酸法测定红枣多糖含量[10],回归方程为:y=0.011x+ 0.0064,R2=0.9997。采用考马斯亮蓝法对红枣多糖蛋白质含量进行测定[11],回归方程为:y=8.1243x+0.0423,R2=0.9911。
1.3.4 单糖组成
在80 ℃下,10 mg多糖用4 mL 2.0 mol/L的三氟乙酸(trifluoroacetic acid,TFA)水解6 h,通过N2冲洗除去溶液中残留的TFA,然后溶于10 mL超纯水中并通过SPE管和0.22 μm 超滤管进行澄清。使用PA10 IC色谱柱在30 ℃下以0.20 moL/L NaOH溶液作为流动相,0.25 mL/min的流速分析样品。
1.3.5 光谱分析
1.3.5.1 紫外光谱分析
将多糖溶液在190~400 nm波段下进行扫描,分析扫描图谱,观察有无核酸吸收峰(260 nm)和蛋白质吸收峰(280 nm),检测杂质是否去除干净[12]。
1.3.5.2 红外光谱分析
取适量干燥的多糖样品使用傅立叶红外光谱分析(Fourier transform infrared spectroscopy,FT-IR)在4 000~400 cm-1范围内扫描,使用OMNIC软件分析结果[13]。
1.3.6 刚果红染色
取1 mL 1 mg/mL红枣多糖溶液、2 mL 60 μmol/L刚果红溶液及1 mL不同浓度的NaOH溶液,静置15 min后观察不同浓度的NaOH溶液中多糖最大吸收波长的迁移情况[14]。
1.3.7 抗氧化
1.3.7.1 体外抗氧化
总还原力的测定,参照LIN等[15]的方法;DPPH自由基清除能力测定,参照许海顺等[16]的方法;ABTS阳离子自由基清除能力的测定,参照胡治远等[17]的方法。
1.3.7.2 斑马鱼模型的抗氧化作用
发育24 h的皮肤荧光斑马鱼,使用链霉蛋白酶脱去其胚胎外层的卵膜后随机分成空白对照组(NC)、5 mmol/L甲硝唑造模组(MC)、阳性对照组(5 mmol/L甲硝唑+100 μg/mL Vc)(PC)、1 μg/mL红枣多糖组(I)和25 μg/mL红枣多糖组(II),在荧光显微镜下观察拍照。使用Imagepro-plus软件统计斑马鱼的皮肤荧光点数量,并利用GraphPad软件对数据进行统计分析,评估样品的抗氧化活性。
1.3.8 统计学分析
试验平均操作3次,数据以![]() 表示,使用SPSS软件进行单因素方差分析,P<0.05表示差异有统计学意义。
表示,使用SPSS软件进行单因素方差分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 单因素实验
超声功率对多糖提取率的影响如图1-a所示,功率100~200 W时,多糖提取率升高,当超声功率继续加大时,多糖提取率反而下降,由于超声功率增大有助于细胞壁的破碎和液固两相的相互混合,多糖提取率增大,但功率过强时,超声波空化作用加大,多糖糖苷键可能遭到破坏,影响多糖提取率[18]。因此超声功率以200 W为宜。超声温度对多糖提取率的影响如图1-b所示,40~50 ℃时,温度升高多糖提取率升高。温度低时,分子运动慢使得多糖无法充分溶出,随温度升高,分子运动加快,多糖提取率升高。但是温度升高到50 ℃以上时,随温度升高多糖提取率反而降低,这可能因为温度升高影响多糖稳定性,多糖糖链降解,多糖提取率降低[19]。因此,适宜红枣多糖提取的温度为50 ℃。超声时间对多糖提取率的影响如图1-c所示,提取时间在10~20 min时,时间越长提取率越大,20 min时达到最大值。继续延长提取时间,多糖提取率反而降低,因为提取前期细胞不断破碎,使多糖溶出、得率增大,当超声时间继续延长,会导致多糖降解,使多糖得率降低[20]。因此,最适宜的超声时间为20 min。液料比对多糖提取率的影响如图1-d所示,当液料比从10∶1 (mL∶g)增加到15∶1 (mL∶g)时,溶剂较少,不利于多糖扩散。随液料比增大,多糖提取率升高,在液料比15∶1时达到最大值。随后提取率降低,随着溶剂增加,多糖尽可能游离到溶液中,但溶剂量过大,大量杂质也会溶出,挤占多糖空间,导致提取率不升反降[21]。因此,最适宜的液料比为15∶1。

图1 单因素对多糖提取率的影响
Fig.1 Effect of single factor on the extraction rate of polysaccharides
2.2 提取工艺条件的优化
2.2.1 模型方程建立与显著性实验
在单因素试验结果基础上,以超声温度(A)、液料比(B)和超声时间(C)为自变量,以红枣多糖得率(Y)为响应值,利用Design-Expert 8.0.6设计3因素3水平试验,得到的响应面分析结果如表2所示,得到回归方程Y=3.06-0.11A+0.15B+0.070C+0.027AB-0.14AC+0.068BC-0.40A2-0.29B2-0.17C2。
回归模型的方差分析结果如表3所示,模型P为0.000 1,说明该回归模型极显著,失拟项P=0.068 2>0.05,R2=0.972 5,表明该模型实验误差小,可利用该方程分析及预测红枣多糖提取率随相关因素变化的波动情况。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken design and results

试验号A(超声温度)B(液料比)C(超声时间)多糖得率/%10003.0921-102.1530003.0540112.9950-112.4360-1-12.3671012.268-10-12.4490002.991010-12.471101-12.6512-1102.54131102.3914-1012.815-1-102.41160003.06170003.12
从表3中回归系数的显著性检验可知,回归模型二次项中的A、B、A2、B2、C2(P<0.01)达到极显著水平,C和AC达到显著水平(P<0.05),AB与BC不显著(P>0.05)。B液料比对多糖提取率影响最大,其次是A超声温度,C超声时间对多糖提取率影响最小。
表3 回归方程的方差分析
Table 3 Analysis of variance of regression model
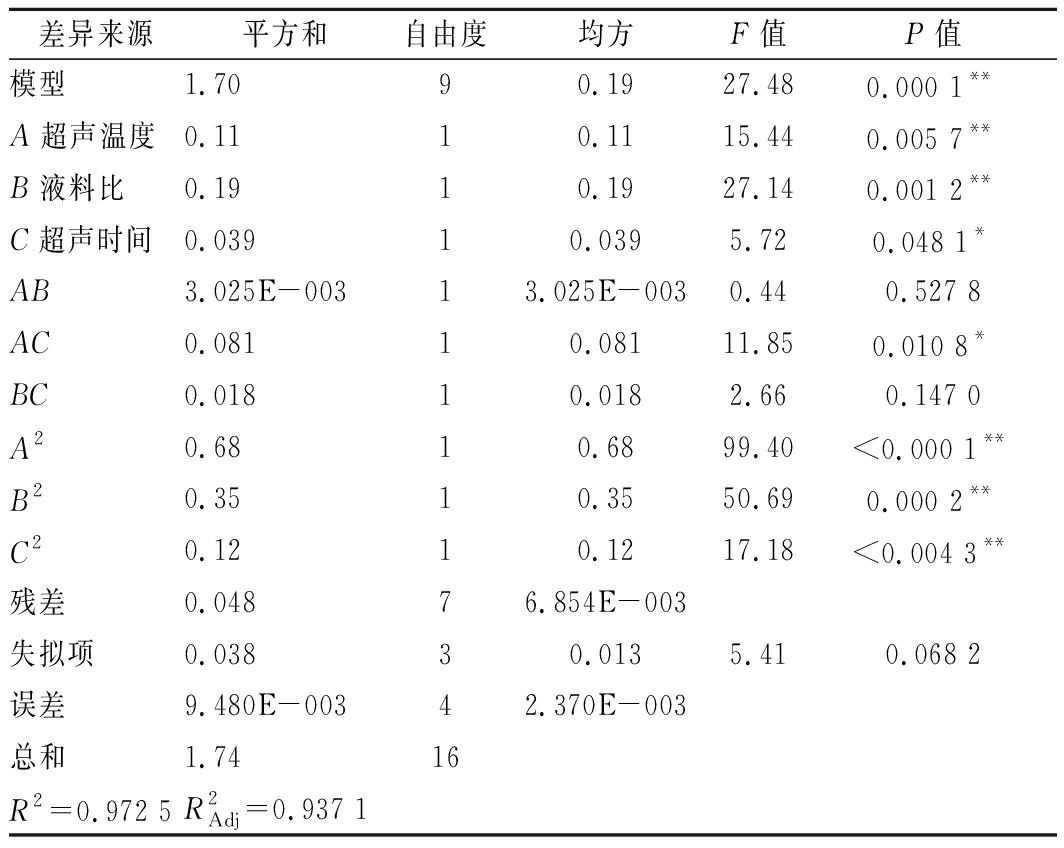
差异来源平方和自由度均方F值P值模型1.7090.1927.480.000 1**A超声温度0.1110.1115.440.005 7**B液料比0.1910.1927.140.001 2**C超声时间0.03910.0395.720.048 1*AB3.025E-00313.025E-0030.440.527 8AC0.08110.08111.850.010 8*BC0.01810.0182.660.147 0A20.6810.6899.40<0.000 1**B20.3510.3550.690.000 2**C20.1210.1217.18<0.004 3**残差0.04876.854E-003失拟项0.03830.0135.410.068 2误差9.480E-00342.370E-003总和1.7416R2=0.972 5R2Adj=0.937 1
注:*P<0.05,差异显著;**P<0.01,差异极显著
2.2.2 响应面交互作用影响结果
响应面图以及等高线图可以直观地反映两两因素间的交互作用。响应面图越陡峭说明2个自变量间的交互作用对响应值影响程度越大,相反,越平缓交互作用影响越不显著[22]。等高线图越偏离圆形交互影响越强,反之,越接近圆形交互影响越弱。由图2 分析得出,AC响应面3D图陡峭,且等高线图呈明显的椭圆形,交互作用显著,AB与BC等高线图接近圆形,表明交互作用不显著(P>0.05),这与方差结果一致。
2.2.3 最优条件的确定与回归模型的验证
通过试验分析,超声辅助提取红枣多糖最优工艺参数为超声功率200 W、超声温度48.05 ℃、液料比16.49∶1 (mL∶g)、超声时间23.52 min,多糖最优得率为3.11%,高于方元等[23]超声波提取哈密大枣多糖的得率。考虑到实际操作的方便性,将提取条件调整为:超声功率200 W、超声温度48 ℃、液料比16∶1(mL∶g)、超声时间24 min,此工艺条件下进行超声波辅助法提取红枣多糖,试验重复3次取平均值,得率为3.09%。实际测定值与预测值误差较小,表明优化后的红枣多糖提取工艺条件准确可靠。
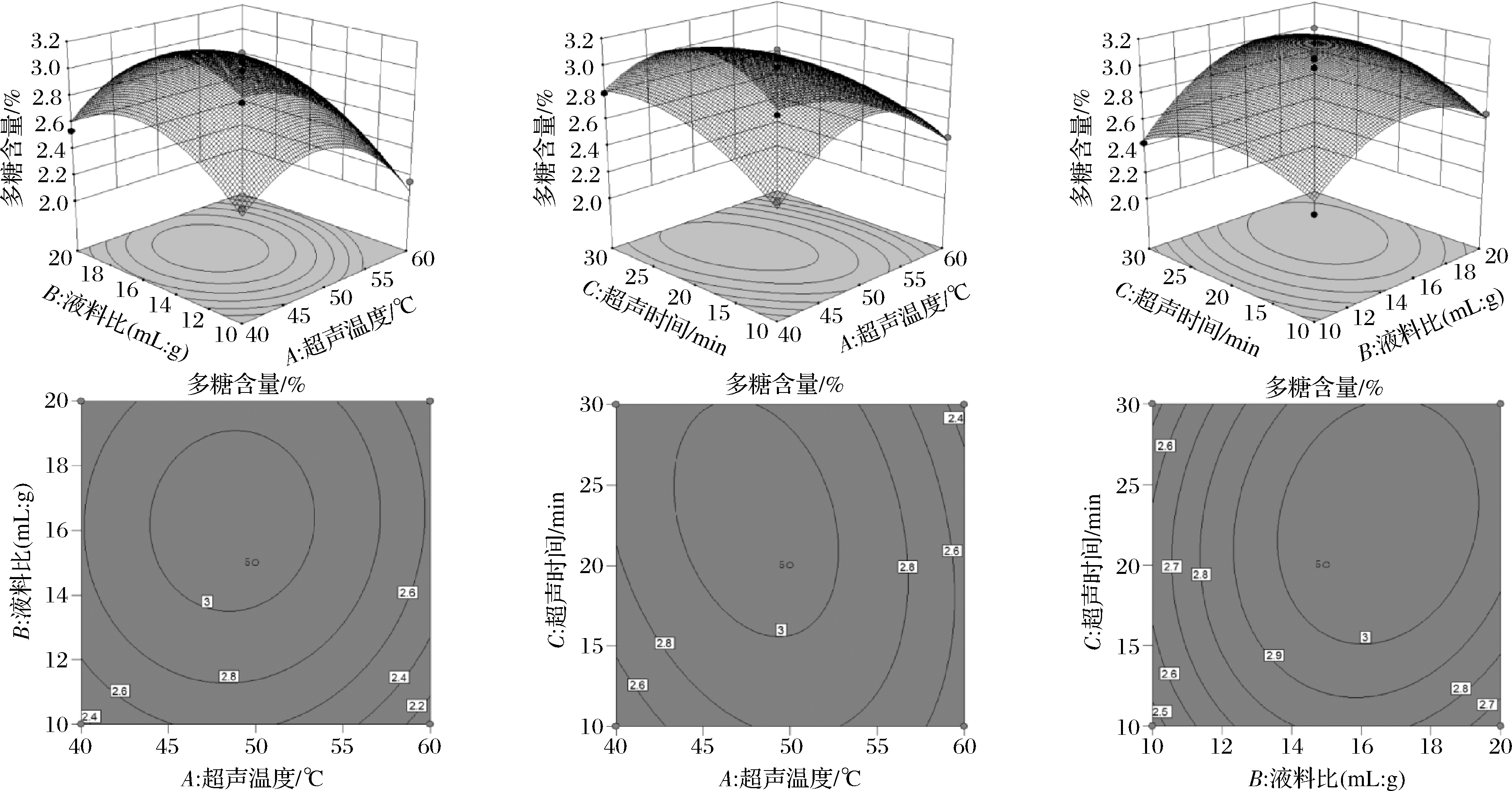
图2 各因素交互作用对多糖得率影响的响应面图
Fig.2 Response surface plots showing the interactive effects of various factors on polysaccharide yield
2.3 指标测定
经测定,红枣多糖总糖含量为(50.98±1.26)%、蛋白质含量为(1.26±0.08)%。
2.4 单糖组成
红枣多糖单糖组成的高效阴离子交换色谱如图3所示。根据出峰时间和峰面积可以推断红枣多糖的单糖组成和比例,其单糖组成主要为阿拉伯糖、半乳糖、葡萄糖、木糖、果糖以及半乳糖醛酸,比例为45.90∶19.72∶19.88∶3.03∶10.37∶1.10。
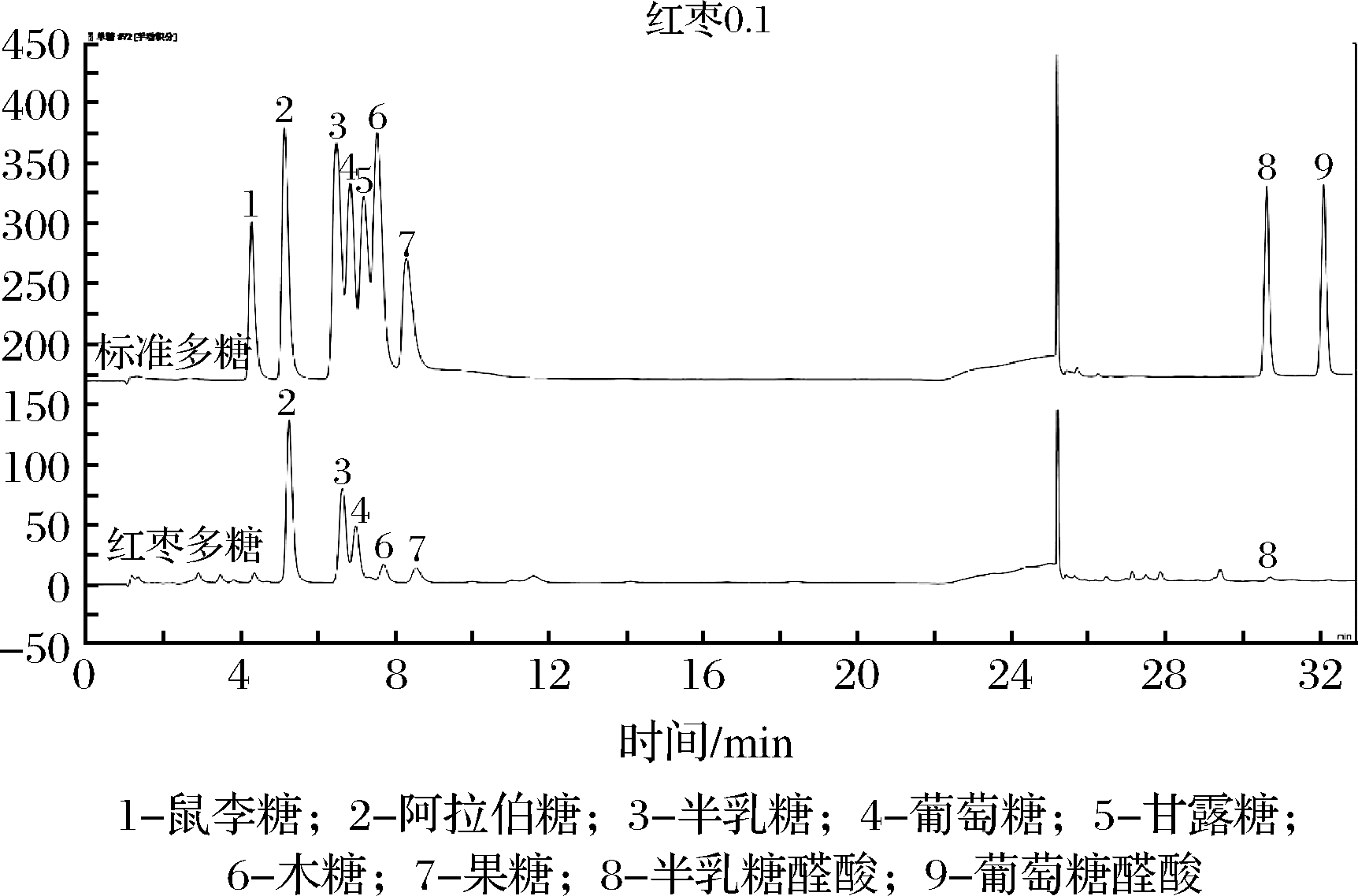
图3 基于HPAEC-PAD的标准品和红枣多糖的单糖谱
Fig.3 Monosaccharide profiles of jujube polysaccharide
based on HPAEC-PAD standards
2.5 光谱分析
2.5.1 紫外光谱分析
由图4可知,在280 nm波长处有弱吸收峰,表明其含有蛋白质,与蛋白质含量测定结果相符合。
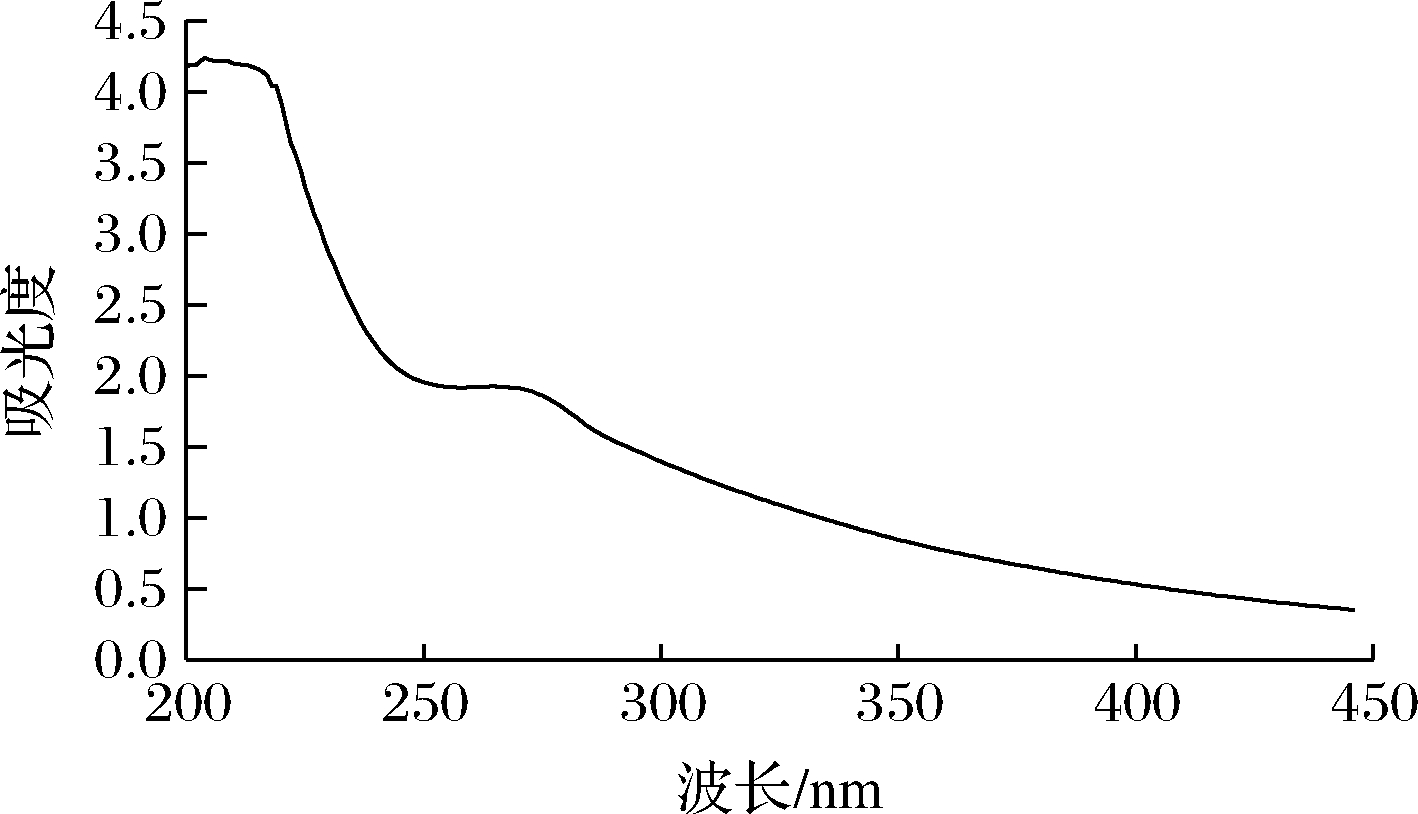
图4 红枣多糖的紫外扫描图谱
Fig.4 UV spectrum of jujube polysaccharide
2.5.2 傅里叶红外变换光谱分析
由图5可知,红枣多糖的红外光谱在3 281.57 cm-1处有1个强的吸收峰,是多糖分子间或分子内的O—H的伸缩振动引起的;在2 930.17 cm-1附近出现了弱吸收峰,是糖类不对称C—H伸缩振动;1 606.35 cm-1处有强的吸收峰,为C![]() O不对称伸缩振动峰[25];在1 415.01 cm-1附近的峰是C—H变角振动吸收峰;在1 100~1 000 cm-1的峰是吡喃型糖苷环骨架C—O变角振动吸收峰,说明分子中存在C—O—H和糖环C—O—C结构[25];在1 733.75和1 234.46 cm-1处的吸收峰分别对应于酯基或羧基中C
O不对称伸缩振动峰[25];在1 415.01 cm-1附近的峰是C—H变角振动吸收峰;在1 100~1 000 cm-1的峰是吡喃型糖苷环骨架C—O变角振动吸收峰,说明分子中存在C—O—H和糖环C—O—C结构[25];在1 733.75和1 234.46 cm-1处的吸收峰分别对应于酯基或羧基中C![]() O和C—O的拉伸振动,表明它们都含有糖醛酸[26];在830.729 cm-1处有吸收峰,说明其可能含有α-糖苷键,其他结构有待进一步研究确证[27]。
O和C—O的拉伸振动,表明它们都含有糖醛酸[26];在830.729 cm-1处有吸收峰,说明其可能含有α-糖苷键,其他结构有待进一步研究确证[27]。
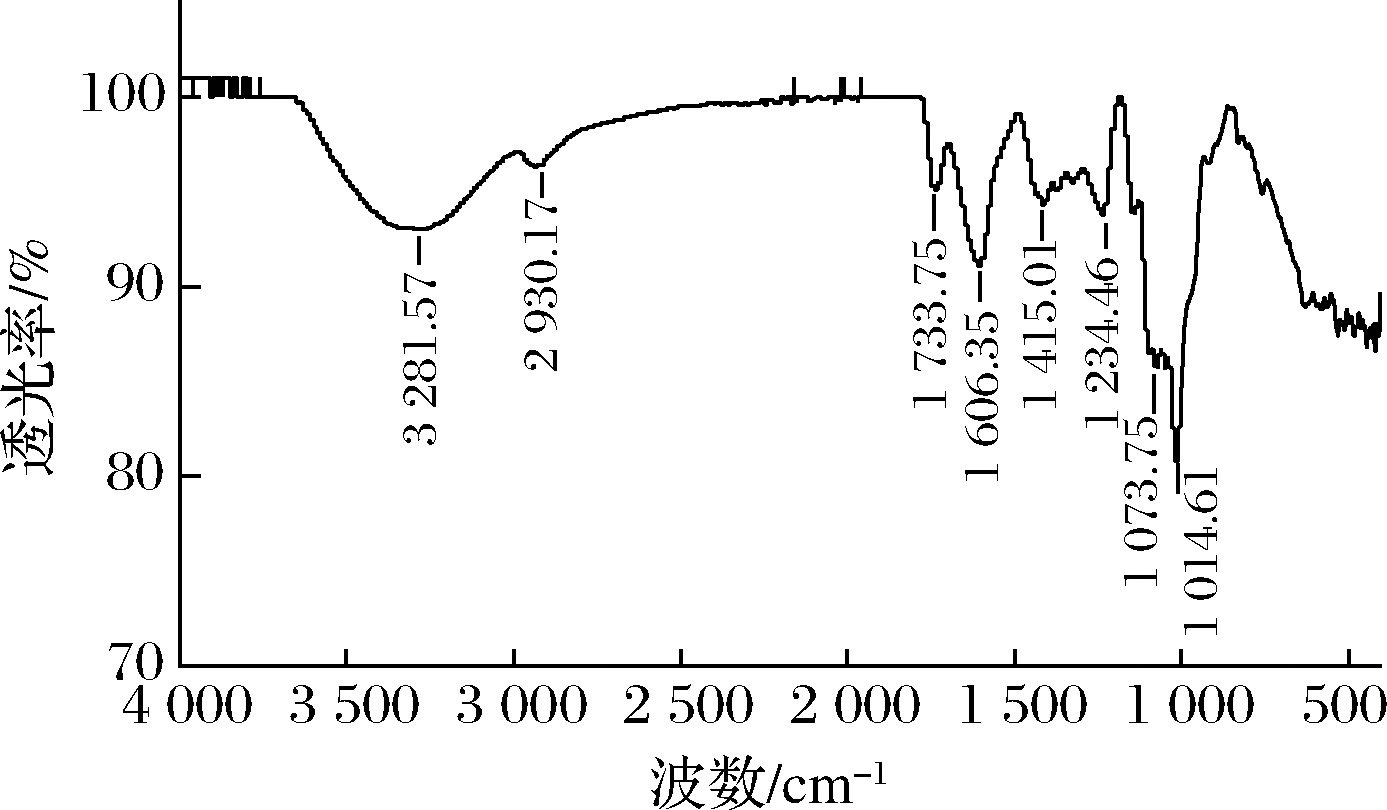
图5 红枣多糖的红外图谱
Fig.5 FT-IR spectrum of jujube polysaccharide
2.6 刚果红实验
由图6可以看出,随着NaOH溶液浓度从0增大到0.5 mol/L,红枣多糖与刚果红试剂作用产生络合物的最大吸收波长呈现逐渐减小的趋势,最大吸收波长的连续下降可能是因为多糖在水溶液中为无规卷曲构象,且越来越多的氢键被碱性溶液破坏[28],可以判断该红枣多糖不具备三螺旋结构。
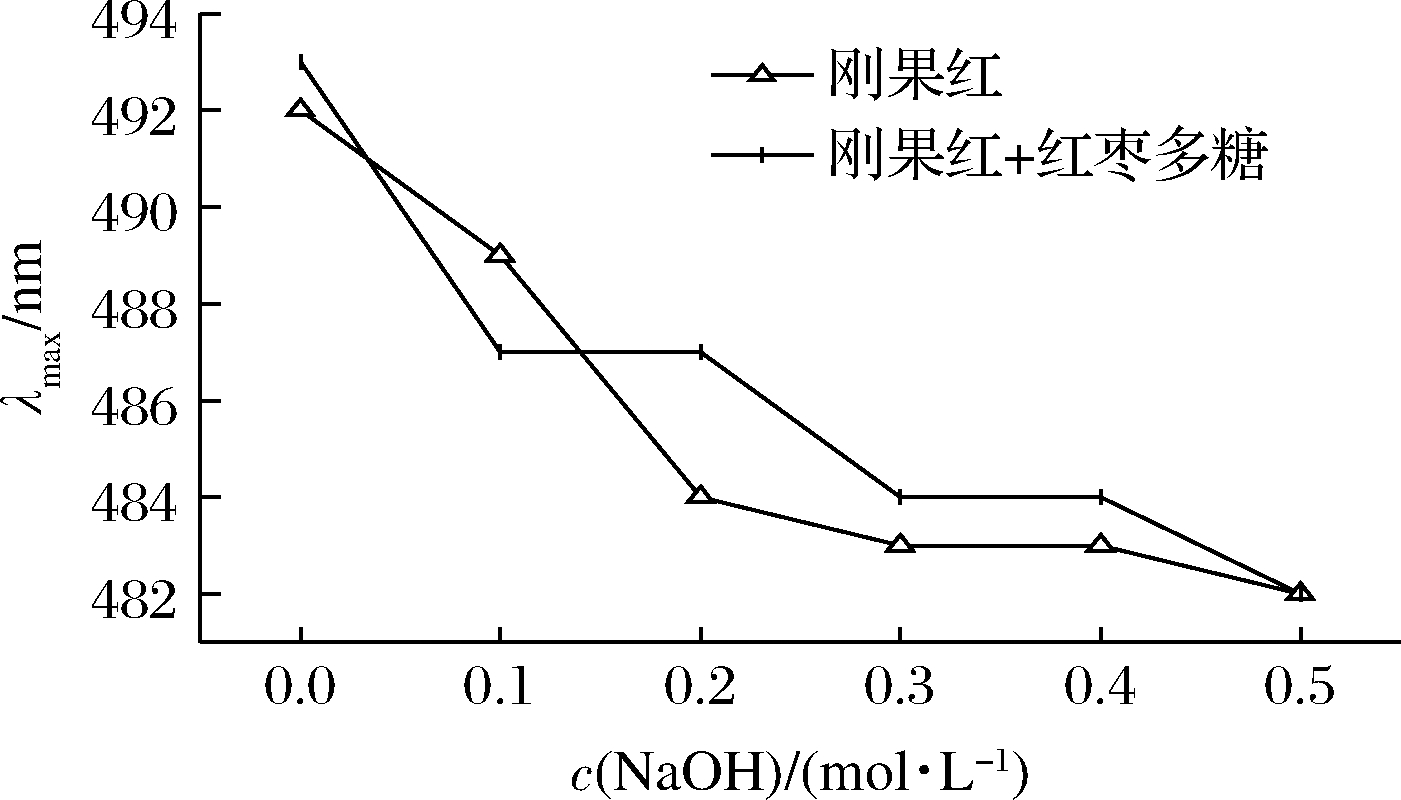
图6 不同NaOH浓度下多糖与刚果红络合物最大吸收波长
Fig 6 Maximum absorption wavelength of Congo red and Congo
red-polysaccharides at various concentrations of NaOH
2.7 抗氧化实验
2.7.1 体外抗氧化能力
由图7可知,随红枣多糖浓度的增大,对DPPH自由基和ABTS阳离子自由基的清除能力逐渐升高后趋于稳定,呈一定的剂量关系。当多糖质量浓度达到1 mg/mL时,DPPH自由基清除率可达89%,其IC50为0.365 mg/mL;ABTS阳离子自由基清除率可达99%,其IC50为0.272 mg/mL。在0~1 mg/mL范围内,总还原能力随多糖浓度增大而增大,当多糖质量浓度为1 mg/mL时,其吸光度可达0.764。

图7 红枣多糖的体外抗氧化
Fig.7 In vitro antioxidant activity of jujube polysaccharides
实验结果表明红枣多糖具有一定体外抗氧化能力。
2.7.2 斑马鱼抗氧化模型
从图8可知,与空白对照组相比,经甲硝唑处理的模型组皮肤荧光数量极显著降低(P<0.001),Vc和红枣多糖能够有效缓解这种氧化损伤。与甲硝唑组相比,红枣多糖在1和25 μg/mL下均具有抗氧化活性,尤其25 μg/mL的红枣多糖皮肤荧光数量极显著增加(P<0.001),是100 μg/mL Vc的1.65倍。结果表明,红枣多糖可以减轻甲硝唑对斑马鱼模型的氧化损伤。
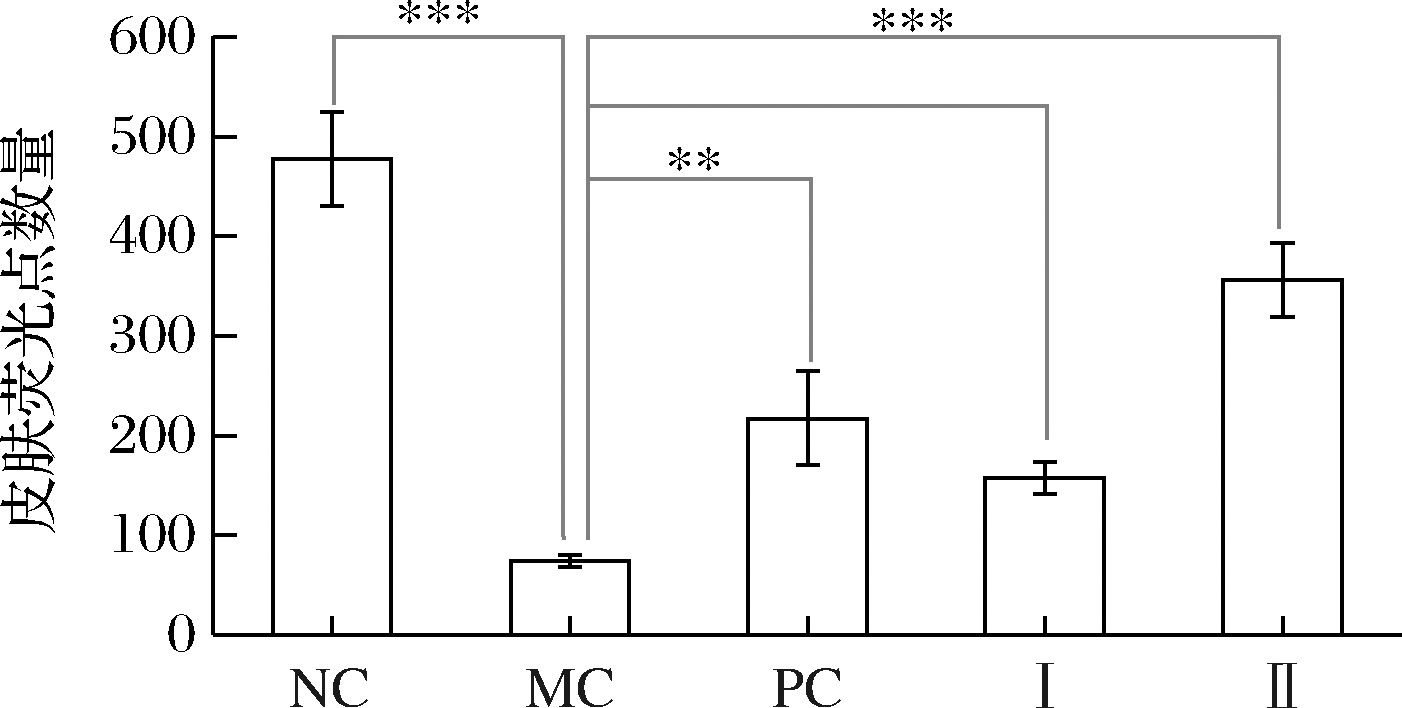
图8 红枣多糖对甲硝唑诱导的斑马鱼氧化损伤
模型的保护作用
Fig.8 Protective effect of jujube polysaccharides on the
zebrafish oxidative damage model induced by metronidazole
3 结论
本实验在单因素试验的基础上,通过Box-Behnken响应面试验设计优化得到了超声辅助提取红枣多糖工艺参数,在此条件下红枣多糖得率为(3.11±0.15)%。光谱分析和刚果红结果表明红枣多糖为α-糖苷键的吡喃型糖苷环骨架,不含三螺旋结构,含少量蛋白质。主要的单糖组成成分为阿拉伯糖、半乳糖、葡萄糖、木糖、果糖以及半乳糖醛酸等。体外抗氧化活性评价与斑马鱼抗氧化损伤模型共同证明了红枣多糖具有较强的抗氧化活性。该研究为红枣多糖进一步分离纯化、结构解析、生物活性的研究以及开发具有潜力的功能性食品提供依据。
[1] 杨燕敏, 高琳,张仁堂,等.红枣多糖提取、分离与纯化研究进展[J].食品研究与开发,2019,40(18):204-208.
YANG Y M,GAO L,ZHANG R T,et al.Advances in extraction,separation and purification of jujube polysaccharides[J].Food Research and Development,2019,40(18):204-208.
[2] 张砚垒,高琳,张仁堂.红枣活性成分及其生物活性的研究进展[J].中国食物与营养,2020,26(3):9-13.
ZHANG Y L,GAO L,ZHANG R T.Researsh advancement on active ingredients and biological activities of jujube[J].China Food and Nutrition,2020,26(3):9-13.
[3] 黎云龙,于震宇,郜海燕,等.骏枣多糖提取工艺优化及其抗氧化活性[J].食品科学,2015,36(4):45-49.
LI Y L,YU Z Y,GAO H Y,et al.Optimization of extraction process and antioxidant capacity of polysaccharides from Zizyphus jujuba cv.Junzao[J].Food Science,2015,36(4):45-49.
[4] WU Z,LI H,WANG Y D,et al.Optimization extraction,structural features and antitumor activity of polysaccharides from Z.jujuba cv.Ruoqiangzao seeds[J].International Journal of Biological Macromolecules,2019(135):1 151-1 161.
[5] YUE Y,WU S C,ZHANG H F,et al.Characterization and hepatoprotective effect of polysaccharides from Ziziphus jujuba Mill.var.spinosa (Bunge) Hu ex H.F.Chou sarcocarp[J].Food and Chemical Toxicology,2014(74):76-84.
[6] JI X L,LIU F,PENG Q,et al.Purifification,structural characterization,and hypolipidemic effffects of a neutral polysaccharide from Ziziphus Jujuba cv.Muzao[J].Food Chemistry,2018(245):1 124-1 130.
[7] 董红敏,李路,沈丽雯,等.超声波辅助提取川明参挥发油及化学成分的GC-MS分析[J].食品工业科技,2015,36(12):259-264.
DONG H M,LI L,SHEN L W,et al.Ultrasonic-assisted extraction and composition analysis by gas chromatography-mass spectrometry of volatile oil from Chuanminshen violaceum[J].Food Industry Science and Technology,2015,36(12):259-264.
[8] 韩利文,袁延强,何秋霞,等.斑马鱼模型在中药活性筛选中的适用性研究[J].中草药,2011,42(10):2 037-2 041.
HAN L W,YUAN Y Q,HE Q X,et al.Adaptability of zebrafish model in activity screening of Chinese materia medica[J].Chinese Traditional and Herbal Drugs,2011,42(10):2 037-2 041.
[9] JING Y S,HUANG L J,LV W J,et al.Structural characterization of a novel polysaccharide from pulp tissues of Litchi chinensis and its immunomodulatory activity[J].Journal of Agricultural and Food Chemistry,2014,62(4):902-911.
[10] 李欢欢, 李莎莎,海力茜·陶尔大洪.响应面法优选新疆红芪多糖提取工艺[J].食品与发酵科技,2020,56(2):45-49;63.
LI H H,LI X X,HAI L Q.The response surface method optimization Xinjiang red stilbene polysaccharide extraction process[J].Food and Fermentation Technology,2020,56(2):45-49;63.
[11] 李晓华. 新疆沙枣多糖的提取、分离纯化的研究[D].石河子:石河子大学,2011.
LI X H.Study on Extraction,separation and purification of polysaccharides from Angustifolia[D].Shihezi:Shihezi University,2011.
[12] HAN X Q,CHUNG L C B,DONG C X,et al.Isolation,structure characterization,and immunomodulating activity of a hyperbranched polysaccharide from the fruiting bodies of Ganoderma sinense[J].Journal of Agricultural and Food Chemistry,2012,60(17):4 276-4 281.
[13] YUAN Q X,ZHAO L Y,CHA Q Q,et al.Structural characterization and immunostimulatory activity of a homogeneous polysaccharide from Sinonovacula constricta[J].Journal of Agricultural and Food Chemistry,2015,63(36):7 986-7 994.
[14] 徐雅琴, 刘柠月,李大龙,等.蓝靛果多糖功能特性、结构及抗糖基化活性[J].食品科学,2020,41(2):8-14.
XU Y Q,LIU N Y,LI D L,et al.Functional properties,structure and anti-glycosylation activity of polysaccharide from blue honeysuckle fruit(Lonicera caerulea L.)[J].Food Science,2020,41(2):8-14.
[15] LIN X M,JI X L,WANG M,et al.An alkali-extracted polysaccharide from Zizyphus jujuba cv.Muzao:Structural characterizations and antioxidant activities[J].International Journal of Biological Macromolecules,2019,136:607-615.
[16] 许海顺,吴学谦,熊科辉,等.三叶青不同洗脱组分的抗氧化活性研究[J].中华中医药学刊,2015,33(8):1 968-1 971;2 068.
XU H S,WU X Q,XIONG K H,et al.Antioxidant activity of different elution fractions from Tetrastigma hemsleyanum Diels et.Gilg[J].Chinese Journal of Traditional Chinese Medicine,2015,33(8):1 968-1 971;2 068.
[17] 胡治远, 刘素纯,刘石泉.冠突散囊菌子囊孢子粗多糖抗氧化活性的比较分析[J].现代食品科技,2019,35(9):102-109.
HU Z Y,LIU S C,LIU S Q.Comparative analysis of antioxidant activity of crude polysaccharides from Eurotium cristatum ascospores[J].Modern Food Technology,2019,35(9):102-109.
[18] 刘婷婷,张晶,刘阳,等.毛葱水溶性多糖的超声波微波协同法提取工艺优化及结构分析[J].食品科学,2017,38(22):284-290.
LIU T T,ZHANG J,LIU Y,et al.Optimization of ultrasonic microwave-assisted extraction and structural analysis of water-soluble polysaccharide from tillering onion[J].Food Science,2017,38(22):284-290.
[19] 杨海涛,曹小燕.超声辅助浸提拐枣中多糖及抗氧化性研究[J].应用化工,2017,46(11):2 174-2 177;2 182.
YANG H T,CAO X Y.Study on ultrasonic wave assisted extraction of polysaccharide from Hovenia dulcis and its antioxidant activity[J].Applied Chemical Industry,2017,46(11):2 174-2 177;2 182.
[20] 巫永华,陆文静,刘梦虎,等.响应面优化超声波辅助双水相提取牛蒡多糖及抗氧化分析[J].食品与发酵工业,2020,46(5):215-223.
WU Y H,LU W J,LIU M H,et al.Optimization of ultrasonic-assisted aqueous two-phase extraction of burdock polysaccharide by response surface design and its antioxidant activities[J].Food and Fermentation Industries,2020,46(5):215-223.
[21] 李珊, 梁俭,冯彬,等.响应面法优化超声波辅助提取山竹果皮多糖的工艺及其体外抗氧活性研究[J].食品研究与开发,2020,41(10):103-110.
LI S,LIANG J,FENG B,et al.Response surface methodology promoted ultrasound-assisted extraction of polysaccharides from mangosteen peels and evaluation of antioxidant activity in vitro[J].Food Research and Development,2020,41(10):103-110.
[22] 乔丽洁, 王安平,阿依夏古丽·巴斯卡,等.响应面法优化天山岩黄芪多糖提取工艺[J].食品安全质量检测学报,2020,11(1):59-65.
QIAO L J,WANG A P,AYIXIAGULI B S K,et al.Optimization of extraction technology of polysaccharides from Hedysarum semenovii Regelet Herd by response surface methodology[J].Journal of Food Safety Quality Inspection,2020,11(1):59-65.
[23] 方元, 许铭强,汪欣蓓,等.超声波辅助提取哈密大枣多糖的工艺优化[J].食品与机械,2014,30(2):175-180.
FANG Y,XU M Q,WANG X B,et al.Optimization on ultrasonic wave extracting process for polysaccharides from Hami jujubes[J].Food and Machinery,2014,30(2):175-180.
[24] 伍燕, 申利群,朱华.假芝菌丝体多糖ARP的纯化、结构及抗氧化活性[J].食品与发酵工业,2019,45(9):214-219.
WU Y,SHENG L Q,ZHU H.Purification,structural characteristics,and in vitro antioxidant activities of polysaccharides ARP from a wild Amauroderma rugosum mycelium[J].Food and Fermentation Industries,2019,45(9):214-219.
[25] 王杏,邓青芳,陈华国,等.桑椹多糖的结构表征及其对乙醇脱氢酶活性的影响研究[J].中国中药杂志,2017,42(12):2 329-2 333.
WANG X,DENG Q F,CHEN H G,et al.Characterization and activity effect on ADH of polysaccharides from Mori fructus[J].Chinese Journal of Traditional Chinese Medicine,2017,42(12):2 329-2 333.
[26] VASILIEVA T,SIGAREV A,KOSYAKOV D,et al.Formation of low molecular weight oligomers from chitin and chitosan stimulated by plasma-assisted processes[J].Carbohydrate Polymers,2017,163:54-61.
[27] 刘晓庆. 沙枣多糖纯化、结构表征及其生物活性研究[D].天津:天津科技大学,2015.
LIU X Q.Purification,structure characterization and biological activity of a polysaccharide form Elaeagnus angustifolia L[D].Tianjin:Tianjin University of Science and Technology,2015.
[28] 徐雅琴, 杜明阳,杨露,等.超声波处理对黑加仑果实多糖性质与生物活性的影响[J].食品科学,2019,40(15):148-153.
XU Y Q,DU M Y,YANG L,et al.Effect of ultrasonic treatment on properties and bioactivity of polysaccharides from blackcurrant fruit[J].Food Science,2019,40(15):148-153.